Centre Hospitalier Moulins-Yzeure
|
|
|
- Salomé Delorme
- il y a 8 ans
- Total affichages :
Transcription
1 Rédacteur Vérificateur Approbateur S.MARLY T.DURET G.GENGEMBRE MANUEL QUALITE Laboratoire de Biologie Médicale Centre Hospitalier Moulins-Yzeure Destinataire: Date: Diffusion contrôlée : Diffusion non contrôlée : Ce document ne peut être reproduit sans l'autorisation du laboratoire 1/24
2 PRESENTATION DU LABORATOIRE DE BIOLOGIE MEDICALE OBJET DU MANUEL QUALITE DOMAINE D'APPLICATION DEFINITIONS ET ABREVIATIONS... 4 GESTION DU MANUEL QUALITE ELABORATION, VALIDATION ET APPROBATION DIFFUSION GESTION DES MODIFICATIONS CLASSEMENT, ARCHIVAGE ET DESTRUCTION... 6 LES PROCESSUS DU LBM... 6 A ORGANISATION GENERALE DU LABORATOIRE... 7 A1. Définition de la politique qualité du laboratoire et des objectifs qualité... 7 A2. Planification des activités et des ressources... 7 A3. Préparation et conduite des revues de direction... 9 A4. Communication et éthique B SUIVI DU SYSTEME QUALITE B1. Gestion de l'écoute des patients B2. Suivi des indicateurs de performances B3. Gestion des évaluations (audits internes, évaluations croisées...) B4. Maîtrise des non-conformités et des évènements indésirables B5. Gestion des actions d'amélioration (actions correctives et préventives) B6 Gestion des processus B7 Gestion des Risques C PRE-ANALYTIQUE C1. Prise en charge d'une demande d'analyse C2. Prélèvements C3. Gestion des échantillons C4. Gestion des analyses transmises D ANALYTIQUE D1. Validation technique : Gestion des contrôles et des calibrations D2. Validation analytique D3. Utilisation du matériel/équipement D4. Réalisation des examens E POST-ANALYTIQUE E1. Validation biologique E2. Transmission des résultats F RECHERCHE BIOMEDICALE G GESTION DU PERSONNEL G1. Gestion des compétences du personnel G2. Gestion de la formation G3. Gestion des plannings H GESTION DES DOCUMENTS QUALITE H1. Maîtrise du système documentaire qualité Ce document ne peut être reproduit sans l'autorisation du laboratoire 2/24
3 I MAITRISE DES ENREGISTREMENTS I1. Maîtrise du système informatique =gestion du système d'information I2. Maîtrise de l'archivage des enregistrements I3. Gestion de la confidentialité J MAINTENANCE DES EQUIPEMENTS J1. Maintenance des automates du laboratoire J2. Maintenance des instruments de mesure et de contrôle du LBM et appareils assimilés K MAITRISE DES ACHATS K1. Achat de matériel K2. Achat et stockage des réactifs et produits consommables L HYGIENE, SECURITE, ENVIRONNEMENT L1. Hygiène et sécurité des personnes L2. Gestion des déchets L3. Entretien des locaux et des équipements M MAITRISE DES PROCESSUS ADMINISTRATIFS M1. Gestion administrative du dossier patient Ce document ne peut être reproduit sans l'autorisation du laboratoire 3/24
4 PRESENTATION DU LABORATOIRE DE BIOLOGIE MEDICALE Localisation Le Centre Hospitalier de Moulins-Yzeure (CHMY) est un établissement de santé localisé sur 2 sites, un à Moulins et un à Yzeure. Il résulte de la fusion du centre hospitalier de Moulins et du centre hospitalier spécialisé d'yzeure (santé mentale). Le laboratoire de Biologie Médicale (LBM) est implanté sur le site de Moulins, 10 Avenue du général de Gaulle Moulins Cedex avec le plateau technique et les unités de soins médicaux et chirurgicaux. Historique Jusqu'à fin 1985, il existait deux LBM, un sur le site de Moulins et un sur le site d'yzeure. Le premier janvier 1986, ces deux LBM ont fusionné sur le site de Moulins avec une organisation en 2 services (un de Biochimie-Microbiologie et un d'hématologie). Depuis janvier 2011, conformément à la réglementation (Ordonnance n du 13 janvier 2010 relative à la biologie médicale), ces deux services ont fusionné en un LBM polyvalent avec un biologiste responsable assisté de 3 biologistes médicaux. 1. Objet du manuel qualité Le présent manuel qualité décrit les dispositions générales et les moyens mis en œuvre par le LBM du CHMY pour assurer et garantir la qualité de ses prestations conformément aux exigences de la réglementation en vigueur et de la norme NF ISO EN Il décrit notamment l'organisation du laboratoire, ses différents types de prestations et les dispositions mises en place et appliquées systématiquement en matière d'assurance de la qualité. Ces dispositions sont connues et appliquées par l'ensemble du personnel. Le manuel qualité est établi pour usage interne et externe. Son existence est portée à la connaissance de tout le personnel, des clients (prescripteurs, patients...) avec une diffusion assurée afin d'y avoir accès. 2. Domaine d'application Les dispositions prises par le présent manuel s'appliquent à l'ensemble des activités du laboratoire. 3. Définitions et abréviations Abréviations: CHMY: LBM: RQ: MQ: GBEA: Centre Hospitalier Moulins-Yzeure Laboratoire de Biologie Médicale Référent Qualité Manuel Qualité Guide de Bonne Exécution des Analyses Vocabulaire relatif à la qualité: Qualité : Politique Qualité : Management de la qualité : Système de management : Aptitude d un ensemble de caractéristiques intrinsèques à satisfaire des exigences. Orientations et intentions générales d un organisme relatives à la qualité telles qu elles sont officiellement formulées par la direction Activités coordonnées permettant d orienter et de contrôler un organisme en matière de qualité. Système permettant d établir une politique et des objectifs et d atteindre ces objectifs Ce document ne peut être reproduit sans l'autorisation du laboratoire 4/24
5 Processus : Maîtrise de la qualité : Amélioration de la qualité : Amélioration continue : Traçabilité : Action corrective : Action préventive: Ensemble d activités corrélées ou interactives qui transforment des éléments d entrée en éléments de sortie Partie du management de la qualité axée sur la satisfaction des exigences pour la qualité. Partie du management de la qualité axée sur l accroissement de la capacité à satisfaire aux exigences pour la qualité. Activité régulière permettant d accroître la capacité à satisfaire aux exigences Aptitude à retrouver l historique, la mise en œuvre ou l emplacement de ce qui est examiné. Action visant à éliminer la cause d une non-conformité ou d une autre situation indésirable détectée. Action visant à éliminer la cause d une non-conformité potentielle ou d une autre situation potentielle indésirable. Vocabulaire relatif au laboratoire Etalonnage : Vérification : Etalon de référence : Etalon de travail : Incertitude de mesure : Examens de biologie médicale: Compte rendu d'examens: Phase préanalytique: Phase analytique: Phase postanalytique: Prélèvement: Validation: Ensemble des opérations établissant, dans des conditions spécifiées, la relation entre les valeurs indiquées par un appareil de mesure ou un système de mesure ou les valeurs représentées par une mesure matérialisée, et les valeurs connues correspondantes d une grandeur mesurée. Confirmation par examen et établissement des preuves que les exigences spécifiées ont été satisfaites. Etalon en général de la plus haute qualité métrologique disponible en un lieu donné, duquel dérive les mesurages effectués en ce lieu. Etalon qui, habituellement étalonné par comparaison à un étalon de référence, est utilisé couramment pour étalonner ou contrôler des mesures matérialisées ou des appareils de mesure. Estimation caractérisant l étendue des valeurs dans laquelle se situe la valeur vraie d une grandeur mesurée. Un examen de biologie médicale est un acte médical qui concourt à la prévention, au dépistage, au diagnostic ou à l évaluation du risque de survenue d états pathologiques, à la décision et à la prise en charge thérapeutiques, à la détermination ou au suivi de l état physiologique ou physiopathologique de l être humain. Un examen de biologie médicale se déroule en trois phases : pré-analytique, analytique et post-analytique. Document écrit, validé et signé par le biologiste, comportant les résultats d'analyses qualitatives et ou quantitatives accompagnés de commentaires aussi souvent que cela est nécessaire ou prévu par la réglementation. Ces résultats doivent être présentés conformément à la réglementation en vigueur. comprend le prélèvement d un échantillon biologique sur un être humain, le recueil des éléments cliniques pertinents, la préparation, le transport et la conservation de l échantillon biologique jusqu à l endroit où il est analysé est le processus technique permettant l obtention d un résultat d analyse biologique comprend la validation biologique, l interprétation contextuelle du résultat ainsi que la communication appropriée du résultat au prescripteur, au patient, dans un délai compatible avec l état de l art. Acte permettant l'obtention d'un échantillon biologique. Opération permettant d'assurer qu'un résultat a été obtenu dans des conditions techniques (validation technique) satisfaisantes et que celui-ci est compatible avec les informations disponibles du dossier patient (validation biologique). Ce document ne peut être reproduit sans l'autorisation du laboratoire 5/24
6 GESTION DU MANUEL QUALITE 1. Elaboration, Validation et Approbation Le manuel qualité a été élaboré par les membres de l équipe qualité. Elle est composé des biologistes, du cadre de santé, du responsable qualité, du référent qualité de l'établissement, du chef de pôle, du cadre supérieur de pôle, du directeur de la qualité, du directeur des soins, du directeur des affaires générales et coopération. Ce travail a été coordonné par le responsable qualité du LBM. Le responsable qualité s'assure de la cohérence sur le fond et sur la forme. Il vérifie notamment l'adéquation des dispositions arrêtées dans le manuel avec la réglementation et les autres documents du LBM. La validation est assurée par le biologiste responsable du LBM qui s'assure que les dispositions prises sont pertinentes vis à vis de la politique et des objectifs qualité édictés. Cette validation est formalisée informatiquement dans le logiciel de qualité du LBM. 2. Diffusion Le manuel qualité est diffusé sous la responsabilité du Directeur de l'établissement suivant la liste de diffusion établie. Le manuel qualité est diffusé selon 2 modalités: la diffusion contrôlée: Lors de la parution d'une nouvelle version du manuel qualité, celui-ci est diffusé et l'ancienne version est retirée. la diffusion non contrôlée: cette diffusion est ponctuelle (remise d'un exemplaire); dans ce cas aucune actualisation de l'exemplaire adressé ne sera assurée. Le nom du destinataire, la date de mise à disposition du manuel qualité et la notion de diffusion contrôlée ou non contrôlée sont mentionnés dans chaque document diffusé. 3. Gestion des modifications Les modifications du manuel qualité sont effectuées par le responsable qualité et sont validées par la direction du LBM. 4. Classement, archivage et destruction Le manuel qualité est accessible à l ensemble du personnel du LBM. LES PROCESSUS DU LBM Le LBM a choisi l'approche processus pour organiser le management de la qualité. Il a identifié ses processus: Processus de management Processus de réalisation Processus de support Il s'agit de l'organisation et du management du LBM Il s'agit de la prise en charge du prélèvement jusqu'au rendu des résultats Ce sont les ressources nécessaires au bon fonctionnement du LBM Chacun de ces processus est présenté dans ce manuel et est décrit dans des documents (procédures, mode opératoires.) qui précisent les différentes étapes, les acteurs et les moyens à utiliser pour prévenir les risques de non-qualité ou d'insatisfaction des clients. Ce document ne peut être reproduit sans l'autorisation du laboratoire 6/24
7 La cartographie (page suivante) permet de visualiser les interactions entre les 3 processus managementréalisation-support. Toutes les activités du LBM sont ainsi représentées. La gestion des Processus du LBM est décrite dans le document : B6L-PR-001 Gestion des processus Exemple de cartographie de processus A ORGANISATION GENERALE DU LABORATOIRE La direction de l établissement a signé un engagement qui soutient le LBM dans sa démarche d accréditation A1. Définition de la politique qualité du laboratoire et des objectifs qualité La politique Qualité du Laboratoire définie les objectifs du LBM, ceux-ci sont revus tous les ans. Sur demande la politique qualité peut être joint au manuel de qualité. A2. Planification des activités et des ressources A2.1 Les activités du LBM Les horaires d ouverture du LBM sont les suivantes : Pour le public externe : Les prélèvements sanguins: Du lundi au vendredi, de 7h30 à 17h, de préférence sur rendez-vous, vous serez accueilli dans le Centre de prélèvement à Mercier 1er étage. La prise de RDV est possible du lundi au samedi de 8h à 15h30 au Pour l'enregistrement administratif au bureau des entrées (Hall principal) munissez-vous de : votre ordonnance, votre carte vitale, votre carte mutuelle, une pièce d'identité. Les résultats et leur interprétation: Au laboratoire du lundi au vendredi de 8h30 à 18h30 hors jours fériés. Ce document ne peut être reproduit sans l'autorisation du laboratoire 7/24
8 Pour les unités de soins : Du Lundi au Vendredi (8h30-18h30), le Samedi (8h30-13h30) : A partir de 8h30, les prélèvements programmés sont acheminés par les navettes. En journée, les prélèvements sont apportés par les coursiers. Les modalités de prélèvements et de conservation sont décrites dans le manuel de prélèvement sur chaque examen ainsi que sur les bons de demandes. Les prélèvements URGENTS doivent être distingués sur les bons de demande pour une prise en charge immédiate. Au-delà de 16h, les examens spécialisés ne sont plus effectués. A partir de 17h, seuls les examens urgents appartenant à la liste limitative de garde sont effectuées. Le biologiste médical d astreinte assure la validation biologique jusqu à 18h30 en semaine et 13h30 le samedi. Durant ces horaires, au minimum un biologiste médical (biologiste d astreinte) est présent sur site ou en contact permanent avec le site et en mesure d intervenir dans des délais compatibles avec les impératifs de sécurité des patients et les demandes d information des prescripteurs et des patients. Période de permanence des soins : En semaine 18h30-8h30, le samedi à partir de 13h30 jusqu au lundi 8h30, et les jours fériés Dimanches et jours fériés : Les prélèvements programmés ou urgents arrivent par les navettes ou par coursiers, le matin à partir de 8h30. Seuls les examens urgents appartenant à la liste limitative de garde sont réalisés. En période de permanence des soins, le biologiste médical d astreinte est joignable et en mesure d intervenir, sur place si nécessaire, dans des délais compatibles avec les impératifs de sécurité des patients et les demandes d information des prescripteurs. Remarque : les IDE libérales peuvent apporter des prélèvements selon les modalités du manuel de prélèvement, mais ses prélèvements restent sous forme anecdotique. Les domaines d'activités sont les suivants: Biochimie générale et spécialisée Pharmacologie-toxicologie Hématocytologie Hémostase Bactériologie Parasitologie-mycologie Sérologie infectieuse Le LBM exécute les examens de biologie médicale conformément à la réglementation en vigueur et selon les prescripteurs médicaux et les besoins des patients. A2.2 Le personnel L'organisation générale du laboratoire est présentée ci-dessous : Ce document ne peut être reproduit sans l'autorisation du laboratoire 8/24
9 Le document A2L-EN-014 Organigramme fonctionnel et nominatif est tenu à jour et diffusé en interne par le cadre de santé. A2.3 Le matériel et la liste des analyses Une liste des matériels et des analyses effectuées au laboratoire est établie et tenue à jour par le cadre de santé. La liste complète des examens réalisés par le LBM est accessible dans le manuel de prélèvement via l adresse électronique suivante Pour les examens non décrits dans notre manuel de prélèvement, réalisés dans les laboratoires spécialisés, les conditions pré analytiques de prélèvement et de transport sont consultables en se connectant sur les sites via la page d accueil du manuel de prélèvement. A3. Préparation et conduite des revues de direction La direction du LBM programme au minimum une fois par an une Revue de Direction. Cela consiste en une évaluation de l ensemble des processus du LBM et de toutes ses prestations, y compris les prestations de conseil. Voici un exemple de points qui sont abordés: le suivi de la revue de Direction précédente, les actions correctives et préventives réalisées le suivi des indicateurs de performances mis en place les résultats d'audits internes récents les évaluations réalisées par des organismes externes les résultats des évaluations externes de la qualité les réclamations les non-conformités la surveillance du délai de rendu résultat l'évaluation des fournisseurs... Ce document ne peut être reproduit sans l'autorisation du laboratoire 9/24
10 L'objectif est de s'assurer que les prestations délivrées par le laboratoire sont toujours appropriées et efficaces, ainsi que d'intégrer les changements et d'introduire toutes les améliorations pertinentes issues de l'analyse des non-conformités, des réclamations, des audits... Le compte-rendu de la revue de direction est réalisé par le responsable qualité sur le formulaire prévu à cet effet. Les résultats de la revue doivent être pris en compte dans les objectifs et les priorités du laboratoire, et intégrés dans les plans d'action internes au laboratoire. Si certains résultats de la revue de direction impactent sur d'autres services de l'établissement (information, logistiques...), il est nécessaire que notre demande d'amélioration leur soit transmise. Les modalités de la Revue de Direction sont définies dans la procédure: A3L-PR-001 Gestion des Revues de Direction et des Revues Qualité A4. Communication et éthique A4.1 Communication interne au laboratoire Pour s'assurer que la politique, les objectifs et les résultats associés sont connus et compris par l'ensemble du personnel du laboratoire, des actions de sensibilisation et de communication interne sont réalisées par différents moyens: tableau d'affichage (avec note d information ) info-flash revue qualité réunions avec le personnel Logiciel Gestion documentaire LOGIDOC avec traçabilité des actions (création, vérification, révision, approbation, prise de connaissance...etc...) Ces moyens permettent de renforcer la compréhension et l'appropriation, par l'ensemble du personnel, des objectifs des attentes des patients et des prescripteurs. A4.2 Communication interne au CHMY Pour informer les unités du centre hospitalier de la démarche engagée par le laboratoire, une communication est assurée par: des articles ponctuels dans le journal de l'établissement «GRAND ANGLE» et dans le journal du service qualité «RENDEZ-VOUS QUALITE». par des notes d'information par messagerie interne au CHMY par courrier interne A4.3 Communication avec les professionnels de santé Les biologistes peuvent proposer ou être sollicités pour apporter des conseils: aux prescripteurs concernant le choix d'examens, la fréquence de demande d'examens, en matière d'interprétation des résultats aux infirmières, aux sages-femmes...en matière de technique de prélèvements, de matériel de prélèvement... Dans tous les cas, les professionnels de santé sont destinataires des compte-rendus d'examens par le biais du dossier patient informatisé, par téléphone/fax si nécessaire et par courrier. Ce document ne peut être reproduit sans l'autorisation du laboratoire 10/24
11 A4.4 Communication avec les patients Les biologistes mettent à disposition les comptes-rendus d'examens des patients externes par courrier postal ou remis en main propre suivant leur choix. Le biologiste médical peut à la demande du patient, lui commenter oralement ses résultats (au laboratoire, ou par téléphone après déclinaison de l'identité). Les tarifs des examens sont communiqués par voie d'affichage dans la salle d'attente des consultations externes et au secrétariat du LBM. Tous ces moyens de communication (interne, externe...) sont décrits dans le document : A2L-PR-002 Communication interne et externe. Les modalités d'apport de conseils sont décrites dans le document : A2L-PR-001 Les prestations de conseil A4.5 Ethique Afin de garantir les exigences déontologiques inhérentes aux activités du laboratoire, les principes suivants sont respectés: aucune considération financière ou politique n'influe sur la réalisation des analyses l'intérêt et les besoins du patient sont toujours la considération première tous les patients sont traités équitablement et sans discrimination seules les informations strictement nécessaires à la réalisation de l'examen et à l'interprétation des résultats sont collectées ou visualisées (dossier informatisé) respect de la confidentialité des informations concernant les patients B SUIVI DU SYSTEME QUALITE B1. Gestion de l'écoute des patients La satisfaction des clients et des prescripteurs est un des objectifs de la Politique Qualité du laboratoire. Aussi est-il nécessaire de la mesurer régulièrement afin d'identifier des axes d'amélioration pertinents. Deux systèmes sont en place dans le laboratoire pour mesurer cette satisfaction. B1.1 Gestion des réclamations Lorsque le personnel du laboratoire est confronté à une réclamation (patient, prescripteur, fournisseur...), celle-ci est enregistrée et fait l'objet d'un traitement Les modalités de traitement des réclamations sont décrites dans la procédure : B1L-PR-001 Gestion des réclamations. B1.2 Enquêtes de satisfaction Le laboratoire réalise par ailleurs des enquêtes de satisfaction. Des synthèses régulières des réclamations et des enquêtes sont faites et présentées par le Responsable Qualité en comité de pilotage et annuellement en revue de direction. Les modalités de traitement des enquêtes de satisfaction sont décrites dans la procédure: B1L-PR-002 Gestion des enquêtes de satisfaction B2. Suivi des indicateurs de performances Le laboratoire a défini des indicateurs de performances à suivre pour chaque processus du LBM. L analyse de ces indicateurs est faite de manière régulière, et est tracée dans un tableau de bord. Ils Ce document ne peut être reproduit sans l'autorisation du laboratoire 11/24
12 permettent: de surveiller le bon fonctionnement du laboratoire d'évaluer la qualité des prestations de mesurer l'atteinte des objectifs fixés dans le cadre de la Politique Qualité du LBM. Les modalités de traitement de la mise en place et du suivi des indicateurs sont décrites dans le document : B2L-PR-001 Gestion des indicateurs de performance B3. Gestion des évaluations (audits internes, évaluations croisées...) Les différents types d'évaluation mis en place par le laboratoire sont: des audits internes des audits externes (audit à blanc, audit d évaluation COFRAC) Régulièrement des audits internes sont réalisés au regard de la norme et ou des procédures dans les différents secteurs du laboratoire. Ils visent à vérifier la mise en application du système qualité défini et d'identifier les actions d'amélioration à apporter. Le LBM peut mandater, un prestataire externe pour réaliser un audit du système de qualité du LBM. Cette démarche s appelle audit à blanc. Elle permet de faire un point sur la maîtrise du système qualité du LBM. A la suite de ces audits, des écarts peuvent être constatés, auquel cas des actions d améliorations seront mises en place. La demande d accréditation du LBM auprès du COFRAC, va faire l objet d un audit d évaluation initial. Cette visite est traitée de la même manière qu un audit à blanc La gestion des audits internes (planification, réalisation et suivi) est décrite dans le document : B3L-PR-001 Gestion des Audits Internes. B4. Maîtrise des non-conformités et des évènements indésirables B4-1 Les non-conformités Afin de faire évoluer notre système qualité, une démarche de déclaration de non-conformité est en place dans le laboratoire. Une non-conformité peut survenir au niveau de tous les processus du laboratoire. Le traitement des non-conformités se réalisent en 2 temps: mise en œuvre de solutions immédiates (ou mesures curatives) analyse et traitement des non-conformités et recherche des causes pour déclencher si nécessaire des actions correctives/préventives. Le Responsable Qualité en collaboration avec le personnel du laboratoire assure le traitement des nonconformités. Une synthèse des non-conformités est réalisée lors de la revue de direction Les modalités de traitement des non-conformités sont décrites dans le document: B4L-PR-001 Gestion des non-conformités et des dérogations B4-2 Les évènements indésirables Tout événement survenant au sein de l établissement de santé et qui peut avoir des conséquences néfastes sur le patient, les professionnels de santé, les visiteurs ou les biens est appelé événement indésirable. Les évènements indésirables déclarés par les services et concernant le LBM ou déclarés par le LBM lui-même, sont gérés au niveau de la Direction Qualité et Gestion des Risques du CHMY; cependant la déclaration d évènements indésirables peut croiser une déclaration des non-conformités au LBM. Les évènements indésirables concernant le LBM sont discutés lors de réunion CREX (réunion en Ce document ne peut être reproduit sans l'autorisation du laboratoire 12/24
13 collaboration avec les Service Qualité du CHMY Les modalités de gestion des évènements indésirables sont décrites dans le document transversal : 06/H/GDR/INC/PR/001 Procédure de déclaration et de traitement des évènements indésirables. B5. Gestion des actions d'amélioration (actions correctives et préventives) Des actions d'amélioration sont déclenchées lorsque des pistes de progrès sont identifiées. Ces dernières peuvent être générées par l'analyse : des non-conformités, réclamations des évènements indésirables de l'établissement des enquêtes de satisfaction des évaluations: auto-évaluations, audits... le suivi d'indicateurs des audits les revues de direction... Au-delà des actions immédiatement mises en œuvre (actions curatives), des actions d'améliorations (correctives et/ ou préventives) peuvent être décidées. Le Responsable Qualité assure le suivi des actions d'amélioration, vérifie la mise en application et s'assure de leur efficacité. Des synthèses régulières des actions d'amélioration sont réalisées par le Responsable Qualité et présentées lors des revues qualité ou revue de direction. Les modalités de gestion des actions d'amélioration sont décrites dans la procédure: B5L-PR-001 Amélioration continue et B5L-PR-002 Gestion des actions correctives et préventives B6 Gestion des processus La gestion du Système de Management de la Qualité du Laboratoire de Biologie Médicale se fait par l approche processus. Cette approche processus consiste à identifier tous les processus en fonction des activités du LBM et de ses prestations. Les processus définis au LBM ont été vus ci-dessus dans le chapitre PROCESSUS DU LBM (page 6-7) La gestion des Processus du LBM est décrite dans le document : B6L-PR-001 Gestion des processus B7 Gestion des Risques La gestion des risques a pour mission de maîtriser tous les risques identifiés potentiellement critiques. Elle s applique plus particulièrement au processus de réalisation. La gestion des risques du LBM est décrites dans la procédures B7L-PR-001 Gestion des risques C PRE-ANALYTIQUE C1. Prise en charge d'une demande d'analyse L organisation mise en place par le LBM permet de: garantir un accueil adapté et conforme aux exigences de la confidentialité s assurer de la capacité du laboratoire à traiter le dossier du patient d accepter et d enregistrer la demande de réaliser les prélèvements dans le respect des exigences réglementaires, conformément au manuel de prélèvement du laboratoire diffusé dans les services de garantir la bonne identification, la réception (critères d acceptation et de refus) et la gestion des échantillons de traiter avec un circuit spécifique les demandes urgentes Ce document ne peut être reproduit sans l'autorisation du laboratoire 13/24
14 de maîtriser les conditions de transport (délai, température, sécurité) des échantillons vers le laboratoire de transmettre vers les salles techniques ou vers les sous-traitants dans des conditions maîtrisées et de préparer les échantillons pour le processus de réalisation d analyse. Pour les consultations externes, l'accès des personnes à mobilité réduite est assuré par la présence d'un ascenseur au niveau du site de prélèvement (Mercier 1er). Les documents suivants décrivent toutes les dispositions prises pour maîtriser ce processus: C1L-MO- 001 Accueil d'un patient - C1L-EN-001-Demandes formulées oralement - C1L-PR-004 Revue de contrat C2. Prélèvements Les prélèvements prescrits ou demandés par le patient sont réalisés soit: dans l'unité d'hospitalisation aux consultations externes Tous les préleveurs sont des professionnels habilités. Le laboratoire met à disposition des préleveurs les consignes et conditions de réalisation de prélèvement via le manuel de prélèvement en ligne. au domicile du patient Dans ce cas les prélèvements sont assurés par les infirmiers de ville. Ceux-ci ont accès au manuel de prélèvement en ligne via le site internet de l hôpital ( au niveau de la rubrique «Laboratoire de biologie médicale» Les renseignements nécessaires à un prélèvement de qualité sont décrits dans le manuel de prélèvement : C3. Gestion des échantillons C3.1 Modalités de transport Les échantillons acheminés par la navette sécurisée sont transportés selon les modalités définies dans les procédures de transport du CHMY: délai, sécurité et conditions de conservation. Lorsque les échantillons sont acheminés par une coursière ou un personnel soignant (urgences...) les échantillons sont transportés dans sacoche isotherme prévue à cet effet. Les échantillons acheminés par la navette sont pris en charge en salle de réception. Les échantillons Ce document ne peut être reproduit sans l'autorisation du laboratoire 14/24
15 acheminés hors navette sont déposés au secrétariat dans un plateau prévu à cet effet et le bon de demande est horodaté par la personne apportant le prélèvement. Les modalités de transport des échantillons sont décrites dans les documents transversaux du CHMY: 07/M/LAB/ORG/PR/001 Procédure d'acheminement des prélèvements et retour des navettes (site de Moulins) 07/M/LAB/ORG/PR/002 Procédure d'acheminement des prélèvements (site d'yzeure) C3.2 Réception des échantillons Les échantillons peuvent être reçus de différentes façons: dans la salle de réception du LBM : Il s'agit des échantillons des transports programmés (services du CHMY, hôpitaux en convention avec le CHMY) et acheminés par une navette. Tous les matins les techniciens les réceptionnent. au secrétariat du LBM : Il s'agit des échantillons des consultations externes, de la médecine du travail... Il s'agit des prélèvements réalisés en dehors des horaires des transports programmés (dont les prélèvements urgents) qui sont apportés par les coursières ou à défaut par un soignant du service Ce sont les prélèvements apportés par le patient lui-même ou par une infirmière libérale Un premier niveau de critères d'acceptation et de refus a été défini et mis en place à chaque lieu de réception afin d'assurer la prise en charge des échantillons dans les meilleures conditions. Un second niveau de critères d'acceptation et de refus est effectué après centrifugation des échantillons. C3.3 Manipulation et conservation des échantillons Une fois les échantillons réceptionnés, ils sont triés et enregistrés dans le SIL du LBM. Ils sont ensuite centrifugés si nécessaire puis dispatchés sur les différents postes techniques. La manipulation des échantillons se fait rigoureusement de manière à éviter tout risque de contamination pour le personnel et tout risque d'inversion en respectant une identification rigoureuse. Le pré-traitement des échantillons est fait selon les recommandations des fournisseurs (centrifugation, décantation..). Avant le traitement analytique des prélèvements, ceux-ci sont conservés en respectant les conditions précises des documents fournisseurs (température de conservation, délai de réalisation,...) Certains échantillons nécessitent d'être conservés en biothèque conformément à la réglementation. Les échantillons sont pris en charge selon les documents: C1L-PR-002 Traitement des demandes d'examen des patients hospitalisés C1L-PR-003 Traitement des demandes d'examen du patient externe C1L-PR-001 Traitement des demandes d'examens urgents C1L-IN-005 Gestion des navettes au laboratoire C3L-IN-001 Conservation pré-analytique des échantillons biologiques (primaire-aliquot) C3L-IN-002 Conservation post-analytique des échantillons biologiques C3L-IN-003 Biothèque C4. Gestion des analyses transmises Le laboratoire transmet des examens à des sous-traitants dans les cas suivants: lorsque les examens ne sont pas réalisés au laboratoire (contrats prestataires, conventions) en cas d'impossibilité de réaliser un ou plusieurs examens (panne automate...) Ce document ne peut être reproduit sans l'autorisation du laboratoire 15/24
16 pour un contrôle d'un résultat par une technique différente Les résultats des examens sous-traités sont consultables et éditables à partir des serveurs des soustraitants. Ils sont transmis par courrier (et fax) au LBM. Une revue des résultats est effectuée par les biologistes. Les résultats sont ensuite adressés aux prescripteurs et aux patients dans le cas des consultations externes (sauf exception). Les prestations des laboratoires sous-traitants sont surveillées annuellement par les biologistes en termes de qualité et de compétence. Les modalités de sous-traitance sont décrites les documents : C4L-PR-001 Gestion des examens sous-traités et C4L-PR-002 Sélection et évaluation des LBM sous-traitants. D ANALYTIQUE D1. Validation technique : Gestion des contrôles et des calibrations La validation technique, sous la responsabilité du technicien, permet de s'assurer de la fiabilité du processus analytique (bon fonctionnement de l'appareil, calibrations, résultats des contrôles internes de la qualité, gestion des valeurs d'alerte, des résultats antérieurs, des critères de repasse...) Les modalités de contrôles internes sont définies par matériel dans les modes opératoires. Le suivi de ces contrôles est assuré par les techniciens et les biologistes afin d'éviter toute dérive. Ainsi la composante de fidélité intermédiaire est vérifiée à chaque série et la composante de justesse selon une fréquence mensuelle. La combinaison des deux permet de définir une erreur totale acceptable à confronter aux critères d'acceptabilité définis par l'état de l'art. De plus l'exactitude des résultats d'analyses est assurée par la participation du laboratoire à des contrôles externes. Les modalités de gestion des contrôles internes et externes sont décrites dans les documents: D1L-PR-001 Gestion des Calibrations et des Contrôles Internes de la Qualité des examens de biologie médicale D1L-PR-002 Gestion des Evaluations Externes de la Qualité et des Contrôles de Qualité Nationaux D2. Validation analytique La validation analytique permet de vérifier pour un patient donné la cohérence des valeurs trouvées avec les valeurs de référence et avec les antériorités de ce patient. Afin de garantir une homogénéité dans les contrôles des résultats des critères de repasse ont été définis. Les modalités de validation technique des examens de biologie médicale sont décrites dans les documents : D2L-PR-001 Validation analytique d'un examen - D2L-IN-001 Critères de repassages des examens de biologie D3. Utilisation du matériel/équipement Pour chaque analyseur, des modes opératoires et ou fiches d'instruction sont rédigés pour décrire les modalités d'utilisation. Ces modes opératoires/ fiches d'instruction font référence aux documents du fournisseur. Les documents sont disponibles à chaque poste de travail (sous format papier et/ou informatique) et connus par le personnel utilisateur. D4. Réalisation des examens Les examens sont effectués par du personnel habilité du laboratoire. Pour chaque examen un mode opératoire est rédigé pour décrire les modalités de réalisation avec référence aux fiches fournisseurs gérées par les référents des automates. Ces documents contiennent les différentes étapes à suivre, le matériel et les réactifs utilisés, dans le respect des règles d'hygiène et de Ce document ne peut être reproduit sans l'autorisation du laboratoire 16/24
17 sécurité. Les documents sont disponibles à chaque poste de travail (sous format papier et/ou informatique). Les modalités de vérification de méthode sont décrites dans le document:d1l-pr-003 Validation ou vérification des méthodes d'analyse E POST-ANALYTIQUE E1. Validation biologique La validation biologique est le contrôle de la vraisemblance et de la cohérence de l'ensemble des résultats des analyses d'un même dossier, et leur confrontation avec les résultats antérieurs. Elle peut nécessiter la connaissance de l'état clinique du patient et les traitements mis en œuvre. Seuls les biologistes peuvent réaliser cette validation. En intra-hospitalier, la validation biologique est assurée sur le système informatique du LBM. Pour les établissements de la communauté du territoire (hôpital Cœur du Bourbonnais, hôpital de Bourbon l'archambault...), la validation biologique est réalisée sur le modèle intra-hospitalier. Pour les externes, la validation biologique est réalisée puis la signature du biologiste est apposée sur le compte-rendu papier des patients. L'ensemble de la procédure est décrite dans E1L-PR-001validation biologique des examens de biologie médicale. E2. Transmission des résultats E2.1 Transmission sur serveur informatique Pour les examens des patients hospitalisés, les résultats sont mis à disposition des prescripteurs sur le serveur informatique du CHMY. La consultation des résultats d examens sur le serveur peut se faire pour des résultats partiels validés techniquement pour la liste limitative des examens urgents et pour les services classés critiques entre 8h30 et 18h30 en semaine hors jours fériés, 8h30-13h30 le samedi. Pendant la période de permanence des soins, les résultats de la liste limitative des examens urgents sont disponibles après validation technique pour l ensemble des services. Dans tous les cas, le compte-rendu définitif est consultable par les prescripteurs par l intermédiaire d un fichier au format pdf qui est généré automatiquement après la validation biologique du dossier. E2.2 Transmission des éditions papier Les comptes rendus papiers de résultats sont présentés conformément à la réglementation et de façon à être compréhensible par le prescripteur et le patient. Les résultats sont édités après validation biologique pour les secteurs de biochimie et d'hématologie et le biologiste signe le compte-rendu pour les externes. Pour le secteur de microbiologie, les résultats sont édités après validation biologique et signés par le biologiste. Des commentaires peuvent être nécessaires: ils sont formulés par écrit ou oralement permettant d'aider l'interprétation des résultats par le prescripteur. Les modalités de transmission des comptes-rendus sont décrites dans la procédure: E2L-PR-001 : Transmission ou Communication des résultats F RECHERCHE BIOMEDICALE A ce jour, le LBM n'effectue pas de recherche biomédicale. Ce document ne peut être reproduit sans l'autorisation du laboratoire 17/24
18 G GESTION DU PERSONNEL G1. Gestion des compétences du personnel G1-1 Les fonctions Les différentes fonctions nécessaires dans le LBM ont été décrites. La fiche de fonction/profil de poste est un document décrivant les missions, les activités et les responsabilités liées à chaque fonction. Le recrutement d une nouvelle personne est sous la responsabilité de la Direction du CHMY. G1-2 Les postes Chaque membre du personnel est habilité sur une ou plusieurs fiches de poste. Ces fiches décrivent le contenu et les exigences d'un poste de travail. La gestion des compétences et l'entretien annuel sont sous la responsabilité du biologiste responsable et du cadre de santé. G2. Gestion de la formation Les besoins de formation sont recueillis et centralisés par le cadre de santé du LBM après consultation des biologistes. L'ensemble des demandes est analysé par le cadre de santé du LBM et le cadre supérieur de santé du Pôle et la fiche de recueil des besoins en formation est réalisée ; cette dernière est transmise à la cellule de formation du CHMY. La direction du CHMY met en place un plan de formation annuel afin que tout le personnel ait un niveau de compétences compatible avec les exigences du LBM. G3. Gestion des plannings Le cadre de santé gère le planning du personnel paramédical. Une délégation pour la réalisation des plannings est formalisée dans chaque secteur avec une personne responsable. Les modalités de gestion du personnel sont définies dans les procédures: G1L-PR-001 Recrutement, intégration et habilitation du personnel au laboratoire G2L-PR-001 Gestion de la formation du personnel paramédical G3L-PR-001 Règles de fonctionnement du planning du laboratoire H GESTION DES DOCUMENTS QUALITE H1. Maîtrise du système documentaire qualité H1.1-La structure documentaire Les documents établissant les dispositions mises en œuvre pour assurer la qualité des prestations du laboratoire sont organisées suivant une architecture pyramidale à 5 niveaux: Niveau 1: manuel qualité. Il présente les dispositions générales prévues dans le cadre de la politique qualité du laboratoire. C'est le document de base du système qualité. Niveau 2: les procédures. Elles décrivent les principes de l'organisation et de fonctionnement au niveau de chaque processus. Niveau 3: les modes opératoires, les fiches d'instructions. Ces documents décrivent spécifiquement les activités nécessaires pour assurer la qualité des prestations du laboratoire. Niveau 4: les enregistrements: ils sont les preuves des activités effectuées ou des résultats obtenus. Niveau 5: les documents internes et documents externes. Ce sont des documents de support nécessaires pour appréhender un processus ou une activité Ce document ne peut être reproduit sans l'autorisation du laboratoire 18/24
19 H1.2 Gestion de la documentation Dans le logiciel de gestion documentaire, une fois rédigé, vérifié, approuvé et autorisé pour application. Le document est diffusé pour lecture auprès des personnes concernées. Une liste des documents qualité avec les versions en vigueur est tenue à jour et accessible à l'ensemble du personnel. La mise à jour et l'archivage des documents qualité sont décrites dans la procédure de gestion documentaire. La consultation des documents est accessible en format informatique, voir en format papier (si la diffusion de celle-ci est tracé) Les règles de gestion et de rédaction d'un document qualité sont décrites dans les procédures: H1L-PR-001 Gestion documentaire interne H1.3 Gestion de la documentation externe Le LBM peut être amené à gérer des documents externes tels que les documents fournisseurs...l utilisation de ses documents est suivi, sous format papier ou intégrer dans la logiciel de gestion documentaire Les règles de gestion des documents externes sont décrites dans le document : H1L-PR-002 Gestion documentaire externe I MAITRISE DES ENREGISTREMENTS Autorités et responsabilités I1. Maîtrise du système informatique =gestion du système d'information Le système informatique général utilisé par le LBM permet les opérations suivantes: gestion des dossiers patients (DxLab) connexion des automates pour le transfert des résultats (DxLab puis Crossway) Gestion des statistiques (DxLab) Ce document ne peut être reproduit sans l'autorisation du laboratoire 19/24
20 Gestion des commandes Gestion documentaire: Logidoc, Open office, Intranet (niveau établissement) Gestion des indicateurs: non-conformités (DxLab)... Gestion des plannings Messagerie interne (niveau établissement) Le SIL (DxLab) a fait l'objet d'une déclaration à la CNIL N Le SIL est couvert par un contrat de maintenance et de télémaintenance avec la société informatique Médasys (fournisseur du logiciel DxLab). Chaque intervention de cette société est tracée sur un compterendu permettant d'identifier les raisons de l'intervention et l'objet des modifications. L'accès à la télémaintenance ne peut être autorisé que par un personnel du laboratoire. Le SIL et l'accès aux logiciels des automates sont protégés par un code d utilisateur propre à chaque agent du laboratoire ainsi qu'un mot de passe donnant l'accès à certaines fonctionnalités du système suivant la fonction de l'utilisateur. Le système est sauvegardé quotidiennement selon la procédure de l'établissement. Les systèmes informatiques des automates font l'objet de sauvegardes conformément aux recommandations des fournisseurs. Les modalités de gestion du système informatique sont définies dans les procédures : I1L-PR-002 Maîtrise du système informatique du Laboratoire I1L-PR-001 Mesures à prendre en cas de panne du système informatique de laboratoire I1L-MO-001 Modalités d'intervention dans le logiciel DxLab de Médasys. I2. Maîtrise de l'archivage des enregistrements I2.1 Identification et traçabilité Afin de pouvoir suivre le cheminement de la demande jusqu'au rendu des résultats, un système d'identification et de traçabilité rigoureux a été mis en place. Des planches d'étiquettes comportant un numéro de travail unique sont préalablement éditées par le LBM. Pour chaque demande, sur la prescription et les échantillons sont collées les étiquettes provenant d'une même planche. Une étape de vérification de la concordance de l'identification des prélèvements par rapport aux bons de demande ou prescription est effectuée par la personne ayant pris en charge la demande Pour les bons de demande (patients hospitalisés au CHMY et établissements conventionnés au CHMY), ceux-ci sont passés au scanbac et enregistrés dans le SIL. Pour les prescriptions hors bon de demande (patient avec ou sans ordonnance), le patient et ses examens sont enregistrés dans le SIL avec le numéro de travail attribué au moment de la réception de la prescription et des prélèvements. La technicienne valide chaque dossier en vérifiant la concordance entre le bon de demande scanné et le dossier SIL, ceci afin d'éviter les risques d'erreur de lecture optique. Les principes d'identification mis en œuvre permettent de retrouver l'historique de l'examen c'est- à - dire les intervenants, les lots de réactifs, calibrateurs et contrôles utilisés, les non-conformités, résultats, interprétations et les différents opérateurs. I2.2 Gestion des enregistrements et archivage La durée d'archivage des enregistrements produits au cours des activités de chaque processus est définie. Ces enregistrements sont conservés sur support informatique et ou support papier. Les modalités de conservation permettent de retrouver facilement les informations et garantissent un environnement Ce document ne peut être reproduit sans l'autorisation du laboratoire 20/24
21 approprié pour éviter les détériorations, les endommagements, les pertes et le respect de la confidentialité. Les enregistrements relatifs à la technique sont conservés de manière à assurer une traçabilité complète des examens. Les modalités d'archivage sont décrites dans le document: I2L-PR-002 «Gestion des enregistrements et archivage» I3. Gestion de la confidentialité Toute l'activité du laboratoire est régie par le secret médical. Le personnel est tenu d'assurer la confidentialité des informations qu'il détient de par son activité au sein du laboratoire. Cependant afin de mieux faire prendre conscience de cette exigence, l'obligation du respect de la confidentialité est précisée dans le contrat de travail, dans un document d'engagement : «obligation de secret professionnel» signé par le professionnel recruté. Une note d'information sur l'obligation de discrétion professionnelle est remise à l'agent. L'accès aux aires techniques est limité aux membres du personnel et aux personnes ayant signé un engagement de confidentialité de façon à garantir la sécurité des informations et des résultats. Depuis l'accueil jusqu'au rendu des résultats, une procédure a été établie pour assurer la confidentialité des informations. Le respect de la confidentialité est décrit dans le document: I3L-PR-001Maîtrise de la Confidentialité J MAINTENANCE DES EQUIPEMENTS Le terme équipement correspond aux automates, aux instruments de mesure, ou autres appareils tels que les centrifugeuses, les congélateurs, les réfrigérateurs... J1. Maintenance des automates du laboratoire J1.1 Maintenance Le matériel du laboratoire est entretenu régulièrement selon les recommandations des fournisseurs. Pour les analyseurs il existe deux types de maintenance: la maintenance interne est réalisée par le technicien habilité travaillant sur l'appareil. Elle est effectuée rigoureusement selon les instructions du constructeur et est enregistrée au niveau du registre des maintenances propre à chaque matériel. La maintenance externe est réalisée par le fournisseur et est préventive. Cependant elle peut être curative/corrective (à la suite d'une panne). Toute intervention de maintenance externe est enregistrée sur un bon d'intervention et celui-ci est incorporé dans le registre propre à chaque matériel. Le biologiste est chargé de vérifier que les maintenances préventives sont effectuées selon le planning prévu. Après une maintenance, le bon fonctionnement de l'automate est vérifié par le technicien du poste. Les dispositions prises pour maîtriser ce processus sont décrites dans la procédure: J1L-PR-001 Gestion des maintenances J1.2 Gestion des pannes Lorsqu'un dysfonctionnement majeur se produit sur un appareil, et que le délai d'intervention est incompatible avec la durée de conservation des échantillons et/ou le degré d'urgence de réalisation des examens, une solution de substitution est mise en place: Mise en œuvre d'une technique manuelle Ce document ne peut être reproduit sans l'autorisation du laboratoire 21/24
Sommaire des documents de la base documentaire 15189 v2012 01/11/2013
 La base documentaire a été complètement révisée pour être en conformité avec cette version 2012 de l ISO 15189. La cartographie des différents processus du LBM a également été modifiée (suppression du
La base documentaire a été complètement révisée pour être en conformité avec cette version 2012 de l ISO 15189. La cartographie des différents processus du LBM a également été modifiée (suppression du
Manuel qualité du laboratoire
 Laboratoire de biologie médicale des Hôpitaux Universitaires de Strasbourg Pôle de biologie 1 place de l Hôpital BP 426 67091 Strasbourg Cedex Manuel qualité du laboratoire Version 04 Rédaction : Cellule
Laboratoire de biologie médicale des Hôpitaux Universitaires de Strasbourg Pôle de biologie 1 place de l Hôpital BP 426 67091 Strasbourg Cedex Manuel qualité du laboratoire Version 04 Rédaction : Cellule
Mise en œuvre de l accréditation dans un laboratoire de biologie médicale privé
 Mise en œuvre de l accréditation dans un laboratoire de biologie médicale privé SELARL ANALYS / SELARL ANALYS-I Une démarche d accréditation multisites Journée du 29 Juin 2010 Thierry Avellan tavellan@free.fr
Mise en œuvre de l accréditation dans un laboratoire de biologie médicale privé SELARL ANALYS / SELARL ANALYS-I Une démarche d accréditation multisites Journée du 29 Juin 2010 Thierry Avellan tavellan@free.fr
Audit interne. Audit interne
 Définition de l'audit interne L'Audit Interne est une activité indépendante et objective qui donne à une organisation une assurance sur le degré de maîtrise de ses opérations, lui apporte ses conseils
Définition de l'audit interne L'Audit Interne est une activité indépendante et objective qui donne à une organisation une assurance sur le degré de maîtrise de ses opérations, lui apporte ses conseils
REF01 Référentiel de labellisation des laboratoires de recherche_v3
 Introduction Le présent référentiel de labellisation est destiné aux laboratoires qui souhaitent mettre en place un dispositif de maîtrise de la qualité des mesures. La norme ISO 9001 contient essentiellement
Introduction Le présent référentiel de labellisation est destiné aux laboratoires qui souhaitent mettre en place un dispositif de maîtrise de la qualité des mesures. La norme ISO 9001 contient essentiellement
La version électronique fait foi
 Page 1/6 Localisation : Classeur VERT Disponible sur Intranet A revoir : 10/2015 Objet : La présente procédure a pour objet de décrire les responsabilités et les principes pour la réalisation des prélèvements.
Page 1/6 Localisation : Classeur VERT Disponible sur Intranet A revoir : 10/2015 Objet : La présente procédure a pour objet de décrire les responsabilités et les principes pour la réalisation des prélèvements.
La gestion documentaire les bases d'un système de management de la qualité
 La gestion documentaire les bases d'un système de management de la qualité 8 ème journée professionnelle de l ANTAB - 21 Octobre 2011 Fatima TOUBAIS Ingénieur qualité Accréditation des Laboratoires Direction
La gestion documentaire les bases d'un système de management de la qualité 8 ème journée professionnelle de l ANTAB - 21 Octobre 2011 Fatima TOUBAIS Ingénieur qualité Accréditation des Laboratoires Direction
Ré!. PRQ42001 QUALITE PROCEDURE. Index 02. Page 1/10. AGENCE NATIONALE DE L'AvIATION PROCEDURE MAÎTRISE DES DOCUMENTS
 PROCEDURE QUALITE Index 02 Page 1/10 AGENCE NATIONALE DE L'AvIATION CIVILE PROCEDURE MAITRISE DES DOCUMENTS PROCEDURE QUALITE Date mai 2014 Page 2/10 1. OBJET La présente procédure définit les règles pour
PROCEDURE QUALITE Index 02 Page 1/10 AGENCE NATIONALE DE L'AvIATION CIVILE PROCEDURE MAITRISE DES DOCUMENTS PROCEDURE QUALITE Date mai 2014 Page 2/10 1. OBJET La présente procédure définit les règles pour
Référentiel Officine
 Référentiel Officine Inscrire la formation dans la réalité et les besoins de la pharmacie d officine de demain - Ce référentiel décrit dans le cadre des missions et des activités du pharmacien d officine
Référentiel Officine Inscrire la formation dans la réalité et les besoins de la pharmacie d officine de demain - Ce référentiel décrit dans le cadre des missions et des activités du pharmacien d officine
LE PROJET QUALITE-GESTION DES RISQUES- DEVELOPPEMENT DURABLE
 LE PROJET QUALITE-GESTION DES RISQUES- DEVELOPPEMENT DURABLE 1 LA POLITIQUE QUALITE-GESTION DES RISQUES Depuis 2003, la Direction s engage à poursuivre, la démarche qualité et à développer une gestion
LE PROJET QUALITE-GESTION DES RISQUES- DEVELOPPEMENT DURABLE 1 LA POLITIQUE QUALITE-GESTION DES RISQUES Depuis 2003, la Direction s engage à poursuivre, la démarche qualité et à développer une gestion
PROCEDURE ENREGISTREMENT
 Page 1 sur 7 ANNULE ET REMPLACE LES DOCUMENTS SUIVANTS référence 04/PR/001/02/V01 04/PR/001/02/V02 04/PR/001/02/V03 04/PR/001/02/V04 04/PR/001/02/V05 04/PR/001/02/V06 04/PR/001/02/V07 04/PR/001/02/V08
Page 1 sur 7 ANNULE ET REMPLACE LES DOCUMENTS SUIVANTS référence 04/PR/001/02/V01 04/PR/001/02/V02 04/PR/001/02/V03 04/PR/001/02/V04 04/PR/001/02/V05 04/PR/001/02/V06 04/PR/001/02/V07 04/PR/001/02/V08
Nom-Projet MODELE PLAN DE MANAGEMENT DE PROJET
 Nom-Projet MODELE PLAN DE MANAGEMENT DE PROJET Glossaire La terminologie propre au projet, ainsi que les abréviations et sigles utilisés sont définis dans le Glossaire. Approbation Décision formelle, donnée
Nom-Projet MODELE PLAN DE MANAGEMENT DE PROJET Glossaire La terminologie propre au projet, ainsi que les abréviations et sigles utilisés sont définis dans le Glossaire. Approbation Décision formelle, donnée
MANUEL ASSURANCE QUALITE MANUEL QUALITE CENTRE DE BIOLOGIE DU LANGUEDOC
 MANUEL ASSURANCE QUALITE Ref : MAQ-COMM-TOUS-001-14 Version : 14 Applicable le : 09-01-2015 MANUEL QUALITE CENTRE DE BIOLOGIE DU LANGUEDOC BEGUIER E. - CALIEZ T. - FONTES C. -JEANE. KERDRANVAT H. - LE
MANUEL ASSURANCE QUALITE Ref : MAQ-COMM-TOUS-001-14 Version : 14 Applicable le : 09-01-2015 MANUEL QUALITE CENTRE DE BIOLOGIE DU LANGUEDOC BEGUIER E. - CALIEZ T. - FONTES C. -JEANE. KERDRANVAT H. - LE
ADDITIF AU RAPPORT DE CERTIFICATION V2010 CLINIQUE CHIRURGICALE DU LIBOURNAIS
 ADDITIF AU RAPPORT DE CERTIFICATION V2010 CLINIQUE CHIRURGICALE DU LIBOURNAIS 119 rue de la marne - 33500 - Libourne NOVEMBRE 2014 SOMMAIRE PREAMBULE 1. Présentation du document 2. Les niveaux de certification
ADDITIF AU RAPPORT DE CERTIFICATION V2010 CLINIQUE CHIRURGICALE DU LIBOURNAIS 119 rue de la marne - 33500 - Libourne NOVEMBRE 2014 SOMMAIRE PREAMBULE 1. Présentation du document 2. Les niveaux de certification
COMPTE RENDU D ACCREDITATION DE L'HOPITAL ET INSTITUT DE FORMATION EN SOINS INFIRMIERS CROIX-ROUGE FRANÇAISE
 COMPTE RENDU D ACCREDITATION DE L'HOPITAL ET INSTITUT DE FORMATION EN SOINS INFIRMIERS CROIX-ROUGE FRANÇAISE Chemin de la Bretèque 76230 BOIS-GUILLAUME Mois de juin 2001 SOMMAIRE COMMENT LIRE LE «COMPTE
COMPTE RENDU D ACCREDITATION DE L'HOPITAL ET INSTITUT DE FORMATION EN SOINS INFIRMIERS CROIX-ROUGE FRANÇAISE Chemin de la Bretèque 76230 BOIS-GUILLAUME Mois de juin 2001 SOMMAIRE COMMENT LIRE LE «COMPTE
Activité : Élaboration, mise en forme et renseignement de documents
 ACTIVITÉS ADMINISTRATIVES À CARACTÈRE TECHNIQUE Activité : Élaboration, mise en forme et renseignement de documents Tâche : Rédaction de messages et de courriers professionnels simples liés à l activité
ACTIVITÉS ADMINISTRATIVES À CARACTÈRE TECHNIQUE Activité : Élaboration, mise en forme et renseignement de documents Tâche : Rédaction de messages et de courriers professionnels simples liés à l activité
Réorganisation du processus de transfusion sanguine au Liban
 Réorganisation du processus de transfusion sanguine au Liban Cahier des charges du Logiciel Médico Technique Rédigé en collaboration avec Cahier des charges du Logiciel Médico Technique La procédure d
Réorganisation du processus de transfusion sanguine au Liban Cahier des charges du Logiciel Médico Technique Rédigé en collaboration avec Cahier des charges du Logiciel Médico Technique La procédure d
SPECIFICATION "E" DU CEFRI CONCERNANT LES ENTREPRISES EMPLOYANT DU PERSONNEL DE CATEGORIE A OU B TRAVAILLANT DANS LES INSTALLATIONS NUCLEAIRES
 92038 PARIS LA DEFENSE CEDEX Page 1 / 11 SPECIFICATION "E" DU CEFRI CONCERNANT LES ENTREPRISES EMPLOYANT DU PERSONNEL DE CATEGORIE A OU B TRAVAILLANT DANS LES INSTALLATIONS NUCLEAIRES 29/11/00 13 Indice
92038 PARIS LA DEFENSE CEDEX Page 1 / 11 SPECIFICATION "E" DU CEFRI CONCERNANT LES ENTREPRISES EMPLOYANT DU PERSONNEL DE CATEGORIE A OU B TRAVAILLANT DANS LES INSTALLATIONS NUCLEAIRES 29/11/00 13 Indice
BEP métiers des services administratifs BREVET D'ÉTUDES PROFESSIONNELLES MÉTIERS DES SERVICES ADMINISTRATIFS
 BREVET D'ÉTUDES PROFESSIONNELLES MÉTIERS DES SERVICES ADMINISTRATIFS ANNEXE I a RÉFÉRENTIEL DES ACTIVITÉS PROFESSIONNELLES I. APPELLATION DU DIPLÔME BEP métiers des services administratifs RÉFÉRENTIEL
BREVET D'ÉTUDES PROFESSIONNELLES MÉTIERS DES SERVICES ADMINISTRATIFS ANNEXE I a RÉFÉRENTIEL DES ACTIVITÉS PROFESSIONNELLES I. APPELLATION DU DIPLÔME BEP métiers des services administratifs RÉFÉRENTIEL
Ce document est la propriété de la MAP. Il ne peut être utilisé, reproduit ou communiqué sans son autorisation. MECANIQUE AERONAUTIQUE PYRENEENNE
 MANUEL MANAGEMENT QUALITE Révision janvier 2010 Ce document est la propriété de la MAP. Il ne peut être utilisé, reproduit ou communiqué sans son autorisation. MECANIQUE AERONAUTIQUE PYRENEENNE Place d
MANUEL MANAGEMENT QUALITE Révision janvier 2010 Ce document est la propriété de la MAP. Il ne peut être utilisé, reproduit ou communiqué sans son autorisation. MECANIQUE AERONAUTIQUE PYRENEENNE Place d
Annexe sur la maîtrise de la qualité
 Version du 09/07/08 Annexe sur la maîtrise de la qualité La présente annexe précise les modalités d'application, en matière de maîtrise de la qualité, de la circulaire du 7 janvier 2008 fixant les modalités
Version du 09/07/08 Annexe sur la maîtrise de la qualité La présente annexe précise les modalités d'application, en matière de maîtrise de la qualité, de la circulaire du 7 janvier 2008 fixant les modalités
BRANCHE DU NÉGOCE ET PRESTATIONS DE SERVICES
 Septembre 2014 CARTOGRAPHIE DES MÉTIERS DES PRESTATAIRES BRANCHE DU NÉGOCE ET PRESTATIONS DE SERVICES DANS LES DOMAINES MÉDICO-TECHNIQUES www.metiers-medico-techniques.fr CPNEFP de la branche Négoce et
Septembre 2014 CARTOGRAPHIE DES MÉTIERS DES PRESTATAIRES BRANCHE DU NÉGOCE ET PRESTATIONS DE SERVICES DANS LES DOMAINES MÉDICO-TECHNIQUES www.metiers-medico-techniques.fr CPNEFP de la branche Négoce et
DURÉE PUBLIC CONCERNÉ PRÉ-REQUIS. OUTIL PÉDAGOGIQUE FORMATEUR(S) PRIX Consultant CQS
 43 A-011 2 demi-journées / 7 heures Utilisateur :Tout personnel de la structure qui sera Obligatoire : Aucun pré-requis n est nécessaire. amené à utiliser le logiciel au quotidien. Facultatif : Avoir des
43 A-011 2 demi-journées / 7 heures Utilisateur :Tout personnel de la structure qui sera Obligatoire : Aucun pré-requis n est nécessaire. amené à utiliser le logiciel au quotidien. Facultatif : Avoir des
Diplôme d Etat d infirmier Référentiel de compétences
 Annexe II Diplôme d Etat d infirmier Référentiel de compétences Les référentiels d activités et de compétences du métier d infirmier diplômé d Etat ne se substituent pas au cadre réglementaire. En effet,
Annexe II Diplôme d Etat d infirmier Référentiel de compétences Les référentiels d activités et de compétences du métier d infirmier diplômé d Etat ne se substituent pas au cadre réglementaire. En effet,
Contrôle interne et organisation comptable de l'entreprise
 Source : "Comptable 2000 : Les textes de base du droit comptable", Les Éditions Raouf Yaïch. Contrôle interne et organisation comptable de l'entreprise Le nouveau système comptable consacre d'importants
Source : "Comptable 2000 : Les textes de base du droit comptable", Les Éditions Raouf Yaïch. Contrôle interne et organisation comptable de l'entreprise Le nouveau système comptable consacre d'importants
REALISATION DES PRESTATIONS
 Manuel de management de la qualité Chapitre 4 : REALISATION DES PRESTATIONS Approuvé par Guy MAZUREK Le 1/10/2014 Visa Page 2 / 13 SOMMAIRE 1 PROCESSUS GENERAL DE REALISATION D'UNE AFFAIRE... 4 2 LA PROSPECTION...
Manuel de management de la qualité Chapitre 4 : REALISATION DES PRESTATIONS Approuvé par Guy MAZUREK Le 1/10/2014 Visa Page 2 / 13 SOMMAIRE 1 PROCESSUS GENERAL DE REALISATION D'UNE AFFAIRE... 4 2 LA PROSPECTION...
Montrer que la gestion des risques en sécurité de l information est liée au métier
 Montrer que la gestion des risques en sécurité de l information est liée au métier Missions de l entreprise Risques métier Solutions pragmatiques et adaptées Savoir gérer la différence Adapter à la norme
Montrer que la gestion des risques en sécurité de l information est liée au métier Missions de l entreprise Risques métier Solutions pragmatiques et adaptées Savoir gérer la différence Adapter à la norme
Rapport d'audit étape 2
 Rapport d'audit étape 2 Numéro d'affaire: Nom de l'organisme : CMA 76 Type d'audit : audit de renouvellement Remarques sur l'audit Normes de référence : Autres documents ISO 9001 : 2008 Documents du système
Rapport d'audit étape 2 Numéro d'affaire: Nom de l'organisme : CMA 76 Type d'audit : audit de renouvellement Remarques sur l'audit Normes de référence : Autres documents ISO 9001 : 2008 Documents du système
La métrologie au laboratoire. vigitemp 10. centrale de surveillance et de traçabilité vigitemp kit de cartographie vigicart
 La métrologie au laboratoire vigitemp 10 centrale de surveillance et de traçabilité vigitemp kit de cartographie vigicart La métrologie au laboratoire vigitemp 10 Base de données Utilisateur Principe général
La métrologie au laboratoire vigitemp 10 centrale de surveillance et de traçabilité vigitemp kit de cartographie vigicart La métrologie au laboratoire vigitemp 10 Base de données Utilisateur Principe général
Appendice 2. (normative) Structure de niveau supérieur, texte de base identique, termes et définitions de base communs
 Appendice 2 (normative) Structure de niveau supérieur, texte de base identique, termes et définitions de base communs NOTE Dans les propositions de Texte identique, XXX désigne un qualificatif de norme
Appendice 2 (normative) Structure de niveau supérieur, texte de base identique, termes et définitions de base communs NOTE Dans les propositions de Texte identique, XXX désigne un qualificatif de norme
Génie Logiciel LA QUALITE 1/5 LA QUALITE 3/5 LA QUALITE 2/5 LA QUALITE 4/5 LA QUALITE 5/5
 Noël NOVELLI ; Université d Aix-Marseille; LIF et Département d Informatique Case 901 ; 163 avenue de Luminy 13 288 MARSEILLE cedex 9 Génie Logiciel LA QUALITE 1/5 La gestion de la qualité Enjeux de la
Noël NOVELLI ; Université d Aix-Marseille; LIF et Département d Informatique Case 901 ; 163 avenue de Luminy 13 288 MARSEILLE cedex 9 Génie Logiciel LA QUALITE 1/5 La gestion de la qualité Enjeux de la
Projet de santé. Nom du site : N Finess : (Sera prochainement attribué par les services de l ARS) Statut juridique : Raison Sociale :
 Projet de santé Nom du site : N Finess : (Sera prochainement attribué par les services de l ARS) Statut juridique : Raison Sociale : Adresse du siège social : Téléphone : Mail : Version : Etablie en date
Projet de santé Nom du site : N Finess : (Sera prochainement attribué par les services de l ARS) Statut juridique : Raison Sociale : Adresse du siège social : Téléphone : Mail : Version : Etablie en date
A1 GESTION DE LA RELATION AVEC LA CLIENTELE
 Référentiel des Activités Professionnelles A1 GESTION DE LA RELATION AVEC LA CLIENTELE L assistant prend en charge l essentiel du processus administratif des ventes. Il met en place certaines actions de
Référentiel des Activités Professionnelles A1 GESTION DE LA RELATION AVEC LA CLIENTELE L assistant prend en charge l essentiel du processus administratif des ventes. Il met en place certaines actions de
Zone de commentaires. Convention EFS / ES ( document à joindre) II, Les systèmes d'information OUI NON NC Zone de commentaires. Zone de commentaires
 5. ENSEMBLE DES PIECES CONSTITUANT LE DOSSIER A FOURNIR A L'AGENCE REGIONALE DE L'HOSPITALISATION POUR UNE DEMANDE D AUTORISATION DE FONCTIONNEMENT D UN DEPÔT DE SANG DANS UN ETABLISSEMENT DE SANTE I.
5. ENSEMBLE DES PIECES CONSTITUANT LE DOSSIER A FOURNIR A L'AGENCE REGIONALE DE L'HOSPITALISATION POUR UNE DEMANDE D AUTORISATION DE FONCTIONNEMENT D UN DEPÔT DE SANG DANS UN ETABLISSEMENT DE SANTE I.
Références : norme ISO 15189 et documents COFRAC applicables au laboratoire. Laboratoire Benezech Delhoume
 MANUEL D ASSURANCE LABORATOIRE Références : norme ISO 15189 et documents COFRAC applicables au laboratoire Laboratoire Benezech Delhoume 1 rue Père Colombier 81000 ALBI Tel : 05 63 77 78 90 Fax : 05 63
MANUEL D ASSURANCE LABORATOIRE Références : norme ISO 15189 et documents COFRAC applicables au laboratoire Laboratoire Benezech Delhoume 1 rue Père Colombier 81000 ALBI Tel : 05 63 77 78 90 Fax : 05 63
MINISTERE DES TECHNOLOGIES COMMUNICATION CENTRE NATIONAL DE L INFORMATIQUE DE L INFORMATION ET DE LA MANUEL DE MANAGEMENT DE LA QUALITE
 MINISTERE DES TECHNOLOGIES DE L INFORMATION ET DE LA COMMUNICATION CENTRE NATIONAL DE L INFORMATIQUE MANUEL DE MANAGEMENT DE LA QUALITE ISO 9001 VERSION 2008 V14 du 25 AVRIL 2012 CNI MANUEL DE MANAGEMENT
MINISTERE DES TECHNOLOGIES DE L INFORMATION ET DE LA COMMUNICATION CENTRE NATIONAL DE L INFORMATIQUE MANUEL DE MANAGEMENT DE LA QUALITE ISO 9001 VERSION 2008 V14 du 25 AVRIL 2012 CNI MANUEL DE MANAGEMENT
Fiche conseil n 16 Audit
 AUDIT 1. Ce qu exigent les référentiels Environnement ISO 14001 4.5.5 : Audit interne EMAS Article 3 : Participation à l'emas, 2.b Annexe I.-A.5.4 : Audit du système de management environnemental SST OHSAS
AUDIT 1. Ce qu exigent les référentiels Environnement ISO 14001 4.5.5 : Audit interne EMAS Article 3 : Participation à l'emas, 2.b Annexe I.-A.5.4 : Audit du système de management environnemental SST OHSAS
Conditions Particulières de Maintenance. Table des matières. Ref : CPM-1.2 du 08/06/2011
 Conditions Particulières de Maintenance Ref : Table des matières 1 CONDITIONS PARTICULIÈRES APPLICABLES AUX CONTRATS DE MAINTENANCE...2 1.1 Préambule...2 1.2 Obligations d'atreal et services rendus...2
Conditions Particulières de Maintenance Ref : Table des matières 1 CONDITIONS PARTICULIÈRES APPLICABLES AUX CONTRATS DE MAINTENANCE...2 1.1 Préambule...2 1.2 Obligations d'atreal et services rendus...2
Manuel Management Qualité ISO 9001 V2000. Réf. 20000-003-002 Indice 13 Pages : 13
 Réf. 20000-003-002 Indice 13 Pages : 13 Manuel Management Qualité ISO 9001 V2000 EVOLUTIONS INDICE DATE NATURE DE L'EVOLUTION 00 09/06/2000 Edition Originale 01 29/09/2000 Modification suite à audit interne
Réf. 20000-003-002 Indice 13 Pages : 13 Manuel Management Qualité ISO 9001 V2000 EVOLUTIONS INDICE DATE NATURE DE L'EVOLUTION 00 09/06/2000 Edition Originale 01 29/09/2000 Modification suite à audit interne
Mise au point sur LA MAINTENANCE DES DISPOSITIFS MEDICAUX. Octobre 2011. www.afssaps.fr. Agence française de sécurité sanitaire des produits de santé
 Octobre 2011 Mise au point sur LA MAINTENANCE DES DISPOSITIFS MEDICAUX Agence française de sécurité sanitaire des produits de santé 143-147 boulevard Anatole France F-93285 Saint-Denis Cedex www.afssaps.fr
Octobre 2011 Mise au point sur LA MAINTENANCE DES DISPOSITIFS MEDICAUX Agence française de sécurité sanitaire des produits de santé 143-147 boulevard Anatole France F-93285 Saint-Denis Cedex www.afssaps.fr
LA QUALITE DU LOGICIEL
 LA QUALITE DU LOGICIEL I INTRODUCTION L'information est aujourd'hui une ressource stratégique pour la plupart des entreprises, dans lesquelles de très nombreuses activités reposent sur l'exploitation d'applications
LA QUALITE DU LOGICIEL I INTRODUCTION L'information est aujourd'hui une ressource stratégique pour la plupart des entreprises, dans lesquelles de très nombreuses activités reposent sur l'exploitation d'applications
RÈGLES DE CERTIFICATION D ENTREPRISE
 RÈGLES DE CERTIFICATION D ENTREPRISE Fabrication et transformation de matériaux et d emballages destinés au contact des aliments : respect des règles d hygiène (méthode HACCP) Réf. Rédacteur LNE PP/GLB
RÈGLES DE CERTIFICATION D ENTREPRISE Fabrication et transformation de matériaux et d emballages destinés au contact des aliments : respect des règles d hygiène (méthode HACCP) Réf. Rédacteur LNE PP/GLB
REGLES DE CERTIFICATION MARQUE NF DENTAIRE PARTIE 3 OBTENTION DE LA CERTIFICATION
 REGLES DE CERTIFICATION MARQUE NF DENTAIRE PARTIE 3 OBTENTION DE LA CERTIFICATION SOMMAIRE 3.1. Constitution du dossier de demande 3.2. Processus d'évaluation initiale Rev. 9 mai 2012 PROCESSUS D'OBTENTION
REGLES DE CERTIFICATION MARQUE NF DENTAIRE PARTIE 3 OBTENTION DE LA CERTIFICATION SOMMAIRE 3.1. Constitution du dossier de demande 3.2. Processus d'évaluation initiale Rev. 9 mai 2012 PROCESSUS D'OBTENTION
Support Administratif
 09 Support Administratif Cette famille rassemble des métiers dont la finalité est d optimiser le fonctionnement et l organisation de l entreprise par la gestion administrative et le traitement d informations
09 Support Administratif Cette famille rassemble des métiers dont la finalité est d optimiser le fonctionnement et l organisation de l entreprise par la gestion administrative et le traitement d informations
C ) Détail volets A, B, C, D et E. Hypothèses (facteurs externes au projet) Sources de vérification. Actions Objectifs Méthode, résultats
 C ) Détail volets A, B, C, D et E Actions Objectifs Méthode, résultats VOLET A : JUMELAGE DE 18 MOIS Rapports d avancement du projet. Réorganisation de l administration fiscale Rapports des voyages d étude.
C ) Détail volets A, B, C, D et E Actions Objectifs Méthode, résultats VOLET A : JUMELAGE DE 18 MOIS Rapports d avancement du projet. Réorganisation de l administration fiscale Rapports des voyages d étude.
POLITIQUE ET LIGNES DIRECTRICES EN MATIERE DE TRACABILITE DES RESULTATS DE MESURE
 BELAC 2-003 Rev 1-2014 POLITIQUE ET LIGNES DIRECTRICES EN MATIERE DE TRACABILITE DES RESULTATS DE MESURE Les versions des documents du système de management de BELAC telles que disponibles sur le site
BELAC 2-003 Rev 1-2014 POLITIQUE ET LIGNES DIRECTRICES EN MATIERE DE TRACABILITE DES RESULTATS DE MESURE Les versions des documents du système de management de BELAC telles que disponibles sur le site
Conformité aux exigences de la réglementation "21 CFR Part 11" de la FDA
 Conformité aux exigences de la réglementation "21 CFR Part 11" de la FDA Définition de la réglementation 21 CFR partie 11 Au cours de la dernière décennie, l'industrie pharmaceutique a très rapidement
Conformité aux exigences de la réglementation "21 CFR Part 11" de la FDA Définition de la réglementation 21 CFR partie 11 Au cours de la dernière décennie, l'industrie pharmaceutique a très rapidement
MINISTÈRE DE LA DÉFENSE SECRÉTARIAT GÉNÉRAL POUR L'ADMINISTRATION CHARTE DE L'AUDIT INTERNE DU SECRÉTARIAT GÉNÉRAL POUR L'ADMINISTRATION
 MINISTÈRE DE LA DÉFENSE SECRÉTARIAT GÉNÉRAL POUR L'ADMINISTRATION CHARTE DE L'AUDIT INTERNE DU SECRÉTARIAT GÉNÉRAL POUR L'ADMINISTRATION 02 CHARTE DE L'AUDIT INTERNE DU SECRÉTARIAT GÉNÉRAL POUR L'ADMINISTRATION
MINISTÈRE DE LA DÉFENSE SECRÉTARIAT GÉNÉRAL POUR L'ADMINISTRATION CHARTE DE L'AUDIT INTERNE DU SECRÉTARIAT GÉNÉRAL POUR L'ADMINISTRATION 02 CHARTE DE L'AUDIT INTERNE DU SECRÉTARIAT GÉNÉRAL POUR L'ADMINISTRATION
Contenu attendu des guides nationaux de bonnes pratiques d hygiène GBPH
 Contenu attendu des guides nationaux de bonnes pratiques d hygiène GBPH Note d information à l usage des professionnels En complément de cette note, des informations relatives au contenu des GBPH sont
Contenu attendu des guides nationaux de bonnes pratiques d hygiène GBPH Note d information à l usage des professionnels En complément de cette note, des informations relatives au contenu des GBPH sont
3 - Sélection des fournisseurs... 4. 4 Marche courante... 5. 4.1 Conditionnement Transport... 5. 4.2 Livraison... 5
 1 SOMMAIRE 1 Introduction... 3 2 Principes... 3 3 - Sélection des fournisseurs... 4 4 Marche courante... 5 4.1 Conditionnement Transport... 5 4.2 Livraison... 5 4.3 - Garantie qualité / Conformité... 5
1 SOMMAIRE 1 Introduction... 3 2 Principes... 3 3 - Sélection des fournisseurs... 4 4 Marche courante... 5 4.1 Conditionnement Transport... 5 4.2 Livraison... 5 4.3 - Garantie qualité / Conformité... 5
Vocera Thierry Géraud Didier Chicheportiche. Résultats critiques et évolutions réglementaires 14-16 mai 2013
 Vocera Thierry Géraud Didier Chicheportiche Résultats critiques et évolutions réglementaires 14-16 mai 2013 1 Mauvaise communication source de décès Une étude de la Joint Commission a conclu que le manque
Vocera Thierry Géraud Didier Chicheportiche Résultats critiques et évolutions réglementaires 14-16 mai 2013 1 Mauvaise communication source de décès Une étude de la Joint Commission a conclu que le manque
Baccalauréat technologique
 Baccalauréat technologique Épreuve relative aux enseignements technologiques transversaux, épreuve de projet en enseignement spécifique à la spécialité et épreuve d'enseignement technologique en langue
Baccalauréat technologique Épreuve relative aux enseignements technologiques transversaux, épreuve de projet en enseignement spécifique à la spécialité et épreuve d'enseignement technologique en langue
La prise en charge de votre affection de longue durée
 La prise en charge de votre affection de longue durée Édition 2012 LA PRISE EN CHARGE DE VOTRE AFFECTION DE LONGUE DURÉE Sommaire Votre protocole de soins en pratique p 4 Comment êtes-vous remboursé? p
La prise en charge de votre affection de longue durée Édition 2012 LA PRISE EN CHARGE DE VOTRE AFFECTION DE LONGUE DURÉE Sommaire Votre protocole de soins en pratique p 4 Comment êtes-vous remboursé? p
REGLES DE CERTIFICATION MARQUE NF REACTION AU FEU MANCHONS ET PLAQUES D ISOLATION THERMIQUE EN ELASTOMERE EXPANSE PARTIE 4
 REGLES DE CERTIFICATION MARQUE MANCHONS ET PLAQUES D ISOLATION THERMIQUE EN ELASTOMERE EXPANSE PARTIE 4 PROCESSUS DE SURVEILLANCE DES PRODUITS CERTIFIES MODIFICATIONS ET EVOLUTION SOMMAIRE 4.1. Processus
REGLES DE CERTIFICATION MARQUE MANCHONS ET PLAQUES D ISOLATION THERMIQUE EN ELASTOMERE EXPANSE PARTIE 4 PROCESSUS DE SURVEILLANCE DES PRODUITS CERTIFIES MODIFICATIONS ET EVOLUTION SOMMAIRE 4.1. Processus
LE PLAN D'AMÉLIORATION DE LA FONCTION MARKETING
 LE PLAN D'AMÉLIORATION DE LA FONCTION MARKETING Direction du développement des entreprises et des affaires Préparé par Michel Coutu, F. Adm.A., CMC Conseiller en gestion Publié par la Direction des communications
LE PLAN D'AMÉLIORATION DE LA FONCTION MARKETING Direction du développement des entreprises et des affaires Préparé par Michel Coutu, F. Adm.A., CMC Conseiller en gestion Publié par la Direction des communications
Réf. Ifremer N 12/2 212 838. Surveillance et gardiennage du Centre Ifremer de Bretagne. Cahier des Clauses Techniques Particulières (CCTP)
 Réf. Ifremer N 12/2 212 838 Surveillance et gardiennage du Centre Ifremer de Bretagne Cahier des Clauses Techniques Particulières (CCTP) 1. OBJET...3 2. RESPONSABLES HABILITES...3 3. DEFINITION DES PRESTATIONS
Réf. Ifremer N 12/2 212 838 Surveillance et gardiennage du Centre Ifremer de Bretagne Cahier des Clauses Techniques Particulières (CCTP) 1. OBJET...3 2. RESPONSABLES HABILITES...3 3. DEFINITION DES PRESTATIONS
Hôpital performant et soins de qualité. La rencontre des extrêmes estelle
 Hôpital performant et soins de qualité. La rencontre des extrêmes estelle possible? 18 octobre 2012 Professeur Philippe KOLH CIO, Directeur du Service des Informations Médico-Economiques CHU de LIEGE Plan
Hôpital performant et soins de qualité. La rencontre des extrêmes estelle possible? 18 octobre 2012 Professeur Philippe KOLH CIO, Directeur du Service des Informations Médico-Economiques CHU de LIEGE Plan
Rapport d'audit interne du processus RESSOURCES MATERIELLES NANCY
 Rapport d'audit interne du processus RESSOURCES MATERIELLES Date de l'audit : 23/03/2010 - Processus audité(s) : Système management qualité Site audité : Nancy Référentiel(s) : ISO 9001 : 2008 Équipe d'audit
Rapport d'audit interne du processus RESSOURCES MATERIELLES Date de l'audit : 23/03/2010 - Processus audité(s) : Système management qualité Site audité : Nancy Référentiel(s) : ISO 9001 : 2008 Équipe d'audit
Medi test. Laboratoires d analyses médicales. Manuel Qualité. www.meditest.ch
 Système Qualité Management Manuel qualité ID 1096 4.01-4.02 Organisation et management / Manuel et programme qualité Responsable : Cristina Cellerai Version 2 du 12/03/2014 Medi test Laboratoires d analyses
Système Qualité Management Manuel qualité ID 1096 4.01-4.02 Organisation et management / Manuel et programme qualité Responsable : Cristina Cellerai Version 2 du 12/03/2014 Medi test Laboratoires d analyses
Commission Médicale de la FFVoile Règles de Fonctionnement Texte adopté par le BE du 09 mars 2007
 Commission Médicale de la FFVoile Règles de Fonctionnement Texte adopté par le BE du 09 mars 2007 PREAMBULE L article L. 231-5 du code du sport rappelle que les fédérations sportives veillent à la santé
Commission Médicale de la FFVoile Règles de Fonctionnement Texte adopté par le BE du 09 mars 2007 PREAMBULE L article L. 231-5 du code du sport rappelle que les fédérations sportives veillent à la santé
Fiche méthodologique Rédiger un cahier des charges
 Fiche méthodologique Rédiger un cahier des charges Plan de la fiche : 1 : Présentation de la fiche 2 : Introduction : les grands principes 3 : Contenu, 1 : positionnement et objectifs du projet 4 : Contenu,
Fiche méthodologique Rédiger un cahier des charges Plan de la fiche : 1 : Présentation de la fiche 2 : Introduction : les grands principes 3 : Contenu, 1 : positionnement et objectifs du projet 4 : Contenu,
RÉFÉRENTIEL DE CERTIFICATION
 BEP métiers des services administratifs ANNEXE I b RÉFÉRENTIEL DE CERTIFICATION ACTIVITÉS ADMINISTRATIVES À CARACTÈRE TECHNIQUE Connaissances communes aux activités administratives à caractère technique
BEP métiers des services administratifs ANNEXE I b RÉFÉRENTIEL DE CERTIFICATION ACTIVITÉS ADMINISTRATIVES À CARACTÈRE TECHNIQUE Connaissances communes aux activités administratives à caractère technique
SERVICES TECHNIQUES CENTRE HOSPITALIER. d AURILLAC. 1er congrès de l AFGRIS
 SERVICES TECHNIQUES CENTRE HOSPITALIER henri MONDOR d AURILLAC 1er congrès de l AFGRIS METHODE D ANALYSE ET DE PREVENTION DES RISQUES ET CERTIFICATION ISO 9002 Un couple pertinent pour les services techniques
SERVICES TECHNIQUES CENTRE HOSPITALIER henri MONDOR d AURILLAC 1er congrès de l AFGRIS METHODE D ANALYSE ET DE PREVENTION DES RISQUES ET CERTIFICATION ISO 9002 Un couple pertinent pour les services techniques
Programme Hôpital numérique
 Programme Hôpital numérique Boite à outils pour l atteinte des pré-requis Fiches pratiques Octobre 2012 Direction générale de l offre de soins Sommaire 1. LE PROGRAMME HOPITAL NUMERIQUE... 3 2. LE SOCLE
Programme Hôpital numérique Boite à outils pour l atteinte des pré-requis Fiches pratiques Octobre 2012 Direction générale de l offre de soins Sommaire 1. LE PROGRAMME HOPITAL NUMERIQUE... 3 2. LE SOCLE
REFERENTIEL DE CERTIFICATION
 REFERENTIEL DE CERTIFICATION DU TITRE PROFESSIONNEL Technicien(ne) d'assistance en Informatique Niveau IV Site : http://www.emploi.gouv.fr REFERENTIEL DE CERTIFICATION D'UNE SPECIALITE DU TITRE PROFESSIONNEL
REFERENTIEL DE CERTIFICATION DU TITRE PROFESSIONNEL Technicien(ne) d'assistance en Informatique Niveau IV Site : http://www.emploi.gouv.fr REFERENTIEL DE CERTIFICATION D'UNE SPECIALITE DU TITRE PROFESSIONNEL
Tremplins de la Qualité. Tome 2
 Tome 2 CET OUVRAGE EST UN GUIDE D INTERPRETATION DE LA NORME NF EN ISO 9001 VERSION 2000 AVANTPROPOS Ce guide d aide à la rédaction du Manuel de Management de la Qualité a été rédigé par la Fédération
Tome 2 CET OUVRAGE EST UN GUIDE D INTERPRETATION DE LA NORME NF EN ISO 9001 VERSION 2000 AVANTPROPOS Ce guide d aide à la rédaction du Manuel de Management de la Qualité a été rédigé par la Fédération
REFERENTIEL DE CERTIFICATION
 REFERENTIEL DE CERTIFICATION Référentiel I4 NF 285 Edition : Janvier 2015 N de révision : 4 ORGANISMES CERTIFICATEURS CNPP Cert. Route de la Chapelle Réanville CD 64 - CS 22265 F- 27950 SAINT-MARCEL Tél.
REFERENTIEL DE CERTIFICATION Référentiel I4 NF 285 Edition : Janvier 2015 N de révision : 4 ORGANISMES CERTIFICATEURS CNPP Cert. Route de la Chapelle Réanville CD 64 - CS 22265 F- 27950 SAINT-MARCEL Tél.
RAPPORT DE CERTIFICATION V2010 CRF DE SAINT BLANCARD
 RAPPORT DE CERTIFICATION V2010 CRF DE SAINT BLANCARD - 32140 - Saint Blancard JUILLET 2012 SOMMAIRE PREAMBULE 4 1. Les objectifs de la certification des établissements de santé 5 2. Les niveaux de certification
RAPPORT DE CERTIFICATION V2010 CRF DE SAINT BLANCARD - 32140 - Saint Blancard JUILLET 2012 SOMMAIRE PREAMBULE 4 1. Les objectifs de la certification des établissements de santé 5 2. Les niveaux de certification
Accueil et Formations du personnel recruté en Stérilisation Centrale. Présenté par Dany GAUDELET et le Dr. Julien MOLINA
 Accueil et Formations du personnel recruté en Stérilisation Centrale Présenté par Dany GAUDELET et le Dr. Julien MOLINA PLAN Introduction Réglementation Circuit du personnel Procédure de Formation Accueil
Accueil et Formations du personnel recruté en Stérilisation Centrale Présenté par Dany GAUDELET et le Dr. Julien MOLINA PLAN Introduction Réglementation Circuit du personnel Procédure de Formation Accueil
Classification : Non sensible public 2 / 22
 Le Ministère de la Santé, via son programme «Hôpital numérique», soutient l amélioration de la qualité de service et de la performance des établissements de santé par le développement et la promotion du
Le Ministère de la Santé, via son programme «Hôpital numérique», soutient l amélioration de la qualité de service et de la performance des établissements de santé par le développement et la promotion du
Charte informatique. Ce document n est qu un exemple. Il doit être adapté à chaque entreprise selon ses moyens et ses nécessités.
 Charte informatique Ce document n est qu un exemple. Il doit être adapté à chaque entreprise selon ses moyens et ses nécessités. Préambule L'entreprise < NOM > met en œuvre un système d'information et
Charte informatique Ce document n est qu un exemple. Il doit être adapté à chaque entreprise selon ses moyens et ses nécessités. Préambule L'entreprise < NOM > met en œuvre un système d'information et
Politique de gestion documentaire
 Politique de gestion documentaire Responsabilité de gestion : Secrétariat général Date d approbation : 24 avril 1979 C.A. C.E. Direction générale Direction Date d'entrée en vigueur : 24 avril 1995 Date
Politique de gestion documentaire Responsabilité de gestion : Secrétariat général Date d approbation : 24 avril 1979 C.A. C.E. Direction générale Direction Date d'entrée en vigueur : 24 avril 1995 Date
Qualité et gestion des risques
 formation 2007 Qualité et gestion des risques Qualité et certification HAS Démarche qualité Qualité et certification ISO Qualité en imagerie Qualité au laboratoire Management des risques Risques spécifiques
formation 2007 Qualité et gestion des risques Qualité et certification HAS Démarche qualité Qualité et certification ISO Qualité en imagerie Qualité au laboratoire Management des risques Risques spécifiques
Auteur : Françoise NICOLAS, Responsable Qualité. Approuvé par : Michel ROUVELLAT, Président. Dernière date de mise à jour : 01 avril 2015
 Manuel Qualité Auteur : Françoise NICOLAS, Responsable Qualité Approuvé par : Michel ROUVELLAT, Président Dernière date de mise à jour : 01 avril 2015 CIS Valley Manuel Qualité- MAQ_V08 page 1/16 Engagement
Manuel Qualité Auteur : Françoise NICOLAS, Responsable Qualité Approuvé par : Michel ROUVELLAT, Président Dernière date de mise à jour : 01 avril 2015 CIS Valley Manuel Qualité- MAQ_V08 page 1/16 Engagement
La démarche qualité. Un nouveau mode de management pour l hôpital
 La démarche qualité Un nouveau mode de management pour l hôpital Quelques définitions La qualité selon la norme ISO La qualité selon la définition de l'oms L'assurance qualité selon la norme ISO Le management
La démarche qualité Un nouveau mode de management pour l hôpital Quelques définitions La qualité selon la norme ISO La qualité selon la définition de l'oms L'assurance qualité selon la norme ISO Le management
Règles de certification
 N d identification : NF212 N de révision : 7.3 Mise à jour : 04/02/2015 Et addendum n 1 du 04/02/2015 Date de mise en application : 04/02/2015 Règles de certification SERVICES DE DEPANNAGE/REMORQUAGE DE
N d identification : NF212 N de révision : 7.3 Mise à jour : 04/02/2015 Et addendum n 1 du 04/02/2015 Date de mise en application : 04/02/2015 Règles de certification SERVICES DE DEPANNAGE/REMORQUAGE DE
Introduction à l ISO/IEC 17025:2005
 Introduction à l ISO/IEC 17025:2005 Relation avec d autres normes de Management de la Qualité Formation Assurance Qualité LNCM, Rabat 27-29 Novembre 2007 Marta Miquel, EDQM-CoE 1 Histoire de l ISO/IEC
Introduction à l ISO/IEC 17025:2005 Relation avec d autres normes de Management de la Qualité Formation Assurance Qualité LNCM, Rabat 27-29 Novembre 2007 Marta Miquel, EDQM-CoE 1 Histoire de l ISO/IEC
SECTION II RELATIVE AU PRÉLEVEUR
 SECTION II RELATIVE AU PRÉLEVEUR II-0 INDEX SECTION II Pages Section relative au préleveur Heures d ouvertures des laboratoires pour clients externes Requête régionale II-2 II-2 II-3 Informations requises
SECTION II RELATIVE AU PRÉLEVEUR II-0 INDEX SECTION II Pages Section relative au préleveur Heures d ouvertures des laboratoires pour clients externes Requête régionale II-2 II-2 II-3 Informations requises
Édition : La Direction des communications du ministère de la Santé et des Services sociaux
 Planification, performance et qualité Guide d élaboration des cadres de gestion des banques de données et de matériel biologique constituées à des fins de recherche Unité de l Éthique Octobre 2012 Rédaction
Planification, performance et qualité Guide d élaboration des cadres de gestion des banques de données et de matériel biologique constituées à des fins de recherche Unité de l Éthique Octobre 2012 Rédaction
PREAMBULE. Baccalauréat professionnel spécialité Environnement nucléaire 5
 PREAMBULE Le candidat au baccalauréat professionnel environnement nucléaire doit préalablement à son entrée en formation être informé des conditions suivantes : 1)Afin d éviter le risque d exclusion pour
PREAMBULE Le candidat au baccalauréat professionnel environnement nucléaire doit préalablement à son entrée en formation être informé des conditions suivantes : 1)Afin d éviter le risque d exclusion pour
Administration canadienne de la sûreté du transport aérien
 Administration canadienne de la sûreté du transport aérien Norme relative au système de gestion des fournisseurs de services de contrôle de l ACSTA Octobre 2009 La présente norme est assujettie aux demandes
Administration canadienne de la sûreté du transport aérien Norme relative au système de gestion des fournisseurs de services de contrôle de l ACSTA Octobre 2009 La présente norme est assujettie aux demandes
BTS Assistant de manager(s) LES FINALITES PROFESSIONNELLES
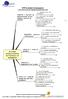 BTS Assistant de manager(s) LES FINALITES PROFESSIONNELLES 1 FINALITÉ 1 Soutien à la communication et aux relations internes et externes L assistant facilite la communication à tous les niveaux (interpersonnel,
BTS Assistant de manager(s) LES FINALITES PROFESSIONNELLES 1 FINALITÉ 1 Soutien à la communication et aux relations internes et externes L assistant facilite la communication à tous les niveaux (interpersonnel,
AUDIT 2009 des UCPC de Lorraine
 AUDIT 2009 des UCPC de Lorraine Nom de l'établissement Date Nombre de préparations / an : Date d'installation: Personnes présentes Nom / Prénom Fonction Signature Réseau Oncolor 2010 1 SOMMAIRE Page I
AUDIT 2009 des UCPC de Lorraine Nom de l'établissement Date Nombre de préparations / an : Date d'installation: Personnes présentes Nom / Prénom Fonction Signature Réseau Oncolor 2010 1 SOMMAIRE Page I
Organiser une permanence d accès aux soins de santé PASS
 Établissements de santé Droits et accueil des usagers Organiser une permanence d accès aux soins de santé PASS Recommandations et indicateurs Préface Faire face aux inégalités de santé qui touchent tout
Établissements de santé Droits et accueil des usagers Organiser une permanence d accès aux soins de santé PASS Recommandations et indicateurs Préface Faire face aux inégalités de santé qui touchent tout
Système d Information Hospitalier L expérience du Centre Hospitalier Ibn Sina (CHIS)
 Séminaire SIM 07 FMP de Fès, le 02 juin 2007 Système d Information Hospitalier L expérience du Centre Hospitalier Ibn Sina (CHIS) Auteurs : Mme Drissia ELACHEJAI Ingénieur en chef Centre Hospitalier Ibn
Séminaire SIM 07 FMP de Fès, le 02 juin 2007 Système d Information Hospitalier L expérience du Centre Hospitalier Ibn Sina (CHIS) Auteurs : Mme Drissia ELACHEJAI Ingénieur en chef Centre Hospitalier Ibn
MANAGEMENT PAR LA QUALITE ET TIC
 Garantir une organisation performante pour satisfaire ses clients et ses partenaires, telle est la finalité d une certification «qualité». On dénombre de nombreux référentiels dont le plus connu et le
Garantir une organisation performante pour satisfaire ses clients et ses partenaires, telle est la finalité d une certification «qualité». On dénombre de nombreux référentiels dont le plus connu et le
PROFIL DE POSTE DU CONDUCTEUR AMBULANCIER SMUR :
 PROFIL DE POSTE DU CONDUCTEUR AMBULANCIER SMUR : IDENTIFICATION DU POSTE : Titre de la fonction : Conducteur Ambulancier SMUR*. Etablissement : Centre Hospitalier Régional Universitaire de Brest. Service
PROFIL DE POSTE DU CONDUCTEUR AMBULANCIER SMUR : IDENTIFICATION DU POSTE : Titre de la fonction : Conducteur Ambulancier SMUR*. Etablissement : Centre Hospitalier Régional Universitaire de Brest. Service
SEP 2B juin 20. Guide méthodologique de calcul du coût d une prestation
 SEP 2B juin 20 12 Guide méthodologique de calcul du coût d une Sommaire Préambule 3 Objectif et démarche 3 1 Les objectifs de la connaissance des coûts 4 2 Définir et identifier une 5 Calculer le coût
SEP 2B juin 20 12 Guide méthodologique de calcul du coût d une Sommaire Préambule 3 Objectif et démarche 3 1 Les objectifs de la connaissance des coûts 4 2 Définir et identifier une 5 Calculer le coût
REFERENTIEL DU CQPM. TITRE DU CQPM : Electricien maintenancier process 1 OBJECTIF PROFESSIONNEL DU CQPM
 COMMISION PARITAIRE NATIONALE DE L EMPLOI DE LE METALLURGIE Qualification : Catégorie : B Dernière modification : 10/04/2008 REFERENTIEL DU CQPM TITRE DU CQPM : Electricien maintenancier process 1 I OBJECTIF
COMMISION PARITAIRE NATIONALE DE L EMPLOI DE LE METALLURGIE Qualification : Catégorie : B Dernière modification : 10/04/2008 REFERENTIEL DU CQPM TITRE DU CQPM : Electricien maintenancier process 1 I OBJECTIF
MANAGEMENT PAR LA QUALITE ET TIC
 MANAGEMENT PAR LA QUALITE ET TIC Lorraine Garantir une organisation performante pour satisfaire ses clients et ses partenaires, telle est la finalité d une certification «qualité». On dénombre de nombreux
MANAGEMENT PAR LA QUALITE ET TIC Lorraine Garantir une organisation performante pour satisfaire ses clients et ses partenaires, telle est la finalité d une certification «qualité». On dénombre de nombreux
Hébergement TNT OM Important
 O F F R E D E R E F E R E N C E 2 0 1 4 Hébergement TNT OM Important ANNEXE H7 REGLES D ACCES AUX SITES GERES PAR TDF Version 2014_1 du 09 janvier 2015 * Imaginer des solutions pour un monde numérique
O F F R E D E R E F E R E N C E 2 0 1 4 Hébergement TNT OM Important ANNEXE H7 REGLES D ACCES AUX SITES GERES PAR TDF Version 2014_1 du 09 janvier 2015 * Imaginer des solutions pour un monde numérique
Manuel Qualité. Satisfaire durablement et efficacement nos clients
 Q Manuel Qualité Satisfaire durablement et efficacement nos clients Politique Qualité Acteur reconnu de la sécurité des personnes et des biens et de la protection de l environnement, Apave a la volonté
Q Manuel Qualité Satisfaire durablement et efficacement nos clients Politique Qualité Acteur reconnu de la sécurité des personnes et des biens et de la protection de l environnement, Apave a la volonté
Article 1 er. Code de la santé publique Texte précédent. Nouveau texte. 28/11/2012 Evelyne Pierron Consultants. Article R5121-25
 Tableau comparatif Décret n 2012-1244 du 8 novembre 2012 relatif au renforcement des dispositions en matière de sécurité des médicaments à usage humain soumis à autorisation de mise sur le marché et à
Tableau comparatif Décret n 2012-1244 du 8 novembre 2012 relatif au renforcement des dispositions en matière de sécurité des médicaments à usage humain soumis à autorisation de mise sur le marché et à
Rôle de l Assurance Qualité dans la recherche clinique
 Rôle de l Assurance Qualité dans la recherche clinique Pôle Qualité / Gestion des Risques 05 Janvier 2012 Plan La qualité d une recherche c est quoi? Bonnes Pratiques Cliniques (BPC) Responsabilités des
Rôle de l Assurance Qualité dans la recherche clinique Pôle Qualité / Gestion des Risques 05 Janvier 2012 Plan La qualité d une recherche c est quoi? Bonnes Pratiques Cliniques (BPC) Responsabilités des
Formation «Système de gestion des documents d activité (SGDA)»
 Formation «Système de gestion des documents d activité (SGDA)» **** Norme principale : - ISO 3030X : Système de gestion des documents d activité (SGDA) ; Normes Connexes : - ISO 15489 : Records Management
Formation «Système de gestion des documents d activité (SGDA)» **** Norme principale : - ISO 3030X : Système de gestion des documents d activité (SGDA) ; Normes Connexes : - ISO 15489 : Records Management
Unité de Recherche Clinique St Louis - Lariboisière Fernand Widal Le 03 Février 2012
 Visite de pré-sélection Visite de Mise en place Murielle COURREGES-VIAUD, ARC Laurence GUERY, ARC responsable Assurance Qualité Véronique JOUIS, Coordinatrice des ARCs Responsable Logistique Unité de Recherche
Visite de pré-sélection Visite de Mise en place Murielle COURREGES-VIAUD, ARC Laurence GUERY, ARC responsable Assurance Qualité Véronique JOUIS, Coordinatrice des ARCs Responsable Logistique Unité de Recherche
LE DIRECTEUR GENERAL DE LA SANTE LE DIRECTEUR DE L'HOSPITALISATION ET DE L'ORGANISATION DES SOINS
 MINISTERE DE LA SANTE, DE LA FAMILLE ET DES PERSONNES HANDICAPEES Direction générale Paris, de la santé Sous direction de la politique des produits de santé (SD3) Sous direction de la qualité du système
MINISTERE DE LA SANTE, DE LA FAMILLE ET DES PERSONNES HANDICAPEES Direction générale Paris, de la santé Sous direction de la politique des produits de santé (SD3) Sous direction de la qualité du système
LE CONTRÔLE INTERNE GUIDE DE PROCÉDURES
 LE CONTRÔLE INTERNE GUIDE DE PROCÉDURES Direction du développement des entreprises Préparé par Jacques Villeneuve, c.a. Conseiller en gestion Publié par la Direction des communications : janvier 1995 Réédité
LE CONTRÔLE INTERNE GUIDE DE PROCÉDURES Direction du développement des entreprises Préparé par Jacques Villeneuve, c.a. Conseiller en gestion Publié par la Direction des communications : janvier 1995 Réédité
COMPTE-RENDU D ACCREDITATION DE LA CLINIQUE LA LIRONDE. Saint-Clément-de-Rivière 34980 Saint-Gély-du-Fesc
 COMPTE-RENDU D ACCREDITATION DE LA CLINIQUE LA LIRONDE Saint-Clément-de-Rivière 34980 Saint-Gély-du-Fesc Avril 2003 SOMMAIRE COMMENT LIRE LE «COMPTE-RENDU D ACCREDITATION»... p.3 PARTIE 1 PRESENTATION
COMPTE-RENDU D ACCREDITATION DE LA CLINIQUE LA LIRONDE Saint-Clément-de-Rivière 34980 Saint-Gély-du-Fesc Avril 2003 SOMMAIRE COMMENT LIRE LE «COMPTE-RENDU D ACCREDITATION»... p.3 PARTIE 1 PRESENTATION
