Progression annuelle du programme de chimie
|
|
|
- Aimé Bilodeau
- il y a 7 ans
- Total affichages :
Transcription
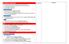
1 Collège de LA SAGESSE Section Saint Jean Brasilia - BAABDA Département de chimie Année scolaire : Classe : 1 ère S (A-B) double Bac Progression annuelle du programme de chimie Dates/ nombre de periodes Chapitres Compétences attendues Séquence Exercices TP/ Activités 19 Sept-23 Sept Rappel 1- Utiliser la mole dans le traitement des aspects quantitatifs. 2- Calculer les concentrations massique et molaire d une espèce en solution. 3- Préparer des solutions aqueuses par dissolution d un soluté solide. - La mole - Concentration molaire et massique Fiche 1 (Exercices Les solutions) Préparation d une solution mère et dilution 26 Sept-30 Sept Rappel 4- Préparer des solutions aqueuses par dilution. 5- Préparer des solutions aqueuses par dilution. - Préparation de solutions et dilution. Fiche 1 (Exercices Les solutions) Préparation d une solution mère et dilution 3 Oct-7 Oct Rappel 6- Calculer la concentration d une solution commerciale. 7- Chiffres significatifs. - Masse volumique et densité. Fiche 1 (Exercices Les solutions) Préparation d une solution mère et dilution 10 Oct-14 Oct Couleurs des objets 1- Interpréter la couleur obsrvée d un objet éclairé. - Synthèse additive - Synthèse soustractive Fiche 2 (Exercices 1
2 17 Oct-21 Oct Molécules organiques de la matière colorée 2- Notions de couleur blanche et couleur complémentaires. 3- Résultat de la superposition de lumières colorées et l effet d un ou de plusieurs filtres colorés sur une lumière incidente. 1- Savoir que les molécules de la chimie organiques sont constituées principalement des éléments C et H. 2- Reconnaitre si deux doubles liaisons sont en position conjuguée dans une chaîne carbonée. - Pigments et colorants. -Molécules organiques. - Différentes formules représentant une molécule organique : brute, développée, semi-développée, topologique couleurs des objets) Fiche 2 (Exercices Molécules coloréesformules topologiques) 24 Oct-28 Oct Molécules organiques de la matière colorée 3- Établir un lien entre la structure moléculaire et le caractère coloré ou non coloré d une molécule. -Molécules à doubles liaisons conjuguées. -Facteurs pouvant influencer la couleur d un matériau Exercices livre p. 101 n p.104 n Oct-4 Nov Molécules organiques de la matière colorée 4- Pratiquer une démarche expérimentale mettant en œuvre une chromatographie. - Chromatographie sur couche mince: CCM Exercices livre p.101 n.14 + p. 104 n Extraction et chromatographie sur papier de pigments foliaires: CCM 7 Nov-11 Nov Avancement d une réaction chimique 1- Identifier le réactif limitant. 2- Décrire quantitativement l état final d un système chimique. - Définition d une transformation Chimique. - Évolution d un Identification du réactif limitant, livre p. 128 (Activité 2
3 14 Nov-18 Nov Avancement d une réaction chimique 3- Interpréter en fonction des conditions initiales la couleur à l état final d une solution siège d une réaction chimique mettant en jeu un réactif ou un produit coloré. système chimique. - Équation-bilan d une réaction. - Définition de l avancement x et de l avancement final x max. - Tableau d avancement d une réaction. - Identification d un réactif limitant. - Description d un système à l état final. Fiche 3 (Exercices Etablir un tableau d avancement- Recherche du réactif limitant- Décrire le système final d une réaction chimique) + Exercices livre p. 135 n expérimentale: Laboratoire) Extraction et chromatographie sur papier de pigments foliaires: CCM 21 Nov-25 Nov Avancement d une réaction chimique - Cas général Exercices livre p. 135 n Nov-2 Déc 5 Déc-9 Déc Avancement d une réaction chimique Avancement d une réaction chimique Exercices livre p. 137 n p. 138 n. 31 Exercices livre - p. 139 n. 32- p. 140 n. 33- p. 141 n. 34 Extraction et chromatographie sur papier de pigments foliaires: CCM Etude d une transformation chimique 12 Déc-16 Les solutions 1- Interpréter la couleur d un mélange obtenu à partir de - Couleur d une solution. Utiliser un spectrophotomètre, 3
4 Déc colorées matières colorées. - Définition de l absorbance. livre p. 111 (Activité expérimentale: Laboratoire) + : Etude d une transformation chimique 19 Déc-23 Déc Les solutions colorées 2- Pratiquer une démarche expérimentale pour déterminer la concentration d une espèce colorée à partir d une courbe d étalonnage en utilisant la loi de Beer-Lambert - Le spectrophotomètre. - Spectre d absorption d une solution Fiche 3 (Exercices Détermination de la concentration d une solution colorée) Exercices livre p. 117 n réaliser un dosage spectrophotométrique (Activité expérimentale: Laboratoire) + Etude d une transformation chimique 9 Janv-13 Janv Les solutions colorées - Facteurs influençant l absorbance et loi de Beer-Lambert. - spectrophotométrique par étalonnage. Exercices livre p. 118 n. 18- p. 119 n. 19 p. 120 n p.121 n.27 spectrophotométrique par étalonnage 16 Janv-18 Janv. (2P) Les solutions colorées p.122 n spectrophotométrique par étalonnage 4
5 23 Janv- 27 Janv Examens 30 Janv 3 Fév Oxydoréduction 1- Reconnaitre l oxydant et le réducteur dans un couple - TP : d une solution coloree(spectro) - -Réactions d oxydoréduction : oxydant, réducteur, oxydation, réduction, réaction redox -Réaliser des réactions redox mettant en jeu un transfert direct d électrons. (Activité expérimentale au Labo): Observation, et interprétation + spectrophotométrique par étalonnage 6 Fév- 10 Fév 13 Fév- 17 Oxydoréduction Oxydoréduction 2- Écrire l équation d une réaction d oxydoréduction en utilisant les demiéquations redox -Modèle par transfert direct d électrons : Expérience, observation, interprétation, demiéquations électroniques et équation de la réaction d oxydoréduction, couple oxydant/ réducteur - classification électrochimique Fiche 4 (Exercices Réactions d oxydoréduction) Fiche 4 (Exercices Extracrion du diiode Extracrion du diiode 5
6 Fév et potentiels redox Réactions d oxydoréduction) 20 Fév- 24 Fév Pile électrochimique 1- Pratiquer une démarche expérimentale pour réaliser une pile et modéliser son fonctionnement. -Modèle par transfert indirect d électrons (les piles): schéma d une pile Daniell, demiéquations anodique et cathodique et équation- bilan, rôle du pont salin, sens des porteurs de charge dans chaque partie de la pile -Réaliser une pile et modéliser son fonctionnement (Activité expérimentale au Labo) + Extracrion du diiode 27 Fév- 3 Mar Pile électrochimique 2- Relier la polarité de la pile aux réactions mises en jeu aux électrodes. - Représentation symbolique d une pile. - f.é.m, quantité d électricité Fiche 5 (Exercices Pile électrochimique) Extracrion d un acide gras 6 Mar- 10 Mar Pile électrochimique - E.S.H. - Différentes piles Fiche 5 (Exercices Pile électrochimique) Extracrion d un acide gras 13 Mar- 17 Mar Équilibrage des réactions d oxydoréduction 1- Équilibrer des réactions d oxydoréduction en milieu acide. 2- Équilibrer des réactions d oxydoréduction en milieu - Équilibrage des réactions d oxydoréduction en milieu acide par la méthode des deux Applications sur le cahier Extracrion d un acide gras 6
7 20 Mar- 24 Mar Titrage volumétrique par réaction redox basique. 1- Expliquer le principe du dosage. 2- Réaliser et schématiser un montage de dosage d un dosage volumétrique. 3- Decrire le mode opératoire d un dosage volumétrique par réaction redox. demi-équations - Équilibrage des réactions d oxydoréduction en milieu basique par la méthode des deux demiéquations - volumétrique redox : but, principe, réaction de dosage, caractéristiques d une réaction de dosage, schéma du montage expérimental, détermination de la concentration inconnue. Réaliser un dosage volumétrique redox (Activité expérimentale au Labo) 27 Mar- 31 Mar Titrage volumétrique par réaction redox 4- Écrire l équation-bilan d une réaction de dosage et citer ses caractéristiques. 5-Déterminer la concentration de la solution à doser. Fiche 6 (Exercices volumétrique redox) volumétrique redox d une eau oxygénée 3 Avr- 7 Avr Chimie organique 1- Reconnaître une chaîne carbonée linéaire, ramifiée ou cyclique. 2- Donner les formules semidéveloppées correspondant à une formule brute donnée dans le cas des molécules simples. - Composé organique et composé Inorganique - Chaîne carbonée linéaire, ramifiée, cyclique - Formule brute, volumétrique redox d une eau oxygénée 7
8 10 Avr- 12 Avr 17 Avr- 21 Avr Chimie organique Congé 3- Donner le nom systématique d un composé organique. 4- Distinguer quelques familles particulières : Alcanes, alcènes, alcynes, alcools, aldéhydes, cétones, acides carboxyliques. 5- Identifier un groupe fonctionnel. 6- Écrire une équation de combustion. développée, semidéveloppée. - Isomères et types d isomérie. - Réactions de combustion. - Réactions de substitution des alcanes. -Réactions d addition des alcènes. Quelques familles (alcanes, alcènes, alcynes, alcools, aldéhydes, cétones, acides carboxyliques): Groupe fonctionnel, formule générale, nomenclature Fiche 7 (exercices Chimie organique) volumétrique redox d une eau oxygénée 24 Avr- 28 Avr Chimie organique 7- Écrire l équation de la réaction de substitution des alcanes. 8- Écrire l équation de la réaction d addition des alcènes. 9- Identifier le type d isomérie. - Classes des alcools. - Réaction d oxydation d un alcool et d un aldéhyde. - Analyse élémentaire qualitative et quantitative. Fiche 7 (exercices Chimie organique) Synthèse de l aspirine 8
9 1 Mai- 5 Mai Chimie organique 10- Distinguer les classes des alcools. 11- Ecrire l équation de la réaction d oxydation d un alcool et d un aldéhyde. Fiche 7 (exercices Chimie organique) Synthèse de l aspirine 8 Mai- 10 Mai 15 Mai- 19 Mai Chimie organique Examens de fin d année 12- Appliquer les notions d analyses élémentaires qualitative et quantitative. Fiche 7 (exercices Chimie organique) Synthèse de l aspirine 9
10 10/3
EXERCICE II. SYNTHÈSE D UN ANESTHÉSIQUE : LA BENZOCAÏNE (9 points)
 Bac S 2015 Antilles Guyane http://labolycee.org EXERCICE II. SYNTHÈSE D UN ANESTHÉSIQUE : LA BENZOCAÏNE (9 points) La benzocaïne (4-aminobenzoate d éthyle) est utilisée en médecine comme anesthésique local
Bac S 2015 Antilles Guyane http://labolycee.org EXERCICE II. SYNTHÈSE D UN ANESTHÉSIQUE : LA BENZOCAÏNE (9 points) La benzocaïne (4-aminobenzoate d éthyle) est utilisée en médecine comme anesthésique local
ANALYSE SPECTRALE. monochromateur
 ht ANALYSE SPECTRALE Une espèce chimique est susceptible d interagir avec un rayonnement électromagnétique. L étude de l intensité du rayonnement (absorbé ou réémis) en fonction des longueurs d ode s appelle
ht ANALYSE SPECTRALE Une espèce chimique est susceptible d interagir avec un rayonnement électromagnétique. L étude de l intensité du rayonnement (absorbé ou réémis) en fonction des longueurs d ode s appelle
TP : Suivi d'une réaction par spectrophotométrie
 Nom : Prénom: n groupe: TP : Suivi d'une réaction par spectrophotométrie Consignes de sécurité de base: Porter une blouse en coton, pas de nu-pieds Porter des lunettes, des gants (en fonction des espèces
Nom : Prénom: n groupe: TP : Suivi d'une réaction par spectrophotométrie Consignes de sécurité de base: Porter une blouse en coton, pas de nu-pieds Porter des lunettes, des gants (en fonction des espèces
EXERCICE 2 : SUIVI CINETIQUE D UNE TRANSFORMATION PAR SPECTROPHOTOMETRIE (6 points)
 BAC S 2011 LIBAN http://labolycee.org EXERCICE 2 : SUIVI CINETIQUE D UNE TRANSFORMATION PAR SPECTROPHOTOMETRIE (6 points) Les parties A et B sont indépendantes. A : Étude du fonctionnement d un spectrophotomètre
BAC S 2011 LIBAN http://labolycee.org EXERCICE 2 : SUIVI CINETIQUE D UNE TRANSFORMATION PAR SPECTROPHOTOMETRIE (6 points) Les parties A et B sont indépendantes. A : Étude du fonctionnement d un spectrophotomètre
Le centre sera fermé du 20 au 31 juillet 2015
 Calendrier officiel des 2015-2016 Date des 2 premières Cours de jour : Mercredi 26 août 2015 Mardi 8 septembre 2015 du 1 e juin au 8 juillet ET du 3 au 5 août 2015 Cours de soir : Inscriptions les lundis
Calendrier officiel des 2015-2016 Date des 2 premières Cours de jour : Mercredi 26 août 2015 Mardi 8 septembre 2015 du 1 e juin au 8 juillet ET du 3 au 5 août 2015 Cours de soir : Inscriptions les lundis
SUIVI CINETIQUE PAR SPECTROPHOTOMETRIE (CORRECTION)
 Terminale S CHIMIE TP n 2b (correction) 1 SUIVI CINETIQUE PAR SPECTROPHOTOMETRIE (CORRECTION) Objectifs : Déterminer l évolution de la vitesse de réaction par une méthode physique. Relier l absorbance
Terminale S CHIMIE TP n 2b (correction) 1 SUIVI CINETIQUE PAR SPECTROPHOTOMETRIE (CORRECTION) Objectifs : Déterminer l évolution de la vitesse de réaction par une méthode physique. Relier l absorbance
LABORATOIRES DE CHIMIE Techniques de dosage
 LABORATOIRES DE CHIMIE Techniques de dosage Un dosage (ou titrage) a pour but de déterminer la concentration molaire d une espèce (molécule ou ion) en solution (généralement aqueuse). Un réactif de concentration
LABORATOIRES DE CHIMIE Techniques de dosage Un dosage (ou titrage) a pour but de déterminer la concentration molaire d une espèce (molécule ou ion) en solution (généralement aqueuse). Un réactif de concentration
Une nouvelle technique d'analyse : La spectrophotométrie
 Une nouvelle technique d'analyse : La spectrophotométrie Par spectrophotométrie on peut : - déterminer la concentration d'une espèce chimique colorée en solution à partir de l'absorbance. - suivre la cinétique
Une nouvelle technique d'analyse : La spectrophotométrie Par spectrophotométrie on peut : - déterminer la concentration d'une espèce chimique colorée en solution à partir de l'absorbance. - suivre la cinétique
Exemple de cahier de laboratoire : cas du sujet 2014
 Exemple de cahier de laboratoire : cas du sujet 2014 Commentaires pour l'évaluation Contenu du cahier de laboratoire Problématique : Le glucose est un nutriment particulièrement important pour le sportif.
Exemple de cahier de laboratoire : cas du sujet 2014 Commentaires pour l'évaluation Contenu du cahier de laboratoire Problématique : Le glucose est un nutriment particulièrement important pour le sportif.
Physique Chimie. Utiliser les langages scientifiques à l écrit et à l oral pour interpréter les formules chimiques
 C est Niveau la représentation 4 ème 2. Document du professeur 1/6 Physique Chimie LES ATOMES POUR COMPRENDRE LA TRANSFORMATION CHIMIQUE Programme Cette séance expérimentale illustre la partie de programme
C est Niveau la représentation 4 ème 2. Document du professeur 1/6 Physique Chimie LES ATOMES POUR COMPRENDRE LA TRANSFORMATION CHIMIQUE Programme Cette séance expérimentale illustre la partie de programme
Partie Observer : Ondes et matière CHAP 04-ACT/DOC Analyse spectrale : Spectroscopies IR et RMN
 Partie Observer : Ondes et matière CHAP 04-ACT/DOC Analyse spectrale : Spectroscopies IR et RMN Objectifs : Exploiter un spectre infrarouge pour déterminer des groupes caractéristiques Relier un spectre
Partie Observer : Ondes et matière CHAP 04-ACT/DOC Analyse spectrale : Spectroscopies IR et RMN Objectifs : Exploiter un spectre infrarouge pour déterminer des groupes caractéristiques Relier un spectre
FICHE 1 Fiche à destination des enseignants
 FICHE 1 Fiche à destination des enseignants 1S 8 (b) Un entretien d embauche autour de l eau de Dakin Type d'activité Activité expérimentale avec démarche d investigation Dans cette version, l élève est
FICHE 1 Fiche à destination des enseignants 1S 8 (b) Un entretien d embauche autour de l eau de Dakin Type d'activité Activité expérimentale avec démarche d investigation Dans cette version, l élève est
Animations. Liste des 114 animations et 145 vidéos présentes dans la Banque de Ressources Physique Chimie Lycée. Physique Chimie Seconde
 Animations Physique Chimie Seconde Extraction de l'eugénol La nature inspire les hommes Identification de principes actifs Identification d'une espèce chimique Support de l'exercice - Colorants alimentaires
Animations Physique Chimie Seconde Extraction de l'eugénol La nature inspire les hommes Identification de principes actifs Identification d'une espèce chimique Support de l'exercice - Colorants alimentaires
BACCALAURÉAT GÉNÉRAL PHYSIQUE-CHIMIE
 BAALAURÉAT GÉNÉRAL SESSIN 2015 PYSIQUE-IMIE Série S Durée de l épreuve : 3 heures 30 oefficient : 6 L usage de la calculatrice est autorisé e sujet ne nécessite pas de feuille de papier millimétré Le sujet
BAALAURÉAT GÉNÉRAL SESSIN 2015 PYSIQUE-IMIE Série S Durée de l épreuve : 3 heures 30 oefficient : 6 L usage de la calculatrice est autorisé e sujet ne nécessite pas de feuille de papier millimétré Le sujet
TRAVAUX PRATIQUESDE BIOCHIMIE L1
 TRAVAUX PRATIQUESDE BICHIMIE L1 PRINTEMPS 2011 Les acides aminés : chromatographie sur couche mince courbe de titrage Etude d une enzyme : la phosphatase alcaline QUELQUES RECMMANDATINS IMPRTANTES Le port
TRAVAUX PRATIQUESDE BICHIMIE L1 PRINTEMPS 2011 Les acides aminés : chromatographie sur couche mince courbe de titrage Etude d une enzyme : la phosphatase alcaline QUELQUES RECMMANDATINS IMPRTANTES Le port
ACIDES BASES. Chap.5 SPIESS
 ACIDES BASES «Je ne crois pas que l on me conteste que l acide n ait des pointes Il ne faut que le goûter pour tomber dans ce sentiment car il fait des picotements sur la langue.» Notion d activité et
ACIDES BASES «Je ne crois pas que l on me conteste que l acide n ait des pointes Il ne faut que le goûter pour tomber dans ce sentiment car il fait des picotements sur la langue.» Notion d activité et
- pellicule de fruits qui a un rôle de prévention contre l'évaporation, le développement de moisissures et l'infection par des parasites
 LES LIPIDES Quelles Sont les Idées Clés? Les lipides sont les huiles et les graisses de la vie courante. Ils sont insolubles dans l eau. Pour les synthétiser, une réaction : l Estérification. Pour les
LES LIPIDES Quelles Sont les Idées Clés? Les lipides sont les huiles et les graisses de la vie courante. Ils sont insolubles dans l eau. Pour les synthétiser, une réaction : l Estérification. Pour les
Enseignement secondaire
 Enseignement secondaire Classe de IIIe Chimie 3e classique F - Musique Nombre de leçons: 1.5 Nombre minimal de devoirs: 4 devoirs par an Langue véhiculaire: Français I. Objectifs généraux Le cours de chimie
Enseignement secondaire Classe de IIIe Chimie 3e classique F - Musique Nombre de leçons: 1.5 Nombre minimal de devoirs: 4 devoirs par an Langue véhiculaire: Français I. Objectifs généraux Le cours de chimie
1 ère partie : tous CAP sauf hôtellerie et alimentation CHIMIE ETRE CAPABLE DE. PROGRAMME - Atomes : structure, étude de quelques exemples.
 Référentiel CAP Sciences Physiques Page 1/9 SCIENCES PHYSIQUES CERTIFICATS D APTITUDES PROFESSIONNELLES Le référentiel de sciences donne pour les différentes parties du programme de formation la liste
Référentiel CAP Sciences Physiques Page 1/9 SCIENCES PHYSIQUES CERTIFICATS D APTITUDES PROFESSIONNELLES Le référentiel de sciences donne pour les différentes parties du programme de formation la liste
Les solutions. Chapitre 2 - Modèle. 1 Définitions sur les solutions. 2 Concentration massique d une solution. 3 Dilution d une solution
 Chapitre 2 - Modèle Les solutions 1 Définitions sur les solutions 1.1 Définition d une solution : Une solution est le mélange homogène et liquide d au moins deux espèces chimiques : Le soluté : c est une
Chapitre 2 - Modèle Les solutions 1 Définitions sur les solutions 1.1 Définition d une solution : Une solution est le mélange homogène et liquide d au moins deux espèces chimiques : Le soluté : c est une
pka D UN INDICATEUR COLORE
 TP SPETROPHOTOMETRIE Lycée F.BUISSON PTSI pka D UN INDIATEUR OLORE ) Principes de la spectrophotométrie La spectrophotométrie est une technique d analyse qualitative et quantitative, de substances absorbant
TP SPETROPHOTOMETRIE Lycée F.BUISSON PTSI pka D UN INDIATEUR OLORE ) Principes de la spectrophotométrie La spectrophotométrie est une technique d analyse qualitative et quantitative, de substances absorbant
BAC BLANC SCIENCES PHYSIQUES. Durée : 3 heures 30
 Terminales S1, S2, S3 2010 Vendredi 29 janvier BAC BLANC SCIENCES PHYSIQUES Durée : 3 heures 30 Toutes les réponses doivent être correctement rédigées et justifiées. Chaque exercice sera traité sur une
Terminales S1, S2, S3 2010 Vendredi 29 janvier BAC BLANC SCIENCES PHYSIQUES Durée : 3 heures 30 Toutes les réponses doivent être correctement rédigées et justifiées. Chaque exercice sera traité sur une
TP n 1: Initiation au laboratoire
 Centre Universitaire d El-Tarf Institut des Sciences Agronomiques 3 ème année Contrôle de Qualité en Agroalimentaire TP n 1: Initiation au laboratoire Introduction L analyse de la matière vivante au laboratoire
Centre Universitaire d El-Tarf Institut des Sciences Agronomiques 3 ème année Contrôle de Qualité en Agroalimentaire TP n 1: Initiation au laboratoire Introduction L analyse de la matière vivante au laboratoire
Nouveau programme de première S (2011) : l essentiel du cours. www.physagreg.fr
 Nouveau programme de première S (2011) : l essentiel du cours www.physagreg.fr 22 avril 2012 Table des matières 1 Couleur, vision et image 3 1.1 Oeil réel et oeil réduit...................... 3 1.2 Lentille
Nouveau programme de première S (2011) : l essentiel du cours www.physagreg.fr 22 avril 2012 Table des matières 1 Couleur, vision et image 3 1.1 Oeil réel et oeil réduit...................... 3 1.2 Lentille
PROGRAMME DE PHYSIQUE - CHIMIE EN CLASSE DE SECONDE GÉNÉRALE ET TECHNOLOGIQUE
 PROGRAMME DE PHYSIQUE - CHIMIE EN CLASSE DE SECONDE GÉNÉRALE ET TECHNOLOGIQUE Préambule Objectifs La culture scientifique et technique acquise au collège doit permettre à l élève d avoir une première représentation
PROGRAMME DE PHYSIQUE - CHIMIE EN CLASSE DE SECONDE GÉNÉRALE ET TECHNOLOGIQUE Préambule Objectifs La culture scientifique et technique acquise au collège doit permettre à l élève d avoir une première représentation
Chapitre 7 Les solutions colorées
 Chapitre 7 Les solutions colorées Manuel pages 114 à 127 Choix pédagogiques. Ce chapitre a pour objectif d illustrer les points suivants du programme : - dosage de solutions colorées par étalonnage ; -
Chapitre 7 Les solutions colorées Manuel pages 114 à 127 Choix pédagogiques. Ce chapitre a pour objectif d illustrer les points suivants du programme : - dosage de solutions colorées par étalonnage ; -
La spectrophotométrie
 Chapitre 2 Document de cours La spectrophotométrie 1 Comment interpréter la couleur d une solution? 1.1 Décomposition de la lumière blanche En 1666, Isaac Newton réalise une expérience cruciale sur la
Chapitre 2 Document de cours La spectrophotométrie 1 Comment interpréter la couleur d une solution? 1.1 Décomposition de la lumière blanche En 1666, Isaac Newton réalise une expérience cruciale sur la
2 C est quoi la chimie?
 PARTIE 1 AVANT LA CHIMIE VERTE... 2 C est quoi la chimie? L inconnu étant source d angoisse, nous allons essayer de définir les grands domaines de la chimie pour mieux la connaître, l appréhender et donc
PARTIE 1 AVANT LA CHIMIE VERTE... 2 C est quoi la chimie? L inconnu étant source d angoisse, nous allons essayer de définir les grands domaines de la chimie pour mieux la connaître, l appréhender et donc
Fiche 19 La couleur des haricots verts et cuisson
 Fiche 19 La couleur des haricots verts et cuisson Objectif : Valider ou réfuter des «précisions culinaires»* permettant de "conserver une belle couleur verte" lors la cuisson des haricots verts frais (gousses
Fiche 19 La couleur des haricots verts et cuisson Objectif : Valider ou réfuter des «précisions culinaires»* permettant de "conserver une belle couleur verte" lors la cuisson des haricots verts frais (gousses
RDP : Voir ou conduire
 1S Thème : Observer RDP : Voir ou conduire DESCRIPTIF DE SUJET DESTINE AU PROFESSEUR Objectif Compétences exigibles du B.O. Initier les élèves de première S à la démarche de résolution de problème telle
1S Thème : Observer RDP : Voir ou conduire DESCRIPTIF DE SUJET DESTINE AU PROFESSEUR Objectif Compétences exigibles du B.O. Initier les élèves de première S à la démarche de résolution de problème telle
Partie 1. Addition nucléophile suivie d élimination (A N + E) 1.1. Réactivité électrophile des acides carboxyliques et groupes dérivés
 Molécules et matériaux organiques Partie 1. Addition nucléophile suivie d élimination (A N + E) 1.1. Réactivité électrophile des acides carboxyliques et groupes dérivés bjectifs du chapitre Notions à connaître
Molécules et matériaux organiques Partie 1. Addition nucléophile suivie d élimination (A N + E) 1.1. Réactivité électrophile des acides carboxyliques et groupes dérivés bjectifs du chapitre Notions à connaître
Rappels sur les couples oxydantsréducteurs
 CHAPITRE 1 TRANSFORMATIONS LENTES ET RAPIDES 1 Rappels sur les couples oxydantsréducteurs 1. Oxydants et réducteurs Un réducteur est une espèce chimique capable de céder au moins un électron Demi-équation
CHAPITRE 1 TRANSFORMATIONS LENTES ET RAPIDES 1 Rappels sur les couples oxydantsréducteurs 1. Oxydants et réducteurs Un réducteur est une espèce chimique capable de céder au moins un électron Demi-équation
TECHNIQUES: Principes de la chromatographie
 TECHNIQUES: Principes de la chromatographie 1 Définition La chromatographie est une méthode physique de séparation basée sur les différentes affinités d un ou plusieurs composés à l égard de deux phases
TECHNIQUES: Principes de la chromatographie 1 Définition La chromatographie est une méthode physique de séparation basée sur les différentes affinités d un ou plusieurs composés à l égard de deux phases
Comment suivre l évolution d une transformation chimique? + S 2 O 8 = I 2 + 2 SO 4
 Afin d optimiser leurs procédés, les industries chimiques doivent contrôler le bon déroulement de la réaction de synthèse menant aux espèces voulues. Comment suivre l évolution d une transformation chimique?
Afin d optimiser leurs procédés, les industries chimiques doivent contrôler le bon déroulement de la réaction de synthèse menant aux espèces voulues. Comment suivre l évolution d une transformation chimique?
(aq) sont colorées et donnent à la solution cette teinte violette, assimilable au magenta.»
 Chapitre 5 / TP 1 : Contrôle qualité de l'eau de Dakin par dosage par étalonnage à l'aide d'un spectrophotomètre Objectif : Vous devez vérifier la concentration massique d'un désinfectant, l'eau de Dakin.
Chapitre 5 / TP 1 : Contrôle qualité de l'eau de Dakin par dosage par étalonnage à l'aide d'un spectrophotomètre Objectif : Vous devez vérifier la concentration massique d'un désinfectant, l'eau de Dakin.
Meine Flüssigkeit ist gefärbt*, comme disaient August Beer (1825-1863) et Johann Heinrich Lambert (1728-1777)
 1ère S Meine Flüssigkeit ist gefärbt*, comme disaient August Beer (1825-1863) et Johann Heinrich Lambert (1728-1777) Objectif : pratiquer une démarche expérimentale pour déterminer la concentration d une
1ère S Meine Flüssigkeit ist gefärbt*, comme disaient August Beer (1825-1863) et Johann Heinrich Lambert (1728-1777) Objectif : pratiquer une démarche expérimentale pour déterminer la concentration d une
THEME 2. LE SPORT CHAP 1. MESURER LA MATIERE: LA MOLE
 THEME 2. LE SPORT CHAP 1. MESURER LA MATIERE: LA MOLE 1. RAPPEL: L ATOME CONSTITUANT DE LA MATIERE Toute la matière de l univers, toute substance, vivante ou inerte, est constituée à partir de particules
THEME 2. LE SPORT CHAP 1. MESURER LA MATIERE: LA MOLE 1. RAPPEL: L ATOME CONSTITUANT DE LA MATIERE Toute la matière de l univers, toute substance, vivante ou inerte, est constituée à partir de particules
Enseignements d exploration de seconde. Sciences de l Ingénieur. Création et Innovation Technologiques
 Enseignements d exploration de seconde Sciences de l Ingénieur Création et Innovation Technologiques SI et CIT enseignements complémentaires pour un développement durable CIT Comprendre comment évoluent
Enseignements d exploration de seconde Sciences de l Ingénieur Création et Innovation Technologiques SI et CIT enseignements complémentaires pour un développement durable CIT Comprendre comment évoluent
A chaque couleur dans l'air correspond une longueur d'onde.
 CC4 LA SPECTROPHOTOMÉTRIE I) POURQUOI UNE SUBSTANCE EST -ELLE COLORÉE? 1 ) La lumière blanche 2 ) Solutions colorées II)LE SPECTROPHOTOMÈTRE 1 ) Le spectrophotomètre 2 ) Facteurs dont dépend l'absorbance
CC4 LA SPECTROPHOTOMÉTRIE I) POURQUOI UNE SUBSTANCE EST -ELLE COLORÉE? 1 ) La lumière blanche 2 ) Solutions colorées II)LE SPECTROPHOTOMÈTRE 1 ) Le spectrophotomètre 2 ) Facteurs dont dépend l'absorbance
Physique : Thermodynamique
 Correction du Devoir urveillé n o 8 Physique : hermodynamique I Cycle moteur [Véto 200] Cf Cours : C P m C V m R relation de Mayer, pour un GP. C P m γr γ 29, 0 J.K.mol et C V m R γ 20, 78 J.K.mol. 2 Une
Correction du Devoir urveillé n o 8 Physique : hermodynamique I Cycle moteur [Véto 200] Cf Cours : C P m C V m R relation de Mayer, pour un GP. C P m γr γ 29, 0 J.K.mol et C V m R γ 20, 78 J.K.mol. 2 Une
Suivi d une réaction lente par chromatographie
 TS Activité Chapitre 8 Cinétique chimique Suivi d une réaction lente par chromatographie Objectifs : Analyser un protocole expérimental de synthèse chimique Analyser un chromatogramme pour mettre en évidence
TS Activité Chapitre 8 Cinétique chimique Suivi d une réaction lente par chromatographie Objectifs : Analyser un protocole expérimental de synthèse chimique Analyser un chromatogramme pour mettre en évidence
TP N 3 La composition chimique du vivant
 Thème 1 : La Terre dans l'univers, la vie et l'évolution du vivant : une planète habitée Chapitre II : La nature du vivant TP N 3 La composition chimique du vivant Les conditions qui règnent sur terre
Thème 1 : La Terre dans l'univers, la vie et l'évolution du vivant : une planète habitée Chapitre II : La nature du vivant TP N 3 La composition chimique du vivant Les conditions qui règnent sur terre
Titre alcalimétrique et titre alcalimétrique complet
 Titre alcalimétrique et titre alcalimétrique complet A Introduction : ) Définitions : Titre Alcalimétrique (T.A.) : F m / L T.A. T.A.C. Définition : C'est le volume d'acide (exprimé en ml) à 0,0 mol.l
Titre alcalimétrique et titre alcalimétrique complet A Introduction : ) Définitions : Titre Alcalimétrique (T.A.) : F m / L T.A. T.A.C. Définition : C'est le volume d'acide (exprimé en ml) à 0,0 mol.l
Centre Universitaire LA CITADELLE 220, avenue de l Université B.P 5526 59379 DUNKERQUE CEDEX 1 GUIDE DES ETUDES LICENCE PROFESSIONNELLE
 Centre Universitaire LA CITADELLE 220, avenue de l Université B.P 5526 59379 DUNKERQUE CEDEX 1 GUIDE DES ETUDES LICENCE PROFESSIONNELLE Chimie Industrielle (anciennement : Industries chimiques et pharmaceutiques)
Centre Universitaire LA CITADELLE 220, avenue de l Université B.P 5526 59379 DUNKERQUE CEDEX 1 GUIDE DES ETUDES LICENCE PROFESSIONNELLE Chimie Industrielle (anciennement : Industries chimiques et pharmaceutiques)
SVE 222 & PCL-442. Fascicule de Travaux Pratiques
 SVE 222 & PCL-442 Fascicule de Travaux Pratiques 2014-2015 Institut Supérieur de l Education et de la Formation Continue Bassem Jamoussi & Radhouane Chakroun 1 Sommaire PCL 442/SVE222 - TP N 1 : Etude
SVE 222 & PCL-442 Fascicule de Travaux Pratiques 2014-2015 Institut Supérieur de l Education et de la Formation Continue Bassem Jamoussi & Radhouane Chakroun 1 Sommaire PCL 442/SVE222 - TP N 1 : Etude
Fiche de révisions sur les acides et les bases
 Fiche de révisions sur les s et les s A Définitions : : espèce chimique capable de libérer un (ou plusieurs proton (s. : espèce chimique capable de capter un (ou plusieurs proton (s. Attention! Dans une
Fiche de révisions sur les s et les s A Définitions : : espèce chimique capable de libérer un (ou plusieurs proton (s. : espèce chimique capable de capter un (ou plusieurs proton (s. Attention! Dans une
Les isomères des molécules organiques
 Les isomères des molécules organiques René CAHAY, Jacques FURNÉMONT I.- INTRODUCTION Le terme isomérie tire son origine du grec ίσος (isos = identique) et µερος (meros = partie). Le phénomène d isomérie
Les isomères des molécules organiques René CAHAY, Jacques FURNÉMONT I.- INTRODUCTION Le terme isomérie tire son origine du grec ίσος (isos = identique) et µερος (meros = partie). Le phénomène d isomérie
TP 2: LES SPECTRES, MESSAGES DE LA LUMIERE
 TP 2: LES SPECTRES, MESSAGES DE LA LUMIERE OBJECTIFS : - Distinguer un spectre d émission d un spectre d absorption. - Reconnaître et interpréter un spectre d émission d origine thermique - Savoir qu un
TP 2: LES SPECTRES, MESSAGES DE LA LUMIERE OBJECTIFS : - Distinguer un spectre d émission d un spectre d absorption. - Reconnaître et interpréter un spectre d émission d origine thermique - Savoir qu un
Fiche professeur. L analyse spectrale : spectroscopies IR et RMN
 Fiche professeur L analyse spectrale : spectroscopies IR et RMN Thème : Observer, ondes et matières Analyse spectrale Type de ressource : Documents de formation en spectroscopies IR et RMN, pistes d activités
Fiche professeur L analyse spectrale : spectroscopies IR et RMN Thème : Observer, ondes et matières Analyse spectrale Type de ressource : Documents de formation en spectroscopies IR et RMN, pistes d activités
 EFFICACITE DE LA RPP DANS LA DÉTECTION DE SUBSTANCES ISSUES DES FAMILLES DU MDMA, DES AMPHETAMINES ET DES HALLUCINOGENES TYPE 2CB RECUEILLIES EN MILIEU FESTIF PRADEILLE J.L.*, CHAKROUN N.**, BELTRAN V.*,
EFFICACITE DE LA RPP DANS LA DÉTECTION DE SUBSTANCES ISSUES DES FAMILLES DU MDMA, DES AMPHETAMINES ET DES HALLUCINOGENES TYPE 2CB RECUEILLIES EN MILIEU FESTIF PRADEILLE J.L.*, CHAKROUN N.**, BELTRAN V.*,
Perrothon Sandrine UV Visible. Spectrophotométrie d'absorption moléculaire Étude et dosage de la vitamine B 6
 Spectrophotométrie d'absorption moléculaire Étude et dosage de la vitamine B 6 1 1.But et théorie: Le but de cette expérience est de comprendre l'intérêt de la spectrophotométrie d'absorption moléculaire
Spectrophotométrie d'absorption moléculaire Étude et dosage de la vitamine B 6 1 1.But et théorie: Le but de cette expérience est de comprendre l'intérêt de la spectrophotométrie d'absorption moléculaire
TS1 TS2 02/02/2010 Enseignement obligatoire. DST N 4 - Durée 3h30 - Calculatrice autorisée
 TS1 TS2 02/02/2010 Enseignement obligatoire DST N 4 - Durée 3h30 - Calculatrice autorisée EXERCICE I : PRINCIPE D UNE MINUTERIE (5,5 points) A. ÉTUDE THÉORIQUE D'UN DIPÔLE RC SOUMIS À UN ÉCHELON DE TENSION.
TS1 TS2 02/02/2010 Enseignement obligatoire DST N 4 - Durée 3h30 - Calculatrice autorisée EXERCICE I : PRINCIPE D UNE MINUTERIE (5,5 points) A. ÉTUDE THÉORIQUE D'UN DIPÔLE RC SOUMIS À UN ÉCHELON DE TENSION.
Marine PEUCHMAUR. Chapitre 4 : Isomérie. Chimie Chimie Organique
 himie himie Organique hapitre 4 : Isomérie Marine PEUMAUR Année universitaire 200/20 Université Joseph Fourier de Grenoble - Tous droits réservés. . Isomérie plane 2. Stéréoisomérie de configuration (chiralité)
himie himie Organique hapitre 4 : Isomérie Marine PEUMAUR Année universitaire 200/20 Université Joseph Fourier de Grenoble - Tous droits réservés. . Isomérie plane 2. Stéréoisomérie de configuration (chiralité)
Bleu comme un Schtroumpf Démarche d investigation
 TP Bleu comme un Schtroumpf Démarche d investigation Règles de sécurité Blouse, lunettes de protection, pas de lentilles de contact, cheveux longs attachés. Toutes les solutions aqueuses seront jetées
TP Bleu comme un Schtroumpf Démarche d investigation Règles de sécurité Blouse, lunettes de protection, pas de lentilles de contact, cheveux longs attachés. Toutes les solutions aqueuses seront jetées
Synthèse et propriétés des savons.
 Synthèse et propriétés des savons. Objectifs: Réaliser la synthèse d'un savon mise en évidence de quelques propriétés des savons. I Introduction: 1. Présentation des savons: a) Composition des savons.
Synthèse et propriétés des savons. Objectifs: Réaliser la synthèse d'un savon mise en évidence de quelques propriétés des savons. I Introduction: 1. Présentation des savons: a) Composition des savons.
Mise en pratique : Etude de spectres
 Mise en pratique : Etude de spectres Introduction La nouvelle génération de spectromètre à détecteur CCD permet de réaliser n importe quel spectre en temps réel sur toute la gamme de longueur d onde. La
Mise en pratique : Etude de spectres Introduction La nouvelle génération de spectromètre à détecteur CCD permet de réaliser n importe quel spectre en temps réel sur toute la gamme de longueur d onde. La
Dr Berdj Haroutunian, 5, Chemin Gottret ch-1255 VEYRIER tél 00 41 (0)22 784-01-18 www.haroutunian.ch E-mail : berdj@haroutunian.ch
 1 L UTILISATION DU PLOMB EN DENTISTERIE : MYTHE OU REALITE Dr Berdj HAROUTUNIAN, Genève Le plomb ne devrait en principe pas être utilisé en dentisterie car il n est pas considéré comme un oligo-élément
1 L UTILISATION DU PLOMB EN DENTISTERIE : MYTHE OU REALITE Dr Berdj HAROUTUNIAN, Genève Le plomb ne devrait en principe pas être utilisé en dentisterie car il n est pas considéré comme un oligo-élément
BACCALAURÉAT GÉNÉRAL
 BACCALAURÉA GÉNÉRAL SUJE PHYSIQUE-CHIMIE Série S DURÉE DE L ÉPREUVE : 3 h 30 COEFFICIEN : 6 L usage d'une calculatrice ES autorisé Ce sujet ne nécessite pas de feuille de papier millimétré Ce sujet comporte
BACCALAURÉA GÉNÉRAL SUJE PHYSIQUE-CHIMIE Série S DURÉE DE L ÉPREUVE : 3 h 30 COEFFICIEN : 6 L usage d'une calculatrice ES autorisé Ce sujet ne nécessite pas de feuille de papier millimétré Ce sujet comporte
LE SPECTRE D ABSORPTION DES PIGMENTS CHLOROPHYLLIENS
 Fiche sujet-élève Les végétaux chlorophylliens collectent l énergie lumineuse grâce à différents pigments foliaires que l on peut classer en deux catégories : - les chlorophylles a et b d une part, - les
Fiche sujet-élève Les végétaux chlorophylliens collectent l énergie lumineuse grâce à différents pigments foliaires que l on peut classer en deux catégories : - les chlorophylles a et b d une part, - les
CLASSE DE PREMIÈRE Série : Science et technique de laboratoire Spécialité : Chimie de laboratoire et de procédés industriels
 CLASSE DE PREMIÈRE Série : Science et technique de laboratoire Spécialité : Chimie de laboratoire et de procédés industriels COURS DE CHIMIE (4 heures hebdomadaires) L'horaire hebdomadaire est réparti
CLASSE DE PREMIÈRE Série : Science et technique de laboratoire Spécialité : Chimie de laboratoire et de procédés industriels COURS DE CHIMIE (4 heures hebdomadaires) L'horaire hebdomadaire est réparti
Classe : 1 ère STL Enseignement : Mesure et Instrumentation. d une mesure. Titre : mesure de concentration par spectrophotométrie
 Classe : 1 ère STL Enseignement : Mesure et Instrumentation THEME du programme : mesures et incertitudes de mesures Sous-thème : métrologie, incertitudes Extrait du BOEN NOTIONS ET CONTENUS Mesures et
Classe : 1 ère STL Enseignement : Mesure et Instrumentation THEME du programme : mesures et incertitudes de mesures Sous-thème : métrologie, incertitudes Extrait du BOEN NOTIONS ET CONTENUS Mesures et
TS 31 ATTAQUE DE FOURMIS!
 FICHE 1 Fiche à destination des enseignants TS 31 ATTAQUE DE FOURMIS! Type d'activité ECE Notions et contenus du programme de Terminale S Compétences exigibles du programme de Terminale S TYPE ECE Evaluation
FICHE 1 Fiche à destination des enseignants TS 31 ATTAQUE DE FOURMIS! Type d'activité ECE Notions et contenus du programme de Terminale S Compétences exigibles du programme de Terminale S TYPE ECE Evaluation
259 VOLUMETRIE ET TITRATION DOSAGE DU NaOH DANS LE DESTOP
 259 VOLUMETRIE ET TITRATION DOSAGE DU NaOH DANS LE DESTOP A d a p t a t i o n : A. - M. F o u r n i e r ( C o p a d ), M. C a s a n o v a & H. J e n n y ( C d C ) 2 0 0 1 C o n c e p t i o n D. M a r g
259 VOLUMETRIE ET TITRATION DOSAGE DU NaOH DANS LE DESTOP A d a p t a t i o n : A. - M. F o u r n i e r ( C o p a d ), M. C a s a n o v a & H. J e n n y ( C d C ) 2 0 0 1 C o n c e p t i o n D. M a r g
Information. BASES LITTERAIRES Etre capable de répondre à une question du type «la valeur trouvée respecte t-elle le cahier des charges?
 Compétences générales Avoir des piles neuves, ou récentes dans sa machine à calculer. Etre capable de retrouver instantanément une info dans sa machine. Prendre une bouteille d eau. Prendre CNI + convocation.
Compétences générales Avoir des piles neuves, ou récentes dans sa machine à calculer. Etre capable de retrouver instantanément une info dans sa machine. Prendre une bouteille d eau. Prendre CNI + convocation.
EOLE TRADING INTEGRALE
 EOLE TRADING INTEGRALE Formation 100% en ligne Coaching Live d un an Accès à nos outils exclusifs 1- PRESENTATION Eole Trading Intégrale est une formation d une année composée en 3 phases. Elle est accessible
EOLE TRADING INTEGRALE Formation 100% en ligne Coaching Live d un an Accès à nos outils exclusifs 1- PRESENTATION Eole Trading Intégrale est une formation d une année composée en 3 phases. Elle est accessible
Master 2 professionnel MAAPS Méthodologies Analytiques Appliquées aux Produits de Santé
 Master 2 professionnel MAAPS Méthodologies Analytiques Appliquées aux Produits de Santé Parcours MASTER : Sciences Technologies Santé MENTION : Médicaments et Produits de Santé SPECIALITE : Master PRO
Master 2 professionnel MAAPS Méthodologies Analytiques Appliquées aux Produits de Santé Parcours MASTER : Sciences Technologies Santé MENTION : Médicaments et Produits de Santé SPECIALITE : Master PRO
LICENCE PHYSIQUE, CHIMIE EN L3 :
 SCIENCES & TECHNOLOGIES - SANTÉ ET STAPS LICENCE EN L : - Parcours : «Chimie» (Dunkerque) - Parcours : «Physique, Sciences-Physiques, Electronique et Instrumentation» (Calais) www.univ-littoral.fr OBJECTIFS
SCIENCES & TECHNOLOGIES - SANTÉ ET STAPS LICENCE EN L : - Parcours : «Chimie» (Dunkerque) - Parcours : «Physique, Sciences-Physiques, Electronique et Instrumentation» (Calais) www.univ-littoral.fr OBJECTIFS
Spectrophotométrie. Spectrophotomètre CCD2. Réf : 701 606. Version 1.0. Français p 2. Version : 4105
 Réf : Version 1.0 Français p 2 Version : 4105 Spectrophotomètre CCD2 1 Avant-propos et description Chère cliente, cher client, nous vous félicitons d'avoir choisi notre Spectrophotomètre CCD2 pour réaliser
Réf : Version 1.0 Français p 2 Version : 4105 Spectrophotomètre CCD2 1 Avant-propos et description Chère cliente, cher client, nous vous félicitons d'avoir choisi notre Spectrophotomètre CCD2 pour réaliser
Résonance Magnétique Nucléaire : RMN
 21 Résonance Magnétique Nucléaire : RMN Salle de TP de Génie Analytique Ce document résume les principaux aspects de la RMN nécessaires à la réalisation des TP de Génie Analytique de 2ème année d IUT de
21 Résonance Magnétique Nucléaire : RMN Salle de TP de Génie Analytique Ce document résume les principaux aspects de la RMN nécessaires à la réalisation des TP de Génie Analytique de 2ème année d IUT de
TPG 12 - Spectrophotométrie
 TPG 12 - Spectrophotométrie Travail par binôme Objectif : découvrir les conditions de validité et les utilisations possibles de la loi de Beer-Lambert I- Tracé de la rosace des couleurs Choisir un des
TPG 12 - Spectrophotométrie Travail par binôme Objectif : découvrir les conditions de validité et les utilisations possibles de la loi de Beer-Lambert I- Tracé de la rosace des couleurs Choisir un des
contributions Les multiples de la chimie dans la conception des tablettes et des Smartphones Jean-Charles Flores
 Les multiples contributions de la chimie dans la conception des tablettes et des Smartphones Jean-Charles Flores Jean-Charles Flores est spécialiste de l électronique organique au sein de la société BASF
Les multiples contributions de la chimie dans la conception des tablettes et des Smartphones Jean-Charles Flores Jean-Charles Flores est spécialiste de l électronique organique au sein de la société BASF
Vitesse d une réaction chimique
 Chimie chapitre itesse d une réaction chimique A. Avancement d un mobile et vitesse de déplacement Soit un mobile supposé ponctuel P se déplaçant le long d un axe x [Doc. ] : sa position instantanée est
Chimie chapitre itesse d une réaction chimique A. Avancement d un mobile et vitesse de déplacement Soit un mobile supposé ponctuel P se déplaçant le long d un axe x [Doc. ] : sa position instantanée est
4. Conditionnement et conservation de l échantillon
 1. Objet S-II-3V1 DOSAGE DU MERCURE DANS LES EXTRAITS D EAU RÉGALE Description du dosage du mercure par spectrométrie d absorption atomique de vapeur froide ou par spectrométrie de fluorescence atomique
1. Objet S-II-3V1 DOSAGE DU MERCURE DANS LES EXTRAITS D EAU RÉGALE Description du dosage du mercure par spectrométrie d absorption atomique de vapeur froide ou par spectrométrie de fluorescence atomique
Un spectromètre à fibre plus précis, plus résistant, plus pratique Concept et logiciel innovants
 & INNOVATION 2014 NO DRIVER! Logiciel embarqué Un spectromètre à fibre plus précis, plus résistant, plus pratique Concept et logiciel innovants contact@ovio-optics.com www.ovio-optics.com Spectromètre
& INNOVATION 2014 NO DRIVER! Logiciel embarqué Un spectromètre à fibre plus précis, plus résistant, plus pratique Concept et logiciel innovants contact@ovio-optics.com www.ovio-optics.com Spectromètre
5.5.5 Exemple d un essai immunologique
 5.5.5 Exemple d un essai immunologique Test de grossesse Test en forme de bâtonnet destiné à mettre en évidence l'hormone spécifique de la grossesse, la gonadotrophine chorionique humaine (hcg), une glycoprotéine.
5.5.5 Exemple d un essai immunologique Test de grossesse Test en forme de bâtonnet destiné à mettre en évidence l'hormone spécifique de la grossesse, la gonadotrophine chorionique humaine (hcg), une glycoprotéine.
Spectrophotométrie - Dilution 1 Dilution et facteur de dilution. 1.1 Mode opératoire :
 Spectrophotométrie - Dilution 1 Dilution et facteur de dilution. 1.1 Mode opératoire : 1. Prélever ml de la solution mère à la pipette jaugée. Est-ce que je sais : Mettre une propipette sur une pipette
Spectrophotométrie - Dilution 1 Dilution et facteur de dilution. 1.1 Mode opératoire : 1. Prélever ml de la solution mère à la pipette jaugée. Est-ce que je sais : Mettre une propipette sur une pipette
Séquence 9. Étudiez le chapitre 11 de physique des «Notions fondamentales» : Physique : Dispersion de la lumière
 Séquence 9 Consignes de travail Étudiez le chapitre 11 de physique des «Notions fondamentales» : Physique : Dispersion de la lumière Travaillez les cours d application de physique. Travaillez les exercices
Séquence 9 Consignes de travail Étudiez le chapitre 11 de physique des «Notions fondamentales» : Physique : Dispersion de la lumière Travaillez les cours d application de physique. Travaillez les exercices
DM n o 8 TS1 2012 Physique 10 (satellites) + Chimie 12 (catalyse) Exercice 1 Lancement d un satellite météorologique
 DM n o 8 TS1 2012 Physique 10 (satellites) + Chimie 12 (catalyse) Exercice 1 Lancement d un satellite météorologique Le centre spatial de Kourou a lancé le 21 décembre 200, avec une fusée Ariane, un satellite
DM n o 8 TS1 2012 Physique 10 (satellites) + Chimie 12 (catalyse) Exercice 1 Lancement d un satellite météorologique Le centre spatial de Kourou a lancé le 21 décembre 200, avec une fusée Ariane, un satellite
K W = [H 3 O + ] [OH - ] = 10-14 = K a K b à 25 C. [H 3 O + ] = [OH - ] = 10-7 M Solution neutre. [H 3 O + ] > [OH - ] Solution acide
![K W = [H 3 O + ] [OH - ] = 10-14 = K a K b à 25 C. [H 3 O + ] = [OH - ] = 10-7 M Solution neutre. [H 3 O + ] > [OH - ] Solution acide K W = [H 3 O + ] [OH - ] = 10-14 = K a K b à 25 C. [H 3 O + ] = [OH - ] = 10-7 M Solution neutre. [H 3 O + ] > [OH - ] Solution acide](/thumbs/20/420627.jpg) La constante d autoprotolyse de l eau, K W, est égale au produit de K a par K b pour un couple acide/base donné : En passant en échelle logarithmique, on voit donc que la somme du pk a et du pk b d un
La constante d autoprotolyse de l eau, K W, est égale au produit de K a par K b pour un couple acide/base donné : En passant en échelle logarithmique, on voit donc que la somme du pk a et du pk b d un
BACCALAURÉAT TECHNOLOGIQUE
 BACCALAURÉAT TECHNOLOGIQUE Série : Sciences et Technologies de Laboratoire Spécialité : Biotechnologies SESSION 2015 Sous-épreuve écrite de Biotechnologies Coefficient de la sous-épreuve : 4 Ce sujet est
BACCALAURÉAT TECHNOLOGIQUE Série : Sciences et Technologies de Laboratoire Spécialité : Biotechnologies SESSION 2015 Sous-épreuve écrite de Biotechnologies Coefficient de la sous-épreuve : 4 Ce sujet est
Visite à l ICV. En 2009, la création du GIE ICV-VVS permet de franchir un cap en regroupant toutes les ressources disponibles aux filiales ICV et VVS.
 Visite à l ICV Cette entreprise analyse les échantillons que les viticulteurs leur transmettent de toute la région PACA (départements 13, 83, 84 et un peu du 06, ce sont en général des coopératives viticoles
Visite à l ICV Cette entreprise analyse les échantillons que les viticulteurs leur transmettent de toute la région PACA (départements 13, 83, 84 et un peu du 06, ce sont en général des coopératives viticoles
Ecole d été des spectroscopies d électrons.
 Lundi 08 juin 2015 16h00 16h30 Principe et fondements de la technique - Les interactions photon-matière, l émission des photoélectrons - l analyse chimique par XPS Jean-Charles DUPIN Appareillage et instrumentation
Lundi 08 juin 2015 16h00 16h30 Principe et fondements de la technique - Les interactions photon-matière, l émission des photoélectrons - l analyse chimique par XPS Jean-Charles DUPIN Appareillage et instrumentation
Comprendre l Univers grâce aux messages de la lumière
 Seconde / P4 Comprendre l Univers grâce aux messages de la lumière 1/ EXPLORATION DE L UNIVERS Dans notre environnement quotidien, les dimensions, les distances sont à l échelle humaine : quelques mètres,
Seconde / P4 Comprendre l Univers grâce aux messages de la lumière 1/ EXPLORATION DE L UNIVERS Dans notre environnement quotidien, les dimensions, les distances sont à l échelle humaine : quelques mètres,
Séquence 5 Réaction chimique par échange de protons et contrôle de la qualité par dosage
 Séquence 5 Réaction chimique par échange de protons et contrôle de la qualité par dosage Problématique La séquence 5, qui comporte deux parties distinctes, mais non indépendantes, traite de la réaction
Séquence 5 Réaction chimique par échange de protons et contrôle de la qualité par dosage Problématique La séquence 5, qui comporte deux parties distinctes, mais non indépendantes, traite de la réaction
SECTEUR 4 - Métiers de la santé et de l hygiène
 SECTEUR 4 - Métiers de la santé et de l hygiène A lire attentivement par les candidats Sujet à traiter par tous les candidats inscrit au BEP Les candidats répondront sur la copie. Les annexes éventuelles
SECTEUR 4 - Métiers de la santé et de l hygiène A lire attentivement par les candidats Sujet à traiter par tous les candidats inscrit au BEP Les candidats répondront sur la copie. Les annexes éventuelles
Les composites thermoplastiques
 Les composites thermoplastiques Définition Par définition, un thermoplastique (anglais :thermoplast) est un matériau à base de polymère (composé de macromolécules) qui peut être mis en forme, à l état
Les composites thermoplastiques Définition Par définition, un thermoplastique (anglais :thermoplast) est un matériau à base de polymère (composé de macromolécules) qui peut être mis en forme, à l état
UNE OFFRE MODERNE DE BANQUE À DOMICILE
 Le réseau Société Générale UNE OFFRE MODERNE DE BANQUE À DOMICILE Alain Brunet Journée Société Générale - 20 juin 2000 1 Sommaire Une utilisation massive et un impact important sur notre exploitation Une
Le réseau Société Générale UNE OFFRE MODERNE DE BANQUE À DOMICILE Alain Brunet Journée Société Générale - 20 juin 2000 1 Sommaire Une utilisation massive et un impact important sur notre exploitation Une
Indicateur d'unité Voyant Marche/Arrêt
 Notice MESURACOLOR Colorimètre à DEL Réf. 22020 Indicateur d'unité Voyant Marche/Arrêt Indicateur Etalonnage Bouton Marche/Arrêt Indicateur de sélection de la longueur d'onde Indicateur de mode chronomètre
Notice MESURACOLOR Colorimètre à DEL Réf. 22020 Indicateur d'unité Voyant Marche/Arrêt Indicateur Etalonnage Bouton Marche/Arrêt Indicateur de sélection de la longueur d'onde Indicateur de mode chronomètre
BREVET DE TECHNICIEN SUPÉRIEUR QUALITÉ DANS LES INDUSTRIES ALIMENTAIRES ET LES BIO-INDUSTRIES
 ~--------------~~-----~- ----~-- Session 2009 BREVET DE TECNICIEN SUPÉRIEUR QUALITÉ DANS LES INDUSTRIES ALIMENTAIRES ET LES BIO-INDUSTRIES U22 - SCIENCES PYSIQUES Durée: 2 heures Coefficient : 3 Les calculatrices
~--------------~~-----~- ----~-- Session 2009 BREVET DE TECNICIEN SUPÉRIEUR QUALITÉ DANS LES INDUSTRIES ALIMENTAIRES ET LES BIO-INDUSTRIES U22 - SCIENCES PYSIQUES Durée: 2 heures Coefficient : 3 Les calculatrices
------- SESSION 2013 ÉPREUVE À OPTION. (durée : 4 heures coefficient : 6 note éliminatoire 4 sur 20) CHIMIE
 CNCURS SUR ÉPREUVES UVERT AUX CANDIDATS TITULAIRES D UN DIPLÔME U TITRE CNFÉRANT LE GRADE DE MASTER U D'UN DIPLÔME U TITRE HMLGUÉ U ENREGISTRÉ AU RÉPERTIRE NATINAL DES CERTIFICATINS PRFESSINNELLES AU NIVEAU
CNCURS SUR ÉPREUVES UVERT AUX CANDIDATS TITULAIRES D UN DIPLÔME U TITRE CNFÉRANT LE GRADE DE MASTER U D'UN DIPLÔME U TITRE HMLGUÉ U ENREGISTRÉ AU RÉPERTIRE NATINAL DES CERTIFICATINS PRFESSINNELLES AU NIVEAU
CHROMATOGRAPHIE SUR COUCHE MINCE
 CHROMATOGRAPHIE SUR COUCHE MINCE I - PRINCIPE La chromatographie est une méthode physique de séparation de mélanges en leurs constituants; elle est basée sur les différences d affinité des substances à
CHROMATOGRAPHIE SUR COUCHE MINCE I - PRINCIPE La chromatographie est une méthode physique de séparation de mélanges en leurs constituants; elle est basée sur les différences d affinité des substances à
1.2 Coordinence. Notion de liaison de coordinence : Cas de NH 3. et NH 4+ , 3 liaisons covalentes + 1 liaison de coordinence.
 Règle de l octet : tendance qu on les atomes à s entourer de 8 électrons dans l édifice moléculaire. Ce n est pas une règle générale. Composés respectant la règle de l octet Composés ne respectant pas
Règle de l octet : tendance qu on les atomes à s entourer de 8 électrons dans l édifice moléculaire. Ce n est pas une règle générale. Composés respectant la règle de l octet Composés ne respectant pas
SCIENCES PHYSIQUES. Durée : 3 heures. L usage d une calculatrice est interdit pour cette épreuve. CHIMIE
 Banque «Agro-Véto» Technologie et Biologie AT - 0310 SCIECES PYSIQUES Durée : 3 heures L usage d une calculatrice est interdit pour cette épreuve. Si, au cours de l épreuve, un candidat repère ce qui lui
Banque «Agro-Véto» Technologie et Biologie AT - 0310 SCIECES PYSIQUES Durée : 3 heures L usage d une calculatrice est interdit pour cette épreuve. Si, au cours de l épreuve, un candidat repère ce qui lui
LA MAIN A LA PATE L électricité Cycle 3 L électricité.
 LA MAIN A LA PATE L électricité Cycle 3 v L électricité. L électricité cycle 3 - doc Ecole des Mines de Nantes 1 LA MAIN A LA PATE L électricité Cycle 3 v L'électricité. PROGRESSION GENERALE Séance n 1
LA MAIN A LA PATE L électricité Cycle 3 v L électricité. L électricité cycle 3 - doc Ecole des Mines de Nantes 1 LA MAIN A LA PATE L électricité Cycle 3 v L'électricité. PROGRESSION GENERALE Séance n 1
6ème. 20/05/2011 10:13. Jour / heure : vendredi 8h30 10h20
 Classe : 6CD 6ème. 20/05/2011 10:13 Jour / heure : vendredi 8h30 10h20 3 sept. Présentation : locaux, matière et programme de l'année. 10 sept. 1/2 heure (sortie foire du Mans) 17 sept. Activités de 1
Classe : 6CD 6ème. 20/05/2011 10:13 Jour / heure : vendredi 8h30 10h20 3 sept. Présentation : locaux, matière et programme de l'année. 10 sept. 1/2 heure (sortie foire du Mans) 17 sept. Activités de 1
BTS BAT 1 Notions élémentaires de chimie 1
 BTS BAT 1 Notions élémentaires de chimie 1 I. L ATOME NOTIONS EÉLEÉMENTAIRES DE CIMIE Les atomes sont des «petits grains de matière» qui constituent la matière. L atome est un système complexe que l on
BTS BAT 1 Notions élémentaires de chimie 1 I. L ATOME NOTIONS EÉLEÉMENTAIRES DE CIMIE Les atomes sont des «petits grains de matière» qui constituent la matière. L atome est un système complexe que l on
Coût de fabrication ou d achat. Calcul des besoins Management Industriel et Logistique (4) (2) (1) (2)
 Etude de cas 1 : La société Lebreton fabrique un produit A dont la nomenclature est la suivante (les chiffres entre parenthèses indiquent le nombre de composants dans un composé de niveau immédiatement
Etude de cas 1 : La société Lebreton fabrique un produit A dont la nomenclature est la suivante (les chiffres entre parenthèses indiquent le nombre de composants dans un composé de niveau immédiatement
www.mesureo.com A N A L Y S E U R E N L I G N E D A G V D E S B I C A R B O N A T E S D E L A L C A L I N I T E
 www.mesureo.com A N A L Y S E U R E N L I G N E D A G V D E S B I C A R B O N A T E S D E L A L C A L I N I T E Solutions pour l analyse de l eau en ligne AnaSense Analyseur en ligne d AGV, des bicarbonates
www.mesureo.com A N A L Y S E U R E N L I G N E D A G V D E S B I C A R B O N A T E S D E L A L C A L I N I T E Solutions pour l analyse de l eau en ligne AnaSense Analyseur en ligne d AGV, des bicarbonates
Application à l astrophysique ACTIVITE
 Application à l astrophysique Seconde ACTIVITE I ) But : Le but de l activité est de donner quelques exemples d'utilisations pratiques de l analyse spectrale permettant de connaître un peu mieux les étoiles.
Application à l astrophysique Seconde ACTIVITE I ) But : Le but de l activité est de donner quelques exemples d'utilisations pratiques de l analyse spectrale permettant de connaître un peu mieux les étoiles.
