Notes d'études secondaires. Sciences et technologie 316 L'énergie
|
|
|
- Raphael Savard
- il y a 6 ans
- Total affichages :
Transcription
1 Notes d'études secondaires Sciences et technologie 316 L'énergie Nom: Prénom: Groupe: Date:
2 1 L énergie L énergie est la capacité d accomplir un travail ou de provoquer un changement. Son unité de mesure est le joule. Le joule est défini comme l'énergie nécessaire pour déplacer 100g de matière sur une distance de 1 m (sur la Terre). 2 Les formes d énergie Solaire Élastique Électrique Thermique Rayonnante Chimique Mécanique Éolienne Sonore Hydraulique Nucléaire Forme d'énergie Exemple Soleil Ressort Appareil électrique Feu (chaleur) Calorifère Cellule vivante Véhicule en mouvement Vent Son Chute d'eau Bombe atomique 2.1 L énergie thermique Énergie thermique: - C'est l'énergie résultant du mouvement désordonné des particules d une substance. - La température mesure le degré d agitation thermique des atomes et des molécules. Plus l agitation des particules est grande, plus l énergie thermique est grande L énergie thermique que possède un objet dépend de : 1) la température de l objet : Plus la température est élevée, plus l agitation des particules est grande. En effet, un verre d eau à la température ambiante possède plus d énergie qu un verre d eau glacée. 2
3 2) La quantité de substance (le nombre de particules) contenue dans l objet : plus la quantité de particules est grande, plus l énergie thermique est grande. Par exemple, une carafe d eau possède plus d énergie thermique qu un verre d eau. 2.2 L énergie rayonnante -L'énergie rayonnante est l énergie transportée par les ondes électromagnétiques. L énergie rayonnante dépend de : - la longueur d onde des rayons : plus la longueur d onde est courte, plus l énergie transportée est grande. La longueur d onde est la distance minimale entre deux points semblables. L ensemble des ondes électromagnétiques de différentes longueurs d ondes forme le spectre électromagnétique. Exemple : les rayons X sont plus puissants que les rayons visibles. - la quantité de rayonnements (le nombre de rayons émis par une source) : plus la quantité de rayons est grande, plus l énergie rayonnante est grande. Exemple : une ampoule de 100 W brille plus qu une autre de 40 W. 3
4 Les rayons électromagnétiques sont d autant plus pénétrants que leur énergie est grande (longueur d onde courte). Exemples d utilisation. 2.3 L énergie chimique L énergie chimique est l énergie emmagasinée dans les liaisons d une molécule. Pour libérer l énergie des liaisons chimiques, il faut les briser et les reformer autrement (produire une réaction chimique). L énergie chimique est une énergie potentielle, de réserve. L énergie chimique dépend de : - la force de la liaison : plus la liaison est forte, plus son énergie est grande. Ceci ne dépend que des types d'atomes reliés entres eux. Exemple : Briser des molécules de méthane (CH 4 ), donne plus d énergie que briser des molécules de tétrachlorure de carbone (CCl 4 ) (par combustion, environ J/g pour le méthane et J/g pour le tétrachlorure de carbone); - la quantité de liaisons (le nombre de liaisons) : plus le nombre de liaisons qu on peut briser est grand, plus l énergie que l on peut obtenir est grande. Exemple : On obtient J/g par la combustion d un gramme d acide oléique (C 18 H 34 O 2 ) et J/g par la combustion d un gramme de glucose (C 6 H 12 O 6 ). Exemples d utilisation : La combustion de l essence fait tourner un moteur; la respiration cellulaire permet aux vivants d utiliser l énergie emmagasinée dans la molécule de glucose. 2.4 L énergie mécanique L énergie mécanique est l énergie due au mouvement d un objet et à sa position par rapport aux objets environnants. L énergie mécanique dépend de trois facteurs : la vitesse, la masse et la position de l objet par rapport aux objets environnants. La partie de l énergie mécanique qui dépend de la vitesse et de la masse de l objet s appelle énergie cinétique. Exemple : camion, auto. 4
5 L autre partie qui dépend de la position de l objet par rapport aux autres ainsi que de sa masse s appelle énergie potentielle. Exemple : parmi deux objets de même masse qui se trouvent à des hauteurs différentes, celui qui est placé plus haut possède une énergie potentielle plus grande. En effet, lorsqu ils tombent, l objet situé plus haut produit une déformation plus importante du sol. Cependant, aussi longtemps que l objet (ne se déplace pas), cette énergie potentielle n est pas mise en évidence. Elle est une énergie de réserve. 3 Les transformations et les transferts d énergie Une transformation d énergie est le passage de l énergie d une forme à l autre. Exemple : lors de la combustion, l énergie chimique emmagasinée dans les molécules du combustible se transforme en énergie thermique (énergie d agitation thermique des particules) et, éventuellement, en énergie rayonnante (lumière). Un transfert d énergie est le passage de l énergie d un milieu à un autre. Exemple : lors de la combustion, l énergie thermique passe du combustible au milieu environnant. En effet, près du feu, l air est plus chaud et l on se réchauffe. La chaleur est un phénomène (un mode) de transfert d énergie thermique entre deux milieux de températures différentes. L énergie thermique passe toujours du milieu plus chaud au milieu plus froid, donc d un milieu ayant la température plus élevée au milieu ayant la température plus basse. Les transformations et les transferts d énergie permettent d accomplir différents changements physiques et chimiques. 4 Les changements physiques Un changement physique ne modifie ni la nature et donc ni les propriétés caractéristiques de la matière. Seuls la forme et l aspect de la matière change. Exemples : les changements de phase, les dissolutions, les déformations, etc. 5
6 4.1 Les changements de phase Un changement de phase est le passage d un état (ou d une phase) de la matière à un autre. N.B. La vaporisation englobe à la fois l évaporation et l ébullition : L évaporation est la vaporisation qui se produit à la surface libre d un liquide, à toute température. Par exemple, l eau s évapore à partir de 0 0 C! L ébullition est la vaporisation qui se produit à l intérieur même du liquide, à une température donnée et sous une pression donnée. Le modèle corpusculaire permet de comprendre pourquoi un changement de phase ne modifie pas les propriétés caractéristiques d une substance : seules les forces d attraction entre les particules diffèrent d une phase à l autre. Les particules elles-mêmes ne changent pas. Donc, on a la même substance, avec les mêmes propriétés caractéristiques. Le rôle de l énergie : Une augmentation de l énergie thermique d une substance fait augmenter l agitation thermique de ses particules, donc des distances qui les séparent. Cela entraîne une diminution des forces d attraction entre ses particules. La substance subit une fusion, une vaporisation ou une sublimation. Une diminution de l énergie thermique d une substance fait diminuer l agitation thermique et les distances entre ses particules, entraînant ainsi l augmentation des forces d attraction. La substance subit une solidification ou une condensation liquide ou solide. Les changements de phase demandent peu d énergie (des centaines de joules par gramme) et sont réversibles. 6
7 Les températures auxquelles se produisent les changements de phases sont des propriétés caractéristiques pour les substances pures. Par exemple, à la pression normale, l eau distillée bout toujours à 100 C. Par contre, lorsqu il s agit d eau salée, un mélange d eau et de sel, la température d ébullition varie avec le taux de sel. 4.2 Les dissolutions Une dissolution est la mise en solution d un soluté dans un solvant. Les propriétés caractéristiques de chaque substance ne changent pas. Les molécules du soluté se détachent les unes des autres et se dispersent uniformément dans le solvant. Seules les forces d attraction entre les molécules changent. Le rôle de l énergie : L on constate, par expérience, qu une dissolution peu impliquer une absorption OU un dégagement d énergie thermique. La température de la solution (à la fin de la dissolution) montre la direction du transfert d énergie : Une augmentation de la température de la solution montre que la dissolution se produit sans apport externe d énergie. De l énergie thermique est libérée vers l extérieur lors de la dissolution. Exemple : les sacs chauffants. Une diminution de la température de la solution montre que la dissolution a besoin d énergie thermique pour se produire. De l énergie thermique est absorbée pour que la dissolution se produise. Exemples : bonbons à menthe, gommes rafraîchissantes, etc. N.B.: L énergie thermique absorbée lors de la dissolution ne sert pas à augmenter la température de la solution, mais à permettre aux deux substances de se mélanger (à favoriser le glissement des particules du soluté dans les espaces libres qui existent entre les particules du solvant). Autres exemples : Hydroxyde de potassium solide è Hydroxyde de potassium en solution + énergie (KOH (s) ) (sa température augmente) Chlorure d ammonium solide+ énergie è Chlorure d ammonium en solution (NH 4 CL (s) ) (sa température diminue) Sans expérience de labo on ne peut savoir si la réaction donne ou prend l'énergie. 7
8 4.3 Les déformations Une déformation est le changement de forme d un corps. Une déformation peut être réversible (ressort) ou permanente (déformations par l exposition du plastique à des températures élevées). Le rôle de l énergie : Une déformation se produit toujours suite à un transfert d énergie, suivi souvent par une ou plusieurs transformations d énergie. Exemple : le trampoline. 5 Les changements chimiques Un changement chimique modifie la nature et les propriétés caractéristiques de la matière. Il entraîne la formation de nouvelles substances. Exemples : les synthèses, les décompositions, les oxydations, les précipitations. Lors d un changement chimique, une ou plusieurs substances (les réactifs) réagissent pour en former de nouvelles (les produits). Lors de toute réaction chimique, la loi de la conservation de la matière continue de s appliquer : le nombre d atomes demeure constant. Ils se réarrangent, en formant de nouvelles substances. H 2 + Cl 2 2 HCl + énergie Par exemple, au cours de cette réaction (changement chimique), la liaison du dihydrogène et celle du dichlore se sont brisées et les liaisons des molécules de chlorure d hydrogène se sont formées. 8
9 En 1789, Lavoisier a énoncé cette loi ainsi : «Rien ne perd, rien ne se crée, tout se transforme». Indices d un changement chimique : - dégagement d un gaz (effervescence) - détonation - dégagement de chaleur - changement de couleur - dégagement de lumière - formation d un précipité 5.1 Les synthèses La synthèse est la formation d une molécule complexe à partir d atomes ou de molécules plus simples. La synthèse absorbe ou dégage de l énergie. Les synthèses chez les vivants (protéines, lipides, glucides, ADN) absorbent toujours de l énergie. Exemples de synthèse : - 2 H 2 + O 2 è 2 H 2 O + énergie - N O 2 + énergie è 2 NO 2 - photosynthèse performée par les plantes : 6 CO H 2 O + énergie è C 6 H 12 O O 2 dioxyde de carbone + eau + énergie è glucose + dioxygène - Synthèse du glycogène à partir du glucose (dans les organismes des consommateurs) : 9
10 5.2 Les décompositions La décomposition est la transformation des molécules complexes en molécules plus simples ou en atomes. Une décomposition absorbe ou dégage de l énergie. La quantité d énergie associée à une décomposition est la même que celle qui est nécessaire à sa synthèse. Mais, si la synthèse d une molécule absorbe de l énergie, sa décomposition en dégagera et vice versa. Exemples de décomposition - L électrolyse de l eau demande de l énergie : 2 H 2 O + énergie électrique è 2 H 2 + O 2 - La décomposition du glycogène en glucose se fait avec libération d énergie. Chez les vivants, les décompositions entraînent toujours une libération d énergie. 5.3 Les oxydations L oxydation est une réaction chimique avec l oxygène ou avec une substance ayant des propriétés semblables à celles de l oxygène (comme le soufre, le chlore, le fluor). Exemples d oxydation - Corrosion des métaux (fer, argent, cuivre) : 4 Fe + 3 O 2 è 2 Fe 2 O 3 + énergie - Oxydation des aliments (le goût et la couleur sont modifiés) - Combustions (avec un dégagement important d énergie) : le feu - La respiration cellulaire (le glucose réagit avec le dioxygène en produisant de l énergie par une combustion lente, contrôlée). C est la réaction inverse de la photosynthèse : 6 CO H 2 O + énergie è C 6 H 12 O O 2 dioxyde de carbone + eau + énergie è glucose + dioxygène Les oxydations sont généralement accompagnées d un dégagement d énergie. 10
11 5.4 Les précipitations La précipitation est la formation d une substance solide peu ou pas soluble, nommée précipité, lors de la réaction de deux solutions. Exemples de précipitation - Le «caillage du lait» pour fabriquer le fromage - L eau de chaux se brouille en présence de dioxyde de carbone (réaction d identification de ce gaz) Les réactions de précipitation impliquent très peu d énergie. On les utilise dans certains procédés de purification, avant une décantation / filtration. 11
L ÉNERGIE C EST QUOI?
 L ÉNERGIE C EST QUOI? L énergie c est la vie! Pourquoi à chaque fois qu on fait quelque chose on dit qu on a besoin d énergie? Parce que l énergie est à l origine de tout! Rien ne peut se faire sans elle.
L ÉNERGIE C EST QUOI? L énergie c est la vie! Pourquoi à chaque fois qu on fait quelque chose on dit qu on a besoin d énergie? Parce que l énergie est à l origine de tout! Rien ne peut se faire sans elle.
LA A RESPIRATION CELLULAIRE
 Instructions aux professeurs Domaine : 1.1 Le transport de substances, réaction chimique de la respiration cellulaire, p. 6 Travail à réaliser : Les élèves répondent aux questions. Matériel : Feuilles
Instructions aux professeurs Domaine : 1.1 Le transport de substances, réaction chimique de la respiration cellulaire, p. 6 Travail à réaliser : Les élèves répondent aux questions. Matériel : Feuilles
Energie nucléaire. Quelques éléments de physique
 Energie nucléaire Quelques éléments de physique Comment produire 1 GW électrique Nucléaire (rendement 33%) Thermique (38%) Hydraulique (85%) Solaire (10%) Vent : 27t d uranium par an : 170 t de fuel par
Energie nucléaire Quelques éléments de physique Comment produire 1 GW électrique Nucléaire (rendement 33%) Thermique (38%) Hydraulique (85%) Solaire (10%) Vent : 27t d uranium par an : 170 t de fuel par
Physique Chimie. Utiliser les langages scientifiques à l écrit et à l oral pour interpréter les formules chimiques
 C est Niveau la représentation 4 ème 2. Document du professeur 1/6 Physique Chimie LES ATOMES POUR COMPRENDRE LA TRANSFORMATION CHIMIQUE Programme Cette séance expérimentale illustre la partie de programme
C est Niveau la représentation 4 ème 2. Document du professeur 1/6 Physique Chimie LES ATOMES POUR COMPRENDRE LA TRANSFORMATION CHIMIQUE Programme Cette séance expérimentale illustre la partie de programme
C3. Produire de l électricité
 C3. Produire de l électricité a. Electricité : définition et génération i. Définition La matière est constituée d. Au centre de l atome, se trouve un noyau constitué de charges positives (.) et neutres
C3. Produire de l électricité a. Electricité : définition et génération i. Définition La matière est constituée d. Au centre de l atome, se trouve un noyau constitué de charges positives (.) et neutres
Chapitre 02. La lumière des étoiles. Exercices :
 Chapitre 02 La lumière des étoiles. I- Lumière monochromatique et lumière polychromatique. )- Expérience de Newton (642 727). 2)- Expérience avec la lumière émise par un Laser. 3)- Radiation et longueur
Chapitre 02 La lumière des étoiles. I- Lumière monochromatique et lumière polychromatique. )- Expérience de Newton (642 727). 2)- Expérience avec la lumière émise par un Laser. 3)- Radiation et longueur
PHYSIQUE Discipline fondamentale
 Examen suisse de maturité Directives 2003-2006 DS.11 Physique DF PHYSIQUE Discipline fondamentale Par l'étude de la physique en discipline fondamentale, le candidat comprend des phénomènes naturels et
Examen suisse de maturité Directives 2003-2006 DS.11 Physique DF PHYSIQUE Discipline fondamentale Par l'étude de la physique en discipline fondamentale, le candidat comprend des phénomènes naturels et
CORRIGE. CHAP 04-ACT PB/DOC Electrolyse de l eau 1/12 1. ALIMENTATION ELECTRIQUE D'UNE NAVETTE SPATIALE
 Thème : L eau CHAP 04-ACT PB/DOC Electrolyse de l eau 1/12 Domaine : Eau et énergie CORRIGE 1. ALIMENTATION ELECTRIQUE D'UNE NAVETTE SPATIALE 2.1. Enoncé L'alimentation électrique d'une navette spatiale
Thème : L eau CHAP 04-ACT PB/DOC Electrolyse de l eau 1/12 Domaine : Eau et énergie CORRIGE 1. ALIMENTATION ELECTRIQUE D'UNE NAVETTE SPATIALE 2.1. Enoncé L'alimentation électrique d'une navette spatiale
4 ème PHYSIQUE-CHIMIE TRIMESTRE 1. Sylvie LAMY Agrégée de Mathématiques Diplômée de l École Polytechnique. PROGRAMME 2008 (v2.4)
 PHYSIQUE-CHIMIE 4 ème TRIMESTRE 1 PROGRAMME 2008 (v2.4) Sylvie LAMY Agrégée de Mathématiques Diplômée de l École Polytechnique Les Cours Pi e-mail : lescourspi@cours-pi.com site : http://www.cours-pi.com
PHYSIQUE-CHIMIE 4 ème TRIMESTRE 1 PROGRAMME 2008 (v2.4) Sylvie LAMY Agrégée de Mathématiques Diplômée de l École Polytechnique Les Cours Pi e-mail : lescourspi@cours-pi.com site : http://www.cours-pi.com
I. Introduction: L énergie consommée par les appareils de nos foyers est sous forme d énergie électrique, facilement transportable.
 DE3: I. Introduction: L énergie consommée par les appareils de nos foyers est sous forme d énergie électrique, facilement transportable. Aujourd hui, nous obtenons cette énergie électrique en grande partie
DE3: I. Introduction: L énergie consommée par les appareils de nos foyers est sous forme d énergie électrique, facilement transportable. Aujourd hui, nous obtenons cette énergie électrique en grande partie
L énergie sous toutes ses formes : définitions
 L énergie sous toutes ses formes : définitions primaire, énergie secondaire, utile ou finale. Quelles sont les formes et les déclinaisons de l énergie? D après le dictionnaire de l Académie française,
L énergie sous toutes ses formes : définitions primaire, énergie secondaire, utile ou finale. Quelles sont les formes et les déclinaisons de l énergie? D après le dictionnaire de l Académie française,
EXERCICES SUPPLÉMENTAIRES
 Questionnaire EXERCICES SUPPLÉMENTAIRES SCP 4010-2 LE NUCLÉAIRE, DE L'ÉNERGIE DANS LA MATIÈRE /263 FORME C Version corrigée: Équipe sciences LeMoyne d'iberville, septembre 2006. QUESTION 1 (5 pts) 1. La
Questionnaire EXERCICES SUPPLÉMENTAIRES SCP 4010-2 LE NUCLÉAIRE, DE L'ÉNERGIE DANS LA MATIÈRE /263 FORME C Version corrigée: Équipe sciences LeMoyne d'iberville, septembre 2006. QUESTION 1 (5 pts) 1. La
Application à l astrophysique ACTIVITE
 Application à l astrophysique Seconde ACTIVITE I ) But : Le but de l activité est de donner quelques exemples d'utilisations pratiques de l analyse spectrale permettant de connaître un peu mieux les étoiles.
Application à l astrophysique Seconde ACTIVITE I ) But : Le but de l activité est de donner quelques exemples d'utilisations pratiques de l analyse spectrale permettant de connaître un peu mieux les étoiles.
Energie Nucléaire. Principes, Applications & Enjeux. 6 ème - 2014/2015
 Energie Nucléaire Principes, Applications & Enjeux 6 ème - 2014/2015 Quelques constats Le belge consomme 3 fois plus d énergie que le terrien moyen; (0,56% de la consommation mondiale pour 0,17% de la
Energie Nucléaire Principes, Applications & Enjeux 6 ème - 2014/2015 Quelques constats Le belge consomme 3 fois plus d énergie que le terrien moyen; (0,56% de la consommation mondiale pour 0,17% de la
Transformations nucléaires
 I Introduction Activité p286 du livre Transformations nucléaires II Les transformations nucléaires II.a Définition La désintégration radioactive d un noyau est une transformation nucléaire particulière
I Introduction Activité p286 du livre Transformations nucléaires II Les transformations nucléaires II.a Définition La désintégration radioactive d un noyau est une transformation nucléaire particulière
BTS BAT 1 Notions élémentaires de chimie 1
 BTS BAT 1 Notions élémentaires de chimie 1 I. L ATOME NOTIONS EÉLEÉMENTAIRES DE CIMIE Les atomes sont des «petits grains de matière» qui constituent la matière. L atome est un système complexe que l on
BTS BAT 1 Notions élémentaires de chimie 1 I. L ATOME NOTIONS EÉLEÉMENTAIRES DE CIMIE Les atomes sont des «petits grains de matière» qui constituent la matière. L atome est un système complexe que l on
THEME 2. LE SPORT CHAP 1. MESURER LA MATIERE: LA MOLE
 THEME 2. LE SPORT CHAP 1. MESURER LA MATIERE: LA MOLE 1. RAPPEL: L ATOME CONSTITUANT DE LA MATIERE Toute la matière de l univers, toute substance, vivante ou inerte, est constituée à partir de particules
THEME 2. LE SPORT CHAP 1. MESURER LA MATIERE: LA MOLE 1. RAPPEL: L ATOME CONSTITUANT DE LA MATIERE Toute la matière de l univers, toute substance, vivante ou inerte, est constituée à partir de particules
Rappels sur les couples oxydantsréducteurs
 CHAPITRE 1 TRANSFORMATIONS LENTES ET RAPIDES 1 Rappels sur les couples oxydantsréducteurs 1. Oxydants et réducteurs Un réducteur est une espèce chimique capable de céder au moins un électron Demi-équation
CHAPITRE 1 TRANSFORMATIONS LENTES ET RAPIDES 1 Rappels sur les couples oxydantsréducteurs 1. Oxydants et réducteurs Un réducteur est une espèce chimique capable de céder au moins un électron Demi-équation
Chapitre 11: Réactions nucléaires, radioactivité et fission
 1re B et C 11 Réactions nucléaires, radioactivité et fission 129 Chapitre 11: Réactions nucléaires, radioactivité et fission 1. Définitions a) Nucléides (= noyaux atomiques) Les nucléides renferment les
1re B et C 11 Réactions nucléaires, radioactivité et fission 129 Chapitre 11: Réactions nucléaires, radioactivité et fission 1. Définitions a) Nucléides (= noyaux atomiques) Les nucléides renferment les
ANALYSE SPECTRALE. monochromateur
 ht ANALYSE SPECTRALE Une espèce chimique est susceptible d interagir avec un rayonnement électromagnétique. L étude de l intensité du rayonnement (absorbé ou réémis) en fonction des longueurs d ode s appelle
ht ANALYSE SPECTRALE Une espèce chimique est susceptible d interagir avec un rayonnement électromagnétique. L étude de l intensité du rayonnement (absorbé ou réémis) en fonction des longueurs d ode s appelle
EXERCICE II. SYNTHÈSE D UN ANESTHÉSIQUE : LA BENZOCAÏNE (9 points)
 Bac S 2015 Antilles Guyane http://labolycee.org EXERCICE II. SYNTHÈSE D UN ANESTHÉSIQUE : LA BENZOCAÏNE (9 points) La benzocaïne (4-aminobenzoate d éthyle) est utilisée en médecine comme anesthésique local
Bac S 2015 Antilles Guyane http://labolycee.org EXERCICE II. SYNTHÈSE D UN ANESTHÉSIQUE : LA BENZOCAÏNE (9 points) La benzocaïne (4-aminobenzoate d éthyle) est utilisée en médecine comme anesthésique local
Enseignement secondaire
 Enseignement secondaire Classe de IIIe Chimie 3e classique F - Musique Nombre de leçons: 1.5 Nombre minimal de devoirs: 4 devoirs par an Langue véhiculaire: Français I. Objectifs généraux Le cours de chimie
Enseignement secondaire Classe de IIIe Chimie 3e classique F - Musique Nombre de leçons: 1.5 Nombre minimal de devoirs: 4 devoirs par an Langue véhiculaire: Français I. Objectifs généraux Le cours de chimie
L École nationale des pompiers du Québec. Dans le cadre de son programme de formation Pompier I
 L École nationale des pompiers du Québec Dans le cadre de son programme de formation Pompier I QUATRIÈME ÉDITION MANUEL DE LUTTE CONTRE L INCENDIE EXPOSÉ DU PROGRAMME D ÉTUDES POMPIER 1 SUJET 4 Énergie
L École nationale des pompiers du Québec Dans le cadre de son programme de formation Pompier I QUATRIÈME ÉDITION MANUEL DE LUTTE CONTRE L INCENDIE EXPOSÉ DU PROGRAMME D ÉTUDES POMPIER 1 SUJET 4 Énergie
ne définition de l arbre.
 LA PHYSIOLOGIE DES ARBRES. U ne définition de l arbre. L es arbres sont des êtres vivants qui occupent une place à part dans le monde végétal. Ils sont indispensables à la vie sur terre et ils ont largement
LA PHYSIOLOGIE DES ARBRES. U ne définition de l arbre. L es arbres sont des êtres vivants qui occupent une place à part dans le monde végétal. Ils sont indispensables à la vie sur terre et ils ont largement
AIDE-MÉMOIRE LA THERMOCHIMIE TABLE DES MATIERES
 Collège Voltaire, 2014-2015 AIDE-MÉMOIRE LA THERMOCHIMIE http://dcpe.net/poii/sites/default/files/cours%20et%20ex/cours-ch2-thermo.pdf TABLE DES MATIERES 3.A. Introduction...2 3.B. Chaleur...3 3.C. Variation
Collège Voltaire, 2014-2015 AIDE-MÉMOIRE LA THERMOCHIMIE http://dcpe.net/poii/sites/default/files/cours%20et%20ex/cours-ch2-thermo.pdf TABLE DES MATIERES 3.A. Introduction...2 3.B. Chaleur...3 3.C. Variation
8/10/10. Les réactions nucléaires
 Les réactions nucléaires En 1900, à Montréal, Rutherford observa un effet curieux, lors de mesures de l'intensité du rayonnement d'une source de thorium [...]. L'intensité n'était pas la même selon que
Les réactions nucléaires En 1900, à Montréal, Rutherford observa un effet curieux, lors de mesures de l'intensité du rayonnement d'une source de thorium [...]. L'intensité n'était pas la même selon que
Compétence 3-1 S EXPRIMER A L ECRIT Fiche professeur
 Compétence 3-1 S EXPRIMER A L ECRIT Fiche professeur Nature de l activité : Réaliser 3 types de productions écrites (réécriture de notes, production d une synthèse de documents, production d une argumentation)
Compétence 3-1 S EXPRIMER A L ECRIT Fiche professeur Nature de l activité : Réaliser 3 types de productions écrites (réécriture de notes, production d une synthèse de documents, production d une argumentation)
Chap 1: Toujours plus vite... Introduction: Comment déterminer la vitesse d une voiture?
 Thème 2 La sécurité Chap 1: Toujours plus vite... Introduction: Comment déterminer la vitesse d une voiture?! Il faut deux informations Le temps écoulé La distance parcourue Vitesse= distance temps > Activité
Thème 2 La sécurité Chap 1: Toujours plus vite... Introduction: Comment déterminer la vitesse d une voiture?! Il faut deux informations Le temps écoulé La distance parcourue Vitesse= distance temps > Activité
Partie Observer : Ondes et matière CHAP 04-ACT/DOC Analyse spectrale : Spectroscopies IR et RMN
 Partie Observer : Ondes et matière CHAP 04-ACT/DOC Analyse spectrale : Spectroscopies IR et RMN Objectifs : Exploiter un spectre infrarouge pour déterminer des groupes caractéristiques Relier un spectre
Partie Observer : Ondes et matière CHAP 04-ACT/DOC Analyse spectrale : Spectroscopies IR et RMN Objectifs : Exploiter un spectre infrarouge pour déterminer des groupes caractéristiques Relier un spectre
FICHE DE DONNEES DE SECURITE
 PAGE 1/7 DATE DE MISE A JOUR : 16/11/2011 1/ - IDENTIFICATION DU PRODUIT ET DE LA SOCIETE Identification du produit : Gaines, films, housses, et/ou sacs transparents et colorés en polyéthylène. Famille
PAGE 1/7 DATE DE MISE A JOUR : 16/11/2011 1/ - IDENTIFICATION DU PRODUIT ET DE LA SOCIETE Identification du produit : Gaines, films, housses, et/ou sacs transparents et colorés en polyéthylène. Famille
Chapitre 1 : Qu est ce que l air qui nous entoure?
 Chapitre 1 : Qu est ce que l air qui nous entoure? Plan : 1. Qu est ce que l atmosphère terrestre? 2. De quoi est constitué l air qui nous entoure? 3. Qu est ce que le dioxygène? a. Le dioxygène dans la
Chapitre 1 : Qu est ce que l air qui nous entoure? Plan : 1. Qu est ce que l atmosphère terrestre? 2. De quoi est constitué l air qui nous entoure? 3. Qu est ce que le dioxygène? a. Le dioxygène dans la
POLY-PREPAS Centre de Préparation aux Concours Paramédicaux. - Section Orthoptiste / stage i-prépa intensif -
 POLY-PREPAS Centre de Préparation aux Concours Paramédicaux - Section Orthoptiste / stage i-prépa intensif - 1 Suite énoncé des exos du Chapitre 14 : Noyaux-masse-énergie I. Fission nucléaire induite (provoquée)
POLY-PREPAS Centre de Préparation aux Concours Paramédicaux - Section Orthoptiste / stage i-prépa intensif - 1 Suite énoncé des exos du Chapitre 14 : Noyaux-masse-énergie I. Fission nucléaire induite (provoquée)
Chapitre n 6 MASSE ET ÉNERGIE DES NOYAUX
 Chapitre n 6 MASSE ET ÉNERGIE DES NOYAUX T ale S Introduction : Une réaction nucléaire est Une réaction nucléaire provoquée est L'unité de masse atomique est une unité permettant de manipuler aisément
Chapitre n 6 MASSE ET ÉNERGIE DES NOYAUX T ale S Introduction : Une réaction nucléaire est Une réaction nucléaire provoquée est L'unité de masse atomique est une unité permettant de manipuler aisément
GUIDE DE BONNES PRATIQUES POUR LA COLLECTE DE PILES ET ACCUMULATEURS AU LUXEMBOURG
 GUIDE DE BONNES PRATIQUES POUR LA COLLECTE DE PILES ET ACCUMULATEURS AU LUXEMBOURG Version 1.0 1 Avant-propos Ce guide de bonnes pratiques a été préparé pour fournir des informations concernant la collecte
GUIDE DE BONNES PRATIQUES POUR LA COLLECTE DE PILES ET ACCUMULATEURS AU LUXEMBOURG Version 1.0 1 Avant-propos Ce guide de bonnes pratiques a été préparé pour fournir des informations concernant la collecte
L échelle du ph est logarithmique, c està-dire
 Le ph Qu est-ce que le ph? Le ph mesure l acidité d un liquide. Sa valeur s exprime sur une échelle graduée de 0 à 14 où 1 désigne une substance fortement acide, 7, une substance neutre, et 14, une substance
Le ph Qu est-ce que le ph? Le ph mesure l acidité d un liquide. Sa valeur s exprime sur une échelle graduée de 0 à 14 où 1 désigne une substance fortement acide, 7, une substance neutre, et 14, une substance
Équivalence masse-énergie
 CHPITRE 5 NOYUX, MSSE ET ÉNERGIE Équivalence masse-énergie. Équivalence masse-énergie Einstein a montré que la masse constitue une forme d énergie appelée énergie de masse. La relation entre la masse (en
CHPITRE 5 NOYUX, MSSE ET ÉNERGIE Équivalence masse-énergie. Équivalence masse-énergie Einstein a montré que la masse constitue une forme d énergie appelée énergie de masse. La relation entre la masse (en
Production mondiale d énergie
 Chapitre 14: Autres sources d énergie Énergie nucléaire Énergie solaire Énergie géothermale Hydro-électricité Énergie éolienne Production mondiale d énergie 23% 39% 27% Coal Nuclear Hydro Geothermal Petroleum
Chapitre 14: Autres sources d énergie Énergie nucléaire Énergie solaire Énergie géothermale Hydro-électricité Énergie éolienne Production mondiale d énergie 23% 39% 27% Coal Nuclear Hydro Geothermal Petroleum
NOTIONS FONDAMENTALES SUR LES ENERGIES
 CHAPITRE 1 NOTIONS FONDAMENTALES SUR LES ENERGIES 1 suite Chapitre 1 : NOTIONS FONDAMENTALES SUR LES ENERGIES 1.1 Généralités 1.2 L'énergie dans le monde 1.2.1 Qu'est-ce que l'énergie? 1.2.2 Aperçu sur
CHAPITRE 1 NOTIONS FONDAMENTALES SUR LES ENERGIES 1 suite Chapitre 1 : NOTIONS FONDAMENTALES SUR LES ENERGIES 1.1 Généralités 1.2 L'énergie dans le monde 1.2.1 Qu'est-ce que l'énergie? 1.2.2 Aperçu sur
1 ère partie : tous CAP sauf hôtellerie et alimentation CHIMIE ETRE CAPABLE DE. PROGRAMME - Atomes : structure, étude de quelques exemples.
 Référentiel CAP Sciences Physiques Page 1/9 SCIENCES PHYSIQUES CERTIFICATS D APTITUDES PROFESSIONNELLES Le référentiel de sciences donne pour les différentes parties du programme de formation la liste
Référentiel CAP Sciences Physiques Page 1/9 SCIENCES PHYSIQUES CERTIFICATS D APTITUDES PROFESSIONNELLES Le référentiel de sciences donne pour les différentes parties du programme de formation la liste
Calcaire ou eau agressive en AEP : comment y remédier?
 Calcaire ou eau agressive en AEP : comment y remédier? Les solutions techniques Principes et critères de choix Par Sébastien LIBOZ - Hydrogéologue Calcaire ou eau agressive en AEP : comment y remédier?
Calcaire ou eau agressive en AEP : comment y remédier? Les solutions techniques Principes et critères de choix Par Sébastien LIBOZ - Hydrogéologue Calcaire ou eau agressive en AEP : comment y remédier?
Chapitre 10 : Radioactivité et réactions nucléaires (chapitre 11 du livre)
 Chapitre 10 : Radioactivité et réactions nucléaires (chapitre 11 du livre) 1. A la découverte de la radioactivité. Un noyau père radioactif est un noyau INSTABLE. Il se transforme en un noyau fils STABLE
Chapitre 10 : Radioactivité et réactions nucléaires (chapitre 11 du livre) 1. A la découverte de la radioactivité. Un noyau père radioactif est un noyau INSTABLE. Il se transforme en un noyau fils STABLE
TP N 3 La composition chimique du vivant
 Thème 1 : La Terre dans l'univers, la vie et l'évolution du vivant : une planète habitée Chapitre II : La nature du vivant TP N 3 La composition chimique du vivant Les conditions qui règnent sur terre
Thème 1 : La Terre dans l'univers, la vie et l'évolution du vivant : une planète habitée Chapitre II : La nature du vivant TP N 3 La composition chimique du vivant Les conditions qui règnent sur terre
Lycée Galilée Gennevilliers. chap. 6. JALLU Laurent. I. Introduction... 2 La source d énergie nucléaire... 2
 Lycée Galilée Gennevilliers L'énergie nucléaire : fusion et fission chap. 6 JALLU Laurent I. Introduction... 2 La source d énergie nucléaire... 2 II. Équivalence masse-énergie... 3 Bilan de masse de la
Lycée Galilée Gennevilliers L'énergie nucléaire : fusion et fission chap. 6 JALLU Laurent I. Introduction... 2 La source d énergie nucléaire... 2 II. Équivalence masse-énergie... 3 Bilan de masse de la
A retenir : A Z m n. m noyau MASSE ET ÉNERGIE RÉACTIONS NUCLÉAIRES I) EQUIVALENCE MASSE-ÉNERGIE
 CP7 MASSE ET ÉNERGIE RÉACTIONS NUCLÉAIRES I) EQUIVALENCE MASSE-ÉNERGIE 1 ) Relation d'équivalence entre la masse et l'énergie -énergie de liaison 2 ) Une unité d énergie mieux adaptée 3 ) application 4
CP7 MASSE ET ÉNERGIE RÉACTIONS NUCLÉAIRES I) EQUIVALENCE MASSE-ÉNERGIE 1 ) Relation d'équivalence entre la masse et l'énergie -énergie de liaison 2 ) Une unité d énergie mieux adaptée 3 ) application 4
ÉNERGIE : DÉFINITIONS ET PRINCIPES
 DÉFINITION DE L ÉNERGIE FORMES D ÉNERGIE LES GRANDS PRINCIPES DE L ÉNERGIE DÉCLINAISONS DE L ÉNERGIE RENDEMENT ET EFFICACITÉ DÉFINITION DE L ÉNERGIE L énergie (du grec : force en action) est ce qui permet
DÉFINITION DE L ÉNERGIE FORMES D ÉNERGIE LES GRANDS PRINCIPES DE L ÉNERGIE DÉCLINAISONS DE L ÉNERGIE RENDEMENT ET EFFICACITÉ DÉFINITION DE L ÉNERGIE L énergie (du grec : force en action) est ce qui permet
Présentation générale des principales sources d énergies fossiles.
 Présentation générale des principales sources d énergies fossiles. Date : 19/09/2012 NOM / Name SIGNATURE Etabli / Prepared Vérifié / Checked Approuvé /Approved G J-L & R-SENE R.SENE R.SENE Sommaire 1.
Présentation générale des principales sources d énergies fossiles. Date : 19/09/2012 NOM / Name SIGNATURE Etabli / Prepared Vérifié / Checked Approuvé /Approved G J-L & R-SENE R.SENE R.SENE Sommaire 1.
P17- REACTIONS NUCLEAIRES
 PC A DOMICILE - 779165576 P17- REACTIONS NUCLEAIRES TRAVAUX DIRIGES TERMINALE S 1 Questions de cours 1) Définir le phénomène de la radioactivité. 2) Quelles sont les différentes catégories de particules
PC A DOMICILE - 779165576 P17- REACTIONS NUCLEAIRES TRAVAUX DIRIGES TERMINALE S 1 Questions de cours 1) Définir le phénomène de la radioactivité. 2) Quelles sont les différentes catégories de particules
CHAÎNES ÉNERGÉTIQUES I CHAÎNES ÉNERGÉTIQUES. II PUISSANCE ET ÉNERGIE
 CHAÎNES ÉNERGÉTIQUES I CHAÎNES ÉNERGÉTIQUES. II PUISSANCE ET ÉNERGIE I Chaine énergétique a- Les différentes formes d énergie L énergie se mesure en Joules, elle peut prendre différentes formes : chimique,
CHAÎNES ÉNERGÉTIQUES I CHAÎNES ÉNERGÉTIQUES. II PUISSANCE ET ÉNERGIE I Chaine énergétique a- Les différentes formes d énergie L énergie se mesure en Joules, elle peut prendre différentes formes : chimique,
L ENERGIE CORRECTION
 Technologie Lis attentivement le document ressource mis à ta disposition et recopie les questions posées sur une feuille de cours (réponds au crayon) : 1. Quelles sont les deux catégories d énergie que
Technologie Lis attentivement le document ressource mis à ta disposition et recopie les questions posées sur une feuille de cours (réponds au crayon) : 1. Quelles sont les deux catégories d énergie que
Comprendre l Univers grâce aux messages de la lumière
 Seconde / P4 Comprendre l Univers grâce aux messages de la lumière 1/ EXPLORATION DE L UNIVERS Dans notre environnement quotidien, les dimensions, les distances sont à l échelle humaine : quelques mètres,
Seconde / P4 Comprendre l Univers grâce aux messages de la lumière 1/ EXPLORATION DE L UNIVERS Dans notre environnement quotidien, les dimensions, les distances sont à l échelle humaine : quelques mètres,
ACIDES BASES. Chap.5 SPIESS
 ACIDES BASES «Je ne crois pas que l on me conteste que l acide n ait des pointes Il ne faut que le goûter pour tomber dans ce sentiment car il fait des picotements sur la langue.» Notion d activité et
ACIDES BASES «Je ne crois pas que l on me conteste que l acide n ait des pointes Il ne faut que le goûter pour tomber dans ce sentiment car il fait des picotements sur la langue.» Notion d activité et
La physique nucléaire et ses applications
 La physique nucléaire et ses applications I. Rappels et compléments sur les noyaux. Sa constitution La représentation symbolique d'un noyau est, dans laquelle : o X est le symbole du noyau et par extension
La physique nucléaire et ses applications I. Rappels et compléments sur les noyaux. Sa constitution La représentation symbolique d'un noyau est, dans laquelle : o X est le symbole du noyau et par extension
TECHNIQUES: Principes de la chromatographie
 TECHNIQUES: Principes de la chromatographie 1 Définition La chromatographie est une méthode physique de séparation basée sur les différentes affinités d un ou plusieurs composés à l égard de deux phases
TECHNIQUES: Principes de la chromatographie 1 Définition La chromatographie est une méthode physique de séparation basée sur les différentes affinités d un ou plusieurs composés à l égard de deux phases
Qu'est-ce que la biométhanisation?
 Qu'est-ce que la biométhanisation? La biométhanisation consiste en une série d'opérations de dégradations biologiques de matières organiques qui se produisent en l'absence d'oxygène. Les produits résultants
Qu'est-ce que la biométhanisation? La biométhanisation consiste en une série d'opérations de dégradations biologiques de matières organiques qui se produisent en l'absence d'oxygène. Les produits résultants
L ÉLECTRICITÉ C EST QUOI?
 L ÉLECTRICITÉ C EST QUOI? L électricité est le moyen de transport de l énergie! L électricité, comme l énergie, est présente dans la nature mais on ne la voit pas. Sauf quand il y a un orage! L électricité
L ÉLECTRICITÉ C EST QUOI? L électricité est le moyen de transport de l énergie! L électricité, comme l énergie, est présente dans la nature mais on ne la voit pas. Sauf quand il y a un orage! L électricité
Chapitre 6 : les groupements d'étoiles et l'espace interstellaire
 Chapitre 6 : les groupements d'étoiles et l'espace interstellaire - Notre Galaxie - Amas stellaires - Milieu interstellaire - Où sommes-nous? - Types de galaxies - Interactions entre galaxies Notre Galaxie
Chapitre 6 : les groupements d'étoiles et l'espace interstellaire - Notre Galaxie - Amas stellaires - Milieu interstellaire - Où sommes-nous? - Types de galaxies - Interactions entre galaxies Notre Galaxie
 Centre de Développement des Energies Renouvelables Caractéristiques techniques des Chauffe-eau eau solaires M. Mohamed El Haouari Directeur du Développement et de la Planification Rappels de thermique
Centre de Développement des Energies Renouvelables Caractéristiques techniques des Chauffe-eau eau solaires M. Mohamed El Haouari Directeur du Développement et de la Planification Rappels de thermique
Transformations nucléaires
 Transformations nucléaires Stabilité et instabilité des noyaux : Le noyau d un atome associé à un élément est représenté par le symbole A : nombre de masse = nombre de nucléons (protons + neutrons) Z :
Transformations nucléaires Stabilité et instabilité des noyaux : Le noyau d un atome associé à un élément est représenté par le symbole A : nombre de masse = nombre de nucléons (protons + neutrons) Z :
2 C est quoi la chimie?
 PARTIE 1 AVANT LA CHIMIE VERTE... 2 C est quoi la chimie? L inconnu étant source d angoisse, nous allons essayer de définir les grands domaines de la chimie pour mieux la connaître, l appréhender et donc
PARTIE 1 AVANT LA CHIMIE VERTE... 2 C est quoi la chimie? L inconnu étant source d angoisse, nous allons essayer de définir les grands domaines de la chimie pour mieux la connaître, l appréhender et donc
Atelier : L énergie nucléaire en Astrophysique
 Atelier : L énergie nucléaire en Astrophysique Elisabeth Vangioni Institut d Astrophysique de Paris Fleurance, 8 Août 2005 Une calculatrice, une règle et du papier quadrillé sont nécessaires au bon fonctionnement
Atelier : L énergie nucléaire en Astrophysique Elisabeth Vangioni Institut d Astrophysique de Paris Fleurance, 8 Août 2005 Une calculatrice, une règle et du papier quadrillé sont nécessaires au bon fonctionnement
Chapitre 5 : Noyaux, masse et énergie
 Chapitre 5 : Noyaux, masse et énergie Connaissances et savoir-faire exigibles : () () (3) () (5) (6) (7) (8) Définir et calculer un défaut de masse et une énergie de liaison. Définir et calculer l énergie
Chapitre 5 : Noyaux, masse et énergie Connaissances et savoir-faire exigibles : () () (3) () (5) (6) (7) (8) Définir et calculer un défaut de masse et une énergie de liaison. Définir et calculer l énergie
Chapitre 6. Réactions nucléaires. 6.1 Généralités. 6.1.1 Définitions. 6.1.2 Lois de conservation
 Chapitre 6 Réactions nucléaires 6.1 Généralités 6.1.1 Définitions Un atome est constitué d électrons et d un noyau, lui-même constitué de nucléons (protons et neutrons). Le nombre de masse, noté, est le
Chapitre 6 Réactions nucléaires 6.1 Généralités 6.1.1 Définitions Un atome est constitué d électrons et d un noyau, lui-même constitué de nucléons (protons et neutrons). Le nombre de masse, noté, est le
Rayonnements dans l univers
 Terminale S Rayonnements dans l univers Notions et contenu Rayonnements dans l Univers Absorption de rayonnements par l atmosphère terrestre. Etude de documents Compétences exigibles Extraire et exploiter
Terminale S Rayonnements dans l univers Notions et contenu Rayonnements dans l Univers Absorption de rayonnements par l atmosphère terrestre. Etude de documents Compétences exigibles Extraire et exploiter
Exercices sur le thème II : Les savons
 Fiche d'exercices Elève pour la classe de Terminale SMS page 1 Exercices sur le thème : Les savons EXERCICE 1. 1. L oléine, composé le plus important de l huile d olive, est le triglycéride de l acide
Fiche d'exercices Elève pour la classe de Terminale SMS page 1 Exercices sur le thème : Les savons EXERCICE 1. 1. L oléine, composé le plus important de l huile d olive, est le triglycéride de l acide
Lycée français La Pérouse TS. L énergie nucléaire CH P6. Exos BAC
 SVOIR Lycée français La Pérouse TS CH P6 L énergie nucléaire Exos BC - Définir et calculer un défaut de masse et une énergie de liaison. - Définir et calculer l'énergie de liaison par nucléon. - Savoir
SVOIR Lycée français La Pérouse TS CH P6 L énergie nucléaire Exos BC - Définir et calculer un défaut de masse et une énergie de liaison. - Définir et calculer l'énergie de liaison par nucléon. - Savoir
REACTIONS D OXYDATION ET DE REDUCTION
 CHIMIE 2 e OS - 2008/2009 : Cours et exercices -19- CHAPITRE 5 : REACTIONS D OXYDATION ET DE REDUCTION Chacun d entre nous a déjà observé l apparition de rouille sur un objet en fer, ou de «vert-degris»
CHIMIE 2 e OS - 2008/2009 : Cours et exercices -19- CHAPITRE 5 : REACTIONS D OXYDATION ET DE REDUCTION Chacun d entre nous a déjà observé l apparition de rouille sur un objet en fer, ou de «vert-degris»
SOLUTIONS TECHNOLOGIQUES D AVENIR
 CPTF et CSC CYCLES COMBINES A GAZ (CCG) COGÉNÉRATION DÉVELOPPEMENT DES RENOUVELABLES SOLUTIONS DE STOCKAGE CPTF ET CSC Le parc thermique est un outil essentiel pour ajuster l offre et la demande, indispensable
CPTF et CSC CYCLES COMBINES A GAZ (CCG) COGÉNÉRATION DÉVELOPPEMENT DES RENOUVELABLES SOLUTIONS DE STOCKAGE CPTF ET CSC Le parc thermique est un outil essentiel pour ajuster l offre et la demande, indispensable
Chapitre 11 Bilans thermiques
 DERNIÈRE IMPRESSION LE 30 août 2013 à 15:40 Chapitre 11 Bilans thermiques Table des matières 1 L état macroscopique et microcospique de la matière 2 2 Énergie interne d un système 2 2.1 Définition.................................
DERNIÈRE IMPRESSION LE 30 août 2013 à 15:40 Chapitre 11 Bilans thermiques Table des matières 1 L état macroscopique et microcospique de la matière 2 2 Énergie interne d un système 2 2.1 Définition.................................
L ÉLECTRICITÉ, C EST QUOI?
 L ÉLECTRICITÉ, C EST QUOI? L'électricité est le moyen de transport de l'énergie! L électricité, comme l énergie, est présente dans la nature mais on ne la voit pas. Sauf quand il y a un orage! L électricité
L ÉLECTRICITÉ, C EST QUOI? L'électricité est le moyen de transport de l'énergie! L électricité, comme l énergie, est présente dans la nature mais on ne la voit pas. Sauf quand il y a un orage! L électricité
MATIE RE DU COURS DE PHYSIQUE
 MATIE RE DU COURS DE PHYSIQUE Titulaire : A. Rauw 5h/semaine 1) MÉCANIQUE a) Cinématique ii) Référentiel Relativité des notions de repos et mouvement Relativité de la notion de trajectoire Référentiel
MATIE RE DU COURS DE PHYSIQUE Titulaire : A. Rauw 5h/semaine 1) MÉCANIQUE a) Cinématique ii) Référentiel Relativité des notions de repos et mouvement Relativité de la notion de trajectoire Référentiel
Principe et fonctionnement des bombes atomiques
 Principe et fonctionnement des bombes atomiques Ouvrage collectif Aurélien Croc Fabien Salicis Loïc Bleibel http ://www.groupe-apc.fr.fm/sciences/bombe_atomique/ Avril 2001 Table des matières Introduction
Principe et fonctionnement des bombes atomiques Ouvrage collectif Aurélien Croc Fabien Salicis Loïc Bleibel http ://www.groupe-apc.fr.fm/sciences/bombe_atomique/ Avril 2001 Table des matières Introduction
L'ÉNERGIE ET LA MATIÈRE PETITE EXPLORATION DU MONDE DE LA PHYSIQUE
 Partie 1 De quoi c'est fait? De quoi sommes nous faits? Qu'est-ce que la matière qui compose les objets qui nous entourent? D'où vient l'énergie qui nous chauffe et nous éclaire, qui déplace les objets
Partie 1 De quoi c'est fait? De quoi sommes nous faits? Qu'est-ce que la matière qui compose les objets qui nous entourent? D'où vient l'énergie qui nous chauffe et nous éclaire, qui déplace les objets
Niveau 2 nde THEME : L UNIVERS. Programme : BO spécial n 4 du 29/04/10 L UNIVERS
 Document du professeur 1/7 Niveau 2 nde THEME : L UNIVERS Physique Chimie SPECTRES D ÉMISSION ET D ABSORPTION Programme : BO spécial n 4 du 29/04/10 L UNIVERS Les étoiles : l analyse de la lumière provenant
Document du professeur 1/7 Niveau 2 nde THEME : L UNIVERS Physique Chimie SPECTRES D ÉMISSION ET D ABSORPTION Programme : BO spécial n 4 du 29/04/10 L UNIVERS Les étoiles : l analyse de la lumière provenant
IFUCOME Sciences et Technologie en Cycle 3 6 0
 IFUCOME Sciences et Technologie en Cycle 3 6 0 La fusion gourmande... ou comment fondre de plaisir! Quitterions-nous le domaine des sciences pour une nouvelle rubrique culinaire? Ce serait, pour le moins,
IFUCOME Sciences et Technologie en Cycle 3 6 0 La fusion gourmande... ou comment fondre de plaisir! Quitterions-nous le domaine des sciences pour une nouvelle rubrique culinaire? Ce serait, pour le moins,
Objectifs pédagogiques : spectrophotomètre Décrire les procédures d entretien d un spectrophotomètre Savoir changer l ampoule d un
 CHAPITRE 6 : LE SPECTROPHOTOMETRE Objectifs pédagogiques : Citer les principaux éléments d un dun spectrophotomètre Décrire les procédures d entretien d un spectrophotomètre p Savoir changer l ampoule
CHAPITRE 6 : LE SPECTROPHOTOMETRE Objectifs pédagogiques : Citer les principaux éléments d un dun spectrophotomètre Décrire les procédures d entretien d un spectrophotomètre p Savoir changer l ampoule
Que sont les sources d énergie renouvelable?
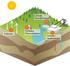 Que sont les sources d énergie renouvelable? Comme leur nom l indique, il s agit de sources qui se renouvellent et ne s épuiseront donc jamais à l échelle du temps humain! Les sources non renouvelables
Que sont les sources d énergie renouvelable? Comme leur nom l indique, il s agit de sources qui se renouvellent et ne s épuiseront donc jamais à l échelle du temps humain! Les sources non renouvelables
LABORATOIRES DE CHIMIE Techniques de dosage
 LABORATOIRES DE CHIMIE Techniques de dosage Un dosage (ou titrage) a pour but de déterminer la concentration molaire d une espèce (molécule ou ion) en solution (généralement aqueuse). Un réactif de concentration
LABORATOIRES DE CHIMIE Techniques de dosage Un dosage (ou titrage) a pour but de déterminer la concentration molaire d une espèce (molécule ou ion) en solution (généralement aqueuse). Un réactif de concentration
Physique Chimie. Réaliser les tests de reconnaissance des ions Cl -,
 Document du professeur 1/5 Niveau 3 ème Physique Chimie Programme A - La chimie, science de la transformation de la matière Connaissances Capacités Exemples d'activités Comment reconnaître la présence
Document du professeur 1/5 Niveau 3 ème Physique Chimie Programme A - La chimie, science de la transformation de la matière Connaissances Capacités Exemples d'activités Comment reconnaître la présence
Chap 2 : Noyaux, masse, énergie.
 Physique. Partie 2 : Transformations nucléaires. Dans le chapitre précédent, nous avons étudié les réactions nucléaires spontanées (radioactivité). Dans ce nouveau chapitre, après avoir abordé le problème
Physique. Partie 2 : Transformations nucléaires. Dans le chapitre précédent, nous avons étudié les réactions nucléaires spontanées (radioactivité). Dans ce nouveau chapitre, après avoir abordé le problème
Activité 38 : Découvrir comment certains déchets issus de fonctionnement des organes sont éliminés de l organisme
 Activité 38 : Découvrir comment certains déchets issus de fonctionnement des organes sont éliminés de l organisme 1. EXTRAITS REFERENTIELS DU BO Partie du programme : Fonctionnement de l organisme et besoin
Activité 38 : Découvrir comment certains déchets issus de fonctionnement des organes sont éliminés de l organisme 1. EXTRAITS REFERENTIELS DU BO Partie du programme : Fonctionnement de l organisme et besoin
Activité 1 : Rayonnements et absorption par l'atmosphère - Correction
 Activité 1 : Rayonnements et absorption par l'atmosphère - Correction Objectifs : Extraire et exploiter des informations sur l'absorption des rayonnements par l'atmosphère terrestre. Connaitre des sources
Activité 1 : Rayonnements et absorption par l'atmosphère - Correction Objectifs : Extraire et exploiter des informations sur l'absorption des rayonnements par l'atmosphère terrestre. Connaitre des sources
Le ph, c est c compliqué! Gilbert Bilodeau, agr., M.Sc.
 Le ph, c est c pas compliqué! Gilbert Bilodeau, agr., M.Sc. Conseiller en serriculture Des réponses r aux questions C est quoi et pourquoi c est c important? Conséquences d un d débalancementd? Comment
Le ph, c est c pas compliqué! Gilbert Bilodeau, agr., M.Sc. Conseiller en serriculture Des réponses r aux questions C est quoi et pourquoi c est c important? Conséquences d un d débalancementd? Comment
10 en agronomie. Domaine. Les engrais minéraux. Livret d autoformation ~ corrigés. technologique et professionnel
 10 en agronomie Les engrais minéraux Livret d autoformation ~ corrigés 8 Domaine technologique et professionnel Collection dirigée par Madeleine ASDRUBAL Ingénieur d agronomie ENESAD Département des Sciences
10 en agronomie Les engrais minéraux Livret d autoformation ~ corrigés 8 Domaine technologique et professionnel Collection dirigée par Madeleine ASDRUBAL Ingénieur d agronomie ENESAD Département des Sciences
5 >L énergie nucléaire: fusion et fission
 LA COLLECTION > 1 > L atome 2 > La radioactivité 3 > L homme et les rayonnements 4 > L énergie 6 > Le fonctionnement d un réacteur nucléaire 7 > Le cycle du combustible nucléaire 8 > La microélectronique
LA COLLECTION > 1 > L atome 2 > La radioactivité 3 > L homme et les rayonnements 4 > L énergie 6 > Le fonctionnement d un réacteur nucléaire 7 > Le cycle du combustible nucléaire 8 > La microélectronique
Baccalauréat STI2D et STL spécialité SPCL Épreuve de physique chimie Corrigé Session de juin 2014 en Polynésie. 15/06/2014 http://www.udppc.asso.
 Baccalauréat STI2D et STL spécialité SPCL Épreuve de physique chimie Corrigé Session de juin 2014 en Polynésie 15/06/2014 http://www.udppc.asso.fr Une entreprise de BTP (Bâtiment et Travaux Publics) déménage
Baccalauréat STI2D et STL spécialité SPCL Épreuve de physique chimie Corrigé Session de juin 2014 en Polynésie 15/06/2014 http://www.udppc.asso.fr Une entreprise de BTP (Bâtiment et Travaux Publics) déménage
Vitesse d une réaction chimique
 Chimie chapitre itesse d une réaction chimique A. Avancement d un mobile et vitesse de déplacement Soit un mobile supposé ponctuel P se déplaçant le long d un axe x [Doc. ] : sa position instantanée est
Chimie chapitre itesse d une réaction chimique A. Avancement d un mobile et vitesse de déplacement Soit un mobile supposé ponctuel P se déplaçant le long d un axe x [Doc. ] : sa position instantanée est
Partie 1. Addition nucléophile suivie d élimination (A N + E) 1.1. Réactivité électrophile des acides carboxyliques et groupes dérivés
 Molécules et matériaux organiques Partie 1. Addition nucléophile suivie d élimination (A N + E) 1.1. Réactivité électrophile des acides carboxyliques et groupes dérivés bjectifs du chapitre Notions à connaître
Molécules et matériaux organiques Partie 1. Addition nucléophile suivie d élimination (A N + E) 1.1. Réactivité électrophile des acides carboxyliques et groupes dérivés bjectifs du chapitre Notions à connaître
A. Énergie nucléaire 1. Fission nucléaire 2. Fusion nucléaire 3. La centrale nucléaire
 Énergie Table des A. Énergie 1. 2. 3. La centrale Énergie Table des Pour ce chapitre du cours il vous faut à peu près 90 minutes. A la fin de ce chapitre, vous pouvez : -distinguer entre fission et fusion.
Énergie Table des A. Énergie 1. 2. 3. La centrale Énergie Table des Pour ce chapitre du cours il vous faut à peu près 90 minutes. A la fin de ce chapitre, vous pouvez : -distinguer entre fission et fusion.
SCIENCES TECHNOLOGIES
 R essources MICHEL WAUTELET SCIENCES TECHNOLOGIES et SOCIÉTÉ Questions et réponses pour illustrer les cours de sciences De Boeck Introduction générale 5 Sciences, technologies, société 1. Quels sont les
R essources MICHEL WAUTELET SCIENCES TECHNOLOGIES et SOCIÉTÉ Questions et réponses pour illustrer les cours de sciences De Boeck Introduction générale 5 Sciences, technologies, société 1. Quels sont les
Piegeage et stockage du CO 2
 Piegeage et stockage du CO 2 Résumé du rapport spécial du GIEC, le Groupe d experts intergouvernemental sur l évolution du climat Un résumé réalisé par: LE PIÉGEAGE ET STOCKAGE DU DIOXYDE DE CARBONE (PSC)
Piegeage et stockage du CO 2 Résumé du rapport spécial du GIEC, le Groupe d experts intergouvernemental sur l évolution du climat Un résumé réalisé par: LE PIÉGEAGE ET STOCKAGE DU DIOXYDE DE CARBONE (PSC)
C4: Réactions nucléaires, radioactivité et fission
 1re B et C C4 Réactions nucléaires, radioactivité et fission 30 C4: Réactions nucléaires, radioactivité et fission 1. Définitions a) Nucléides (= noyaux atomiques) Les nucléides renferment les nucléons:
1re B et C C4 Réactions nucléaires, radioactivité et fission 30 C4: Réactions nucléaires, radioactivité et fission 1. Définitions a) Nucléides (= noyaux atomiques) Les nucléides renferment les nucléons:
SP. 3. Concentration molaire exercices. Savoir son cours. Concentrations : Classement. Concentration encore. Dilution :
 SP. 3 Concentration molaire exercices Savoir son cours Concentrations : Calculer les concentrations molaires en soluté apporté des solutions désinfectantes suivantes : a) Une solution de 2,0 L contenant
SP. 3 Concentration molaire exercices Savoir son cours Concentrations : Calculer les concentrations molaires en soluté apporté des solutions désinfectantes suivantes : a) Une solution de 2,0 L contenant
Végétaux Exemples d individus
 Végétaux Formation Biologie 2011 2012 Végétaux Exemples d individus Végétaux Embranchement Classification Description Reproduction Mode de vie Exemples d individu Végétaux Règne > Etymologie «Végetaux»
Végétaux Formation Biologie 2011 2012 Végétaux Exemples d individus Végétaux Embranchement Classification Description Reproduction Mode de vie Exemples d individu Végétaux Règne > Etymologie «Végetaux»
K W = [H 3 O + ] [OH - ] = 10-14 = K a K b à 25 C. [H 3 O + ] = [OH - ] = 10-7 M Solution neutre. [H 3 O + ] > [OH - ] Solution acide
![K W = [H 3 O + ] [OH - ] = 10-14 = K a K b à 25 C. [H 3 O + ] = [OH - ] = 10-7 M Solution neutre. [H 3 O + ] > [OH - ] Solution acide K W = [H 3 O + ] [OH - ] = 10-14 = K a K b à 25 C. [H 3 O + ] = [OH - ] = 10-7 M Solution neutre. [H 3 O + ] > [OH - ] Solution acide](/thumbs/20/420627.jpg) La constante d autoprotolyse de l eau, K W, est égale au produit de K a par K b pour un couple acide/base donné : En passant en échelle logarithmique, on voit donc que la somme du pk a et du pk b d un
La constante d autoprotolyse de l eau, K W, est égale au produit de K a par K b pour un couple acide/base donné : En passant en échelle logarithmique, on voit donc que la somme du pk a et du pk b d un
Épreuve collaborative
 Épreuve collaborative Épreuve collaborative 1. Faire une présentation de quelqu idé fort relativ au mix énergétique (ou bouquet énergétique). (Exposé de 5 minut maximum) 2. Faut-il encore brûler le charbon?
Épreuve collaborative Épreuve collaborative 1. Faire une présentation de quelqu idé fort relativ au mix énergétique (ou bouquet énergétique). (Exposé de 5 minut maximum) 2. Faut-il encore brûler le charbon?
1.2 Coordinence. Notion de liaison de coordinence : Cas de NH 3. et NH 4+ , 3 liaisons covalentes + 1 liaison de coordinence.
 Règle de l octet : tendance qu on les atomes à s entourer de 8 électrons dans l édifice moléculaire. Ce n est pas une règle générale. Composés respectant la règle de l octet Composés ne respectant pas
Règle de l octet : tendance qu on les atomes à s entourer de 8 électrons dans l édifice moléculaire. Ce n est pas une règle générale. Composés respectant la règle de l octet Composés ne respectant pas
MASSE, VOLUME ET QUANTITE DE MATIERE
 MASSE, OLUME ET QUANTITE DE MATIERE Exercices du Livre Microega Hatier (004 Correction L acide sulfurique 1. Calculons la asse olaire de l acide sulfurique : M(H SO 4 xm(h + M(S + 4xM(O M(H SO 4 x1,00
MASSE, OLUME ET QUANTITE DE MATIERE Exercices du Livre Microega Hatier (004 Correction L acide sulfurique 1. Calculons la asse olaire de l acide sulfurique : M(H SO 4 xm(h + M(S + 4xM(O M(H SO 4 x1,00
Production d eau chaude sanitaire thermodynamique, que dois-je savoir?
 COURS-RESSOURCES Production d eau chaude sanitaire thermodynamique, que Objectifs : / 1 A. Les besoins en eau chaude sanitaire La production d'eau chaude est consommatrice en énergie. Dans les pays occidentaux,
COURS-RESSOURCES Production d eau chaude sanitaire thermodynamique, que Objectifs : / 1 A. Les besoins en eau chaude sanitaire La production d'eau chaude est consommatrice en énergie. Dans les pays occidentaux,
août La météo Congrès provincial de l AEFNB Journée de perfectionnement professionnel
 août La météo Congrès provincial de l AEFNB Journée de perfectionnement professionnel Bienvenue Tribond - La danse de la pluie L oeil dans la météo A yous que la météo fit dans mon programme Météo everywhere
août La météo Congrès provincial de l AEFNB Journée de perfectionnement professionnel Bienvenue Tribond - La danse de la pluie L oeil dans la météo A yous que la météo fit dans mon programme Météo everywhere
Centre Universitaire LA CITADELLE 220, avenue de l Université B.P 5526 59379 DUNKERQUE CEDEX 1 GUIDE DES ETUDES LICENCE PROFESSIONNELLE
 Centre Universitaire LA CITADELLE 220, avenue de l Université B.P 5526 59379 DUNKERQUE CEDEX 1 GUIDE DES ETUDES LICENCE PROFESSIONNELLE Chimie Industrielle (anciennement : Industries chimiques et pharmaceutiques)
Centre Universitaire LA CITADELLE 220, avenue de l Université B.P 5526 59379 DUNKERQUE CEDEX 1 GUIDE DES ETUDES LICENCE PROFESSIONNELLE Chimie Industrielle (anciennement : Industries chimiques et pharmaceutiques)
