Veuillez compléter la carte d alerte du patient d Entyvio et la remettre à chaque patient.
|
|
|
- Alizée Boulet
- il y a 6 ans
- Total affichages :
Transcription
1 Cette information fait partie du plan de gestion des risques en Belgique et au Luxembourg, qui met du matériel d information à la disposition des professionnels de la santé (et des patients). Ces activités additionnelles de minimisation des risques ont pour but une utilisation sûre et efficace d Entyvio et doivent comporter les parties importantes suivantes: Les autorités de santé de l Union Européenne ont assorti la mise sur le marché du médicament Entyvio de certaines conditions. Le plan obligatoire de minimisation risques en Belgique et au Luxembourg, dont cette information fait partie, est une mesure prise pour garantir une utilisation sûre et efficace du médicament Entyvio (RMA version 10/2014). Prenez en considération les antécédents médicaux du patient, incluant toute utilisation antérieure ou concomitante de produits biologiques. Aucune donnée issue des essais cliniques portant sur Entyvio n est disponible pour les patients précédemment traités par natalizumab. Etant donné le risque d apparition de LEMP chez les patients précédemment traités par natalizumab, les médecins doivent attendre 12 semaines après la dernière dose de natalizumab avant d instaurer un traitement par Entyvio. Les patients traités par Entyvio devront faire l objet d une surveillance afin de détecter une apparition ou aggravation de signes et symptômes neurologiques suivants: Faiblesse progressive d un côté du corps ou maladresse touchant les membres Troubles de la vue Changements dans la façon de penser, la mémoire et le sens de l orientation, entraînant de la confusion et des changements de la personnalité Il convient d envisager une consultation neurologique des patients, présentant une apparition ou une aggravation des signes et symptômes évocateurs d une LEMP, vers un centre équipé pour diagnostiquer cette maladie. Veuillez compléter la carte d alerte du patient d Entyvio et la remettre à chaque patient. Si vous souhaitez recevoir des exemplaires additionnels de la carte d alerte du patient ou si vous souhaitez plus d informations concernant Entyvio, veuillez prendre contact avec la firme: Takeda Belgium, Chaussée de Gand 615, 1080 Bruxelles Tél.: +32 (0) medical.department@takeda.com Site web: Ce médicament fait l objet d une surveillance supplémentaire Informations importantes de sécurité Utilisation d Entyvio chez les patients atteints de rectocolite hémorragique ou de maladie de Crohn ITEM CODE: EUCAN/VED/ Date de préparation: Avril Ce matériel ne contient pas toutes les informations. Pour une information complète, lisez attentivement le RCP (en annexe) avant de prescrire (et/ou d utiliser et/ou de délivrer) Entyvio. Le texte complet et actualisé de ce RCP est disponible sur le site rubrique «Notices et RCP».
2 Entyvio (vedolizumab) est un anticorps monoclonal humanisé sélectif de l intestin, indiqué dans le traitement des patients adultes atteints de rectocolite hémorragique ou de maladie de Crohn, active modérée à sévère, présentant une réponse insuffisante ou une perte de réponse ou une intolérance à un traitement conventionnel ou par anti-tnf (antagoniste du facteur de nécrose tumorale alpha). Informations importantes de sécurité La leuco-encéphalopathie multifocale progressive (LEMP) est une infection opportuniste rare et souvent fatale du système nerveux central (SNC) qui a été associée à l utilisation du Tysabri (natalizumab, un antagoniste de l intégrine α4β7 et α4β1), indiqué dans le traitement des patients présentant une sclérose en plaques. Le risque de LEMP avec natalizumab serait principalement dû à la liaison avec l intégrine α4β1 qui inhibe la migration leucocytaire et la surveillance immunitaire du SNC, et non pas à la liaison avec l intégrine α4β7 qui inhibe la migration de certains leucocytes vers le tractus gastro-intestinal. Cependant, le risque théorique de LEMP avec Entyvio ne peut être exclu puisque Entyvio se lie à l intégrine α4β7. A l obtention de l autorisation de mise sur la marché d Entyvio (vedolizumab), aucun cas de LEMP n avait été rapporté parmi plus de 3100 patients traités par Entyvio dans les études cliniques. Il n y a aucune preuve d activité immunosuppressive systémique ou du système nerveux central avec Entyvio. Cependant, le risque théorique de survenue de LEMP chez un patient traité par Entyvio ne peut être exclu. Par conséquent, les patients traités par Entyvio devront faire l objet d une surveillance afin de détecter une apparition ou aggravation de symptômes neurologiques tels que ceux décrits ci-dessous: Faiblesse progressive d un côté du corps ou maladresse touchant les membres Troubles de la vue Changements dans la façon de penser, la mémoire et le sens de l orientation, entraînant de la confusion et des changements de la personnalité. Il convient d envisager une consultation neurologique des patients, présentant une apparition ou une aggravation des signes et symptômes évocateurs d une LEMP, vers un centre équipé pour diagnostiquer cette maladie. Si une LEMP est suspectée, le traitement par Entyvio doit être suspendu; si celle-ci est confirmée, le traitement doit être arrêté de façon permanente. Les cas suspectés de LEMP doivent être rapportés à Takeda ou directement au Centre Belge de pharmacovigilance pour les médicaments à usage humain (CBPH) de l AFMPS (Belgique) ou au Direction de la Santé - Division de la Pharmacie et des Médicaments (Luxembourg). Considérations à prendre en compte avant d initier le traitement chez les patients ayant précédemment reçu du natalizumab Aucune donnée issue des essais cliniques portant sur Entyvio n est disponible pour les patients précédemment traités par natalizumab. Le natalizumab étant associé à une augmentation du risque de LEMP, les médecins doivent attendre 12 semaines après la dernière dose de natalizumab avant d instaurer un traitement par Entyvio. Les médecins sont encouragés à inclure leurs patients dans l étude non interventionnelle de tolérance à long terme menée chez des patients présentant une rectocolite hémorragique ou une maladie de Crohn, sponsorisée par Takeda. Veuillez contacter Entyvio401study@entyviopass.com Instauration du traitement par Entyvio Entyvio est administré en perfusion intraveineuse pendant 30 minutes et doit être reconstitué puis dilué avant administration. Entyvio ne doit pas être administré par voie intramusculaire ou par injection rapide ou bolus intraveineux. Avant l instauration du traitement, les patients doivent être informés des bénéfices et risques potentiels d Entyvio. La notice et la carte d alerte patient d Entyvio doivent leur être fournies pour qu ils puissent les lire et poser des questions. Il est important que l état de santé général du patient soit évalué à chaque perfusion, et que leurs questions sur la notice soient discutées. Aucune donnée issue des essais cliniques n est disponible sur un usage concomitant avec des immunosuppresseurs biologiques. Par conséquent, l instauration d un traitement par Entyvio chez les patients utilisant ces médicaments n est pas recommandée. Déclaration des effets indésirables La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de la santé en Belgique sont invités à notifier les effets indésirables liés à l utilisation d Entyvio au CBPH de l AFMPS. La notification peut se faire en ligne via ou à l aide de la «fiche jaune papier» disponible via le Répertoire Commenté des Médicaments et trois fois par an via les Folia Pharmacotherapeutica. La fiche jaune peut être envoyée par la poste à l adresse AFMPS CBPH Eurostation II Place Victor Horta 40/ Bruxelles, par fax au numéro 02/ , ou encore par à : adversedrugreactions@afmps.be. Les professionnels de la santé au Luxembourg sont invités à notifier les effets indésirables liés à l utilisation d Entyvio au Direction de la Santé Division de la Pharmacie et des Médicaments, Villa Louvigny Allée Marconi, L-2120 Luxembourg. Site internet: pharmacie-medicament/index.html Information sur l étude non interventionnelle de tolérance à long terme Takeda sponsorise une étude non interventionnelle de tolérance à long terme menée chez des patients volontaires présentant une rectocolite hémorragique ou une maladie de Crohn traités par biothérapie, afin d observer et d évaluer la tolérance à long terme. Vous êtes encouragés à inclure des patients initiant Entyvio ou des patients similaires instaurant une autre biothérapie, particulièrement ceux précédemment traités par natalizumab. Veuillez contacter Entyvio401study@entyviopass.com. Veuillez-vous rapporter au Résumé des Caractéristiques du Produit et à la notice joints
3 RMA version 10/2014 Ce médicament fait l objet d une surveillance supplémentaire Carte d Alerte Patient Cette carte d alerte contient des informations importantes de sécurité dont vous devez avoir pris connaissance. Montrez cette carte à tout médecin impliqué dans votre traitement. ITEM CODE: EUCAN/VED/ Date de préparation: Avril 2014
4 Infections Entyvio augmente le risque d infections. Les infections peuvent progresser plus rapidement et être plus sévères. Cela peut inclure de graves infections cérébrales et du système nerveux. Vous ne pouvez pas être traité par Entyvio si vous souffrez d une infection grave. Si vous développez des symptômes suggérant: Des infections tels que de la fièvre, une toux persistante, une perte de poids, une lassitude ou; Des troubles du système nerveux tels que de la confusion, des troubles de la vue ou des difficultés à bouger, vous devez consultez un médecin immédiatement. Gardez cette carte avec vous 4 mois après la dernière dose d Entyvio, car les effets secondaires peuvent apparaitre longtemps après la dernière dose d Entyvio. Lire la notice d utilisation d Entyvio pour plus d informations. Assurez-vous d avoir une liste complète de tous vos autres médicaments à chacune de vos visites avec un médecin ou un(e) infirmie(è)r(e).
5 Nom du patient: Nom du médecin: Téléphone du médecin: Dates du traitement par Entyvio : Initiation: Perfusions supplémentaires: Lire la notice d utilisation d Entyvio pour plus d informations. Assurez-vous d avoir une liste complète de tous vos autres médicaments à chacune de vos visites avec un professionnel de santé.
Information transmise sous l autorité de l Agence fédérale des médicaments et des produits de santé
 Les Direct Healthcare Professional Communications (DHPC) sont des courriers envoyés aux professionnels de la santé par les firmes pharmaceutiques, afin de les informer de risques potentiels apparus lors
Les Direct Healthcare Professional Communications (DHPC) sont des courriers envoyés aux professionnels de la santé par les firmes pharmaceutiques, afin de les informer de risques potentiels apparus lors
Assurance Maladie Obligatoire Commission de la Transparence des médicaments. Avis 2 23 Octobre 2012
 Assurance Maladie Obligatoire Commission de la Transparence des médicaments Avis 2 23 Octobre 2012 Titre I : Nom du médicament, DCI, forme pharmaceutique, dosage, présentation HUMIRA (DCI : Adalimumab
Assurance Maladie Obligatoire Commission de la Transparence des médicaments Avis 2 23 Octobre 2012 Titre I : Nom du médicament, DCI, forme pharmaceutique, dosage, présentation HUMIRA (DCI : Adalimumab
Point d Information. Le PRAC a recommandé que le RCP soit modifié afin d inclure les informations suivantes:
 Point d Information Médicaments à base d ivabradine, de codéine, médicaments contenant du diméthyl fumarate, du mycophénolate mofétil/acide mycophénolique, de l octocog alpha, spécialité Eligard (contenant
Point d Information Médicaments à base d ivabradine, de codéine, médicaments contenant du diméthyl fumarate, du mycophénolate mofétil/acide mycophénolique, de l octocog alpha, spécialité Eligard (contenant
Plan. Introduction. Les Nouveaux Anticoagulants Oraux et le sujet âgé. Audit de prescription au Centre Hospitalier Geriatrique du Mont d Or
 Plan Introduction Les Nouveaux Anticoagulants Oraux et le sujet âgé Audit de prescription au Centre Hospitalier Geriatrique du Mont d Or Introduction NACO: une actualité brûlante! AVK: Plus forte incidence
Plan Introduction Les Nouveaux Anticoagulants Oraux et le sujet âgé Audit de prescription au Centre Hospitalier Geriatrique du Mont d Or Introduction NACO: une actualité brûlante! AVK: Plus forte incidence
ACTUALITES THERAPEUTIQUES. Dr Sophie PITTION (CHU Nancy) Metz, le 2 Juin 2012
 ACTUALITES THERAPEUTIQUES Dr Sophie PITTION (CHU Nancy) Metz, le 2 Juin 2012 Traitement de fond Objectifs: Réduire le nombre de poussées Arrêter ou freiner la progression du handicap Les traitements disponibles
ACTUALITES THERAPEUTIQUES Dr Sophie PITTION (CHU Nancy) Metz, le 2 Juin 2012 Traitement de fond Objectifs: Réduire le nombre de poussées Arrêter ou freiner la progression du handicap Les traitements disponibles
Spondylarthropathies : diagnostic, place des anti-tnf et surveillance par le généraliste. Pr P. Claudepierre CHU Henri Mondor - Créteil
 Spondylarthropathies : diagnostic, place des anti-tnf et surveillance par le généraliste Pr P. Claudepierre CHU Henri Mondor - Créteil Le Diagnostic Objectif de la démarche diagnostique Diagnostic de SPONDYLARTHROPATHIE
Spondylarthropathies : diagnostic, place des anti-tnf et surveillance par le généraliste Pr P. Claudepierre CHU Henri Mondor - Créteil Le Diagnostic Objectif de la démarche diagnostique Diagnostic de SPONDYLARTHROPATHIE
Table des matières chronologique volume 1 médicaments
 volume 1 médicaments vii Lois - versions consolidées Loi du 15 mai 2007 relative à la répression de la contrefaçon et de la piraterie de droits de propriété intellectuelle........... 3 Chapitre I. Disposition
volume 1 médicaments vii Lois - versions consolidées Loi du 15 mai 2007 relative à la répression de la contrefaçon et de la piraterie de droits de propriété intellectuelle........... 3 Chapitre I. Disposition
AMMA HOSPI-PLAN Déclaration de sinistre
 AMMA HOSPI-PLAN Déclaration de sinistre AMMA ASSURANCES a.m. Association Mutuelle Médicale d Assurances entreprise d assurance mutuelle association d assurance mutuelle à cotisations fixes conformément
AMMA HOSPI-PLAN Déclaration de sinistre AMMA ASSURANCES a.m. Association Mutuelle Médicale d Assurances entreprise d assurance mutuelle association d assurance mutuelle à cotisations fixes conformément
Quelles sont les options?
 Quelles sont les options? Un DVD et un livret d information de Choisir un traitement contre la SP Quelles sont les options? Si votre médecin vous a recommandé de commencer un traitement modificateur de
Quelles sont les options? Un DVD et un livret d information de Choisir un traitement contre la SP Quelles sont les options? Si votre médecin vous a recommandé de commencer un traitement modificateur de
Fiche Produit Profils Médicalisés PHMEV
 Guide méthodologique développé par l équipe de projets ci-dessous : Fiche Produit Profils Médicalisés PHMEV EQUIPE PROJET Chef de projet : Maryline CHARRA, Pharmacien Conseil Responsable de la mission
Guide méthodologique développé par l équipe de projets ci-dessous : Fiche Produit Profils Médicalisés PHMEV EQUIPE PROJET Chef de projet : Maryline CHARRA, Pharmacien Conseil Responsable de la mission
DOSSIER-TYPE DE DEMANDE D AUTORISATION DE CREATION D UN SITE INTERNET DE COMMERCE ELECTRONIQUE DE MEDICAMENTS HUMAINS
 DOSSIER-TYPE DE DEMANDE D AUTORISATION DE CREATION D UN SITE INTERNET DE COMMERCE ELECTRONIQUE DE MEDICAMENTS HUMAINS Références juridiques : Articles L.5125-33 à L.5125-41, article L.5122-6-1 et article
DOSSIER-TYPE DE DEMANDE D AUTORISATION DE CREATION D UN SITE INTERNET DE COMMERCE ELECTRONIQUE DE MEDICAMENTS HUMAINS Références juridiques : Articles L.5125-33 à L.5125-41, article L.5122-6-1 et article
XARELTO (RIVAROXABAN) 2,5 MG - 15 MG - 20 MG, COMPRIMÉS PELLICULÉS GUIDE DE PRESCRIPTION
 Les autorités de santé de l Union Européenne ont assorti la mise sur le marché du médicament Xarelto 2,5 mg; 15 mg et 20 mg de certaines conditions. Le plan obligatoire de minimisation des risques en Belgique
Les autorités de santé de l Union Européenne ont assorti la mise sur le marché du médicament Xarelto 2,5 mg; 15 mg et 20 mg de certaines conditions. Le plan obligatoire de minimisation des risques en Belgique
Bulletin. Le mot du président Quel avenir pour les interférons et le Copaxone?
 Bulletin Numéro 34 I Novembre 2013 Vaincre la Sclérose en Plaques par la recherche Le mot du président Quel avenir pour les interférons et le Copaxone? Depuis 1992, les interférons (IFNs) et le Copaxone
Bulletin Numéro 34 I Novembre 2013 Vaincre la Sclérose en Plaques par la recherche Le mot du président Quel avenir pour les interférons et le Copaxone? Depuis 1992, les interférons (IFNs) et le Copaxone
VOTRE REGIME DE FRAIS DE SANTE. en vigueur au 1 er Janvier 2012. Ensemble du Personnel
 VOTRE REGIME DE FRAIS DE SANTE en vigueur au 1 er Janvier 2012 Ensemble du Personnel Le présent livret a pour objet de vous aider dans vos démarches administratives liées à votre régime frais de santé.
VOTRE REGIME DE FRAIS DE SANTE en vigueur au 1 er Janvier 2012 Ensemble du Personnel Le présent livret a pour objet de vous aider dans vos démarches administratives liées à votre régime frais de santé.
Alemtuzumab (Lemtrada * ) réduit significativement les rechutes dans la sclérose en plaques comparé à l interféron Bêta-1a dans une étude de Phase III
 COMMUNIQUE DE PRESSE Alemtuzumab (Lemtrada * ) réduit significativement les rechutes dans la sclérose en plaques comparé à l interféron Bêta-1a dans une étude de Phase III - Présentation de nouvelles données
COMMUNIQUE DE PRESSE Alemtuzumab (Lemtrada * ) réduit significativement les rechutes dans la sclérose en plaques comparé à l interféron Bêta-1a dans une étude de Phase III - Présentation de nouvelles données
Complément à la circulaire DH/EO 2 n 2000-295 du 30 mai 2000 relative à l'hospitalisation à domicile
 http://www.sante.gouv.fr/adm/dagpb/bo/2001/01-01/a0010017.htm Bulletin Officiel n 2001-1 Direction de l'hospitalisation et de l'organisation des soins Page 1 sur 6 Complément à la circulaire DH/EO 2 n
http://www.sante.gouv.fr/adm/dagpb/bo/2001/01-01/a0010017.htm Bulletin Officiel n 2001-1 Direction de l'hospitalisation et de l'organisation des soins Page 1 sur 6 Complément à la circulaire DH/EO 2 n
Communiqué. Abbott présente à Santé Canada une demande d homologation d HUMIRA pour le traitement du psoriasis POUR PUBLICATION IMMÉDIATE
 POUR PUBLICATION IMMÉDIATE Communiqué Abbott présente à Santé Canada une demande d homologation d HUMIRA pour le traitement du psoriasis Media: Sylvie Légaré (514) 832-7268 Abbott Gabrielle Collu 514)
POUR PUBLICATION IMMÉDIATE Communiqué Abbott présente à Santé Canada une demande d homologation d HUMIRA pour le traitement du psoriasis Media: Sylvie Légaré (514) 832-7268 Abbott Gabrielle Collu 514)
Céphalées vues aux Urgences. Dominique VALADE Centre d Urgence des Céphalées Hôpital Lariboisière PARIS
 Céphalées vues aux Urgences Dominique VALADE Centre d Urgence des Céphalées Hôpital Lariboisière PARIS Deux Objectifs aux Urgences Identifier les céphalées à risque vital Optimiser le traitement des céphalées
Céphalées vues aux Urgences Dominique VALADE Centre d Urgence des Céphalées Hôpital Lariboisière PARIS Deux Objectifs aux Urgences Identifier les céphalées à risque vital Optimiser le traitement des céphalées
COMMISSION DE LA TRANSPARENCE AVIS DE LA COMMISSION. 10 octobre 2001
 COMMISSION DE LA TRANSPARENCE AVIS DE LA COMMISSION 10 octobre 2001 VIRAFERONPEG 50 µg 80 µg 100 µg 120 µg 150 µg, poudre et solvant pour solution injectable B/1 B/4 Laboratoires SCHERING PLOUGH Peginterféron
COMMISSION DE LA TRANSPARENCE AVIS DE LA COMMISSION 10 octobre 2001 VIRAFERONPEG 50 µg 80 µg 100 µg 120 µg 150 µg, poudre et solvant pour solution injectable B/1 B/4 Laboratoires SCHERING PLOUGH Peginterféron
Peut-on reconnaître une tumeur de bas-grade en imagerie conventionnelle? S. Foscolo, L. Taillandier, E. Schmitt, A.S. Rivierre, S. Bracard, CHU NANCY
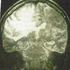 Peut-on reconnaître une tumeur de bas-grade en imagerie conventionnelle? S. Foscolo, L. Taillandier, E. Schmitt, A.S. Rivierre, S. Bracard, CHU NANCY A quoi sert l imagerie conventionnelle dans le diagnostic
Peut-on reconnaître une tumeur de bas-grade en imagerie conventionnelle? S. Foscolo, L. Taillandier, E. Schmitt, A.S. Rivierre, S. Bracard, CHU NANCY A quoi sert l imagerie conventionnelle dans le diagnostic
Entremise: Cigna International Health Services BVBA - Plantin en Moretuslei 299 B 2140 Anvers POLICE D ASSURANCE COLLECTIVE N BCVR 8673
 Entremise: Cigna International Health Services BVBA - Plantin en Moretuslei 299 B 2140 Anvers POLICE D ASSURANCE COLLECTIVE N BCVR 8673 Contrat MALADIE COMPLEMENTAIRE - GROS RISQUES conclu entre L ASSOCIATION
Entremise: Cigna International Health Services BVBA - Plantin en Moretuslei 299 B 2140 Anvers POLICE D ASSURANCE COLLECTIVE N BCVR 8673 Contrat MALADIE COMPLEMENTAIRE - GROS RISQUES conclu entre L ASSOCIATION
Ordelys santé. senior. Ordelys. santé senior. Demande d adhesion immédiate, Adhésion à partir de 55 ans
 Demande d adhesion immédiate, Sans questionnaire de santé, ni délai d attente san Ordelys santé Complémentaire santé senior Ordelys santé senior Adhésion à partir de 55 ans Vos garanties /// ORDELYS SANTE
Demande d adhesion immédiate, Sans questionnaire de santé, ni délai d attente san Ordelys santé Complémentaire santé senior Ordelys santé senior Adhésion à partir de 55 ans Vos garanties /// ORDELYS SANTE
Stelara (ustekinumab)
 Les autorités de santé de l Union européenne ont assorti la mise sur le marché du médicament Stelara de certaines conditions. Le plan obligatoire de minimisation des risques en Belgique, dont cette information
Les autorités de santé de l Union européenne ont assorti la mise sur le marché du médicament Stelara de certaines conditions. Le plan obligatoire de minimisation des risques en Belgique, dont cette information
HEPATITES VIRALES 22/09/09. Infectieux. Mme Daumas
 HEPATITES VIRALES 22/09/09 Mme Daumas Infectieux Introduction I. Hépatite aigu II. Hépatite chronique III. Les différents types d hépatites A. Hépatite A 1. Prévention de la transmission 2. Vaccination
HEPATITES VIRALES 22/09/09 Mme Daumas Infectieux Introduction I. Hépatite aigu II. Hépatite chronique III. Les différents types d hépatites A. Hépatite A 1. Prévention de la transmission 2. Vaccination
Les maladies rares sont définies comme étant des affections avec une prévalence de moins d 1 personne sur 2000. La Belgique s est engagée à suivre l
 Les maladies rares sont définies comme étant des affections avec une prévalence de moins d 1 personne sur 2000. La Belgique s est engagée à suivre l appel européen et à développer un plan d action pour
Les maladies rares sont définies comme étant des affections avec une prévalence de moins d 1 personne sur 2000. La Belgique s est engagée à suivre l appel européen et à développer un plan d action pour
Diplôme d Etat d infirmier Référentiel de compétences
 Annexe II Diplôme d Etat d infirmier Référentiel de compétences Les référentiels d activités et de compétences du métier d infirmier diplômé d Etat ne se substituent pas au cadre réglementaire. En effet,
Annexe II Diplôme d Etat d infirmier Référentiel de compétences Les référentiels d activités et de compétences du métier d infirmier diplômé d Etat ne se substituent pas au cadre réglementaire. En effet,
Révision des descriptions génériques Comment monter un dossier?
 DISPOSITIFS MEDICAUX Révision des descriptions génériques Comment monter un dossier? Guide pour le dossier déposé par les fabricants/distributeurs Adopté en séance de la CEPP* le 13 juillet 2005 *CEPP
DISPOSITIFS MEDICAUX Révision des descriptions génériques Comment monter un dossier? Guide pour le dossier déposé par les fabricants/distributeurs Adopté en séance de la CEPP* le 13 juillet 2005 *CEPP
2007-2012. L agence fédérale des médicaments et des produits de santé fête son cinquième anniversaire
 2007-2012 L agence fédérale des médicaments et des produits de santé fête son cinquième anniversaire Cinq ans : petit coup d œil dans le rétro Cher lecteur, chère lectrice, 2012 est une année particulière
2007-2012 L agence fédérale des médicaments et des produits de santé fête son cinquième anniversaire Cinq ans : petit coup d œil dans le rétro Cher lecteur, chère lectrice, 2012 est une année particulière
SUAREZ VALENCIA Juan Sebastian @toolsdoc MARCHAND Guillaume @drguiloo dmdpost.com Résumé Hélène Caillault
 ATELIER THEMATIQUE : APPLICATIONS POUR TABLETTES ET SMARTPHONES SUAREZ VALENCIA Juan Sebastian @toolsdoc MARCHAND Guillaume @drguiloo dmdpost.com Résumé Hélène Caillault INTRODUCTION La santé mobile, c
ATELIER THEMATIQUE : APPLICATIONS POUR TABLETTES ET SMARTPHONES SUAREZ VALENCIA Juan Sebastian @toolsdoc MARCHAND Guillaume @drguiloo dmdpost.com Résumé Hélène Caillault INTRODUCTION La santé mobile, c
LIGNES DIRECTRICES CLINIQUES TOUT AU LONG DU CONTINUUM DE SOINS : Objectif de ce chapitre. 6.1 Introduction 86
 LIGNES DIRECTRICES CLINIQUES TOUT AU LONG DU CONTINUUM DE SOINS : ÉTABLISSEMENT DE LIENS ENTRE LES PERSONNES CHEZ QUI UN DIAGNOSTIC D INFECTION À VIH A ÉTÉ POSÉ ET LES SERVICES DE SOINS ET DE TRAITEMENT
LIGNES DIRECTRICES CLINIQUES TOUT AU LONG DU CONTINUUM DE SOINS : ÉTABLISSEMENT DE LIENS ENTRE LES PERSONNES CHEZ QUI UN DIAGNOSTIC D INFECTION À VIH A ÉTÉ POSÉ ET LES SERVICES DE SOINS ET DE TRAITEMENT
e-santé du transplanté rénal : la télémédecine au service du greffé
 e-santé du transplanté rénal : la télémédecine au service du greffé Professeur Michèle Kessler CHU de Nancy et réseau Néphrolor L une des applications de la télémédecine est la télésurveillance à domicile,
e-santé du transplanté rénal : la télémédecine au service du greffé Professeur Michèle Kessler CHU de Nancy et réseau Néphrolor L une des applications de la télémédecine est la télésurveillance à domicile,
REFERENTIEL D AUTO-EVALUATION DES PRATIQUES EN ODONTOLOGIE
 REFERENTIEL D AUTO-EVALUATION DES PRATIQUES EN ODONTOLOGIE Janvier 2006 I. PROMOTEURS Association dentaire française (ADF). Haute Autorité de santé (HAS). II. SOURCE Agence nationale d accréditation et
REFERENTIEL D AUTO-EVALUATION DES PRATIQUES EN ODONTOLOGIE Janvier 2006 I. PROMOTEURS Association dentaire française (ADF). Haute Autorité de santé (HAS). II. SOURCE Agence nationale d accréditation et
et l utilisation des traitements biologiques
 et l utilisation des traitements biologiques Choisir le meilleur traitement pour retrouver la qualité de vie que vous êtes en droit d avoir Les agents biologiques (biothérapies) Étant les plus récents
et l utilisation des traitements biologiques Choisir le meilleur traitement pour retrouver la qualité de vie que vous êtes en droit d avoir Les agents biologiques (biothérapies) Étant les plus récents
Item 169 : Évaluation thérapeutique et niveau de preuve
 Item 169 : Évaluation thérapeutique et niveau de preuve COFER, Collège Français des Enseignants en Rhumatologie Date de création du document 2010-2011 Table des matières ENC :...3 SPECIFIQUE :...3 I Différentes
Item 169 : Évaluation thérapeutique et niveau de preuve COFER, Collège Français des Enseignants en Rhumatologie Date de création du document 2010-2011 Table des matières ENC :...3 SPECIFIQUE :...3 I Différentes
GUICHET D ACCÈS À UN MÉDECIN DE FAMILLE
 GUICHET D ACCÈS À UN MÉDECIN DE FAMILLE Vous êtes à la recherche d un médecin de famille? Le CSSS-IUGS peut vous aider. Inscrivez-vous au guichet d accès à un médecin de famille en remplissant le formulaire
GUICHET D ACCÈS À UN MÉDECIN DE FAMILLE Vous êtes à la recherche d un médecin de famille? Le CSSS-IUGS peut vous aider. Inscrivez-vous au guichet d accès à un médecin de famille en remplissant le formulaire
Association lymphome malin-traitement par Interféron-α- sarcoïdose
 Association lymphome malin-traitement par Interféron-α- sarcoïdose Auteurs Cendrine Godet (*) Jean-Pierre Frat (**) Cédric Landron (*) Lydia Roy (***) Paul Ardilouze (****) Jean-Pierre Tasu (****) (*)
Association lymphome malin-traitement par Interféron-α- sarcoïdose Auteurs Cendrine Godet (*) Jean-Pierre Frat (**) Cédric Landron (*) Lydia Roy (***) Paul Ardilouze (****) Jean-Pierre Tasu (****) (*)
Céphalées. 1- Mise au point sur la migraine 2- Quand s inquiéter face à une céphalée. APP du DENAISIS
 Céphalées 1- Mise au point sur la migraine 2- Quand s inquiéter face à une céphalée EPU DENAIN -14 novembre 2006 Dr Kubat-Majid14 novembre 2006 Dr KUBAT-MAJID Céphalées 1 Mise au point sur la migraine
Céphalées 1- Mise au point sur la migraine 2- Quand s inquiéter face à une céphalée EPU DENAIN -14 novembre 2006 Dr Kubat-Majid14 novembre 2006 Dr KUBAT-MAJID Céphalées 1 Mise au point sur la migraine
Ordonnance du DFI sur les prestations dans l assurance obligatoire des soins en cas de maladie
 Ordonnance du DFI sur les prestations dans l assurance obligatoire des soins en cas de maladie (Ordonnance sur les prestations de l assurance des soins, OPAS) Modification du 14 juin 2010 Le Département
Ordonnance du DFI sur les prestations dans l assurance obligatoire des soins en cas de maladie (Ordonnance sur les prestations de l assurance des soins, OPAS) Modification du 14 juin 2010 Le Département
LISTE DES ACTES ET PRESTATIONS - AFFECTION DE LONGUE DURÉE HÉPATITE CHRONIQUE B
 LISTE DES ACTES ET PRESTATIONS - AFFECTION DE LONGUE DURÉE HÉPATITE CHRONIQUE B Actualisation février 2009 Ce document est téléchargeable sur www.has-sante.fr Haute Autorité de santé Service communication
LISTE DES ACTES ET PRESTATIONS - AFFECTION DE LONGUE DURÉE HÉPATITE CHRONIQUE B Actualisation février 2009 Ce document est téléchargeable sur www.has-sante.fr Haute Autorité de santé Service communication
EXEMPLE DE METHODOLOGIE POUR L ELABORATION D UN PROTOCOLE DOULEUR Marie AUBRY Infirmière référente douleur Hôpital TENON AP-HP Paris XX e SOMMAIRE
 EXEMPLE DE METHODOLOGIE POUR L ELABORATION D UN PROTOCOLE DOULEUR Marie AUBRY Infirmière référente douleur Hôpital TENON AP-HP Paris XX e SOMMAIRE Etape n 1 : Faire l état des lieux Identifier la situation
EXEMPLE DE METHODOLOGIE POUR L ELABORATION D UN PROTOCOLE DOULEUR Marie AUBRY Infirmière référente douleur Hôpital TENON AP-HP Paris XX e SOMMAIRE Etape n 1 : Faire l état des lieux Identifier la situation
AGRéMENT DES PHARMACIENS HOSPITALIERS
 COMMISSION D AGRÉMENT DES PHARMACIENS HOSPITALIERS AGRéMENT DES PHARMACIENS HOSPITALIERS Pourquoi un agrément en tant que Pharmacien hospitalier? 4 introduction 5 notice explicative I. La demande d InscrIptIon
COMMISSION D AGRÉMENT DES PHARMACIENS HOSPITALIERS AGRéMENT DES PHARMACIENS HOSPITALIERS Pourquoi un agrément en tant que Pharmacien hospitalier? 4 introduction 5 notice explicative I. La demande d InscrIptIon
GUIDE Gestion en ligne de votre compte pour la phytolicence (18/05/2015; v.4)
 GUIDE Gestion en ligne de votre compte pour la phytolicence (18/05/2015; v.4) Attention! Les navigateurs recommandés pour obtenir un rendu optimal de l'application sont Internet Explorer 8 et 9. Il est
GUIDE Gestion en ligne de votre compte pour la phytolicence (18/05/2015; v.4) Attention! Les navigateurs recommandés pour obtenir un rendu optimal de l'application sont Internet Explorer 8 et 9. Il est
Charte pour la communication sur internet des entreprises pharmaceutiques
 DIRECTION DE L EVALUATION DE LA PUBLICITE, DES PRODUITS COSMETIQUES ET DES BIOCIDES Charte pour la communication sur internet des entreprises pharmaceutiques Préambule Mise à jour 2010 Au plan mondial,
DIRECTION DE L EVALUATION DE LA PUBLICITE, DES PRODUITS COSMETIQUES ET DES BIOCIDES Charte pour la communication sur internet des entreprises pharmaceutiques Préambule Mise à jour 2010 Au plan mondial,
QUELLES SONT LES OPTIONS DU TRAITEMENT DE LA LMC?
 QUELLES SONT LES OPTIONS DU TRAITEMENT DE LA LMC? On vous a diagnostiqué une leucémie myéloïde chronique (LMC) et il se peut que vous ayez déjà débuté un traitement. Le traitement de la LMC dépend largement
QUELLES SONT LES OPTIONS DU TRAITEMENT DE LA LMC? On vous a diagnostiqué une leucémie myéloïde chronique (LMC) et il se peut que vous ayez déjà débuté un traitement. Le traitement de la LMC dépend largement
Projet de grossesse : informations, messages de prévention, examens à proposer
 DOCUMENT D INFORMATION POUR LES PROFESSIONNELS Projet de grossesse : informations, messages de prévention, examens à proposer Septembre 2009 DÉFINITION ET OBJECTIF Dès lors qu ils expriment un projet de
DOCUMENT D INFORMATION POUR LES PROFESSIONNELS Projet de grossesse : informations, messages de prévention, examens à proposer Septembre 2009 DÉFINITION ET OBJECTIF Dès lors qu ils expriment un projet de
Ordonnance collective
 Centre de Santé et de Services sociaux de Québec-Nord NUMÉRO DE L ORDONNANCE: OC-31 Ordonnance collective Nom de l ordonnance: Initier des analyses de laboratoire pour le suivi de la clientèle présentant
Centre de Santé et de Services sociaux de Québec-Nord NUMÉRO DE L ORDONNANCE: OC-31 Ordonnance collective Nom de l ordonnance: Initier des analyses de laboratoire pour le suivi de la clientèle présentant
QU EST-CE QUE LA PROPHYLAXIE?
 QU EST-CE QUE LA PROPHYLAXIE? TABLES DES MATIÈRES Publié par la Fédération mondiale de l hémophilie (FMH) Fédération mondiale de l hémophilie, 2014 La FMH encourage la traduction et la redistribution de
QU EST-CE QUE LA PROPHYLAXIE? TABLES DES MATIÈRES Publié par la Fédération mondiale de l hémophilie (FMH) Fédération mondiale de l hémophilie, 2014 La FMH encourage la traduction et la redistribution de
Pharmacovigilance des nouveaux anticoagulants oraux
 Pharmacovigilance des nouveaux anticoagulants oraux Dr A.Lillo-Le Louët, Centre Régional de Pharmacovigilance (CRPV) Paris-HEGP Avec avec Dr P.Lainé, CRPV - Angers Préambule Directeur du Centre Régional
Pharmacovigilance des nouveaux anticoagulants oraux Dr A.Lillo-Le Louët, Centre Régional de Pharmacovigilance (CRPV) Paris-HEGP Avec avec Dr P.Lainé, CRPV - Angers Préambule Directeur du Centre Régional
Vaccinations pour les professionnels : actualités
 Vaccinations pour les professionnels : actualités Dominique Abiteboul Service de Santé au Travail Hôpital Bichat - Claude Bernard Paris GERES Les vaccins A (H1N1)v 4QUESTIONS +++++ Pas assez de recul???
Vaccinations pour les professionnels : actualités Dominique Abiteboul Service de Santé au Travail Hôpital Bichat - Claude Bernard Paris GERES Les vaccins A (H1N1)v 4QUESTIONS +++++ Pas assez de recul???
La complémentaire santé des salariés des établissements et services pour personnes inadaptées et handicapées
 La complémentaire santé des salariés des établissements et services pour personnes inadaptées et handicapées Une complémentaire santé obligatoire pour les salariés de la CCN 1966 L avenant 328 du 1 er
La complémentaire santé des salariés des établissements et services pour personnes inadaptées et handicapées Une complémentaire santé obligatoire pour les salariés de la CCN 1966 L avenant 328 du 1 er
Vous et votre traitement anticoagulant par AVK (antivitamine K)
 Ce carnet a été réalisé sous la coordination de l Agence française de sécurité sanitaire des produits de santé (Afssaps). Vous et votre traitement anticoagulant par AVK (antivitamine K) Carte à découper
Ce carnet a été réalisé sous la coordination de l Agence française de sécurité sanitaire des produits de santé (Afssaps). Vous et votre traitement anticoagulant par AVK (antivitamine K) Carte à découper
Humira Solution pour injection dans un injecteur prérempli
 Humira Solution pour injection dans un injecteur prérempli ABBOTT OEMéd Qu est-ce que Humira et quand doit-il être utilisé? Humira est un médicament qui limite le processus inflammatoire dans le cadre
Humira Solution pour injection dans un injecteur prérempli ABBOTT OEMéd Qu est-ce que Humira et quand doit-il être utilisé? Humira est un médicament qui limite le processus inflammatoire dans le cadre
La prise en charge de votre polyarthrite rhumatoïde
 G U I D E - A F F E C T I O N D E L O N G U E D U R É E La prise en charge de votre polyarthrite rhumatoïde Vivre avec une polyarthrite rhumatoïde Décembre 2008 Pourquoi ce guide? Votre médecin traitant
G U I D E - A F F E C T I O N D E L O N G U E D U R É E La prise en charge de votre polyarthrite rhumatoïde Vivre avec une polyarthrite rhumatoïde Décembre 2008 Pourquoi ce guide? Votre médecin traitant
Questions / Réponses. Troubles du sommeil : stop à la prescription systématique de somnifères chez les personnes âgées
 Questions / Réponses Troubles du sommeil : stop à la prescription systématique de somnifères chez les personnes âgées Quelques chiffres sur les troubles du sommeil et la consommation de benzodiazépines
Questions / Réponses Troubles du sommeil : stop à la prescription systématique de somnifères chez les personnes âgées Quelques chiffres sur les troubles du sommeil et la consommation de benzodiazépines
Migraine et Abus de Médicaments
 Migraine et Abus de Médicaments Approches diagnostiques et thérapeutiques des Céphalées Chroniques Quotidiennes Pr D. DEPLANQUE Département de Pharmacologie médicale EA 1046, Institut de Médecine Prédictive
Migraine et Abus de Médicaments Approches diagnostiques et thérapeutiques des Céphalées Chroniques Quotidiennes Pr D. DEPLANQUE Département de Pharmacologie médicale EA 1046, Institut de Médecine Prédictive
MINISTERE DE LA SANTE ET DES SOLIDARITES DIRECTION GENERALE DE LA SANTE- DDASS DE SEINE MARITIME
 Département des situations d urgence sanitaire Personne chargée du dossier : Evelyne FALIP/Nicole BOHIC Tél : 01 40 56 59 65/02 32 18 31 66 evelyne.falip@sante.gouv.fr MINISTERE DE LA SANTE ET DES SOLIDARITES
Département des situations d urgence sanitaire Personne chargée du dossier : Evelyne FALIP/Nicole BOHIC Tél : 01 40 56 59 65/02 32 18 31 66 evelyne.falip@sante.gouv.fr MINISTERE DE LA SANTE ET DES SOLIDARITES
N o de contrat : Je demande par la présente une révision de la surprime concernant le numéro de contrat susmentionné. Signé à ce jour de 20
 RÉVISION DE SURPRIME Nom : Prénom : Date de naissance : - - Année Mois Jour N o de contrat : Je demande par la présente une révision de la surprime concernant le numéro de contrat susmentionné. Signé à
RÉVISION DE SURPRIME Nom : Prénom : Date de naissance : - - Année Mois Jour N o de contrat : Je demande par la présente une révision de la surprime concernant le numéro de contrat susmentionné. Signé à
admission aux urgences
 Société française de neurologie RÉFÉRENTIEL D AUTO-ÉVALUATION DES PRATIQUES EN NEUROLOGIE Prise en charge hospitalière initiale des personnes ayant fait un accident vasculaire cérébral (AVC) : admission
Société française de neurologie RÉFÉRENTIEL D AUTO-ÉVALUATION DES PRATIQUES EN NEUROLOGIE Prise en charge hospitalière initiale des personnes ayant fait un accident vasculaire cérébral (AVC) : admission
INDUCTION DES LYMPHOCYTES T- RÉGULATEURS PAR IL2 A TRÈS FAIBLE DOSE DANS LES PATHOLOGIES AUTO- IMMUNES ET INFLAMMATOIRES APPROCHE TRANSNOSOGRAPHIQUE
 INDUCTION DES LYMPHOCYTES T- RÉGULATEURS PAR IL2 A TRÈS FAIBLE DOSE DANS LES PATHOLOGIES AUTO- IMMUNES ET INFLAMMATOIRES APPROCHE TRANSNOSOGRAPHIQUE Etude clinique N NCT01988506 Inves9gateur coordinateur
INDUCTION DES LYMPHOCYTES T- RÉGULATEURS PAR IL2 A TRÈS FAIBLE DOSE DANS LES PATHOLOGIES AUTO- IMMUNES ET INFLAMMATOIRES APPROCHE TRANSNOSOGRAPHIQUE Etude clinique N NCT01988506 Inves9gateur coordinateur
Observation. Merci à l équipe de pharmaciens FormUtip iatro pour ce cas
 Cas clinique M. ZAC Observation Mr ZAC ans, 76 ans, 52 kg, est admis aux urgences pour des algies fessières invalidantes, résistantes au AINS. Ses principaux antécédents sont les suivants : une thrombopénie
Cas clinique M. ZAC Observation Mr ZAC ans, 76 ans, 52 kg, est admis aux urgences pour des algies fessières invalidantes, résistantes au AINS. Ses principaux antécédents sont les suivants : une thrombopénie
Don de moelle osseuse. pour. la vie. Agence relevant du ministère de la santé. Agence relevant du ministère de la santé
 Don de moelle osseuse Engagez-VOUS pour la vie 1 Pourquoi devenir veilleur de vie? Le don de moelle osseuse peut sauver des vies La greffe de moelle osseuse représente une chance importante de guérison
Don de moelle osseuse Engagez-VOUS pour la vie 1 Pourquoi devenir veilleur de vie? Le don de moelle osseuse peut sauver des vies La greffe de moelle osseuse représente une chance importante de guérison
DOMAINE 7 RELATIONS ET RÔLES
 DOMAINE 7 RELATIONS ET RÔLES 327 Allaitement maternel inefficace (00104) 327 Allaitement maternel interrompu (00105) 328 Motivation à améliorer l allaitement maternel (00106) 329 Tension dans l exercice
DOMAINE 7 RELATIONS ET RÔLES 327 Allaitement maternel inefficace (00104) 327 Allaitement maternel interrompu (00105) 328 Motivation à améliorer l allaitement maternel (00106) 329 Tension dans l exercice
Formation sur la sécurisation du circuit du médicament
 Formation sur la sécurisation du circuit du médicament Virginie Roué, Ingénieur Qualité-Risques Réseau AQuaREL Santé Dr Brigitte Paulmier, Pharmacien coordonnateur de la gestion des risques CH Saumur CONTEXTE
Formation sur la sécurisation du circuit du médicament Virginie Roué, Ingénieur Qualité-Risques Réseau AQuaREL Santé Dr Brigitte Paulmier, Pharmacien coordonnateur de la gestion des risques CH Saumur CONTEXTE
Désignation/mise en place des points focaux nationaux RSI
 1 GUIDE DES POINTS FOCAUX NATIONAUX RSI Désignation/mise en place des points focaux nationaux RSI 1. Introduction Le Règlement sanitaire international (2005) (RSI(2005)) définit un point focal national
1 GUIDE DES POINTS FOCAUX NATIONAUX RSI Désignation/mise en place des points focaux nationaux RSI 1. Introduction Le Règlement sanitaire international (2005) (RSI(2005)) définit un point focal national
Déclarations européennes de la pharmacie hospitalière
 Déclarations européennes de la pharmacie hospitalière Les pages qui suivent constituent les Déclarations européennes de la pharmacie hospitalière. Elles représentent l expression consensuelle de ce que
Déclarations européennes de la pharmacie hospitalière Les pages qui suivent constituent les Déclarations européennes de la pharmacie hospitalière. Elles représentent l expression consensuelle de ce que
La complémentaire santé des salariés de la CCN PACT ARIM
 La complémentaire santé des salariés de la CCN PACT ARIM Une complémentaire santé obligatoire pour les salariés de la CCN PACT ARIM L accord du 30 septembre 2014 instaure un régime frais de santé. dans
La complémentaire santé des salariés de la CCN PACT ARIM Une complémentaire santé obligatoire pour les salariés de la CCN PACT ARIM L accord du 30 septembre 2014 instaure un régime frais de santé. dans
Garantie Senior Régime général ou local Sécurité Sociale
 Garantie Senior Régime général ou local Sécurité Sociale Remboursement total R.O. + Mutuelle Visites, consultations, actes, majorations des médecins généraliste et spécialistes 150% Analyses et examens
Garantie Senior Régime général ou local Sécurité Sociale Remboursement total R.O. + Mutuelle Visites, consultations, actes, majorations des médecins généraliste et spécialistes 150% Analyses et examens
Information à un nouveau donneur de cellules souches du sang
 Information à un nouveau donneur de cellules souches du sang Pour des raisons de simplification, les dénominations masculines s appliquent également aux femmes. La transplantation de cellules souches du
Information à un nouveau donneur de cellules souches du sang Pour des raisons de simplification, les dénominations masculines s appliquent également aux femmes. La transplantation de cellules souches du
Vaccinations - Rédaction Dr BOUTON
 20-14 Vaccinations - Rédaction Dr BOUTON Chaque personnel navigant est responsable de la mise à jour des ses vaccins. 1 - VACCINATION OBLIGATOIRE La vaccination contre la fièvre jaune (vaccination anti-amarile)
20-14 Vaccinations - Rédaction Dr BOUTON Chaque personnel navigant est responsable de la mise à jour des ses vaccins. 1 - VACCINATION OBLIGATOIRE La vaccination contre la fièvre jaune (vaccination anti-amarile)
DÉFICITS IMMUNITAIRE COMMUN VARIABLE
 DÉFICITS IMMUNITAIRE COMMUN VARIABLE Le présent livret a été rédigé à l attention des patients et de leurs familles. Il ne doit pas remplacer les conseils d un spécialiste en immunologie. 1 Egalement Disponible
DÉFICITS IMMUNITAIRE COMMUN VARIABLE Le présent livret a été rédigé à l attention des patients et de leurs familles. Il ne doit pas remplacer les conseils d un spécialiste en immunologie. 1 Egalement Disponible
ANNEXE I RESUME DES CARACTERISTIQUES DU PRODUIT
 ANNEXE I RESUME DES CARACTERISTIQUES DU PRODUIT 1 1. DENOMINATION DU MÉDICAMENT Betaferon 250 microgrammes/ml, poudre et solvant pour solution injectable. 2. COMPOSITION QUALITATIVE ET QUANTITATIVE Interféron
ANNEXE I RESUME DES CARACTERISTIQUES DU PRODUIT 1 1. DENOMINATION DU MÉDICAMENT Betaferon 250 microgrammes/ml, poudre et solvant pour solution injectable. 2. COMPOSITION QUALITATIVE ET QUANTITATIVE Interféron
Migraine et céphalées de tension: diagnostic différentiel et enjeux thérapeutiques
 Migraine et céphalées de tension: diagnostic différentiel et enjeux thérapeutiques Dr Solène de Gaalon Service de neurologie- CHU Nantes Société française des migraines et céphalées Céphalées de tension
Migraine et céphalées de tension: diagnostic différentiel et enjeux thérapeutiques Dr Solène de Gaalon Service de neurologie- CHU Nantes Société française des migraines et céphalées Céphalées de tension
ANNEXE I RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
 ANNEXE I RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT 1 1. DÉNOMINATION DU MÉDICAMENT VÉTÉRINAIRE Equip WNV - émulsion injectable pour chevaux 2. COMPOSITION QUALITATIVE ET QUANTITATIVE Chaque dose de 1 ml contient:
ANNEXE I RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT 1 1. DÉNOMINATION DU MÉDICAMENT VÉTÉRINAIRE Equip WNV - émulsion injectable pour chevaux 2. COMPOSITION QUALITATIVE ET QUANTITATIVE Chaque dose de 1 ml contient:
GUIDE D INFORMATIONS A LA PREVENTION DE L INSUFFISANCE RENALE
 GUIDE D INFORMATIONS A LA PREVENTION DE L INSUFFISANCE RENALE SOURCES : ligues reins et santé A LA BASE, TOUT PART DES REINS Organes majeurs de l appareil urinaire, les reins permettent d extraire les
GUIDE D INFORMATIONS A LA PREVENTION DE L INSUFFISANCE RENALE SOURCES : ligues reins et santé A LA BASE, TOUT PART DES REINS Organes majeurs de l appareil urinaire, les reins permettent d extraire les
Que représentent les Spondyloarthrites Axiales Non Radiographiques? Pascal Claudepierre CHU Mondor - Créteil
 Que représentent les Spondyloarthrites Axiales Non Radiographiques? Pascal Claudepierre CHU Mondor - Créteil Liens d intérêt Intérêts financiers : aucun Liens durables ou permanents : aucun Interventions
Que représentent les Spondyloarthrites Axiales Non Radiographiques? Pascal Claudepierre CHU Mondor - Créteil Liens d intérêt Intérêts financiers : aucun Liens durables ou permanents : aucun Interventions
Bienvenue chez votre pharmacien
 Bienvenue chez votre pharmacien En première ligne Le pharmacien Prestataire de soins à part entière, le pharmacien occupe aujourd hui une place centrale au cœur de notre système de santé. Disponible sans
Bienvenue chez votre pharmacien En première ligne Le pharmacien Prestataire de soins à part entière, le pharmacien occupe aujourd hui une place centrale au cœur de notre système de santé. Disponible sans
Qu est-ce qu un sarcome?
 Qu est-ce qu un sarcome? Qu est-ce qu une tumeur? Une tumeur est une prolifération anormale de cellules. Les tumeurs ne devraient donc pas automatiquement être associées à un cancer. Certaines tumeurs
Qu est-ce qu un sarcome? Qu est-ce qu une tumeur? Une tumeur est une prolifération anormale de cellules. Les tumeurs ne devraient donc pas automatiquement être associées à un cancer. Certaines tumeurs
Numéro 18 l 2011. l Traitements pharmacologiques et SEP
 Numéro 18 l 2011 l Traitements pharmacologiques et SEP Comité de Rédaction Fédération Internationale contre la Sclérose en Plaques (MSIF) La mission de la MSIF est de diriger le mouvement international
Numéro 18 l 2011 l Traitements pharmacologiques et SEP Comité de Rédaction Fédération Internationale contre la Sclérose en Plaques (MSIF) La mission de la MSIF est de diriger le mouvement international
COMMISSION DE LA TRANSPARENCE AVIS. 18 janvier 2006
 COMMISSION DE LA TRANSPARENCE AVIS 18 janvier 2006 ADVATE 1500 UI, poudre et solvant pour solution injectable 1 flacon(s) en verre de 1 500 UI - 1 flacon(s) en verre de 5 ml avec matériel(s) de perfusion(s)
COMMISSION DE LA TRANSPARENCE AVIS 18 janvier 2006 ADVATE 1500 UI, poudre et solvant pour solution injectable 1 flacon(s) en verre de 1 500 UI - 1 flacon(s) en verre de 5 ml avec matériel(s) de perfusion(s)
LA CMU COMPLÉMENTAIRE
 Vous êtes artisan ou commerçant, le RSI est votre interlocuteur social unique pour toute votre protection sociale personnelle obligatoire. Vous exercez une profession libérale, le RSI gère votre assurance
Vous êtes artisan ou commerçant, le RSI est votre interlocuteur social unique pour toute votre protection sociale personnelle obligatoire. Vous exercez une profession libérale, le RSI gère votre assurance
COMMISSION DE LA TRANSPARENCE AVIS. 1 er octobre 2008
 COMMISSION DE LA TRANSPARENCE AVIS 1 er octobre 2008 Examen dans le cadre de la réévaluation du service médical rendu de la classe des IMAO B, en application de l article R 163-21 du code de la sécurité
COMMISSION DE LA TRANSPARENCE AVIS 1 er octobre 2008 Examen dans le cadre de la réévaluation du service médical rendu de la classe des IMAO B, en application de l article R 163-21 du code de la sécurité
Dracunculose Association Française des Enseignants de Parasitologie et Mycologie (ANOFEL)
 Dracunculose Association Française des Enseignants de Parasitologie et Mycologie (ANOFEL) 2014 1 Table des matières Introduction... 3 1. Historique et actualité... 3 2. Agent pathogène et cycle... 4 3.
Dracunculose Association Française des Enseignants de Parasitologie et Mycologie (ANOFEL) 2014 1 Table des matières Introduction... 3 1. Historique et actualité... 3 2. Agent pathogène et cycle... 4 3.
Migraine : traitement de la crise. Comment utiliser les triptans?
 Migraine : traitement de la crise Comment utiliser les triptans? 6 ème congrès national de lutte contre la douleur 19-20 Mars Alger Alain Serrie Service de Médecine de la douleur, médecine palliative et
Migraine : traitement de la crise Comment utiliser les triptans? 6 ème congrès national de lutte contre la douleur 19-20 Mars Alger Alain Serrie Service de Médecine de la douleur, médecine palliative et
Les nouveaux anticoagulants ont ils une place aux Urgences?
 Les nouveaux anticoagulants ont ils une place aux Urgences? Emmanuel Andrès Service de Médecine Interne Diabète et Maladies métabolique Clinique Médicale B - CHRU de Strasbourg Remerciements au Professeur
Les nouveaux anticoagulants ont ils une place aux Urgences? Emmanuel Andrès Service de Médecine Interne Diabète et Maladies métabolique Clinique Médicale B - CHRU de Strasbourg Remerciements au Professeur
Diabète de type 1 de l enfant et de l adolescent
 GUIDE - AFFECTION DE LONGUE DURÉE Diabète de type 1 de l enfant et de l adolescent Juillet 2007 Juillet 2007 1 Ce document est téléchargeable sur www.has-sante.fr Haute Autorité de santé Service communication
GUIDE - AFFECTION DE LONGUE DURÉE Diabète de type 1 de l enfant et de l adolescent Juillet 2007 Juillet 2007 1 Ce document est téléchargeable sur www.has-sante.fr Haute Autorité de santé Service communication
La recherche d assurance maladie à l étranger Procédure à l usage des CPAS
 La recherche d assurance maladie à l étranger Procédure à l usage des CPAS CAAMI Service Relations internationales (iri.enquete@caami.be) www.caami.be Introduction La Caisse Auxiliaire d Assurance Maladie-Invalidité
La recherche d assurance maladie à l étranger Procédure à l usage des CPAS CAAMI Service Relations internationales (iri.enquete@caami.be) www.caami.be Introduction La Caisse Auxiliaire d Assurance Maladie-Invalidité
Épidémiologie des accidents hémorragiques dus aux anticoagulants oraux
 Épidémiologie des accidents hémorragiques dus aux anticoagulants oraux Docteur Marie-Josèphe JEAN-PASTOR Centre Régional Pharmacovigilance Marseille-Provence-Corse Hôpital Sainte Marguerite AP-HM Tél :
Épidémiologie des accidents hémorragiques dus aux anticoagulants oraux Docteur Marie-Josèphe JEAN-PASTOR Centre Régional Pharmacovigilance Marseille-Provence-Corse Hôpital Sainte Marguerite AP-HM Tél :
Rôle de l Assurance Qualité dans la recherche clinique
 Rôle de l Assurance Qualité dans la recherche clinique Pôle Qualité / Gestion des Risques 05 Janvier 2012 Plan La qualité d une recherche c est quoi? Bonnes Pratiques Cliniques (BPC) Responsabilités des
Rôle de l Assurance Qualité dans la recherche clinique Pôle Qualité / Gestion des Risques 05 Janvier 2012 Plan La qualité d une recherche c est quoi? Bonnes Pratiques Cliniques (BPC) Responsabilités des
DISTRIBUTION DU TRAITEMENT MEDICAMENTEUX PAR VOIE ORALE PAR L INFIRMIERE : RISQUE DE NON PRISE DU TRAITEMENT MEDICAMENTEUX PAR LE PATIENT
 INSTITUT DE FORMATION DES CADRES DE SANTE ASSISTANCE PUBLIQUE HOPITAUX DE PARIS ACTIVITE PROFESSIONNELLE N 8 : LE CADRE GERE LES RISQUES CONCERNANT LES PRESTATIONS, LES CONDITIONS DE TRAVAIL DES PERSONNELS,
INSTITUT DE FORMATION DES CADRES DE SANTE ASSISTANCE PUBLIQUE HOPITAUX DE PARIS ACTIVITE PROFESSIONNELLE N 8 : LE CADRE GERE LES RISQUES CONCERNANT LES PRESTATIONS, LES CONDITIONS DE TRAVAIL DES PERSONNELS,
Saisie en ligne des dossiers de demande de subvention Extranet
 Saisie en ligne des dossiers de demande de subvention Extranet Guide de l utilisateur V 3.0 - décembre 2013 Sommaire / Référencement de votre organisme par l Acsé p. 3 / Ecran de connexion p. 4 / Rubrique
Saisie en ligne des dossiers de demande de subvention Extranet Guide de l utilisateur V 3.0 - décembre 2013 Sommaire / Référencement de votre organisme par l Acsé p. 3 / Ecran de connexion p. 4 / Rubrique
ECOLE SUPERIEURE DE L EDUCATION NATIONALE
 ECOLE SUPERIEURE DE L EDUCATION NATIONALE Formation des Chefs d Etablissement d Affectation Management adaptatif et délégations Support participants SOMMAIRE La formation dans son contexte p.3 Les facteurs
ECOLE SUPERIEURE DE L EDUCATION NATIONALE Formation des Chefs d Etablissement d Affectation Management adaptatif et délégations Support participants SOMMAIRE La formation dans son contexte p.3 Les facteurs
Don d organes et mort cérébrale. Drs JL Frances & F Hervé Praticiens hospitaliers en réanimation polyvalente Hôpital Laennec, Quimper
 Don d organes et mort cérébrale Drs JL Frances & F Hervé Praticiens hospitaliers en réanimation polyvalente Hôpital Laennec, Quimper La mort cérébrale Cessation irréversible de toute fonction cérébrale
Don d organes et mort cérébrale Drs JL Frances & F Hervé Praticiens hospitaliers en réanimation polyvalente Hôpital Laennec, Quimper La mort cérébrale Cessation irréversible de toute fonction cérébrale
Une échelle d évaluation semistructurée. B. Gravier
 Une échelle d évaluation semistructurée : la HCR-20 B. Gravier Exemple de jugement clinique structuré: The Historical Clinical Risk Management 20 item scale HCR - 20 Echelle utilisée par les cliniciens
Une échelle d évaluation semistructurée : la HCR-20 B. Gravier Exemple de jugement clinique structuré: The Historical Clinical Risk Management 20 item scale HCR - 20 Echelle utilisée par les cliniciens
G U I D E - A F F E C T I O N D E L O N G U E D U R É E. La prise en charge de votre mélanome cutané
 G U I D E - A F F E C T I O N D E L O N G U E D U R É E La prise en charge de votre mélanome cutané Mars 2010 Pourquoi ce guide? Votre médecin traitant vous a remis ce guide pour vous informer sur le mélanome
G U I D E - A F F E C T I O N D E L O N G U E D U R É E La prise en charge de votre mélanome cutané Mars 2010 Pourquoi ce guide? Votre médecin traitant vous a remis ce guide pour vous informer sur le mélanome
LE FINANCEMENT DES HOPITAUX EN BELGIQUE. Prof. G. DURANT
 LE FINANCEMENT DES HOPITAUX EN BELGIQUE Prof. G. DURANT La Belgique (11 millions d habitants) est un pays fédéral. Le financement est organisé au niveau national sauf le financement des infrastructures
LE FINANCEMENT DES HOPITAUX EN BELGIQUE Prof. G. DURANT La Belgique (11 millions d habitants) est un pays fédéral. Le financement est organisé au niveau national sauf le financement des infrastructures
Contribution du Syndicat national des pharmaciens praticiens hospitaliers (SNPHPU)
 Contribution du Syndicat national des pharmaciens praticiens hospitaliers (SNPHPU) pour un cahier des charges des bases de données des produits de santé exigeant Rappelons pour mémoire que le législateur
Contribution du Syndicat national des pharmaciens praticiens hospitaliers (SNPHPU) pour un cahier des charges des bases de données des produits de santé exigeant Rappelons pour mémoire que le législateur
COMMISSION D AGRÉMENT DES PHARMACIENS HOSPITALIERS. AGRéMENT DES PHARMACIENS HOSPITALIERS
 COMMISSION D AGRÉMENT DES PHARMACIENS HOSPITALIERS AGRéMENT DES PHARMACIENS HOSPITALIERS sommaire Pourquoi un agrément en tant que spécialiste pharmacien hospitalier? 4 Introduction 5 Notice explicative
COMMISSION D AGRÉMENT DES PHARMACIENS HOSPITALIERS AGRéMENT DES PHARMACIENS HOSPITALIERS sommaire Pourquoi un agrément en tant que spécialiste pharmacien hospitalier? 4 Introduction 5 Notice explicative
Les nouveaux traitements du psoriasis
 Les nouveaux traitements du psoriasis Ci-après, vous trouverez 3 articles, parus récemment, parmi d'autres tout aussi intéressants, dans notre bulletin trimestriel Pso Magazine: - un extrait de l'exposé
Les nouveaux traitements du psoriasis Ci-après, vous trouverez 3 articles, parus récemment, parmi d'autres tout aussi intéressants, dans notre bulletin trimestriel Pso Magazine: - un extrait de l'exposé
www.dondemoelleosseuse.fr
 Agence relevant du ministère de la santé www.dondemoelleosseuse.fr 01 Pourquoi devenir Veilleur de Vie? Le don de moelle osseuse peut sauver des vies. Chaque année, des milliers de personnes - enfants
Agence relevant du ministère de la santé www.dondemoelleosseuse.fr 01 Pourquoi devenir Veilleur de Vie? Le don de moelle osseuse peut sauver des vies. Chaque année, des milliers de personnes - enfants
Réglementation. Import/Export CHAPITRE 6
 CHAPITRE 6 Réglementation Import/Export Dans ce chapitre: Rubriques / pages Prescriptions du Traité/ 187 Mesures Législatives et Administratives / 191 Conformité / 194 Diffusion / 196 Programme d Assistance
CHAPITRE 6 Réglementation Import/Export Dans ce chapitre: Rubriques / pages Prescriptions du Traité/ 187 Mesures Législatives et Administratives / 191 Conformité / 194 Diffusion / 196 Programme d Assistance
