Jaydess (13,5 mg lévonorgestrel) Système de diffusion intra-utérin
|
|
|
- François-Xavier Noël
- il y a 5 ans
- Total affichages :
Transcription
1 Les autorités belges de santé publique ont assorti la mise sur le marché du médicament Jaydess de certaines conditions. Le plan obligatoire de minimisation des risques en Belgique, dont cette information fait partie, est une mesure prise pour garantir une utilisation sûre et efficace du médicament Jaydess (RMA version 12/2017). Jaydess (13,5 mg lévonorgestrel) Système de diffusion intra-utérin Information pour les professionnels de la santé La pose de Jaydess chez les femmes enceintes est contre-indiquée. Ce matériel ne contient pas toutes les informations. Pour une information complète, lisez attentivement le RCP avant de prescrire (ou d utiliser) Jaydess. Le texte complet et actualisé de ce RCP est disponible sur le site rubrique «NOTICE et RCP d un médicament».
2 But de ce matériel (RMA ou Risk Minimisation Activities) : Cette information fait partie du plan de gestion des risques en Belgique, qui met du matériel d information à la disposition des professionnels de la santé et des patients. Cette activité additionnelle de minimisation des risques a pour but une utilisation sûre et efficace du Jaydess et doit comporter les parties importantes suivantes : Matériel éducationnel à l intention des professionnels de la santé et des patientes en vue d éviter le risque de grossesse extra-utérine et d erreurs médicamenteuses, à savoir l utilisation par inadvertance de Jaydess pendant plus de 3 ans : 1. Communication adéquate à destination des professionnels de la santé incluant les élémentsclés suivants : - Les professionnels de la santé doivent être conscients du risque de grossesse extra-utérine et offrir un accompagnement adéquat aux patientes. - Les professionnels de la santé doivent avoir conscience de la date précise de retrait/remplacement après 3 ans de Jaydess et doivent être informés des différences entre produits en matière de durée d utilisation approuvée et de la différenciation des différents types de systèmes intra-utérins au lévonorgestrel (SIU assortis de différentes durées d utilisation approuvées) au moyen de l échographie et de la couleur des fils de retrait. 2. Carte de rappel patiente mentionnant le type de système intra-utérin au lévonorgestrel, la date d insertion, la date du dernier retrait et les coordonnées du médecin. Cette carte est insérée dans chaque emballage de Jaydess et ne fait donc pas partie du matériel de minimisation des risques (RMA).
3 Jaydess est un système de diffusion intra-utérin (SIU) sur le marché depuis Il contient 13,5 mg de lévonorgestrel (LNG). Jaydess est un moyen de contraception efficace pendant 3 ans. Dans la présente brochure, nous évoquons le risque de grossesse ectopique (extra-utérine) et nous donnons un aperçu des caractéristiques spécifiques de Jaydess afin d éviter le risque d erreur de médication. 1. Informations concernant le risque de grossesse ectopique (extrautérine) Grossesse ectopique chez les femmes qui utilisent Jaydess Les études cliniques font état d une incidence des grossesses ectopiques avec Jaydess correspondant à environ 0,11 cas par 100 années-femmes. Près de la moitié des grossesses sous Jaydess seront vraisemblablement ectopiques. Les femmes qui envisagent d utiliser Jaydess doivent être informées des signes, des symptômes et des risques d une grossesse ectopique. Chez les femmes qui tombent enceintes sous Jaydess, la possibilité d une grossesse ectopique doit être envisagée et évaluée. Signes et symptômes d une grossesse ectopique Il importe de reconnaître au plus tôt les signes et symptômes d une grossesse ectopique, afin que le traitement puisse être administré directement. C est pourquoi il est important que les femmes 1, 2-4 soient informées des signes et symptômes d une grossesse ectopique, dont : une douleur importante ou continue au niveau d un côté du bas-ventre. La douleur peut être soudaine et aiguë, ou augmenter progressivement au fil des jours ; des saignements vaginaux. Ces saignements peuvent différer des menstruations (le sang peut être plus foncé, par exemple) ; un saignement persistant survenant après une période d aménorrhée, surtout si le saignement s accompagne de douleur ; des symptômes de grossesse «habituels», mais associés à des saignements et une sensation de vertige ;
4 une douleur à l épaule (du fait de la présence de sang au niveau de la cavité abdominale, qui provoque une irritation du diaphragme) ; une douleur aiguë ou un évanouissement en raison d'une hémorragie interne importante associée à une rupture; des symptômes généraux : diarrhée, sensation de faiblesse ou de douleur à la défécation ; ces symptômes sont uniquement inquiétants s ils sont associés aux symptômes spécifiques énumérés ci-dessus ; un test de grossesse positif. Si une femme obtient un résultat positif à un test de grossesse alors qu elle utilise Jaydess, la possibilité d une grossesse ectopique doit être envisagée et des tests supplémentaires doivent être effectués en vue d exclure ou de confirmer une grossesse ectopique. 1 Il peut être difficile de diagnostiquer un début de grossesse ectopique ; des examens supplémentaires peuvent être nécessaires. Une grossesse ectopique peut être confirmée par échographie transvaginale et un dosage sanguin de l'hormone béta-hcg. 5 Influence d une grossesse ectopique sur l évolution de la fécondité Une grossesse ectopique peut endommager un organe du système reproducteur, voire le détruire (une trompe de fallope, par exemple) et affecter gravement la fécondité future de la femme. Grossesse ectopique et conseils en matière de contraception Les femmes doivent être informées des avantages et des risques des moyens de contraception disponibles, y compris Jaydess, afin d'être en mesure d effectuer un choix éclairé. Elles doivent notamment être informées de leur risque individuel de grossesse ectopique pendant qu elles utilisent Jaydess. Les femmes qui choisissent Jaydess doivent être informées des signes et symptômes de grossesse, notamment ectopique, doivent pouvoir les reconnaître et comprendre l importance de demander une aide médicale rapide si un ou plusieurs des symptômes évoqués se présentent. Dans la circonstance peu probable d une grossesse, elles doivent également être informées de la nécessité d immédiatement contacter un professionnel de la santé pour exclure ou confirmer une grossesse ectopique. Les prestataires de soins doivent évaluer individuellement le risque de grossesse ectopique pour chaque femme qui envisage de recourir à Jaydess comme moyen de contraception. Les facteurs de risque d une grossesse ectopique sont les suivants : Antécédents de grossesse ectopique 6 Âge (le risque augmente proportionnellement à l âge) 6
5 Tabagisme (le risque augmente proportionnellement au degré de tabagisme) 6 Antécédents d avortement spontané ou provoqué 6 Antécédents de maladie sexuellement transmissible 6 Antécédents chirurgicaux au niveau des trompes de fallope 6 Antécédents d infertilité 6 Multiplicité des partenaires sexuels 6 Endométriose 2 2. Différentiation entre Jaydess et d autres types de dispositifs intra-utérins à base de lévonorgestrel Il existe des différences entre les dispositifs intra-utérins à base de lévonorgestrel en termes de propriétés et de durée d utilisation. Nous traitons ci-dessous des caractéristiques spécifiques de Jaydess. Indication thérapeutique Contraception pour une durée maximale de 3 ans. Caractéristiques extérieures de Jaydess Jaydess se distingue des autres systèmes intra-utérins disponibles par la combinaison de la visibilité de l anneau en argent à l échographie et de la couleur brune des fils de retrait. Le corps en T contient du sulfate de baryum, ce qui rend le système visible à la radiographie. L extrémité supérieure de la tige verticale du corps en T du système comporte un anneau d argent pour l identification à l échographie. Pour les dimensions du corps en T et le diamètre de l inserteur, cf. Figure 1 et Tableau 1. Les fils de retrait bruns sont fixés à l anneau qui se trouve à la partie inférieure du bras vertical. Une distinction entre Jaydess (lévonorgestrel à 13,5 mg ; durée de 3 ans) et lévonorgestrel à 19,5 mg (durée de 5 ans) in situ à l échographie n est pas possible. Ceux-ci peuvent être distingués par la différence de couleur des fils de retrait visible au niveau du col utérin (bruns par rapport à bleus). Voir aussi tableau 1. Jaydess (levonorgestrel 13,5 mg) se distingue des autres systèmes intra-utérins plus hautement dosés (52 mg levonorgestrel) sur le marché par la visibilité de son anneau en argent à l échographie, qui est propre à Jaydess. En outre, Jaydess présente un cylindre contenant les hormones de plus petite dimension. Voir aussi tableau 1.
6 Tableau 1: Différences des systèmes intra-utérins au lévonorgestrel Ce tableau n est pas exhaustif. Jaydess lévonorgestrel 13.5 mg lévonorgestrel 19.5 mg lévonorgestrel 52 mg* Contenu total en LNG [mg] Durée maximale [ans] / 3 Dimension corps en T [mm] Diamètre du tube insertion [mm] Anneau d argent pour augmenter la visibilité à l échographie 28 x x x / 4.80 oui oui non Couleur des fils de retrait brun bleu brun / bleu * Il existe différentes formes de lévonorgestrel 52 mg sur le marché
7 Figure 1 : Apparence physique de Jaydess Carte de rappel pour la patiente Jaydess est fourni, dans l emballage extérieur, avec une carte de rappel pour la patiente. Complétez cette carte de rappel et remettez-la à la patiente après l insertion. Les données suivantes doivent être complétées : Nom de la patiente Nom du professionnel de santé Numéro de téléphone du professionnel de santé Date d insertion Date limite de retrait Date de la première visite de contrôle Rendez-vous suivants
8 Demande du matériel Pour commander des copies papier du matériel RMA, vous pouvez vous adresser à Bayer SA-NV : - par téléphone : par courrier : Bayer SA-NV, Medical department, J.E. Mommaertslaan 14, 1831 Diegem Références 1. Jaydess Résumé des caractéristiques du produit Torpy JM, Burke AE, Golub RM. JAMA patient page. Ectopic pregnancy. JAMA 2012;308: Patient.co.uk. Ectopic Pregnancy Disponible sur Pregnancy.htm (consulté le 23 novembre 2012). 4. NHS Choices. Symptoms of ectopic pregnancy Disponible sur (consulté le 23 novembre 2012). 5. Kazandi M & Turan V. Ectopic pregnancy; risk factors and comparison of intervention success rates in tubal ectopic pregnancy. Clin Exp Obstet Gynecol 2011;38: Bouyer J, Coste J, Shojaei T et al. Risk factors for ectopic pregnancy: a comprehensive analysis based on a large case-control, population-based study in France. Am J Epidemiol 2003;157: Notification des effets indésirables Les professionnels de la santé sont invités à notifier les effets indésirables liés à l utilisation de Jaydess à la division Vigilance de l agence fédérale des médicaments et des produits de santé (afmps). La notification peut se faire en ligne via ou à l aide de la «fiche jaune papier» disponible via le Répertoire Commenté des Médicaments et via les Folia Pharmacotherapeutica. La fiche jaune peut être envoyée par la poste à l adresse AFMPS division Vigilance Eurostation II Place Victor Horta 40/ Bruxelles, par fax au numéro 02/ , ou par à l adresse adversedrugreactions@afmps.be. Vous pouvez toujours signaler les effets secondaires à Bayer SA-NV via drugsafety.belux@bayer.com ou par téléphone (02/ ) ou par poste à l adresse suivante : Bayer SA-NV, Local PharmacoVigilance, J.E. Mommaertslaan 14, 1831 Diegem.
NOTICE : INFORMATION DE L UTILISATEUR. JAYDESS 13,5 mg, système de diffusion intra-utérin. Lévonorgestrel
 NOTICE : INFORMATION DE L UTILISATEUR JAYDESS 13,5 mg, système de diffusion intra-utérin Lévonorgestrel Ce médicament fait l objet d une surveillance supplémentaire qui permettra l identification rapide
NOTICE : INFORMATION DE L UTILISATEUR JAYDESS 13,5 mg, système de diffusion intra-utérin Lévonorgestrel Ce médicament fait l objet d une surveillance supplémentaire qui permettra l identification rapide
ASPECT ECHOGRAPHIQUE NORMAL DE LA CAVITE UTERINE APRES IVG. Dr D. Tasias Département de gynécologie, d'obstétrique et de stérilité
 Hôpitaux Universitaires de Genève ASPECT ECHOGRAPHIQUE NORMAL DE LA CAVITE UTERINE APRES IVG Dr D. Tasias Département de gynécologie, d'obstétrique et de stérilité Introduction (1) L IVG chirurgicale est
Hôpitaux Universitaires de Genève ASPECT ECHOGRAPHIQUE NORMAL DE LA CAVITE UTERINE APRES IVG Dr D. Tasias Département de gynécologie, d'obstétrique et de stérilité Introduction (1) L IVG chirurgicale est
Des soins après avortement : Amis des Jeunes. Cartes à conseils 1-6
 Des soins après avortement : Amis des Jeunes Cartes à conseils 1-6 SAA: Avant l intervention Accueillir cordialement la cliente et la mettre à l aise Garantir la confidentialité et l intimité Prendre les
Des soins après avortement : Amis des Jeunes Cartes à conseils 1-6 SAA: Avant l intervention Accueillir cordialement la cliente et la mettre à l aise Garantir la confidentialité et l intimité Prendre les
Information transmise sous l autorité de l Agence fédérale des médicaments et des produits de santé
 Les Direct Healthcare Professional Communications (DHPC) sont des courriers envoyés aux professionnels de la santé par les firmes pharmaceutiques, afin de les informer de risques potentiels apparus lors
Les Direct Healthcare Professional Communications (DHPC) sont des courriers envoyés aux professionnels de la santé par les firmes pharmaceutiques, afin de les informer de risques potentiels apparus lors
La planification familiale
 La planification familiale après l avortement spontané ou provoqué Introduction Les grossesses non désirées sont l une des principales raisons pour lesquelles les femmes choisissent d avorter. Beaucoup
La planification familiale après l avortement spontané ou provoqué Introduction Les grossesses non désirées sont l une des principales raisons pour lesquelles les femmes choisissent d avorter. Beaucoup
Leucémies de l enfant et de l adolescent
 Janvier 2014 Fiche tumeur Prise en charge des adolescents et jeunes adultes Leucémies de l enfant et de l adolescent GENERALITES COMMENT DIAGNOSTIQUE-T-ON UNE LEUCEMIE AIGUË? COMMENT TRAITE-T-ON UNE LEUCEMIE
Janvier 2014 Fiche tumeur Prise en charge des adolescents et jeunes adultes Leucémies de l enfant et de l adolescent GENERALITES COMMENT DIAGNOSTIQUE-T-ON UNE LEUCEMIE AIGUË? COMMENT TRAITE-T-ON UNE LEUCEMIE
Un test Pap pourrait vous sauver la vie
 Un test Pap pourrait vous sauver la vie Un test Pap pourrait vous sauver la vie Vous avez 21 ans ou plus et êtes sexuellement active? Passez un test Pap! Si vous saviez qu un test Pap, qui prend 5 minutes,
Un test Pap pourrait vous sauver la vie Un test Pap pourrait vous sauver la vie Vous avez 21 ans ou plus et êtes sexuellement active? Passez un test Pap! Si vous saviez qu un test Pap, qui prend 5 minutes,
NOTICE : INFORMATION DE L'UTILISATEUR. DAKTOZIN 2,5 mg/150 mg pommade Nitrate de miconazole et oxyde de zinc
 NOTICE : INFORMATION DE L'UTILISATEUR DAKTOZIN 2,5 mg/150 mg pommade Nitrate de miconazole et oxyde de zinc Veuillez lire attentivement cette notice avant d utiliser ce médicament car elle contient des
NOTICE : INFORMATION DE L'UTILISATEUR DAKTOZIN 2,5 mg/150 mg pommade Nitrate de miconazole et oxyde de zinc Veuillez lire attentivement cette notice avant d utiliser ce médicament car elle contient des
NOTICE: INFORMATION DE L UTILISATEUR. Dulcolax bisacodyl 5 mg comprimés enrobés (bisacodyl)
 NOTICE: INFORMATION DE L UTILISATEUR Dulcolax bisacodyl 5 mg comprimés enrobés (bisacodyl) Veuillez lire attentivement cette notice avant de prendre ce médicament. Elle contient des informations importantes
NOTICE: INFORMATION DE L UTILISATEUR Dulcolax bisacodyl 5 mg comprimés enrobés (bisacodyl) Veuillez lire attentivement cette notice avant de prendre ce médicament. Elle contient des informations importantes
LIGNES DIRECTRICES CLINIQUES TOUT AU LONG DU CONTINUUM DE SOINS : Objectif de ce chapitre. 6.1 Introduction 86
 LIGNES DIRECTRICES CLINIQUES TOUT AU LONG DU CONTINUUM DE SOINS : ÉTABLISSEMENT DE LIENS ENTRE LES PERSONNES CHEZ QUI UN DIAGNOSTIC D INFECTION À VIH A ÉTÉ POSÉ ET LES SERVICES DE SOINS ET DE TRAITEMENT
LIGNES DIRECTRICES CLINIQUES TOUT AU LONG DU CONTINUUM DE SOINS : ÉTABLISSEMENT DE LIENS ENTRE LES PERSONNES CHEZ QUI UN DIAGNOSTIC D INFECTION À VIH A ÉTÉ POSÉ ET LES SERVICES DE SOINS ET DE TRAITEMENT
2007-2012. L agence fédérale des médicaments et des produits de santé fête son cinquième anniversaire
 2007-2012 L agence fédérale des médicaments et des produits de santé fête son cinquième anniversaire Cinq ans : petit coup d œil dans le rétro Cher lecteur, chère lectrice, 2012 est une année particulière
2007-2012 L agence fédérale des médicaments et des produits de santé fête son cinquième anniversaire Cinq ans : petit coup d œil dans le rétro Cher lecteur, chère lectrice, 2012 est une année particulière
IMPORTANT : VEUILLEZ LIRE ATTENTIVEMENT
 IMPORTANT : VEUILLEZ LIRE ATTENTIVEMENT PARTIE III : RENSEIGNEMENTS POUR LE CONSOMMATEUR PROMETRIUM Progestérone en capsules Le présent dépliant constitue la troisième et dernière partie de la «monographie
IMPORTANT : VEUILLEZ LIRE ATTENTIVEMENT PARTIE III : RENSEIGNEMENTS POUR LE CONSOMMATEUR PROMETRIUM Progestérone en capsules Le présent dépliant constitue la troisième et dernière partie de la «monographie
Stelara (ustekinumab)
 Les autorités de santé de l Union européenne ont assorti la mise sur le marché du médicament Stelara de certaines conditions. Le plan obligatoire de minimisation des risques en Belgique, dont cette information
Les autorités de santé de l Union européenne ont assorti la mise sur le marché du médicament Stelara de certaines conditions. Le plan obligatoire de minimisation des risques en Belgique, dont cette information
NOTICE: INFORMATION DE L UTILISATEUR. Bisolax 5 mg comprimés enrobés. Bisacodyl
 NOTICE: INFORMATION DE L UTILISATEUR Bisolax 5 mg comprimés enrobés Bisacodyl Veuillez lire attentivement cette notice avant d utiliser ce médicament car elle contient des informations importantes pour
NOTICE: INFORMATION DE L UTILISATEUR Bisolax 5 mg comprimés enrobés Bisacodyl Veuillez lire attentivement cette notice avant d utiliser ce médicament car elle contient des informations importantes pour
comprimé pelliculé? Si votre médecin vous a informée d'une intolérance à certains sucres, contactez-le avant de prendre ce médicament.
 Désogestrel Biogaran 75 µg, comprimé pelliculé. Veuillez lire attentivement l'intégralité de cette notice avant de prendre ce médicament. Gardez cette notice, vous pourriez avoir besoin de la relire. Si
Désogestrel Biogaran 75 µg, comprimé pelliculé. Veuillez lire attentivement l'intégralité de cette notice avant de prendre ce médicament. Gardez cette notice, vous pourriez avoir besoin de la relire. Si
PRISE EN CHARGE DES LESIONS SPINCTERIENNES ANALES DU POST-PARTUM : DU CURATIF AU PREVENTIF
 PRISE EN CHARGE DES LESIONS SPINCTERIENNES ANALES DU POST-PARTUM : DU CURATIF AU PREVENTIF Laurent ABRAMOWITZ Unité de proctologie médico-chirurgicale Hôpital Bichat Claude Bernard 95, Rue de Passy 75016
PRISE EN CHARGE DES LESIONS SPINCTERIENNES ANALES DU POST-PARTUM : DU CURATIF AU PREVENTIF Laurent ABRAMOWITZ Unité de proctologie médico-chirurgicale Hôpital Bichat Claude Bernard 95, Rue de Passy 75016
Incontinence urinaire. DR.L.PEYRAT C.H.U. Tenon, Paris
 Incontinence urinaire DR.L.PEYRAT C.H.U. Tenon, Paris INCONTINENCE URINAIRE : DEFINITION 2002 ICS (Internationnal Contience Society) : perte involontaire d urine, on distingue Symptôme : élément décrit
Incontinence urinaire DR.L.PEYRAT C.H.U. Tenon, Paris INCONTINENCE URINAIRE : DEFINITION 2002 ICS (Internationnal Contience Society) : perte involontaire d urine, on distingue Symptôme : élément décrit
Table des matières chronologique volume 1 médicaments
 volume 1 médicaments vii Lois - versions consolidées Loi du 15 mai 2007 relative à la répression de la contrefaçon et de la piraterie de droits de propriété intellectuelle........... 3 Chapitre I. Disposition
volume 1 médicaments vii Lois - versions consolidées Loi du 15 mai 2007 relative à la répression de la contrefaçon et de la piraterie de droits de propriété intellectuelle........... 3 Chapitre I. Disposition
Insuffisance cardiaque
 Insuffisance cardiaque Connaître son évolution pour mieux la vivre Guide d accompagnement destiné au patient et ses proches Table des matières L évolution habituelle de l insuffisance cardiaque 5 Quelles
Insuffisance cardiaque Connaître son évolution pour mieux la vivre Guide d accompagnement destiné au patient et ses proches Table des matières L évolution habituelle de l insuffisance cardiaque 5 Quelles
Que sont les. inhibiteurs?
 Que sont les inhibiteurs? TABLE DES MATIÈRES Publié par la Fédération mondiale de l hémophilie (FMH) Fédération mondiale de l hémophilie, 2010 La FMH encourage la redistribution de ses publications à des
Que sont les inhibiteurs? TABLE DES MATIÈRES Publié par la Fédération mondiale de l hémophilie (FMH) Fédération mondiale de l hémophilie, 2010 La FMH encourage la redistribution de ses publications à des
Prise en charge de l embolie pulmonaire
 Prise en charge de l embolie pulmonaire Dr Serge Motte Liège 06.12.14 - Laack TA et Goyal DG, Emerg Med Clin N Am 2004; 961-983 2 PLAN Diagnostic Prise en charge: Phase aiguë: analyse de gravité Choix
Prise en charge de l embolie pulmonaire Dr Serge Motte Liège 06.12.14 - Laack TA et Goyal DG, Emerg Med Clin N Am 2004; 961-983 2 PLAN Diagnostic Prise en charge: Phase aiguë: analyse de gravité Choix
Contraception après 40 ans
 Contraception après 40 ans Stratégies de choix des méthodes contraceptives chez la femme. Recommandations pour la pratique clinique Décembre 2004. ANAES/AFSSAPS Un vaste choix contraceptif Contraception
Contraception après 40 ans Stratégies de choix des méthodes contraceptives chez la femme. Recommandations pour la pratique clinique Décembre 2004. ANAES/AFSSAPS Un vaste choix contraceptif Contraception
Accidents des anticoagulants
 30 Item 182 Accidents des anticoagulants Insérer les T1 Objectifs pédagogiques ENC Diagnostiquer un accident des anticoagulants. Identifier les situations d urgence et planifier leur prise en charge. COFER
30 Item 182 Accidents des anticoagulants Insérer les T1 Objectifs pédagogiques ENC Diagnostiquer un accident des anticoagulants. Identifier les situations d urgence et planifier leur prise en charge. COFER
23. Interprétation clinique des mesures de l effet traitement
 23. Interprétation clinique des mesures de l effet traitement 23.1. Critères de jugement binaires Plusieurs mesures (indices) sont utilisables pour quantifier l effet traitement lors de l utilisation d
23. Interprétation clinique des mesures de l effet traitement 23.1. Critères de jugement binaires Plusieurs mesures (indices) sont utilisables pour quantifier l effet traitement lors de l utilisation d
NOTICE : INFORMATIONS DU PATIENT. Keforal 500 mg comprimés pelliculés. Céfalexine monohydratée
 NOTICE : INFORMATIONS DU PATIENT Keforal 500 mg comprimés pelliculés Céfalexine monohydratée Veuillez lire attentivement cette notice avant de prendre ce médicament car elle contient des informations importantes
NOTICE : INFORMATIONS DU PATIENT Keforal 500 mg comprimés pelliculés Céfalexine monohydratée Veuillez lire attentivement cette notice avant de prendre ce médicament car elle contient des informations importantes
F us u ses c ouc u he h s s po p nt n a t né n es J. L J. an sac CHU H T ou
 Fausses couches spontanées J Lansac CHU Tours Définition Avortement : expulsion produit de conception avant 22SA ou enfant
Fausses couches spontanées J Lansac CHU Tours Définition Avortement : expulsion produit de conception avant 22SA ou enfant
sur la valve mitrale À propos de l insuffisance mitrale et du traitement par implantation de clip
 À propos de l insuffisance mitrale et du traitement par implantation de clip sur la valve mitrale Support destiné aux médecins en vue d informer les patients. À propos de l insuffisance mitrale L insuffisance
À propos de l insuffisance mitrale et du traitement par implantation de clip sur la valve mitrale Support destiné aux médecins en vue d informer les patients. À propos de l insuffisance mitrale L insuffisance
QUE SAVOIR SUR LA CHIRURGIE de FISTULE ANALE A LA CLINIQUE SAINT-PIERRE?
 QUE SAVOIR SUR LA CHIRURGIE de FISTULE ANALE A LA CLINIQUE SAINT-PIERRE? Vous allez être opéré(e) à la clinique Saint-pierre d une fistule anale par l équipe chirurgicale des docteurs Bardou, Ben brahem
QUE SAVOIR SUR LA CHIRURGIE de FISTULE ANALE A LA CLINIQUE SAINT-PIERRE? Vous allez être opéré(e) à la clinique Saint-pierre d une fistule anale par l équipe chirurgicale des docteurs Bardou, Ben brahem
Approche centrée e sur le patient
 Approche centrée e sur le patient Objectifs Prendre conscience des différences de type d approche Connaître le concept de l approche centrée sur le patient Savoir utiliser un outil d approche centrée sur
Approche centrée e sur le patient Objectifs Prendre conscience des différences de type d approche Connaître le concept de l approche centrée sur le patient Savoir utiliser un outil d approche centrée sur
Un avantage décisif pour la résection des polypes et des myomes. Système
 Un avantage décisif pour la résection des polypes et des myomes Système Nouvelle norme en résection hystéroscopique Truclear apporte une précision, une clarté et une efficacité sans précédents pour réséquer
Un avantage décisif pour la résection des polypes et des myomes Système Nouvelle norme en résection hystéroscopique Truclear apporte une précision, une clarté et une efficacité sans précédents pour réséquer
INTERVENTIONS CHIRURGICALES EN GYNÉCOLOGIE
 INTERVENTIONS CHIRURGICALES EN GYNÉCOLOGIE Informations générales pour la convalescence Pour vous, pour la vie Ce feuillet est destiné à mieux vous renseigner sur les points à observer après une opération
INTERVENTIONS CHIRURGICALES EN GYNÉCOLOGIE Informations générales pour la convalescence Pour vous, pour la vie Ce feuillet est destiné à mieux vous renseigner sur les points à observer après une opération
La prise en charge de votre insuffisance cardiaque
 G U I D E - A F F E C T I O N D E L O N G U E D U R É E La prise en charge de votre insuffisance cardiaque Vivre avec une insuffisance cardiaque Décembre 2007 Pourquoi ce guide? Votre médecin traitant
G U I D E - A F F E C T I O N D E L O N G U E D U R É E La prise en charge de votre insuffisance cardiaque Vivre avec une insuffisance cardiaque Décembre 2007 Pourquoi ce guide? Votre médecin traitant
Formation sur la sécurisation du circuit du médicament
 Formation sur la sécurisation du circuit du médicament Virginie Roué, Ingénieur Qualité-Risques Réseau AQuaREL Santé Dr Brigitte Paulmier, Pharmacien coordonnateur de la gestion des risques CH Saumur CONTEXTE
Formation sur la sécurisation du circuit du médicament Virginie Roué, Ingénieur Qualité-Risques Réseau AQuaREL Santé Dr Brigitte Paulmier, Pharmacien coordonnateur de la gestion des risques CH Saumur CONTEXTE
info ROACCUTANE Brochure d'information sur la contraception destinée aux patientes traitées par Roaccutane Roaccutane
 Roaccutane isotrétinoïne Brochure d'information sur la contraception destinée aux patientes traitées par Roaccutane info ROACCUTANE RM SM MANAGEMENT Programme de prévention de la grossesse SOMMAIRE 3.
Roaccutane isotrétinoïne Brochure d'information sur la contraception destinée aux patientes traitées par Roaccutane info ROACCUTANE RM SM MANAGEMENT Programme de prévention de la grossesse SOMMAIRE 3.
Embolisation des artères utérines
 Embolisation des artères utérines Avertissement Ces renseignements ont été préparés par L Hôpital d Ottawa et ne visent pas à remplacer les conseils d un fournisseur de soins de santé qualifié. Veuillez
Embolisation des artères utérines Avertissement Ces renseignements ont été préparés par L Hôpital d Ottawa et ne visent pas à remplacer les conseils d un fournisseur de soins de santé qualifié. Veuillez
NOTICE : INFORMATION DE L UTILISATEUR. Bisolax 5 mg comprimés enrobés Bisacodyl
 NOTICE : INFORMATION DE L UTILISATEUR Bisolax 5 mg comprimés enrobés Bisacodyl Veuillez lire attentivement cette notice avant d utiliser ce médicament. Elle contient des informations importante s pour
NOTICE : INFORMATION DE L UTILISATEUR Bisolax 5 mg comprimés enrobés Bisacodyl Veuillez lire attentivement cette notice avant d utiliser ce médicament. Elle contient des informations importante s pour
LA CHOLÉCYSTECTOMIE PAR LAPAROSCOPIE
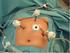 LA CHOLÉCYSTECTOMIE PAR LAPAROSCOPIE Une technique chirurgicale Pour vous, pour la vie Qu est-ce que la cholécystectomie? C est l intervention chirurgicale pratiquée pour enlever la vésicule biliaire.
LA CHOLÉCYSTECTOMIE PAR LAPAROSCOPIE Une technique chirurgicale Pour vous, pour la vie Qu est-ce que la cholécystectomie? C est l intervention chirurgicale pratiquée pour enlever la vésicule biliaire.
LE FINANCEMENT DES HOPITAUX EN BELGIQUE. Prof. G. DURANT
 LE FINANCEMENT DES HOPITAUX EN BELGIQUE Prof. G. DURANT La Belgique (11 millions d habitants) est un pays fédéral. Le financement est organisé au niveau national sauf le financement des infrastructures
LE FINANCEMENT DES HOPITAUX EN BELGIQUE Prof. G. DURANT La Belgique (11 millions d habitants) est un pays fédéral. Le financement est organisé au niveau national sauf le financement des infrastructures
Carte de soins et d urgence
 Direction Générale de la Santé Carte de soins et d urgence Emergency and Healthcare Card Porphyries Aiguës Hépatiques Acute Hepatic Porphyrias Type de Porphyrie* Déficit en Ala déhydrase Ala Dehydrase
Direction Générale de la Santé Carte de soins et d urgence Emergency and Healthcare Card Porphyries Aiguës Hépatiques Acute Hepatic Porphyrias Type de Porphyrie* Déficit en Ala déhydrase Ala Dehydrase
Pour l'instant, les connaissances actuelles ne permettent pas d'empêcher un cancer du sein de survenir.
 Dépistage Pour l'instant, les connaissances actuelles ne permettent pas d'empêcher un cancer du sein de survenir. Par contre, nous pouvons tenter de le dépister plus tôt afin d'avoir plus de chances de
Dépistage Pour l'instant, les connaissances actuelles ne permettent pas d'empêcher un cancer du sein de survenir. Par contre, nous pouvons tenter de le dépister plus tôt afin d'avoir plus de chances de
QU EST-CE QUE LA PROPHYLAXIE?
 QU EST-CE QUE LA PROPHYLAXIE? TABLES DES MATIÈRES Publié par la Fédération mondiale de l hémophilie (FMH) Fédération mondiale de l hémophilie, 2014 La FMH encourage la traduction et la redistribution de
QU EST-CE QUE LA PROPHYLAXIE? TABLES DES MATIÈRES Publié par la Fédération mondiale de l hémophilie (FMH) Fédération mondiale de l hémophilie, 2014 La FMH encourage la traduction et la redistribution de
First do no harm Hippocrates (470 360 BC)
 PHARMACOVIGILANCE DR A.TEBAA - Pr R. SOULAYMANI BENCHEIKH CENTRE ANTI POISON ET DE PHARMACOVIGILANCE M.COOPER-SHANTHI-PAL QUALITY ASSURANCE ET SECURITY MEDECINE Dakar 5-9 Mars 2006 First do no harm Hippocrates
PHARMACOVIGILANCE DR A.TEBAA - Pr R. SOULAYMANI BENCHEIKH CENTRE ANTI POISON ET DE PHARMACOVIGILANCE M.COOPER-SHANTHI-PAL QUALITY ASSURANCE ET SECURITY MEDECINE Dakar 5-9 Mars 2006 First do no harm Hippocrates
Le guide du bon usage des médicaments
 Le guide du bon usage des médicaments Les médicaments sont là pour vous aider mais......ils ont parfois du mal à vivre ensemble. Votre médecin et votre pharmacien peuvent adapter votre traitement pour
Le guide du bon usage des médicaments Les médicaments sont là pour vous aider mais......ils ont parfois du mal à vivre ensemble. Votre médecin et votre pharmacien peuvent adapter votre traitement pour
Traiter la Fausse Couche avec des pilules: ce que vous devez savoir
 Traiter la Fausse Couche avec des pilules: ce que vous devez savoir Ce pamphlet contient des informations générales que vous devriez connaître avant de traiter une fausse couche avec du misoprostol. Quand
Traiter la Fausse Couche avec des pilules: ce que vous devez savoir Ce pamphlet contient des informations générales que vous devriez connaître avant de traiter une fausse couche avec du misoprostol. Quand
G U I D E - A F F E C T I O N D E L O N G U E D U R É E. La prise en charge de votre mélanome cutané
 G U I D E - A F F E C T I O N D E L O N G U E D U R É E La prise en charge de votre mélanome cutané Mars 2010 Pourquoi ce guide? Votre médecin traitant vous a remis ce guide pour vous informer sur le mélanome
G U I D E - A F F E C T I O N D E L O N G U E D U R É E La prise en charge de votre mélanome cutané Mars 2010 Pourquoi ce guide? Votre médecin traitant vous a remis ce guide pour vous informer sur le mélanome
Pourquoi une femme-enceinte présente un certain nombre de douleurs inconnues jusqu'à lors?
 Pourquoi une femme-enceinte présente un certain nombre de douleurs inconnues jusqu'à lors? elle va pour cela créer des éléments chargées de transmettre un message à son corps (les hormones) : la «relaxine»
Pourquoi une femme-enceinte présente un certain nombre de douleurs inconnues jusqu'à lors? elle va pour cela créer des éléments chargées de transmettre un message à son corps (les hormones) : la «relaxine»
Le Dossier Pharmaceutique Partagé
 Un nouveau + pour votre Santé Le Dossier Pharmaceutique Partagé Les pharmaciens continuent à investir dans la qualité des soins et la sécurité des patients COMMUNIQUE DE PRESSE 25 février 2014 Le Dossier
Un nouveau + pour votre Santé Le Dossier Pharmaceutique Partagé Les pharmaciens continuent à investir dans la qualité des soins et la sécurité des patients COMMUNIQUE DE PRESSE 25 février 2014 Le Dossier
Prolapsus génital et incontinence urinaire chez la femme Professeur Pierre BERNARD Septembre 2002
 Prolapsus génital et incontinence urinaire chez la femme Professeur Pierre BERNARD Septembre 2002 Pré-Requis : Connaissance de bases : Anatomie du pelvis Classification des troubles de la statique génitale
Prolapsus génital et incontinence urinaire chez la femme Professeur Pierre BERNARD Septembre 2002 Pré-Requis : Connaissance de bases : Anatomie du pelvis Classification des troubles de la statique génitale
Streptocoque B :apports des tests en fin de grossesse, nouvelles propositions.
 Streptocoque B :apports des tests en fin de grossesse, nouvelles propositions. Exemple d une étude prospective sur la place d un test de détection rapide du SGB. HONORAT Raphaële 1, ASSOULINE Corinne 1,
Streptocoque B :apports des tests en fin de grossesse, nouvelles propositions. Exemple d une étude prospective sur la place d un test de détection rapide du SGB. HONORAT Raphaële 1, ASSOULINE Corinne 1,
Sélection et Évaluation Quantitative des Médicaments pour la Prise en Charge du VIH/SIDA. Sophie Logez, OMS/PSM Addis Abeba, Ethiopie, Février 2005
 Sélection et Évaluation Quantitative des Médicaments pour la Prise en Charge du VIH/SIDA Sophie Logez, OMS/PSM Addis Abeba, Ethiopie, Février 2005 Sélection et Évaluation Quantitative Références Sélection
Sélection et Évaluation Quantitative des Médicaments pour la Prise en Charge du VIH/SIDA Sophie Logez, OMS/PSM Addis Abeba, Ethiopie, Février 2005 Sélection et Évaluation Quantitative Références Sélection
L endométriose. souvent méconnue. Brochure d information destinée aux femmes atteintes et aux personnes
 L endométriose une maladie gynécologique évolutive, souvent méconnue Brochure d information destinée aux femmes atteintes et aux personnes intéressées Groupe d experts de l endométriose de la Société d
L endométriose une maladie gynécologique évolutive, souvent méconnue Brochure d information destinée aux femmes atteintes et aux personnes intéressées Groupe d experts de l endométriose de la Société d
Bienvenue chez votre pharmacien
 Bienvenue chez votre pharmacien En première ligne Le pharmacien Prestataire de soins à part entière, le pharmacien occupe aujourd hui une place centrale au cœur de notre système de santé. Disponible sans
Bienvenue chez votre pharmacien En première ligne Le pharmacien Prestataire de soins à part entière, le pharmacien occupe aujourd hui une place centrale au cœur de notre système de santé. Disponible sans
La mienne est. La mienne est. en comprimés
 La mienne est dans mon bras La mienne est au cuivre La mienne est en latex La mienne est sans ordonnance La mienne dure 3 ans La mienne n est pas contraignante La mienne est remboursée La mienne est en
La mienne est dans mon bras La mienne est au cuivre La mienne est en latex La mienne est sans ordonnance La mienne dure 3 ans La mienne n est pas contraignante La mienne est remboursée La mienne est en
L hépatite C pas compliqué! Véronique Lussier, M.D., F.R.C.P.C. Gastroentérologue Hôpital Honoré-Mercier 16 avril 2015
 L hépatite C pas compliqué! Véronique Lussier, M.D., F.R.C.P.C. Gastroentérologue Hôpital Honoré-Mercier 16 avril 2015 Objectifs de la présentation Décrire l évolution clinique et la prise en charge d
L hépatite C pas compliqué! Véronique Lussier, M.D., F.R.C.P.C. Gastroentérologue Hôpital Honoré-Mercier 16 avril 2015 Objectifs de la présentation Décrire l évolution clinique et la prise en charge d
HTA et grossesse. Dr M. Saidi-Oliver chef de clinique-assistant CHU de Nice
 HTA et grossesse Dr M. Saidi-Oliver chef de clinique-assistant CHU de Nice Définition HTA gravidique: Après 20 SA Systole> 140mmHg et/ou Diastole>90mmHg A 2 reprises séparées de plus de 6 heures Résolutive
HTA et grossesse Dr M. Saidi-Oliver chef de clinique-assistant CHU de Nice Définition HTA gravidique: Après 20 SA Systole> 140mmHg et/ou Diastole>90mmHg A 2 reprises séparées de plus de 6 heures Résolutive
Le VIH et votre cœur
 Le VIH et votre cœur Le VIH et votre cœur Que dois-je savoir au sujet de mon cœur? Les maladies cardiovasculaires représentent une des cause les plus courante de décès, elles incluent: les maladies coronariennes,
Le VIH et votre cœur Le VIH et votre cœur Que dois-je savoir au sujet de mon cœur? Les maladies cardiovasculaires représentent une des cause les plus courante de décès, elles incluent: les maladies coronariennes,
Biométrie foetale. Comité éditorial pédagogique de l'uvmaf. Date de création du document 01/071011. - Support de Cours (Version PDF) -
 Biométrie foetale Comité éditorial pédagogique de l'uvmaf Date de création du document 01/071011 Table des matières I Techniques de biométrie...3 I.1 Mesure de la longueur cranio-caudale...3 I.2 Mesure
Biométrie foetale Comité éditorial pédagogique de l'uvmaf Date de création du document 01/071011 Table des matières I Techniques de biométrie...3 I.1 Mesure de la longueur cranio-caudale...3 I.2 Mesure
da Vinci Pontage gastrique
 da Vinci Pontage gastrique Une nouvelle approche de la chirurgie bariatrique Êtes-vous intéressé par la dernière option de traitement de l'obésité? Votre docteur peut vous proposer une nouvelle procédure
da Vinci Pontage gastrique Une nouvelle approche de la chirurgie bariatrique Êtes-vous intéressé par la dernière option de traitement de l'obésité? Votre docteur peut vous proposer une nouvelle procédure
Spondylarthropathies : diagnostic, place des anti-tnf et surveillance par le généraliste. Pr P. Claudepierre CHU Henri Mondor - Créteil
 Spondylarthropathies : diagnostic, place des anti-tnf et surveillance par le généraliste Pr P. Claudepierre CHU Henri Mondor - Créteil Le Diagnostic Objectif de la démarche diagnostique Diagnostic de SPONDYLARTHROPATHIE
Spondylarthropathies : diagnostic, place des anti-tnf et surveillance par le généraliste Pr P. Claudepierre CHU Henri Mondor - Créteil Le Diagnostic Objectif de la démarche diagnostique Diagnostic de SPONDYLARTHROPATHIE
Diabète Type 2. Épidémiologie Aspects physiques Aspects physiologiques
 Diabète Type 2 Épidémiologie Aspects physiques Aspects physiologiques Épidémiologie 90% de tous les cas de diabètes Environ 1 personne sur 20 est atteinte Diabète gras Facteur de risque majeur pour les
Diabète Type 2 Épidémiologie Aspects physiques Aspects physiologiques Épidémiologie 90% de tous les cas de diabètes Environ 1 personne sur 20 est atteinte Diabète gras Facteur de risque majeur pour les
Délivrer le médicament le moins cher :
 Délivrer le médicament le moins cher : - Prescrire en DCI - Antibiotiques et antimycosiques Brochure pour les médecins, dentistes et pharmaciens Sommaire 1 Sommaire Introduction... 2 I. Prescription en
Délivrer le médicament le moins cher : - Prescrire en DCI - Antibiotiques et antimycosiques Brochure pour les médecins, dentistes et pharmaciens Sommaire 1 Sommaire Introduction... 2 I. Prescription en
Livret des nouveaux anticoagulants oraux. Ce qu il faut savoir pour bien gérer leur utilisation
 Livret des nouveaux anticoagulants oraux Ce qu il faut savoir pour bien gérer leur utilisation DONNÉES DU PATIENT Nom Adresse Tél MÉDECIN TRAITANT Nom Adresse Tél SPÉCIALISTE Nom Hôpital Tél MÉDICAMENT
Livret des nouveaux anticoagulants oraux Ce qu il faut savoir pour bien gérer leur utilisation DONNÉES DU PATIENT Nom Adresse Tél MÉDECIN TRAITANT Nom Adresse Tél SPÉCIALISTE Nom Hôpital Tél MÉDICAMENT
Plan. Introduction. Les Nouveaux Anticoagulants Oraux et le sujet âgé. Audit de prescription au Centre Hospitalier Geriatrique du Mont d Or
 Plan Introduction Les Nouveaux Anticoagulants Oraux et le sujet âgé Audit de prescription au Centre Hospitalier Geriatrique du Mont d Or Introduction NACO: une actualité brûlante! AVK: Plus forte incidence
Plan Introduction Les Nouveaux Anticoagulants Oraux et le sujet âgé Audit de prescription au Centre Hospitalier Geriatrique du Mont d Or Introduction NACO: une actualité brûlante! AVK: Plus forte incidence
DOSSIER-TYPE DE DEMANDE D AUTORISATION DE CREATION D UN SITE INTERNET DE COMMERCE ELECTRONIQUE DE MEDICAMENTS
 DOSSIER-TYPE DE DEMANDE D AUTORISATION DE CREATION D UN SITE INTERNET DE COMMERCE ELECTRONIQUE DE MEDICAMENTS N.B. : la règlementation relative à la vente de médicaments par internet est susceptible de
DOSSIER-TYPE DE DEMANDE D AUTORISATION DE CREATION D UN SITE INTERNET DE COMMERCE ELECTRONIQUE DE MEDICAMENTS N.B. : la règlementation relative à la vente de médicaments par internet est susceptible de
CEPHALEES POST-BRECHE DURALE. Post Dural Puncture Headache (PDPH)
 CEPHALEES POST-BRECHE DURALE Post Dural Puncture Headache (PDPH) G. Buzançais Dr E. Morau 6 Mars 2013 Plan Introduction Physiopathologie Traitements Conclusion Définitions Brèche durale Ponction de dure-mère
CEPHALEES POST-BRECHE DURALE Post Dural Puncture Headache (PDPH) G. Buzançais Dr E. Morau 6 Mars 2013 Plan Introduction Physiopathologie Traitements Conclusion Définitions Brèche durale Ponction de dure-mère
CONTRAT DE BAIL POUR UN APPARTEMENT Entre : 1. Monsieur... et Madame... domicilies a... ci-apres denomme bailleur - et 2. Monsieur... et madame...
 CONTRAT DE BAIL POUR UN APPARTEMENT Entre : 1. Monsieur... et Madame... domicilies a... ci-apres denomme bailleur - et 2. Monsieur... et madame... domicilie actuellement a... ci-apres denomme locataire
CONTRAT DE BAIL POUR UN APPARTEMENT Entre : 1. Monsieur... et Madame... domicilies a... ci-apres denomme bailleur - et 2. Monsieur... et madame... domicilie actuellement a... ci-apres denomme locataire
Guide à l intention des patients et des familles. Le don d un rein. www.nshealth.ca
 Guide à l intention des patients et des familles 2015 Le don d un rein www.nshealth.ca Le don d un rein Programme de transplantation rénale avec donneur vivant Il n y a jamais assez de dons de reins pour
Guide à l intention des patients et des familles 2015 Le don d un rein www.nshealth.ca Le don d un rein Programme de transplantation rénale avec donneur vivant Il n y a jamais assez de dons de reins pour
Cas clinique n 1. Y-a-t-il plusieurs diagnostics possibles? Son HTA a t elle favorisé ce problème?
 Cas clinique n 1 Michel que vous suivez de longue date a l impression depuis quelques jours, d entendre des battements irréguliers le soir en se couchant ; il va parfaitement bien par ailleurs et rapporte
Cas clinique n 1 Michel que vous suivez de longue date a l impression depuis quelques jours, d entendre des battements irréguliers le soir en se couchant ; il va parfaitement bien par ailleurs et rapporte
NOTICE TELESERVICES : Demander un état hypothécaire
 NOTICE TELESERVICES : Demander un état hypothécaire Sommaire Sommaire... 1 Objet de la notice... 1 A qui s adresse cette notice?... 1 Pré-requis... 2 Le guide pas à pas pour faire une demande d état hypothécaire...
NOTICE TELESERVICES : Demander un état hypothécaire Sommaire Sommaire... 1 Objet de la notice... 1 A qui s adresse cette notice?... 1 Pré-requis... 2 Le guide pas à pas pour faire une demande d état hypothécaire...
Médicaments en vente libre : considérations pour la pratique de la physiothérapie
 Médicaments en vente libre : considérations pour la pratique de la physiothérapie Adapté d un article approuvé de l Alliance canadienne des organismes de réglementation de la physiothérapie (2012) Le CPTNB
Médicaments en vente libre : considérations pour la pratique de la physiothérapie Adapté d un article approuvé de l Alliance canadienne des organismes de réglementation de la physiothérapie (2012) Le CPTNB
La prise en charge de votre artérite des membres inférieurs
 G U I D E - A F F E C T I O N D E L O N G U E D U R É E La prise en charge de votre artérite des membres inférieurs Vivre avec une artérite des membres inférieurs Novembre 2007 Pourquoi ce guide? Votre
G U I D E - A F F E C T I O N D E L O N G U E D U R É E La prise en charge de votre artérite des membres inférieurs Vivre avec une artérite des membres inférieurs Novembre 2007 Pourquoi ce guide? Votre
Entremise: Cigna International Health Services BVBA - Plantin en Moretuslei 299 B 2140 Anvers POLICE D ASSURANCE COLLECTIVE N BCVR 8673
 Entremise: Cigna International Health Services BVBA - Plantin en Moretuslei 299 B 2140 Anvers POLICE D ASSURANCE COLLECTIVE N BCVR 8673 Contrat MALADIE COMPLEMENTAIRE - GROS RISQUES conclu entre L ASSOCIATION
Entremise: Cigna International Health Services BVBA - Plantin en Moretuslei 299 B 2140 Anvers POLICE D ASSURANCE COLLECTIVE N BCVR 8673 Contrat MALADIE COMPLEMENTAIRE - GROS RISQUES conclu entre L ASSOCIATION
JEU VIDEO : UN NOUVEAU COMPAGNON par Colette KELLER-DIDIER
 JEU VIDEO : UN NOUVEAU COMPAGNON par Colette KELLER-DIDIER JEU VIDEO : UN NOUVEAU COMPAGNON par Colette KELLER-DIDIER ALS (séance du 11 mai 2003) 48 Jeu video : un nouveau compagnon (Colette KELLER-DIDIER)
JEU VIDEO : UN NOUVEAU COMPAGNON par Colette KELLER-DIDIER JEU VIDEO : UN NOUVEAU COMPAGNON par Colette KELLER-DIDIER ALS (séance du 11 mai 2003) 48 Jeu video : un nouveau compagnon (Colette KELLER-DIDIER)
NOTICE : INFORMATIONS DESTINÉES A L UTILISATEUR. Firazyr 30 mg solution injectable en seringue pré-remplie Icatibant
 B. NOTICE 1 NOTICE : INFORMATIONS DESTINÉES A L UTILISATEUR Firazyr 30 mg solution injectable en seringue pré-remplie Icatibant Veuillez lire attentivement l intégralité de cette notice avant d utiliser
B. NOTICE 1 NOTICE : INFORMATIONS DESTINÉES A L UTILISATEUR Firazyr 30 mg solution injectable en seringue pré-remplie Icatibant Veuillez lire attentivement l intégralité de cette notice avant d utiliser
Les nouveaux anticoagulants oraux, FA et AVC. Docteur Thalie TRAISSAC Hôpital Saint André CAPCV 15 février 2014
 Les nouveaux anticoagulants oraux, FA et AVC Docteur Thalie TRAISSAC Hôpital Saint André CAPCV 15 février 2014 Un AVC toutes les 4 minutes 1 130 000 AVC par an en France 1 770 000 personnes ont été victimes
Les nouveaux anticoagulants oraux, FA et AVC Docteur Thalie TRAISSAC Hôpital Saint André CAPCV 15 février 2014 Un AVC toutes les 4 minutes 1 130 000 AVC par an en France 1 770 000 personnes ont été victimes
Principales causes de décès selon le groupe d âge. 0 24 25 44 45 64 65 84 85 et plus
 Module 2 Exercice 1: Cellules souches hématopoïétiques 1. Causes de décès en Suisse (2010) La figure suivante montre les causes de décès les plus fréquentes en Suisse en 2010, telles qu elles ont été relevées
Module 2 Exercice 1: Cellules souches hématopoïétiques 1. Causes de décès en Suisse (2010) La figure suivante montre les causes de décès les plus fréquentes en Suisse en 2010, telles qu elles ont été relevées
AMMA vous épaule en toutes circonstances.
 L allocation gratuite de l INAMI pour médecins, dentistes, pharmaciens et kinésithérapeutes Maladie, accident, pension, AMMA vous épaule en toutes circonstances. A L L O C A T I O N I N A M I Qu est-ce
L allocation gratuite de l INAMI pour médecins, dentistes, pharmaciens et kinésithérapeutes Maladie, accident, pension, AMMA vous épaule en toutes circonstances. A L L O C A T I O N I N A M I Qu est-ce
FORMULAIRE DE DECLARATION DU RISQUE PERTE DE PROFESSION INSTRUMENTISTE ARTISTE LYRIQUE LUTHIER
 FORMULAIRE DE DECLARATION DU RISQUE PERTE DE PROFESSION INSTRUMENTISTE ARTISTE LYRIQUE LUTHIER Date d'effet : Échéance Annuelle : Périodicité : Annuelle Semestrielle Durée : 1. LE PROPOSANT (sera le preneur
FORMULAIRE DE DECLARATION DU RISQUE PERTE DE PROFESSION INSTRUMENTISTE ARTISTE LYRIQUE LUTHIER Date d'effet : Échéance Annuelle : Périodicité : Annuelle Semestrielle Durée : 1. LE PROPOSANT (sera le preneur
Le don de moelle osseuse
 Le don de moelle osseuse Enfant, je rêvais de sauver des vies. Aujourd hui, je le fais. Grande cause nationale 2009 Olivier, 4 ans Olivier, 32 ans Établissement relevant du ministère de la santé Le don
Le don de moelle osseuse Enfant, je rêvais de sauver des vies. Aujourd hui, je le fais. Grande cause nationale 2009 Olivier, 4 ans Olivier, 32 ans Établissement relevant du ministère de la santé Le don
Vous et votre traitement anticoagulant par AVK (antivitamine K)
 Ce carnet a été réalisé sous la coordination de l Agence française de sécurité sanitaire des produits de santé (Afssaps). Vous et votre traitement anticoagulant par AVK (antivitamine K) Carte à découper
Ce carnet a été réalisé sous la coordination de l Agence française de sécurité sanitaire des produits de santé (Afssaps). Vous et votre traitement anticoagulant par AVK (antivitamine K) Carte à découper
RÉFÉRENCES ET RECOMMANDATIONS MEDICALES
 CHAPITRE VI RÉFÉRENCES ET RECOMMANDATIONS MEDICALES I - Situation juridique La notion de références médicales opposables (RMO) est apparue dans la convention nationale des médecins de 1993. La réforme
CHAPITRE VI RÉFÉRENCES ET RECOMMANDATIONS MEDICALES I - Situation juridique La notion de références médicales opposables (RMO) est apparue dans la convention nationale des médecins de 1993. La réforme
Pseudotumor cerebri. Anatomie Le cerveau et la moelle épinière baignent dans un liquide clair, appelé le liquide céphalo-rachidien (LCR).
 Hypertension intracrânienne idiopathique Pseudotumor cerebri Votre médecin pense que vous pouvez souffrir d hypertension intracrânienne idiopathique connue aussi sous le nom de «pseudotumeur cérébrale».
Hypertension intracrânienne idiopathique Pseudotumor cerebri Votre médecin pense que vous pouvez souffrir d hypertension intracrânienne idiopathique connue aussi sous le nom de «pseudotumeur cérébrale».
Vertiges et étourdissements :
 : comment être à la hauteur? Anthony Zeitouni, MD, FRCSC Présenté à la 71 e édition du Programme scientifique de l Association des médecins de langue française du Canada. Est-ce bien des vertiges? Il n
: comment être à la hauteur? Anthony Zeitouni, MD, FRCSC Présenté à la 71 e édition du Programme scientifique de l Association des médecins de langue française du Canada. Est-ce bien des vertiges? Il n
DOSSIER-TYPE DE DEMANDE D AUTORISATION DE CREATION D UN SITE INTERNET DE COMMERCE ELECTRONIQUE DE MEDICAMENTS HUMAINS
 DOSSIER-TYPE DE DEMANDE D AUTORISATION DE CREATION D UN SITE INTERNET DE COMMERCE ELECTRONIQUE DE MEDICAMENTS HUMAINS Références juridiques : Articles L.5125-33 à L.5125-41, article L.5122-6-1 et article
DOSSIER-TYPE DE DEMANDE D AUTORISATION DE CREATION D UN SITE INTERNET DE COMMERCE ELECTRONIQUE DE MEDICAMENTS HUMAINS Références juridiques : Articles L.5125-33 à L.5125-41, article L.5122-6-1 et article
XARELTO (RIVAROXABAN) 2,5 MG - 15 MG - 20 MG, COMPRIMÉS PELLICULÉS GUIDE DE PRESCRIPTION
 Les autorités de santé de l Union Européenne ont assorti la mise sur le marché du médicament Xarelto 2,5 mg; 15 mg et 20 mg de certaines conditions. Le plan obligatoire de minimisation des risques en Belgique
Les autorités de santé de l Union Européenne ont assorti la mise sur le marché du médicament Xarelto 2,5 mg; 15 mg et 20 mg de certaines conditions. Le plan obligatoire de minimisation des risques en Belgique
Indications de la césarienne programmée à terme
 Indications de la césarienne programmée à terme Janvier 2012 Quelles sont les indications de la césarienne programmée? Utérus cicatriciel Transmissions mère-enfant d infections maternelles Grossesse gémellaire
Indications de la césarienne programmée à terme Janvier 2012 Quelles sont les indications de la césarienne programmée? Utérus cicatriciel Transmissions mère-enfant d infections maternelles Grossesse gémellaire
Information pour les patients dialysés qui prennent du chlorhydrate de sévélamer (RENAGEL)
 Les autorités de santé de l Union Européenne ont assorti la mise sur le marché du médicament RENAGEL de certaines conditions. Le plan obligatoire de minimalisation des risques en Belgique, dont cette information
Les autorités de santé de l Union Européenne ont assorti la mise sur le marché du médicament RENAGEL de certaines conditions. Le plan obligatoire de minimalisation des risques en Belgique, dont cette information
Assurance-maladie complémentaire (LCA)
 CC (Conditions complémentaires) Visana Assurances SA Valable dès 2014 Assurance-maladie complémentaire (LCA) Traitements ambulatoires Sommaire Page 3 3 4 6 Assurance complémentaire des frais de guérison
CC (Conditions complémentaires) Visana Assurances SA Valable dès 2014 Assurance-maladie complémentaire (LCA) Traitements ambulatoires Sommaire Page 3 3 4 6 Assurance complémentaire des frais de guérison
LA RÉTENTION URINAIRE DU POST-PARTUM
 LA RÉTENTION URINAIRE DU POST-PARTUM Prise en charge au CH de Pau Dr Sophie Rouleaud Service de médecine physique et de réadaptation Samedi 4 octobre 1 2 DEFINITION Définition 2003 Glavind K. et Bjork
LA RÉTENTION URINAIRE DU POST-PARTUM Prise en charge au CH de Pau Dr Sophie Rouleaud Service de médecine physique et de réadaptation Samedi 4 octobre 1 2 DEFINITION Définition 2003 Glavind K. et Bjork
Notice publique PERDOLAN - PÉDIATRIE
 Notice publique PERDOLAN - PÉDIATRIE Lisez attentivement cette notice jusqu'à la fin car elle contient des informations importantes pour vous. Ce médicament est délivré sans ordonnance. Néanmoins, vous
Notice publique PERDOLAN - PÉDIATRIE Lisez attentivement cette notice jusqu'à la fin car elle contient des informations importantes pour vous. Ce médicament est délivré sans ordonnance. Néanmoins, vous
Les différentes maladies du coeur
 Auteur : Dr Pascal AMEDRO Les différentes maladies du coeur 1. Le cœur normal L oxygène capté dans l air va dans les poumons, où le sang «bleu» est alors oxygéné et devient «rouge». Il est conduit par
Auteur : Dr Pascal AMEDRO Les différentes maladies du coeur 1. Le cœur normal L oxygène capté dans l air va dans les poumons, où le sang «bleu» est alors oxygéné et devient «rouge». Il est conduit par
KARDEGIC 75 mg, poudre pour solution buvable en sachet-dose Acétylsalicylate de DL-Lysine
 KARDEGIC 75 mg, poudre pour solution buvable en sachet-dose Acétylsalicylate de DL-Lysine Veuillez lire attentivement cette notice avant d'utiliser ce médicament. Elle contient des informations importantes
KARDEGIC 75 mg, poudre pour solution buvable en sachet-dose Acétylsalicylate de DL-Lysine Veuillez lire attentivement cette notice avant d'utiliser ce médicament. Elle contient des informations importantes
Information à un nouveau donneur de cellules souches du sang
 Information à un nouveau donneur de cellules souches du sang Pour des raisons de simplification, les dénominations masculines s appliquent également aux femmes. La transplantation de cellules souches du
Information à un nouveau donneur de cellules souches du sang Pour des raisons de simplification, les dénominations masculines s appliquent également aux femmes. La transplantation de cellules souches du
La goutte la maladie des rois
 La goutte la maladie des rois Tous droits protégés Pharmanetis Sàrl Tout savoir sur la goutte Comment bien gérer sa maladie? Par Van Nguyen et Xavier Gruffat (pharmaciens) Photo: Matthew Cole - Fotolia.com
La goutte la maladie des rois Tous droits protégés Pharmanetis Sàrl Tout savoir sur la goutte Comment bien gérer sa maladie? Par Van Nguyen et Xavier Gruffat (pharmaciens) Photo: Matthew Cole - Fotolia.com
I Identification du bénéficiaire (nom, prénom, N d affiliation à l O.A.) : II Eléments à attester par un médecin spécialiste en rhumatologie :
 ANNEXE A : Formulaire de première demande Formulaire de première demande de remboursement de la spécialité HUMIRA pour une spondylarthrite axiale sévère sans signes radiographiques de spondylarthrite ankylosante
ANNEXE A : Formulaire de première demande Formulaire de première demande de remboursement de la spécialité HUMIRA pour une spondylarthrite axiale sévère sans signes radiographiques de spondylarthrite ankylosante
Une avancée majeure dans le domaine de l implantologie. Roxolid SLActive Moins invasif pour de nouveaux standards
 Une avancée majeure dans le domaine de l implantologie. Roxolid SLActive Moins invasif pour de nouveaux standards 1 Excellentes performances scientifiquement démontrées. Roxolid est un matériau unique
Une avancée majeure dans le domaine de l implantologie. Roxolid SLActive Moins invasif pour de nouveaux standards 1 Excellentes performances scientifiquement démontrées. Roxolid est un matériau unique
Les tests génétiques à des fins médicales
 Les tests génétiques à des fins médicales Les tests génétiques à des fins médicales Nous avons tous hérité d une combinaison unique de gènes de la part de nos parents. Cette constitution originale et l
Les tests génétiques à des fins médicales Les tests génétiques à des fins médicales Nous avons tous hérité d une combinaison unique de gènes de la part de nos parents. Cette constitution originale et l
Le Data WareHouse à l INAMI Exploitation des données
 www.coopami.org Le Data WareHouse à l INAMI Exploitation des données TUNIS 17 décembre 2013 Michel Vigneul Conseiller Actuaire PLAN de l exposé : Partie 1 : Contexte général du système de remboursement
www.coopami.org Le Data WareHouse à l INAMI Exploitation des données TUNIS 17 décembre 2013 Michel Vigneul Conseiller Actuaire PLAN de l exposé : Partie 1 : Contexte général du système de remboursement
le traitement de la douleur
 le traitement de la douleur Chère patiente, cher patient Vous allez bientôt être admis dans l un des hôpitaux de jour de l az groeninge en vue d un traitement de la douleur. Dans cette brochure, vous trouverez
le traitement de la douleur Chère patiente, cher patient Vous allez bientôt être admis dans l un des hôpitaux de jour de l az groeninge en vue d un traitement de la douleur. Dans cette brochure, vous trouverez
