ANNEXE I RESUME DES CARACTERISTIQUES DU PRODUIT
|
|
|
- Sabine Leblanc
- il y a 10 ans
- Total affichages :
Transcription
1 ANNEXE I RESUME DES CARACTERISTIQUES DU PRODUIT 1
2 1. DENOMINATION DU MEDICAMENT Amyvid 800 MBq/mL, solution injectable 2. COMPOSITION QUALITATIVE ET QUANTITATIVE Chaque ml de solution injectable contient 800 MBq de florbétapir ( 18 F) à la date et à l'heure de calibration (ToC). L'activité par flacon varie de 800 MBq à MBq à la date et à l'heure de calibration. Le fluor ( 18 F) se désintègre en oxygène stable ( 18 O) avec une demi-vie d'environ 110 minutes en émettant un positon (rayonnement de 634 kev), suivi d un rayonnement d'annihilation photonique de 511 kev. Excipients à effet notoire : Ce médicament contient 79 mg/ml d'éthanol et jusqu'à 37 mg de sodium. Pour la liste complète des excipients, voir rubrique FORME PHARMACEUTIQUE Solution injectable. Solution transparente, incolore. 4. DONNEES CLINIQUES 4.1 Indications thérapeutiques Ce médicament est à usage diagnostique uniquement. Amyvid est un produit radiopharmaceutique indiqué pour l imagerie en Tomographie par Emission de Positons (TEP) afin d estimer la densité des plaques séniles de ß-amyloïde dans le cerveau de patients adultes ayant une déficience cognitive qui sont en cours d'évaluation pour une maladie d'alzheimer et pour d autres causes de déficience cognitive. Amyvid doit être utilisé en complément à l évaluation clinique. Un résultat négatif de l examen TEP indique une densité très faible à nulle de plaques amyloïdes, ce qui n est pas compatible avec un diagnostic de maladie d'alzheimer. Pour les limites dans l interprétation des résultats positifs de l examen TEP, voir les rubriques 4.4 et Posologie et mode d administration Un examen d imagerie TEP avec le florbétapir ( 18 F) doit être demandée par des médecins ayant l expérience de la prise en charge clinique des maladies neurodégénératives. Les images obtenues avec Amyvid ne doivent être interprétées que par des médecins nucléaires formés dans l'interprétation des images TEP avec le florbétapir ( 18 F). Un examen récent de tomodensitométrie (TDM) ou d imagerie par résonnance magnétique (IRM) du patient est recommandé afin d obtenir une image de fusion TEP-TDM ou TEP-IRM dans les cas où la localisation de la substance grise ou de la limite substance grise/substance blanche est incertaine sur l examen TEP (voir rubrique 4.4 Interprétation des images). 2
3 Posologie L activité recommandée pour un adulte de 70 kg est de 370 MBq de florbétapir ( 18 F). Le volume de l'injection ne doit pas être inférieur à 1 ml ni dépasser 10 ml. Populations particulières Patients âgés Aucune adaptation posologique n'est recommandée sur la base de l'âge. Insuffisance rénale et hépatique Il convient d'évaluer attentivement l'activité à administrer car la dose effective reçue peut être plus élevée chez ces patients. Voir rubrique 4.4. Il n a pas été conduit d études exhaustives de détermination et d ajustement de doses avec le médicament sur des populations normales et particulières. Les caractéristiques pharmacocinétiques du florbétapir ( 18 F) chez les patients présentant une insuffisance rénale ou hépatique n'ont pas été décrites. Population pédiatrique Il n'y a pas de justification à l utilisation d'amyvid dans la population pédiatrique. Mode d'administration Voie intraveineuse. Utilisation multidose. L activité du florbétapir ( 18 F) doit être mesurée à l'aide d'un activimètre (calibreur de dose) immédiatement avant l injection. La dose est administrée en bolus par injection intraveineuse, suivie d'un rinçage avec une solution injectable de chlorure de sodium à 9 mg/ml (0,9 %) pour garantir l'administration complète de la dose. L injection d Amyvid par un cathéter intraveineux court (d une longueur d environ 4 cm ou moins) minimise le potentiel d'adsorption de la substance active sur le cathéter. L'injection du florbétapir ( 18 F) doit être intraveineuse afin d éviter l'irradiation due à l extravasation locale ainsi que des artefacts d'imagerie. Acquisition des images L'acquisition de l image TEP doit démarrer environ 30 à 50 minutes après l'injection intraveineuse d Amyvid et doit durer 10 minutes. Les patients doivent être allongés sur le dos, la tête positionnée afin que le cerveau, y compris le cervelet, soient au centre du champ de vue de la caméra. Il est parfois nécessaire de limiter les mouvements de la tête à l'aide de bandes de contention adhésives ou de tout autre moyen de contention souple pour la tête. La reconstruction doit inclure une correction de l'atténuation ce qui permet d'obtenir une taille de pixels comprise entre 2,0 et 3,0 mm pour les images axiales. 4.3 Contre-indications Hypersensibilité à la substance active ou à l un des excipients mentionnés à la rubrique
4 4.4 Mises en garde spéciales et précautions d emploi Justification du bénéfice / risque individuel Pour chaque patient, l'exposition aux radiations ionisantes doit être justifiée par le bénéfice diagnostique attendu. La radioactivité administrée doit être telle que l irradiation qui en résulte soit aussi faible que possible tout en permettant d obtenir l information diagnostique attendue. Insuffisance rénale et insuffisance hépatique Il convient d'évaluer attentivement le rapport bénéfice risque chez ces patients car une exposition accrue aux rayonnements est possible. Le florbétapir ( 18 F) est excrété principalement par le système hépatobiliaire et chez les patients atteints d'insuffisance hépatique, il existe un risque potentiel d'exposition accrue aux rayonnements. Voir la rubrique 4.2. Population pédiatrique Pour toute information sur l'utilisation dans la population pédiatrique, voir les rubriques 4.2 ou 5.1. Interprétation des images acquises avec Amyvid Les images obtenues avec Amyvid ne doivent être interprétées que par des médecins nucléaires formés dans l'interprétation des images TEP avec le florbétapir ( 18 F). Un examen TEP négatif révèle une densité faible voir nulle de plaques de ß-amyloïde corticales. Un examen TEP positif indique une densité modérée à importante. Des erreurs d interprétation de l estimation de la densité des plaques de ß-amyloïde dans le cerveau, notamment des faux négatifs, ont été observées. L'examen des images doit se faire principalement selon une orientation axiale avec accès si besoin aux plans sagittal et coronal. Il est recommandé d'inclure dans l'examen des images toutes les coupes axiales du cerveau en utilisant une échelle de blanc-noir, l'intensité maximale de l'échelle correspondant à l'intensité maximale de tous les pixels du cerveau. L'interprétation de l'image comme positive ou négative est réalisée visuellement en comparant l'activité dans la substance grise corticale avec l'activité dans la substance blanche corticale adjacente (voir Figure 1). Sur les images négatives, l'activité est plus importante dans la substance blanche que dans la substance grise, ce qui crée un contraste gris-blanc net. Les images positives comporteront : a) Deux zones du cerveau ou plus (chacune étant plus grande qu'une seule circonvolution corticale) dans lesquelles le contraste gris-blanc est réduit ou absent. Il s'agit là de l'aspect le plus courant d'une image positive ; b) Une ou plusieurs zones dans lesquelles l'activité dans la substance grise est intense et nettement supérieure à l'activité dans la substance blanche adjacente. 4
5 Figure 1 : Exemples d examens négatifs (deux flèches du haut) et d examens positifs (deux flèches du bas) réalisés en TEP avec Amyvid. Les colonnes de gauche à droite présentent des images TEP en coupes sagittales, coronales et transversales. La colonne à l'extrémité droite présente un agrandissement de l image de la zone du cerveau délimitée par l encadré. Les deux flèches du haut indiquent des zones de conservation du contraste gris-blanc normal avec une activité corticale moindre par rapport à l'activité dans la substance blanche adjacente. Les deux flèches du bas indiquent des zones de diminution du contraste gris-blanc avec une activité corticale accrue, comparable à l'activité de la substance blanche adjacente. Images TEP d Amyvid Sagittale Coronale Transversale Limites d'utilisation Un examen positif ne permet pas d établir isolément un diagnostic de maladie d Alzheimer ou d autres déficiences cognitives puisque des plaques séniles de β-amyloïde peuvent être présentes dans la substance grise de patients atteints d'autres démences neurodégénératives (démence à corps de Lewy, démence associée à la maladie de Parkinson) ainsi que chez des personnes âgées asymptomatiques. Pour les limites d utilisation chez les patients ayant un trouble cognitif léger («Mild Cognitive Impairment», MCI), voir la rubrique 5.1. L'efficacité d Amyvid n'a pas été établie pour prédire l évolutivité de la maladie d Alzheimer ni pour évaluer la réponse au traitement (voir rubrique 5.1). Certaines images peuvent être difficiles à interpréter en raison de la présence d artéfacts sur l'image, d'une atrophie avec amincissement du ruban cortical ou d'une image floue, susceptibles de conduire à 5
6 des erreurs d'interprétation. En cas d'incertitude quant à l emplacement de la substance grise et de la jonction entre la substance grise et la substance blanche, sur une image réalisée par TEP, et s'il existe une image récente, réalisée par TDM ou IRM, le médecin nucléaire doit analyser l image fusionnée TEP-TDM ou TEP-IRM afin de préciser les relations entre la fixation du traceur TEP et la localisation de la substance grise. Dans certains cas, une augmentation de captation du traceur a été identifiée dans des structures extracérébrales telles que les glandes salivaires, la peau, les muscles et les os (voir rubrique 5.2). L évaluation des images TEP sagittales, couplées avec la TDM ou l IRM pourrait aider à distinguer l os occipital de la substance grise occipitale. Après l'examen Tout contact étroit avec les jeunes enfants et les femmes enceintes doit être restreint dans les 24 heures suivant l administration. Mises en garde spéciales La teneur en sodium est supérieure à 1 mmol (jusqu'à 37 mg par dose). A prendre en compte chez les patients suivant un régime hyposodé. Ce médicament contient 10 % de volume d éthanol (alcool), c'est-à-dire jusqu'à 790 mg par dose, ce qui équivaut à 20 ml de bière ou 8 ml de vin. Cette quantité peut être nocive en cas d utilisation chez les sujets alcooliques et doit être prise en compte chez les femmes enceintes et allaitantes et chez les groupes à haut risque tels que les insuffisants hépatiques ou les épileptiques. 4.5 Interactions avec d autres médicaments et autres formes d interactions Aucune étude d interaction in vivo n a été réalisée. Les études de fixation in vitro n'ont pas montré d'interférence de la fixation du florbétapir ( 18 F) sur les plaques de β-amyloïde en présence d'autres médicaments couramment utilisés pour traiter les patients atteints de la maladie d'alzheimer. 4.6 Fécondité, grossesse et allaitement Femmes en âge de procréer Lorsqu'il est nécessaire d'administrer des produits radiopharmaceutiques chez la femme en âge de procréer, toute éventualité de grossesse doit être écartée. Toute femme n ayant pas eu ses règles doit être considérée comme enceinte jusqu à preuve du contraire. Dans l incertitude (absence de règles, règles irrégulières, etc.), d autres techniques n utilisant pas les rayonnements ionisants (le cas échéant) doivent être envisagées. Grossesse Les examens utilisant des radionucléides chez la femme enceinte entraînent également l'irradiation du fœtus. Seuls les examens impératifs doivent donc être réalisés pendant la grossesse, si le bénéfice attendu excède largement le risque encouru par la mère et le fœtus. Aucune étude n'a été menée chez des femmes enceintes. Aucune étude des effets du florbétapir ( 18 F) sur la reproduction n'a été menée chez l'animal (voir rubrique 5.3). Allaitement On ne sait pas si le florbétapir ( 18 F) est excrété dans le lait maternel pendant l'allaitement. Avant d administrer un produit radiopharmaceutique à une femme qui allaite, il faut envisager de retarder l examen jusqu à la fin de l allaitement ou s assurer, dans le cas contraire, que le produit radiopharmaceutique le plus approprié a été choisi, compte tenu du passage de la radioactivité dans le lait. Si l administration est considérée comme indispensable, l allaitement maternel doit être interrompu pendant 24 heures et le lait tiré doit être éliminé. 6
7 Tout contact étroit avec les jeunes enfants doit être restreint dans les 24 heures suivant l administration. Fécondité Aucune étude sur la fécondité n'a été menée. 4.7 Effets sur l aptitude à conduire des véhicules et à utiliser des machines Sans objet. 4.8 Effets indésirables Résumé du profil de sécurité Les effets indésirables ont été recueillis dans des études cliniques impliquant 555 sujets et 665 administrations d'amyvid en solution injectable. Aucun effet indésirable grave lié à l'administration d'amyvid n'a été rapporté. Liste des effets indésirables Les fréquences sont définies comme suit : très fréquent ( 1/10) ; fréquent ( 1/100, < 1/10) ; peu fréquent ( 1/1 000, <1/100) ; rare ( 1/10 000, <1/1 000) ; très rare (< 1/10 000) ; fréquence indéterminée (ne peut être estimée sur la base des données disponibles). Même si des effets indésirables peuvent, en réalité, se produire à des fréquences inférieures à celles indiquées ci-dessous, la taille de la base de données source ne permettait pas d'attribution dans des catégories de fréquence inférieure à la catégorie «peu fréquent» ( 1/1 000, < 1/100). Affections du système nerveux Fréquent : céphalées Peu fréquent : dysgueusie Affections vasculaires Peu fréquent : bouffées vasomotrices Affections gastro-intestinales Peu fréquent : nausées Affections de la peau et du tissu sous-cutané Peu fréquent : prurit, urticaire Troubles généraux et anomalies au site d administration Peu fréquent : érythème au site d'injection L exposition aux rayonnements ionisants peut entraîner le développement de cancer et d anomalies héréditaires. La dose efficace étant de 7 msv lorsque l activité maximale recommandée de 370 MBq de florbétapir ( 18 F) est administrée, la probabilité de survenue de ces évènements indésirables est faible. 4.9 Surdosage Compte tenu de la faible quantité de florbétapir ( 18 F) contenue dans chaque dose, un surdosage entraînant des effets pharmacologiques n est pas attendu. En cas d administration d un surdosage de rayonnements, la dose absorbée par le patient doit être réduite en favorisant autant que possible l'élimination du radionucléide par une augmentation de la fréquence des mictions et de l'excrétion fécale. Il peut être utile d'estimer la dose réelle ayant été appliquée. 7
8 5. PROPRIETES PHARMACOLOGIQUES 5.1 Propriétés pharmacodynamiques Classe pharmacothérapeutique : produit radiopharmaceutique à usage diagnostique, système nerveux central, Code ATC : V09AX05 Mécanisme d'action Le florbétapir ( 18 F) se fixe aux plaques séniles de ß-amyloïde. Des études de fixation, utilisant des méthodes de coloration neuropathologique traditionnelle sur des cerveaux post-mortem de patients atteints de la maladie d'alzheimer ont mis en évidence des corrélations statistiquement significatives (p < 0,0001) entre la fixation in vitro du florbétapir ( 18 F) et les dépôts de β-amyloïde sous forme d'agrégats. In vivo, la corrélation entre la captation du florbétapir ( 18 F) dans la substance grise corticale et la charge totale de ß-amyloïde a été évaluée chez des patients en fin de vie à l aide d anticorps antiamyloïde 4G8 qui teinte l amyloïde β présente dans les plaques séniles diffuses. La fixation in vivo du florbétapir ( 18 F) à d autres structures ß-amyloïde, à d autres structures du cerveau ou à d autres récepteurs reste inconnue. Effets pharmacodynamiques Le florbétapir ( 18 F) n'a aucune activité pharmacologique détectable aux faibles concentrations chimiques présentes dans Amyvid. Dans les essais cliniques terminés, la captation du florbétapir ( 18 F) dans 6 zones corticales du cerveau préalablement définies (précunéus, cortex frontal, cortex cingulaire antérieur, cortex cingulaire postérieur, cortex pariétal et temporal) a été mesurée quantitativement à l'aide des valeurs de fixation normalisées (SUV, Standardised Uptake Values). Les ratios des SUV moyennes corticales (SUVR, par rapport au cervelet) sont plus élevés chez les patients atteints de la maladie d'alzheimer comparativement à ceux de sujets volontaires sains. Chez les patients atteints de la maladie d Alzheimer, les valeurs SUVR moyennes corticales par rapport au cervelet montrent des augmentations substantielles continues depuis le temps zéro jusqu à 30 minutes après l'administration, avec par la suite seulement de petits changements jusqu'à 90 minutes après l'injection. Aucune différence n'a été observée dans les résultats des SUVR chez des sujets prenant des médicaments couramment utilisés pour traiter la maladie d'alzheimer comparativement à ceux ne prenant aucun traitement pour la maladie d'alzheimer. Utilité clinique Une étude pivot chez 59 patients en fin de vie avait pour objectif d établir, les performances diagnostiques d Amyvid pour détecter la densité des plaques séniles corticales (rares ou nulles vs modérées ou importantes). Les résultats de l examen TEP ont été comparés avec la densité maximale de plaques séniles sur les coupes du cortex frontal, temporal et pariétal lors de l autopsie des patients dans les 24 mois suivant le TEP. Le statut cognitif des sujets n a pas pu être mesuré de manière fiable. Sur la totalité des 59 sujets, une lecture des images TEP réalisée en aveugle par 5 médecins spécialisés en médecine nucléaire s'est traduite par une lecture d'une sensibilité de 92 % (IC à 95 % : %) et d'une spécificité de 100 % (IC à 95 % : %). Dans une étude menée chez 47 volontaires sains jeunes (<40 ans), présumés ne pas présenter de plaques de β-amyloïde, toutes les images TEP avec Amyvid ont été négatives. La sensibilité et la spécificité d Amyvid pour détecter la densité des plaques séniles corticales ont été étudiées ensuite dans deux études complémentaires dans lesquelles différents groupes de médecins nucléaires ont interprété les images de quelques sujets ayant été suivis jusqu'à leur autopsie dans l étude pivot. Les résultats de ces études ont été similaires à ceux de l'étude pivot. En utilisant des valeurs des coefficients kappa de Fleiss, la concordance inter-imageur allait de 0,75 à 0,85. Dans une étude longitudinale, 142 sujets (dont le diagnostic clinique était un MCI, une maladie d Alzheimer ou un état cognitif normal) ont subi des examens d'imagerie TEP avec le florbétapir ( 18 F), 8
9 à l état initial, et ont été suivis pendant 3 ans afin d'évaluer la relation entre l'imagerie avec Amyvid et les modifications du diagnostic. Les valeurs de performance du diagnostic du TEP avec le florbétapir ( 18 F) sont présentées dans le tableau ci-dessus : En accord avec un diagnostic de MCI à l état initial En accord avec un diagnostic clinique de maladie d Alzheimer à l état initial N=51 N=31 Sensibilité 19/51 = 37.3% (IC à 95 % : 24,1-51,9%) 21/31 = 67.7% (IC à 95 % : 51,3-84,2%) Spécificité Ratio de probabilité positive Utilisation des cas non - MCI (état cognitif normal et maladie d Alzheimer clinique) 69/100 = 69,0% (IC à 95 % : 59,9-78,1%) Utilisation des cas non - Alzheimer (état cognitif normal et MCI) 91/120 = 75,8% (IC à 95 % : 68,2-83,5%) 1,20 (IC à 95 % :0,76-1,91) 2,80 (IC à 95 % : 1,88-4,18) Parmi les patients qui ont été cliniquement diagnostiqués avec un MCI à l entrée dans l étude, 9 (19%) ont développé une maladie d Alzheimer clinique 36 mois plus tard. Parmi les 17 patients ayant un MCI avec un examen TEP positif, 6 (35%) ont été cliniquement diagnostiqués avec une maladie d Alzheimer probable, 36 mois plus tard, comparés à 3 (10%) des 30 ayant eu un examen TEP négatif. La sensibilité des examens TEP avec Amyvid pour montrer le taux de conversion d un MCI vers une maladie d Alzheimer chez 9 patients ayant un MCI et ayant développé la maladie d Alzheimer («converters») était de 66,7% (IC à 95 % : 35-88%). La spécificité chez 38 patients «non converters» était de 71,0% (IC à 95 % : 55-83%). Le ratio de probabilité positive était de 2,31 (IC à 95 % : 1,2-4,5). Le schéma de l étude ne permet pas d estimer le risque de progression d un MCI vers une maladie d Alzheimer clinique. Population pédiatrique L Agence européenne des médicaments a accordé une dérogation à l obligation de soumettre les résultats d études réalisées avec Amyvid dans tous les sous-groupes de la population pédiatrique car il n'y a pas d'utilisation destinée à la population pédiatrique. 5.2 Propriétés pharmacocinétiques Distribution Le florbétapir ( 18 F) est distribué dans tout l'organisme en quelques minutes après l'injection, puis il est rapidement métabolisé. Fixation au niveau des organes La fixation maximale du florbétapir ( 18 F) au niveau du cerveau se produit en quelques minutes suivant l'injection. Elle est suivie d'une clairance cérébrale rapide dans les 30 premières minutes suivant l'injection. Les organes soumis à la plus forte exposition sont les organes d'élimination, principalement la vésicule biliaire, le foie et les intestins. Chez des sujets témoins sains, les niveaux de fixation du florbétapir ( 18 F) observés dans le cortex et le cervelet sont relativement faibles. Les analyses par régions montrent des niveaux de fixation légèrement plus élevés dans le noyau caudé, le putamen et l'hippocampe. Le niveau de fixation le plus élevé s observe dans les régions composées essentiellement de substance blanche (pont de Varole et centre ovale de Vieussens). Chez les sujets atteints de la maladie d Alzheimer, les régions corticales et le putamen affichent une fixation nettement supérieure comparativement aux sujets témoins. Chez les sujets atteints de la maladie d Alzheimer, comme chez les sujets témoins, on observe une faible 9
10 fixation dans le cervelet et l'hippocampe et une rétention élevée dans le pont de Varole et dans le centre ovale de Vieussens. Les fondements biochimiques de la fixation du florbétapir ( 18 F) dans la substance blanche du cerveau humain vivant ne peuvent s expliquer de manière définitive. Il a été émis l hypothèse que le ralentissement de la clairance du produit radiopharmaceutique pourrait contribuer à sa fixation dans la substance blanche étant donné que le débit sanguin cérébral régional dans la substance blanche est inférieur à la moitié de celui du cortex. La fixation a également été identifiée dans certain cas dans les structures extracérébrales telles que le cuir chevelu, les glandes salivaires, les muscles et les os du crâne. La raison de cette fixation n est pas connue mais il se peut qu elle soit due à l accumulation de florbétapir ( 18 F) ou de tout autre métabolite radioactif du florbétapir ( 18 F) ou à la radioactivité sanguine. Élimination L'élimination se fait principalement par clairance hépatique et excrétion dans la vésicule biliaire et les intestins. Une certaine accumulation/excrétion est également observée dans la vessie. Une radioactivité est présente dans l'urine sous forme de métabolites polaires du florbétapir ( 18 F). Demi-vie Le florbétapir ( 18 F) est très rapidement éliminé de la circulation sanguine après l'injection intraveineuse. Moins de 5 % de la radioactivité 18 F injectée réside dans le sang 20 minutes après l'administration, et moins de 2% est présente 45 minutes après l'administration. Le 18 F résiduel dans la circulation pendant la fenêtre d'imagerie de 30 à 90 minutes est essentiellement présent sous forme d'espèces 18 F polaires. La demi-vie physique du 18 F est de 110 minutes. Insuffisance rénale/hépatique La pharmacocinétique chez des patients atteints d'insuffisance rénale ou hépatique n'a pas été caractérisée. 5.3 Données de sécurité préclinique Toxicologie et pharmacologie de sécurité chez l'animal Les données non cliniques issues des études conventionnelles de pharmacologie de sécurité, toxicologie en administration unique et répétée, dans lesquelles le florbétapir [forme non radioactive de florbétapir ( 18 F)] a été utilisé, n ont pas révélé de risque particulier pour l homme. Une étude de dose aiguë a été menée chez le rat et la dose sans effet nocif observé (NOAEL) a été établie à une dose au moins égale à 100 fois la dose maximale chez l'homme. La toxicité potentielle de l'administration répétée des injections intraveineuses de florbétapir pendant 28 jours a été testée sur des rats et des chiens, et la dose sans effet nocif observé (NOAEL) a été établie à une dose au moins égale à 25 fois la dose maximale chez l'homme. Dans un essai in vitro de mutation bactérienne inverse (test d'ames), des augmentations du nombre de colonies en réversion ont été observées dans 2 des 5 souches exposées au florbétapir. Dans l'étude d'aberration chromosomique in vitro réalisée en utilisant des cultures de cellules lymphocytes périphériques humaines, le florbétapir n'a pas entraîné d augmentation du pourcentage des cellules présentant des aberrations structurelles lors d'une exposition de 3 heures, avec ou sans système d'activation ; toutefois, une exposition de 22 heures a entraîné une augmentation des aberrations structurelles à toutes les concentrations testées. La génotoxicité potentielle in vivo du florbétapir a été évaluée dans un test de détection des micronoyaux chez le rat. Dans ce test, le florbétapir n'a pas entraîné d'augmentation du nombre de micronoyaux dans les érythrocytes polychromatiques au plus fort niveau de dose possible, 372 µg/kg/jour, lorsqu'il est administré deux fois par jour pendant 3 jours consécutifs. Cette dose est égale à environ 500 fois la dose maximale chez l'homme, et n'a montré aucun signe de mutagénicité. Aucune étude n'a été menée chez l'animal pour étudier le potentiel carcinogène à long terme du florbétapir ( 18 F) ainsi que ses effets sur la fécondité ou la reproduction. 10
11 Aucune étude de toxicologie et de pharmacologie n'a été menée chez l'animal avec le florbétapir ( 18 F). 6 DONNEES PHARMACEUTIQUES 6.1. Liste des excipients Éthanol Ascorbate de sodium Chlorure de sodium Eau pour préparation injectable 6.2. Incompatibilités En l absence d études de compatibilité, ce médicament ne doit pas être mélangé avec d autres médicaments Durée de conservation 7,5 heures à compter de l'heure de calibration Précautions particulières de conservation Ce médicament ne nécessite pas de précautions particulières de conservation. Pour les précautions de conservation après la première ouverture, voir rubrique 6.3. Le stockage des radiopharmaceutiques doit être effectué conformément aux réglementations nationales relatives aux produits radioactifs Nature et contenu de l emballage extérieur Amyvid est conditionné en flacon de 10 ml ou de 15 ml en verre borosilicate, incolore, de type I, fermés par un bouchon en caoutchouc chlorobutylé, revêtu d un film de protection FluroTec et scellé par une capsule en aluminium. Un flacon multidose d'une capacité de 10 ml contient de 1 à 10 ml de solution, soit 800 MBq à MBq à la date et à l'heure de calibration. Un flacon multidose d'une capacité de 15 ml contient de 1 à 15 ml de solution, soit 800 MBq à MBq à la date et à l'heure de calibration. En raison de différences de processus de fabrication, il est possible que certains lots de produits soient distribués dans des flacons avec des bouchons en caoutchouc percés. Chaque flacon est enfermé dans un conteneur blindé et ayant une épaisseur appropriée pour minimiser l'exposition au rayonnement externe. Taille de l emballage : 1 flacon Précautions particulières d élimination et manipulation Mises en garde générales Les produits radiopharmaceutiques ne doivent être réceptionnés, utilisés et administrés que par des personnes autorisées dans un service clinique agréé. Leur réception, conservation, utilisation, transfert et élimination sont soumis à la réglementation en vigueur et aux autorisations appropriées des autorités officielles compétentes. 11
12 Les produits radiopharmaceutiques doivent être préparés de manière à satisfaire aux exigences en matière de radioprotection et de qualité pharmaceutique. Les conditions d asepsie appropriées doivent être prises. Si l'intégrité du flacon est compromise, le produit ne doit pas être utilisé. Les procédures d'administration doivent être effectuées de manière à minimiser le risque de contamination de ce médicament et l'irradiation des opérateurs. Une protection adéquate est obligatoire. L'administration de produits radiopharmaceutiques présente des risques pour les autres personnes (y compris pour les femmes enceintes parmi les professionnels de santé), en raison des rayonnements externes ou de la contamination par les urines, les vomissements, etc. Des mesures de protection contre les rayonnements doivent donc être prises, conformément aux réglementations nationales. Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur. 7. TITULAIRE DE L AUTORISATION DE MISE SUR LE MARCHE Eli Lilly Nederland B.V., Grootslag 1-5, NL-3991 RA Houten, Pays-Bas 8. NUMERO(S) D AUTORISATION DE MISE SUR LE MARCHE 9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L AUTORISATION 10. DATE DE MISE A JOUR DU TEXTE 11. DOSIMETRIE Les doses de rayonnements absorbées par les différents organes et tissus d'un patient adulte moyen (70 kg) pour 370 MBq de florbétapir ( 18 F), estimées à l'aide des méthodes standard des calculs de dosimétrie (Volume 30 de la Commission Internationale de Protection Radiologique, CIPR) sont présentées dans le tableau ci-dessous. Aucune hypothèse n'a été formulée sur la vidange de la vessie. 12
13 Dose absorbée par activité administrée (µgy/mbq) Moyenne ORGANE/TISSU Surrénales 13,6 Cerveau 10,0 Seins 6,2 Paroi de la vésicule biliaire 143,0 Paroi du côlon descendant 27,8 Intestin grêle 65,5 Paroi gastrique 11,7 Paroi du côlon ascendant 74,4 Paroi cardiaque 12,7 Reins 13,0 Foie 64,4 Poumons 8,5 Muscle 8,6 Ovaires 17,6 Pancréas 14,4 Moelle rouge 14,3 Cellules ostéogéniques 27,6 Peau 5,9 Rate 8,9 Testicules 6,8 Thymus 7,3 Thyroïde 6,8 Paroi de la vessie 27,1 Utérus 15,6 Corps entier 11,6 Dose efficace (µsv/mbq) a 18,6 a On suppose un facteur de qualité (Q) de 1 pour la conversion de la dose absorbée en dose efficace pour 18 F. La dose efficace résultant de l'administration d'une dose de 370 MBq pour un adulte de 70 kg est d'environ 7 msv. Si une TDM est réalisée simultanément dans le cadre d un examen TEP, l exposition aux radiations ionisantes augmentera selon le paramétrage utilisé lors de l acquisition des images TDM. Pour une activité administrée de 370 MBq, la dose type de rayonnement délivrée à l'organe cible (cerveau) est de 3,7 mgy. Pour une activité administrée de 370 MBq, les doses types de rayonnement délivrées aux organes critiques sont de 53 mgy pour la vésicule biliaire, 27,5 mgy pour la paroi du côlon ascendant, 10,3 mgy pour la paroi du côlon descendant, 24,2 mgy pour l'intestin grêle et de 23,8 mgy pour le foie. 12. INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES Méthode de préparation Avant utilisation, le conditionnement doit être vérifié et l'activité mesurée à l'aide d'un activimètre. Les prélèvements doivent être effectués dans des conditions d'asepsie. Les flacons ne doivent pas être ouverts avant désinfection du bouchon ; la solution doit être prélevée à travers le bouchon à l'aide d une seringue à dose unique munie d'une protection appropriée et d'une aiguille stérile à usage unique ou à l aide d un système d application automatisé autorisé. Utiliser uniquement des seringues en polypropylène/polyéthylène haute densité. Si l'intégrité du flacon est compromise, le produit ne doit pas être utilisé. Amyvid peut être dilué aseptiquement avec une solution injectable de chlorure de sodium à 9 mg/ml (0,9 %) jusqu à une dilution maximale de 1:5. Le produit dilué doit être utilisé dans les 4 heures suivant la dilution. 13
14 Contrôle qualité Un contrôle visuel de la solution doit être effectué avant utilisation. Seules les solutions limpides et dépourvues de particules visibles pourront être utilisées. Des informations détaillées sur ce médicament sont disponibles sur le site internet de l Agence européenne des médicaments 14
15 1. DENOMINATION DU MEDICAMENT Amyvid MBq/mL, solution injectable 2. COMPOSITION QUALITATIVE ET QUANTITATIVE Chaque ml de solution injectable contient MBq de florbétapir ( 18 F) à la date et à l'heure de calibration (ToC). L'activité par flacon varie de MBq à MBq à la date et à l'heure de calibration. Le fluor ( 18 F) se désintègre en oxygène stable ( 18 O) avec une demi-vie d'environ 110 minutes en émettant un positon (rayonnement de 634 kev), suivi d un rayonnement d'annihilation photonique de 511 kev. Excipients à effet notoire : Ce médicament contient 79 mg/ml d'éthanol et jusqu'à 37 mg de sodium. Pour la liste complète des excipients, voir rubrique FORME PHARMACEUTIQUE Solution injectable. Solution transparente, incolore. 4. DONNEES CLINIQUES 4.1 Indications thérapeutiques Ce médicament est à usage diagnostique uniquement. Amyvid est un produit radiopharmaceutique indiqué pour l imagerie en Tomographie par Emission de Positons (TEP) afin d estimer la densité des plaques séniles de ß-amyloïde dans le cerveau de patients adultes ayant une déficience cognitive qui sont en cours d'évaluation pour une maladie d'alzheimer et pour d autres causes de déficience cognitive. Amyvid doit être utilisé en complément à l évaluation clinique. Un résultat négatif de l examen TEP indique une densité très faible à nulle de plaques amyloïdes, ce qui n est pas compatible avec un diagnostic de maladie d'alzheimer. Pour les limites dans l interprétation des résultats positifs de l examen TEP, voir les rubriques 4.4 et Posologie et mode d administration Un examen d imagerie TEP avec le florbétapir ( 18 F) doit être demandée par des médecins ayant l expérience de la prise en charge clinique des maladies neurodégénératives. Les images obtenues avec Amyvid ne doivent être interprétées que par des médecins nucléaires formés dans l'interprétation des images TEP avec le florbétapir ( 18 F). Un examen récent de tomodensitométrie (TDM) ou d imagerie par résonnance magnétique (IRM) du patient est recommandé afin d obtenir une image de fusion TEP-TDM ou TEP-IRM dans les cas où la localisation de la substance grise ou de la limite substance grise/substance blanche est incertaine sur l examen TEP (voir rubrique 4.4 Interprétation des images). 15
16 Posologie L activité recommandée pour un adulte de 70 kg est de 370 MBq de florbétapir ( 18 F). Le volume de l'injection ne doit pas être inférieur à 1 ml ni dépasser 10 ml. Populations particulières Patients âgés Aucune adaptation posologique n'est recommandée sur la base de l'âge. Insuffisance rénale et hépatique Il convient d'évaluer attentivement l'activité à administrer car la dose effective reçue peut être plus élevée chez ces patients. Voir rubrique 4.4. Il n a pas été conduit d études exhaustives de détermination et d ajustement de doses avec le médicament sur des populations normales et particulières. Les caractéristiques pharmacocinétiques du florbétapir ( 18 F) chez les patients présentant une insuffisance rénale ou hépatique n'ont pas été décrites. Population pédiatrique Il n'y a pas de justification à l utilisation d'amyvid dans la population pédiatrique. Mode d'administration Voie intraveineuse. Utilisation multidose. L activité du florbétapir ( 18 F) doit être mesurée à l'aide d'un activimètre (calibreur de dose) immédiatement avant l injection. La dose est administrée en bolus par injection intraveineuse, suivie d'un rinçage avec une solution injectable de chlorure de sodium à 9 mg/ml (0,9 %) pour garantir l'administration complète de la dose. L injection d Amyvid par un cathéter intraveineux court (d une longueur d environ 4 cm ou moins) minimise le potentiel d'adsorption de la substance active sur le cathéter. L'injection du florbétapir ( 18 F) doit être intraveineuse afin d éviter l'irradiation due à l extravasation locale ainsi que des artefacts d'imagerie. Acquisition des images L'acquisition de l image TEP doit démarrer environ 30 à 50 minutes après l'injection intraveineuse d Amyvid et doit durer 10 minutes. Les patients doivent être allongés sur le dos, la tête positionnée afin que le cerveau, y compris le cervelet, soient au centre du champ de vue de la caméra. Il est parfois nécessaire de limiter les mouvements de la tête à l'aide de bandes de contention adhésives ou de tout autre moyen de contention souple pour la tête. La reconstruction doit inclure une correction de l'atténuation ce qui permet d'obtenir une taille de pixels comprise entre 2,0 et 3,0 mm pour les images axiales. 4.3 Contre-indications Hypersensibilité à la substance active ou à l un des excipients mentionnés à la rubrique
17 4.4 Mises en garde spéciales et précautions d emploi Justification du bénéfice / risque individuel Pour chaque patient, l'exposition aux radiations ionisantes doit être justifiée par le bénéfice diagnostique attendu. La radioactivité administrée doit être telle que l irradiation qui en résulte soit aussi faible que possible tout en permettant d obtenir l information diagnostique attendue. Insuffisance rénale et insuffisance hépatique Il convient d'évaluer attentivement le rapport bénéfice risque chez ces patients car une exposition accrue aux rayonnements est possible. Le florbétapir ( 18 F) est excrété principalement par le système hépatobiliaire et chez les patients atteints d'insuffisance hépatique, il existe un risque potentiel d'exposition accrue aux rayonnements. Voir la rubrique 4.2. Population pédiatrique Pour toute information sur l'utilisation dans la population pédiatrique, voir les rubriques 4.2 ou 5.1. Interprétation des images acquises avec Amyvid Les images obtenues avec Amyvid ne doivent être interprétées que par des médecins nucléaires formés dans l'interprétation des images TEP avec le florbétapir ( 18 F). Un examen TEP négatif révèle une densité faible voir nulle de plaques de ß-amyloïde corticales. Un examen TEP positif indique une densité modérée à importante. Des erreurs d interprétation de l estimation de la densité des plaques de ß-amyloïde dans le cerveau, notamment des faux négatifs, ont été observées. L'examen des images doit se faire principalement selon une orientation axiale avec accès si besoin aux plans sagittal et coronal. Il est recommandé d'inclure dans l'examen des images toutes les coupes axiales du cerveau en utilisant une échelle de blanc-noir, l'intensité maximale de l'échelle correspondant à l'intensité maximale de tous les pixels du cerveau. L'interprétation de l'image comme positive ou négative est réalisée visuellement en comparant l'activité dans la substance grise corticale avec l'activité dans la substance blanche corticale adjacente (voir Figure 1). Sur les images négatives, l'activité est plus importante dans la substance blanche que dans la substance grise, ce qui crée un contraste gris-blanc net. Les images positives comporteront : a) Deux zones du cerveau ou plus (chacune étant plus grande qu'une seule circonvolution corticale) dans lesquelles le contraste gris-blanc est réduit ou absent. Il s'agit là de l'aspect le plus courant d'une image positive ; b) Une ou plusieurs zones dans lesquelles l'activité dans la substance grise est intense et nettement supérieure à l'activité dans la substance blanche adjacente. 17
18 Figure 1 : Exemples d examens négatifs (deux flèches du haut) et d examens positifs (deux flèches du bas) réalisés en TEP avec Amyvid. Les colonnes de gauche à droite présentent des images TEP en coupes sagittales, coronales et transversales. La colonne à l'extrémité droite présente un agrandissement de l image de la zone du cerveau délimitée par l encadré. Les deux flèches du haut indiquent des zones de conservation du contraste gris-blanc normal avec une activité corticale moindre par rapport à l'activité dans la substance blanche adjacente. Les deux flèches du bas indiquent des zones de diminution du contraste gris-blanc avec une activité corticale accrue, comparable à l'activité de la substance blanche adjacente. Images TEP d Amyvid Sagittale Coronale Transversale Limites d'utilisation Un examen positif ne permet pas d établir isolément un diagnostic de maladie d Alzheimer ou d autres déficiences cognitives puisque des plaques séniles de β-amyloïde peuvent être présentes dans la substance grise de patients atteints d'autres démences neurodégénératives (démence à corps de Lewy, démence associée à la maladie de Parkinson) ainsi que chez des personnes âgées asymptomatiques. Pour les limites d utilisation chez les patients ayant un trouble cognitif léger («Mild Cognitive Impairment», MCI), voir la rubrique 5.1. L'efficacité d Amyvid n'a pas été établie pour prédire l évolutivité de la maladie d Alzheimer ni pour évaluer la réponse au traitement (voir rubrique 5.1). Certaines images peuvent être difficiles à interpréter en raison de la présence d artéfacts sur l'image, d'une atrophie avec amincissement du ruban cortical ou d'une image floue, susceptibles de conduire à 18
19 des erreurs d'interprétation. En cas d'incertitude quant à l emplacement de la substance grise et de la jonction entre la substance grise et la substance blanche, sur une image réalisée par TEP, et s'il existe une image récente, réalisée par TDM ou IRM, le médecin nucléaire doit analyser l image fusionnée TEP-TDM ou TEP-IRM afin de préciser les relations entre la fixation du traceur TEP et la localisation de la substance grise. Dans certains cas, une augmentation de captation du traceur a été identifiée dans des structures extracérébrales telles que les glandes salivaires, la peau, les muscles et les os (voir rubrique 5.2). L évaluation des images TEP sagittales, couplées avec la TDM ou l IRM pourrait aider à distinguer l os occipital de la substance grise occipitale. Après l'examen Tout contact étroit avec les jeunes enfants et les femmes enceintes doit être restreint dans les 24 heures suivant l administration. Mises en garde spéciales La teneur en sodium est supérieure à 1 mmol (jusqu'à 37 mg par dose). A prendre en compte chez les patients suivant un régime hyposodé. Ce médicament contient 10 % de volume d éthanol (alcool), c'est-à-dire jusqu'à 790 mg par dose, ce qui équivaut à 20 ml de bière ou 8 ml de vin. Cette quantité peut être nocive en cas d utilisation chez les sujets alcooliques et doit être prise en compte chez les femmes enceintes et allaitantes et chez les groupes à haut risque tels que les insuffisants hépatiques ou les épileptiques. 4.5 Interactions avec d autres médicaments et autres formes d interactions Aucune étude d interaction in vivo n a été réalisée. Les études de fixation in vitro n'ont pas montré d'interférence de la fixation du florbétapir ( 18 F) sur les plaques de β-amyloïde en présence d'autres médicaments couramment utilisés pour traiter les patients atteints de la maladie d'alzheimer. 4.6 Fécondité, grossesse et allaitement Femmes en âge de procréer Lorsqu'il est nécessaire d'administrer des produits radiopharmaceutiques chez la femme en âge de procréer, toute éventualité de grossesse doit être écartée. Toute femme n ayant pas eu ses règles doit être considérée comme enceinte jusqu à preuve du contraire. Dans l incertitude (absence de règles, règles irrégulières, etc.), d autres techniques n utilisant pas les rayonnements ionisants (le cas échéant) doivent être envisagées. Grossesse Les examens utilisant des radionucléides chez la femme enceinte entraînent également l'irradiation du fœtus. Seuls les examens impératifs doivent donc être réalisés pendant la grossesse, si le bénéfice attendu excède largement le risque encouru par la mère et le fœtus. Aucune étude n'a été menée chez des femmes enceintes. Aucune étude des effets du florbétapir ( 18 F) sur la reproduction n'a été menée chez l'animal (voir rubrique 5.3). Allaitement On ne sait pas si le florbétapir ( 18 F) est excrété dans le lait maternel pendant l'allaitement. Avant d administrer un produit radiopharmaceutique à une femme qui allaite, il faut envisager de retarder l examen jusqu à la fin de l allaitement ou s assurer, dans le cas contraire, que le produit radiopharmaceutique le plus approprié a été choisi, compte tenu du passage de la radioactivité dans le lait. Si l administration est considérée comme indispensable, l allaitement maternel doit être interrompu pendant 24 heures et le lait tiré doit être éliminé. 19
20 Tout contact étroit avec les jeunes enfants doit être restreint dans les 24 heures suivant l administration. Fécondité Aucune étude sur la fécondité n'a été menée. 4.7 Effets sur l aptitude à conduire des véhicules et à utiliser des machines Sans objet. 4.8 Effets indésirables Résumé du profil de sécurité Les effets indésirables ont été recueillis dans des études cliniques impliquant 555 sujets et 665 administrations d'amyvid en solution injectable. Aucun effet indésirable grave lié à l'administration d'amyvid n'a été rapporté. Liste des effets indésirables Les fréquences sont définies comme suit : très fréquent ( 1/10) ; fréquent ( 1/100, < 1/10) ; peu fréquent ( 1/1 000, <1/100) ; rare ( 1/10 000, <1/1 000) ; très rare (< 1/10 000) ; fréquence indéterminée (ne peut être estimée sur la base des données disponibles). Même si des effets indésirables peuvent, en réalité, se produire à des fréquences inférieures à celles indiquées ci-dessous, la taille de la base de données source ne permettait pas d'attribution dans des catégories de fréquence inférieure à la catégorie «peu fréquent» ( 1/1 000, < 1/100). Affections du système nerveux Fréquent : céphalées Peu fréquent : dysgueusie Affections vasculaires Peu fréquent : bouffées vasomotrices Affections gastro-intestinales Peu fréquent : nausées Affections de la peau et du tissu sous-cutané Peu fréquent : prurit, urticaire Troubles généraux et anomalies au site d administration Peu fréquent : érythème au site d'injection L exposition aux rayonnements ionisants peut entraîner le développement de cancer et d anomalies héréditaires. La dose efficace étant de 7 msv lorsque l activité maximale recommandée de 370 MBq de florbétapir ( 18 F) est administrée, la probabilité de survenue de ces évènements indésirables est faible. 4.9 Surdosage Compte tenu de la faible quantité de florbétapir ( 18 F) contenue dans chaque dose, un surdosage entraînant des effets pharmacologiques n est pas attendu. En cas d administration d un surdosage de rayonnements, la dose absorbée par le patient doit être réduite en favorisant autant que possible l'élimination du radionucléide par une augmentation de la fréquence des mictions et de l'excrétion fécale. Il peut être utile d'estimer la dose réelle ayant été appliquée. 20
21 5. PROPRIETES PHARMACOLOGIQUES 5.1 Propriétés pharmacodynamiques Classe pharmacothérapeutique : produit radiopharmaceutique à usage diagnostique, système nerveux central, Code ATC : V09AX05 Mécanisme d'action Le florbétapir ( 18 F) se fixe aux plaques séniles de ß-amyloïde. Des études de fixation, utilisant des méthodes de coloration neuropathologique traditionnelle sur des cerveaux post-mortem de patients atteints de la maladie d'alzheimer ont mis en évidence des corrélations statistiquement significatives (p < 0,0001) entre la fixation in vitro du florbétapir ( 18 F) et les dépôts de β-amyloïde sous forme d'agrégats. In vivo, la corrélation entre la captation du florbétapir ( 18 F) dans la substance grise corticale et la charge totale de ß-amyloïde a été évaluée chez des patients en fin de vie à l aide d anticorps antiamyloïde 4G8 qui teinte l amyloïde β présente dans les plaques séniles diffuses. La fixation in vivo du florbétapir ( 18 F) à d autres structures ß-amyloïde, à d autres structures du cerveau ou à d autres récepteurs reste inconnue. Effets pharmacodynamiques Le florbétapir ( 18 F) n'a aucune activité pharmacologique détectable aux faibles concentrations chimiques présentes dans Amyvid. Dans les essais cliniques terminés, la captation du florbétapir ( 18 F) dans 6 zones corticales du cerveau préalablement définies (précunéus, cortex frontal, cortex cingulaire antérieur, cortex cingulaire postérieur, cortex pariétal et temporal) a été mesurée quantitativement à l'aide des valeurs de fixation normalisées (SUV, Standardised Uptake Values). Les ratios des SUV moyennes corticales (SUVR, par rapport au cervelet) sont plus élevés chez les patients atteints de la maladie d'alzheimer comparativement à ceux de sujets volontaires sains. Chez les patients atteints de la maladie d Alzheimer, les valeurs SUVR moyennes corticales par rapport au cervelet montrent des augmentations substantielles continues depuis le temps zéro jusqu à 30 minutes après l'administration, avec par la suite seulement de petits changements jusqu'à 90 minutes après l'injection. Aucune différence n'a été observée dans les résultats des SUVR chez des sujets prenant des médicaments couramment utilisés pour traiter la maladie d'alzheimer comparativement à ceux ne prenant aucun traitement pour la maladie d'alzheimer. Utilité clinique Une étude pivot chez 59 patients en fin de vie avait pour objectif d établir, les performances diagnostiques d Amyvid pour détecter la densité des plaques séniles corticales (rares ou nulles vs modérées ou importantes). Les résultats de l examen TEP ont été comparés avec la densité maximale de plaques séniles sur les coupes du cortex frontal, temporal et pariétal lors de l autopsie des patients dans les 24 mois suivant le TEP. Le statut cognitif des sujets n a pas pu être mesuré de manière fiable. Sur la totalité des 59 sujets, une lecture des images TEP réalisée en aveugle par 5 médecins spécialisés en médecine nucléaire s'est traduite par une lecture d'une sensibilité de 92 % (IC à 95 % : %) et d'une spécificité de 100 % (IC à 95 % : %). Dans une étude menée chez 47 volontaires sains jeunes (<40 ans), présumés ne pas présenter de plaques de β-amyloïde, toutes les images TEP avec Amyvid ont été négatives. La sensibilité et la spécificité d Amyvid pour détecter la densité des plaques séniles corticales ont été étudiées ensuite dans deux études complémentaires dans lesquelles différents groupes de médecins nucléaires ont interprété les images de quelques sujets ayant été suivis jusqu'à leur autopsie dans l étude pivot. Les résultats de ces études ont été similaires à ceux de l'étude pivot. En utilisant des valeurs des coefficients kappa de Fleiss, la concordance inter-imageur allait de 0,75 à 0,85. Dans une étude longitudinale, 142 sujets (dont le diagnostic clinique était un MCI, une maladie d Alzheimer ou un état cognitif normal) ont subi des examens d'imagerie TEP avec le florbétapir ( 18 F), 21
22 à l état initial, et ont été suivis pendant 3 ans afin d'évaluer la relation entre l'imagerie avec Amyvid et les modifications du diagnostic. Les valeurs de performance du diagnostic du TEP avec le florbétapir ( 18 F) sont présentées dans le tableau ci-dessus : En accord avec un diagnostic de MCI à l état initial En accord avec un diagnostic clinique de maladie d Alzheimer à l état initial N=51 N=31 Sensibilité 19/51 = 37.3% (IC à 95 % : 24,1-51,9%) 21/31 = 67.7% (IC à 95 % : 51,3-84,2%) Spécificité Ratio de probabilité positive Utilisation des cas non - MCI (état cognitif normal et maladie d Alzheimer clinique) 69/100 = 69,0% (IC à 95 % : 59,9-78,1%) Utilisation des cas non - Alzheimer (état cognitif normal et MCI) 91/120 = 75,8% (IC à 95 % : 68,2-83,5%) 1,20 (IC à 95 % :0,76-1,91) 2,80 (IC à 95 % : 1,88-4,18) Parmi les patients qui ont été cliniquement diagnostiqués avec un MCI à l entrée dans l étude, 9 (19%) ont développé une maladie d Alzheimer clinique 36 mois plus tard. Parmi les 17 patients ayant un MCI avec un examen TEP positif, 6 (35%) ont été cliniquement diagnostiqués avec une maladie d Alzheimer probable, 36 mois plus tard, comparés à 3 (10%) des 30 ayant eu un examen TEP négatif. La sensibilité des examens TEP avec Amyvid pour montrer le taux de conversion d un MCI vers une maladie d Alzheimer chez 9 patients ayant un MCI et ayant développé la maladie d Alzheimer («converters») était de 66,7% (IC à 95 % : 35-88%). La spécificité chez 38 patients «non converters» était de 71,0% (IC à 95 % : 55-83%). Le ratio de probabilité positive était de 2,31 (IC à 95 % : 1,2-4,5). Le schéma de l étude ne permet pas d estimer le risque de progression d un MCI vers une maladie d Alzheimer clinique. Population pédiatrique L Agence européenne des médicaments a accordé une dérogation à l obligation de soumettre les résultats d études réalisées avec Amyvid dans tous les sous-groupes de la population pédiatrique car il n'y a pas d'utilisation destinée à la population pédiatrique. 5.2 Propriétés pharmacocinétiques Distribution Le florbétapir ( 18 F) est distribué dans tout l'organisme en quelques minutes après l'injection, puis il est rapidement métabolisé. Fixation au niveau des organes La fixation maximale du florbétapir ( 18 F) au niveau du cerveau se produit en quelques minutes suivant l'injection. Elle est suivie d'une clairance cérébrale rapide dans les 30 premières minutes suivant l'injection. Les organes soumis à la plus forte exposition sont les organes d'élimination, principalement la vésicule biliaire, le foie et les intestins. Chez des sujets témoins sains, les niveaux de fixation du florbétapir ( 18 F) observés dans le cortex et le cervelet sont relativement faibles. Les analyses par régions montrent des niveaux de fixation légèrement plus élevés dans le noyau caudé, le putamen et l'hippocampe. Le niveau de fixation le plus élevé s observe dans les régions composées essentiellement de substance blanche (pont de Varole et centre ovale de Vieussens). Chez les sujets atteints de la maladie d Alzheimer, les régions corticales et le putamen affichent une fixation nettement supérieure comparativement aux sujets témoins. Chez les sujets atteints de la maladie d Alzheimer, comme chez les sujets témoins, on observe une faible 22
23 fixation dans le cervelet et l'hippocampe et une rétention élevée dans le pont de Varole et dans le centre ovale de Vieussens. Les fondements biochimiques de la fixation du florbétapir ( 18 F) dans la substance blanche du cerveau humain vivant ne peuvent s expliquer de manière définitive. Il a été émis l hypothèse que le ralentissement de la clairance du produit radiopharmaceutique pourrait contribuer à sa fixation dans la substance blanche étant donné que le débit sanguin cérébral régional dans la substance blanche est inférieur à la moitié de celui du cortex. La fixation a également été identifiée dans certain cas dans les structures extracérébrales telles que le cuir chevelu, les glandes salivaires, les muscles et les os du crâne. La raison de cette fixation n est pas connue mais il se peut qu elle soit due à l accumulation de florbétapir ( 18 F) ou de tout autre métabolite radioactif du florbétapir ( 18 F) ou à la radioactivité sanguine. Élimination L'élimination se fait principalement par clairance hépatique et excrétion dans la vésicule biliaire et les intestins. Une certaine accumulation/excrétion est également observée dans la vessie. Une radioactivité est présente dans l'urine sous forme de métabolites polaires du florbétapir ( 18 F). Demi-vie Le florbétapir ( 18 F) est très rapidement éliminé de la circulation sanguine après l'injection intraveineuse. Moins de 5 % de la radioactivité 18 F injectée réside dans le sang 20 minutes après l'administration, et moins de 2% est présente 45 minutes après l'administration. Le 18 F résiduel dans la circulation pendant la fenêtre d'imagerie de 30 à 90 minutes est essentiellement présent sous forme d'espèces 18 F polaires. La demi-vie physique du 18 F est de 110 minutes. Insuffisance rénale/hépatique La pharmacocinétique chez des patients atteints d'insuffisance rénale ou hépatique n'a pas été caractérisée. 5.3 Données de sécurité préclinique Toxicologie et pharmacologie de sécurité chez l'animal Les données non cliniques issues des études conventionnelles de pharmacologie de sécurité, toxicologie en administration unique et répétée, dans lesquelles le florbétapir [forme non radioactive de florbétapir ( 18 F)] a été utilisé, n ont pas révélé de risque particulier pour l homme. Une étude de dose aiguë a été menée chez le rat et la dose sans effet nocif observé (NOAEL) a été établie à une dose au moins égale à 100 fois la dose maximale chez l'homme. La toxicité potentielle de l'administration répétée des injections intraveineuses de florbétapir pendant 28 jours a été testée sur des rats et des chiens, et la dose sans effet nocif observé (NOAEL) a été établie à une dose au moins égale à 25 fois la dose maximale chez l'homme. Dans un essai in vitro de mutation bactérienne inverse (test d'ames), des augmentations du nombre de colonies en réversion ont été observées dans 2 des 5 souches exposées au florbétapir. Dans l'étude d'aberration chromosomique in vitro réalisée en utilisant des cultures de cellules lymphocytes périphériques humaines, le florbétapir n'a pas entraîné d augmentation du pourcentage des cellules présentant des aberrations structurelles lors d'une exposition de 3 heures, avec ou sans système d'activation ; toutefois, une exposition de 22 heures a entraîné une augmentation des aberrations structurelles à toutes les concentrations testées. La génotoxicité potentielle in vivo du florbétapir a été évaluée dans un test de détection des micronoyaux chez le rat. Dans ce test, le florbétapir n'a pas entraîné d'augmentation du nombre de micronoyaux dans les érythrocytes polychromatiques au plus fort niveau de dose possible, 372 µg/kg/jour, lorsqu'il est administré deux fois par jour pendant 3 jours consécutifs. Cette dose est égale à environ 500 fois la dose maximale chez l'homme, et n'a montré aucun signe de mutagénicité. Aucune étude n'a été menée chez l'animal pour étudier le potentiel carcinogène à long terme du florbétapir ( 18 F) ainsi que ses effets sur la fécondité ou la reproduction. 23
24 Aucune étude de toxicologie et de pharmacologie n'a été menée chez l'animal avec le florbétapir ( 18 F). 6 DONNEES PHARMACEUTIQUES 6.1 Liste des excipients Éthanol Ascorbate de sodium Chlorure de sodium Eau pour préparation injectable 6.2 Incompatibilités En l absence d études de compatibilité, ce médicament ne doit pas être mélangé avec d autres médicaments. 6.3 Durée de conservation 10 heures à compter de l'heure de calibration. 6.4 Précautions particulières de conservation Ce médicament ne nécessite pas de précautions particulières de conservation. Pour les précautions de conservation après la première ouverture, voir rubrique 6.3. Le stockage des radiopharmaceutiques doit être effectué conformément aux réglementations nationales relatives aux produits radioactifs. 6.5 Nature et contenu de l emballage extérieur Amyvid est conditionné en flacon de 10 ml ou de 15 ml en verre borosilicate, incolore, de type I, fermés par un bouchon en caoutchouc chlorobutylé, revêtu d un film de protection FluroTec et scellé par une capsule en aluminium. Un flacon multidose d'une capacité de 10 ml contient 1 à 10 ml de solution, correspondant à MBq à MBq à la date et à l'heure de calibration. Un flacon multidose d'une capacité de 15 ml contient 1 à 15 ml de solution, soit MBq à MBq à la date et à l'heure de calibration. En raison de différences de processus de fabrication, il est possible que certains lots de produits soient distribués dans des flacons avec des bouchons en caoutchouc percés. Chaque flacon est enfermé dans un conteneur blindé et ayant une épaisseur appropriée pour minimiser l'exposition au rayonnement externe. Taille de l emballage : 1 flacon. 6.6 Précautions particulières d élimination et manipulation Mises en garde générales Les produits radiopharmaceutiques ne doivent être réceptionnés, utilisés et administrés que par des personnes autorisées dans un service clinique agréé. Leur réception, conservation, utilisation, transfert et élimination sont soumis à la réglementation en vigueur et aux autorisations appropriées des autorités officielles compétentes. 24
25 Les produits radiopharmaceutiques doivent être préparés de manière à satisfaire aux exigences en matière de radioprotection et de qualité pharmaceutique. Les conditions d asepsie appropriées doivent être prises. Si l'intégrité du flacon est compromise, le produit ne doit pas être utilisé. Les procédures d'administration doivent être effectuées de manière à minimiser le risque de contamination de ce médicament et l'irradiation des opérateurs. Une protection adéquate est obligatoire. L'administration de produits radiopharmaceutiques présente des risques pour les autres personnes (y compris pour les femmes enceintes parmi les professionnels de santé), en raison des rayonnements externes ou de la contamination par les urines, les vomissements, etc. Des mesures de protection contre les rayonnements doivent donc être prises, conformément aux réglementations nationales. Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur. 7 TITULAIRE DE L AUTORISATION DE MISE SUR LE MARCHE Eli Lilly Nederland B.V., Grootslag 1-5, NL-3991 RA Houten, Pays-Bas 8 NUMERO(S) D AUTORISATION DE MISE SUR LE MARCHE 9 DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L AUTORISATION 10 DATE DE MISE A JOUR DU TEXTE 11 DOSIMETRIE Les doses de rayonnements absorbées par les différents organes et tissus d'un patient adulte moyen (70 kg) pour 370 MBq de florbétapir ( 18 F), estimées à l'aide des méthodes standard des calculs de dosimétrie (Volume 30 de la Commission Internationale de Protection Radiologique, CIPR) sont présentées dans le tableau ci-dessous. Aucune hypothèse n'a été formulée sur la vidange de la vessie. 25
26 Dose absorbée par activité administrée (µgy/mbq) Moyenne ORGANE/TISSU Surrénales 13,6 Cerveau 10,0 Seins 6,2 Paroi de la vésicule biliaire 143,0 Paroi du côlon descendant 27,8 Intestin grêle 65,5 Paroi gastrique 11,7 Paroi du côlon ascendant 74,4 Paroi cardiaque 12,7 Reins 13,0 Foie 64,4 Poumons 8,5 Muscle 8,6 Ovaires 17,6 Pancréas 14,4 Moelle rouge 14,3 Cellules ostéogéniques 27,6 Peau 5,9 Rate 8,9 Testicules 6,8 Thymus 7,3 Thyroïde 6,8 Paroi de la vessie 27,1 Utérus 15,6 Corps entier 11,6 Dose efficace (µsv/mbq) a 18,6 a On suppose un facteur de qualité (Q) de 1 pour la conversion de la dose absorbée en dose efficace pour 18 F. La dose efficace résultant de l'administration d'une dose de 370 MBq pour un adulte de 70 kg est d'environ 7 msv. Si une TDM est réalisée simultanément dans le cadre d un examen TEP, l exposition aux radiations ionisantes augmentera selon le paramétrage utilisé lors de l acquisition des images TDM. Pour une activité administrée de 370 MBq, la dose type de rayonnement délivrée à l'organe cible (cerveau) est de 3,7 mgy. Pour une activité administrée de 370 MBq, les doses types de rayonnement délivrées aux organes critiques sont de 53 mgy pour la vésicule biliaire, 27,5 mgy pour la paroi du côlon ascendant, 10,3 mgy pour la paroi du côlon descendant, 24,2 mgy pour l'intestin grêle et de 23,8 mgy pour le foie. 12 INSTRUCTIONS POUR LA PREPARATION DES RADIOPHARMACEUTIQUES Méthode de préparation Avant utilisation, le conditionnement doit être vérifié et l'activité mesurée à l'aide d'un activimètre. Les prélèvements doivent être effectués dans des conditions d'asepsie. Les flacons ne doivent pas être ouverts avant désinfection du bouchon ; la solution doit être prélevée à travers le bouchon à l'aide d une seringue à dose unique munie d'une protection appropriée et d'une aiguille stérile à usage unique ou à l aide d un système d application automatisé autorisé. Utiliser uniquement des seringues en polypropylène/polyéthylène haute densité. Si l'intégrité du flacon est compromise, le produit ne doit pas être utilisé. Amyvid peut être dilué aseptiquement avec une solution injectable de chlorure de sodium à 9 mg/ml (0,9 %) jusqu à une dilution maximale de 1:5. Le produit dilué doit être utilisé dans les 4 heures suivant la dilution. 26
27 Contrôle qualité Un contrôle visuel de la solution doit être effectué avant utilisation. Seules les solutions limpides et dépourvues de particules visibles pourront être utilisées. Des informations détaillées sur ce médicament sont disponibles sur le site internet de l Agence européenne des médicaments 27
28 ANNEXE II A. FABRICANT(S) RESPONSABLE(S) DE LA LIBERATION DES LOTS B. CONDITIONS OU RESTRICTIONS DE DELIVRANCE ET D UTILISATION C. AUTRES CONDITIONS ET OBLIGATIONS DE L AUTORISATION DE MISE SUR LE MARCHE 28
29 A. FABRICANT(S) RESPONSABLE(S) DE LA LIBERATION DES LOTS Noms et adresses des fabricants responsables de la libération des lots Advanced Accelerator Applications-Bethune 126 Rocade Sud Beuvry France Advanced Accelerator Applications (Italy). S.r.l. Via Piero Maroncelli, Meldola (FC) Italie Advanced Accelerator Applications-Saint Genis-Poully 20 Rue Diesel Saint Genis-Poully France Advanced Accelerator Applications Iberica Avda Navarra 3-5 Pol. Ind. La Cuesta, Sector La Almunia de Dona Godina Zaragoza Espagne Cyclopharma Laboratories Glisy Allee Nautilus Glisy France Cyclopharma Laboratories Toulouse Canceropole Voie interne Toulouse-Langlade France PETNET solutions Heathfield Way, Nottingham City Hospital, Gate 1 Hucknall Road Nottingham NG51PB Royaume-Uni Le nom et l adresse du fabricant responsable de la libération du lot concerné doivent figurer sur la notice du médicament. B. CONDITIONS OU RESTRICTIONS DE DELIVRANCE ET D UTILISATION Médicament soumis à prescription médicale restreinte (voir Annexe I : résumé des caractéristiques du produit, rubrique 4.2). 29
30 C. AUTRES CONDITIONS ET OBLIGATIONS DE L AUTORISATION DE MISE SUR LE MARCHE Système de pharmacovigilance Le titulaire de l autorisation de mise sur le marché doit s assurer que le système de pharmacovigilance, présenté dans le Module de l autorisation de mise sur le marché, est mis en place et est opérationnel avant et pendant la commercialisation du médicament. Plan de gestion des risques (PGR) Le titulaire de l autorisation de mise sur le marché réalisera les activités décrites dans le plan de pharmacovigilance et le plan de minimisation du risque, comme convenu dans le PGR présenté dans le Module de l autorisation de mise sur le marché, ainsi que toutes actualisations ultérieures du PGR adoptées par le comité des médicaments à usage humain (CHMP). Conformément à la recommandation du CHMP concernant les systèmes de gestion des risques des médicaments à usage humain, le PGR actualisé doit être soumis en même temps que le prochain rapport périodique de pharmacovigilance (PSUR). De plus, un PGR actualisé doit être soumis lors de la réception de nouvelles informations pouvant avoir un impact sur le profil de sécurité du médicament, le plan de pharmacovigilance ou les activités de minimisation des risques, dans les 60 jours qui suivent la date à laquelle une étape importante (pharmacovigilance ou minimisation du risque) est franchie, à la demande de l Agence européenne des médicaments. CONDITIONS OU RESTRICTIONS RELATIVES A L UTILISATION SÛRE ET EFFICACE DU MEDICAMENT Avant le lancement dans chaque Etat Membre, le titulaire de l autorisation de mise sur le marché devra convenir d un programme d éducation final en accord avec l Autorité Compétente nationale. Suite aux discussions et aux accords conclus avec l Autorité Compétente nationale de chaque Etat Membre où Amyvid est commercialisé, le titulaire de l autorisation de mise sur le marché devra s assurer, au moment du lancement et après le lancement, de l accès au programme de formation de chaque médecin susceptible d utiliser Amyvid afin de garantir une interprétation exacte et fiable des images TEP. Le programme de formation des médecins doit contenir les éléments clé suivants : L information relative à la pathologie amyloïde dans la maladie d Alzheimer ; toute information pertinente sur Amyvid en tant que traceur TEP ß-amyloïde, notamment l indication approuvée selon le RCP, les limites d utilisation, les erreurs d interprétation, les informations relatives à la tolérance ainsi que l information provenant des résultats des essais cliniques sur l utilisation diagnostique d Amyvid. La revue des critères de lecture TEP, notamment la méthode de lecture des images, les critères d interprétation ainsi que les images illustrant la méthodologie de la lecture binaire. Le matériel doit inclure des cas de démonstration de TEP avec Amyvid avec une interprétation correcte des images TEP par un médecin nucléaire expérimenté ; des images TEP avec Amyvid pour une auto-évaluation ; et une procédure d auto-qualification doit être proposée à chaque participant à la formation. La formation doit inclure un nombre suffisant de cas clairement positifs et négatifs ainsi que des cas de niveau intermédiaire. Les cas doivent être histopathologiquement confirmés, si possible. L expertise et la qualification des formateurs doivent être garanties aussi bien lors de la formation électronique que présentielle. 30
31 ANNEXE III ETIQUETAGE ET NOTICE 31
32 A. ETIQUETAGE 32
33 MENTIONS DEVANT FIGURER SUR L EMBALLAGE EXTÉRIEUR EMBALLAGE EXTÉRIEUR 1. DENOMINATION DU MEDICAMENT Amyvid 800 MBq/mL, solution injectable Florbétapir ( 18 F) 2. COMPOSITION EN SUBSTANCE(S) ACTIVE(S) Chaque ml de solution injectable contient 800 MBq de florbétapir ( 18 F) à la date et à l'heure de calibration (ToC). 3. LISTE DES EXCIPIENTS Éthanol, ascorbate de sodium, chlorure de sodium, eau pour préparation injectable. Voir la notice pour plus d informations. 4. FORME PHARMACEUTIQUE ET CONTENU Solution injectable 1 flacon contient Volume : {Z} ml Activité : {Y} MBq dans {Z} ml à {hh:mm}{fuseau horaire} le {JJ/MM/AAAA} 5. MODE ET VOIE(S) D'ADMINISTRATION Lire la notice avant utilisation. Voie intraveineuse Multidose 6. MISE EN GARDE SPECIALE INDIQUANT QUE LE MEDICAMENT DOIT ETRE CONSERVE HORS DE PORTEE ET DE VUE DES ENFANTS Tenir hors de la vue et de la portée des enfants. 7. AUTRE(S) MISE(S) EN GARDE SPECIALE(S), SI NECESSAIRE Produit radioactif 8. DATE DE PEREMPTION EXP {hh:mm}{fuseau horaire} le{jj/mm/aaaa} 33
34 9. PRECAUTIONS PARTICULIERES DE CONSERVATION 10. PRECAUTIONS PARTICULIERES D ELIMINATION DES MEDICAMENTS NON UTILISES OU DES DECHETS PROVENANT DE CES MEDICAMENTS S IL Y A LIEU Tout matériel non utilisé doit être détruit conformément à la réglementation locale. 11. NOM ET ADRESSE DU TITULAIRE DE L AUTORISATION DE MISE SUR LE MARCHE Eli Lilly Nederland B.V., Grootslag 1-5, NL-3991 RA Houten, Pays-Bas 12. NUMERO(S) D AUTORISATION DE MISE SUR LE MARCHE 13. NUMERO DU LOT Lot 14. CONDITIONS DE PRESCRIPTION ET DE DELIVRANCE Médicament soumis à prescription médicale. 15. INDICATIONS D UTILISATION 16. INFORMATIONS EN BRAILLE Justification de ne pas inclure l information en Braille acceptée 34
35 MENTIONS MINIMALES DEVANT FIGURER SUR LES PETITS CONDITIONNEMENTS PRIMAIRES ETIQUETAGE FLACON 1. DENOMINATION DU MEDICAMENT ET VOIE(S) D ADMINISTRATION Amyvid 800 MBq/mL, solution injectable Florbétapir ( 18 F) 2. MODE D ADMINISTRATION Voie intraveineuse Lire la notice avant utilisation. 3. DATE DE PEREMPTION EXP : ToC + 7,5 h 4. NUMERO DU LOT Lot 5. CONTENU EN POIDS, VOLUME OU UNITE Pas plus de MBq au ToC (voir emballage extérieur) 6. AUTRES Produit radioactif Advanced Accelerator Applications, 62660, Beuvry, France Advanced Accelerator Applications, 47014, Meldola, Italie Advanced Accelerator Applications, 01630, Saint Genis Pouilly, France Advanced Accelerator Applications, 50100, Saragosse, Espagne Laboratoires Cyclopharma, 80440, Glisy, France Laboratoires Cyclopharma, 31000, Toulouse, France PETNET Solutions, Nottingham, NG5 1PB, Royaume-Uni 35
36 MENTIONS DEVANT FIGURER SUR L EMBALLAGE EXTÉRIEUR EMBALLAGE EXTÉRIEUR 1. DENOMINATION DU MEDICAMENT Amyvid MBq/mL, solution injectable Florbétapir ( 18 F) 2. COMPOSITION EN SUBSTANCE(S) ACTIVE(S) Chaque ml de solution injectable contient MBq de florbétapir ( 18 F) à la date et à l'heure de calibration (ToC). 3. LISTE DES EXCIPIENTS Éthanol, ascorbate de sodium, chlorure de sodium, eau pour préparation injectable. Voir la notice pour plus d informations. 4. FORME PHARMACEUTIQUE ET CONTENU Solution injectable 1 flacon contient Volume : {Z} ml Activité : {Y} MBq dans {Z} ml à {hh:mm}{fuseau horaire} le {JJ/MM/AAAA} 5. MODE ET VOIE(S) D'ADMINISTRATION Lire la notice avant utilisation. Voie intraveineuse Multidose 6. MISE EN GARDE SPECIALE INDIQUANT QUE LE MEDICAMENT DOIT ETRE CONSERVE HORS DE PORTEE ET DE VUE DES ENFANTS Tenir hors de la vue et de la portée des enfants. 7. AUTRE(S) MISE(S) EN GARDE SPECIALE(S), SI NECESSAIRE Produit radioactif 8. DATE DE PEREMPTION EXP {hh:mm}{fuseau horaire} le{jj/mm/aaaa} 36
37 9. PRECAUTIONS PARTICULIERES DE CONSERVATION 10. PRECAUTIONS PARTICULIERES D ELIMINATION DES MEDICAMENTS NON UTILISES OU DES DECHETS PROVENANT DE CES MEDICAMENTS S IL Y A LIEU Tout matériel non utilisé doit être détruit conformément à la réglementation locale. 11. NOM ET ADRESSE DU TITULAIRE DE L AUTORISATION DE MISE SUR LE MARCHE Eli Lilly Nederland B.V., Grootslag 1-5, NL-3991 RA Houten, Pays-Bas 12. NUMERO(S) D AUTORISATION DE MISE SUR LE MARCHE 13. NUMERO DU LOT Lot 14. CONDITIONS DE PRESCRIPTION ET DE DELIVRANCE Médicament soumis à prescription médicale. 15. INDICATIONS D UTILISATION 16. INFORMATIONS EN BRAILLE Justification de ne pas inclure l information en Braille acceptée 37
38 MENTIONS MINIMALES DEVANT FIGURER SUR LES PETITS CONDITIONNEMENTS PRIMAIRES ETIQUETAGE FLACON 1. DENOMINATION DU MEDICAMENT ET VOIE(S) D ADMINISTRATION Amyvid MBq/mL, solution injectable Florbétapir ( 18 F) 2. MODE D ADMINISTRATION Voie intraveineuse Lire la notice avant utilisation. 3. DATE DE PEREMPTION EXP. : ToC + 10 h 4. NUMERO DU LOT Lot 5. CONTENU EN POIDS, VOLUME OU UNITE Pas plus de MBq au ToC (voir emballage extérieur) 6. AUTRES Produit radioactif Advanced Accelerator Applications, 62660, Beuvry, France Advanced Accelerator Applications, 47014, Meldola, Italie Advanced Accelerator Applications, 01630, Saint Genis Pouilly, France Advanced Accelerator Applications, 50100, Saragosse, Espagne Laboratoires Cyclopharma, 80440, Glisy, France Laboratoires Cyclopharma, 31000, Toulouse, France PETNET Solutions, Nottingham, NG5 1PB, Royaume-Uni 38
39 B. NOTICE 39
40 Notice : Information du patient Amyvid MBq/mL, solution injectable Amyvid 800 MBq/mL, solution injectable Florbétapir ( 18 F) Veuillez lire attentivement cette notice avant de recevoir ce médicament car elle contient des informations importantes pour vous. - Gardez cette notice. Vous pourriez avoir besoin de la relire. - Si vous avez d autres questions, interrogez votre médecin ou votre spécialiste en médecine nucléaire qui supervisera la procédure. - Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin spécialiste en médecine nucléaire. Ceci s applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Que contient cette notice? 1. Qu'est-ce qu'amyvid et dans quel cas est-il utilisé? 2. Quelles sont les informations à connaître avant qu Amyvid soit utilisé? 3. Comment Amyvid sera-t-il utilisé? 4. Quels sont les effets indésirables éventuels? 5 Comment Amyvid est-il conservé? 6. Contenu de l'emballage et autres informations 1. Qu'est-ce qu'amyvid et dans quel cas est-il utilisé? Ce médicament est un produit radiopharmaceutique à usage diagnostique uniquement. Amyvid contient la substance active florbétapir ( 18 F). Amyvid est administré aux personnes ayant des problèmes de mémoire pour permettre aux médecins d'effectuer un examen d imagerie cérébrale dénommé Tomographie par Emission de Positons (TEP). Un examen TEP avec Amyvid, associé à d'autres tests du fonctionnement cérébral peut aider votre médecin à déterminer si vous avez ou non des plaques de β-amyloïde au niveau du cerveau. Ce médicament est destiné aux adultes uniquement. Il convient de discuter des résultats avec le médecin qui a demandé cet examen. L'utilisation d'amyvid implique une exposition à de petites quantités de radioactivité. Votre médecin et le médecin spécialisé en médecine nucléaire ont considéré que le bénéfice de cet examen avec le produit radiopharmaceutique est supérieur au risque d'exposition aux rayonnements. 2. Quelles sont les informations à connaître avant qu Amyvid soit utilisé? Amyvid ne doit pas être utilisé - si vous êtes allergique au florbétapir ( 18 F) ou à l un des autres composants contenus dans ce médicament mentionnés dans la rubrique 6. Avertissements et précautions Adressez-vous à votre médecin spécialisé en médecine nucléaire avant de recevoir Amyvid si vous : - avez des problèmes rénaux - avez des problèmes hépatiques - êtes enceinte ou si vous pensez que vous pouvez l'être - allaitez Enfants et adolescents Amyvid n est pas destiné à être utilisé chez les enfants et les adolescents. 40
41 Autres médicaments et Amyvid Informez votre médecin spécialisé en médecine nucléaire si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament car ils sont susceptibles d interférer avec l interprétation des images. Grossesse et allaitement S il existe une possibilité pour que vous soyez enceinte, si vous n avez pas eu vos règles ou si vous allaitez, vous devez informer le médecin spécialiste en médecine nucléaire avant qu Amyvid ne vous soit administré. En cas de doute, il est important de consulter votre médecin spécialiste en médecine nucléaire qui supervisera l examen. Si vous êtes enceinte Le médecin spécialisé en médecine nucléaire ne donnera ce produit pendant la grossesse seulement si un bénéfice est attendu et qui serait supérieur aux risques. Si vous allaitez Vous devez interrompre l'allaitement pendant 24 heures après l'injection d'amyvid et le lait tiré pendant cette période devra être éliminé. Veuillez demander au médecin spécialisé en médecine nucléaire qui supervisera l examen à quel moment vous pouvez reprendre l allaitement. Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez d avoir un enfant, demandez conseil au spécialiste en médecine nucléaire avant de recevoir ce médicament. Conduite de véhicules et utilisation de machines Il est peu probable qu'amyvid ait un effet sur l'aptitude à conduire des véhicules et à utiliser des machines. Amyvid contient de l éthanol et du sodium Ce médicament contient 10 % d éthanol (alcool) en volume, c est-à-dire jusqu'à 790 mg par dose, soit l'équivalent de 20 ml de bière ou de 8 ml de vin, ce qui peut être nocif pour les patients souffrant d alcoolisme. Ceci doit être pris en compte chez les femmes enceintes ou qui allaitent, chez les groupes à risque tels que les patients ayant une maladie du foie ou souffrant d épilepsie. Ce médicament contient également de l ascorbate de sodium et du chlorure de sodium. La teneur en sodium est supérieure à 1 mmol (jusqu'à 37 mg par dose). Ceci doit être pris en compte chez les patients suivant un régime à faible teneur en sel. 3. Comment Amyvid sera-t-il utilisé? Il existe des réglementations strictes concernant l utilisation, la manipulation et l élimination des substances radioactives. Amyvid ne sera utilisé que dans des services spécialisés contrôlés. Il ne peut être manipulé et injecté que par un personnel formé et qualifié pour l utiliser en toute sécurité. Ce personnel vous expliquera tout ce que vous devez faire pour une utilisation sans risque de ce médicament. Dose Le médecin spécialisé en médecine nucléaire qui supervise l examen décidera de la quantité d'amyvid à utiliser dans votre cas. Il s'agit de la quantité minimale nécessaire pour obtenir les informations souhaitées. La quantité habituellement recommandée pour un adulte est de 370 MBq. Le Mégabecquerel (MBq) est l unité utilisée pour exprimer la radioactivité. Administration d Amyvid et déroulement de l examen Amyvid est administré par injection dans une veine (injection intraveineuse) suivie du rinçage par une solution de chlorure de sodium pour garantir l'administration complète de la dose. 41
42 Une injection est généralement suffisante pour effectuer l'examen dont votre médecin a besoin. Durée de la procédure Votre médecin spécialisé en médecine nucléaire vous informera de la durée habituelle de l examen. La durée d un examen d imagerie cérébrale est habituellement de 30 à 50 minutes environ après l'injection d'amyvid. Après l'administration d'amyvid, vous devez : Éviter tout contact étroit avec les jeunes enfants et les femmes enceintes dans les 24 heures suivant l'injection. Le médecin spécialisé en médecine nucléaire vous indiquera si vous devez prendre des précautions spéciales après avoir reçu ce médicament. Veuillez contacter votre médecin spécialisé en médecine nucléaire si vous avez des questions à poser. Si vous avez reçu plus d Amyvid que vous n auriez dû Un surdosage est peu probable car vous ne recevrez qu'une seule dose d Amyvid contrôlée avec précision par le médecin spécialisé en médecine nucléaire qui supervise l examen. Cependant, en cas de surdosage, vous recevrez le traitement approprié. En particulier, le médecin spécialisé en médecine nucléaire en charge de l examen pourra fournir des moyens d augmenter l élimination des urines et des selles afin d aider à éliminer la radioactivité de votre corps. Si vous avez d'autres questions sur l'utilisation d Amyvid, demandez plus d informations à votre médecin spécialisé en médecine nucléaire qui supervise l examen. 4. Quels sont les effets indésirables éventuels Comme tous les médicaments, ce médicament peut provoquer des effets indésirables, mais ils ne surviennent pas systématiquement chez tout le monde. Les effets indésirables fréquents d Amyvid (pouvant toucher jusqu à 1 personne sur 10) sont les suivants : - maux de tête Les effets indésirables peu fréquents d Amyvid (pouvant toucher jusqu à 1 personne sur 100) sont les suivants : - nausées, - goût altéré, - bouffées de chaleur, - démangeaisons, - éruption cutanée au niveau du point d'injection ou à d'autres endroits. Ce produit radiopharmaceutique libèrera de faibles quantités de rayonnements ionisants, associées au plus faible risque d'induction de cancer et de survenue d'anomalies congénitales (c'est-à-dire de maladies génétiques). Voir aussi la rubrique 1. Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin spécialisé en médecine nucléaire. Ceci s applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. 5. Comment Amyvid sera-t-il conservé? Vous n'aurez pas à conserver ce médicament. Ce médicament est conservé sous la responsabilité du spécialiste dans des locaux appropriés. Les produits radiopharmaceutiques seront conservés conformément à la réglementation nationale relative aux matières radioactives. 42
43 Les informations suivantes sont destinées exclusivement au spécialiste. Amyvid ne doit pas être utilisé après la date de péremption indiquée sur l étiquette après EXP. 6. Contenu de l'emballage et autres informations Ce que contient Amyvid - La substance active est le florbétapir ( 18 F). Amyvid MBq/mL : 1 ml de solution injectable contient MBq de florbétapir ( 18 F) à la date et à l heure de calibration. Amyvid 800 MBq/mL : 1 ml de solution injectable contient 800 MBq de florbétapir ( 18 F) à la date et à l heure de calibration. - Les autres composants sont : éthanol, ascorbate de sodium, chlorure de sodium, eau pour préparation injectable (voir rubrique 2 «Amyvid contient de l éthanol et du sodium»). Qu est-ce qu Amyvid et contenu de l emballage extérieur Amyvid est une solution pour injection limpide, incolore. Il est fourni dans un flacon en verre borosilicate transparent de type I de 10 ml ou de 15 ml. Taille de l emballage : Amyvid MBq/mL : Un flacon multidose d une capacité de 10 ml contient 1 à 10 ml de solution, correspondant à 1900 à MBq à la date et à l heure de calibration. Un flacon multidose d une capacité de 15 ml contient 1 à 15 ml de solution, correspondant à à MBq à la date et à l heure de calibration. Amyvid 800 MBq/mL : Un flacon multidose d une capacité de 10 ml contient 1 à 10 ml de solution, correspondant à 800 à 8000 MBq à la date et à l heure de calibration. Un flacon multidose d une capacité de 15 ml contient 1 à 15 ml de solution, correspondant à 800 à MBq à la date et à l heure de calibration. Titulaire de l Autorisation de mise sur le marché et fabricant Eli Lilly Nederland B.V., Grootslag 1-5, NL-3991 RA Houten, Pays-Bas Fabricant Advanced Accelerator Applications - Béthune, 126, Rocade Sud, Beuvry, France Advanced Accelerator Applications - Saint Genis Pouilly, 20, Rue Diesel, 01630, Saint Genis Pouilly, France Advanced Accelerator Applications - Meldola, Via Piero Maroncelli, 40/ Meldola (FO), Italie Advanced Accelerator Applications - Zaragoza, Poligono Industrial La Cuesta-Sector 3, Parcelas 1 y 2 La Almunia de Doña Godina (Saragosse), Espagne Laboratoires Cyclopharma - Glisy, Allée du Nautilus, ZAC Croix de Fer Glisy, France Laboratoires Cyclopharma - Toulouse, Cancéropôle de Toulouse, Voie interne Toulouse- Langlade, France PETNET Solutions, Heathfield Way, Nottingham City Hospital, Gate 1, Hucknall Road, Nottingham, NG51PB, Royaume-Uni Pour toute information complémentaire concernant ce médicament, veuillez prendre contact avec le représentant local du titulaire de l autorisation de mise sur le marché : 43
44 Belgique/België/Belgien Eli Lilly Benelux S.A./N.V. Tél/Tel: + 32-(0) България ТП "Ели Лили Недерланд" Б.В. - България тел Česká republika ELI LILLY ČR, s.r.o. Tel: Danmark Eli Lilly Danmark A/S Tlf: Deutschland Lilly Deutschland GmbH Tel (0) Eesti Eli Lilly Holdings Limited Eesti filiaal Tel: Ελλάδα ΦΑΡΜΑΣΕΡΒ-ΛΙΛΛΥ Α.Ε.Β.Ε. Τηλ: España Lilly S.A. Tel: France Lilly France SAS Tél: +33-(0) Ireland Eli Lilly and Company (Ireland) Limited Tel: (0) Ísland Icepharma hf. Sími Italia Eli Lilly Italia S.p.A. Tel: Κύπρος Phadisco Ltd Τηλ: Latvija Eli Lilly Holdings Limited pārstāvniecība Latvijā Tel: Lietuva Eli Lilly Holdings Limited atstovybė Tel (5) Luxembourg/Luxemburg Eli Lilly Benelux S.A./N.V. Tél/Tel: + 32-(0) Magyarország Lilly Hungária Kft. Tel: Malta Charles de Giorgio Ltd. Tel: Nederland Eli Lilly Nederland B.V. Tel: + 31-(0) Norge Eli Lilly Norge A.S. Tlf: Österreich Eli Lilly Ges.m.b.H. Tel: + 43-(0) Polska Eli Lilly Polska Sp. z o.o. Tel: +48 (0) Portugal Lilly Portugal Produtos Farmacêuticos, Lda Tel: România Eli Lilly România S.R.L. Tel: Slovenija Eli Lilly farmacevtska družba, d.o.o. Tel: +386 (0) Slovenská republika Eli Lilly Slovakia, s.r.o. Tel: Suomi/Finland Oy Eli Lilly Finland Ab Puh/Tel: (0) Sverige Eli Lilly Sweden AB Tel: + 46-(0) United Kingdom Eli Lilly and Company Limited Tel: + 44-(0) La dernière date à laquelle cette notice a été révisée est {MM/AAAA} Des informations détaillées sur ce médicament sont disponibles sur le site internet de l Agence européenne des médicaments : Les informations suivantes sont destinées exclusivement aux professionnels de la santé : 44
45 Le résumé des caractéristiques du produit (RCP) complet d Amyvid figure sous la forme d un document séparé dans l emballage du produit, afin de fournir aux professionnels de la santé des informations scientifiques complémentaires et d ordre pratique sur l'administration et l utilisation de ce produit radiopharmaceutique. Veuillez vous reporter au RCP. 45
GONADOTROPHINE CHORIONIQUE ENDO 5000 U.I./1 ml, lyophilisat et solution pour usage parentéral intramusculaire
 ésumé des Caractéristiques du Produit 1 sur 5 21/09/2010 14:31 Mis à jour : 16/02/2010 1. DENOMINATION DU MEDICAMENT GONADOTROPHINE CHORIONIQUE ENDO 5000 U.I./1 ml, lyophilisat et solution pour usage parentéral
ésumé des Caractéristiques du Produit 1 sur 5 21/09/2010 14:31 Mis à jour : 16/02/2010 1. DENOMINATION DU MEDICAMENT GONADOTROPHINE CHORIONIQUE ENDO 5000 U.I./1 ml, lyophilisat et solution pour usage parentéral
UE2 CANCEROLOGIE Place de la Médecine Nucléaire
 UE2 CANCEROLOGIE Place de la Médecine Nucléaire Imagerie Imagerie de Gamma Caméra Tomographie d émission monophotoniqueou TEMP: radiopharmaceutiqueémetteurs de rayonnement Gamma Imagerie de Caméra TEP
UE2 CANCEROLOGIE Place de la Médecine Nucléaire Imagerie Imagerie de Gamma Caméra Tomographie d émission monophotoniqueou TEMP: radiopharmaceutiqueémetteurs de rayonnement Gamma Imagerie de Caméra TEP
ANNEXE IIIB NOTICE : INFORMATION DE L UTILISATEUR
 Dénomination du médicament ANNEXE IIIB NOTICE : INFORMATION DE L UTILISATEUR LYSOPAÏNE MAUX DE GORGE AMBROXOL CITRON 20 mg SANS SUCRE, pastille édulcorée au sorbitol et au sucralose. Chlorhydrate d ambroxol
Dénomination du médicament ANNEXE IIIB NOTICE : INFORMATION DE L UTILISATEUR LYSOPAÏNE MAUX DE GORGE AMBROXOL CITRON 20 mg SANS SUCRE, pastille édulcorée au sorbitol et au sucralose. Chlorhydrate d ambroxol
Tout ce que vous avez toujours voulu savoir sur la scintigraphie osseuse et le TEP-SCAN
 Tout ce que vous avez toujours voulu savoir sur la scintigraphie osseuse et le TEP-SCAN Docteur Antoine MONET Centre d Imagerie Fonctionnelle Clinique Saint Augustin Jeudi 25 Septembre 2008 Un peu d histoire
Tout ce que vous avez toujours voulu savoir sur la scintigraphie osseuse et le TEP-SCAN Docteur Antoine MONET Centre d Imagerie Fonctionnelle Clinique Saint Augustin Jeudi 25 Septembre 2008 Un peu d histoire
Médecine nucléaire Diagnostic in vivo
 RADIOPROTECTION : SECTEUR MÉDICAL Médecine nucléaire Diagnostic in vivo TEP-TDM ou TEP (1) au fluor 18 et autres émetteurs de positons Définition : acte à visée diagnostique utilisant actuellement du fluor
RADIOPROTECTION : SECTEUR MÉDICAL Médecine nucléaire Diagnostic in vivo TEP-TDM ou TEP (1) au fluor 18 et autres émetteurs de positons Définition : acte à visée diagnostique utilisant actuellement du fluor
Rapport final sur les priorités en matière de surveillance de la médecine
 Département fédéral de l'intérieur DF) Office fédéral de la santé publique OFSP Unité de direction Protection des consommateurs Rapport final sur les priorités en matière de surveillance de la médecine
Département fédéral de l'intérieur DF) Office fédéral de la santé publique OFSP Unité de direction Protection des consommateurs Rapport final sur les priorités en matière de surveillance de la médecine
Notice publique PERDOLAN - PÉDIATRIE
 Notice publique PERDOLAN - PÉDIATRIE Lisez attentivement cette notice jusqu'à la fin car elle contient des informations importantes pour vous. Ce médicament est délivré sans ordonnance. Néanmoins, vous
Notice publique PERDOLAN - PÉDIATRIE Lisez attentivement cette notice jusqu'à la fin car elle contient des informations importantes pour vous. Ce médicament est délivré sans ordonnance. Néanmoins, vous
RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT. Bisolax 5 mg comprimés enrobés contient 5 mg de bisacodyl par comprimé enrobé.
 RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT 1. Dé nomination du mé dicame nt Bisolax 5 mg comprimés enrobés. 2. Composition qualitative e t quantitative Bisolax 5 mg comprimés enrobés contient 5 mg de bisacodyl
RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT 1. Dé nomination du mé dicame nt Bisolax 5 mg comprimés enrobés. 2. Composition qualitative e t quantitative Bisolax 5 mg comprimés enrobés contient 5 mg de bisacodyl
NOTICE : INFORMATIONS DESTINÉES A L UTILISATEUR. Firazyr 30 mg solution injectable en seringue pré-remplie Icatibant
 B. NOTICE 1 NOTICE : INFORMATIONS DESTINÉES A L UTILISATEUR Firazyr 30 mg solution injectable en seringue pré-remplie Icatibant Veuillez lire attentivement l intégralité de cette notice avant d utiliser
B. NOTICE 1 NOTICE : INFORMATIONS DESTINÉES A L UTILISATEUR Firazyr 30 mg solution injectable en seringue pré-remplie Icatibant Veuillez lire attentivement l intégralité de cette notice avant d utiliser
COMMISSION DE LA TRANSPARENCE AVIS DE LA COMMISSION. 10 octobre 2001
 COMMISSION DE LA TRANSPARENCE AVIS DE LA COMMISSION 10 octobre 2001 VIRAFERONPEG 50 µg 80 µg 100 µg 120 µg 150 µg, poudre et solvant pour solution injectable B/1 B/4 Laboratoires SCHERING PLOUGH Peginterféron
COMMISSION DE LA TRANSPARENCE AVIS DE LA COMMISSION 10 octobre 2001 VIRAFERONPEG 50 µg 80 µg 100 µg 120 µg 150 µg, poudre et solvant pour solution injectable B/1 B/4 Laboratoires SCHERING PLOUGH Peginterféron
N/Réf. : CODEP-PRS-2010-037299 Monsieur le Directeur Institut Gustave Roussy (IGR) 39, rue Camille Desmoulins 94800 VILLEJUIF
 RÉPUBLIQUE FRANÇAISE DIVISION DE PARIS N/Réf. : CODEP-PRS-2010-037299 Monsieur le Directeur Institut Gustave Roussy (IGR) 39, rue Camille Desmoulins 94800 VILLEJUIF Paris, le 06 juillet 2010 Objet : Inspection
RÉPUBLIQUE FRANÇAISE DIVISION DE PARIS N/Réf. : CODEP-PRS-2010-037299 Monsieur le Directeur Institut Gustave Roussy (IGR) 39, rue Camille Desmoulins 94800 VILLEJUIF Paris, le 06 juillet 2010 Objet : Inspection
Article 1 er. Code de la santé publique Texte précédent. Nouveau texte. 28/11/2012 Evelyne Pierron Consultants. Article R5121-25
 Tableau comparatif Décret n 2012-1244 du 8 novembre 2012 relatif au renforcement des dispositions en matière de sécurité des médicaments à usage humain soumis à autorisation de mise sur le marché et à
Tableau comparatif Décret n 2012-1244 du 8 novembre 2012 relatif au renforcement des dispositions en matière de sécurité des médicaments à usage humain soumis à autorisation de mise sur le marché et à
Document d information dans le cadre de l installation d un cyclotron. à Saint-Louis
 Document d information dans le cadre de l installation d un cyclotron à Saint-Louis Cancers & imagerie médicale Un progrès majeur pour une meilleure prise en charge des patients. Accroitre les possibilités
Document d information dans le cadre de l installation d un cyclotron à Saint-Louis Cancers & imagerie médicale Un progrès majeur pour une meilleure prise en charge des patients. Accroitre les possibilités
Le but de la radioprotection est d empêcher ou de réduire les LES PRINCIPES DE LA RADIOPROTECTION
 LES PRINCIPES DE LA RADIOPROTECTION TOUT PUBLIC 1. Source de rayonnements ionisants 2. Les différents rayonnements ionisants et leur capacité à traverser le corps humain 3. Ecran de protection absorbant
LES PRINCIPES DE LA RADIOPROTECTION TOUT PUBLIC 1. Source de rayonnements ionisants 2. Les différents rayonnements ionisants et leur capacité à traverser le corps humain 3. Ecran de protection absorbant
NOTICE: INFORMATION DE L UTILISATEUR. Immukine 100 microgrammes/0,5 ml solution injectable (Interféron gamma-1b recombinant humain)
 NOTICE: INFORMATION DE L UTILISATEUR Immukine 100 microgrammes/0,5 ml solution injectable (Interféron gamma-1b recombinant humain) Veuillez lire attentivement l'intégralité de cette notice avant d'utiliser
NOTICE: INFORMATION DE L UTILISATEUR Immukine 100 microgrammes/0,5 ml solution injectable (Interféron gamma-1b recombinant humain) Veuillez lire attentivement l'intégralité de cette notice avant d'utiliser
De nombreux composés comportant le squelette aryléthanolamine (Ar-CHOH-CH2-NHR) interfèrent avec le
 [E1-2007S] pp75 (40 points) Chimie Thérapeutique - Pharmacologie De nombreux composés comportant le squelette aryléthanolamine (Ar-CHOH-CH2-NHR) interfèrent avec le système adrénergique. Leur profil d
[E1-2007S] pp75 (40 points) Chimie Thérapeutique - Pharmacologie De nombreux composés comportant le squelette aryléthanolamine (Ar-CHOH-CH2-NHR) interfèrent avec le système adrénergique. Leur profil d
Bases physiques de l imagerie en
 Bases physiques de l imagerie en Médecine Nucléaire (MN) Pr. Malika ÇAOUI Service de Médecine Nucléaire CHU International Cheikh Zaid Faculté de Médecine et de Pharmacie - Rabat- 02/12/2010 Pr. Malika
Bases physiques de l imagerie en Médecine Nucléaire (MN) Pr. Malika ÇAOUI Service de Médecine Nucléaire CHU International Cheikh Zaid Faculté de Médecine et de Pharmacie - Rabat- 02/12/2010 Pr. Malika
Simulation d'un examen anthropomorphique en imagerie TEMP à l iode 131 par simulation Monte Carlo GATE
 Simulation d'un examen anthropomorphique en imagerie TEMP à l iode 131 par simulation Monte Carlo GATE LAURENT Rémy [email protected] http://clrpcsv.in2p3.fr Journées des LARD Septembre 2007 M2R
Simulation d'un examen anthropomorphique en imagerie TEMP à l iode 131 par simulation Monte Carlo GATE LAURENT Rémy [email protected] http://clrpcsv.in2p3.fr Journées des LARD Septembre 2007 M2R
COMMISSION DE LA TRANSPARENCE AVIS. 10 mai 2006
 COMMISSION DE LA TRANSPARENCE AVIS 10 mai 2006 METOJECT 10 mg/ml, solution injectable en seringue pré-remplie 1 seringue pré-remplie en verre de 0,75 ml avec aiguille : 371 754-3 1 seringue pré- remplie
COMMISSION DE LA TRANSPARENCE AVIS 10 mai 2006 METOJECT 10 mg/ml, solution injectable en seringue pré-remplie 1 seringue pré-remplie en verre de 0,75 ml avec aiguille : 371 754-3 1 seringue pré- remplie
NOTICE : INFORMATION DE L'UTILISATEUR. DAKTOZIN 2,5 mg/150 mg pommade Nitrate de miconazole et oxyde de zinc
 NOTICE : INFORMATION DE L'UTILISATEUR DAKTOZIN 2,5 mg/150 mg pommade Nitrate de miconazole et oxyde de zinc Veuillez lire attentivement cette notice avant d utiliser ce médicament car elle contient des
NOTICE : INFORMATION DE L'UTILISATEUR DAKTOZIN 2,5 mg/150 mg pommade Nitrate de miconazole et oxyde de zinc Veuillez lire attentivement cette notice avant d utiliser ce médicament car elle contient des
La Dysplasie Ventriculaire Droite Arythmogène
 1 La Dysplasie Ventriculaire Droite Arythmogène Document rédigé par l équipe pluridisciplinaire du centre de référence pour les maladies cardiaques héréditaires (Paris), en collaboration avec des patients
1 La Dysplasie Ventriculaire Droite Arythmogène Document rédigé par l équipe pluridisciplinaire du centre de référence pour les maladies cardiaques héréditaires (Paris), en collaboration avec des patients
',5(&7,9((85$720'8&216(,/ GXMXLQ
 ',5(&7,9((85$720'8&216(,/ GXMXLQ UHODWLYHjODSURWHFWLRQVDQLWDLUHGHVSHUVRQQHVFRQWUHOHVGDQJHUVGHVUD\RQQHPHQWVLRQLVDQWVORUV GH[SRVLWLRQVjGHVILQVPpGLFDOHVUHPSODoDQWODGLUHFWLYH(XUDWRP LE CONSEIL DE L'UNION EUROPÉENNE,
',5(&7,9((85$720'8&216(,/ GXMXLQ UHODWLYHjODSURWHFWLRQVDQLWDLUHGHVSHUVRQQHVFRQWUHOHVGDQJHUVGHVUD\RQQHPHQWVLRQLVDQWVORUV GH[SRVLWLRQVjGHVILQVPpGLFDOHVUHPSODoDQWODGLUHFWLYH(XUDWRP LE CONSEIL DE L'UNION EUROPÉENNE,
IMIJECT 6 mg/0,5 ml, solution injectable pour voie sous-cutanée en seringue pré-remplie
 1 sur 6 13/09/2010 16:58 Mis à jour : 23/02/2009 1. DENOMINATION DU MEDICAMENT IMIJECT 6 mg/0,5 ml, solution injectable pour voie sous-cutanée en seringue pré-remplie 2. COMPOSITION QUALITATIVE ET QUANTITATIVE
1 sur 6 13/09/2010 16:58 Mis à jour : 23/02/2009 1. DENOMINATION DU MEDICAMENT IMIJECT 6 mg/0,5 ml, solution injectable pour voie sous-cutanée en seringue pré-remplie 2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Surveillance biologique d'un traitement par Héparine de Bas Poids Moléculaire (HBPM)
 Hématologie biologique (Pr Marc Zandecki) Faculté de Médecine CHU 49000 Angers France Surveillance biologique d'un traitement par Héparine de Bas Poids Moléculaire (HBPM) 1. Structure et mode d'action
Hématologie biologique (Pr Marc Zandecki) Faculté de Médecine CHU 49000 Angers France Surveillance biologique d'un traitement par Héparine de Bas Poids Moléculaire (HBPM) 1. Structure et mode d'action
«Actualités réglementaires en radioprotection»
 Contenu des informations à joindre aux D. ou demande d Autorisation Cyril THIEFFRY Sûreté Nucléaire et Radioprotection Arrêté du 29 janvier 2010 portant homologation de la décision n 2009-DC-0148 de l
Contenu des informations à joindre aux D. ou demande d Autorisation Cyril THIEFFRY Sûreté Nucléaire et Radioprotection Arrêté du 29 janvier 2010 portant homologation de la décision n 2009-DC-0148 de l
Sujets présentés par le Professeur Olivier CUSSENOT
 ANAMACaP Association Nationale des Malades du Cancer de la Prostate 17, bis Avenue Poincaré. 57400 SARREBOURG Sujets présentés par le Professeur Olivier CUSSENOT Place des nouvelles techniques d imagerie
ANAMACaP Association Nationale des Malades du Cancer de la Prostate 17, bis Avenue Poincaré. 57400 SARREBOURG Sujets présentés par le Professeur Olivier CUSSENOT Place des nouvelles techniques d imagerie
COMMISSION DE LA TRANSPARENCE AVIS. 18 janvier 2006
 COMMISSION DE LA TRANSPARENCE AVIS 18 janvier 2006 ADVATE 1500 UI, poudre et solvant pour solution injectable 1 flacon(s) en verre de 1 500 UI - 1 flacon(s) en verre de 5 ml avec matériel(s) de perfusion(s)
COMMISSION DE LA TRANSPARENCE AVIS 18 janvier 2006 ADVATE 1500 UI, poudre et solvant pour solution injectable 1 flacon(s) en verre de 1 500 UI - 1 flacon(s) en verre de 5 ml avec matériel(s) de perfusion(s)
Médecine Nucléaire : PET-scan et imagerie hybride
 Médecine Nucléaire : PET-scan et imagerie hybride Benjamin GEISSLER Centre d d Imagerie Nucléaire St-Etienne, Roanne, Le Puy en Velay 1967 2007 Principes Spécialit cialité médicale (1950) Radiologie Radiothérapie
Médecine Nucléaire : PET-scan et imagerie hybride Benjamin GEISSLER Centre d d Imagerie Nucléaire St-Etienne, Roanne, Le Puy en Velay 1967 2007 Principes Spécialit cialité médicale (1950) Radiologie Radiothérapie
NOTICE : INFORMATION DE L UTILISATEUR. Delphi 0,1 % crème Acétonide de triamcinolone
 NOTICE : INFORMATION DE L UTILISATEUR Delphi 0,1 % crème Acétonide de triamcinolone Veuillez lire attentivement cette notice avant d utiliser ce médicament car elle contient des informations importantes
NOTICE : INFORMATION DE L UTILISATEUR Delphi 0,1 % crème Acétonide de triamcinolone Veuillez lire attentivement cette notice avant d utiliser ce médicament car elle contient des informations importantes
Maladie de Hodgkin ou lymphome de Hodgkin
 Maladie de Hodgkin ou lymphome de Hodgkin Ce que vous devez savoir Le cancer : une lutte à finir 1 888 939-3333 www.cancer.ca MALADIE DE HODGKIN Ce que vous devez savoir Même si vous entendez parler du
Maladie de Hodgkin ou lymphome de Hodgkin Ce que vous devez savoir Le cancer : une lutte à finir 1 888 939-3333 www.cancer.ca MALADIE DE HODGKIN Ce que vous devez savoir Même si vous entendez parler du
French Version. Aciclovir Labatec 250 mg (For Intravenous Use Only) 02/2010. Product Information Leaflet for Aciclovir Labatec i.v.
 Product Information Leaflet for Aciclovir Labatec i.v. 250 mg French Version Aciclovir Labatec i.v. Composition Principe actif: Aciclovirum ut Acicloviri natricum (Praeparatio cryodesiccata). Excipients:
Product Information Leaflet for Aciclovir Labatec i.v. 250 mg French Version Aciclovir Labatec i.v. Composition Principe actif: Aciclovirum ut Acicloviri natricum (Praeparatio cryodesiccata). Excipients:
Pourquoi une femme-enceinte présente un certain nombre de douleurs inconnues jusqu'à lors?
 Pourquoi une femme-enceinte présente un certain nombre de douleurs inconnues jusqu'à lors? elle va pour cela créer des éléments chargées de transmettre un message à son corps (les hormones) : la «relaxine»
Pourquoi une femme-enceinte présente un certain nombre de douleurs inconnues jusqu'à lors? elle va pour cela créer des éléments chargées de transmettre un message à son corps (les hormones) : la «relaxine»
FIPROTEC, PIPETTES CONTRE PUCES ET TIQUES :
 FIPROTEC, PIPETTES CONTRE PUCES ET TIQUES : FIPROTEC 50 MG SOLUTION SPOT-ON POUR CHAT Composition :Une pipette de 0,50 ml contient 50 mg de Fipronil. Indications d utilisation : Chez les chats : - Traitement
FIPROTEC, PIPETTES CONTRE PUCES ET TIQUES : FIPROTEC 50 MG SOLUTION SPOT-ON POUR CHAT Composition :Une pipette de 0,50 ml contient 50 mg de Fipronil. Indications d utilisation : Chez les chats : - Traitement
Utilisation des médicaments au niveau des soins primaires dans les pays en développement et en transition
 09-0749 1 WHO/EMP/MAR/2009.3 Utilisation des médicaments au niveau des soins primaires dans les pays en développement et en transition Synthèse des résultats des études publiées entre 1990 et 2006 Organisation
09-0749 1 WHO/EMP/MAR/2009.3 Utilisation des médicaments au niveau des soins primaires dans les pays en développement et en transition Synthèse des résultats des études publiées entre 1990 et 2006 Organisation
ETAT DES LIEUX DE LA RADIOPROTECTION DANS LES SERVICES DE MEDECINE NUCLEAIRE
 ETAT DES LIEUX DE LA RADIOPROTECTION DANS LES SERVICES DE MEDECINE NUCLEAIRE PENDANT LA PERIODE 2009-2011 RESUME Le bilan national des inspections des services de médecine nucléaire a été établi sur la
ETAT DES LIEUX DE LA RADIOPROTECTION DANS LES SERVICES DE MEDECINE NUCLEAIRE PENDANT LA PERIODE 2009-2011 RESUME Le bilan national des inspections des services de médecine nucléaire a été établi sur la
KARDEGIC 75 mg, poudre pour solution buvable en sachet-dose Acétylsalicylate de DL-Lysine
 KARDEGIC 75 mg, poudre pour solution buvable en sachet-dose Acétylsalicylate de DL-Lysine Veuillez lire attentivement cette notice avant d'utiliser ce médicament. Elle contient des informations importantes
KARDEGIC 75 mg, poudre pour solution buvable en sachet-dose Acétylsalicylate de DL-Lysine Veuillez lire attentivement cette notice avant d'utiliser ce médicament. Elle contient des informations importantes
Fédération de Recherche en Imagerie multimodalité (FRIM) Inserm Universités Paris Diderot & Paris Nord CNRS AP-HP
 Fédération de Recherche en Imagerie multimodalité (FRIM) Inserm Universités Paris Diderot & Paris Nord CNRS AP-HP Directeur Dominique Le Guludec Tomographie d'emission MonoPhotonique (TEMP) Convention
Fédération de Recherche en Imagerie multimodalité (FRIM) Inserm Universités Paris Diderot & Paris Nord CNRS AP-HP Directeur Dominique Le Guludec Tomographie d'emission MonoPhotonique (TEMP) Convention
ANNEXE I RESUME DES CARACTERISTIQUES DU PRODUIT
 ANNEXE I RESUME DES CARACTERISTIQUES DU PRODUIT 1. DENOMINATION DU MEDICAMENT NARATRIPTAN ARROW 2,5 mg, comprimé pelliculé 2. COMPOSITION QUALITATIVE ET QUANTITATIVE Naratriptan..2,50 mg Sous forme de
ANNEXE I RESUME DES CARACTERISTIQUES DU PRODUIT 1. DENOMINATION DU MEDICAMENT NARATRIPTAN ARROW 2,5 mg, comprimé pelliculé 2. COMPOSITION QUALITATIVE ET QUANTITATIVE Naratriptan..2,50 mg Sous forme de
Infestation par Dipylidium caninum,
 Fiche technique n 24 Infestation par Dipylidium caninum, le téniasis félin à Dipylidium Parmi tous les vers qui peuvent infester le chat, Dipylidium caninum est un parasite fréquemment rencontré dans le
Fiche technique n 24 Infestation par Dipylidium caninum, le téniasis félin à Dipylidium Parmi tous les vers qui peuvent infester le chat, Dipylidium caninum est un parasite fréquemment rencontré dans le
ANNEXE I RESUME DES CARACTERISTIQUES DU PRODUIT
 ANNEXE I RESUME DES CARACTERISTIQUES DU PRODUIT 1 1. DENOMINATION DU MEDICAMENT Osigraft 3,3 mg poudre pour suspension implantable 2. COMPOSITION QUALITATIVE ET QUANTITATIVE Chaque flacon contient 3,3
ANNEXE I RESUME DES CARACTERISTIQUES DU PRODUIT 1 1. DENOMINATION DU MEDICAMENT Osigraft 3,3 mg poudre pour suspension implantable 2. COMPOSITION QUALITATIVE ET QUANTITATIVE Chaque flacon contient 3,3
Professeur Diane GODIN-RIBUOT
 UE3-2 - Physiologie rénale Chapitre 5 : Mesure de la fonction rénale : la clairance rénale Professeur Diane GODIN-RIBUOT Année universitaire 2011/2012 Université Joseph Fourier de Grenoble - Tous droits
UE3-2 - Physiologie rénale Chapitre 5 : Mesure de la fonction rénale : la clairance rénale Professeur Diane GODIN-RIBUOT Année universitaire 2011/2012 Université Joseph Fourier de Grenoble - Tous droits
PARTIE III : RENSEIGNEMENTS POUR LE CONSOMMATEUR
 PARTIE III : RENSEIGNEMENTS POUR LE CONSOMMATEUR Pr BETASERON Interféron bêta-1b Le présent dépliant constitue la troisième et dernière partie de la monographie de produit publiée à la suite de l approbation
PARTIE III : RENSEIGNEMENTS POUR LE CONSOMMATEUR Pr BETASERON Interféron bêta-1b Le présent dépliant constitue la troisième et dernière partie de la monographie de produit publiée à la suite de l approbation
Cancer du sein. Du CA15-3 à la tomographie à émission de positons.
 Cancer du sein. Du CA15-3 à la tomographie à émission de positons. Un taux de récidive de 30% dans les dix premières années chez des patientes en rémission complète après un traitement curatif, requiert
Cancer du sein. Du CA15-3 à la tomographie à émission de positons. Un taux de récidive de 30% dans les dix premières années chez des patientes en rémission complète après un traitement curatif, requiert
Lymphome non hodgkinien
 Lymphome non hodgkinien Ce que vous devez savoir Le cancer : une lutte à finir 1 888 939-3333 www.cancer.ca LYMPHOME NON HODGKINIEN Ce que vous devez savoir Même si vous entendez parler du cancer presque
Lymphome non hodgkinien Ce que vous devez savoir Le cancer : une lutte à finir 1 888 939-3333 www.cancer.ca LYMPHOME NON HODGKINIEN Ce que vous devez savoir Même si vous entendez parler du cancer presque
Nouvelles caméras CZT cardiaques: une seconde vie pour le thallium 201?
 Symposium Covidien, Nice, 10 mai 2010 Nouvelles caméras CZT cardiaques: une seconde vie pour le thallium 201? Bernard Songy Centre Cardiologique du Nord St-Denis Thallium 201: Le thallium 201 présente
Symposium Covidien, Nice, 10 mai 2010 Nouvelles caméras CZT cardiaques: une seconde vie pour le thallium 201? Bernard Songy Centre Cardiologique du Nord St-Denis Thallium 201: Le thallium 201 présente
ANNEXE I RESUME DES CARACTERISTIQUES DU PRODUIT
 ANNEXE I RESUME DES CARACTERISTIQUES DU PRODUIT 1 1. DENOMINATION DU MÉDICAMENT Betaferon 250 microgrammes/ml, poudre et solvant pour solution injectable. 2. COMPOSITION QUALITATIVE ET QUANTITATIVE Interféron
ANNEXE I RESUME DES CARACTERISTIQUES DU PRODUIT 1 1. DENOMINATION DU MÉDICAMENT Betaferon 250 microgrammes/ml, poudre et solvant pour solution injectable. 2. COMPOSITION QUALITATIVE ET QUANTITATIVE Interféron
A-ESSE s.p.a. FICHE DE SÉCURITÉ
 A-ESSE s.p.a. USINE OXYDES de ZINC FICHE DE SÉCURITÉ Oxyde de zinc 1. IDENTIFICATION DU PRODUIT CHIMIQUE ET DE LA SOCIÉTÉ NOM DU PRODUIT: DÉNOMINATION COMMUNE, COMMERCIALE ET SYNONYMES: UTILISATION DE
A-ESSE s.p.a. USINE OXYDES de ZINC FICHE DE SÉCURITÉ Oxyde de zinc 1. IDENTIFICATION DU PRODUIT CHIMIQUE ET DE LA SOCIÉTÉ NOM DU PRODUIT: DÉNOMINATION COMMUNE, COMMERCIALE ET SYNONYMES: UTILISATION DE
The consent form is also available in English.
 Université McGill et hôpitaux affiliés Centre universitaire de santé McGill (CUSM) Hôpital général juif - Sir Mortimer B. Davis The Sir Mortimer B. Davis - Jewish General Hospital Centre hospitalier de
Université McGill et hôpitaux affiliés Centre universitaire de santé McGill (CUSM) Hôpital général juif - Sir Mortimer B. Davis The Sir Mortimer B. Davis - Jewish General Hospital Centre hospitalier de
N/Réf. : CODEP-PRS-2015-009248 Hôpital d'instruction des Armées du Val de Grâce 74 boulevard de Port Royal 75005 PARIS
 RÉPUBLIQUE FRANÇAISE DIVISION DE PARIS Paris, le 6 mars 2015 N/Réf. : CODEP-PRS-2015-009248 Hôpital d'instruction des Armées du Val de Grâce 74 boulevard de Port Royal 75005 PARIS Objet : Réf : Inspection
RÉPUBLIQUE FRANÇAISE DIVISION DE PARIS Paris, le 6 mars 2015 N/Réf. : CODEP-PRS-2015-009248 Hôpital d'instruction des Armées du Val de Grâce 74 boulevard de Port Royal 75005 PARIS Objet : Réf : Inspection
AMAMI Anaïs 3 C LORDEL Maryne. Les dons de cellules & de tissus.
 AMAMI Anaïs 3 C LORDEL Maryne Les dons de cellules & de tissus. Introduction : Une greffe (don) de cellules consiste à administrer à un patient dont un organe vital ne fonctionne plus correctement, une
AMAMI Anaïs 3 C LORDEL Maryne Les dons de cellules & de tissus. Introduction : Une greffe (don) de cellules consiste à administrer à un patient dont un organe vital ne fonctionne plus correctement, une
Livret d accueil des stagiaires
 Livret d accueil des stagiaires SOMMAIRE : I/ Présentation du service II/Le métier de manipulateur III/ Modalités d encadrement IV/ Votre stage V/ Bilan global de votre stage I/ Présentation du service
Livret d accueil des stagiaires SOMMAIRE : I/ Présentation du service II/Le métier de manipulateur III/ Modalités d encadrement IV/ Votre stage V/ Bilan global de votre stage I/ Présentation du service
1985, 169, n 7, 1071-1075,séancedu 22 octobre1985. ALBARÈDE et Jean-Claude DARRAS
 Bull. Acad.NatleMéd., 1985, 169, n 7, 1071-1075,séancedu 22 octobre1985 Etude des méridiens d'acupuncture Par les traceurs radioactifs Pierre de VERNEJOUL *, Pierre ALBARÈDE et Jean-Claude DARRAS On sait
Bull. Acad.NatleMéd., 1985, 169, n 7, 1071-1075,séancedu 22 octobre1985 Etude des méridiens d'acupuncture Par les traceurs radioactifs Pierre de VERNEJOUL *, Pierre ALBARÈDE et Jean-Claude DARRAS On sait
DOSSIER D'INSCRIPTION
 CENTRE HOSPITALIER UNIVERSITAIRE DE NICE ECOLE D' INFIRMIERS ANESTHESISTES CONCOURS D ENTREE DOSSIER D'INSCRIPTION DATE LIMITE DE DEPOT LE DERNIER JOUR OUVRABLE DU MOIS DE MARS ANNEE N ECOLE INFIRMIERS
CENTRE HOSPITALIER UNIVERSITAIRE DE NICE ECOLE D' INFIRMIERS ANESTHESISTES CONCOURS D ENTREE DOSSIER D'INSCRIPTION DATE LIMITE DE DEPOT LE DERNIER JOUR OUVRABLE DU MOIS DE MARS ANNEE N ECOLE INFIRMIERS
Activité 38 : Découvrir comment certains déchets issus de fonctionnement des organes sont éliminés de l organisme
 Activité 38 : Découvrir comment certains déchets issus de fonctionnement des organes sont éliminés de l organisme 1. EXTRAITS REFERENTIELS DU BO Partie du programme : Fonctionnement de l organisme et besoin
Activité 38 : Découvrir comment certains déchets issus de fonctionnement des organes sont éliminés de l organisme 1. EXTRAITS REFERENTIELS DU BO Partie du programme : Fonctionnement de l organisme et besoin
REHABILITATION DE LA FRICHE INDUSTRIELLE DE L ESTAQUE. Surveillance médico-professionnelle des entreprises intervenantes
 REHABILITATION DE LA FRICHE INDUSTRIELLE DE L ESTAQUE Surveillance médico-professionnelle des entreprises intervenantes Dr BAJON-THERY Dr COURJARET Dr SURET Dr DEWITTE Dr MICHOT Surveillance médico-professionnelle
REHABILITATION DE LA FRICHE INDUSTRIELLE DE L ESTAQUE Surveillance médico-professionnelle des entreprises intervenantes Dr BAJON-THERY Dr COURJARET Dr SURET Dr DEWITTE Dr MICHOT Surveillance médico-professionnelle
Communiqué de presse. Merck Serono. 18 septembre 2008
 Communiqué de presse 18 septembre 2008 Merck Serono annonce le lancement de l'essai clinique ORACLE MS destiné à évaluer la cladribine en comprimés chez des patients à risque de développer une sclérose
Communiqué de presse 18 septembre 2008 Merck Serono annonce le lancement de l'essai clinique ORACLE MS destiné à évaluer la cladribine en comprimés chez des patients à risque de développer une sclérose
PRINCIPE MICROSCOPIE CONFOCALE
 PRINCIPE MICROSCOPIE CONFOCALE Un microscope confocal est un système pour lequel l'illumination et la détection sont limités à un même volume de taille réduite (1). L'image confocale (ou coupe optique)
PRINCIPE MICROSCOPIE CONFOCALE Un microscope confocal est un système pour lequel l'illumination et la détection sont limités à un même volume de taille réduite (1). L'image confocale (ou coupe optique)
Le don de moelle osseuse :
 DON DE MOELLE OSSEUSE Le don de moelle osseuse : se décider aujourd hui, s engager pour longtemps LA MOELLE OSSEUSE ET SA GREFFE La moelle osseuse C est le tissu mou dans le centre du corps des os qui
DON DE MOELLE OSSEUSE Le don de moelle osseuse : se décider aujourd hui, s engager pour longtemps LA MOELLE OSSEUSE ET SA GREFFE La moelle osseuse C est le tissu mou dans le centre du corps des os qui
Atrovent HFA 20 mcg/bouffée solution pour inhalation en flacon pressurisé (bromure d'ipratropium)
 NOTICE ATROVENT HFA 20 MCG/BOUFFEE SOLUTION POUR INHALATION EN FLACON PRESSURISE (BPI n 0250-03 du 27.07.2005) Veuillez lire attentivement l'intégralité de cette notice avant d'utiliser ce médicament.
NOTICE ATROVENT HFA 20 MCG/BOUFFEE SOLUTION POUR INHALATION EN FLACON PRESSURISE (BPI n 0250-03 du 27.07.2005) Veuillez lire attentivement l'intégralité de cette notice avant d'utiliser ce médicament.
LIGNES DIRECTRICES CLINIQUES TOUT AU LONG DU CONTINUUM DE SOINS : Objectif de ce chapitre. 6.1 Introduction 86
 LIGNES DIRECTRICES CLINIQUES TOUT AU LONG DU CONTINUUM DE SOINS : ÉTABLISSEMENT DE LIENS ENTRE LES PERSONNES CHEZ QUI UN DIAGNOSTIC D INFECTION À VIH A ÉTÉ POSÉ ET LES SERVICES DE SOINS ET DE TRAITEMENT
LIGNES DIRECTRICES CLINIQUES TOUT AU LONG DU CONTINUUM DE SOINS : ÉTABLISSEMENT DE LIENS ENTRE LES PERSONNES CHEZ QUI UN DIAGNOSTIC D INFECTION À VIH A ÉTÉ POSÉ ET LES SERVICES DE SOINS ET DE TRAITEMENT
RELPAX. hydrobromure d élétriptan
 RELPAX hydrobromure d élétriptan * Pharmacocinétique * Toxicologie * Formulation galénique * Essais cliniques * Conclusion * Pharmacocinétique * Toxicologie * Formulation galénique * Essais cliniques *
RELPAX hydrobromure d élétriptan * Pharmacocinétique * Toxicologie * Formulation galénique * Essais cliniques * Conclusion * Pharmacocinétique * Toxicologie * Formulation galénique * Essais cliniques *
ANNEXE I RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
 ANNEXE I RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT 1 Ce médicament fait l objet d une surveillance supplémentaire qui permettra l identification rapide de nouvelles informations relatives à la sécurité. Les
ANNEXE I RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT 1 Ce médicament fait l objet d une surveillance supplémentaire qui permettra l identification rapide de nouvelles informations relatives à la sécurité. Les
COMMISSION DE LA TRANSPARENCE AVIS. 19 octobre 2011
 COMMISSION DE LA TRANSPARENCE AVIS 19 octobre 2011 PEDIAVEN AP-HP G15, solution pour perfusion 1000 ml de solution en poche bi-compartiment, boîte de 4 (CIP: 419 999-0) PEDIAVEN AP-HP G20, solution pour
COMMISSION DE LA TRANSPARENCE AVIS 19 octobre 2011 PEDIAVEN AP-HP G15, solution pour perfusion 1000 ml de solution en poche bi-compartiment, boîte de 4 (CIP: 419 999-0) PEDIAVEN AP-HP G20, solution pour
L eau dans le corps. Fig. 6 L eau dans le corps. Cerveau 85 % Dents 10 % Cœur 77 % Poumons 80 % Foie 73 % Reins 80 % Peau 71 % Muscles 73 %
 24 L eau est le principal constituant du corps humain. La quantité moyenne d eau contenue dans un organisme adulte est de 65 %, ce qui correspond à environ 45 litres d eau pour une personne de 70 kilogrammes.
24 L eau est le principal constituant du corps humain. La quantité moyenne d eau contenue dans un organisme adulte est de 65 %, ce qui correspond à environ 45 litres d eau pour une personne de 70 kilogrammes.
TROISIÈME PARTIE : INFORMATION POUR LE PATIENT
 TROISIÈME PARTIE : INFORMATION POUR LE PATIENT REBIF (Interféron bêta-1a) Solution pour injection dans des seringues préremplies Ce livret représente la troisième partie de la «Monographie de produit»
TROISIÈME PARTIE : INFORMATION POUR LE PATIENT REBIF (Interféron bêta-1a) Solution pour injection dans des seringues préremplies Ce livret représente la troisième partie de la «Monographie de produit»
Exposition de la population française aux rayonnements ionisants liée aux actes de diagnostic médical en 2012
 R A P P O R T Exposition de la population française aux rayonnements ionisants liée aux actes de Pôle Radioprotection, Environnement, Déchets et Crise RESUME Ce rapport met à jour, pour l année 2012, les
R A P P O R T Exposition de la population française aux rayonnements ionisants liée aux actes de Pôle Radioprotection, Environnement, Déchets et Crise RESUME Ce rapport met à jour, pour l année 2012, les
Leucémies de l enfant et de l adolescent
 Janvier 2014 Fiche tumeur Prise en charge des adolescents et jeunes adultes Leucémies de l enfant et de l adolescent GENERALITES COMMENT DIAGNOSTIQUE-T-ON UNE LEUCEMIE AIGUË? COMMENT TRAITE-T-ON UNE LEUCEMIE
Janvier 2014 Fiche tumeur Prise en charge des adolescents et jeunes adultes Leucémies de l enfant et de l adolescent GENERALITES COMMENT DIAGNOSTIQUE-T-ON UNE LEUCEMIE AIGUË? COMMENT TRAITE-T-ON UNE LEUCEMIE
ANNEXE I RESUME DES CARACTERISTIQUES DU PRODUIT
 1. DENOMINATION DU MEDICAMENT ANNEXE I RESUME DES CARACTERISTIQUES DU PRODUIT GAVISCONELL FRUITS DE LA PASSION SANS SUCRE, poudre orale en sachet-dose édulcorée à l'aspartam, au xylitol et à l'acésulfame
1. DENOMINATION DU MEDICAMENT ANNEXE I RESUME DES CARACTERISTIQUES DU PRODUIT GAVISCONELL FRUITS DE LA PASSION SANS SUCRE, poudre orale en sachet-dose édulcorée à l'aspartam, au xylitol et à l'acésulfame
ENFIN, UN SYSTÈME POLYVALENT D'IMAGERIE ORL ET DENTAIRE
 CS 9300 ENFIN, UN SYSTÈME POLYVALENT D'IMAGERIE ORL ET DENTAIRE Conçu pour de multiples applications cliniques, le système CS 9300 fournit des images panoramiques de très grande qualité, ainsi que des
CS 9300 ENFIN, UN SYSTÈME POLYVALENT D'IMAGERIE ORL ET DENTAIRE Conçu pour de multiples applications cliniques, le système CS 9300 fournit des images panoramiques de très grande qualité, ainsi que des
La surveillance biologique des salariés Surveiller pour prévenir
 Evaluer et prévenir le risque radiologique professionnel dans les opérations de radiographie industrielle La surveillance biologique des salariés Surveiller pour prévenir Dr Irène Sari-Minodier Service
Evaluer et prévenir le risque radiologique professionnel dans les opérations de radiographie industrielle La surveillance biologique des salariés Surveiller pour prévenir Dr Irène Sari-Minodier Service
Observation. Merci à l équipe de pharmaciens FormUtip iatro pour ce cas
 Cas clinique M. ZAC Observation Mr ZAC ans, 76 ans, 52 kg, est admis aux urgences pour des algies fessières invalidantes, résistantes au AINS. Ses principaux antécédents sont les suivants : une thrombopénie
Cas clinique M. ZAC Observation Mr ZAC ans, 76 ans, 52 kg, est admis aux urgences pour des algies fessières invalidantes, résistantes au AINS. Ses principaux antécédents sont les suivants : une thrombopénie
ANNEXES AU REGLEMENT N 06/2010/CM/UEMOA
 UNION ECONOMIQUE ET MONETAIRE OUEST AFRICAINE ------------------------- La Commission ANNEXES AU REGLEMENT N 06/2010/CM/UEMOA LES ANNEXES AU REGLEMENT RELATIF AUX PROCEDURES D HOMOLOGATION DES PRODUITS
UNION ECONOMIQUE ET MONETAIRE OUEST AFRICAINE ------------------------- La Commission ANNEXES AU REGLEMENT N 06/2010/CM/UEMOA LES ANNEXES AU REGLEMENT RELATIF AUX PROCEDURES D HOMOLOGATION DES PRODUITS
Carnet de suivi Lithium
 Carnet de suivi Lithium Brochure d information sur les troubles bipolaires et leur traitement par lithium Nom : Ce carnet est important Si vous le trouvez, merci de le faire parvenir à l adresse cidessous
Carnet de suivi Lithium Brochure d information sur les troubles bipolaires et leur traitement par lithium Nom : Ce carnet est important Si vous le trouvez, merci de le faire parvenir à l adresse cidessous
Peut-on reconnaître une tumeur de bas-grade en imagerie conventionnelle? S. Foscolo, L. Taillandier, E. Schmitt, A.S. Rivierre, S. Bracard, CHU NANCY
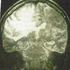 Peut-on reconnaître une tumeur de bas-grade en imagerie conventionnelle? S. Foscolo, L. Taillandier, E. Schmitt, A.S. Rivierre, S. Bracard, CHU NANCY A quoi sert l imagerie conventionnelle dans le diagnostic
Peut-on reconnaître une tumeur de bas-grade en imagerie conventionnelle? S. Foscolo, L. Taillandier, E. Schmitt, A.S. Rivierre, S. Bracard, CHU NANCY A quoi sert l imagerie conventionnelle dans le diagnostic
Résumé des Caractéristiques du Produit 1. DENOMINATION DU MEDICAMENT PARONAL 2. COMPOSITION QUALITATIVE ET QUANTITATIVE
 Résumé des Caractéristiques du Produit 1. DENOMINATION DU MEDICAMENT PARONAL 2. COMPOSITION QUALITATIVE ET QUANTITATIVE Par fiole: L - asparaginase 10.000 U.I. Pour les excipients, cfr section 6.1. 3.
Résumé des Caractéristiques du Produit 1. DENOMINATION DU MEDICAMENT PARONAL 2. COMPOSITION QUALITATIVE ET QUANTITATIVE Par fiole: L - asparaginase 10.000 U.I. Pour les excipients, cfr section 6.1. 3.
J ai l honneur de vous communiquer ci-dessous la synthèse de l inspection ainsi que les principales demandes et observations qui en résultent.
 RÉPUBLIQUE FRANÇAISE DIVISION DE LILLE Lille, le 5 juillet 2013 CODEP-LIL-2013-037759 AD/EL Monsieur le Dr W SCM des Docteurs V W X Y 23, Boulevard Victor Hugo 62100 CALAIS Objet : Inspection de la radioprotection
RÉPUBLIQUE FRANÇAISE DIVISION DE LILLE Lille, le 5 juillet 2013 CODEP-LIL-2013-037759 AD/EL Monsieur le Dr W SCM des Docteurs V W X Y 23, Boulevard Victor Hugo 62100 CALAIS Objet : Inspection de la radioprotection
Les conséquences sanitaires de l accident de Fukushima Dai-ichi : point de situation en février 2012
 Les conséquences sanitaires de l accident de Fukushima Dai-ichi : point de situation en février 2012 Faire avancer la sûreté nucléaire Jean-René Jourdain Paris, 28 février 2012 Comment évaluer les conséquences
Les conséquences sanitaires de l accident de Fukushima Dai-ichi : point de situation en février 2012 Faire avancer la sûreté nucléaire Jean-René Jourdain Paris, 28 février 2012 Comment évaluer les conséquences
NOTICE: INFORMATION DE L UTILISATEUR. Bisolax 5 mg comprimés enrobés. Bisacodyl
 NOTICE: INFORMATION DE L UTILISATEUR Bisolax 5 mg comprimés enrobés Bisacodyl Veuillez lire attentivement cette notice avant d utiliser ce médicament car elle contient des informations importantes pour
NOTICE: INFORMATION DE L UTILISATEUR Bisolax 5 mg comprimés enrobés Bisacodyl Veuillez lire attentivement cette notice avant d utiliser ce médicament car elle contient des informations importantes pour
Ligne Dentaire. Système Dentaire Panoramique et 3D
 Ligne Dentaire Système Dentaire Panoramique et 3D La Société Villa Sistemi Medicali est fière de présenter son nouveau panoramique Rotograph Evo 3D, un système d'imagerie dentaire avec fonctionnalité 3-en-1:
Ligne Dentaire Système Dentaire Panoramique et 3D La Société Villa Sistemi Medicali est fière de présenter son nouveau panoramique Rotograph Evo 3D, un système d'imagerie dentaire avec fonctionnalité 3-en-1:
DIFFRACTion des ondes
 DIFFRACTion des ondes I DIFFRACTION DES ONDES PAR LA CUVE À ONDES Lorsqu'une onde plane traverse un trou, elle se transforme en onde circulaire. On dit que l'onde plane est diffractée par le trou. Ce phénomène
DIFFRACTion des ondes I DIFFRACTION DES ONDES PAR LA CUVE À ONDES Lorsqu'une onde plane traverse un trou, elle se transforme en onde circulaire. On dit que l'onde plane est diffractée par le trou. Ce phénomène
Test d immunofluorescence (IF)
 Test d immunofluorescence (IF) 1.1 Prélèvement du cerveau et échantillonnage Avant toute manipulation, il est fondamental de s assurer que tout le personnel en contact avec un échantillon suspect soit
Test d immunofluorescence (IF) 1.1 Prélèvement du cerveau et échantillonnage Avant toute manipulation, il est fondamental de s assurer que tout le personnel en contact avec un échantillon suspect soit
Dakar, Sénégal 5-9 Mars 2006. Dr Joël Keravec MSH/RPM Plus - Brésil et représentant le Globa
 éminaire pour les onsultants Francophones - estion des Approvisionments et des Stocks pour VIH, la TB et le Paludisme Assurance Qualité des Médicament s Dakar, Sénégal 5-9 Mars 2006 Dr Joël Keravec MSH/RPM
éminaire pour les onsultants Francophones - estion des Approvisionments et des Stocks pour VIH, la TB et le Paludisme Assurance Qualité des Médicament s Dakar, Sénégal 5-9 Mars 2006 Dr Joël Keravec MSH/RPM
Les Applications industrielles et commerciales des cellules souches. Inserm Transfert Pôle Création d Entreprises
 Les Applications industrielles et commerciales s cellules souches Inserm Transfert Pôle Création d Entreprises Matthieu COUTET, Responsable du Pôle Jean-François RAX, Business Analyst 1 Plan Cellules souches
Les Applications industrielles et commerciales s cellules souches Inserm Transfert Pôle Création d Entreprises Matthieu COUTET, Responsable du Pôle Jean-François RAX, Business Analyst 1 Plan Cellules souches
sur la valve mitrale À propos de l insuffisance mitrale et du traitement par implantation de clip
 À propos de l insuffisance mitrale et du traitement par implantation de clip sur la valve mitrale Support destiné aux médecins en vue d informer les patients. À propos de l insuffisance mitrale L insuffisance
À propos de l insuffisance mitrale et du traitement par implantation de clip sur la valve mitrale Support destiné aux médecins en vue d informer les patients. À propos de l insuffisance mitrale L insuffisance
Rad4Med.be, premier acteur global dans le nucléaire médical
 Bruxelles, 15 octobre 2013 Communiqué de presse Rad4Med.be, premier acteur global dans le nucléaire médical La radioactivité au service de la médecine, un savoir-faire belge qui s exporte dans le monde
Bruxelles, 15 octobre 2013 Communiqué de presse Rad4Med.be, premier acteur global dans le nucléaire médical La radioactivité au service de la médecine, un savoir-faire belge qui s exporte dans le monde
La Greffe de Cellules Souches Hématopoïétiques
 La Greffe de Cellules Souches Hématopoïétiques Professeur Ibrahim Yakoub-Agha CHRU de LILLE (Illustration de J. Cloup, extraite du CD-Rom «greffe de Moelle» réalisé par la société K Noë) La moelle osseuse
La Greffe de Cellules Souches Hématopoïétiques Professeur Ibrahim Yakoub-Agha CHRU de LILLE (Illustration de J. Cloup, extraite du CD-Rom «greffe de Moelle» réalisé par la société K Noë) La moelle osseuse
L AUTOGREFFE QUELQUES EXPLICATIONS
 L AUTOGREFFE QUELQUES EXPLICATIONS Le traitement de votre maladie nécessite une Chimiothérapie intensive. Cette chimiothérapie qui utilise de fortes doses de médicaments antimitotiques est plus efficace
L AUTOGREFFE QUELQUES EXPLICATIONS Le traitement de votre maladie nécessite une Chimiothérapie intensive. Cette chimiothérapie qui utilise de fortes doses de médicaments antimitotiques est plus efficace
Stelara (ustekinumab)
 Les autorités de santé de l Union européenne ont assorti la mise sur le marché du médicament Stelara de certaines conditions. Le plan obligatoire de minimisation des risques en Belgique, dont cette information
Les autorités de santé de l Union européenne ont assorti la mise sur le marché du médicament Stelara de certaines conditions. Le plan obligatoire de minimisation des risques en Belgique, dont cette information
CLINIMIX AVIS DE LA COMMISSION DE LA TRANSPARENCE
 CLINIMIX AVIS DE LA COMMISSION DE LA TRANSPARENCE BAXTER_CLINIMIX N9G15 E et N12G20E_Avis CT_14-02-2007.pdf BAXTER_CLINIMIX N9G15E N12G20E N14G30 N17G35_Avis CT_12-12-2001.pdf BAXTER_CLINIMIX changement
CLINIMIX AVIS DE LA COMMISSION DE LA TRANSPARENCE BAXTER_CLINIMIX N9G15 E et N12G20E_Avis CT_14-02-2007.pdf BAXTER_CLINIMIX N9G15E N12G20E N14G30 N17G35_Avis CT_12-12-2001.pdf BAXTER_CLINIMIX changement
10. Instruments optiques et Microscopes Photomètre/Cuve
 0. Instruments s et Microscopes GENERAL CATALOGUE 00/ Cuve à usage unique pour spectrophotomètre Cuve jetable, moulée en et en pour UV. Avec parois traitées Kartell ment pour une transparence optimale
0. Instruments s et Microscopes GENERAL CATALOGUE 00/ Cuve à usage unique pour spectrophotomètre Cuve jetable, moulée en et en pour UV. Avec parois traitées Kartell ment pour une transparence optimale
Résonance magnétique (IRM)
 (IRM) Le médecin a prescrit une résonance magnétique (IRM) et vous vous demandez en quoi consiste cet examen. Afin de répondre à vos questions, voici quelques informations. But de l examen Les examens
(IRM) Le médecin a prescrit une résonance magnétique (IRM) et vous vous demandez en quoi consiste cet examen. Afin de répondre à vos questions, voici quelques informations. But de l examen Les examens
Sytème de Diagnostic d'imagerie Numérique simple et évolutif
 Sytème de Diagnostic d'imagerie Numérique simple et évolutif Un système simple et évolutif Scanner Ceph - Temps d'exposition : minimum 4 sec - Mode HD Fonction de prévisualisation Décidez ainsi immédiatement
Sytème de Diagnostic d'imagerie Numérique simple et évolutif Un système simple et évolutif Scanner Ceph - Temps d'exposition : minimum 4 sec - Mode HD Fonction de prévisualisation Décidez ainsi immédiatement
GROUPE CLINIQUE DU MAIL
 DOSSIER DE PRESSE GROUPE CLINIQUE DU MAIL Le centre d imagerie médicale conforte son implantation sur le site du Mail avenue Marie-Reynoard à Grenoble & présente son nouveau scanner spiralé, issu de la
DOSSIER DE PRESSE GROUPE CLINIQUE DU MAIL Le centre d imagerie médicale conforte son implantation sur le site du Mail avenue Marie-Reynoard à Grenoble & présente son nouveau scanner spiralé, issu de la
Conseil Supérieur d Hygiène Rue de L Autonomie 4. Recommandations en matière de thérapie au moyen de radionucléides sous forme non scellée
 SPF Santé publique, Sécurité de la Chaîne alimentaire et Environnement Conseil Supérieur d Hygiène Rue de L Autonomie 4 B-1070 BRUXELLES Recommandations en matière de thérapie au moyen de radionucléides
SPF Santé publique, Sécurité de la Chaîne alimentaire et Environnement Conseil Supérieur d Hygiène Rue de L Autonomie 4 B-1070 BRUXELLES Recommandations en matière de thérapie au moyen de radionucléides
Les tests génétiques à des fins médicales
 Les tests génétiques à des fins médicales Les tests génétiques à des fins médicales Nous avons tous hérité d une combinaison unique de gènes de la part de nos parents. Cette constitution originale et l
Les tests génétiques à des fins médicales Les tests génétiques à des fins médicales Nous avons tous hérité d une combinaison unique de gènes de la part de nos parents. Cette constitution originale et l
.( /.*!0) %1 2"+ %#(3004) 05' 203 .(.*0"+ ) '!2"+ %#(30+ 0!"%) 4!%2) 3 .( @.*" '!%2"+ %#(30! &' 4!!% .+.*0%!!'!(!%2"+ 16 3047!
 !"#! $ %#&' (!"#$!% & % ' (!%' ) )''! *)+* *! %#"+, ' ( ', -) " *.( /.*!0) %1 2"+ %#(3004) 05' 203.(.*0"+ ) '!2"+ %#(30+ 0!"%) 4!%2) 3.( -.* %)!(2"+ %#(30! &' 4!!%.+.*0%!!'!(!%2"+ 16 3047!%(%' 0.(89.*
!"#! $ %#&' (!"#$!% & % ' (!%' ) )''! *)+* *! %#"+, ' ( ', -) " *.( /.*!0) %1 2"+ %#(3004) 05' 203.(.*0"+ ) '!2"+ %#(30+ 0!"%) 4!%2) 3.( -.* %)!(2"+ %#(30! &' 4!!%.+.*0%!!'!(!%2"+ 16 3047!%(%' 0.(89.*
Information à un nouveau donneur de cellules souches du sang
 Information à un nouveau donneur de cellules souches du sang Pour des raisons de simplification, les dénominations masculines s appliquent également aux femmes. La transplantation de cellules souches du
Information à un nouveau donneur de cellules souches du sang Pour des raisons de simplification, les dénominations masculines s appliquent également aux femmes. La transplantation de cellules souches du
Protéger. son animal. la gamme FRONTLINE. grâce à la gamme. Contre les puces et les tiques. Efficace plusieurs semaines (1) Résistant à la pluie,
 la gamme Frontline Contre les puces et les tiques Efficace plusieurs semaines (1) Résistant à la pluie, aux bains et aux shampooings (2) Protéger son animal grâce à la gamme FRONTLINE La gamme FRONTLINE
la gamme Frontline Contre les puces et les tiques Efficace plusieurs semaines (1) Résistant à la pluie, aux bains et aux shampooings (2) Protéger son animal grâce à la gamme FRONTLINE La gamme FRONTLINE
