ANNEXE III. Résumé des caractéristiques du produit, étiquetage et notice
|
|
|
- Stanislas Fournier
- il y a 8 ans
- Total affichages :
Transcription
1 Remarque : ANNEXE III Résumé des caractéristiques du produit, étiquetage et notice Ce Résumé des Caractéristiques du Produit, étiquetage et notice sont le résultat de la procédure d arbitrage à laquelle la décision de la Commission fait référence. L information produit pourra ensuite être mise à jour par les autorités compétentes des états membres, en relation avec l état membre de référence, le cas échéant, conformément aux procédures fixées dans le Chapitre 4 du Titre III de la Directive 2001/83/CE. 15
2 RESUME DES CARACTERISTIQUES DU PRODUIT, ETIQUETAGE ET NOTICE 16
3 RESUME DES CARACTERISTIQUES DU PRODUIT 17
4 1. DENOMINATION DU MEDICAMENT EMLA et noms associés (voir Annexe I) 25mg/g + 25mg/g crème [Voir Annexe I - A compléter au niveau national] 2. COMPOSITION QUALITATIVE ET QUANTITATIVE 3. FORME PHARMACEUTIQUE Crème 4. DONNEES CLINIQUES 4.1 Indications thérapeutiques EMLA crème est indiquée pour : L anesthésie topique de la peau lors de : o l insertion d aiguilles, par exemple insertion de cathéters intraveineux ou prélèvements sanguins ; o procédures chirurgicales superficielles ; chez les adultes et dans la population pédiatrique L anesthésie topique des muqueuses génitales, par exemple avant des procédures chirurgicales superficielles ou une anesthésie par infiltration ; chez les adultes et les adolescents 12 ans L anesthésie topique des ulcères de jambe afin de faciliter le nettoyage mécanique/débridement chez les adultes uniquement. 4.2 Posologie et mode d administration Posologie Adultes et adolescents Les détails des indications ou des procédures d utilisation, ainsi que la dose et la durée d application sont fournis dans les Tableaux 1 et 2. Pour plus de renseignements sur l utilisation appropriée du produit selon de telles procédures, veuillez vous référer au Mode d administration. Tableau 1 Adultes et adolescents de 12 ans et plus Indication/Procédure Dose et durée d application Peau Petites interventions, par exemple insertion d aiguilles et traitement chirurgical de lésions localisées. heures 1). Interventions dermatologiques sur peau récemment rasée sur de larges parties du corps, par exemple l épilation au laser (auto-application par le patient) Interventions chirurgicales dermatologiques sur de plus grandes surfaces, par exemple greffe de peau mince en milieu hospitalier Peau des organes génitaux chez l homme, avant 18 2 g (approximativement un demi tube de 5 g) ou approximativement 1,5 g/10 cm 2 pendant 1 à 5 Dose maximale recommandée : 60 g. Surface traitée maximale recommandée : 600 cm 2 pendant au moins 1 heure, maximum 5 heures 1). Approximativement 1,5-2 g/10 cm 2 pendant 2 à 5 heures 1). 1 g/10 cm 2 pendant 15 minutes
5 injection d'anesthésiques locaux Peau des organes génitaux chez la femme, avant injection d'anesthésiques locaux 2) Muqueuses génitales Traitement chirurgical de lésions localisées, par exemple ablation de verrues génitales (condylomes acuminés) et avant injection d anesthésiques locaux 1-2 g/10 cm 2 pendant 60 minutes Approximativement 5-10 g de crème pendant 5-10 minutes 1) 3) 4). Avant curetage cervical Ulcère(s) de jambe Adultes uniquement Nettoyage mécanique/débridement 10 g de crème doivent être administrés au niveau du cul-de-sac vaginal latéral pendant 10 minutes. Approximativement 1-2 g/10 cm 2 jusqu à un total de 10 g sur le ou les ulcère(s) de jambe 3) 5). Temps d application : minutes. 1) Après une période d application plus longue, l anesthésie diminue. 2) Sur la peau des organes génitaux chez la femme, l'application seule d EMLA pendant 60 ou 90 minutes ne permet pas une anesthésie suffisante pour le traitement de verrues génitales par thermocautérisation ou diathermie. 3) Les concentrations plasmatiques n ont pas été déterminées chez les patients traités avec des doses > à 10 g (voir aussi rubrique 5.2). 4) Chez les adolescents pesant moins de 20 kg, la dose maximale d EMLA à appliquer sur les muqueuses génitales doit être proportionnellement réduite. 5) EMLA a été utilisé pour le traitement des ulcères de jambe jusqu à 15 reprises sur une période de 1 à 2 mois sans perte d efficacité ni augmentation du nombre ou de la sévérité des événements indésirables. Population pédiatrique Tableau 2 Patients pédiatriques âgés de 0 à 11 ans Groupe d âge Procédure Dosage et temps d application Petites interventions, par exemple insertion d aiguilles et traitement chirurgical de lésions localisées. Approximativement 1 g/10 cm 2 pendant une heure (voir détails ci-dessous) Nouveau-nés et Jusqu à 1) 2) 3) nourrissons 0-2 mois Nourrissons 3-11 mois 2) 1 g et 10 cm 2 pendant une heure 4) Jusqu à 2 g et 20 cm 2 pendant une heure 5) Jeunes enfants et enfants 1-5 ans Enfants 6-11 ans Patients pédiatriques avec dermatite atopique Avant curetage de molluscum Jusqu à 10 g et 100 cm 2 pendant 1-5 heures 6) Jusqu à 20 g et 200 cm 2 pendant 1-5 heures 6) Temps d application : 30 minutes 1) Chez les nouveau-nés nés à terme et les nourrissons de moins de 3 mois, une unique dose devra seulement être appliquée sur une période de 24 heures. Pour les enfants âgés de 3 mois et plus, un maximum de 2 doses, séparées d au moins 12 heures, peut être donnée sur une période de 24 heures, voir rubriques 4.4 et ) EMLA ne doit pas être utilisé chez les enfants de moins de 12 mois qui sont traités par des médicaments inducteurs de méthémoglobine, pour des raisons de sécurité, voir rubriques 4.4 et
6 3) EMLA ne doit pas être utilisé chez les prématurés de moins de 37 semaines d âge gestationnel, pour des raisons de sécurité voir rubrique ) Un temps d application > 1 heure n a pas été étudié. 5) Aucune augmentation cliniquement significative des taux de méthémoglobine après application d EMLA pendant maximum 4 heures sur 16 cm 2 n a été observée. 6) Après une période d application plus longue, l anesthésie diminue. L efficacité et la sécurité de l utilisation d EMLA sur la peau des organes génitaux et les muqueuses génitales n ont pas été établies chez les enfants de moins de 12 ans. Les données pédiatriques disponibles ne démontrent pas d efficacité adéquate pour la circoncision. Patients âgés Aucune réduction de dose n est nécessaire chez les patients âgés (voir rubriques 5.1 et 5.2) Atteinte de la fonction hépatique Une réduction de dose unique n est pas nécessaire chez les patients présentant une atteinte de la fonction hépatique (voir rubrique 5.2) Atteinte de la fonction rénale Une réduction de dose n est pas nécessaire chez les patients présentant une fonction rénale diminuée. Mode d administration Utilisation cutanée La membrane de protection du tube est perforée à l aide du bouchon. Un gramme d EMLA correspond approximativement à 3,5 cm de longueur de crème prélevée dans un tube de 30 g. Si le dosage requiert un niveau de précision élevé pour éviter un surdosage (par exemple à des doses proches de la limite maximale chez le nouveau-né ou si deux applications peuvent être requises sur une durée de 24 heures), il est possible d utiliser une seringue, sachant que 1 ml = 1 g. Une couche épaisse d EMLA doit être appliquée sur la peau, incluant la peau des organes génitaux, sous un pansement occlusif. Pour l application sur des zones plus étendues, telle que pour la greffe de peau mince, un bandage élastique doit être appliqué au-dessus du pansement occlusif pour assurer une distribution uniforme de la crème et protéger la zone. En présence d une dermatite atopique, la durée d application doit être réduite. Pour les interventions concernant les muqueuses génitales, il n est pas nécessaire d utiliser un pansement occlusif. L intervention doit commencer immédiatement après le retrait de la crème. Pour les interventions concernant les ulcères de jambe, EMLA doit être appliqué en couche épaisse sous un pansement occlusif. Le nettoyage doit débuter sans délai après le retrait de la crème. Le tube d EMLA est destiné à un usage unique lorsqu il est utilisé pour traiter les ulcères de jambe : le tube ainsi que le contenu restant doivent être jetés à chaque fois qu un patient a été traité. 4.3 Contre-indications Hypersensibilité à la lidocaïne et/ou à la prilocaïne ou aux anesthésiques locaux de type amide ou à l un des excipients mentionnés à la rubrique Mises en garde spéciales et précautions d emploi Les patients souffrant d un déficit congénital en glucose-6-phosphate-déshydrogénase ou de méthémoglobinémie idiopathique sont plus susceptibles de présenter des signes de méthémoglobinémie induite par la substance active. Chez les patients présentant un déficit en 20
7 glucose-6-phosphate déshydrogénase, l antidote bleu de méthylène est inefficace pour diminuer le taux de méthémoglobine et peut oxyder l hémoglobine elle-même. Par conséquent, une thérapie par le bleu de méthylène ne peut pas être effectuée. En raison de données insuffisantes sur son absorption, EMLA ne doit pas être appliqué sur les blessures ouvertes (excepté les ulcères de jambe). En raison de l absorption potentiellement plus importante sur la peau récemment rasée, il est important de respecter la posologie, la zone et le temps d application recommandés (voir rubrique 4.2). Il faut faire attention lors de l application d'emla chez les patients atteints de dermatite atopique. Un temps d'application réduit à minutes peut être suffisant (voir rubrique 5.1). Des temps d application supérieurs à 30 minutes chez des patients atteints de dermatite atopique peuvent conduire à une augmentation de l incidence des réactions vasculaires locales, en particulier rougeur au site d application et dans certains cas pétéchies et purpura (voir rubrique 4.8). Avant le curetage de molluscum chez les enfants atteints de dermatite atopique, un temps d application de 30 minutes est recommandé. Lors de son application à proximité des yeux, EMLA doit être utilisé avec précaution car cela peut provoquer des irritations au niveau des yeux. La perte des réflexes de protection des yeux peut également conduire à une irritation de la cornée et à une potentielle abrasion. En cas de contact oculaire, les yeux doivent être immédiatement rincés avec de l eau ou une solution saline et protégés jusqu au retour de la sensibilité. EMLA ne doit pas être utilisé sur une membrane tympanique endommagée. Des tests effectués sur des animaux de laboratoire ont révélé une ototoxicité d'emla lors de son instillation dans l'oreille moyenne. Cependant, chez les animaux avec une membrane tympanique intacte, aucune anomalie n a été montrée lors de l application d EMLA au niveau du canal auditif externe. Les patients traités avec des médicaments anti-arythmiques de classe III (par exemple, l amiodarone) doivent être étroitement surveillés et une surveillance ECG doit être envisagée car les effets cardiaques peuvent être additifs. La lidocaïne et la prilocaïne ont des propriétés bactéricides et antivirales à des concentrations supérieures à 0,5 2 %. C est pourquoi, bien que les résultats d une étude clinique suggèrent que l utilisation d EMLA avant une vaccination contre la tuberculose (BCG) n influence pas la réponse immunitaire, évaluée par la formation d une papule locale, il est nécessaire de suivre le résultat d injections intradermiques de vaccins vivants. EMLA contient de l huile de ricin polyoxyl hydrogénée, qui peut causer des réactions cutanées. Population pédiatrique Lors d études, l efficacité d EMLA lors des prélèvements capillaires au talon chez les nouveau-nés n a pas été démontrée. Chez les nouveau-nés et les nourrissons de moins de 3 mois, une augmentation transitoire dépourvue de signification clinique des taux de méthémoglobine est couramment observée, jusqu à 12 heures après application de la dose recommandée d EMLA. Si la dose recommandée est dépassée, le patient doit être surveillé en cas de survenue d effets indésirables systémiques secondaires à une méthémoglobinémie (voir rubriques 4.2, 4.8 et 4.9). EMLA ne doit pas être utilisé chez les nouveau-nés/nourrissons de 0 à 12 mois traités par des médicaments inducteurs de méthémoglobine ; chez les nouveau-nés prématurés de moins de 37 semaines d âge gestationnel car ils risquent de développer des taux élevés de méthémoglobine. 21
8 La sécurité et l efficacité de l application d EMLA sur la peau des organes génitaux et sur les muqueuses génitales n ont pas été établies chez les enfants de moins de 12 ans. Les données pédiatriques disponibles ne démontrent pas d efficacité adéquate pour la circoncision. 4.5 Interactions avec d autres médicaments et autres formes d interactions De fortes doses de prilocaïne peuvent augmenter les taux de méthémoglobine, en particulier chez des patients traités par des médicaments inducteurs de méthémoglobine (ex. sulfamides, nitrofuradantine, phénytoïne, phénobarbital). Cette liste n est pas exhaustive. Avec des doses élevées d'emla, le risque de toxicité systémique supplémentaire doit être envisagé chez les patients recevant d'autres anesthésiques locaux ou des médicaments de structure apparentée aux anesthésiques locaux, puisque les effets toxiques sont additifs. Des études d interaction spécifique avec la lidocaïne/prilocaïne et des anti-arythmiques de classe III (par exemple l amiodarone) n ont pas été réalisées mais une précaution particulière est conseillée (voir aussi rubrique 4.4). Les médicaments qui réduisent la clairance de la lidocaïne (par exemple la cimétidine ou les béta-bloquants) peuvent causer des concentrations plasmatiques potentiellement toxiques lorsque la lidocaïne est donnée à fortes doses répétées sur une longue période. Population pédiatrique Des études d interaction spécifiques chez les enfants n ont pas été réalisées. Les interactions sont probablement similaires à celles de la population adulte. 4.6 Fertilité, grossesse et allaitement Grossesse Bien qu une application topique soit uniquement associée à un faible taux d absorption systémique, l utilisation d EMLA chez les femmes enceintes doit être considérée avec précaution car les données disponibles concernant l utilisation d EMLA chez les femmes enceintes sont insuffisantes. Cependant, des études chez l animal n ont pas montré d effets nocifs directs ou indirects sur la grossesse, le développement embryonnaire/fœtal, l accouchement ou le développement postnatal. Une toxicité de reproduction a été montrée lors d une administration sous-cutanée/intramusculaire de fortes doses de lidocaïne ou de prilocaïne excédant considérablement l exposition lors d une application topique (voir rubrique 5.3). La lidocaïne et la prilocaïne traversent la barrière placentaire, et peuvent être absorbées par les tissus fœtaux. Il est raisonnable de penser que la lidocaïne et la prilocaïne ont été utilisées chez de nombreuses femmes enceintes ou en âge de procréer. Jusqu à présent, aucun trouble spécifique de la fonction reproductrice n a été rapporté par exemple une incidence accrue de malformations ou autres effets directement ou indirectement nocifs pour le fœtus. Allaitement La lidocaïne et, en toute probabilité, la prilocaïne sont excrétées dans le lait maternel mais en quantités si faibles qu il n y a généralement pas de risque que l enfant soit affecté à des doses thérapeutiques. EMLA peut être utilisé pendant l allaitement en cas de nécessité clinique. Fertilité Des études chez l animal n ont montré aucune altération de la fertilité des rats mâles ou femelles (voir rubrique 5.3). 22
9 4.7 Effets sur l aptitude à conduire des véhicules et à utiliser des machines EMLA n a pas d effet ou un effet négligeable sur l aptitude à conduire des véhicules et à utiliser des machines quand il est utilisé aux doses recommandées. 4.8 Effets indésirables Résumé du profil de sécurité Les effets indésirables les plus fréquemment observés sont liés au site d administration (réactions locales transitoires au site d application) et sont rapportés comme fréquents. Liste des réactions indésirables sous forme de tableau Les incidences des effets indésirables (EIs) associés à un traitement par EMLA sont présentées dans le tableau ci-dessous. Le tableau est basé sur les évènements indésirables rapportés pendant les essais cliniques et/ou l utilisation post-commercialisation. Les effets indésirables sont listés par ordre de fréquence, selon la terminologie MedDRA par Classe de Système d Organe (SOC), au niveau des termes préférés. Dans chaque Classe de Système d Organe, les fréquences des effets indésirables sont répertoriées comme suit : très fréquent ( 1/10), fréquent ( 1/100 à < 1/10), peu fréquent ( 1/1 000 à < 1/100), rare ( 1/ à < 1/1 000) et très rare (< 1/10 000). Dans chaque groupe de fréquence, les effets indésirables sont présentés dans un ordre de sévérité décroissante. Tableau 3 Effets indésirables Classe de Système Fréquent Peu fréquent Rare d Organe Affections Méthémoglobinémie 1 hématologiques et du système lymphatique Affections du système 1, 2, 3 Hypersensibilité immunitaire Affections oculaires Irritation de la cornée 1 Affections de la peau et du tissu sous-cutané Troubles généraux et anomalies au site d administration 1 Peau 2 Muqueuses génitales 3 Ulcère de jambe Sensation de brûlure 2, 3 Prurit au site d application 2, 3 Erythème au site 1, 2,3 d application Œdème au site 1, 2, 3 d application Chaleur au site d application 2, 3 Pâleur au site 1, 2, 3 d application Sensation de brûlure 1 Irritation au site d application 3 Prurit au site d application 1 Paresthésie au site d application 2 telle que fourmillements Chaleur au site d application 1 Purpura 1, pétéchies 1 (en particulier après des durées d application plus longues chez les enfants souffrant de dermatite atopique ou de molluscum contagiosum) Population pédiatrique 23
10 La fréquence, le type et la sévérité des effets indésirables sont similaires dans les groupes d âges pédiatriques et adultes, excepté en ce qui concerne la méthémoglobinémie qui est observée plus fréquemment, souvent en relation avec un surdosage (voir la rubrique 4.9), chez les nouveau-nés et les nourrissons âgés de 0 à 12 mois. Déclaration des effets indésirables suspectés La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament. Les professionnels de santé déclarent tout effet indésirable suspecté via le système national de déclaration - Voir Annexe V. 4.9 Surdosage De rares cas de méthémoglobinémie cliniquement significative ont été rapportés. La prilocaïne à fortes doses peut causer une augmentation des taux de méthémoglobine, en particulier chez les individus sensibles (voir rubrique 4.4), avec une administration trop fréquente chez les nouveau-nés et les nourrissons de moins de 12 mois (voir rubrique 4.2) et traités par des médicaments inducteurs de méthémoglobine (ex. sulfamides, nitrofuradantine, phénytoïne et phénobarbital). Il convient de tenir compte du fait que les valeurs de saturation à l oxymètre de pouls peuvent surestimer la saturation réelle en oxygène dans le cas d une augmentation de la fraction de méthémoglobine ; par conséquent, si une méthémoglobinémie est suspectée, il peut être plus utile de surveiller la saturation d oxygène par co-oxymétrie. Une méthémoglobinémie cliniquement significative devra être traitée par une injection intraveineuse lente de bleu de méthylène (voir également rubrique 4.4). Si d autres symptômes de toxicité systémique survenaient, les signes devraient être similaires à ceux qui se produiraient suite à l administration d anesthésiques locaux par d autres voies d administration. La toxicité d un anesthésique local se manifeste par des symptômes d excitation du système nerveux central et, dans les cas sévères, dépression du système nerveux central et dépression cardiovasculaire. Des symptômes neurologiques graves (convulsions, dépression du système nerveux central) doivent être traités symptomatiquement par assistance respiratoire et par administration de médicaments anticonvulsivants ; les signes circulatoires sont traités suivant les recommandations de réanimation. Le taux d absorption du produit sur peau intacte étant lent, un patient montrant des signes de toxicité doit être maintenu sous observation pendant plusieurs heures après le traitement d urgence. 5. PROPRIETES PHARMACOLOGIQUES 5.1 Propriétés pharmacodynamiques Classe pharmacothérapeutique : anesthésiques, local ; amides ; Code ATC : N01B B20. Mécanisme d action EMLA produit une anesthésie de la peau par libération de lidocaïne et de prilocaïne à partir de la crème dans les couches épidermique et dermique de la peau et à proximité des récepteurs dermiques de la douleur et des terminaisons nerveuses. La lidocaïne et la prilocaïne sont des anesthésiques locaux de type amide. Ces deux composants stabilisent les membranes neuronales en inhibant les flux ioniques nécessaires à l initiation et à la conduction des influx, produisant ainsi une anesthésie locale. La qualité de l anesthésie dépend du temps d application et de la dose utilisée. Peau EMLA est appliqué sur la peau intacte sous un pansement occlusif. Le temps nécessaire pour réaliser une anesthésie fiable de la peau intacte est de 1 à 2 heures, en fonction du type d intervention. L effet 24
11 anesthésique local est renforcé avec des durées d application plus longues de 1 à 2 heures sur la plupart des parties du corps, à l exception de la peau du visage et des parties génitales masculines. Compte tenu de la finesse de la peau du visage et d une irrigation sanguine élevée des tissus, un effet anesthésique local maximal est obtenu après 30 à 60 minutes sur le front et les joues. De même, une anesthésie locale des parties génitales masculines est obtenue en 15 minutes. La durée de l anesthésie après l application d EMLA pendant 1 à 2 heures est d au moins 2 heures après le retrait du pansement, excepté sur le visage où ce délai est plus court. EMLA est tout aussi efficace et a le même temps de déclenchement de l effet anesthésiant quelque soit le niveau de pigmentation de la peau de claire à foncée (types de peau de I à VI). Au cours des études cliniques avec application d EMLA sur la peau intacte, aucune différence de sécurité ou d efficacité (y compris le délai avant le début de l anesthésie) n a été observée entre les patients gériatriques (de 65 à 96 ans) et les patients plus jeunes. EMLA produit une réponse vasculaire biphasique impliquant une vasoconstriction initiale suivie d une vasodilatation au site d application (voir rubrique 4.8). Indépendamment de la réponse vasculaire, EMLA facilite l insertion de l aiguille par rapport à une crème placebo. Chez les patients atteints de dermatite atopique, une réaction vasculaire similaire mais plus courte a été observée, avec apparition d un érythème après minutes, indiquant une absorption plus rapide à travers la peau (voir rubrique 4.4). EMLA peut causer une augmentation transitoire de l épaisseur cutanée, provoquée en partie par l hydratation de la peau sous le pansement occlusif. L épaisseur de la peau se réduit au cours des 15 minutes suivant l exposition à l air. La profondeur de l'anesthésie cutanée augmente avec le temps d'application. Chez 90 % des patients, l'anesthésie est suffisante pour l'insertion d'un poinçon de biopsie (de 4 mm de diamètre) à une profondeur de 2 mm après 60 minutes et 3 mm après 120 minutes de traitement par EMLA. L utilisation d EMLA, avant une vaccination rougeole-oreillons-rubéole ou avant l administration intramusculaire d un vaccin inactivé diphtérie-coqueluche-tétanos-poliovirus -Haemophilus influenzae b ou un vaccin contre l hépatite B, n a pas affecté la moyenne des titres en anticorps, le taux de séroconversion ou la proportion de patients obtenant des titres d anticorps protecteurs ou positifs après immunisation, par rapport aux patients traités par un placebo. Muqueuses génitales L absorption sur les muqueuses génitales est plus rapide, et le délai de survenue de l anesthésie est plus court qu après application sur la peau. Après une application de 5-10 minutes d EMLA sur la muqueuse génitale de la femme, la durée moyenne de l analgésie efficace à un stimulus au laser à argon qui produit une douleur vive avec sensation de piqûre était de 15 à 20 minutes (variations individuelles dans l intervalle 5-45 minutes) Ulcères de jambe Une anesthésie fiable dans le cas du nettoyage des ulcères de jambe est obtenue après un temps d application de 30 minutes chez la plupart des patients. Une application d une durée de 60 minutes peut améliorer davantage l anesthésie. Le nettoyage doit commencer dans les 10 minutes qui suivent le retrait de la crème. Des données cliniques relatives à des temps d attente plus longs ne sont pas disponibles. EMLA réduit la douleur postopératoire jusqu à 4 heures après débridement. EMLA réduit le nombre de séances de nettoyage nécessaires pour obtenir un ulcère propre par comparaison au débridement obtenu avec une crème placebo. On n a observé aucun effet négatif sur la guérison de l ulcère ou sur la flore bactérienne. Population pédiatrique Des études cliniques impliquant plus de 2300 patients pédiatriques de tout âge ont démontré une efficacité pour la douleur liée à l aiguille (prélèvement sanguin veineux, cathétérisme, vaccination sous-cutanée et intramusculaire, ponction lombaire), pour le traitement des lésions vasculaires au laser, et le curetage des molluscum contagiosum. EMLA a diminué la douleur lors de l insertion d aiguilles et lors de l injection de vaccins. L efficacité analgésique a augmenté d une application de 25
12 15 minutes à une application de 90 minutes sur une peau normale ; mais sur des lésions vasculaires, une application de 90 minutes n a pas fourni de bénéfice supérieur à une application de 60 minutes. EMLA ne montre pas de bénéfice versus placebo concernant la cryothérapie à l azote liquide des verrues communes. Aucune efficacité suffisante pour la circoncision n a pu être démontrée. Onze études cliniques réalisées chez des nouveau-nés et des nourrissons ont montré que les pics de concentrations de méthémoglobine qui survenaient environ 8 heures après l administration épicutanée d EMLA, étaient cliniquement non significatifs au dosage recommandé et revenaient à des valeurs normales après environ heures. La formation de méthémoglobine est associée à la quantité cumulée de prilocaïne absorbée par voie percutanée et peut donc augmenter en fonction de l allongement de la durée d application d EMLA. L utilisation d EMLA, avant une vaccination rougeole-oreillons-rubéole ou avant l administration intramusculaire d un vaccin inactivé diphtérie-coqueluche-tétanos-poliovirus -Haemophilus influenzae b ou un vaccin contre l hépatite B, n a pas affecté la moyenne des titres en anticorps, le taux de séroconversion ou la proportion de patients obtenant des titres d anticorps protecteurs ou positifs après immunisation, par rapport aux patients traités par un placebo. 5.2 Propriétés pharmacocinétiques Absorption, distribution, biotransformation et élimination L absorption systémique de la lidocaïne et de la prilocaïne à partir d EMLA est fonction de la dose, de la surface d application et du temps d application. Des facteurs additionnels incluent l épaisseur de la peau (qui varie selon les parties du corps) ainsi que d autres facteurs tels que les maladies de la peau, et le rasage. Après application sur des ulcères de jambe, les caractéristiques des ulcères peuvent également affecter l absorption. Les concentrations plasmatiques après traitement par EMLA sont de 20 à 60 % inférieures pour la prilocaïne par rapport à la lidocaïne en raison d un volume de distribution supérieur et d une clairance plus rapide. La voie d élimination principale de la lidocaïne et de la prilocaïne est le métabolisme hépatique et les métabolites sont éliminés par voie rénale. Toutefois, les taux de métabolisation et d élimination des anesthésiques locaux après une application topique d EMLA dépendent de la vitesse d absorption. Par conséquent, une réduction de la clairance, notamment chez les patients présentant une atteinte grave de la fonction hépatique, a des effets limités sur les concentrations plasmatiques systémiques après administration d une dose unique d EMLA et après administrations réitérées une fois par jour de doses uniques à court terme (jusqu à 10 jours). Les symptômes de toxicité anesthésique locale deviennent de plus en plus marqués lorsque la concentration plasmatique augmente de 5 à 10 μg/ml de l une ou l autre des substances actives. Il convient de considérer que la toxicité de la lidocaïne et celle de la prilocaïne sont additives. Peau intacte Après application sur la cuisse chez l adulte (60 g de crème/400 cm² pendant 3 heures), le degré d absorption de la lidocaïne et de la prilocaïne était d environ 5 %. Les concentrations plasmatiques maximales (en moyenne 0,12 et 0,07 µg/ml) ont été atteintes en approximativement 2-6 heures après l application. Le degré d absorption systémique était d environ 10 % après application sur le visage (10 g/100 cm² pendant 2 heures). Les concentrations plasmatiques maximales (en moyenne 0,16 et 0,06 µg/ml) ont été atteintes après environ 1,5-3 heures. Dans des études de greffe de peau mince chez les adultes une application de 7 heures 40 minutes au niveau de la cuisse ou de l avant-bras jusqu à une surface de cm 2 a conduit des concentrations plasmatiques maximales ne dépassant pas 1,1 µg/ml de lidocaïne et 0,2 µg/ml de prilocaïne. Muqueuses génitales Après application de 10 g d EMLA pendant 10 minutes sur la muqueuse vaginale, les concentrations plasmatiques maximales de lidocaïne et de prilocaïne (en moyenne respectivement 0,18 µg/ml et 0,15 µg/ml) ont été atteintes après minutes. 26
13 Ulcère de jambe Suite à une application unique de 5 à 10 g d EMLA sur des ulcères de jambe d une surface s étendant jusqu à 64 cm 2 pendant 30 minutes, les concentrations plasmatiques maximales de lidocaïne (intervalle de 0,05 à 0,25 µg/ml avec une valeur individuelle de 0,84 µg/ml) et de prilocaïne (0,02-0,08 µg/ml) ont été atteintes en 1 à 2,5 heures. Après un temps d application de 24 heures sur les ulcères de jambe sur une zone s étendant jusqu à 50 à 100 cm 2, les concentrations plasmatiques maximales pour la lidocaïne (0,19-0,71 µg/ml) et pour la prilocaïne (0,06-0,28 µg/ml) ont été généralement atteintes en 2 à 4 heures. Des applications répétées de 2-10 g d EMLA sur des ulcères de jambe sur une surface s étendant jusqu'à 62 cm 2 pendant minutes 3-7 fois par semaine jusqu à 15 doses sur une période d un mois, n ont pas montré d accumulation plasmatique apparente de lidocaïne ni de ses métabolites monoglycinexylidide et 2,6-xylidine ou de prilocaïne ni de son métabolite l ortho-toluidine. Les concentrations plasmatiques maximales observées de lidocaïne, de monoglycinexylidide et de 2,6-xylidine étaient respectivement de 0,41 µg/ml, de 0,03 µg/ml et de 0,01 µg/ml. Les concentrations plasmatiques maximales observées de prilocaïne et d ortho-toluidine étaient respectivement de 0,08 µg/ml et de 0,01 µg/ml. Après une application répétée de 10 g d EMLA sur des ulcères de jambe chroniques sur une surface comprise entre 62 et 160 cm 2 pendant 60 minutes une fois par jour pendant 10 jours consécutifs, la concentration plasmatique maximale moyenne résultant de la somme des concentrations de lidocaïne et de prilocaïne était de 0,6 µg/ml. La concentration maximale ne dépend pas de l âge du patient mais est significativement (p < 0,01) associée à la taille de la surface de l ulcère. L augmentation de la surface de l ulcère de 1 cm 2 entraîne une augmentation de la valeur C max de la somme des concentrations de lidocaïne et de prilocaïne de 7,2 ng/ml. La somme des concentrations plasmatiques maximales de lidocaïne et de prilocaïne est inférieure d un tiers à celle associée aux réactions toxiques et aucune accumulation n est apparemment observée sur 10 jours. Populations spéciales Patients âgés Après application d EMLA sur la peau intacte de patients gériatriques ou sur d autres patients non gériatriques, les concentrations plasmatiques de lidocaïne et de prilocaïne sont très basses et nettement inférieures aux niveaux toxiques potentiels. Population pédiatrique Les concentrations plasmatiques maximales de lidocaïne et de prilocaïne après application d EMLA chez les patients pédiatriques de différents âges étaient également en dessous des niveaux potentiellement toxiques. Voir tableau 4. Tableau 4. Concentrations plasmatiques de lidocaïne et de prilocaïne dans les groupes pédiatriques âgés de 0 mois à 8 ans Age Quantité de crème appliquée Temps d application de la crème sur la peau Concentration plasmatique [ng/ml] Lidocaïne Prilocaïne 0-3 mois 1 g/10 cm 2 1 heure mois 2 g/16 cm 2 4 heures ans 10 g/100 cm 2 2 heures ans g/ cm 2 (1 g/ 10 cm 2 ) 2 heures Données de sécurité préclinique 27
14 Dans des études chez l animal, la toxicité observée après administrations de doses élevées de lidocaïne ou de prilocaïne, en association ou non, s est manifestée par des effets sur le système nerveux central et sur le système cardio-vasculaire. Lorsque la lidocaïne et la prilocaïne étaient administrées en association, seuls des effets additifs ont été observés, sans indication de synergie ou de toxicité inattendue. Après ingestion involontaire d EMLA, les deux substances actives présentaient une faible toxicité orale aiguë avec une bonne marge de sécurité. Dans des études de toxicité sur la reproduction, des effets embryotoxiques ou foeto-toxiques ont été détectés à des doses de 25 mg/kg de lidocaïne par voie sous-cutanée chez le lapin ; et à partir des dose de 100 mg/kg de prilocaïne par voie intramusculaire chez le rat. A des doses inférieures à la dose maternelle toxique chez le rat, la lidocaïne n a pas d effet sur le développement postnatal des petits. La fertilité chez les rats mâles ou femelles traités par la lidocaïne ou la prilocaïne n a pas été altérée. La lidocaïne passe la barrière placentaire par diffusion simple. Le rapport entre la dose embryo-foetale et les concentrations sériques de la mère est de 0,4 à 1,3. Aucun des deux anesthésiques locaux n a présenté de potentiel génotoxique lors des tests de génotoxicité in vitro ou in vivo. Etant donné l indication et la durée d utilisation thérapeutique de ces substances actives, aucune étude de cancérogénicité n a été réalisée avec la lidocaïne ou la prilocaïne, seules ou en association. Un métabolite de la lidocaïne, le 2,6-diméthylaniline, et un métabolite de la prilocaïne, l o-toluidine, ont fait preuve d une activité génotoxique. Au cours d études précliniques toxicologiques évaluant l exposition chronique, ces métabolites ont montré un potentiel cancérogène. Les évaluations du risque comparant l exposition humaine maximale calculée lors de l utilisation intermittente de lidocaïne et de prilocaïne à l exposition au cours des études précliniques, indiquent une grande marge de sécurité lors de l utilisation clinique. Des études de tolérance locale avec des mélanges de lidocaïne et de prilocaïne 1:1 (m/m) sous forme d émulsion, de crème ou de gel ont montré que ces formulations sont bien tolérées par la peau intacte et lésée et par les muqueuses. Lors d une étude chez l animal, une réaction irritative prononcée a été observée après application unique dans l œil d une émulsion contenant 50 mg/g de lidocaïne + prilocaïne 1:1 (m/m). La concentration en anesthésiques locaux était identique et la formulation similaire à celles d EMLA. Cette réaction oculaire peut avoir été influencée par le ph élevé de la formulation de l émulsion (environ 9) mais il est probable qu elle soit due en partie au pouvoir irritant propre des anesthésiques locaux. 6. DONNEES PHARMACEUTIQUES 6.1 Liste des excipients 6.2 Incompatibilités Sans objet. 6.3 Durée de conservation 6.4 Précautions particulières de conservation 6.5 Nature et contenu de l emballage extérieur 28
15 Toutes les présentations peuvent ne pas être commercialisées. 6.6 Précautions particulières d élimination et manipulation Précautions à prendre avant de manipuler ou d administrer le médicament Les personnes qui appliquent ou enlèvent fréquemment la crème doivent veiller à ce que le contact soit évité afin de prévenir le développement d hypersensibilité. Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur. 7. TITULAIRE DE L AUTORISATION DE MISE SUR LE MARCHE [Voir annexe I -A compléter au niveau national] {Nom et adresse} {tel} {fax} { } 8. NUMERO(S) D AUTORISATION DE MISE SUR LE MARCHE 9. DATE DE PREMIERE AUTORISATION/DE RENOUVELLEMENT DE L AUTORISATION Date de première autorisation: :{JJ mois AAAA} Date de dernier renouvellement: :{JJ mois AAAA} 10. DATE DE MISE A JOUR DU TEXTE 29
16 ETIQUETAGE 30
17 MENTIONS DEVANT FIGURER SUR L EMBALLAGE EXTERIEUR ETUI 1. DENOMINATION DU MEDICAMENT EMLA et noms associés (voir Annexe I) 25mg/g + 25mg/g crème [Voir Annexe I - A compléter au niveau national] lidocaïne / prilocaïne 2. COMPOSITION EN SUBSTANCE(S) ACTIVE(S) 3. LISTE DES EXCIPIENTS 4. FORME PHARMACEUTIQUE ET CONTENU 5. MODE ET VOIE(S) D ADMINISTRATION Lire la notice avant utilisation. Utilisation cutanée 6. MISE EN GARDE SPECIALE INDIQUANT QUE LE MEDICAMENT DOIT ETRE CONSERVE HORS DE LA VUE ET DE LA PORTEE DES ENFANTS Tenir hors de la vue et de la portée des enfants. 7. AUTRE(S) MISE(S) EN GARDE SPECIALE(S), SI NECESSAIRE Eviter tout contact avec les yeux. 8. DATE DE PEREMPTION EXP 9. PRECAUTIONS PARTICULIERES DE CONSERVATION 31
18 10. PRECAUTIONS PARTICULIERES D ELIMINATION DES MEDICAMENTS NON UTILISES OU DES DECHETS PROVENANT DE CES MEDICAMENTS S IL Y A LIEU 11. NOM ET ADRESSE DU TITULAIRE DE L AUTORISATION DE MISE SUR LE MARCHE [Voir Annexe I - A compléter au niveau national] {Nom et adresse} {tel} {fax} { } 12. NUMERO(S) D AUTORISATION DE MISE SUR LE MARCHE 13. NUMERO DU LOT LOT 14. CONDITIONS DE PRESCRIPTION ET DE DELIVRANCE 15. INDICATIONS D UTILISATION Lire la notice avant utilisation. 16 INFORMATIONS EN BRAILLE 32
19 MENTIONS MINIMALES DEVANT FIGURER SUR LES PETITS CONDITIONNEMENTS PRIMAIRES Tube en aluminium 5 g 1. DENOMINATION DU MEDICAMENT ET VOIE(S) D ADMINISTRATION EMLA et noms associés (voir Annexe I) 25mg/g + 25mg/g crème [Voir Annexe I - A compléter au niveau national] lidocaïne / prilocaïne. Utilisation cutanée 2. MODE D ADMINISTRATION Lire la notice avant utilisation. 3. DATE DE PEREMPTION EXP 4. NUMERO DU LOT LOT 5. CONTENU EN POIDS, VOLUME OU UNITE 5g 6. AUTRES 33
20 MENTION DEVANT FIGURER SUR LE CONDITIONNEMENT PRIMAIRE Tube en aluminium 30 g 1. DENOMINATION DU MEDICAMENT EMLA et noms associés (voir Annexe I) 25mg/g + 25mg/g crème [Voir Annexe I - A compléter au niveau national] lidocaïne / prilocaïne 2. COMPOSITION EN SUBSTANCE(S) ACTIVE(S) 3. LISTE DES EXCIPIENTS 4. FORME PHARMACEUTIQUE ET CONTENU 30 g de crème 5. MODE ET VOIE(S) D ADMINISTRATION Lire la notice avant utilisation. Utilisation cutanée 6. MISE EN GARDE SPECIALE INDIQUANT QUE LE MEDICAMENT DOIT ETRE CONSERVE HORS DE LA VUE ET DE LA PORTEE DES ENFANTS Tenir hors de la vue et de la portée des enfants. 7. AUTRE(S) MISE(S) EN GARDE SPECIALE(S), SI NECESSAIRE Eviter tout contact avec les yeux. 8. DATE DE PEREMPTION EXP 9. PRECAUTIONS PARTICULIERES DE CONSERVATION 34
21 10. PRECAUTIONS PARTICULIERES D ELIMINATION DES MEDICAMENTS NON UTILISES OU DES DECHETS PROVENANT DE CES MEDICAMENTS S IL Y A LIEU 11. NOM ET ADRESSE DU TITULAIRE DE L AUTORISATION DE MISE SUR LE MARCHE [Voir Annexe I - A compléter au niveau national] {Nom et adresse} {tel} {fax} { } 12. NUMERO(S) D AUTORISATION DE MISE SUR LE MARCHE 13. NUMERO DU LOT LOT 14. CONDITIONS DE PRESCRIPTION ET DE DELIVRANCE 15. INDICATIONS D UTILISATION 16 INFORMATIONS EN BRAILLE 35
22 NOTICE 36
23 Notice : information de l utilisateur EMLA et noms associés (voir Annexe I) 25mg/g + 25mg/g crème [Voir Annexe I - A compléter au niveau national] Veuillez lire attentivement cette notice avant d utiliser ce médicament car elle contient des informations importantes pour vous. - Gardez cette notice. Vous pourriez avoir besoin de la relire. - Si vous avez d autres questions, interrogez votre médecin ou votre pharmacien. - Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres. - Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4. Que contient cette notice 1. Qu'est-ce qu EMLA et dans quels cas est-il utilisé 2. Quelles sont les informations à connaître avant d utiliser EMLA 3. Comment utiliser EMLA 4. Quels sont les effets indésirables éventuels 5. Comment conserver EMLA 6. Contenu de l emballage et autres informations. 1. Qu est-ce qu EMLA et dans quel cas est-il utilisé? EMLA contient deux substances actives appelées la lidocaïne et la prilocaïne. Ces dernières appartiennent à un groupe de médicaments appelés anesthésiques locaux. EMLA fonctionne en provoquant une anesthésie de la surface de la peau pendant une courte durée. Il est appliqué sur la peau avant certains actes médicaux. Cela permet d arrêter la douleur au niveau de la peau ; cependant, vous pouvez encore avoir les sensations de pression et de toucher. Adultes, adolescents et enfants Il peut être utilisé pour anesthésier la peau avant : l insertion d aiguilles (par exemple, si vous devez avoir une injection ou faire une prise de sang). des opérations mineures de la peau. Adultes et adolescents Il peut aussi être utilisé : pour anesthésier les parties génitales avant : o de recevoir une injection. o certains actes médicaux tels que le retrait de verrues. Un médecin ou un(e) infirmier/ère doit superviser l utilisation d EMLA sur les parties génitales. Adultes Il peut aussi être utilisé pour anesthésier la peau avant : Le nettoyage ou le retrait de la peau endommagée en cas d ulcères de jambe 2. Quelles sont les informations à connaître avant d utiliser EMLA? N utilisez jamais EMLA 37
24 - si vous êtes allergique à la lidocaïne ou à la prilocaïne, à d autres anesthésiques locaux similaires ou à l un des autres composants contenus dans ce médicament (mentionnés dans la rubrique 6). Avertissement et précautions Adressez-vous à votre médecin ou votre pharmacien avant d utiliser EMLA - si vous ou votre enfant avez une maladie héréditaire rare qui affecte le sang, appelée «déficit en glucose-6-phosphate-déshydrogénase» - si vous ou votre enfant avez un problème au niveau de la quantité de pigments sanguins appelé «méthémoglobinémie» - N utilisez pas EMLA sur les zones présentant des éruptions cutanées, des coupures, des écorchures ou d autres plaies ouvertes, à l exception des ulcères de jambe. Si l un de ces problèmes est présent, vérifiez avec votre médecin ou pharmacien avant d utiliser la crème. - si vous ou votre enfant souffrez d une affection cutanée appelée «dermatite atopique», un temps d application réduit peut être suffisant. Un temps d application de plus de 30 minutes peut conduire à une augmentation de l incidence des réactions cutanées locales (voir aussi rubrique 4 «Effets indésirables éventuels»). - si vous prenez des médicaments spécifiques pour traiter les troubles du rythme cardiaque (anti-arythmiques de classe III tels que l amiodarone). Dans ce cas, le médecin doit surveiller votre fonction cardiaque. En raison de l absorption potentiellement renforcée sur une peau récemment rasée, il est important de suivre la posologie recommandée, le site d application et le temps d application. Evitez le contact d EMLA avec les yeux car il peut provoquer une irritation. Si vous recevez accidentellement EMLA dans votre œil, vous devez le rincer immédiatement à l eau tiède ou avec une solution saline (chlorure de sodium). Veillez à ne rien recevoir d autre dans les yeux jusqu au retour de la sensibilité. EMLA ne doit pas être appliqué à un tympan altéré. Si vous utilisez EMLA avant d être vacciné par des vaccins vivants (par exemple le vaccin contre la tuberculose), vous devez consulter à nouveau votre médecin ou votre infirmier/ère après la période de délai demandée dans le cadre du suivi de la vaccination. Enfants et adolescents Chez les nourrissons et les nouveau-nés âgés de moins de 3 mois, une augmentation transitoire, cliniquement non significative, de la quantité de pigments sanguins appelés «méthémoglobinémie» est fréquemment observée jusqu à 12 heures après l application d EMLA. L efficacité d EMLA lors du prélèvement sanguin au talon chez les nouveau-nés ou afin d assurer une analgésie adéquate lors de la circoncision n a pas pu être confirmée dans les études cliniques. EMLA ne doit pas être appliqué sur les muqueuses génitales (par exemple dans le vagin) chez les enfants (âgés de moins de 12 ans) en raison de données insuffisantes sur l absorption des substances actives. EMLA ne doit pas être utilisé chez les enfants âgés de moins de 12 mois qui reçoivent simultanément d autres traitements affectant la quantité de pigments sanguins «méthémoglobinémie» (par exemple les sulfamides, voir aussi rubrique 2 «Autres médicaments et EMLA»). EMLA ne doit pas être utilisé chez les nourrissons prématurés. Autres médicaments et EMLA Informez votre médecin ou pharmacien si vous utilisez/prenez, avez récemment utilisé/pris ou pourriez utiliser/prendre tout autre médicament. Ceci inclut les médicaments que vous achetez sans 38
25 prescription et les médicaments à base de plantes. EMLA peut avoir un effet sur le mode d action de certains médicaments et certains médicaments peuvent avoir un effet sur EMLA. Informez en particulier votre médecin ou votre pharmacien, si vous ou votre enfant avez récemment utilisé ou reçu l un des médicaments suivants : Des médicaments utilisés pour traiter les infections appelés «sulfamides» et du nitrofuradantine. Des médicaments utilisés pour traiter l épilepsie, appelés phénytoïne et phénobarbital. D autres anesthésiques locaux. Des médicaments pour traiter un rythme cardique irrégulier tels que l amiodarone. La cimétidine ou les béta-bloquants qui peuvent augmenter les concentrations de lidocaïne dans le sang. Cette interaction n a pas d impact clinique si EMLA est utilisé aux doses recommandées pour une courte durée de traitement. Grossesse, allaitement et fertilité Si vous êtes enceinte ou que vous allaitez, si vous pensez être enceinte ou planifiez une grossesse, demandez conseil à votre médecin ou pharmacien avant de prendre ce médicament. Il est peu probable qu EMLA, utillisé occasionnellement pendant la grossesse, provoque des effets indésirables sur le fœtus. Les substances actives contenues dans EMLA (lidocaïne et prilocaïne) sont excrétées dans le lait maternel. Cependant, les quantités sont si faibles qu il n y a généralement pas de risque pour l enfant. Des études chez l animal ont montré une absence d altération de la fertilité chez le mâle ou la femelle. Conduite de véhicules et utilisation de machines EMLA n a aucune ou qu une influence négligeable sur l aptitude à conduire et à utiliser des machines quand il est utilisé aux doses recommandées. EMLA contient de l'huile de ricin polyoxyl hydrogénée L huile de ricin polyoxyl hydrogénée peut provoquer des réactions cutanées. 3. Comment utiliser EMLA? Veillez à toujours utiliser ce médicament en suivant exactement les indications de votre médecin, pharmacien ou de votre infirmier/ère. Vérifiez auprès de votre médecin, pharmacien ou de votre infirmier/ère en cas de doute. Utilisation d EMLA - Le site d application, la quantité à utiliser ainsi que le temps d application dépendront de la raison pour laquelle EMLA est utilisé. - Votre médecin, pharmacien ou infirmier/ère vous appliqueront la crème ou vous montreront comment le faire vous-même. - Si EMLA est utilisé sur les parties génitales, l application doit être supervisée par un médecin ou un(e) infirmier/ère. Ne pas utiliser EMLA sur les zones suivantes : - Coupures, écorchures ou plaies, excepté les ulcères de jambe. - Zone avec éruptions cutanées ou eczéma. - Dans les yeux ou près des yeux. - A l intérieur du nez, de l oreille ou de la bouche. - Au niveau de l anus. - Sur les parties génitales des enfants. 39
26 Les personnes qui appliquent ou enlèvent régulièrement la crème doivent s assurer que tout contact est évité afin de prévenir le développement d une hypersensibilité. La membrane de protection du tube est perforée à l aide du capuchon. Utilisation sur la peau avant de petits actes médicaux (comme l insertion d aiguille ou des opérations mineures de la peau) : - La crème est appliquée sur la peau en couche épaisse. Votre médecin, pharmacien ou votre infirmier/ère vous diront où vous devrez l appliquer. - La crème est ensuite recouverte par un pansement [ruban adhésif]. Ce dernier sera enlevé juste avant le début de l intervention. Si vous appliquez vous-même la crème, assurez-vous d avoir reçu des pansements de la part de votre médecin, pharmacien ou infirmier/ère. - La dose usuelle chez les adultes et les adolescents âgés de plus de 12 ans est de 2 g (grammes). - Chez les adultes et adolescents âgés de plus de 12 ans, la crème doit être appliquée au moins 60 minutes avant le début de l intervention (excepté si la crème est utilisée au niveau des parties génitales). Cependant, ne pas appliquer la crème plus de 5 heures avant le début de l intervention. - Chez les enfants, la quantité d EMLA utilisée et le temps d application dépendent de leur âge. Votre médecin, infirmier/ère ou pharmacien vous diront la quantité à utiliser et à quel moment l appliquer. Lorsque vous appliquez la crème, il est très important de suivre exactement les instructions suivantes : 1. Pressez le tube de crème afin de former un monticule au niveau de la zone à anesthésier (par exemple à l endroit où l aiguille va être insérée). Une ligne de crème d environ 3,5 cm d épaisseur provenant d un tube de 30 g est équivalente à 1 g de crème. La moitié d un tube de 5 g correspond environ à 2 g d EMLA. 2. Ne pas faire pénétrer la crème. 3. Décollez «le centre prédécoupé» du pansement. 40
NOTICE : INFORMATION DE L UTILISATEUR. Delphi 0,1 % crème Acétonide de triamcinolone
 NOTICE : INFORMATION DE L UTILISATEUR Delphi 0,1 % crème Acétonide de triamcinolone Veuillez lire attentivement cette notice avant d utiliser ce médicament car elle contient des informations importantes
NOTICE : INFORMATION DE L UTILISATEUR Delphi 0,1 % crème Acétonide de triamcinolone Veuillez lire attentivement cette notice avant d utiliser ce médicament car elle contient des informations importantes
NOTICE : INFORMATION DE L'UTILISATEUR. DAKTOZIN 2,5 mg/150 mg pommade Nitrate de miconazole et oxyde de zinc
 NOTICE : INFORMATION DE L'UTILISATEUR DAKTOZIN 2,5 mg/150 mg pommade Nitrate de miconazole et oxyde de zinc Veuillez lire attentivement cette notice avant d utiliser ce médicament car elle contient des
NOTICE : INFORMATION DE L'UTILISATEUR DAKTOZIN 2,5 mg/150 mg pommade Nitrate de miconazole et oxyde de zinc Veuillez lire attentivement cette notice avant d utiliser ce médicament car elle contient des
NOTICE : INFORMATIONS DESTINÉES A L UTILISATEUR. Firazyr 30 mg solution injectable en seringue pré-remplie Icatibant
 B. NOTICE 1 NOTICE : INFORMATIONS DESTINÉES A L UTILISATEUR Firazyr 30 mg solution injectable en seringue pré-remplie Icatibant Veuillez lire attentivement l intégralité de cette notice avant d utiliser
B. NOTICE 1 NOTICE : INFORMATIONS DESTINÉES A L UTILISATEUR Firazyr 30 mg solution injectable en seringue pré-remplie Icatibant Veuillez lire attentivement l intégralité de cette notice avant d utiliser
PIL Décembre 2009. Autres composants: acide tartrique, macrogol 4000, macrogol 1000, macrogol 400, butylhydroxyanisol.
 Notice publique MOTILIUM Veuillez lire attentivement l intégralité de cette notice avant d utiliser ce médicament. Gardez cette notice, vous pourriez avoir besoin de la relire. Si vous avez d autres questions,
Notice publique MOTILIUM Veuillez lire attentivement l intégralité de cette notice avant d utiliser ce médicament. Gardez cette notice, vous pourriez avoir besoin de la relire. Si vous avez d autres questions,
ANNEXE IIIB NOTICE : INFORMATION DE L UTILISATEUR
 Dénomination du médicament ANNEXE IIIB NOTICE : INFORMATION DE L UTILISATEUR LYSOPAÏNE MAUX DE GORGE AMBROXOL CITRON 20 mg SANS SUCRE, pastille édulcorée au sorbitol et au sucralose. Chlorhydrate d ambroxol
Dénomination du médicament ANNEXE IIIB NOTICE : INFORMATION DE L UTILISATEUR LYSOPAÏNE MAUX DE GORGE AMBROXOL CITRON 20 mg SANS SUCRE, pastille édulcorée au sorbitol et au sucralose. Chlorhydrate d ambroxol
vaccin pneumococcique polyosidique conjugué (13-valent, adsorbé)
 EMA/90006/2015 EMEA/H/C/001104 Résumé EPAR à l intention du public vaccin pneumococcique polyosidique conjugué (13-valent, adsorbé) Le présent document est un résumé du rapport européen public d évaluation
EMA/90006/2015 EMEA/H/C/001104 Résumé EPAR à l intention du public vaccin pneumococcique polyosidique conjugué (13-valent, adsorbé) Le présent document est un résumé du rapport européen public d évaluation
NOTICE: INFORMATION DE L UTILISATEUR. Immukine 100 microgrammes/0,5 ml solution injectable (Interféron gamma-1b recombinant humain)
 NOTICE: INFORMATION DE L UTILISATEUR Immukine 100 microgrammes/0,5 ml solution injectable (Interféron gamma-1b recombinant humain) Veuillez lire attentivement l'intégralité de cette notice avant d'utiliser
NOTICE: INFORMATION DE L UTILISATEUR Immukine 100 microgrammes/0,5 ml solution injectable (Interféron gamma-1b recombinant humain) Veuillez lire attentivement l'intégralité de cette notice avant d'utiliser
NOTICE : INFORMATION DE L UTILISATEUR. Bisolax 5 mg comprimés enrobés Bisacodyl
 NOTICE : INFORMATION DE L UTILISATEUR Bisolax 5 mg comprimés enrobés Bisacodyl Veuillez lire attentivement cette notice avant d utiliser ce médicament. Elle contient des informations importante s pour
NOTICE : INFORMATION DE L UTILISATEUR Bisolax 5 mg comprimés enrobés Bisacodyl Veuillez lire attentivement cette notice avant d utiliser ce médicament. Elle contient des informations importante s pour
FIPROTEC, PIPETTES CONTRE PUCES ET TIQUES :
 FIPROTEC, PIPETTES CONTRE PUCES ET TIQUES : FIPROTEC 50 MG SOLUTION SPOT-ON POUR CHAT Composition :Une pipette de 0,50 ml contient 50 mg de Fipronil. Indications d utilisation : Chez les chats : - Traitement
FIPROTEC, PIPETTES CONTRE PUCES ET TIQUES : FIPROTEC 50 MG SOLUTION SPOT-ON POUR CHAT Composition :Une pipette de 0,50 ml contient 50 mg de Fipronil. Indications d utilisation : Chez les chats : - Traitement
Livret des nouveaux anticoagulants oraux. Ce qu il faut savoir pour bien gérer leur utilisation
 Livret des nouveaux anticoagulants oraux Ce qu il faut savoir pour bien gérer leur utilisation DONNÉES DU PATIENT Nom Adresse Tél MÉDECIN TRAITANT Nom Adresse Tél SPÉCIALISTE Nom Hôpital Tél MÉDICAMENT
Livret des nouveaux anticoagulants oraux Ce qu il faut savoir pour bien gérer leur utilisation DONNÉES DU PATIENT Nom Adresse Tél MÉDECIN TRAITANT Nom Adresse Tél SPÉCIALISTE Nom Hôpital Tél MÉDICAMENT
KARDEGIC 75 mg, poudre pour solution buvable en sachet-dose Acétylsalicylate de DL-Lysine
 KARDEGIC 75 mg, poudre pour solution buvable en sachet-dose Acétylsalicylate de DL-Lysine Veuillez lire attentivement cette notice avant d'utiliser ce médicament. Elle contient des informations importantes
KARDEGIC 75 mg, poudre pour solution buvable en sachet-dose Acétylsalicylate de DL-Lysine Veuillez lire attentivement cette notice avant d'utiliser ce médicament. Elle contient des informations importantes
313-40013-B MIS À JOUR EN MARS 2013
 313-40013-B MIS À JOUR EN MARS 2013 SOMMAIRE 1 - La vaccination, comment ça marche? 3, 4 et 5 2 - Les vaccins détériorent-ils LA protection naturelle contre les maladies? 6 3 - Avec autant de vaccins,
313-40013-B MIS À JOUR EN MARS 2013 SOMMAIRE 1 - La vaccination, comment ça marche? 3, 4 et 5 2 - Les vaccins détériorent-ils LA protection naturelle contre les maladies? 6 3 - Avec autant de vaccins,
Stelara (ustekinumab)
 Les autorités de santé de l Union européenne ont assorti la mise sur le marché du médicament Stelara de certaines conditions. Le plan obligatoire de minimisation des risques en Belgique, dont cette information
Les autorités de santé de l Union européenne ont assorti la mise sur le marché du médicament Stelara de certaines conditions. Le plan obligatoire de minimisation des risques en Belgique, dont cette information
1. Identification de la substance ou préparation et de la Société. 2. Composition/ informations sur les composants
 Date d impression : 23/08/02 Valable à partir du : 08.08.01 Page: 1/7 1. Identification de la substance ou préparation et de la Société Données relatives au produit : Nom commercial : KNAUF ZADUR Mortier
Date d impression : 23/08/02 Valable à partir du : 08.08.01 Page: 1/7 1. Identification de la substance ou préparation et de la Société Données relatives au produit : Nom commercial : KNAUF ZADUR Mortier
Atrovent HFA 20 mcg/bouffée solution pour inhalation en flacon pressurisé (bromure d'ipratropium)
 NOTICE ATROVENT HFA 20 MCG/BOUFFEE SOLUTION POUR INHALATION EN FLACON PRESSURISE (BPI n 0250-03 du 27.07.2005) Veuillez lire attentivement l'intégralité de cette notice avant d'utiliser ce médicament.
NOTICE ATROVENT HFA 20 MCG/BOUFFEE SOLUTION POUR INHALATION EN FLACON PRESSURISE (BPI n 0250-03 du 27.07.2005) Veuillez lire attentivement l'intégralité de cette notice avant d'utiliser ce médicament.
Protéger. son animal. la gamme FRONTLINE. grâce à la gamme. Contre les puces et les tiques. Efficace plusieurs semaines (1) Résistant à la pluie,
 la gamme Frontline Contre les puces et les tiques Efficace plusieurs semaines (1) Résistant à la pluie, aux bains et aux shampooings (2) Protéger son animal grâce à la gamme FRONTLINE La gamme FRONTLINE
la gamme Frontline Contre les puces et les tiques Efficace plusieurs semaines (1) Résistant à la pluie, aux bains et aux shampooings (2) Protéger son animal grâce à la gamme FRONTLINE La gamme FRONTLINE
COMMISSION DE LA TRANSPARENCE AVIS. 18 janvier 2006
 COMMISSION DE LA TRANSPARENCE AVIS 18 janvier 2006 ADVATE 1500 UI, poudre et solvant pour solution injectable 1 flacon(s) en verre de 1 500 UI - 1 flacon(s) en verre de 5 ml avec matériel(s) de perfusion(s)
COMMISSION DE LA TRANSPARENCE AVIS 18 janvier 2006 ADVATE 1500 UI, poudre et solvant pour solution injectable 1 flacon(s) en verre de 1 500 UI - 1 flacon(s) en verre de 5 ml avec matériel(s) de perfusion(s)
ANNEXE I RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
 ANNEXE I RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT 1 1. DÉNOMINATION DU MÉDICAMENT VÉTÉRINAIRE Equip WNV - émulsion injectable pour chevaux 2. COMPOSITION QUALITATIVE ET QUANTITATIVE Chaque dose de 1 ml contient:
ANNEXE I RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT 1 1. DÉNOMINATION DU MÉDICAMENT VÉTÉRINAIRE Equip WNV - émulsion injectable pour chevaux 2. COMPOSITION QUALITATIVE ET QUANTITATIVE Chaque dose de 1 ml contient:
Observation. Merci à l équipe de pharmaciens FormUtip iatro pour ce cas
 Cas clinique M. ZAC Observation Mr ZAC ans, 76 ans, 52 kg, est admis aux urgences pour des algies fessières invalidantes, résistantes au AINS. Ses principaux antécédents sont les suivants : une thrombopénie
Cas clinique M. ZAC Observation Mr ZAC ans, 76 ans, 52 kg, est admis aux urgences pour des algies fessières invalidantes, résistantes au AINS. Ses principaux antécédents sont les suivants : une thrombopénie
FICHE DE DONNEE SECURITE
 Degy Anti-fourmis 28/03/12 page1/6 FICHE DE DONNEE SECURITE 1. IDENTIFICATION DE LA SUBSTANCE/PREPARATION ET DU FOURNISSEUR Désignation commerciale: DEGY ANTI-FOURMIS Utilisation de la préparation : Produit
Degy Anti-fourmis 28/03/12 page1/6 FICHE DE DONNEE SECURITE 1. IDENTIFICATION DE LA SUBSTANCE/PREPARATION ET DU FOURNISSEUR Désignation commerciale: DEGY ANTI-FOURMIS Utilisation de la préparation : Produit
Contenu de la formation PSE1et PSE2 (Horaires à titre indicatif)
 Contenu de la formation PSE1et PSE2 (Horaires à titre indicatif) Contenu de la formation PSE1 LE SECOURISTE : 1 h 30 Indiquer le rôle et les responsabilités d un secouriste. Indiquer les connaissances
Contenu de la formation PSE1et PSE2 (Horaires à titre indicatif) Contenu de la formation PSE1 LE SECOURISTE : 1 h 30 Indiquer le rôle et les responsabilités d un secouriste. Indiquer les connaissances
Acides et bases. Acides et bases Page 1 sur 6
 Acides et bases Acides et bases Page 1 sur 6 Introduction Sont réputés acides et bases au sens des règles de sécurité en vigueur en Suisse, les solides ou liquides qui ont une réaction acide ou alcaline
Acides et bases Acides et bases Page 1 sur 6 Introduction Sont réputés acides et bases au sens des règles de sécurité en vigueur en Suisse, les solides ou liquides qui ont une réaction acide ou alcaline
Traitements topiques. Utiliser conformément aux instructions figurant sur l emballage. Aident à éliminer les squames. Soulagent les démangeaisons.
 SANS ORDONNANCE Solutions pour le bain et la douche : Huiles Farine d avoine Sels d Epsom Sels de al Mer Morte Utiliser conformément aux instructions figurant sur l emballage. Aident à éliminer les squames.
SANS ORDONNANCE Solutions pour le bain et la douche : Huiles Farine d avoine Sels d Epsom Sels de al Mer Morte Utiliser conformément aux instructions figurant sur l emballage. Aident à éliminer les squames.
Notice publique PERDOLAN - PÉDIATRIE
 Notice publique PERDOLAN - PÉDIATRIE Lisez attentivement cette notice jusqu'à la fin car elle contient des informations importantes pour vous. Ce médicament est délivré sans ordonnance. Néanmoins, vous
Notice publique PERDOLAN - PÉDIATRIE Lisez attentivement cette notice jusqu'à la fin car elle contient des informations importantes pour vous. Ce médicament est délivré sans ordonnance. Néanmoins, vous
A-ESSE s.p.a. FICHE DE SÉCURITÉ
 A-ESSE s.p.a. USINE OXYDES de ZINC FICHE DE SÉCURITÉ Oxyde de zinc 1. IDENTIFICATION DU PRODUIT CHIMIQUE ET DE LA SOCIÉTÉ NOM DU PRODUIT: DÉNOMINATION COMMUNE, COMMERCIALE ET SYNONYMES: UTILISATION DE
A-ESSE s.p.a. USINE OXYDES de ZINC FICHE DE SÉCURITÉ Oxyde de zinc 1. IDENTIFICATION DU PRODUIT CHIMIQUE ET DE LA SOCIÉTÉ NOM DU PRODUIT: DÉNOMINATION COMMUNE, COMMERCIALE ET SYNONYMES: UTILISATION DE
FICHE DE DONNÉES DE SÉCURITÉ conformément au Règlement (CE) nº1907/2006 REACH Nom : KR-G KR-G
 KR-G Page 1 de 5 1. IDENTIFICATION DE LA SUBSTANCE/PRÉPARATION ET DE LA SOCIÉTÉ/ENTREPRISE 1.1 Identificateur de produit : Nom du produit : KR-G 1.2 Utilisations identifiées pertinentes de la substance
KR-G Page 1 de 5 1. IDENTIFICATION DE LA SUBSTANCE/PRÉPARATION ET DE LA SOCIÉTÉ/ENTREPRISE 1.1 Identificateur de produit : Nom du produit : KR-G 1.2 Utilisations identifiées pertinentes de la substance
RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT. Bisolax 5 mg comprimés enrobés contient 5 mg de bisacodyl par comprimé enrobé.
 RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT 1. Dé nomination du mé dicame nt Bisolax 5 mg comprimés enrobés. 2. Composition qualitative e t quantitative Bisolax 5 mg comprimés enrobés contient 5 mg de bisacodyl
RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT 1. Dé nomination du mé dicame nt Bisolax 5 mg comprimés enrobés. 2. Composition qualitative e t quantitative Bisolax 5 mg comprimés enrobés contient 5 mg de bisacodyl
BDL2, BDL3 Enviro Liner Part A. Dominion Sure Seal FICHE SIGNALÉTIQUE. % (p/p) Numéro CAS. TLV de l' ACGIH 28182-81-2 70-100 Non disponible
 FICHE SIGNALÉTIQUE 1. PRODUIT CHIMIQUE ET IDENTIFICATION DE L'ENTREPRISE Adresse du fournisseur/distributeur : Dominion Sure Seal Group of Companies 6175, chemin Danville, Mississauga (Ontario) Canada,
FICHE SIGNALÉTIQUE 1. PRODUIT CHIMIQUE ET IDENTIFICATION DE L'ENTREPRISE Adresse du fournisseur/distributeur : Dominion Sure Seal Group of Companies 6175, chemin Danville, Mississauga (Ontario) Canada,
Humira Solution pour injection dans un injecteur prérempli
 Humira Solution pour injection dans un injecteur prérempli ABBOTT OEMéd Qu est-ce que Humira et quand doit-il être utilisé? Humira est un médicament qui limite le processus inflammatoire dans le cadre
Humira Solution pour injection dans un injecteur prérempli ABBOTT OEMéd Qu est-ce que Humira et quand doit-il être utilisé? Humira est un médicament qui limite le processus inflammatoire dans le cadre
Bijsluiter FR versie Collier Propoxur Halsband B. NOTICE 1/5
 B. NOTICE 1/5 NOTICE COLLIER PROPOXUR HALSBAND pour chiens de petite taille et chats COLLIER PROPOXUR HALSBAND pour chiens de grande et moyenne taille 1. NOM ET ADRESSE DU TITULAIRE DE L AUTORISATION DE
B. NOTICE 1/5 NOTICE COLLIER PROPOXUR HALSBAND pour chiens de petite taille et chats COLLIER PROPOXUR HALSBAND pour chiens de grande et moyenne taille 1. NOM ET ADRESSE DU TITULAIRE DE L AUTORISATION DE
MINISTERE DE LA SANTE ET DES SOLIDARITES DIRECTION GENERALE DE LA SANTE- DDASS DE SEINE MARITIME
 Département des situations d urgence sanitaire Personne chargée du dossier : Evelyne FALIP/Nicole BOHIC Tél : 01 40 56 59 65/02 32 18 31 66 evelyne.falip@sante.gouv.fr MINISTERE DE LA SANTE ET DES SOLIDARITES
Département des situations d urgence sanitaire Personne chargée du dossier : Evelyne FALIP/Nicole BOHIC Tél : 01 40 56 59 65/02 32 18 31 66 evelyne.falip@sante.gouv.fr MINISTERE DE LA SANTE ET DES SOLIDARITES
L ACCÈS VEINEUX DE COURTE DURÉE CHEZ L ENFANT ET LE NOUVEAU-NÉ
 L ACCÈS VEINEUX DE COURTE DURÉE CHEZ L ENFANT ET LE NOUVEAU-NÉ Plan de la présentation Introduction L enfant Le cathéter court La voie veineuse centrale La voie intra-osseuse Plan de la présentation Le
L ACCÈS VEINEUX DE COURTE DURÉE CHEZ L ENFANT ET LE NOUVEAU-NÉ Plan de la présentation Introduction L enfant Le cathéter court La voie veineuse centrale La voie intra-osseuse Plan de la présentation Le
LIGNES DIRECTRICES CLINIQUES TOUT AU LONG DU CONTINUUM DE SOINS : Objectif de ce chapitre. 6.1 Introduction 86
 LIGNES DIRECTRICES CLINIQUES TOUT AU LONG DU CONTINUUM DE SOINS : ÉTABLISSEMENT DE LIENS ENTRE LES PERSONNES CHEZ QUI UN DIAGNOSTIC D INFECTION À VIH A ÉTÉ POSÉ ET LES SERVICES DE SOINS ET DE TRAITEMENT
LIGNES DIRECTRICES CLINIQUES TOUT AU LONG DU CONTINUUM DE SOINS : ÉTABLISSEMENT DE LIENS ENTRE LES PERSONNES CHEZ QUI UN DIAGNOSTIC D INFECTION À VIH A ÉTÉ POSÉ ET LES SERVICES DE SOINS ET DE TRAITEMENT
Questionnaire Médical
 Nom et prénom(s) de l élève: Date de naissance: Questionnaire Médical Ce formulaire est à compléter, avant de commencer l année scolaire, pour les nouveaux élèves ainsi que pour les élèves poursuivant
Nom et prénom(s) de l élève: Date de naissance: Questionnaire Médical Ce formulaire est à compléter, avant de commencer l année scolaire, pour les nouveaux élèves ainsi que pour les élèves poursuivant
Vulcano Pièges Fourmis
 FDS Conforme au règlement 1907/2006/CE et 1272/2008/CE 16-12-10- Page 1/5 FICHES DE DONNEES DE SECURITE 1. IDENTIFICATION DU PRODUIT ET DE LA SOCIETE Produit : Utilisation : Fournisseur : Vulcano Pièges
FDS Conforme au règlement 1907/2006/CE et 1272/2008/CE 16-12-10- Page 1/5 FICHES DE DONNEES DE SECURITE 1. IDENTIFICATION DU PRODUIT ET DE LA SOCIETE Produit : Utilisation : Fournisseur : Vulcano Pièges
Situation Agent Schéma posologique*
 Le besoin d une antibioprophylaxie pour la prévention d une endocardite infectieuse et d une infection hématogène à la suite d une arthroplastie doit être envisagé sur une base individuelle et en collaboration
Le besoin d une antibioprophylaxie pour la prévention d une endocardite infectieuse et d une infection hématogène à la suite d une arthroplastie doit être envisagé sur une base individuelle et en collaboration
NOTICE: INFORMATION DE L UTILISATEUR. Bisolax 5 mg comprimés enrobés. Bisacodyl
 NOTICE: INFORMATION DE L UTILISATEUR Bisolax 5 mg comprimés enrobés Bisacodyl Veuillez lire attentivement cette notice avant d utiliser ce médicament car elle contient des informations importantes pour
NOTICE: INFORMATION DE L UTILISATEUR Bisolax 5 mg comprimés enrobés Bisacodyl Veuillez lire attentivement cette notice avant d utiliser ce médicament car elle contient des informations importantes pour
BRICOLAGE. Les précautions à prendre
 BRICOLAGE Les précautions à prendre Chaque année, près de 300 000 personnes arrivent aux Urgences à la suite d un accident de bricolage et/ou de jardinage. Respecter quelques règles simples de prévention
BRICOLAGE Les précautions à prendre Chaque année, près de 300 000 personnes arrivent aux Urgences à la suite d un accident de bricolage et/ou de jardinage. Respecter quelques règles simples de prévention
NOTICE: INFORMATION DE L UTILISATEUR. Dulcolax bisacodyl 5 mg comprimés enrobés (bisacodyl)
 NOTICE: INFORMATION DE L UTILISATEUR Dulcolax bisacodyl 5 mg comprimés enrobés (bisacodyl) Veuillez lire attentivement cette notice avant de prendre ce médicament. Elle contient des informations importantes
NOTICE: INFORMATION DE L UTILISATEUR Dulcolax bisacodyl 5 mg comprimés enrobés (bisacodyl) Veuillez lire attentivement cette notice avant de prendre ce médicament. Elle contient des informations importantes
Infection par le VIH/sida et travail
 Documents publiés dans la collection VIH-sida du ministère de la Santé et de la Protection sociale : COLLECTION VIH/SIDA Sida-MST (maladies sexuellement transmissibles) Transmission - Diagnostic/dépistage
Documents publiés dans la collection VIH-sida du ministère de la Santé et de la Protection sociale : COLLECTION VIH/SIDA Sida-MST (maladies sexuellement transmissibles) Transmission - Diagnostic/dépistage
direct Pansement électronique pour le traitement antidouleurs de blocages douloureux sans médicaments MODE D EMPLOI
 direct Pansement électronique pour le traitement antidouleurs de blocages douloureux sans médicaments MODE D EMPLOI Table des matières Table des matières Contre-indications, avertissements, mesures de
direct Pansement électronique pour le traitement antidouleurs de blocages douloureux sans médicaments MODE D EMPLOI Table des matières Table des matières Contre-indications, avertissements, mesures de
1 La scintigraphie myocardique au Persantin ou Mibi Persantin
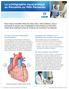 La scintigraphie myocardique au Persantin ou Mibi Persantin Pour mieux connaître l état de votre cœur, votre médecin vous a demandé de passer une scintigraphie myocardique au Persantin. Cette fiche explique
La scintigraphie myocardique au Persantin ou Mibi Persantin Pour mieux connaître l état de votre cœur, votre médecin vous a demandé de passer une scintigraphie myocardique au Persantin. Cette fiche explique
Un test Pap pourrait vous sauver la vie
 Un test Pap pourrait vous sauver la vie Un test Pap pourrait vous sauver la vie Vous avez 21 ans ou plus et êtes sexuellement active? Passez un test Pap! Si vous saviez qu un test Pap, qui prend 5 minutes,
Un test Pap pourrait vous sauver la vie Un test Pap pourrait vous sauver la vie Vous avez 21 ans ou plus et êtes sexuellement active? Passez un test Pap! Si vous saviez qu un test Pap, qui prend 5 minutes,
Carnet de suivi Lithium
 Carnet de suivi Lithium Brochure d information sur les troubles bipolaires et leur traitement par lithium Nom : Ce carnet est important Si vous le trouvez, merci de le faire parvenir à l adresse cidessous
Carnet de suivi Lithium Brochure d information sur les troubles bipolaires et leur traitement par lithium Nom : Ce carnet est important Si vous le trouvez, merci de le faire parvenir à l adresse cidessous
Le VIH et votre foie
 Le VIH et votre foie Le VIH et votre foie Que dois-je savoir au sujet de mon foie? Votre foie joue un rôle incroyablement important. Il filtre votre sang en éliminant les substances nocives (toxiques)
Le VIH et votre foie Le VIH et votre foie Que dois-je savoir au sujet de mon foie? Votre foie joue un rôle incroyablement important. Il filtre votre sang en éliminant les substances nocives (toxiques)
Fiche de données de sécurité
 Produit 2T QUAD R BIODEGRADABLE Page 1/5 Etiquette du produit ETIQUETAGE (d usage ou CE) Phrases de risque Conseils de prudence ETIQUETAGE TRANSPORT Non concerné Néant Néant Non concerné 1. IDENTIFICATION
Produit 2T QUAD R BIODEGRADABLE Page 1/5 Etiquette du produit ETIQUETAGE (d usage ou CE) Phrases de risque Conseils de prudence ETIQUETAGE TRANSPORT Non concerné Néant Néant Non concerné 1. IDENTIFICATION
GONADOTROPHINE CHORIONIQUE ENDO 5000 U.I./1 ml, lyophilisat et solution pour usage parentéral intramusculaire
 ésumé des Caractéristiques du Produit 1 sur 5 21/09/2010 14:31 Mis à jour : 16/02/2010 1. DENOMINATION DU MEDICAMENT GONADOTROPHINE CHORIONIQUE ENDO 5000 U.I./1 ml, lyophilisat et solution pour usage parentéral
ésumé des Caractéristiques du Produit 1 sur 5 21/09/2010 14:31 Mis à jour : 16/02/2010 1. DENOMINATION DU MEDICAMENT GONADOTROPHINE CHORIONIQUE ENDO 5000 U.I./1 ml, lyophilisat et solution pour usage parentéral
ANNEXES AU REGLEMENT N 06/2010/CM/UEMOA
 UNION ECONOMIQUE ET MONETAIRE OUEST AFRICAINE ------------------------- La Commission ANNEXES AU REGLEMENT N 06/2010/CM/UEMOA LES ANNEXES AU REGLEMENT RELATIF AUX PROCEDURES D HOMOLOGATION DES PRODUITS
UNION ECONOMIQUE ET MONETAIRE OUEST AFRICAINE ------------------------- La Commission ANNEXES AU REGLEMENT N 06/2010/CM/UEMOA LES ANNEXES AU REGLEMENT RELATIF AUX PROCEDURES D HOMOLOGATION DES PRODUITS
Le traitement du paludisme d importation de l enfant est une urgence
 Le traitement du paludisme d importation de l enfant est une urgence Dominique GENDREL Necker-Enfants Malades Traiter en urgence en présence de trophozoïtes Plus de 80% des paludismes d importation en
Le traitement du paludisme d importation de l enfant est une urgence Dominique GENDREL Necker-Enfants Malades Traiter en urgence en présence de trophozoïtes Plus de 80% des paludismes d importation en
Fiche de données de sécurité Selon l Ochim (ordonn. produits chim.) du18.05.2005, paragr.3
 Nr. Article- Produit : 48785 Page: Page 1 En cas d urgence appeler le Centre Suisse d information toxicologique, Freiestr. 16, 8032 Zürich; Tél. des Urgences: ( jour et nuit) 145 ou +41 (0)44 251 51 51.
Nr. Article- Produit : 48785 Page: Page 1 En cas d urgence appeler le Centre Suisse d information toxicologique, Freiestr. 16, 8032 Zürich; Tél. des Urgences: ( jour et nuit) 145 ou +41 (0)44 251 51 51.
NOTICE : INFORMATIONS DU PATIENT. Keforal 500 mg comprimés pelliculés. Céfalexine monohydratée
 NOTICE : INFORMATIONS DU PATIENT Keforal 500 mg comprimés pelliculés Céfalexine monohydratée Veuillez lire attentivement cette notice avant de prendre ce médicament car elle contient des informations importantes
NOTICE : INFORMATIONS DU PATIENT Keforal 500 mg comprimés pelliculés Céfalexine monohydratée Veuillez lire attentivement cette notice avant de prendre ce médicament car elle contient des informations importantes
FICHE DE SECURITE FUMESAAT 500 SC
 1/5 FICHE DE SECURITE FUMESAAT 500 SC Identification de la préparation 1. Identification de la préparation de l entreprise Nom commercial: FUMESAAT 500 SC Identification Produit : éthofumésate 500 SC Substance
1/5 FICHE DE SECURITE FUMESAAT 500 SC Identification de la préparation 1. Identification de la préparation de l entreprise Nom commercial: FUMESAAT 500 SC Identification Produit : éthofumésate 500 SC Substance
1 ère manche Questions fermées
 Quiz VIH 2011 1 ère manche Questions fermées Crips Ile-de-France / Mise à jour : août 2015 Thème : Dépistage Un test VIH négatif indique toujours que la personne qui a fait le test n est pas contaminée
Quiz VIH 2011 1 ère manche Questions fermées Crips Ile-de-France / Mise à jour : août 2015 Thème : Dépistage Un test VIH négatif indique toujours que la personne qui a fait le test n est pas contaminée
NOTICE : INFORMATION DE L UTILISATEUR. Sumatriptan Sandoz 50 mg comprimés Sumatriptan Sandoz 100 mg comprimés. sumatriptan
 NOTICE : INFORMATION DE L UTILISATEUR Sumatriptan Sandoz 50 mg comprimés Sumatriptan Sandoz 100 mg comprimés sumatriptan Veuillez lire attentivement cette notice avant de prendre ce médicament. - Gardez
NOTICE : INFORMATION DE L UTILISATEUR Sumatriptan Sandoz 50 mg comprimés Sumatriptan Sandoz 100 mg comprimés sumatriptan Veuillez lire attentivement cette notice avant de prendre ce médicament. - Gardez
Unité d enseignement 4 : Perception/système nerveux/revêtement cutané
 Énoncés Unité d enseignement 4 : Perception/système nerveux/revêtement cutané N 109 Dermatoses faciales : acné, rosacée, dermatite séborrhéique Diagnostiquer l acné, la rosacée, la dermatite séborrhéique.
Énoncés Unité d enseignement 4 : Perception/système nerveux/revêtement cutané N 109 Dermatoses faciales : acné, rosacée, dermatite séborrhéique Diagnostiquer l acné, la rosacée, la dermatite séborrhéique.
La vaccination, une bonne protection
 Vaccin contre l hépatite A et l hépatite B La personne qui reçoit ce vaccin se protège contre l hépatite A, l hépatite B et leurs complications. L hépatite A et l hépatite B sont des infections du foie
Vaccin contre l hépatite A et l hépatite B La personne qui reçoit ce vaccin se protège contre l hépatite A, l hépatite B et leurs complications. L hépatite A et l hépatite B sont des infections du foie
Contact cutané. Contact avec les yeux. Inhalation. Ingestion.
 FICHE SIGNALÉTIQUE 995-01 Canutec 1-613-996-6666 (24 heures) 1. PRODUIT CHIMIQUE ET FOURNISSEUR Identification du produit : 995-01 Nom du produit : Graisse montage pneu Famille chimique : Mélange Fournisseur/Fabricant
FICHE SIGNALÉTIQUE 995-01 Canutec 1-613-996-6666 (24 heures) 1. PRODUIT CHIMIQUE ET FOURNISSEUR Identification du produit : 995-01 Nom du produit : Graisse montage pneu Famille chimique : Mélange Fournisseur/Fabricant
HUMI-BLOCK - TOUPRET
 FICHE DE DONNEES DE SECURITE Révision antérieure : (Selon l annexe II du Règlement REACH de l UE 1907/2006) Mise à jour : 19 janvier 2010 Version : 1 HUMI-BLOCK - TOUPRET 1-IDENTIFICATION DU PRODUIT ET
FICHE DE DONNEES DE SECURITE Révision antérieure : (Selon l annexe II du Règlement REACH de l UE 1907/2006) Mise à jour : 19 janvier 2010 Version : 1 HUMI-BLOCK - TOUPRET 1-IDENTIFICATION DU PRODUIT ET
FICHE DE DONNEES DE SECURITE
 PAGE 1/7 DATE DE MISE A JOUR : 16/11/2011 1/ - IDENTIFICATION DU PRODUIT ET DE LA SOCIETE Identification du produit : Gaines, films, housses, et/ou sacs transparents et colorés en polyéthylène. Famille
PAGE 1/7 DATE DE MISE A JOUR : 16/11/2011 1/ - IDENTIFICATION DU PRODUIT ET DE LA SOCIETE Identification du produit : Gaines, films, housses, et/ou sacs transparents et colorés en polyéthylène. Famille
7- Les Antiépileptiques
 7- Les Antiépileptiques 1 Définition L épilepsie est un trouble neurologique chronique caractérisé par la survenue périodique et imprévisible de crises convulsives dues à l émission de décharges électriques
7- Les Antiépileptiques 1 Définition L épilepsie est un trouble neurologique chronique caractérisé par la survenue périodique et imprévisible de crises convulsives dues à l émission de décharges électriques
Point d Information. Le PRAC a recommandé que le RCP soit modifié afin d inclure les informations suivantes:
 Point d Information Médicaments à base d ivabradine, de codéine, médicaments contenant du diméthyl fumarate, du mycophénolate mofétil/acide mycophénolique, de l octocog alpha, spécialité Eligard (contenant
Point d Information Médicaments à base d ivabradine, de codéine, médicaments contenant du diméthyl fumarate, du mycophénolate mofétil/acide mycophénolique, de l octocog alpha, spécialité Eligard (contenant
FICHE DE DONNÉES DE SECURITÉ Demand CS
 01. IDENTIFICATION DU PRODUIT ET DE LA SOCIÉTÉ Nom commercial Code produit Usage envisagé LAMB97201 A UTILISER COMME INSECTICIDE UNIQUEMENT Le produit doit être utilisé conformément à l'étiquette Apparence
01. IDENTIFICATION DU PRODUIT ET DE LA SOCIÉTÉ Nom commercial Code produit Usage envisagé LAMB97201 A UTILISER COMME INSECTICIDE UNIQUEMENT Le produit doit être utilisé conformément à l'étiquette Apparence
NOTICE : INFORMATION DE L UTILISATEUR. Flunarizine
 NOTICE : INFORMATION DE L UTILISATEUR SIBELIUM 10 mg, comprimé sécable Flunarizine Veuillez lire attentivement l'intégralité de cette notice avant de prendre ce médicament. Gardez cette notice, vous pourriez
NOTICE : INFORMATION DE L UTILISATEUR SIBELIUM 10 mg, comprimé sécable Flunarizine Veuillez lire attentivement l'intégralité de cette notice avant de prendre ce médicament. Gardez cette notice, vous pourriez
QU EST-CE QUE LA PROPHYLAXIE?
 QU EST-CE QUE LA PROPHYLAXIE? TABLES DES MATIÈRES Publié par la Fédération mondiale de l hémophilie (FMH) Fédération mondiale de l hémophilie, 2014 La FMH encourage la traduction et la redistribution de
QU EST-CE QUE LA PROPHYLAXIE? TABLES DES MATIÈRES Publié par la Fédération mondiale de l hémophilie (FMH) Fédération mondiale de l hémophilie, 2014 La FMH encourage la traduction et la redistribution de
Bien vous soigner. avec des médicaments disponibles sans ordonnance. juin 2008. Douleur. de l adulte
 Bien vous soigner avec des médicaments disponibles sans ordonnance juin 2008 Douleur de l adulte Douleur de l adulte Ce qu il faut savoir La douleur est une expérience sensorielle et émotionnelle désagréable,
Bien vous soigner avec des médicaments disponibles sans ordonnance juin 2008 Douleur de l adulte Douleur de l adulte Ce qu il faut savoir La douleur est une expérience sensorielle et émotionnelle désagréable,
COMMISSION DE LA TRANSPARENCE AVIS. 10 mai 2006
 COMMISSION DE LA TRANSPARENCE AVIS 10 mai 2006 METOJECT 10 mg/ml, solution injectable en seringue pré-remplie 1 seringue pré-remplie en verre de 0,75 ml avec aiguille : 371 754-3 1 seringue pré- remplie
COMMISSION DE LA TRANSPARENCE AVIS 10 mai 2006 METOJECT 10 mg/ml, solution injectable en seringue pré-remplie 1 seringue pré-remplie en verre de 0,75 ml avec aiguille : 371 754-3 1 seringue pré- remplie
CE QU IL FAUT SAVOIR PARTICIPATION À UN ESSAI CLINIQUE SUR UN MÉDICAMENT
 CE QU IL FAUT SAVOIR PARTICIPATION À UN ESSAI CLINIQUE SUR UN MÉDICAMENT Sommaire Comment se fait la recherche sur un nouveau médicament? (page 1) A quoi sert la recherche sur un nouveau médicament? (page
CE QU IL FAUT SAVOIR PARTICIPATION À UN ESSAI CLINIQUE SUR UN MÉDICAMENT Sommaire Comment se fait la recherche sur un nouveau médicament? (page 1) A quoi sert la recherche sur un nouveau médicament? (page
COMMISSION DE LA TRANSPARENCE AVIS DE LA COMMISSION. 10 octobre 2001
 COMMISSION DE LA TRANSPARENCE AVIS DE LA COMMISSION 10 octobre 2001 VIRAFERONPEG 50 µg 80 µg 100 µg 120 µg 150 µg, poudre et solvant pour solution injectable B/1 B/4 Laboratoires SCHERING PLOUGH Peginterféron
COMMISSION DE LA TRANSPARENCE AVIS DE LA COMMISSION 10 octobre 2001 VIRAFERONPEG 50 µg 80 µg 100 µg 120 µg 150 µg, poudre et solvant pour solution injectable B/1 B/4 Laboratoires SCHERING PLOUGH Peginterféron
Algorithme d utilisation des anti-inflammatoires non stéroïdiens (AINS)
 Algorithme d utilisation des anti-inflammatoires non stéroïdiens (AINS) Édition Conseil du médicament www.cdm.gouv.qc.ca Coordination Anne Fortin, pharmacienne Élaboration Conseil du médicament Fédération
Algorithme d utilisation des anti-inflammatoires non stéroïdiens (AINS) Édition Conseil du médicament www.cdm.gouv.qc.ca Coordination Anne Fortin, pharmacienne Élaboration Conseil du médicament Fédération
La lutte contre la tuberculose est régie par l arrêté royal du 17 octobre 2002.
 Le diagnostic de la tuberculose bovine La lutte contre la tuberculose est régie par l arrêté royal du 17 octobre 2002. 1. Tuberculination Dans la première phase d une infection de tuberculose bovine (Mycobacterium
Le diagnostic de la tuberculose bovine La lutte contre la tuberculose est régie par l arrêté royal du 17 octobre 2002. 1. Tuberculination Dans la première phase d une infection de tuberculose bovine (Mycobacterium
Leucémies de l enfant et de l adolescent
 Janvier 2014 Fiche tumeur Prise en charge des adolescents et jeunes adultes Leucémies de l enfant et de l adolescent GENERALITES COMMENT DIAGNOSTIQUE-T-ON UNE LEUCEMIE AIGUË? COMMENT TRAITE-T-ON UNE LEUCEMIE
Janvier 2014 Fiche tumeur Prise en charge des adolescents et jeunes adultes Leucémies de l enfant et de l adolescent GENERALITES COMMENT DIAGNOSTIQUE-T-ON UNE LEUCEMIE AIGUË? COMMENT TRAITE-T-ON UNE LEUCEMIE
RAID PIEGES ANTI-FOURMIS x 2 1/5 Date de création/révision: 25/10/1998 FICHE DE DONNEES DE SECURITE NON CLASSE
 RAID PIEGES ANTI-FOURMIS x 2 1/5 RAISON SOCIALE JOHNSONDIVERSEY FICHE DE DONNEES DE SECURITE RISQUES SPECIFIQUES NON CLASSE 1 IDENTIFICATION DU PRODUIT ET DE LA SOCIETE - NOM DU PRODUIT RAID PIEGES ANTI-FOURMIS
RAID PIEGES ANTI-FOURMIS x 2 1/5 RAISON SOCIALE JOHNSONDIVERSEY FICHE DE DONNEES DE SECURITE RISQUES SPECIFIQUES NON CLASSE 1 IDENTIFICATION DU PRODUIT ET DE LA SOCIETE - NOM DU PRODUIT RAID PIEGES ANTI-FOURMIS
+ Questions et réponses
 HÉPATITE B L hépatite B c est quoi? L hépatite B est un type de maladie du foie causée par le virus de l hépatite B, une des formes les plus courantes de l hépatite virale (les autres sont le virus de
HÉPATITE B L hépatite B c est quoi? L hépatite B est un type de maladie du foie causée par le virus de l hépatite B, une des formes les plus courantes de l hépatite virale (les autres sont le virus de
Plan. Introduction. Les Nouveaux Anticoagulants Oraux et le sujet âgé. Audit de prescription au Centre Hospitalier Geriatrique du Mont d Or
 Plan Introduction Les Nouveaux Anticoagulants Oraux et le sujet âgé Audit de prescription au Centre Hospitalier Geriatrique du Mont d Or Introduction NACO: une actualité brûlante! AVK: Plus forte incidence
Plan Introduction Les Nouveaux Anticoagulants Oraux et le sujet âgé Audit de prescription au Centre Hospitalier Geriatrique du Mont d Or Introduction NACO: une actualité brûlante! AVK: Plus forte incidence
Les médicaments génériques
 ASSURANCE COLLECTIVE Les médicaments génériques Leurs effets bénéfiques sur votre portefeuille Qu est-ce qu un médicament générique? Un médicament générique est l équivalent d une marque maison dans le
ASSURANCE COLLECTIVE Les médicaments génériques Leurs effets bénéfiques sur votre portefeuille Qu est-ce qu un médicament générique? Un médicament générique est l équivalent d une marque maison dans le
TECHNIQUES D AVENIR LASER DOPPLER IMAGING LASER DOPPLER IMAGING LASER DOPPLER IMAGING
 TECHNIQUES D AVENIR Jonathan LONDNER, Aurélie HAUTIER Centre Régional de Traitement des Grands Brûlés Service de chirurgie Plastique, Hôpital de la Conception, Marseille. DIAGNOSTIC DÉTERSION BOURGEONNEMENT
TECHNIQUES D AVENIR Jonathan LONDNER, Aurélie HAUTIER Centre Régional de Traitement des Grands Brûlés Service de chirurgie Plastique, Hôpital de la Conception, Marseille. DIAGNOSTIC DÉTERSION BOURGEONNEMENT
Le don de moelle osseuse :
 DON DE MOELLE OSSEUSE Le don de moelle osseuse : se décider aujourd hui, s engager pour longtemps LA MOELLE OSSEUSE ET SA GREFFE La moelle osseuse C est le tissu mou dans le centre du corps des os qui
DON DE MOELLE OSSEUSE Le don de moelle osseuse : se décider aujourd hui, s engager pour longtemps LA MOELLE OSSEUSE ET SA GREFFE La moelle osseuse C est le tissu mou dans le centre du corps des os qui
QUESTIONS FREQUEMMENT POSEES AUX EXPERTS DU SERVICE TELEPHONE VERT SIDA (800861061) ISTITUTO SUPERIORE DI SANITA
 QUESTIONS FREQUEMMENT POSEES AUX EXPERTS DU SERVICE TELEPHONE VERT SIDA (800861061) ISTITUTO SUPERIORE DI SANITA INFORMATIONS SUR LE TEST DE DEPISTAGE Q. Quels examens médicaux doit-on faire pour détecter
QUESTIONS FREQUEMMENT POSEES AUX EXPERTS DU SERVICE TELEPHONE VERT SIDA (800861061) ISTITUTO SUPERIORE DI SANITA INFORMATIONS SUR LE TEST DE DEPISTAGE Q. Quels examens médicaux doit-on faire pour détecter
FICHE DE DONNEES DE SECURITE. 1 Identification de la Substance / du Mélange et de la Société / l Entreprise
 FICHE DE DONNEES DE SECURITE MAURAN SAS Modèle conforme au Règlement Européen n 453/2010 NOM PRODUIT : Indice et Date de mise à jour : Page : 1/7 1 Identification de la Substance / du Mélange et de la
FICHE DE DONNEES DE SECURITE MAURAN SAS Modèle conforme au Règlement Européen n 453/2010 NOM PRODUIT : Indice et Date de mise à jour : Page : 1/7 1 Identification de la Substance / du Mélange et de la
et l utilisation des traitements biologiques
 et l utilisation des traitements biologiques Choisir le meilleur traitement pour retrouver la qualité de vie que vous êtes en droit d avoir Les agents biologiques (biothérapies) Étant les plus récents
et l utilisation des traitements biologiques Choisir le meilleur traitement pour retrouver la qualité de vie que vous êtes en droit d avoir Les agents biologiques (biothérapies) Étant les plus récents
ANNEXE I RESUME DES CARACTERISTIQUES DU PRODUIT
 1. DENOMINATION DU MEDICAMENT ANNEXE I RESUME DES CARACTERISTIQUES DU PRODUIT GAVISCONELL FRUITS DE LA PASSION SANS SUCRE, poudre orale en sachet-dose édulcorée à l'aspartam, au xylitol et à l'acésulfame
1. DENOMINATION DU MEDICAMENT ANNEXE I RESUME DES CARACTERISTIQUES DU PRODUIT GAVISCONELL FRUITS DE LA PASSION SANS SUCRE, poudre orale en sachet-dose édulcorée à l'aspartam, au xylitol et à l'acésulfame
Information à un nouveau donneur de cellules souches du sang
 Information à un nouveau donneur de cellules souches du sang Pour des raisons de simplification, les dénominations masculines s appliquent également aux femmes. La transplantation de cellules souches du
Information à un nouveau donneur de cellules souches du sang Pour des raisons de simplification, les dénominations masculines s appliquent également aux femmes. La transplantation de cellules souches du
GUIDE D INFORMATIONS A LA PREVENTION DE L INSUFFISANCE RENALE
 GUIDE D INFORMATIONS A LA PREVENTION DE L INSUFFISANCE RENALE SOURCES : ligues reins et santé A LA BASE, TOUT PART DES REINS Organes majeurs de l appareil urinaire, les reins permettent d extraire les
GUIDE D INFORMATIONS A LA PREVENTION DE L INSUFFISANCE RENALE SOURCES : ligues reins et santé A LA BASE, TOUT PART DES REINS Organes majeurs de l appareil urinaire, les reins permettent d extraire les
Article 1 er. Code de la santé publique Texte précédent. Nouveau texte. 28/11/2012 Evelyne Pierron Consultants. Article R5121-25
 Tableau comparatif Décret n 2012-1244 du 8 novembre 2012 relatif au renforcement des dispositions en matière de sécurité des médicaments à usage humain soumis à autorisation de mise sur le marché et à
Tableau comparatif Décret n 2012-1244 du 8 novembre 2012 relatif au renforcement des dispositions en matière de sécurité des médicaments à usage humain soumis à autorisation de mise sur le marché et à
Avis 23 avril 2014. BARITEKAL 20 mg/ml, solution injectable Boîte de 10 ampoules de 5 ml (CIP : 34009 585 896 3 8) Laboratoire NORDIC PHARMA
 COMMISSION DE LA TRANSPARENCE Avis 23 avril 2014 BARITEKAL 20 mg/ml, solution injectable Boîte de 10 ampoules de 5 ml (CIP : 34009 585 896 3 8) Laboratoire NORDIC PHARMA DCI Code ATC (2012) Motif de l
COMMISSION DE LA TRANSPARENCE Avis 23 avril 2014 BARITEKAL 20 mg/ml, solution injectable Boîte de 10 ampoules de 5 ml (CIP : 34009 585 896 3 8) Laboratoire NORDIC PHARMA DCI Code ATC (2012) Motif de l
NOTICE : INFORMATION DE L UTILISATEUR. JAYDESS 13,5 mg, système de diffusion intra-utérin. Lévonorgestrel
 NOTICE : INFORMATION DE L UTILISATEUR JAYDESS 13,5 mg, système de diffusion intra-utérin Lévonorgestrel Ce médicament fait l objet d une surveillance supplémentaire qui permettra l identification rapide
NOTICE : INFORMATION DE L UTILISATEUR JAYDESS 13,5 mg, système de diffusion intra-utérin Lévonorgestrel Ce médicament fait l objet d une surveillance supplémentaire qui permettra l identification rapide
GUIDE DE BONNES PRATIQUES POUR LA COLLECTE DE PILES ET ACCUMULATEURS AU LUXEMBOURG
 GUIDE DE BONNES PRATIQUES POUR LA COLLECTE DE PILES ET ACCUMULATEURS AU LUXEMBOURG Version 1.0 1 Avant-propos Ce guide de bonnes pratiques a été préparé pour fournir des informations concernant la collecte
GUIDE DE BONNES PRATIQUES POUR LA COLLECTE DE PILES ET ACCUMULATEURS AU LUXEMBOURG Version 1.0 1 Avant-propos Ce guide de bonnes pratiques a été préparé pour fournir des informations concernant la collecte
Vous et votre traitement anticoagulant par AVK (antivitamine K)
 Ce carnet a été réalisé sous la coordination de l Agence française de sécurité sanitaire des produits de santé (Afssaps). Vous et votre traitement anticoagulant par AVK (antivitamine K) Carte à découper
Ce carnet a été réalisé sous la coordination de l Agence française de sécurité sanitaire des produits de santé (Afssaps). Vous et votre traitement anticoagulant par AVK (antivitamine K) Carte à découper
L assurance maternité des femmes chefs d entreprises et des conjointes collaboratrices. Édition 2013
 1 L assurance maternité des femmes chefs d entreprises et des conjointes collaboratrices Édition 2013 L assurance maternité Sommaire Les prestations maternité 3 Cas particuliers 8 Le congé paternité 11
1 L assurance maternité des femmes chefs d entreprises et des conjointes collaboratrices Édition 2013 L assurance maternité Sommaire Les prestations maternité 3 Cas particuliers 8 Le congé paternité 11
Conseils pour le traitement des douleurs persistantes
 Page -1- Conseils pour le traitement des douleurs persistantes Ce qu'il faut savoir avant tout, c'est que les douleurs persistantes sont des "douleurs particulières", qui doivent donc être traitées en
Page -1- Conseils pour le traitement des douleurs persistantes Ce qu'il faut savoir avant tout, c'est que les douleurs persistantes sont des "douleurs particulières", qui doivent donc être traitées en
Maternité et activités sportives
 Maternité et activités sportives L obstétricien est de plus en plus souvent interrogé sur les avantages et les risques de maintenir ou de débuter une APS ou de loisir pendant la grossesse. Transformations
Maternité et activités sportives L obstétricien est de plus en plus souvent interrogé sur les avantages et les risques de maintenir ou de débuter une APS ou de loisir pendant la grossesse. Transformations
Etablissement Français du Sang
 Etablissement Français du Sang LE LIEN ENTRE LA GÉNÉROSITÉ DES DONNEURS DE SANG ET LES BESOINS DES MALADES Document de préparation à l entretien médical préalable au don de sang Partie médicale La sécurité
Etablissement Français du Sang LE LIEN ENTRE LA GÉNÉROSITÉ DES DONNEURS DE SANG ET LES BESOINS DES MALADES Document de préparation à l entretien médical préalable au don de sang Partie médicale La sécurité
phase de destruction et d'élimination de débris
 LE POST PARTUM I ) Définition : c'est une période de 6 semaines allant de l'accouchement jusqu'au retour de couches (= règles). Pendant ce temps il est nécessaire d'effectuer une surveillance médicale
LE POST PARTUM I ) Définition : c'est une période de 6 semaines allant de l'accouchement jusqu'au retour de couches (= règles). Pendant ce temps il est nécessaire d'effectuer une surveillance médicale
INFORMATIONS pour le médecin qui contrôle et complète le formulaire
 Vaccination des étudiants du Baccalauréat en Médecine de Lausanne INFORMATIONS pour le médecin qui contrôle et complète le formulaire La vaccination du personnel de santé est recommandée par l Office fédéral
Vaccination des étudiants du Baccalauréat en Médecine de Lausanne INFORMATIONS pour le médecin qui contrôle et complète le formulaire La vaccination du personnel de santé est recommandée par l Office fédéral
B. REGLEMENTS D EXECUTION
 MEDICAMENTS - B. REGLEMENTS D EXECUTION 1 B. REGLEMENTS D EXECUTION Sommaire Règlement grand-ducal du 29 avril 1983 fixant la composition et le fonctionnement de la commission d experts chargée de donner
MEDICAMENTS - B. REGLEMENTS D EXECUTION 1 B. REGLEMENTS D EXECUTION Sommaire Règlement grand-ducal du 29 avril 1983 fixant la composition et le fonctionnement de la commission d experts chargée de donner
Des soins après avortement : Amis des Jeunes. Cartes à conseils 1-6
 Des soins après avortement : Amis des Jeunes Cartes à conseils 1-6 SAA: Avant l intervention Accueillir cordialement la cliente et la mettre à l aise Garantir la confidentialité et l intimité Prendre les
Des soins après avortement : Amis des Jeunes Cartes à conseils 1-6 SAA: Avant l intervention Accueillir cordialement la cliente et la mettre à l aise Garantir la confidentialité et l intimité Prendre les
SECTION 3: Composition/informations sur les composants 3.2. Mélanges % CAS # (EC) No 1272/2008 1999/45/EC Deuterium oxide 99.
 FICHE TECHNIQUE SANTE-SECURITE Selon la règlementation (CE) n 1907/2006 Date de la modification: 07/10/14 www.restek.com SECTION 1: Identification de la substance/du mélange et de la société/l entreprise
FICHE TECHNIQUE SANTE-SECURITE Selon la règlementation (CE) n 1907/2006 Date de la modification: 07/10/14 www.restek.com SECTION 1: Identification de la substance/du mélange et de la société/l entreprise
DON DE SANG. Label Don de Soi
 DON DE SANG Label Don de Soi 2015 SOMMAIRE Les différents types de dons p.3 Le don de sang total Le don de plasma Le don de plaquettes Le don de moelle osseuse Que soigne-t-on avec un don de sang? p.7
DON DE SANG Label Don de Soi 2015 SOMMAIRE Les différents types de dons p.3 Le don de sang total Le don de plasma Le don de plaquettes Le don de moelle osseuse Que soigne-t-on avec un don de sang? p.7
Patchs contre la douleur contenant des dérivés de morphine. Réponses aux questions les plus fréquentes
 Patchs contre la douleur contenant des dérivés de morphine Réponses aux questions les plus fréquentes Introduction Quel objectif? Ce document constitue une aide dans la gestion au quotidien de votre douleur.
Patchs contre la douleur contenant des dérivés de morphine Réponses aux questions les plus fréquentes Introduction Quel objectif? Ce document constitue une aide dans la gestion au quotidien de votre douleur.
