COMMISSION DE LA TRANSPARENCE AVIS. 29 novembre 2006
|
|
|
- Timothée Poitras
- il y a 10 ans
- Total affichages :
Transcription
1 COMMISSION DE LA TRANSPARENCE AVIS 29 novembre 2006 BONVA 3 mg solution injectable en seringue pré-remplie Boîte de 1 seringue pré-remplie en verre de 3 ml avec 1 aiguille : Boîte de 4 seringues pré-remplies en verre de 3 ml avec 4 aiguilles : Laboratoires ROCHE acide ibandronique liste I Date de l AMM : 19 mars 2006 Rectificatif d AMM : 28 août 2006 (indication et propriétés pharmacodynamiques) Motif de la demande : Inscription Sécurité Sociale et Collectivités (B/1) Inscription Collectivités (B/4) Direction de l'évaluation des actes et produits de santé 1
2 1 CARACTERISTIQUES DU MEDICAMENT 1.1. Principe actif acide ibandronique 1.2. Originalité Premier bisphosphonate administré par voie intra-veineuse tous les 3 mois indiqué dans le traitement de l ostéoporose post-ménopausique Indication Traitement de l ostéoporose post-ménopausique chez la femme à risque augmenté de fractures. Une réduction du risque de fractures vertébrales a été démontrée, l efficacité sur les fractures du col du fémur n a pas été établie Posologie La posologie recommandée d acide ibandronique est de 3 mg, administrée par voie intraveineuse en 15 à 30 secondes, tous les 3 mois. Respecter strictement la voie intraveineuse Les patientes doivent être supplémentées en calcium et en vitamine D. En cas d oubli, l injection doit être pratiquée dès que possible. Les injections suivantes devront ensuite être planifiées tous les 3 mois à compter de la date de la dernière injection. Insuffisants rénaux Aucune adaptation de la posologie n est nécessaire chez les patientes présentant une insuffisance rénale légère ou modérée, caractérisée par une créatinine sérique inférieure ou égale à 200 µmol/l (2,3 mg/dl) ou par une clairance de la créatinine (mesurée ou estimée) supérieure ou égale à 30 ml/min. En raison de données limitées chez ces patientes lors des études cliniques, l utilisation de BONVA I.V. n est pas recommandée chez les patientes présentant une créatinine sérique supérieure à 200 µmol/l (2,3 mg/dl) ou une clairance de la créatinine (mesurée ou estimée) inférieure à 30 ml/min Insuffisants hépatiques Aucune adaptation de la posologie n est nécessaire Personnes âgées Aucune adaptation de la posologie n est nécessaire Enfants et adolescents Il n y a pas d expérience chez l enfant. 2
3 2 MEDICAMENTS COMPARABLES 2.1. Classement ATC (2006) M : Muscle et squelette 05 : Médicaments pour le traitement des désordres osseux B : Médicaments agissant sur la minéralisation A : Bisphosphonates 06: Acide ibandronique 2.2. Médicaments de même classe pharmaco-thérapeutique Médicaments de comparaison Aucun autre bisphosphonate sous forme injectable n a l AMM dans le traitement de l ostéoporose post-ménopausique. Bisphosphonates oraux indiqués dans le traitement de l ostéoporose postménopausique : - DIDRONEL 400 mg comprimé et ses génériques (étidronate) - ACTONEL 5 mg et 35 mg comprimé (risédronate) - FOSAMAX 10 mg, 70 mg comprimé et les autres spécialités à base d alendronate 10 mg et 70 mg, FOSAVANCE comprimé (alendronate ou association alendronate + vitamine D) - BONVA 150 mg et 2,5 mg comprimé (ibandronate) Médicaments à même visée thérapeutique Autres spécialités indiquées dans l ostéoporose post-ménopausique : - EVISTA et OPTRUMA (raloxifène), - PROTELOS (ranélate de strontium) - FORSTEO (tériparatide). Le calcium et la vitamine D sont utilisés le plus souvent en traitement adjuvant. 3
4 3 ANALYSE DES DONNEES DISPONIBLES 3.1. Efficacité Le plan de développement de BONVA 3 mg/3 mois repose sur : l étude BONE qui a mis en évidence l effet anti-fracturaire de la forme orale quotidienne (BONVA 2,5 mg, comprimé) et, l étude DA qui a démontré la non-infériorité sur la DMO (densité minérale osseuse) de BONVA 3 mg/3mois par rapport à BONVA 2,5 mg. Rappel des résultats de l étude pivot BONE (MF4411) 1 L efficacité anti-fracturaire vertébrale de BONVA à la posologie journalière de 2,5 mg et intermittente de 20 mg pendant 12 jours tous les 3 mois a été démontrée versus placebo chez 2929 femmes ayant une ostéoporose post-ménopausique avec au moins une fracture vertébrale prévalente (1-4) et âgées de moins de 80 ans. Toutes les patientes ont reçu une supplémentation en calcium (500 mg/j) et en vitamine D (400 UI/j). Le critère principal d évaluation a été le nombre de patientes chez lesquelles une nouvelle fracture vertébrale est apparue après 3 ans de traitement. Résultats : (analyse en ITT) Nombre et pourcentage de patientes chez lesquelles une nouvelle fracture vertébrale est apparue après 3 ans de traitement : Placebo N = ,6%[7,47%;11,66%] BONVA 2,5 mg / j N = ,7% [3,20%; 6,16%] BONVA 20 mg/j pendant 12 jours tous les 3 mois N = ,9% [3,39%; 6,41%] BONVA a été supérieur au placebo pour la réduction de l incidence de nouvelles fractures vertébrales. La réduction du risque relatif de fracture vertébrale a été de 62% [40,89% ; 75,08%] dans le groupe traité par BONVA 2,5 mg/j (p= 0,0001) et de 50% [25,66% ; 66,20%] dans le groupe traité par BONVA 20 mg (p= 0,0006) par rapport au placebo. Dans la population totale de l étude, aucune efficacité n a été démontrée sur les fractures non vertébrales (incidences : 9,1% et 8,9% sous ibandronate vs 8,1% sous placebo). Cependant, dans une analyse a posteriori (donc purement exploratoire) réalisée chez un sous groupe de patientes ayant une DMO au niveau du col fémoral <-3, il a été observé une réduction du risque de fractures non vertébrales de 69% avec la forme quotidienne de BONVA (2,5 mg). Tolérance : Dans cette étude, l incidence des effets indésirables dans les trois groupes a été similaire, en dehors d une dyspepsie plus fréquente sous BONVA 2,5 mg/j (11%) que sous placebo (9%) et BONVA 20 mg (9%). 1 Chesnut et al. Effects of oral ibandronate administered daily or intermittently on fracture risk in postmenopausal osteoporosis. J Bone Miner Res 2004; 19 (8) :
5 Étude pivot DA (Delmas et al ) Etude randomisée, double-aveugle ayant eu pour objectif de démontrer la noninfériorité de la forme à la posologie trimestrielle de 3 mg ou bimestrielle de 2 mg par rapport à la forme orale journalière 2,5 mg de BONVA sur les variations de la DMO lombaire chez 1386 femmes âgées de 55 à 80 ans ayant une ostéoporose post-ménopausique. Critère principal d efficacité : variation (%) de la DMO lombaire moyenne (L2-L4) par rapport à la valeur à l inclusion après 1 an de traitement. Les principaux critères secondaires ont été : - Variation relative (%) et absolue (g/cm²) de la DMO lombaire moyenne (L2-L4) par rapport aux valeurs initiales à 2 ans, - Variation absolue de la DMO lombaire moyenne (L2-L4) par rapport aux valeurs initiales à 1 an, - Variation relative et absolue de la DMO au fémur proximal (hanche totale, trochanter, col fémoral) à 1 an et 2 ans par rapport aux valeurs initiales, - Taux de répondeurs : étaient considérées comme répondeuses, les patientes ayant une DMO lombaire ou de hanche totale à la valeur à l inclusion à 1 an et 2 ans. - Variation absolue et relative des taux sériques de CTX (C télopeptide) à 6, 12 et 24 mois. L hypothèse avait été faite que les traitements d ibandronate (2 mg/2 mois et 3 mg/ 3 mois) seraient considérés comme non-inférieurs au traitement oral journalier si la borne inférieure de l intervalle de confiance à 95% de la différence de la variation relative (%) de la DMO lombaire par rapport à la valeur initiale était supérieure ou égale à -1%. Cette limite de non-infériorité fixée à 1% correspondait à une perte consentie de 30% de l effet minimal de BONVA 2,5 mg/j sur la DMO lombaire par rapport au placebo à 1 an. En contre-partie, il était attendu avec BONVA 3 mg/3 mois une meilleure tolérance digestive. Le protocole prévoyait de réaliser un test de supériorité si la non-infériorité était démontrée et une analyse de confirmation à 2 ans, la limite de non infériorité étant alors fixée à 1,3%. Les patientes ont été réparties en 4-3 groupes et ont reçu BONVA à la posologie de : 2,5 mg per os par jour (n= 469) 2 mg tous les 2 mois (n = 454) 3 mg tous les 3 mois (n = 472) L étude a comporté un double placebo (per os et ). Toutes les patientes ont reçu une supplémentation de 500 mg de calcium et 400 UI de vitamine D par jour. Les critères d inclusion ont été : - ménopause depuis au moins 5 ans - âge compris entre 55 et 80 ans, - DMO lombaire moyenne (L2-L4) : T-score compris entre -2,5 et -5,0. 2 Delmas et al. Intravenous Ibandronate Injections in Postmenopausal Women with osteoporosis. Arthritis & Rheumatism 2006; 54 (6) :
6 Résultats : (Analyse per protocole) Caractéristiques des patientes à l inclusion BONVA 2.5 mg/j n =465 BONVA 2 mg /2 mois n =448 BONVA 3 mg /3 mois n =469 Age (m±sd) 65.7± ± ±6.3 Antécédent de fracture (%) 202 (43.5) 187 (42.1) 206 (43.9) T-score lombaire moyen -3.26± ± ±0.59 (L2-L4) (m±sd) T score hanche totale (m±sd) -1.99± ± ±0.91 Sur le critère principal Variation relative en % de la DMO lombaire après 1 an de traitement (population PP) Augmentation moyenne de la DMO lombaire à 1 an (%) BONVA 2,5 mg/ j n =377 IC 95% de la différence versus BONVA -- 2,5 mg/j Source : Rapport d étude DA à 1 an BONVA 2 mg / 2mois n =353 BONVA 3 mg /3 mois n = ( ) 5.1 ( ) 4.8 ( ) 1.3 [0.76,1.86] 1 [0.49, 1.58] La non-infériorité de BONVA 2 mg/2 mois et 3 mg/3 mois par rapport à BONVA 2,5 mg/j a été démontrée sur l augmentation de la DMO à 1 an. Ces résultats ont été confirmés par l analyse des données à 2 ans : Augmentation moyenne de la DMO lombaire à 2 ans (%) IC 97,5% de la différence versus BONVA 2,5 mg/j Source : Rapport d étude DA à 2 ans BONVA 2,5 mg/ j n =334 BONVA 2 mg / 2mois n =320 BONVA 3 mg /3 mois n = ( ) 6.4 ( ) 6.3 ( ) [0.80, 2.28] 1.5 [0.76, 2.23] Par ailleurs, dans une analyse prévue de façon prospective, BONVA 2 mg/2 mois et 3 mg/3 mois se sont montrés supérieurs à BONVA 2,5 mg/j sur l augmentation de la DMO lombaire à 1 an et à 2 ans, p <0,001. Ces résultats ont été confirmés dans l analyse en ITT. 6
7 Sur les critères secondaires : DMO Augmentation de DMO par rapport à l inclusion (%) à 1 an et 2 ans, IC 95% (population PP) 1 an 2 ans 2.5 mg/j per os (373) Hanche 1.8 totale ( ) Col 1.6 fémoral (1.2-2) Trochanter 3 ( ) 2 mg/2 mois (346) 2.6 * ( ) 2 ( ) 4.1* ( ) 3 mg/3 mois (362) 2.4 * (2-2.7) 2.3 * ( ) 3.8* ( ) * différence significative par rapport au groupe oral quotidien % de répondeurs 2.5mg/j per os (330) 2.2 ( ) 2.2 ( ) 3.5 (3-4) 2mg/2mois (316) 3.4* (3-3.7) 2.7 ( ) 5.0* ( ) 3mg/3mois (333) 3.1* ( ) 2.8 ( ) 4.9 * ( ) En comparaison au traitement journalier, il a été observé un taux de répondeurs plus important dans les groupes traités par BONVA. 1 an 2 ans % de répondeurs 2.5mg/j per os 2mg/2mois 3mg/3mois 2.5mg/j per os 2mg/2mois 3mg/3mois DMO * 92.1* * 92.8* lombaire DMO * 82.3* * 85.6* hanche totale * différence significative par rapport au groupe oral quotidien CTX 3 sérique Variation médiane par rapport à la valeur d inclusion (%) (population PP) BONVA 2.5 mg/j BONVA 2 mg /2 mois BONVA 3 mg /3 mois Mois Mois Mois Mois Mois Mois Source : rapports d étude DA à 1an et 2 ans 3.2. Tolérance Dans l étude DA, la tolérance globale à 2 ans de BONVA 3 mg/3 mois a été similaire à celle de BONVA 2,5 mg oral : l incidence des effets indésirables a été de 22,6% avec la forme orale versus 28,6% avec la forme trimestrielle. Des symptômes pseudo-grippaux transitoires ont été rapportés chez les patientes recevant BONVA 3 mg tous les 3 mois, habituellement lors de 3 C-télopeptides sériques 7
8 la première injection. Le syndrome pseudo-grippal a inclus : myalgies, arthralgies, fièvre, frissons, fatigue, nausées, perte d appétit ou douleurs osseuses. Ces symptômes ont généralement été de courte durée, d intensité légère à modérée et ont disparu lors de la poursuite du traitement sans nécessiter de mesures particulières. Cependant, deux patientes du groupe BONVA 3 mg/3 mois ont interrompu le traitement en raison d un syndrome pseudo-grippal. Effets indésirables de fréquence > 1% et considérés par l investigateur comme possiblement ou probablement liés au traitement à l étude dans DA 2 ans Pourcentages de patientes avec au moins un effet indésirable 2.5mg/j per os N=465 DA 2 ans 2mg/2mois N=448 3mg/3mois N=469 Digestif Gastrite Diarrhée Douleurs abdominales Dyspepsie Nausées Constipation Système musculosquelettique Douleurs musculosquelettiques Arthralgies Myalgies Douleurs dorsales Troubles généraux Syndrome pseudo-grippal Fatigue Système nerveux Céphalées Affections de la peau Eruptions cutanées Source : RCP Fractures cliniques N (%) Fractures cliniques ostéoporotiques Fractures cliniques non vertébrales 2.5 mg oral quotidien 2 mg / 2 mois 3 mg / 3 mois 1 an 2 ans 1 an 2 ans 1 an 2 ans 15 (3.2) 29 (6.2) 10 (2.2) 21 (4.7) 12 (2.6) 23 (4.9) 11(2.4) 28 (6.0) 7(1.6) 21 (4.7) 5(1.1) 18 (3.8) 3.3. Conclusion L efficacité anti-fracturaire vertébrale de BONVA per os a été démontrée à la posologie journalière de 2,5 mg dans l étude clinique BONE réalisée chez 2929 femmes âgées de moins de 80 ans et ayant une ostéoporose post-ménopausique avec une fracture vertébrale. L efficacité sur les fractures du col fémoral n a pas été démontrée. 8
9 Dans une étude de non-infériorité (DA), le schéma d administration 3 mg tous les 3 mois a été non-inférieur au traitement oral 2,5 mg une fois par jour sur l augmentation de la DMO lombaire à un an et à 2 ans. Le seuil de non-infériorité avait été fixé à 1%, ce qui correspondait à une perte de 30% de l effet minimal de la forme orale quotidienne 2,5 mg/j par rapport au placebo sur la DMO lombaire. De plus, une analyse prévue de façon prospective, a montré la supériorité de BONVA 3 mg tous les 3 mois par rapport à BONVA oral 2,5 mg/j sur l augmentation de la DMO lombaire à 1 an et à 2 ans ( p <0,001). Compte tenu de son mode d administration, par voie intra-veineuse, il était attendu avec BONVA 3mg/3 mois une meilleure tolérance digestive permettant son administration à des femmes intolérantes aux bisphosphonates oraux ou à risque accru d intolérance digestive. Dans l étude pivot DA, les douleurs abdominales, les dyspepsies, les nausées et la constipation ont été moins fréquentes avec la forme intra-veineuse BONVA 3mg/3mois mais les gastrites et les diarrhées ont été plus importantes que sous BONVA 2,5 mg. Par ailleurs, les syndromes pseudo-grippaux ont été plus fréquents avec BONVA 3mg/3mois (4,5%) qu avec la forme journalière (0,9%). Ces symptômes ont généralement été de courte durée, d intensité légère à modérée et ont disparu lors de la poursuite du traitement sans nécessiter de mesures particulières. La commission regrette qu aucune efficacité anti-fracturaire n ait été démontrée de manière directe avec la forme injectable trimestrielle BONVA 3 mg et l absence d étude comparative avec les autres bisphosphonates oraux (alendronate, risédronate). 9
10 4 CONCLUSIONS DE LA COMMISSION DE LA TRANSPARENCE 4.1. Service médical rendu L'ostéoporose est une affection dont le caractère de gravité tient au risque fracturaire. En particulier, les fractures du col fémoral peuvent compromettre le pronostic vital. BONVA 3 mg/3 mois est un traitement préventif des fractures ostéoporotiques. Toutefois, son efficacité sur les fractures du col du fémur n a pas été établie. Intérêt en termes de santé publique : Compte tenu de la fréquence élevée de l ostéoporose post ménopausique et de la gravité de ses conséquences, le fardeau de la maladie est important en termes de santé publique. Il existe un besoin de santé publique insuffisamment couvert dans l ostéoporose. L impact attendu de BONVA 3mg/3mois sur la réduction de la morbimortalité liée à l ostéoporose post ménopausique ne peut être apprécié compte tenu de l absence d étude clinique ayant comparé, en particulier en termes d effet anti-fracturaire, cette forme injectable trimestrielle de l ibandronate aux autres bisphosphonates oraux. De plus, les résultats des études ne permettent pas d étayer l hypothèse d une meilleure observance liée à une moindre survenue des effets indésirables digestifs. Les données disponibles sont ainsi insuffisantes pour présumer que BONVA 3mg/3mois apportera une réponse supplémentaire au besoin de santé publique par rapport aux autres bisphosphonates. En conséquence, en l état actuel des connaissances, il n est pas attendu d intérêt de santé publique pour BONVA 3mg/3mois. Le rapport efficacité/effets indésirables de BONVA 3mg/3mois est important. BONVA 3mg/3mois est un médicament de première intention. Il existe des alternatives thérapeutiques notamment d autres bisphosphonates administrés par voie orale ayant démontré leur efficacité dans la prévention des fractures vertébrales et périphériques d origine ostéoporotique. Le service médical rendu par cette spécialité est important Amélioration du service médical rendu BONVA 3 mg/ 3 mois n apporte pas d amélioration du service médical rendu (V) dans la prise en charge de l ostéoporose post-ménopausique vertébrale Place dans la stratégie thérapeutique L ostéoporose est définie par un T-score -2,5 en l absence de toute autre cause d ostéopathie déminéralisante ou fragilisante. L objectif du traitement de l ostéoporose est la prévention des fractures. Avant l instauration de tout traitement anti-ostéoporotique, il convient de rechercher et de corriger les carences en calcium et vitamine D. La supplémentation vitaminocalcique sera poursuivie si nécessaire pendant le traitement anti-ostéoporotique. Selon les recommandations de l AFSSAPS publiées en janvier 2006, un traitement est systématiquement préconisé en cas d ostéoporose compliquée de fracture. En l absence de fracture chez les femmes ménopausées, l indication du traitement sera discutée au cas par cas, en fonction du risque individuel de fracture. Ce risque est 10
11 évalué en se fondant sur la valeur du T-score et de la présence éventuelle d autres facteurs de risque de fractures. Un traitement doit ainsi être envisagé chez les femmes ayant : - une diminution importante de la densité osseuse (T score < -3) ou - un T score -2,5 associé à d autres facteurs de risque de fracture, en particulier : un âge > 60 ans, une corticothérapie systémique ancienne ou actuelle à une posologie 7,5 mg/jour d équivalent prednisone, un indice de masse corporelle < 19 kg/m², un antécédent de fracture de l extrémité du col du fémur chez un parent du premier degré (mère), une ménopause précoce (avant l âge de 40 ans). En l absence de comparaison directe entre les différents médicaments antiostéoporotiques (bisphosphonates, raloxifène, tériparatide et le ranélate de strontium), le choix du traitement sera fonction du risque de fracture vertébrale et/ou non vertébrale, de l âge, du nombre et de la localisation des fractures, ainsi que du terrain du patient et de ses contre-indications éventuelles à l un ou l autre des médicaments. Parmi les bisphosphonates indiqués dans le traitement de l ostéoporose postménopausique, l acide ibandronique (BONVA ) diminue le risque de fractures vertébrales chez les femmes de moins de 80 ans ayant une ostéoporose postménopausique, mais n a pas montré d efficacité sur les fractures du col fémoral. A l heure actuelle, trois spécialités à base d acide ibandronique ont l AMM dans le traitement de l ostéoporose post-ménopausique dont deux sous forme orale : BONVA 2,5 mg à prise journalière, BONVA 150 mg à prise mensuelle et BONVA 3mg/3 mois. La survenue d une fracture après la première année de traitement, malgré une observance satisfaisante, doit faire reconsidérer le traitement. Un autre médicament pourra être proposé y compris au sein de la même classe pharmacologique Population cible La population cible de BONVA 3 mg/3 mois est identique à celles de BONVA 2,5 mg et 150 mg. Elle est représentée par les femmes ayant une ostéoporose postménopausique vertébrale et un faible risque de fracture du col fémoral. La population des femmes ayant une ostéoporose peut être estimée à partir des données suivantes : - environ 25% des femmes de 65 ans et 50% des femmes de 80 ans présenteraient une ostéoporose (GTNDO, 2003). - selon l INSEE ( la population féminine de plus de 50 ans était de 11,5 millions au 1 er janvier 2005, celle de plus de 65 ans de 6 millions et celle de plus de 80 ans de 1,9 million. Selon ces données, la population présentant une ostéoporose post-ménopausique pourrait être estimée à environ 3 à 3,3 millions de femmes. Compte tenu de la population incluse dans l étude et de l absence de démonstration d efficacité sur les fractures du col du fémur, les femmes de plus de 80 ans doivent être exclues de la population cible de BONVA 3 mg/3 mois. Par conséquent, la population cible de BONVA 3 mg/3 mois est comprise entre 2 et 2,4 millions Recommandations de la commission de la transparence Avis favorable à l'inscription sur la liste des spécialités remboursables aux assurés sociaux et sur la liste des médicaments agréés à l'usage des collectivités et divers services publics. 11
12 Périmètre de remboursement Traitement de l ostéoporose post-ménopausique vertébrale : - chez les patientes ayant fait une fracture par fragilité osseuse, - en l absence de fracture, chez les femmes ayant une diminution importante de la densité osseuse (T score < -3) ou ayant un T score -2,5 associé à d autres facteurs de risque de fracture en particulier, un âge > 60 ans, une corticothérapie systémique ancienne ou actuelle à une posologie 7,5 mg/jour d équivalent prednisone, un indice de masse corporelle < 19 kg/m², un antécédent de fracture de l extrémité du col du fémur chez un parent du premier degré (mère), une ménopause précoce (avant l âge de 40 ans) Conditionnement : il est adapté aux conditions de prescription Taux de remboursement : 65% 12
Evaluer le risque fracturaire: l outil FRAX (Fracture Risk Assessment Tool)
 Evaluer le risque fracturaire: l outil FRAX (Fracture Risk Assessment Tool) F. FLAISLER Service de Rhumatologie Groupe Hospitalo-Universitaire CAREMEAU, Nîmes OSTÉOPOROSE DEFINITION AFSSAPS «Maladie diffuse
Evaluer le risque fracturaire: l outil FRAX (Fracture Risk Assessment Tool) F. FLAISLER Service de Rhumatologie Groupe Hospitalo-Universitaire CAREMEAU, Nîmes OSTÉOPOROSE DEFINITION AFSSAPS «Maladie diffuse
Traitement de l ostéoporose post-ménopausique Janv ier 2006 TRAITEMENT MEDICAMENTEUX DE L OSTEOPOROSE POST-MENOPAUSIQUE RECOMMANDATIONS
 TRAITEMENT MEDICAMENTEUX DE L OSTEOPOROSE POST-MENOPAUSIQUE RECOMMANDATIONS Actualisation 2006 Afssaps - 143/ 147, bd Anatole France F-93285 Sai nt-denis Cedex t él. +33 (0)1 55 87 30 00 www.afssaps.sante.fr
TRAITEMENT MEDICAMENTEUX DE L OSTEOPOROSE POST-MENOPAUSIQUE RECOMMANDATIONS Actualisation 2006 Afssaps - 143/ 147, bd Anatole France F-93285 Sai nt-denis Cedex t él. +33 (0)1 55 87 30 00 www.afssaps.sante.fr
COMMISSION DE LA TRANSPARENCE AVIS DE LA COMMISSION. 10 octobre 2001
 COMMISSION DE LA TRANSPARENCE AVIS DE LA COMMISSION 10 octobre 2001 VIRAFERONPEG 50 µg 80 µg 100 µg 120 µg 150 µg, poudre et solvant pour solution injectable B/1 B/4 Laboratoires SCHERING PLOUGH Peginterféron
COMMISSION DE LA TRANSPARENCE AVIS DE LA COMMISSION 10 octobre 2001 VIRAFERONPEG 50 µg 80 µg 100 µg 120 µg 150 µg, poudre et solvant pour solution injectable B/1 B/4 Laboratoires SCHERING PLOUGH Peginterféron
COMMISSION DE LA TRANSPARENCE AVIS. 10 mai 2006
 COMMISSION DE LA TRANSPARENCE AVIS 10 mai 2006 METOJECT 10 mg/ml, solution injectable en seringue pré-remplie 1 seringue pré-remplie en verre de 0,75 ml avec aiguille : 371 754-3 1 seringue pré- remplie
COMMISSION DE LA TRANSPARENCE AVIS 10 mai 2006 METOJECT 10 mg/ml, solution injectable en seringue pré-remplie 1 seringue pré-remplie en verre de 0,75 ml avec aiguille : 371 754-3 1 seringue pré- remplie
COMMISSION DE LA TRANSPARENCE. Avis. 10 mars 2010
 COMMISSION DE LA TRANSPARENCE Avis 10 mars 2010 ARIXTRA 1,5 mg/0,3 ml, solution injectable en seringue pré-remplie - Boîte de 2 (CIP : 363 500-6) - Boîte de 7 (CIP : 363 501-2) - Boîte de 10 (CIP : 564
COMMISSION DE LA TRANSPARENCE Avis 10 mars 2010 ARIXTRA 1,5 mg/0,3 ml, solution injectable en seringue pré-remplie - Boîte de 2 (CIP : 363 500-6) - Boîte de 7 (CIP : 363 501-2) - Boîte de 10 (CIP : 564
CLINIMIX AVIS DE LA COMMISSION DE LA TRANSPARENCE
 CLINIMIX AVIS DE LA COMMISSION DE LA TRANSPARENCE BAXTER_CLINIMIX N9G15 E et N12G20E_Avis CT_14-02-2007.pdf BAXTER_CLINIMIX N9G15E N12G20E N14G30 N17G35_Avis CT_12-12-2001.pdf BAXTER_CLINIMIX changement
CLINIMIX AVIS DE LA COMMISSION DE LA TRANSPARENCE BAXTER_CLINIMIX N9G15 E et N12G20E_Avis CT_14-02-2007.pdf BAXTER_CLINIMIX N9G15E N12G20E N14G30 N17G35_Avis CT_12-12-2001.pdf BAXTER_CLINIMIX changement
COMMISSION DE LA TRANSPARENCE AVIS. 18 janvier 2006
 COMMISSION DE LA TRANSPARENCE AVIS 18 janvier 2006 ADVATE 1500 UI, poudre et solvant pour solution injectable 1 flacon(s) en verre de 1 500 UI - 1 flacon(s) en verre de 5 ml avec matériel(s) de perfusion(s)
COMMISSION DE LA TRANSPARENCE AVIS 18 janvier 2006 ADVATE 1500 UI, poudre et solvant pour solution injectable 1 flacon(s) en verre de 1 500 UI - 1 flacon(s) en verre de 5 ml avec matériel(s) de perfusion(s)
COMMISSION DE LA TRANSPARENCE. AVIS 1 er février 2012
 COMMISSION DE LA TRANSPARENCE AVIS 1 er février 2012 Le projet d avis adopté par la Commission de la Transparence le 16 novembre 2011 a fait l objet d une audition le 1 février 2012 XEPLION 25 mg, suspension
COMMISSION DE LA TRANSPARENCE AVIS 1 er février 2012 Le projet d avis adopté par la Commission de la Transparence le 16 novembre 2011 a fait l objet d une audition le 1 février 2012 XEPLION 25 mg, suspension
DENSITOMÉTRIE OSSEUSE : CE QUE LE RADIOLOGUE DOIT SAVOIR
 DENSITOMÉTRIE OSSEUSE : CE QUE LE RADIOLOGUE DOIT SAVOIR C Andreux et F L Huillier H Guerini, A Feydy, X Poittevin, F Thevenin, R Campagna, JL Drapé, A Chevrot Hôpital COCHIN, Paris, France OBJECTIF Proposer
DENSITOMÉTRIE OSSEUSE : CE QUE LE RADIOLOGUE DOIT SAVOIR C Andreux et F L Huillier H Guerini, A Feydy, X Poittevin, F Thevenin, R Campagna, JL Drapé, A Chevrot Hôpital COCHIN, Paris, France OBJECTIF Proposer
COMMISSION DE LA TRANSPARENCE AVIS. 23 mai 2012
 COMMISSION DE LA TRANSPARENCE AVIS 23 mai 2012 SEGLOR 5 mg, gélule B/30 (CIP: 321 899-8) SEGLOR LYOC 5 mg, lyophilisat oral B/30 (CIP: 334 062-4) Laboratoire UCB PHARMA dihydroergotamine (mésilate de)
COMMISSION DE LA TRANSPARENCE AVIS 23 mai 2012 SEGLOR 5 mg, gélule B/30 (CIP: 321 899-8) SEGLOR LYOC 5 mg, lyophilisat oral B/30 (CIP: 334 062-4) Laboratoire UCB PHARMA dihydroergotamine (mésilate de)
COMMISSION DE LA TRANSPARENCE
 COMMISSION DE LA TRANSPARENCE Avis 2 avril 2014 DERMOVAL, gel flacon de 20 ml (CIP : 34009 326 130 4 5) DERMOVAL 0,05 POUR CENT, crème tube de 10 g (CIP : 34009 320 432 9 3) Laboratoire GLAXOSMITHKLINE
COMMISSION DE LA TRANSPARENCE Avis 2 avril 2014 DERMOVAL, gel flacon de 20 ml (CIP : 34009 326 130 4 5) DERMOVAL 0,05 POUR CENT, crème tube de 10 g (CIP : 34009 320 432 9 3) Laboratoire GLAXOSMITHKLINE
COMMISSION DE LA TRANSPARENCE AVIS. 1 er octobre 2008
 COMMISSION DE LA TRANSPARENCE AVIS 1 er octobre 2008 Examen dans le cadre de la réévaluation du service médical rendu de la classe des IMAO B, en application de l article R 163-21 du code de la sécurité
COMMISSION DE LA TRANSPARENCE AVIS 1 er octobre 2008 Examen dans le cadre de la réévaluation du service médical rendu de la classe des IMAO B, en application de l article R 163-21 du code de la sécurité
Avis 29 mai 2013. XYZALL 5 mg, comprimé B/14 (CIP : 34009 358 502 4-9) B/28 (CIP : 34009 358 505 3-9) Laboratoire UCB PHARMA SA.
 COMMISSION DE LA TRANSPARENCE Avis 29 mai 2013 XYZALL 5 mg, comprimé B/14 (CIP : 34009 358 502 4-9) B/28 (CIP : 34009 358 505 3-9) Laboratoire UCB PHARMA SA DCI Code ATC (2012) Motif de l examen Liste
COMMISSION DE LA TRANSPARENCE Avis 29 mai 2013 XYZALL 5 mg, comprimé B/14 (CIP : 34009 358 502 4-9) B/28 (CIP : 34009 358 505 3-9) Laboratoire UCB PHARMA SA DCI Code ATC (2012) Motif de l examen Liste
COMMISSION DE LA TRANSPARENCE AVIS. 19 octobre 2011
 COMMISSION DE LA TRANSPARENCE AVIS 19 octobre 2011 PEDIAVEN AP-HP G15, solution pour perfusion 1000 ml de solution en poche bi-compartiment, boîte de 4 (CIP: 419 999-0) PEDIAVEN AP-HP G20, solution pour
COMMISSION DE LA TRANSPARENCE AVIS 19 octobre 2011 PEDIAVEN AP-HP G15, solution pour perfusion 1000 ml de solution en poche bi-compartiment, boîte de 4 (CIP: 419 999-0) PEDIAVEN AP-HP G20, solution pour
Avis 23 avril 2014. BARITEKAL 20 mg/ml, solution injectable Boîte de 10 ampoules de 5 ml (CIP : 34009 585 896 3 8) Laboratoire NORDIC PHARMA
 COMMISSION DE LA TRANSPARENCE Avis 23 avril 2014 BARITEKAL 20 mg/ml, solution injectable Boîte de 10 ampoules de 5 ml (CIP : 34009 585 896 3 8) Laboratoire NORDIC PHARMA DCI Code ATC (2012) Motif de l
COMMISSION DE LA TRANSPARENCE Avis 23 avril 2014 BARITEKAL 20 mg/ml, solution injectable Boîte de 10 ampoules de 5 ml (CIP : 34009 585 896 3 8) Laboratoire NORDIC PHARMA DCI Code ATC (2012) Motif de l
TRAITEMENT MEDICAMENTEUX DE L OSTÉOPOROSE CORTISONIQUE
 Recommandation de Bonne Pratique TRAITEMENT MEDICAMENTEUX DE L OSTÉOPOROSE CORTISONIQUE RECOMMANDATIONS 1 GROUPE DE TRAVAIL Docteur Christian ROUX, Président, Rhumatologue, Paris Docteur Bertrand MOURA,
Recommandation de Bonne Pratique TRAITEMENT MEDICAMENTEUX DE L OSTÉOPOROSE CORTISONIQUE RECOMMANDATIONS 1 GROUPE DE TRAVAIL Docteur Christian ROUX, Président, Rhumatologue, Paris Docteur Bertrand MOURA,
Accidents des anticoagulants
 30 Item 182 Accidents des anticoagulants Insérer les T1 Objectifs pédagogiques ENC Diagnostiquer un accident des anticoagulants. Identifier les situations d urgence et planifier leur prise en charge. COFER
30 Item 182 Accidents des anticoagulants Insérer les T1 Objectifs pédagogiques ENC Diagnostiquer un accident des anticoagulants. Identifier les situations d urgence et planifier leur prise en charge. COFER
COMMISSION DE LA TRANSPARENCE. Avis. 23 mai 2007
 COMMISSION DE LA TRANSPARENCE Avis 23 mai 2007 SUTENT 12,5 mg, gélule Flacon de 30 (CIP: 376 265-0) SUTENT 25 mg, gélule Flacon de 30 (CIP: 376 266-7) SUTENT 50 mg, gélule Flacon de 30 (CIP: 376 267-3)
COMMISSION DE LA TRANSPARENCE Avis 23 mai 2007 SUTENT 12,5 mg, gélule Flacon de 30 (CIP: 376 265-0) SUTENT 25 mg, gélule Flacon de 30 (CIP: 376 266-7) SUTENT 50 mg, gélule Flacon de 30 (CIP: 376 267-3)
Item 169 : Évaluation thérapeutique et niveau de preuve
 Item 169 : Évaluation thérapeutique et niveau de preuve COFER, Collège Français des Enseignants en Rhumatologie Date de création du document 2010-2011 Table des matières ENC :...3 SPECIFIQUE :...3 I Différentes
Item 169 : Évaluation thérapeutique et niveau de preuve COFER, Collège Français des Enseignants en Rhumatologie Date de création du document 2010-2011 Table des matières ENC :...3 SPECIFIQUE :...3 I Différentes
journées chalonnaises de la thrombose
 Nos connaissances certaines et notre pratique journalière : Les Nouveaux Anticoagulants dans la thromboprophylaxie de la chirurgie prothétique du MI Benoit Cots et Jean Marc Royer le 29/11/12-1 Recommandations
Nos connaissances certaines et notre pratique journalière : Les Nouveaux Anticoagulants dans la thromboprophylaxie de la chirurgie prothétique du MI Benoit Cots et Jean Marc Royer le 29/11/12-1 Recommandations
COMMISSION DE LA TRANSPARENCE. 10 décembre 2008
 COMMISSION DE LA TRANSPARENCE AVIS 10 décembre 2008 VIRAFERONPEG 50 µg/ 0.5 ml, poudre et solvant pour solution injectable B/1 : code CIP 355 189.3 B/4 : code CIP 355 191.8 VIRAFERONPEG, stylo pré-rempli
COMMISSION DE LA TRANSPARENCE AVIS 10 décembre 2008 VIRAFERONPEG 50 µg/ 0.5 ml, poudre et solvant pour solution injectable B/1 : code CIP 355 189.3 B/4 : code CIP 355 191.8 VIRAFERONPEG, stylo pré-rempli
COMMISSION DE LA TRANSPARENCE. Avis. 3 septembre 2008
 COMMISSION DE LA TRANSPARENCE Avis 3 septembre 2008 PRIVIGEN 100 mg/ml, solution pour perfusion Flacon en verre de 50 ml (CIP: 572 790-7 Flacon en verre de 100 ml (CIP: 572 791-3) Flacon en verre de 200
COMMISSION DE LA TRANSPARENCE Avis 3 septembre 2008 PRIVIGEN 100 mg/ml, solution pour perfusion Flacon en verre de 50 ml (CIP: 572 790-7 Flacon en verre de 100 ml (CIP: 572 791-3) Flacon en verre de 200
COMMISSION DE LA TRANSPARENCE AVIS. 7 janvier 2009
 COMMISSION DE LA TRANSPARENCE AVIS 7 janvier 2009 ZANEXTRA 20 mg/10 mg, comprimés pelliculés B/30, code CIP : 385 967.4 B/90, code CIP : 387 392.9 Laboratoires BOUCHARA RECORDATI Enalapril/Lercanidipine
COMMISSION DE LA TRANSPARENCE AVIS 7 janvier 2009 ZANEXTRA 20 mg/10 mg, comprimés pelliculés B/30, code CIP : 385 967.4 B/90, code CIP : 387 392.9 Laboratoires BOUCHARA RECORDATI Enalapril/Lercanidipine
COMMISSION DE LA TRANSPARENCE AVIS. 31 janvier 2007
 COMMISSION DE LA TRANSPARENCE AVIS 31 janvier 2007 NEUPRO 2 mg/24 h dispositif transdermique Sachet-dose, B/30 : 377 209-7 Sachet-dose, B/90 : 570 143-4 NEUPRO 4 mg/24 h dispositif transdermique Sachet-dose,
COMMISSION DE LA TRANSPARENCE AVIS 31 janvier 2007 NEUPRO 2 mg/24 h dispositif transdermique Sachet-dose, B/30 : 377 209-7 Sachet-dose, B/90 : 570 143-4 NEUPRO 4 mg/24 h dispositif transdermique Sachet-dose,
1 - Que faut-il retenir sur les anticoagulants oraux?
 La nouvelle convention pharmaceutique offre l opportunité aux pharmaciens d accompagner les patients traités par anticoagulants oraux au long cours afin de prévenir les risques iatrogéniques. Les anticoagulants
La nouvelle convention pharmaceutique offre l opportunité aux pharmaciens d accompagner les patients traités par anticoagulants oraux au long cours afin de prévenir les risques iatrogéniques. Les anticoagulants
LIGNES DIRECTRICES CLINIQUES TOUT AU LONG DU CONTINUUM DE SOINS : Objectif de ce chapitre. 6.1 Introduction 86
 LIGNES DIRECTRICES CLINIQUES TOUT AU LONG DU CONTINUUM DE SOINS : ÉTABLISSEMENT DE LIENS ENTRE LES PERSONNES CHEZ QUI UN DIAGNOSTIC D INFECTION À VIH A ÉTÉ POSÉ ET LES SERVICES DE SOINS ET DE TRAITEMENT
LIGNES DIRECTRICES CLINIQUES TOUT AU LONG DU CONTINUUM DE SOINS : ÉTABLISSEMENT DE LIENS ENTRE LES PERSONNES CHEZ QUI UN DIAGNOSTIC D INFECTION À VIH A ÉTÉ POSÉ ET LES SERVICES DE SOINS ET DE TRAITEMENT
Placebo Effet Placebo. Pr Claire Le Jeunne Hôtel Dieu- Médecine Interne et Thérapeutique Faculté de Médecine Paris Descartes
 Placebo Effet Placebo Pr Claire Le Jeunne Hôtel Dieu- Médecine Interne et Thérapeutique Faculté de Médecine Paris Descartes Plan Définitions Placebo dans les essais thérapeutiques Effet placebo Médicaments
Placebo Effet Placebo Pr Claire Le Jeunne Hôtel Dieu- Médecine Interne et Thérapeutique Faculté de Médecine Paris Descartes Plan Définitions Placebo dans les essais thérapeutiques Effet placebo Médicaments
Document d orientation sur les allégations issues d essais de non-infériorité
 Document d orientation sur les allégations issues d essais de non-infériorité Février 2013 1 Liste de contrôle des essais de non-infériorité N o Liste de contrôle (les clients peuvent se servir de cette
Document d orientation sur les allégations issues d essais de non-infériorité Février 2013 1 Liste de contrôle des essais de non-infériorité N o Liste de contrôle (les clients peuvent se servir de cette
Assurance Maladie Obligatoire Commission de la Transparence des médicaments. Avis 2 23 Octobre 2012
 Assurance Maladie Obligatoire Commission de la Transparence des médicaments Avis 2 23 Octobre 2012 Titre I : Nom du médicament, DCI, forme pharmaceutique, dosage, présentation HUMIRA (DCI : Adalimumab
Assurance Maladie Obligatoire Commission de la Transparence des médicaments Avis 2 23 Octobre 2012 Titre I : Nom du médicament, DCI, forme pharmaceutique, dosage, présentation HUMIRA (DCI : Adalimumab
COMMISSION DE LA TRANSPARENCE AVIS. 14 mars 2012
 COMMISSION DE LA TRANSPARENCE AVIS 14 mars 2012 XARELTO 15 mg, comprimés pelliculés B/14 (CIP: 34009 219 225 1 6) B/28 (CIP: 34009 219 226 8 4) B/42 (CIP: 34009 219 227 4 5) B/10 (CIP: 34009 219 228 0
COMMISSION DE LA TRANSPARENCE AVIS 14 mars 2012 XARELTO 15 mg, comprimés pelliculés B/14 (CIP: 34009 219 225 1 6) B/28 (CIP: 34009 219 226 8 4) B/42 (CIP: 34009 219 227 4 5) B/10 (CIP: 34009 219 228 0
Catherine Prost Squarcioni Centre de Références Maladies Rares NET-DBAI-IDF Hôpital Saint Louis et hôpital Avicenne
 1 PREVENTION DES COMPLICATIONS DE LA CORTICOTHERAPIE GENERALE DANS LES PEMPHIGUS DE L ADULTE Catherine Prost Squarcioni Centre de Références Maladies Rares NET-DBAI-IDF Hôpital Saint Louis et hôpital Avicenne
1 PREVENTION DES COMPLICATIONS DE LA CORTICOTHERAPIE GENERALE DANS LES PEMPHIGUS DE L ADULTE Catherine Prost Squarcioni Centre de Références Maladies Rares NET-DBAI-IDF Hôpital Saint Louis et hôpital Avicenne
1- Parmi les affirmations suivantes, quelles sont les réponses vraies :
 1- Parmi les affirmations suivantes, quelles sont les réponses vraies : a. Les troubles fonctionnels digestifs sont définis par les critères de Paris b. En France, le syndrome de l intestin irritable touche
1- Parmi les affirmations suivantes, quelles sont les réponses vraies : a. Les troubles fonctionnels digestifs sont définis par les critères de Paris b. En France, le syndrome de l intestin irritable touche
Plan. Introduction. Les Nouveaux Anticoagulants Oraux et le sujet âgé. Audit de prescription au Centre Hospitalier Geriatrique du Mont d Or
 Plan Introduction Les Nouveaux Anticoagulants Oraux et le sujet âgé Audit de prescription au Centre Hospitalier Geriatrique du Mont d Or Introduction NACO: une actualité brûlante! AVK: Plus forte incidence
Plan Introduction Les Nouveaux Anticoagulants Oraux et le sujet âgé Audit de prescription au Centre Hospitalier Geriatrique du Mont d Or Introduction NACO: une actualité brûlante! AVK: Plus forte incidence
Pharmacologie des «nouveaux» anticoagulants oraux
 Pharmacologie des «nouveaux» anticoagulants oraux Apixaban, Dabigatran, Rivaroxaban Pr D. DEPLANQUE Département de Pharmacologie médicale EA 1046 et CIC 9301 INSERM-CHRU, Institut de Médecine Prédictive
Pharmacologie des «nouveaux» anticoagulants oraux Apixaban, Dabigatran, Rivaroxaban Pr D. DEPLANQUE Département de Pharmacologie médicale EA 1046 et CIC 9301 INSERM-CHRU, Institut de Médecine Prédictive
23. Interprétation clinique des mesures de l effet traitement
 23. Interprétation clinique des mesures de l effet traitement 23.1. Critères de jugement binaires Plusieurs mesures (indices) sont utilisables pour quantifier l effet traitement lors de l utilisation d
23. Interprétation clinique des mesures de l effet traitement 23.1. Critères de jugement binaires Plusieurs mesures (indices) sont utilisables pour quantifier l effet traitement lors de l utilisation d
Observation. Merci à l équipe de pharmaciens FormUtip iatro pour ce cas
 Cas clinique M. ZAC Observation Mr ZAC ans, 76 ans, 52 kg, est admis aux urgences pour des algies fessières invalidantes, résistantes au AINS. Ses principaux antécédents sont les suivants : une thrombopénie
Cas clinique M. ZAC Observation Mr ZAC ans, 76 ans, 52 kg, est admis aux urgences pour des algies fessières invalidantes, résistantes au AINS. Ses principaux antécédents sont les suivants : une thrombopénie
Marseille 25 octobre 2012 Accompagnement du traitement chez les co-infectés VHC-VIH en pratique
 Marseille 25 octobre 2012 Accompagnement du traitement chez les co-infectés VHC-VIH en pratique Dominique Larrey Service d Hépatogastroenterologie et transplantation Hôpital Saint Eloi CHU Montpellier
Marseille 25 octobre 2012 Accompagnement du traitement chez les co-infectés VHC-VIH en pratique Dominique Larrey Service d Hépatogastroenterologie et transplantation Hôpital Saint Eloi CHU Montpellier
ANNEXE I RESUME DES CARACTERISTIQUES DU PRODUIT
 ANNEXE I RESUME DES CARACTERISTIQUES DU PRODUIT 1 1. DENOMINATION DU MÉDICAMENT Betaferon 250 microgrammes/ml, poudre et solvant pour solution injectable. 2. COMPOSITION QUALITATIVE ET QUANTITATIVE Interféron
ANNEXE I RESUME DES CARACTERISTIQUES DU PRODUIT 1 1. DENOMINATION DU MÉDICAMENT Betaferon 250 microgrammes/ml, poudre et solvant pour solution injectable. 2. COMPOSITION QUALITATIVE ET QUANTITATIVE Interféron
EVALUATION DES METHODES D AIDE A L ARRET DU TABAGISME
 EVALUATION DES METHODES D AIDE A L ARRET DU TABAGISME Docteur Jean PERRIOT Dispensaire Emile Roux Clermont-Ferrand [email protected] DIU Tabacologie Clermont-Ferrand - 2015 NOTIONS GENERALES INTRODUCTION.
EVALUATION DES METHODES D AIDE A L ARRET DU TABAGISME Docteur Jean PERRIOT Dispensaire Emile Roux Clermont-Ferrand [email protected] DIU Tabacologie Clermont-Ferrand - 2015 NOTIONS GENERALES INTRODUCTION.
Le traitement du paludisme d importation de l enfant est une urgence
 Le traitement du paludisme d importation de l enfant est une urgence Dominique GENDREL Necker-Enfants Malades Traiter en urgence en présence de trophozoïtes Plus de 80% des paludismes d importation en
Le traitement du paludisme d importation de l enfant est une urgence Dominique GENDREL Necker-Enfants Malades Traiter en urgence en présence de trophozoïtes Plus de 80% des paludismes d importation en
Critères de Choix d une Echelle de Qualité De Vie. Etudes cliniques dans l autisme. Introduction
 Critères de Choix d une Echelle de Qualité De Vie Etudes cliniques dans l autisme Marie-Christine Picot Congrès Epsylon 5 avril 2013 Introduction Mesurer la Qualité de Vie liée à la Santé : Evaluer les
Critères de Choix d une Echelle de Qualité De Vie Etudes cliniques dans l autisme Marie-Christine Picot Congrès Epsylon 5 avril 2013 Introduction Mesurer la Qualité de Vie liée à la Santé : Evaluer les
Programme commun d'évaluation des médicaments Sommaire
 Programme commun d'évaluation des médicaments Sommaire Juillet 2015 Médicament élosulfase alfa (Vimizim) (2 mg/kg) Indication Enzymothérapie substitutive à long terme dans le traitement de la mucopolysaccharidose
Programme commun d'évaluation des médicaments Sommaire Juillet 2015 Médicament élosulfase alfa (Vimizim) (2 mg/kg) Indication Enzymothérapie substitutive à long terme dans le traitement de la mucopolysaccharidose
NAVELBINE voie orale
 DENOMINATION DU MEDICAMENT & FORME PHARMACEUTIQUE NAVELBINE voie orale CARACTERISTIQUES Dénomination commune : vinorelbine Composition qualitative et quantitative : Statut : A.M.M. A.T.U. Classe ATC :
DENOMINATION DU MEDICAMENT & FORME PHARMACEUTIQUE NAVELBINE voie orale CARACTERISTIQUES Dénomination commune : vinorelbine Composition qualitative et quantitative : Statut : A.M.M. A.T.U. Classe ATC :
vaccin pneumococcique polyosidique conjugué (13-valent, adsorbé)
 EMA/90006/2015 EMEA/H/C/001104 Résumé EPAR à l intention du public vaccin pneumococcique polyosidique conjugué (13-valent, adsorbé) Le présent document est un résumé du rapport européen public d évaluation
EMA/90006/2015 EMEA/H/C/001104 Résumé EPAR à l intention du public vaccin pneumococcique polyosidique conjugué (13-valent, adsorbé) Le présent document est un résumé du rapport européen public d évaluation
Les nouveaux anticoagulants oraux, FA et AVC. Docteur Thalie TRAISSAC Hôpital Saint André CAPCV 15 février 2014
 Les nouveaux anticoagulants oraux, FA et AVC Docteur Thalie TRAISSAC Hôpital Saint André CAPCV 15 février 2014 Un AVC toutes les 4 minutes 1 130 000 AVC par an en France 1 770 000 personnes ont été victimes
Les nouveaux anticoagulants oraux, FA et AVC Docteur Thalie TRAISSAC Hôpital Saint André CAPCV 15 février 2014 Un AVC toutes les 4 minutes 1 130 000 AVC par an en France 1 770 000 personnes ont été victimes
I Identification du bénéficiaire (nom, prénom, N d affiliation à l O.A.) : II Eléments à attester par un médecin spécialiste en rhumatologie :
 ANNEXE A : Formulaire de première demande Formulaire de première demande de remboursement de la spécialité HUMIRA pour une spondylarthrite axiale sévère sans signes radiographiques de spondylarthrite ankylosante
ANNEXE A : Formulaire de première demande Formulaire de première demande de remboursement de la spécialité HUMIRA pour une spondylarthrite axiale sévère sans signes radiographiques de spondylarthrite ankylosante
NOTICE: INFORMATION DE L UTILISATEUR. Immukine 100 microgrammes/0,5 ml solution injectable (Interféron gamma-1b recombinant humain)
 NOTICE: INFORMATION DE L UTILISATEUR Immukine 100 microgrammes/0,5 ml solution injectable (Interféron gamma-1b recombinant humain) Veuillez lire attentivement l'intégralité de cette notice avant d'utiliser
NOTICE: INFORMATION DE L UTILISATEUR Immukine 100 microgrammes/0,5 ml solution injectable (Interféron gamma-1b recombinant humain) Veuillez lire attentivement l'intégralité de cette notice avant d'utiliser
Point d information Avril 2012. Les nouveaux anticoagulants oraux (dabigatran et rivaroxaban) dans la fibrillation auriculaire : ce qu il faut savoir
 Point d information Avril 2012 Les nouveaux anticoagulants oraux (dabigatran et rivaroxaban) dans la fibrillation auriculaire : ce qu il faut savoir Le dabigatran (PRADAXA), inhibiteur direct de la thrombine,
Point d information Avril 2012 Les nouveaux anticoagulants oraux (dabigatran et rivaroxaban) dans la fibrillation auriculaire : ce qu il faut savoir Le dabigatran (PRADAXA), inhibiteur direct de la thrombine,
ACTUALITES THERAPEUTIQUES. Dr Sophie PITTION (CHU Nancy) Metz, le 2 Juin 2012
 ACTUALITES THERAPEUTIQUES Dr Sophie PITTION (CHU Nancy) Metz, le 2 Juin 2012 Traitement de fond Objectifs: Réduire le nombre de poussées Arrêter ou freiner la progression du handicap Les traitements disponibles
ACTUALITES THERAPEUTIQUES Dr Sophie PITTION (CHU Nancy) Metz, le 2 Juin 2012 Traitement de fond Objectifs: Réduire le nombre de poussées Arrêter ou freiner la progression du handicap Les traitements disponibles
Essais cliniques de phase 0 : état de la littérature 2006-2009
 17 èmes Journées des Statisticiens des Centres de Lutte contre le Cancer 4 ème Conférence Francophone d Epidémiologie Clinique Essais cliniques de phase 0 : état de la littérature 2006-2009 Q Picat, N
17 èmes Journées des Statisticiens des Centres de Lutte contre le Cancer 4 ème Conférence Francophone d Epidémiologie Clinique Essais cliniques de phase 0 : état de la littérature 2006-2009 Q Picat, N
Les nouveaux anticoagulants oraux (NAC)
 Les nouveaux anticoagulants oraux (NAC) Dr Jean-Marie Vailloud Cardiologue libéral/ salarié (CHU/clinique) Pas de lien d'intérêt avec une entreprise pharmaceutique Adhérent à l'association Mieux Prescrire
Les nouveaux anticoagulants oraux (NAC) Dr Jean-Marie Vailloud Cardiologue libéral/ salarié (CHU/clinique) Pas de lien d'intérêt avec une entreprise pharmaceutique Adhérent à l'association Mieux Prescrire
Pharmacovigilance des nouveaux anticoagulants oraux
 Pharmacovigilance des nouveaux anticoagulants oraux Dr A.Lillo-Le Louët, Centre Régional de Pharmacovigilance (CRPV) Paris-HEGP Avec avec Dr P.Lainé, CRPV - Angers Préambule Directeur du Centre Régional
Pharmacovigilance des nouveaux anticoagulants oraux Dr A.Lillo-Le Louët, Centre Régional de Pharmacovigilance (CRPV) Paris-HEGP Avec avec Dr P.Lainé, CRPV - Angers Préambule Directeur du Centre Régional
Ostéoporose au cours des hépatopathies chroniques en 2006
 Ostéoporose au cours des hépatopathies chroniques en 2006 Gérard Chalès Service de Rhumatologie, CHU Rennes Hôpital Sud, Rennes Points clés L ostéoporose et non l ostéomalacie est la complication la plus
Ostéoporose au cours des hépatopathies chroniques en 2006 Gérard Chalès Service de Rhumatologie, CHU Rennes Hôpital Sud, Rennes Points clés L ostéoporose et non l ostéomalacie est la complication la plus
COMMISSION DE LA TRANSPARENCE AVIS. 18 novembre 2009
 COMMISSION DE LA TRANSPARENCE AVIS 18 novembre 2009 LEDERTREXATE 5 mg, solution injectable B/1 ampoule de 2 ml (Code CIP : 315 012-5) LEDERTREXATE 25 mg, solution injectable B/1 ampoule de 1 ml (Code CIP
COMMISSION DE LA TRANSPARENCE AVIS 18 novembre 2009 LEDERTREXATE 5 mg, solution injectable B/1 ampoule de 2 ml (Code CIP : 315 012-5) LEDERTREXATE 25 mg, solution injectable B/1 ampoule de 1 ml (Code CIP
XARELTO (RIVAROXABAN) 2,5 MG - 15 MG - 20 MG, COMPRIMÉS PELLICULÉS GUIDE DE PRESCRIPTION
 Les autorités de santé de l Union Européenne ont assorti la mise sur le marché du médicament Xarelto 2,5 mg; 15 mg et 20 mg de certaines conditions. Le plan obligatoire de minimisation des risques en Belgique
Les autorités de santé de l Union Européenne ont assorti la mise sur le marché du médicament Xarelto 2,5 mg; 15 mg et 20 mg de certaines conditions. Le plan obligatoire de minimisation des risques en Belgique
Item 182 : Accidents des anticoagulants
 Item 182 : Accidents des anticoagulants COFER, Collège Français des Enseignants en Rhumatologie Date de création du document 2010-2011 Table des matières ENC :...3 SPECIFIQUE :...3 I Cruralgie par hématome
Item 182 : Accidents des anticoagulants COFER, Collège Français des Enseignants en Rhumatologie Date de création du document 2010-2011 Table des matières ENC :...3 SPECIFIQUE :...3 I Cruralgie par hématome
27 ème JOURNEE SPORT ET MEDECINE Dr Roukos ABI KHALIL Digne Les Bains 23 novembre 2013
 27 ème JOURNEE SPORT ET MEDECINE Dr Roukos ABI KHALIL Digne Les Bains 23 novembre 2013 Les Nouveaux Anticoagulants Oraux (NACO) dans la maladie thrombo embolique veineuse INTRODUCTION Thrombose veineuse
27 ème JOURNEE SPORT ET MEDECINE Dr Roukos ABI KHALIL Digne Les Bains 23 novembre 2013 Les Nouveaux Anticoagulants Oraux (NACO) dans la maladie thrombo embolique veineuse INTRODUCTION Thrombose veineuse
{ Introduction. Proposition GIHP 05/12/2014
 Etude descriptive des accidents hémorragiques sous Nouveaux Anticoagulants Oraux au Service d Accueil des Urgences du CHU de Besançon entre janvier 2012 et janvier 2014 { Dr Claire KANY SAMU Besançon KEPKA
Etude descriptive des accidents hémorragiques sous Nouveaux Anticoagulants Oraux au Service d Accueil des Urgences du CHU de Besançon entre janvier 2012 et janvier 2014 { Dr Claire KANY SAMU Besançon KEPKA
Nouveaux anticoagulants oraux : aspects pratiques
 Nouveaux anticoagulants oraux : aspects pratiques Christelle MARQUIE CHRU de Lille Clinique de Cardiologie L i l l e 2 Université du Droit et de la Santé Les NOAG: QCM 1. ont les mêmes indications que
Nouveaux anticoagulants oraux : aspects pratiques Christelle MARQUIE CHRU de Lille Clinique de Cardiologie L i l l e 2 Université du Droit et de la Santé Les NOAG: QCM 1. ont les mêmes indications que
Assurance Maladie Obligatoire Commission de la Transparence des médicaments. Avis 1 23 Octobre 2012
 Assurance Maladie Obligatoire Commission de la Transparence des médicaments Avis 1 23 Octobre 2012 Titre I : Nom du médicament, DCI, Forme pharmaceutique, Dosage, Présentation - ARANESP 10 µg, Darbépoétine
Assurance Maladie Obligatoire Commission de la Transparence des médicaments Avis 1 23 Octobre 2012 Titre I : Nom du médicament, DCI, Forme pharmaceutique, Dosage, Présentation - ARANESP 10 µg, Darbépoétine
SUAREZ VALENCIA Juan Sebastian @toolsdoc MARCHAND Guillaume @drguiloo dmdpost.com Résumé Hélène Caillault
 ATELIER THEMATIQUE : APPLICATIONS POUR TABLETTES ET SMARTPHONES SUAREZ VALENCIA Juan Sebastian @toolsdoc MARCHAND Guillaume @drguiloo dmdpost.com Résumé Hélène Caillault INTRODUCTION La santé mobile, c
ATELIER THEMATIQUE : APPLICATIONS POUR TABLETTES ET SMARTPHONES SUAREZ VALENCIA Juan Sebastian @toolsdoc MARCHAND Guillaume @drguiloo dmdpost.com Résumé Hélène Caillault INTRODUCTION La santé mobile, c
Les facteurs de croissance lignée blanche Polynucléaires neutrophiles Grastims
 Les facteurs de croissance lignée blanche Polynucléaires neutrophiles Grastims 12 2014 HEMATOPOIESE Progéniteurs puis précurseurs Stimulation par facteur : activation spécifique de leur récepteur Moelle
Les facteurs de croissance lignée blanche Polynucléaires neutrophiles Grastims 12 2014 HEMATOPOIESE Progéniteurs puis précurseurs Stimulation par facteur : activation spécifique de leur récepteur Moelle
Fibrillation atriale chez le sujet âgé
 Dr Benoit Blanchard LE HAVRE Le 18 MARS 2014 Fibrillation atriale chez le sujet âgé Le plus fréquent des trouble du rythme cardiaque, 750,000 personnes atteintes de FA en France, 100,000 nouveaux cas chaque
Dr Benoit Blanchard LE HAVRE Le 18 MARS 2014 Fibrillation atriale chez le sujet âgé Le plus fréquent des trouble du rythme cardiaque, 750,000 personnes atteintes de FA en France, 100,000 nouveaux cas chaque
Implantologie et Bisphosphonates
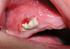 Société Française de Stomatologie et Chirurgie Maxillo-Faciale DD Implantologie et Bisphosphonates Recommandations de Bonne Pratique Juillet 2012 1 SOMMAIRE INTRODUCTION... 3 CONTEXTE... 5 BISPHOSPHONATES
Société Française de Stomatologie et Chirurgie Maxillo-Faciale DD Implantologie et Bisphosphonates Recommandations de Bonne Pratique Juillet 2012 1 SOMMAIRE INTRODUCTION... 3 CONTEXTE... 5 BISPHOSPHONATES
EVALUATION DES TECHNOLOGIES DE SANTÉ ANALYSE MÉDICO-ÉCONOMIQUE. Efficacité et efficience des hypolipémiants Une analyse centrée sur les statines
 EVALUATION DES TECHNOLOGIES DE SANTÉ ANALYSE MÉDICO-ÉCONOMIQUE Efficacité et efficience des hypolipémiants Une analyse centrée sur les statines Juillet 2010 Mise à jour Septembre 2010 1 Le rapport complet
EVALUATION DES TECHNOLOGIES DE SANTÉ ANALYSE MÉDICO-ÉCONOMIQUE Efficacité et efficience des hypolipémiants Une analyse centrée sur les statines Juillet 2010 Mise à jour Septembre 2010 1 Le rapport complet
INTERFERON Traitement adjuvant du mélanome à haut risque de récidive. Dr Ingrid KUPFER-BESSAGUET Dermatologue CH de quimper
 INTERFERON Traitement adjuvant du mélanome à haut risque de récidive Dr Ingrid KUPFER-BESSAGUET Dermatologue CH de quimper Pourquoi proposer un TTT adjuvant? Probabilité de survie à 10 ans en fonction
INTERFERON Traitement adjuvant du mélanome à haut risque de récidive Dr Ingrid KUPFER-BESSAGUET Dermatologue CH de quimper Pourquoi proposer un TTT adjuvant? Probabilité de survie à 10 ans en fonction
COMMISSION DE LA TRANSPARENCE AVIS. 1 décembre 2010
 COMMISSION DE LA TRANSPARENCE AVIS 1 décembre 2010 MENVEO, poudre et solution pour injection Vaccin méningococcique des groupes A, C, W-135 et Y conjugué B/1 flacon + 1 seringue préremplie (CIP: 360 379-1)
COMMISSION DE LA TRANSPARENCE AVIS 1 décembre 2010 MENVEO, poudre et solution pour injection Vaccin méningococcique des groupes A, C, W-135 et Y conjugué B/1 flacon + 1 seringue préremplie (CIP: 360 379-1)
EXEMPLE DE METHODOLOGIE POUR L ELABORATION D UN PROTOCOLE DOULEUR Marie AUBRY Infirmière référente douleur Hôpital TENON AP-HP Paris XX e SOMMAIRE
 EXEMPLE DE METHODOLOGIE POUR L ELABORATION D UN PROTOCOLE DOULEUR Marie AUBRY Infirmière référente douleur Hôpital TENON AP-HP Paris XX e SOMMAIRE Etape n 1 : Faire l état des lieux Identifier la situation
EXEMPLE DE METHODOLOGIE POUR L ELABORATION D UN PROTOCOLE DOULEUR Marie AUBRY Infirmière référente douleur Hôpital TENON AP-HP Paris XX e SOMMAIRE Etape n 1 : Faire l état des lieux Identifier la situation
Guide du parcours de soins Titre ACTES ET PRESTATIONS AFFECTION DE LONGUE DURÉE. Hépatite chronique B
 Guide du parcours de soins Titre ACTES ET PRESTATIONS AFFECTION DE LONGUE DURÉE Hépatite chronique B Février 2015 Ce document est téléchargeable sur : www.has-sante.fr Haute Autorité de Santé Service des
Guide du parcours de soins Titre ACTES ET PRESTATIONS AFFECTION DE LONGUE DURÉE Hépatite chronique B Février 2015 Ce document est téléchargeable sur : www.has-sante.fr Haute Autorité de Santé Service des
Semaine Sécurité des patients
 Bienvenue dans le «mystère de la chambre des erreurs»! Découvrez le tableau de synthèse des réponses du matériel nécessaire à la mise en place de la chambre des erreurs ainsi que les réponses attendues
Bienvenue dans le «mystère de la chambre des erreurs»! Découvrez le tableau de synthèse des réponses du matériel nécessaire à la mise en place de la chambre des erreurs ainsi que les réponses attendues
UTILISATION DES C.C.P DANS LES HEMORRAGIES SOUS AVK ET SOUS NACO : RECOMMANDATIONS DE L HAS COPACAMU 2014
 UTILISATION DES C.C.P DANS LES HEMORRAGIES SOUS AVK ET SOUS NACO : RECOMMANDATIONS DE L HAS SYMPOSIUM CSL BEHRING COPACAMU 2014 PROFESSEUR François BERTRAND CHU DE NICE CHRONOLOGIE DES RECOMMANDATIONS
UTILISATION DES C.C.P DANS LES HEMORRAGIES SOUS AVK ET SOUS NACO : RECOMMANDATIONS DE L HAS SYMPOSIUM CSL BEHRING COPACAMU 2014 PROFESSEUR François BERTRAND CHU DE NICE CHRONOLOGIE DES RECOMMANDATIONS
Spondylarthropathies : diagnostic, place des anti-tnf et surveillance par le généraliste. Pr P. Claudepierre CHU Henri Mondor - Créteil
 Spondylarthropathies : diagnostic, place des anti-tnf et surveillance par le généraliste Pr P. Claudepierre CHU Henri Mondor - Créteil Le Diagnostic Objectif de la démarche diagnostique Diagnostic de SPONDYLARTHROPATHIE
Spondylarthropathies : diagnostic, place des anti-tnf et surveillance par le généraliste Pr P. Claudepierre CHU Henri Mondor - Créteil Le Diagnostic Objectif de la démarche diagnostique Diagnostic de SPONDYLARTHROPATHIE
APPORT DE LA MICROKINESITHERAPIE DANS LES TMS
 APPORT DE LA MICROKINESITHERAPIE DANS LES TMS 10è Congrès International en Microkinésithérapie, Arcachon 2 juin 2012 André Bonté Daniel Grosjean Introduction: Cette étude a été lancée dans le cadre d'une
APPORT DE LA MICROKINESITHERAPIE DANS LES TMS 10è Congrès International en Microkinésithérapie, Arcachon 2 juin 2012 André Bonté Daniel Grosjean Introduction: Cette étude a été lancée dans le cadre d'une
OUTIL D'EVALUATION DU TEMPS ARC / CHEF DE PROJET PROMOTEUR REQUIS POUR UNE RECHERCHE BIOMEDICALE V 2.3 DE L OUTIL NOTICE D UTILISATION
 OUTIL D'EVALUATION DU TEMPS ARC / CHEF DE PROJET PROMOTEUR REQUIS POUR UNE RECHERCHE BIOMEDICALE V 2.3 DE L OUTIL NOTICE D UTILISATION i) Contexte :... - 2 - ii) But de l outil :... - 2 - iii) Fonctionnement
OUTIL D'EVALUATION DU TEMPS ARC / CHEF DE PROJET PROMOTEUR REQUIS POUR UNE RECHERCHE BIOMEDICALE V 2.3 DE L OUTIL NOTICE D UTILISATION i) Contexte :... - 2 - ii) But de l outil :... - 2 - iii) Fonctionnement
28 avril 2009 au 28 avril 2010
 Journée e Mondiale pour la Santé et la SécuritS curité au Travail 28 avril 2009 au 28 avril 2010 RECHERCE ACTION en Pays de Charleroi Evaluation des troubles musculo-squelettiques squelettiques Des travailleurs
Journée e Mondiale pour la Santé et la SécuritS curité au Travail 28 avril 2009 au 28 avril 2010 RECHERCE ACTION en Pays de Charleroi Evaluation des troubles musculo-squelettiques squelettiques Des travailleurs
Traitement de l hépatite C: données récentes
 Traitement de l hépatite C: données récentes J.-P. BRONOWICKI (Vandœuvre-lès-Nancy) Tirés à part : Jean-Pierre Bronowicki Service d Hépatogastroentérologie, CHU de Nancy, 54500 Vandœuvre-lès-Nancy. Le
Traitement de l hépatite C: données récentes J.-P. BRONOWICKI (Vandœuvre-lès-Nancy) Tirés à part : Jean-Pierre Bronowicki Service d Hépatogastroentérologie, CHU de Nancy, 54500 Vandœuvre-lès-Nancy. Le
Les médicaments génériques
 ASSURANCE COLLECTIVE Les médicaments génériques Leurs effets bénéfiques sur votre portefeuille Qu est-ce qu un médicament générique? Un médicament générique est l équivalent d une marque maison dans le
ASSURANCE COLLECTIVE Les médicaments génériques Leurs effets bénéfiques sur votre portefeuille Qu est-ce qu un médicament générique? Un médicament générique est l équivalent d une marque maison dans le
Cinq stratégies essentielles pour prendre soin de ses os après 50 ans. www.iofbonehealth.org
 Cinq stratégies essentielles pour prendre soin de ses os après 50 ans www.iofbonehealth.org QU EST-CE QUE L OSTÉOPOROSE? L ostéoporose est une maladie qui fragilise les os, conduisant à une augmentation
Cinq stratégies essentielles pour prendre soin de ses os après 50 ans www.iofbonehealth.org QU EST-CE QUE L OSTÉOPOROSE? L ostéoporose est une maladie qui fragilise les os, conduisant à une augmentation
Deux nouveaux anticoagulants oraux : Dabigatran et Rivaroxaban
 Deux nouveaux anticoagulants oraux : Dabigatran et Rivaroxaban Améliorations attendues et problèmes M.M. Samama, M-H. Horellou, J. Conard Groupe Hémostase-Thrombose Hôtel-Dieu L. Le Flem, C. Guinet, F.
Deux nouveaux anticoagulants oraux : Dabigatran et Rivaroxaban Améliorations attendues et problèmes M.M. Samama, M-H. Horellou, J. Conard Groupe Hémostase-Thrombose Hôtel-Dieu L. Le Flem, C. Guinet, F.
Ordonnance collective
 Centre de Santé et de Services sociaux de Québec-Nord NUMÉRO DE L ORDONNANCE: OC-31 Ordonnance collective Nom de l ordonnance: Initier des analyses de laboratoire pour le suivi de la clientèle présentant
Centre de Santé et de Services sociaux de Québec-Nord NUMÉRO DE L ORDONNANCE: OC-31 Ordonnance collective Nom de l ordonnance: Initier des analyses de laboratoire pour le suivi de la clientèle présentant
COMMISSION DE LA TRANSPARENCE AVIS. 29 février 2012
 COMMISSION DE LA TRANSPARENCE AVIS 29 février 2012 Le projet d avis adopté par la Commission de la Transparence le 14 décembre 2011 a fait l objet d une audition le 18 janvier 2012. L avis définitif a
COMMISSION DE LA TRANSPARENCE AVIS 29 février 2012 Le projet d avis adopté par la Commission de la Transparence le 14 décembre 2011 a fait l objet d une audition le 18 janvier 2012. L avis définitif a
ANNEXE IIIB NOTICE : INFORMATION DE L UTILISATEUR
 Dénomination du médicament ANNEXE IIIB NOTICE : INFORMATION DE L UTILISATEUR LYSOPAÏNE MAUX DE GORGE AMBROXOL CITRON 20 mg SANS SUCRE, pastille édulcorée au sorbitol et au sucralose. Chlorhydrate d ambroxol
Dénomination du médicament ANNEXE IIIB NOTICE : INFORMATION DE L UTILISATEUR LYSOPAÏNE MAUX DE GORGE AMBROXOL CITRON 20 mg SANS SUCRE, pastille édulcorée au sorbitol et au sucralose. Chlorhydrate d ambroxol
L arthrose, ses maux si on en parlait!
 REF 27912016 INFORMER UPSA BROCH ARTHROSE V2 08-12.indd 2 30/08/12 11:48 Qu est-ce que l arthrose? L arthrose est une maladie courante des articulations dont la fréquence augmente avec l âge. C est une
REF 27912016 INFORMER UPSA BROCH ARTHROSE V2 08-12.indd 2 30/08/12 11:48 Qu est-ce que l arthrose? L arthrose est une maladie courante des articulations dont la fréquence augmente avec l âge. C est une
ANNEXE I RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
 ANNEXE I RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT 1 1. DÉNOMINATION DU MÉDICAMENT Extavia 250 microgrammes/ml, poudre et solvant pour solution injectable. 2. COMPOSITION QUALITATIVE ET QUANTITATIVE Un flacon
ANNEXE I RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT 1 1. DÉNOMINATION DU MÉDICAMENT Extavia 250 microgrammes/ml, poudre et solvant pour solution injectable. 2. COMPOSITION QUALITATIVE ET QUANTITATIVE Un flacon
Nouveaux Anti-thrombotiques. Prof. Emmanuel OGER Pharmacovigilance Pharmaco-épidémiologie Faculté de Médecine Université de Rennes 1
 Nouveaux Anti-thrombotiques Prof. Emmanuel OGER Pharmacovigilance Pharmaco-épidémiologie Faculté de Médecine Université de Rennes 1 Classification Antithrombines directes o Ximélagatran EXANTA o Désirudine
Nouveaux Anti-thrombotiques Prof. Emmanuel OGER Pharmacovigilance Pharmaco-épidémiologie Faculté de Médecine Université de Rennes 1 Classification Antithrombines directes o Ximélagatran EXANTA o Désirudine
CONVENTION de COLLABORATION. La Mutuelle de Santé de Bignamou et. Le Centre de Santé de Bignamou
 CONVENTION de COLLABORATION entre La Mutuelle de Santé de Bignamou et Le Centre de Santé de Bignamou La mutuelle de Bignamou d une part, et le Centre de Santé de Bignamou d autre part, sont désireux de
CONVENTION de COLLABORATION entre La Mutuelle de Santé de Bignamou et Le Centre de Santé de Bignamou La mutuelle de Bignamou d une part, et le Centre de Santé de Bignamou d autre part, sont désireux de
Le prélèvement de moelle. osseuse. Agence relevant du ministère de la santé
 Le prélèvement de moelle osseuse Agence relevant du ministère de la santé Vous êtes compatible avec un patient qui a besoin d une greffe 1 Avant le prélèvement La date du prélèvement La date du prélèvement
Le prélèvement de moelle osseuse Agence relevant du ministère de la santé Vous êtes compatible avec un patient qui a besoin d une greffe 1 Avant le prélèvement La date du prélèvement La date du prélèvement
Traitement antibiotique probabiliste des urétrites et cervicites non compliquées
 Bon usage Mise au point Traitement antibiotique probabiliste des urétrites et cervicites non compliquées Actualisation Octobre 2008 MESSAGES CLÉS L évolution de la résistance du gonocoque aux quinolones
Bon usage Mise au point Traitement antibiotique probabiliste des urétrites et cervicites non compliquées Actualisation Octobre 2008 MESSAGES CLÉS L évolution de la résistance du gonocoque aux quinolones
ELABORATION DU PLAN DE MONITORING ADAPTE POUR UNE RECHERCHE BIOMEDICALE A PROMOTION INSTITUTIONNELLE
 Référence HCL : Titre de l étude : ELABORATION DU PLAN DE MONITORING ADAPTE POUR UNE RECHERCHE BIOMEDICALE A PROMOTION INSTITUTIONNELLE Investigateur Coordonnateur : Méthode. Définition du niveau de risque
Référence HCL : Titre de l étude : ELABORATION DU PLAN DE MONITORING ADAPTE POUR UNE RECHERCHE BIOMEDICALE A PROMOTION INSTITUTIONNELLE Investigateur Coordonnateur : Méthode. Définition du niveau de risque
L OSTÉOPOROSE INVOLUTIVE DE LA FEMME : STRATÉGIE THÉRAPEUTIQUE Un point de vue actualisé du Belgian Bone Club*
 L OSTÉOPOROSE INVOLUTIVE DE LA FEMME : STRATÉGIE THÉRAPEUTIQUE Un point de vue actualisé du Belgian Bone Club* J.M. Kaufman (1), J.J. Body (2), S. Boonen (3), J.P. Devogelaer (4), F. Raeman (5), S. Rozenberg
L OSTÉOPOROSE INVOLUTIVE DE LA FEMME : STRATÉGIE THÉRAPEUTIQUE Un point de vue actualisé du Belgian Bone Club* J.M. Kaufman (1), J.J. Body (2), S. Boonen (3), J.P. Devogelaer (4), F. Raeman (5), S. Rozenberg
Tableau récapitulatif : composition nutritionnelle de la spiruline
 Tableau récapitulatif : composition nutritionnelle de la spiruline (Valeur énergétique : 38 kcal/10 g) Composition nutritionnelle Composition pour 10 g Rôle Protéines (végétales) 55 à 70 % Construction
Tableau récapitulatif : composition nutritionnelle de la spiruline (Valeur énergétique : 38 kcal/10 g) Composition nutritionnelle Composition pour 10 g Rôle Protéines (végétales) 55 à 70 % Construction
Evaluation d un appareil quantitatif ultrasonore utilisant des matrices (Beam scanner):précision standardisée
 Evaluation d un appareil quantitatif ultrasonore utilisant des matrices (Beam scanner):précision standardisée M-A Gomez, M Nasser-Eddin, M Defontaine, B Giraudeau, F Jacquot, F Patat INTRODUCTION L ostéoporose
Evaluation d un appareil quantitatif ultrasonore utilisant des matrices (Beam scanner):précision standardisée M-A Gomez, M Nasser-Eddin, M Defontaine, B Giraudeau, F Jacquot, F Patat INTRODUCTION L ostéoporose
Semaine Sécurité des patients «Le mystère de la chambre des erreurs!»
 Semaine Sécurité des patients «Le mystère de la chambre des erreurs!» Vous avez été X à prendre le risque d entrer dans notre chambre des erreurs, à présent découvrez les erreurs ou risques potentiels
Semaine Sécurité des patients «Le mystère de la chambre des erreurs!» Vous avez été X à prendre le risque d entrer dans notre chambre des erreurs, à présent découvrez les erreurs ou risques potentiels
Le RIVAROXABAN (XARELTO ) dans l embolie pulmonaire
 Le RIVAROXABAN (XARELTO ) dans l embolie pulmonaire Dr Florence Parent Service de Pneumologie et Soins Intensifs de Pneumologie Hôpital Bicêtre, AP-HP Inserm U999. Université Paris-Sud Traitement anticoagulant
Le RIVAROXABAN (XARELTO ) dans l embolie pulmonaire Dr Florence Parent Service de Pneumologie et Soins Intensifs de Pneumologie Hôpital Bicêtre, AP-HP Inserm U999. Université Paris-Sud Traitement anticoagulant
La maladie de Still de l adulte
 La maladie de Still de l adulte Syndrome de Wissler-Fanconi La maladie Le diagnostic Le traitement, la prise en charge, la prévention Vivre avec En savoir plus Madame, Monsieur Cette fiche est destinée
La maladie de Still de l adulte Syndrome de Wissler-Fanconi La maladie Le diagnostic Le traitement, la prise en charge, la prévention Vivre avec En savoir plus Madame, Monsieur Cette fiche est destinée
COMMISSION DE LA TRANSPARENCE AVIS. 14 mars 2012
 COMMISSION DE LA TRANSPARENCE AVIS 14 mars 2012 XARELTO 15 mg, comprimés pelliculés B/14 (CIP: 34009 219 225 1 6) B/28 (CIP: 34009 219 226 8 4) B/42 (CIP: 34009 219 227 4 5) B/10 (CIP: 34009 219 228 0
COMMISSION DE LA TRANSPARENCE AVIS 14 mars 2012 XARELTO 15 mg, comprimés pelliculés B/14 (CIP: 34009 219 225 1 6) B/28 (CIP: 34009 219 226 8 4) B/42 (CIP: 34009 219 227 4 5) B/10 (CIP: 34009 219 228 0
Livret des nouveaux anticoagulants oraux. Ce qu il faut savoir pour bien gérer leur utilisation
 Livret des nouveaux anticoagulants oraux Ce qu il faut savoir pour bien gérer leur utilisation DONNÉES DU PATIENT Nom Adresse Tél MÉDECIN TRAITANT Nom Adresse Tél SPÉCIALISTE Nom Hôpital Tél MÉDICAMENT
Livret des nouveaux anticoagulants oraux Ce qu il faut savoir pour bien gérer leur utilisation DONNÉES DU PATIENT Nom Adresse Tél MÉDECIN TRAITANT Nom Adresse Tél SPÉCIALISTE Nom Hôpital Tél MÉDICAMENT
