Ceftriaxone Fresenius Kabi 1 g poudre pour solution injectable.
|
|
|
- Heloïse André
- il y a 10 ans
- Total affichages :
Transcription
1 1. DENOMINATION DU MEDICAMENT Ceftriaxone Fresenius Kabi 1 g poudre pour solution injectable. 2. COMPOSITION QUALITATIVE ET QUANTITATIVE Chaque flacon de poudre pour solution injectable contient de la ceftriaxone sodique, en quantités équivalant à 1 g de ceftriaxone. Contenu en sodium : 83 mg (équivalant à 3,6 mmol). Le produit ne contient aucun excipient ni conservateur. 3. FORME PHARMACEUTIQUE Poudre pour solution injectable. Flacons contenant une poudre blanche à jaunâtre. 4. DONNEES CLINIQUES 4.1 Indications thérapeutiques Ceftriaxone Fresenius Kabi 1 g est indiqué dans le traitement des infections suivantes, lorsqu elles sont causées par des micro-organismes sensibles à la ceftriaxone (voir rubrique 5.1) et lorsqu un traitement parentéral s avère nécessaire : Infections de l oreille, du nez et de la gorge Infections des voies respiratoires inférieures Infections du rein et des voies urinaires Infections de la peau et des tissus mous, incluant infections de plaies Infections des organes génitaux, incluant gonorrhée Infections abdominales (péritonite) Infections des os et des articulations Infections septicémiques Méningite Prophylaxie préopératoire chez les patients présentant un risque accru d infections Borréliose de Lyme (stades II et III) Traitement de la fièvre neutropénique Il faut veiller à respecter les directives officielles locales relatives à l usage adéquat des antibiotiques. 4.2 Posologie et mode d administration Après reconstitution de la solution selon les directives mentionnées ci-dessous (voir également rubrique 6.6), on peut administrer Ceftriaxone Fresenius Kabi 1 g poudre pour solution injectable sous forme d une injection bolus intraveineuse lente ou d une injection intramusculaire profonde. La posologie et le mode d administration doivent être déterminés sur base de la sévérité et du site de l infection, de la sensibilité du micro-organisme impliqué, ainsi que de l âge et de l état du patient. Posologie normale Adultes et adolescents de plus de 12 ans et ayant un poids corporel 50 kg :
2 La dose habituelle est de 1 à 2 g de ceftriaxone, administrée une fois par jour (toutes les 24 heures). Dans les infections sévères ou causées par des micro-organismes modérément sensibles, on peut augmenter la dose à 4 g, administrée une fois par jour par voie intraveineuse. Nouveaux-nés (de 0 à 14 jours) : 20 à 50 mg par kg de poids corporel, par voie intraveineuse, une fois par jour (intervalles de 24 heures). Même en cas d infections sévères, la dose quotidienne de 50 mg par kg de poids corporel ne doit pas être dépassée. Enfants âgés de 15 jours à 12 ans et ayant un poids corporel < 50 kg : 20 à 80 mg par kg de poids corporel, par voie intraveineuse, une fois par jour (intervalles de 24 heures). En cas d infections sévères, la dose quotidienne de 80 mg par kg de poids corporel ne doit pas être dépassée, sauf en cas de méningite (voir : Recommandations particulières de posologie). Les enfants ayant un poids corporel de 50 kg ou plus reçoivent la posologie habituelle de l adulte, une fois par jour (voir ci-dessus). Patients âgés : Chez les patients âgés, les recommandations de posologie sont les mêmes que chez l adulte sans modification. Groupe d âge Posologie normale Fréquence Nouveaux-nés (0 à 14 jours) mg/kg Une fois par jour Maximum : 50 mg/kg Enfants (15 jours 12 ans, < mg/kg Une fois par jour kg) Maximum : 80 mg/kg (- 100 mg/kg en cas de méningite) Adolescents (12 17 ans, > g Une fois par jour kg) Maximum : 4 g Adultes (> 17 ans) 1-2 g Une fois par jour Maximum : 4 g Patients âgés 1-2 g Maximum : 4 g Une fois par jour Recommandations particulières de posologie Méningite : On instaure le traitement au moyen d une dose de 100 mg par kg de poids corporel, une fois par jour sans dépasser 4 g par jour. Après détermination de la sensibilité de l agent pathogène, on peut réduire la posologie en conséquence. Chez les nouveaux-nés (de 0 à 14 jours), la dose ne doit pas dépasser 50 mg/kg/24 h. Prophylaxie préopératoire : Il faut administrer la dose quotidienne habituelle de ceftriaxone 30 à 90 minutes avant l intervention chirurgicale. Une seule administration suffit généralement. Gonorrhée : En cas de gonorrhée non compliquée chez les adultes et les adolescents de plus de 12 ans ou pesant plus de 50 kg, il faut administrer une seule dose de 250 mg de ceftriaxone, par voie intramusculaire. En présence de micro-organismes moins sensibles, il peut s avérer nécessaire d augmenter la posologie. Pour cette recommandation de posologie, d autres formes de dosage sont disponibles. Avant d instaurer le traitement par ceftriaxone, il faut exclure une infection concomitante par Treponema pallidum (syphilis).
3 Borréliose de Lyme (stades II et III) : Chez les adultes et les adolescents de plus de 12 ans, la dose thérapeutique de ceftriaxone est de 2 g/j et le traitement doit durer au moins 14 jours. Dans les cas sévères, on a rapporté l utilisation de doses allant jusqu à 4 g par jour. Chez les enfants d âge égal ou inférieur à 12 ans, la dose est de 50 à 100 mg/kg de poids corporel, une fois par jour, pendant minimum 14 jours. La dose maximale est de 2 g par jour. Insuffisance rénale : Chez les patients ayant une altération de la fonction rénale et une clairance de la créatinine > 10 ml/min, il n est pas nécessaire d ajuster la posologie quotidienne de ceftriaxone, pour autant que la fonction hépatique soit normale. En cas d insuffisance rénale avec une clairance de la créatinine 10 ml/min, la dose quotidienne de ceftriaxone ne doit pas dépasser 2 g chez les patients adultes. Insuffisance hépatique : Chez les patients ayant une maladie hépatique, il ne faut pas modifier la posologie quotidienne de ceftriaxone, pour autant que la fonction rénale soit normale (voir rubrique 4.8). Insuffisance rénale et hépatique En présence simultanée d insuffisance sévère rénale et hépatique, il faut surveiller régulièrement les concentrations sériques de ceftriaxone et il faut adapter la posologie de manière adéquate chez les enfants et les adultes (voir rubriques 4.4 et 5.2). Hémodialyse ou dialyse péritonéale : La ceftriaxone ne s éliminant que très peu par dialyse, il n est pas nécessaire d administrer une dose supplémentaire de ceftriaxone après la dialyse. Néanmoins, il faut surveiller les concentrations sériques afin de déterminer s il est nécessaire d adapter la posologie, car la vitesse d élimination peut être réduite chez ces patients. Chez les patients sous dialyse péritonéale ambulatoire continue (DPAC), on peut administrer la ceftriaxone par voie intraveineuse ou en cas d infections associées à la DPAC, on peut l ajouter directement à la solution de dialyse (par ex. 1 à 2 g de ceftriaxone dans le premier liquide de dialyse du jour de traitement) (voir rubrique 6.6). Mode d administration Les diluants contenant du calcium (p. ex. solution de Ringer ou solution de Hartmann) ne doivent pas être utilisés pour reconstituer les flacons de ceftriaxone ni pour poursuivre la dilution d un flacon reconstitué pour administration IV, en raison du risque de formation de précipité. Une précipitation de ceftriaxone-calcium peut également survenir lorsque la ceftriaxone est mélangée à des solutions contenant du calcium dans la même tubulure d administration IV. Par conséquent, la ceftriaxone et les solutions contenant du calcium ne doivent pas être mélangées, ni administrées simultanément (voir rubriques 4.3, 4.4 et 6.2). On administre régulièrement la ceftriaxone par voie intraveineuse. Il faut administrer une injection intraveineuse sur une période d au moins 2 à 4 minutes, directement dans la veine ou dans la tubulure d une perfusion intraveineuse contenant une solution pour perfusion de chlorure de sodium 0,9 % ou de glucose 5 %. Le mode d administration intramusculaire est réservé aux interventions uniques et aux situations cliniques exceptionnelles, et doit faire l objet d une évaluation de la balance risques/bénéfices. Ce mode d administration n est pas indiqué dans la borréliose de Lyme, ni dans les affections sévères (telles que septicémie ou méningite), ni chez les enfants de moins de 12 ans. Injection intraveineuse: Pour l injection intraveineuse, on dissout Ceftriaxone Fresenius Kabi 1 g dans 10 ml d eau pour préparations injectables. La durée de l injection doit être de 2 à 4 minutes. Si l on injecte Ceftriaxone
4 Fresenius Kabi trop rapidement (en moins d une minute) au niveau d un cathéter veineux central, une arythmie sévère peut survenir. Les solutions injectables reconstituées présentent une coloration jaune pâle, ce qui n altère en rien l efficacité ou la tolérance de Ceftriaxone Fresenius Kabi 1 g. Il faut inspecter visuellement les solutions reconstituées. Il ne faut utiliser que les solutions claires et sans particules visibles. Le produit reconstitué n est destiné qu à un usage unique et il faut jeter toute solution inutilisée. Injection intramusculaire Pour l administration intramusculaire, on dissout Ceftriaxone Fresenius Kabi 1 g, poudre pour solution injectable dans 3,5 ml d une solution de chlorhydrate de lidocaïne 1 % (voir également rubrique 6.6). On pratique une injection profonde dans le muscle fessier. Il ne faut pas injecter plus d 1 g de ceftriaxone dans chaque fesse. En cas d injection intramusculaire, la dose quotidienne maximale ne doit pas dépasser 2 g. Il faut absolument éviter une injection intravasculaire, car l administration intravasculaire de lidocaïne peut donner lieu à des effets indésirables sévères. Il faut tenir compte du résumé des caractéristiques du produit de la solution de chlorhydrate de lidocaïne 1 % choisie. L administration intramusculaire de Ceftriaxone Fresenius Kabi 1 g est contre-indiquée pour le traitement de la borréliose de Lyme (stades II et III), pour le traitement des infections sévères et chez les enfants de moins de 12 ans (voir rubrique 4.2). Durée de la thérapie La durée normale de la thérapie dépend des caractéristiques de l infection. Généralement il faut poursuivre l administration de ceftriaxone pendant au moins les 48 à 72 heures suivant la normalisation de la température corporelle et l obtention d une preuve de l éradication bactérienne. Il faut tenir compte des recommandations de posologie relatives aux indications spécifiques. 4.3 Contre-indications Hypersensibilité à ceftriaxone, la substance active, ou à d autres céphalosporines. Antécédents de réaction d hypersensibilité immédiate et/ou sévère à la pénicilline ou à d autres médicaments bêta-lactames (voir rubrique 4.4). La céftriaxone est contre-indiquée : chez les nouveau-nés prématurés jusqu à l âge corrigé de 41 semaines (semaines de gestation + semaines de vie), chez les nouveau-nés nés à terme (jusqu à l âge de 28 jours) : qui présentent un ictère, une hypoalbuminémie ou une acidose, en raison du risque d altération de la conjugaison de la bilirubine dans ces pathologies qui nécessitent (ou sont supposés nécessiter) un traitement IV de calcium ou des perfusions contenant du calcium, en raison du risque de précipitation de ceftriaxone-calcium (voir rubriques 4.4, 4.8 et 6.2). 4.4 Mises en garde spéciales et précautions d emploi Réactions d hypersensibilité/anaphylaxie Des réactions d hypersensibilité peuvent survenir, et leur sévérité peut être de tout degré et aller jusqu au choc anaphylactique (voir rubrique 4.8).
5 Une prudence particulière s impose et il faut détermine s il existe des antécédents de tout autre type de réactions d hypersensibilité à la pénicilline ou à d autres médicaments bêta-lactames, vu l existence éventuelle d une allergie croisée. Les réactions d hypersensibilité à la ceftriaxone sont plus probables chez les patients présentant tout autre type de réactions d hypersensibilité ou un asthme bronchique. Chez les patients présentant une diathèse allergique, il faut effectuer les injections de ceftriaxone avec une prudence particulière, car les réactions d hypersensibilité apparaissent plus rapidement et évoluent de manière plus sévère après injection intraveineuse (voir rubrique 4.8). Les réactions aigues sévères d hypersensibilité et le choc anaphylactique nécessitent l arrêt immédiat du traitement par ceftriaxone et la prise des mesures d urgence adéquates. En cas d insuffisance rénale sévère associée à une insuffisance hépatique, il faut réduire la posologie comme on le mentionne dans la rubrique 4.2. En cas d altération simultanée de la fonction rénale et hépatique, il faut surveiller régulièrement les taux sériques de ceftriaxone. Toute administration d antibiotique peut donner lieu à une multiplication des agents pathogènes résistants à la substance active utilisée. Il faut tenir compte des signes d infections secondaires dues à ce type d agents pathogènes (incluant candida et champignons) et les traiter en conséquence (voir également rubrique 5.1). Il faut envisager le diagnostic de colite pseudomembraneuse, une complication potentiellement fatale généralement causée par clostridium difficile, chez les patients développant une diarrhée hémorragique sévère et persistante pendant ou après le traitement par ceftriaxone (voir rubrique 4.8). Il faut envisager l arrêt du traitement par ceftriaxone selon l indication sous-jacente et prendre les mesures thérapeutiques adéquates : prise d antibiotiques spécifiques / d agents chimiothérapeutiques dont l efficacité clinique est démontrée. Les anti-péristaltiques sont contre-indiqués. Interactions avec des produits contenant du calcium Des cas de réactions fatales ont été décrits avec des précipités de calcium-ceftriaxone dans les poumons et les reins chez les nouveau-nés prématurés et les nouveau-nés nés à terme âgés de moins d 1 mois. L un d entre eux au moins avait reçu de la ceftriaxone et du calcium à différents moments et au moyen de tubulures intraveineuses différentes. Les données scientifiques disponibles ne font état d aucune précipitation intravasculaire confirmée chez les patients traités par la ceftriaxone et par des solutions contenant du calcium ou un quelconque autre produit contenant du calcium, si ce n est chez les nouveau-nés. Les études in vitro ont montré que les nouveau-nés ont un risque accru de précipitation de ceftriaxone-calcium par rapport aux autres groupes d âge. Quel que soit l âge des patients, la ceftriaxone ne doit pas être mélangée ni administrée simultanément avec une quelconque solution IV contenant du calcium, même au moyen de tubulures de perfusion différentes ou à différents sites de perfusion. Toutefois, chez les patients âgés de plus de 28 jours, il est possible d administrer la ceftriaxone et des solutions contenant du calcium de manière séquentielle (l une après l autre) si l on utilise des tubulures de perfusion à différents sites, ou si les tubulures de perfusion sont remplacées ou rincées abondamment entre les perfusions au moyen d une solution saline physiologique, afin d éviter toute précipitation. Chez les patients nécessitant une perfusion continue à base de solutions NPT contenant du calcium, les professionnels de santé peuvent souhaiter envisager l utilisation d autres traitements antibactériens qui ne comportent pas un tel risque de précipitation. Si l utilisation de la ceftriaxone est estimée indispensable chez des patients nécessitant une nutrition continue, il est possible d administrer simultanément des solutions NPT et la ceftriaxone à condition d utiliser différentes tubulures de perfusion et des sites différents. En variante, la perfusion de solution NPT peut être interrompue pendant la durée de la perfusion de ceftriaxone, tout en respectant la recommandation de rincer les tubulures de perfusion entre l administration des solutions (voir rubriques 4.3, 4.8, 5.2 et 6.2). Vu le risque d incompatibilités physiques ou chimiques, Ceftriaxone Fresenius Kabi 1 g ne doit être reconstitué et mélangé qu avec les solutions et les médicaments mentionnés dans la rubrique 4.2.
6 La ceftriaxone peut précipiter dans la vésicule biliaire et dans les reins et est alors détectable à l échographie (voir rubrique 4.8). Ce phénomène peut se produire chez les patients de tout âge, mais est plus probable chez les bébés et les petits enfants, qui reçoivent généralement une dose de ceftriaxone plus importante par rapport à leur poids corporel. Chez les enfants, il faut éviter d administrer une dose supérieure à 80mg/kg de poids corporel sauf en cas de méningite en raison du risque accru de précipitation biliaire. En fait, l apparition de calculs biliaires et le développement d une cholécystite aigue n ont pas été clairement démontrés chez les enfants ou les bébés traités par ceftriaxone. En cas de précipitation de ceftriaxone dans la vésicule biliaire, on recommande une prise en charge conservatrice (voir également rubrique 4.8). Les patients ayant des facteurs de risque de stase biliaire/boue biliaire (par ex. en cas de thérapie majeure antérieure, de maladie sévère et de nutrition parentérale totale) présentent un risque accru de pancréatite (voir également rubrique 4.8). Il est impossible d exclure le rôle déclencheur de la précipitation biliaire liée à la ceftriaxone. Les médicaments de la classe des céphalosporines ont tendance à être absorbés à la surface membranaire des globules rouges et à réagir avec les anticorps dirigés contre le médicament, ce qui produit un résultat positif au test de Coombs et parfois une anémie hémolytique plutôt légère. A cet égard, une certaine réactivité croisée avec les pénicillines peut survenir. En présence ou en cas de suspicion d infections à Pseudomonas aeruginosa, il faut tenir compte des taux élevés de résistance (> 60 %) à l égard de la ceftriaxone dans au moins certains pays européens (voir rubrique 5.1). En cas d infections causés par Pseudomonas aeruginosa ayant une sensibilité démontrée à la ceftriaxone, l association à des aminoglycosides permet d éviter la survenue d une résistance secondaire. En cas d infections dues à d autres bactéries et survenant chez des patients présentant une fièvre neutropénique, le traitement interventionnel consiste à associer la ceftriaxone à un aminoglycoside. En cas d administration concomitante de céphalosporines et d aminoglycosides, il faut tenir compte de l incompatibilité physique et chimique et d un risque accru d oto- et de néphrotoxicité. Lors d un traitement de long terme, une surveillance régulière des fonctions rénale et hépatique et des paramètres hématologiques s avère indiquée (voir rubrique 4.8). Ce médicament contient 3,6 mmol (ou 83 mg) de sodium par dose. Il faut en tenir compte chez les patients suivant un régime à teneur contrôlée en sodium. En cas d administration intramusculaire de ceftriaxone, il faut consulter le résumé des caractéristiques du produit du médicament à base de lidocaïne choisi pour la reconstitution. 4.5 Interactions avec d autres médicaments et autres formes d interactions Antibiotiques bactériostatiques Les antibiotiques bactériostatiques tels que le chloramphénicol et la tétracycline, peuvent contrecarrer l activité des antibiotiques bactéricides tels que la ceftriaxone, surtout en cas d infections aigues s accompagnant d une prolifération rapide des micro-organismes. L utilisation simultanée de ceftriaxone et d antibiotiques bactériostatiques est donc déconseillée. Ceftriaxone / probénécide : Contrairement aux autres céphalosporines, le probénécide n empêche pas la sécrétion tubulaire de ceftriaxone. Contraceptifs oraux :
7 La ceftriaxone peut altérer l efficacité des contraceptifs hormonaux. Par conséquent, il est conseillé d utiliser des mesures contraceptives non hormonales supplémentaires. Autres : Tests biologiques / diagnostiques Le test de Coombs peut s avérer faussement positif durant le traitement par ceftriaxone (voir rubrique 4.4). Les méthodes non enzymatiques de détermination du glucose urinaire peuvent produire des résultats faux positifs. Pour cette raison, en cas de traitement par ceftriaxone, il faut utiliser des méthodes enzymatiques pour déterminer le glucose urinaire. La ceftriaxone peut induire des résultats faux positifs lors de la détermination des taux sanguins de galactose. 4.6 Fécondité, grossesse et allaitement Grossesse Il existe des données limitées sur l utilisation de la ceftriaxone chez la femme enceinte. La ceftriaxone traverse la barrière placentaire. Les études effectuées chez l animal n ont pas mis en évidence de toxicité sur la reproduction. La sécurité n étant pas établie chez la femme enceinte, la ceftriaxone doit uniquement être utilisée en cas d indication évidente. Allaitement La ceftriaxone est excrétée dans le lait maternel à de faibles concentrations. Une diarrhée et des infections fongiques des muqueuses peuvent survenir chez le nourrisson allaité, nécessitant l arrêt de l allaitement. Il convient de tenir compte du risque de sensibilisation. La ceftriaxone ne peut être administrée pendant l allaitement qu après une évaluation minutieuse par le médecin du rapport bénéfices/risques. Fécondité Dans une étude non clinique, on a observé une diminution de la qualité du sperme. On ignore la signification clinique de cette observation. Pour l administration intramusculaire L administration intramusculaire de ceftriaxone et de lidocaïne n est pas recommandée pendant la grossesse. Dans les études menées chez des animaux traités par la lidocaïne, des signes de modifications neurocomportementales ont été observés, mais aucun effet embryotoxique ou tératogène n a été relevé. 4.7 Effets sur l aptitude à conduire des véhicules et à utiliser des machines La ceftriaxone n a aucun effet ou qu un effet négligeable sur l aptitude à conduire des véhicules et à utiliser des machines. Néanmoins, il faut tenir compte de certains effets indésirables tels qu une hypotension ou des vertiges (voir rubrique 4.8). 4.8 Effets indésirables Dans de rares cas, des effets indésirables sévères, parfois fatals, ont été rapportés chez des nouveaunés prématurés et nés à terme (moins de 28 jours) ayant reçu un traitement intraveineux à base de ceftriaxone et de calcium. Des précipitations de ceftriaxone-sel de calcium ont été observées dans les poumons et les reins post-mortem. Le risque élevé de précipitation chez les nouveau-nés est dû à leur
8 faible volémie et à la demi-vie plus longue de la ceftriaxone par rapport aux adultes (voir rubriques 4.3, 4.4 et 5.2). Les effets indésirables associés à l utilisation de la ceftriaxone sont énumérés ci-dessous par catégorie de fréquence. Classe de systèmes d organes Très fréquent ( 1/10) Fréquent 1/100 à <1/10 Peu fréquent 1/1 000 à <1/100 Rare 1/ à <1/1 000 Très rare <1/ Affections hématologique s et du système lymphatique Affections du système nerveux Affections gastrointestinales Affections du rein et des voies urinaires Infections et infestations Céphalées, étourdissement s, vertige Stomatite, glossite, anorexie, nausées, vomissements, douleur abdominale, selles molles ou diarrhée. 1 Oligurie, augmentation de la créatininémie. Infections fongiques génitales. Surinfections dues à des Éosinophilie, leucopénie, granulocytopéni e Précipitations de ceftriaxone dans les reins chez les enfants de plus de 3 ans. 3 Agranulocytos e (<500/mm3), le plus souvent après un traitement de 10 jours et une dose totale de 20 g de ceftriaxone ou plus. Troubles de la coagulation, thrombocytopénie. Légère prolongation du temps de prothrombine. Anémie (y compris anémie hémolytique). Entérocolite pseudomembraneuse. 2
9 Troubles généraux et anomalies au site d administratio n Affections du système immunitaire Affections hépatobiliaires Précipitatio n de sel calcique de ceftriaxone dans la vésicule biliaire d enfants. Ce trouble est rare Phlébite après une administratio n intraveineuse, pouvant être réduite au minimum par une injection lente (sur 2 à 4 minutes). Douleur au site d injection. 4 Risque de douleur et d induration tissulaires au site d injection intramusculai re Réaction allergique (p. ex. dermatite, urticaire, exanthème), prurit, gonflement œdémateux de la peau et des articulations. 5 Fièvre d origine médicamenteuse, frissons. Élévation des taux sériques des enzymes hépatiques (ASAT, ALAT, phosphatase alcaline). microorganismes non sensibles. Réactions d hypersensibilit é aiguës sévères allant jusqu au choc anaphylactique Syndrome de Lyell/nécrolyse épidermique toxique, syndrome de Stevens-Johnson ou érythème polymorphe. (Pour les mesures d urgence, voir rubrique 4.4.) Pancréatite
10 chez l adulte* 1 Ces effets indésirables sont généralement légers et régressent fréquemment pendant le traitement ou après celui-ci. 2 Si une diarrhée sévère et persistante survient pendant ou après le traitement par, il convient d envisager le diagnostic de colite pseudomembraneuse, une complication grave mettant en jeu le pronostic vital, généralement causée par clostridium difficile (voir également rubrique 4.4). 3 Ces effets indésirables apparaissent chez les patients traités par des doses quotidiennes élevées (p. ex. 80 mg/kg de PC par jour et plus) ou par une dose totale supérieure à 10 g de ceftriaxone (soit une posologie supérieure à la dose quotidienne maximale de 4 g), et qui présentaient plusieurs facteurs de risque (p. ex. apport limité en liquide). Ce symptôme est toutefois réversible après l arrêt du traitement par ceftriaxone. 4 Lors d une injection intraveineuse rapide, des réactions d incompatibilité telles qu une sensation de chaleur ou des nausées peuvent survenir ; la survenue de telles réactions peut être prévenue par l administration d une injection lente (2-4 minutes). 5 Le traitement de la spirochétose, telle que la borréliose de Lyme, peut provoquer une réaction de Herxheimer se manifestant par de la fièvre, des frissons, des céphalées et des douleurs articulaires. Cette réaction résulte de l effet bactéricide de la ceftriaxone sur Borrelia burgdorferi. Il convient d informer les patients qu il s agit d un effet fréquent, généralement spontanément résolutif, de l antibiothérapie de la borréliose de Lyme. Des symptômes tels que réactions cutanées, prurit, fièvre, leucopénie, élévation des enzymes hépatiques, troubles respiratoires et douleurs articulaires ont été fréquemment décrits après un traitement prolongé de la borréliose de Lyme par la ceftriaxone. Ces troubles correspondent en partie aux symptômes de la borréliose de Lyme. Des anomalies à l échographie au niveau de la vésicule biliaire ont été rapportées des patients traités par ceftriaxone ; certains de ces patients présentaient également des symptômes de pathologie de la vésicule biliaire. Ces anomalies apparaissent à l échographie sous forme d un écho sans onde acoustique ou d un écho avec onde acoustique suggérant une boue biliaire et pouvant être interprété à tort comme étant des calculs biliaires. La nature chimique des matériaux détectés à l échographie a été déterminée : il s agissait principalement d un sel calcique de ceftriaxone. L affection semble être transitoire et est réversible lorsque l on arrête le traitement par ceftriaxone et lorsque l on instaure une prise en charge conservatrice. 4.9 Surdosage On n a rapporté aucun cas de surdosage. Symptômes d intoxication On peut s attendre à ce que les signes typiques d un surdosage correspondent au profil des réactions indésirables. En cas d administration de fortes doses de manière plus fréquente et plus rapide que selon les recommandations, des coliques survenaient très rarement en présence d une néphropathie ou d une lithiase biliaire. Traitement de l intoxication Ni l hémodialyse ni la dialyse péritonéale ne permettent de réduire les concentrations sériques excessives de ceftriaxone. Il n existe aucun antidote spécifique. La prise de mesures thérapeutiques symptomatiques s avère indiquée. 5. PROPRIETES PHARMACOLOGIQUES
11 5.1 Propriétés pharmacodynamiques La ceftriaxone est un antibiotique β Lactame bactéricide administré par voie parentérale Antibiotique du groupe pharmacothérapeutique des Céphalosporines. Code ATC : J01DD04. Mode d action L activité bactéricide de la ceftriaxone provient de l inhibition de la synthèse de la paroi des cellules bactériennes (pendant la phase de croissance) induite par une inhibition des protéines se liant à la Pénicilline (PBP) telles que les transpeptidases. PC-PK ratio : L importance de l activité bactéricide dépend de la période durant laquelle les taux sériques dépassent la concentration minimale inhibitrice (CMI) de l agent pathogène. Mécanisme de résistance - Inactivation par les β-lactamases. La ceftriaxone peut être hydrolysée par certaines β-lactamases, en particulier par des β-lactamases à spectre étendu parfois présentes dans des souches d Escherichia coli ou de Klebsiella pneumoniae, par des β-lactamases inductibles génétiquement codées ou par des β-lactamases constitutives de type AmpC pouvant être détectées dans Enterobacter cloacae. Les infections dues à des agents pathogènes présentant des β-lactamases inductibles, génétiquement codées de type AmpC ne doivent donc pas être traitées par ceftriaxone, même en cas de sensibilité démontrée en milieu in vitro, car il existe un risque de sélection de mutants déréprimés exprimant des β-lactamases constitutives de type AmpC. - Affinité réduite des PBP à l égard de la ceftriaxone. La résistance acquise de Pneumococcus et d autres Streptococcus provient d une modification des PBP déjà existantes, induite par un processus de mutation. Contrairement à cela, concernant le Staphylococcus résistant à la Méthicilline (Oxacilline), la création d une PBP supplémentaire présentant une affinité réduite à l égard de la ceftriaxone est l élément responsable de la résistance. - Pénétration inadéquate de la ceftriaxone à travers la membrane cellulaire extérieure des bactéries gram-négatives, rendant ainsi l inhibition des PBP insuffisante. - Présence de mécanismes de transport (pompes refoulantes) capables de transporter de manière active la ceftriaxone en dehors de la cellule. Dans une seule cellule bactérienne, plus d'un des mécanismes mentionnés ci-dessus peuvent intervenir en même temps. Une résistance croisée partielle ou complète peut survenir avec les autres céphalosporines telles que la céfotaxime ou la ceftazidime. Concentrations critiques :On utilise les séries de dilution habituelles pour tester la ceftriaxone. On a défini les concentrations minimales inhibitrices suivantes pour les germes résistants et sensibles : Valeurs limites EUCAST (European Committee on Antimicrobial Susceptibility Testing, Comité Européen des Tests de Sensibilité Antimicrobienne) : Agent pathogène Sensible Résistant
12 Enterobacteriaceae 1 mg/l > 2 mg/l Staphylococcus spp. --* --* Streptococcus (Gr. sérolog. A, B, C, G) --** --** Streptococcus pneumoniae 0,5 mg/l*** > 2 mg/l Haemophilus influenzae 0,12 mg/l*** > 0,12 mg/l Moraxella catarrhalis 1 mg/l 2 mg/l Neisseria gonorrhoeae 0,12 mg/l > 0,12 mg/l Neisseria meningitidis 0,12 mg/l*** > 0,12 mg/l Valeurs limites non spécifiques à l espèce **** 1 mg/l > 2 mg/l * La sensibilité des staphylocoques aux céphalosporines est déduite de leur sensibilité à la céfoxitine. ** La sensibilité des streptocoques bêta-hémolytiques des groupes A, B, C et G aux bêta-lactamines est déduite de leur sensibilité à la pénicilline. *** Les isolats ayant des valeurs CMI supérieures à la concentration critique sensible sont très rares ou n ont pas encore été rapportées. Les tests d identification et de sensibilité antimicrobienne sur un isolat de ce type doivent être répétés ; si le résultat est confirmé, l isolat sera envoyé à un laboratoire de référence. En l absence de réponse clinique pour les isolats confirmés ayant des valeurs CMI supérieures à la concentration critique résistante actuelle, ces isolats doivent être considérés comme résistants. **** Les concentrations critiques s appliquent à une dose intraveineuse quotidienne de 1 g x 1 et à une dose élevée d au moins 2 g x 1. La prévalence de résistance acquise peut varier avec le temps et selon la géographie pour les espèces sélectionnées et une information locale concernant la résistance est souhaitable, surtout lorsqu on traite des infections sévères. Si nécessaire, il faut solliciter l avis d un expert si la prévalence locale de la résistance est telle que l utilité de l agent s avère douteuse dans au moins certains types d infections. Particulièrement en cas d infections sévères ou d échec de la thérapie, il faut tenter d obtenir un diagnostic microbiologique, incluant une vérification du germe et de sa sensibilité. Espèces généralement sensibles Aérobies Gram-positifs Staphylococcus aureus* MSSA Streptococcus agalactiae Streptococcus pneumoniae* Streptococcus pyogenes* Aérobies Gram-négatifs Borrelia burgdorferi Haemophilus influenzae* Moraxella catarrhalis* Morganella morganii 1 Neisseria gonorrhoeae Neisseria meningitidis* Proteus mirabilis* 1 Espèces présentant une résistance acquise pouvant poser problème Aérobies Gram-positifs Staphylococcus aureus Staphylococcus epidermidis + Staphylococcus haemolyticus + Staphylococcus hominis +
13 Aérobies Gram-négatifs Citrobacter freundii 1 Enterobacter aerognes Enterobacter cloacae Escherichia coli* 1 Klebsiella pneumoniae* 1 Klebsiella oxytoca Proteus vulgaris Serratia marcescens Anaérobies Bacteroides fragilis Espèces présentant une résistance inhérente Aérobies Gram-positifs Enterococcus spp. Listeria monocytogenes Staphylococcus aureus MRSA Aérobies Gram-négatifs Acinetobacter baumannii* Pseudomonas aeruginosa Stenotrophomonas maltophilia Anaérobies Clostridium difficile Autres Chlamydia spp. Chlamydophila spp. Legionella pneumophila Mycoplasma spp. Treponema pallidum * Dans les indications cliniques approuvées, on a démontré une efficacité clinique pour les isolats sensibles. $ Espèces présentant une sensibilité intermédiaire naturelle. 1 Certaines souches produisent des céphalosporinases génétiquement codées inductibles ou à dérépression stable et des bêta-lactamases à spectre étendu, et sont donc cliniquement résistantes aux céphalosporines. + Espèces pour lesquelles un taux de résistance de 50% a été observé dans un(e) ou plusieurs zones/pays au sein de l Union européenne. 5.2 Propriétés pharmacocinétiques La ceftriaxone est une céphalosporine pour administration parentérale, intraveineuse et intramusculaire. Elle n est pas absorbée après administration orale. Après l administration d une dose de 1 à 2 g, on a constaté que les concentrations restent supérieures aux CMI pour la plupart des agents pathogènes responsables d infection, pendant plus de 24 heures et dans plus de 60 tissus différents (dont les poumons, le coeur, les voies biliaires, le foie, les amygdales,
14 l oreille moyenne, les muqueuses nasales, les os) et dans de nombreux liquides tissulaires (dont le liquide céphalorachidien, le liquide pleural, ainsi que les liquides prostatique et synovial). Absorption La biodisponibilité de la ceftriaxone est complète après une administration intramusculaire, et le pic plasmatique différé (environ 80 mg/l) est atteint dans les 2 à 3 heures suivant l administration. Distribution La ceftriaxone se distribue bien dans les divers compartiments et traverse également la barrière placentaire. Chez les adultes sains, le volume de distribution moyen est de 0,13 l/kg. La ceftriaxone se lie de manière réversible à l albumine. A des concentrations plasmatiques inférieures à 100 mg/l, son taux de liaison est de 95 % et le pourcentage de liaison diminue lorsque les concentrations augmentent (jusqu à 85 % à des concentrations plasmatiques de ceftriaxone de 300 μg/ml). Taux sériques Après la perfusion intraveineuse d une dose de 1 g de ceftriaxone durant 30 minutes, les taux sériques étaient de 123,2 μg/ml juste après l arrêt de la perfusion. 1,5 heures, 4 heures, 12 heures et 24 heures après le début de la perfusion, ces taux étaient respectivement de 94,81 μg/ml, 57,8 μg/ml, 20,2 μg/ml et 4,6 μg/ml. Après une injection intramusculaire d une dose d 1 g de ceftriaxone, les concentrations sériques s élevaient à 79,2 μg/ml après 1,5 heures. 4 heures, 12 heures et 24 heures après l injection, ils étaient respectivement de 58,2 μg/ml, 35,5 μg/ml et 7,8 μg/ml. Chez les nouveaux-nés, les nourrissons et les enfants, la ceftriaxone pénètre dans les méninges enflammées. Dans le LCR, les concentrations maximales sont de 18 mg/l après l administration intraveineuse d une dose de 50 à 100 mg/kg sur une période d environ quatre heures. Chez les patients adultes atteints de méningite, les concentrations thérapeutiques sont atteintes dans les 2 à 24 heures suivant l administration d une dose de 50 mg/kg. La ceftriaxone traverse le placenta et s élimine dans le lait maternel à faibles concentrations. Biotransformation La ceftriaxone ne subit aucun métabolisme systémique mais subit une dégradation dans l intestin grêle, sous l action des bactéries. Elimination Dans une gamme de doses comprises entre 0,15 et 3 g, la demi-vie d élimination varie de 6 à 9 heures, la clairance plasmatique totale est de 0,6 à 1,4 l/h et la clairance rénale est de 0,3 à 0,7 l/h. 50 à 60 % de la ceftriaxone s éliminent dans l urine sous forme inchangée, tandis que le reste s élimine dans la bile puis dans les selles, sous forme de métabolites microbiologiquement inactifs. La ceftriaxone se concentre dans l urine. Les concentrations urinaires sont 5 à 10 fois supérieures par rapport à celles observées dans le plasma. La dialyse ne permet pas l élimination de la ceftriaxone. Ceci s applique également à l hémodialyse et à la dialyse péritonéale. L excrétion urinaire s effectue par filtration glomérulaire. Il n y a aucune excrétion tubulaire. Pour cette raison, en cas d administration concomitante de probénécide, on ne s attend à aucune augmentation des taux sériques, ce qui a été vérifié même en cas d administration de plus fortes doses de probénécide (1 à 2 g). Non-Linéarité
15 La pharmacocinétique de la ceftriaxone est non linéaire par rapport à la dose. Cette non-linéarité s explique par une réduction dose-dépendante de la liaison aux protéines plasmatiques, qui donne lieu à une augmentation correspondante de la distribution et de l élimination. A l exception de la demi-vie d élimination, tous les paramètres pharmacocinétiques dépendent de la dose. L administration répétée de 0,5 à 2 g de ceftriaxone induit une accumulation de 15 à 36 % par rapport aux valeurs observées lors de l administration d une dose unique. Groupes particuliers de patients Patients de plus de 75 ans : La demi-vie d élimination plasmatique de la ceftriaxone est environ 2 à 3 fois supérieure par rapport à celle des adultes jeunes. Nouveaux-nés Chez les nouveaux-nés de 3 jours, la demi-vie sérique de la ceftriaxone est d environ 16 heures. Elle est d environ 9 heures chez les nouveaux-nés âgés de 9 à 30 jours. Patients ayant une altération de la fonction rénale et/ou hépatique : Les patients ayant une altération de la fonction rénale présentent une élimination biliaire accrue de ceftriaxone. Les patients ayant une altération de la fonction hépatique présentent une excrétion rénale accrue. La demi-vie d élimination plasmatique de la ceftriaxone n augmente presque pas chez ces patients. Les patients ayant une altération simultanée des fonctions rénale et hépatique peuvent présenter une augmentation de la demi-vie d élimination plasmatique de la ceftriaxone. En cas d insuffisance rénale terminale, la demi-vie est nettement plus élevée et atteint environ 14 heures. Pharmacocinétique dans des situations cliniques particulières Au cours de la première semaine de vie, 80% de la dose est excrétée dans les urines ; au cours du premier mois, l excrétion retombe à des taux similaires à ceux observés chez l adulte. Chez les nourrissons de moins de 8 jours, la demi-vie d élimination moyenne est généralement deux à trois fois plus longue que celle des jeunes adultes. 5.3 Données de sécurité précliniques Les données non cliniques issues des études conventionnelles de toxicologie aiguë, toxicologie en administration répétée et génotoxicité n ont pas révélé de risque particulier pour l homme autre que ceux déjà mentionnés dans les autres rubriques du RCP. Une diminution de la concentration, du volume et de la motilité du sperme a été observée chez le bélier à une dose comparable ou inférieure à la dose utilisée chez l homme en mg/kg. Aucun effet n a été observé sur la fécondité ni sur les performances de reproduction chez le rat à une dose équivalant à environ 20 fois la dose utilisée chez l homme. Aucune embryotoxicité/fœtotoxicité ni tératogénicité n a été observée chez la souris, le rat et le primate à des doses équivalant à 20, 20 et 3 fois la dose utilisée chez l homme. 6. DONNEES PHARMACEUTIQUES 6.1 Liste des excipients Ceftriaxone Fresenius Kabi 1 g ne contient aucun excipient ou conservateur. 6.2 Incompatibilités
16 Le médicament Ceftriaxone Fresenius Kabi 1 g ne doit pas être reconstitué avec d autres solutions, à l exception de celles mentionnées dans la rubrique 6.6. La solution reconstituée ne doit pas être ajoutée à des solutions pour perfusion (par la tubulure d un système de perfusion), à l exception de celles mentionnées dans la rubrique 4.2! Les solutions contenant de la ceftriaxone ne doivent pas être mélangées ni ajoutées à d autres agents. Plus spécifiquement, les diluants contenant du calcium (p. ex. solution de Ringer, solution de Hartmann) ne doivent pas être utilisés pour reconstituer les flacons de ceftriaxone ni pour poursuivre la dilution d un flacon reconstitué pour administration IV, en raison du risque de formation de précipité. La ceftriaxone ne doit pas être mélangée ni administrée simultanément avec des solutions contenant du calcium (voir rubriques 4.2, 4.3, 4.4 et 4.8). Les solutions suivantes ne sont pas compatibles avec Ceftriaxone Fresenius Kabi 1 g : - Aminoglycosides. Vu l incompatibilité physicochimique avec tous les aminoglycosides, la ceftriaxone ne doit pas être administrée dans une seringue ou dans une solution de perfusion avec des aminoglycosides. Il faut injecter les deux antibiotiques à des endroits différents et en utilisant des kits d administration séparés. - Solutions contenant d autres produits anti-microbiens ; en cas d utilisation concomitante, il faut administrer ces produits séparément. On a rapporté des cas d incompatibilité de la ceftriaxone avec l amsacrine, la vancomycine et le fluconazole. 6.3 Durée de conservation 3 ans. Solution reconstituée : Une stabilité chimique et physique a été démontrée pendant 12 heures en cas de conservation à une température de 25 C, et pendant 2 jours en cas de conservation à une température comprise entre 2 C et 8 C. Du point de vue microbiologique, il faut utiliser le produit immédiatement. Si ce n est pas le cas, les durées et les conditions de conservation sont sous l unique responsabilité de l utilisateur et ne devraient normalement pas dépasser 24 heures à une température comprise entre 2 et 8 C, sauf si la reconstitution s est effectuée dans des conditions d asepsie contrôlées et validées. 6.4 Précautions particulières de conservation Conserver le flacon dans l emballage extérieur, à l abri de la lumière. Pour les conditions de conservation du médicament reconstitué, voir rubrique Nature et contenu de l emballage extérieur Flacon en verre de 15 ml, de classe hydrolytique 2 ou 3 (Ph. Eur.), muni d un bouchon en caoutchouc butyle avec une capsule en aluminium. Conditionnements : 5, 10 flacons. 6.6 Précautions particulières d élimination et manipulation La ceftriaxone ne doit pas être mélangée à d autres médicaments dans la même seringue, à l exception d une solution de chlorhydrate de lidocaïne 1 % (uniquement pour l injection intramusculaire). Il faut secouer la solution reconstituée pendant 60 secondes, afin d assurer la dissolution complète de la ceftriaxone. Injection intramusculaire :
17 On dissout Ceftriaxone Fresenius Kabi 1 g dans 3,5 ml d une solution de chlorhydrate de lidocaïne 1%. Il faut administrer la solution au moyen d une injection profonde dans le muscle fessier. Les solutions de lidocaïne ne doivent pas être administrées par voie intraveineuse. Injection intraveineuse : On dissout Ceftriaxone Fresenius Kabi 1 g dans 10 ml d eau pour préparations injectables. Il faut administrer l injection sur une période d au moins 2 à 4 minutes, directement dans une veine ou par la tubulure d une perfusion intraveineuse. Pour la compatibilité, voir rubrique 4.2. Les solutions injectables reconstituées présentent une coloration jaune pâle, ce qui n altère en rien l efficacité ou la tolérance de Ceftriaxone Fresenius Kabi 1 g. Il faut inspecter visuellement les solutions reconstituées. Il ne faut utiliser que les solutions claires et sans particules visibles. Le produit reconstitué n est destiné qu à un usage unique et il faut jeter toute solution inutilisée. Tout produit non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur. 7. TITULAIRE DE L AUTORISATION DE MISE SUR LE MARCHE Fresenius Kabi n.v./s.a. Molenberglei Schelle 8. NUMERO(S) D AUTORISATION DE MISE SUR LE MARCHE BE DATE DE PREMIERE AUTORISATION / DE RENOUVELLEMENT DE L AUTORISATION 20/10/ DATE DE MISE A JOUR DU TEXTE Date d approbation : 08/2012
ANNEXE IIIB NOTICE : INFORMATION DE L UTILISATEUR
 Dénomination du médicament ANNEXE IIIB NOTICE : INFORMATION DE L UTILISATEUR LYSOPAÏNE MAUX DE GORGE AMBROXOL CITRON 20 mg SANS SUCRE, pastille édulcorée au sorbitol et au sucralose. Chlorhydrate d ambroxol
Dénomination du médicament ANNEXE IIIB NOTICE : INFORMATION DE L UTILISATEUR LYSOPAÏNE MAUX DE GORGE AMBROXOL CITRON 20 mg SANS SUCRE, pastille édulcorée au sorbitol et au sucralose. Chlorhydrate d ambroxol
French Version. Aciclovir Labatec 250 mg (For Intravenous Use Only) 02/2010. Product Information Leaflet for Aciclovir Labatec i.v.
 Product Information Leaflet for Aciclovir Labatec i.v. 250 mg French Version Aciclovir Labatec i.v. Composition Principe actif: Aciclovirum ut Acicloviri natricum (Praeparatio cryodesiccata). Excipients:
Product Information Leaflet for Aciclovir Labatec i.v. 250 mg French Version Aciclovir Labatec i.v. Composition Principe actif: Aciclovirum ut Acicloviri natricum (Praeparatio cryodesiccata). Excipients:
NOTICE : INFORMATIONS DU PATIENT. Keforal 500 mg comprimés pelliculés. Céfalexine monohydratée
 NOTICE : INFORMATIONS DU PATIENT Keforal 500 mg comprimés pelliculés Céfalexine monohydratée Veuillez lire attentivement cette notice avant de prendre ce médicament car elle contient des informations importantes
NOTICE : INFORMATIONS DU PATIENT Keforal 500 mg comprimés pelliculés Céfalexine monohydratée Veuillez lire attentivement cette notice avant de prendre ce médicament car elle contient des informations importantes
Mise au point sur le bon usage des aminosides administrés par voie injectable : gentamicine, tobramycine, nétilmicine, amikacine
 Mise au point mars 2011 MAP Mise au point sur le bon usage des aminosides administrés par voie injectable : gentamicine, tobramycine, nétilmicine, amikacine Sommaire ~ ~ ~ ~ ~ ~ d un traitement par aminosides
Mise au point mars 2011 MAP Mise au point sur le bon usage des aminosides administrés par voie injectable : gentamicine, tobramycine, nétilmicine, amikacine Sommaire ~ ~ ~ ~ ~ ~ d un traitement par aminosides
LIGNES DIRECTRICES CLINIQUES TOUT AU LONG DU CONTINUUM DE SOINS : Objectif de ce chapitre. 6.1 Introduction 86
 LIGNES DIRECTRICES CLINIQUES TOUT AU LONG DU CONTINUUM DE SOINS : ÉTABLISSEMENT DE LIENS ENTRE LES PERSONNES CHEZ QUI UN DIAGNOSTIC D INFECTION À VIH A ÉTÉ POSÉ ET LES SERVICES DE SOINS ET DE TRAITEMENT
LIGNES DIRECTRICES CLINIQUES TOUT AU LONG DU CONTINUUM DE SOINS : ÉTABLISSEMENT DE LIENS ENTRE LES PERSONNES CHEZ QUI UN DIAGNOSTIC D INFECTION À VIH A ÉTÉ POSÉ ET LES SERVICES DE SOINS ET DE TRAITEMENT
NOTICE : INFORMATION DE L'UTILISATEUR. DAKTOZIN 2,5 mg/150 mg pommade Nitrate de miconazole et oxyde de zinc
 NOTICE : INFORMATION DE L'UTILISATEUR DAKTOZIN 2,5 mg/150 mg pommade Nitrate de miconazole et oxyde de zinc Veuillez lire attentivement cette notice avant d utiliser ce médicament car elle contient des
NOTICE : INFORMATION DE L'UTILISATEUR DAKTOZIN 2,5 mg/150 mg pommade Nitrate de miconazole et oxyde de zinc Veuillez lire attentivement cette notice avant d utiliser ce médicament car elle contient des
Résumé des Caractéristiques du Produit 1. DENOMINATION DU MEDICAMENT PARONAL 2. COMPOSITION QUALITATIVE ET QUANTITATIVE
 Résumé des Caractéristiques du Produit 1. DENOMINATION DU MEDICAMENT PARONAL 2. COMPOSITION QUALITATIVE ET QUANTITATIVE Par fiole: L - asparaginase 10.000 U.I. Pour les excipients, cfr section 6.1. 3.
Résumé des Caractéristiques du Produit 1. DENOMINATION DU MEDICAMENT PARONAL 2. COMPOSITION QUALITATIVE ET QUANTITATIVE Par fiole: L - asparaginase 10.000 U.I. Pour les excipients, cfr section 6.1. 3.
E04a - Héparines de bas poids moléculaire
 E04a - 1 E04a - Héparines de bas poids moléculaire Les héparines de bas poids moléculaire (HBPM) sont un mélange inhomogène de chaînes polysaccharidiques obtenues par fractionnement chimique ou enzymatique
E04a - 1 E04a - Héparines de bas poids moléculaire Les héparines de bas poids moléculaire (HBPM) sont un mélange inhomogène de chaînes polysaccharidiques obtenues par fractionnement chimique ou enzymatique
RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT. Bisolax 5 mg comprimés enrobés contient 5 mg de bisacodyl par comprimé enrobé.
 RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT 1. Dé nomination du mé dicame nt Bisolax 5 mg comprimés enrobés. 2. Composition qualitative e t quantitative Bisolax 5 mg comprimés enrobés contient 5 mg de bisacodyl
RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT 1. Dé nomination du mé dicame nt Bisolax 5 mg comprimés enrobés. 2. Composition qualitative e t quantitative Bisolax 5 mg comprimés enrobés contient 5 mg de bisacodyl
L eau dans le corps. Fig. 6 L eau dans le corps. Cerveau 85 % Dents 10 % Cœur 77 % Poumons 80 % Foie 73 % Reins 80 % Peau 71 % Muscles 73 %
 24 L eau est le principal constituant du corps humain. La quantité moyenne d eau contenue dans un organisme adulte est de 65 %, ce qui correspond à environ 45 litres d eau pour une personne de 70 kilogrammes.
24 L eau est le principal constituant du corps humain. La quantité moyenne d eau contenue dans un organisme adulte est de 65 %, ce qui correspond à environ 45 litres d eau pour une personne de 70 kilogrammes.
COMMISSION DE LA TRANSPARENCE AVIS DE LA COMMISSION. 10 octobre 2001
 COMMISSION DE LA TRANSPARENCE AVIS DE LA COMMISSION 10 octobre 2001 VIRAFERONPEG 50 µg 80 µg 100 µg 120 µg 150 µg, poudre et solvant pour solution injectable B/1 B/4 Laboratoires SCHERING PLOUGH Peginterféron
COMMISSION DE LA TRANSPARENCE AVIS DE LA COMMISSION 10 octobre 2001 VIRAFERONPEG 50 µg 80 µg 100 µg 120 µg 150 µg, poudre et solvant pour solution injectable B/1 B/4 Laboratoires SCHERING PLOUGH Peginterféron
Leucémies de l enfant et de l adolescent
 Janvier 2014 Fiche tumeur Prise en charge des adolescents et jeunes adultes Leucémies de l enfant et de l adolescent GENERALITES COMMENT DIAGNOSTIQUE-T-ON UNE LEUCEMIE AIGUË? COMMENT TRAITE-T-ON UNE LEUCEMIE
Janvier 2014 Fiche tumeur Prise en charge des adolescents et jeunes adultes Leucémies de l enfant et de l adolescent GENERALITES COMMENT DIAGNOSTIQUE-T-ON UNE LEUCEMIE AIGUË? COMMENT TRAITE-T-ON UNE LEUCEMIE
vaccin pneumococcique polyosidique conjugué (13-valent, adsorbé)
 EMA/90006/2015 EMEA/H/C/001104 Résumé EPAR à l intention du public vaccin pneumococcique polyosidique conjugué (13-valent, adsorbé) Le présent document est un résumé du rapport européen public d évaluation
EMA/90006/2015 EMEA/H/C/001104 Résumé EPAR à l intention du public vaccin pneumococcique polyosidique conjugué (13-valent, adsorbé) Le présent document est un résumé du rapport européen public d évaluation
COMMISSION DE LA TRANSPARENCE. Avis. 3 septembre 2008
 COMMISSION DE LA TRANSPARENCE Avis 3 septembre 2008 PRIVIGEN 100 mg/ml, solution pour perfusion Flacon en verre de 50 ml (CIP: 572 790-7 Flacon en verre de 100 ml (CIP: 572 791-3) Flacon en verre de 200
COMMISSION DE LA TRANSPARENCE Avis 3 septembre 2008 PRIVIGEN 100 mg/ml, solution pour perfusion Flacon en verre de 50 ml (CIP: 572 790-7 Flacon en verre de 100 ml (CIP: 572 791-3) Flacon en verre de 200
NOTICE: INFORMATION DE L UTILISATEUR. Immukine 100 microgrammes/0,5 ml solution injectable (Interféron gamma-1b recombinant humain)
 NOTICE: INFORMATION DE L UTILISATEUR Immukine 100 microgrammes/0,5 ml solution injectable (Interféron gamma-1b recombinant humain) Veuillez lire attentivement l'intégralité de cette notice avant d'utiliser
NOTICE: INFORMATION DE L UTILISATEUR Immukine 100 microgrammes/0,5 ml solution injectable (Interféron gamma-1b recombinant humain) Veuillez lire attentivement l'intégralité de cette notice avant d'utiliser
GUIDE D INFORMATIONS A LA PREVENTION DE L INSUFFISANCE RENALE
 GUIDE D INFORMATIONS A LA PREVENTION DE L INSUFFISANCE RENALE SOURCES : ligues reins et santé A LA BASE, TOUT PART DES REINS Organes majeurs de l appareil urinaire, les reins permettent d extraire les
GUIDE D INFORMATIONS A LA PREVENTION DE L INSUFFISANCE RENALE SOURCES : ligues reins et santé A LA BASE, TOUT PART DES REINS Organes majeurs de l appareil urinaire, les reins permettent d extraire les
chronique La maladie rénale Un risque pour bon nombre de vos patients Document destiné aux professionnels de santé
 Document destiné aux professionnels de santé Agence relevant du ministère de la santé La maladie rénale chronique Un risque pour bon nombre de vos patients Clés pour la dépister et ralentir sa progression
Document destiné aux professionnels de santé Agence relevant du ministère de la santé La maladie rénale chronique Un risque pour bon nombre de vos patients Clés pour la dépister et ralentir sa progression
DÉFICITS IMMUNITAIRE COMMUN VARIABLE
 DÉFICITS IMMUNITAIRE COMMUN VARIABLE Le présent livret a été rédigé à l attention des patients et de leurs familles. Il ne doit pas remplacer les conseils d un spécialiste en immunologie. 1 Egalement Disponible
DÉFICITS IMMUNITAIRE COMMUN VARIABLE Le présent livret a été rédigé à l attention des patients et de leurs familles. Il ne doit pas remplacer les conseils d un spécialiste en immunologie. 1 Egalement Disponible
INTERET PRATIQUE DU MDRD AU CHU DE RENNES
 INTERET PRATIQUE DU MDRD AU CHU DE RENNES QU EST-CE QUE LE MDRD? Il s agit d une formule permettant d estimer le débit de filtration glomérulaire et donc la fonction rénale La formule est la suivante :
INTERET PRATIQUE DU MDRD AU CHU DE RENNES QU EST-CE QUE LE MDRD? Il s agit d une formule permettant d estimer le débit de filtration glomérulaire et donc la fonction rénale La formule est la suivante :
Professeur Diane GODIN-RIBUOT
 UE3-2 - Physiologie rénale Chapitre 5 : Mesure de la fonction rénale : la clairance rénale Professeur Diane GODIN-RIBUOT Année universitaire 2011/2012 Université Joseph Fourier de Grenoble - Tous droits
UE3-2 - Physiologie rénale Chapitre 5 : Mesure de la fonction rénale : la clairance rénale Professeur Diane GODIN-RIBUOT Année universitaire 2011/2012 Université Joseph Fourier de Grenoble - Tous droits
RELPAX. hydrobromure d élétriptan
 RELPAX hydrobromure d élétriptan * Pharmacocinétique * Toxicologie * Formulation galénique * Essais cliniques * Conclusion * Pharmacocinétique * Toxicologie * Formulation galénique * Essais cliniques *
RELPAX hydrobromure d élétriptan * Pharmacocinétique * Toxicologie * Formulation galénique * Essais cliniques * Conclusion * Pharmacocinétique * Toxicologie * Formulation galénique * Essais cliniques *
Protéger. son animal. la gamme FRONTLINE. grâce à la gamme. Contre les puces et les tiques. Efficace plusieurs semaines (1) Résistant à la pluie,
 la gamme Frontline Contre les puces et les tiques Efficace plusieurs semaines (1) Résistant à la pluie, aux bains et aux shampooings (2) Protéger son animal grâce à la gamme FRONTLINE La gamme FRONTLINE
la gamme Frontline Contre les puces et les tiques Efficace plusieurs semaines (1) Résistant à la pluie, aux bains et aux shampooings (2) Protéger son animal grâce à la gamme FRONTLINE La gamme FRONTLINE
Le traitement du paludisme d importation de l enfant est une urgence
 Le traitement du paludisme d importation de l enfant est une urgence Dominique GENDREL Necker-Enfants Malades Traiter en urgence en présence de trophozoïtes Plus de 80% des paludismes d importation en
Le traitement du paludisme d importation de l enfant est une urgence Dominique GENDREL Necker-Enfants Malades Traiter en urgence en présence de trophozoïtes Plus de 80% des paludismes d importation en
MINISTERE DE LA SANTE ET DES SOLIDARITES DIRECTION GENERALE DE LA SANTE- DDASS DE SEINE MARITIME
 Département des situations d urgence sanitaire Personne chargée du dossier : Evelyne FALIP/Nicole BOHIC Tél : 01 40 56 59 65/02 32 18 31 66 [email protected] MINISTERE DE LA SANTE ET DES SOLIDARITES
Département des situations d urgence sanitaire Personne chargée du dossier : Evelyne FALIP/Nicole BOHIC Tél : 01 40 56 59 65/02 32 18 31 66 [email protected] MINISTERE DE LA SANTE ET DES SOLIDARITES
Traitement antibiotique probabiliste des urétrites et cervicites non compliquées
 Bon usage Mise au point Traitement antibiotique probabiliste des urétrites et cervicites non compliquées Actualisation Octobre 2008 MESSAGES CLÉS L évolution de la résistance du gonocoque aux quinolones
Bon usage Mise au point Traitement antibiotique probabiliste des urétrites et cervicites non compliquées Actualisation Octobre 2008 MESSAGES CLÉS L évolution de la résistance du gonocoque aux quinolones
COMMISSION DE LA TRANSPARENCE AVIS. 19 octobre 2011
 COMMISSION DE LA TRANSPARENCE AVIS 19 octobre 2011 PEDIAVEN AP-HP G15, solution pour perfusion 1000 ml de solution en poche bi-compartiment, boîte de 4 (CIP: 419 999-0) PEDIAVEN AP-HP G20, solution pour
COMMISSION DE LA TRANSPARENCE AVIS 19 octobre 2011 PEDIAVEN AP-HP G15, solution pour perfusion 1000 ml de solution en poche bi-compartiment, boîte de 4 (CIP: 419 999-0) PEDIAVEN AP-HP G20, solution pour
PIL Décembre 2009. Autres composants: acide tartrique, macrogol 4000, macrogol 1000, macrogol 400, butylhydroxyanisol.
 Notice publique MOTILIUM Veuillez lire attentivement l intégralité de cette notice avant d utiliser ce médicament. Gardez cette notice, vous pourriez avoir besoin de la relire. Si vous avez d autres questions,
Notice publique MOTILIUM Veuillez lire attentivement l intégralité de cette notice avant d utiliser ce médicament. Gardez cette notice, vous pourriez avoir besoin de la relire. Si vous avez d autres questions,
Observation. Merci à l équipe de pharmaciens FormUtip iatro pour ce cas
 Cas clinique M. ZAC Observation Mr ZAC ans, 76 ans, 52 kg, est admis aux urgences pour des algies fessières invalidantes, résistantes au AINS. Ses principaux antécédents sont les suivants : une thrombopénie
Cas clinique M. ZAC Observation Mr ZAC ans, 76 ans, 52 kg, est admis aux urgences pour des algies fessières invalidantes, résistantes au AINS. Ses principaux antécédents sont les suivants : une thrombopénie
NOTICE : INFORMATION DE L UTILISATEUR. Delphi 0,1 % crème Acétonide de triamcinolone
 NOTICE : INFORMATION DE L UTILISATEUR Delphi 0,1 % crème Acétonide de triamcinolone Veuillez lire attentivement cette notice avant d utiliser ce médicament car elle contient des informations importantes
NOTICE : INFORMATION DE L UTILISATEUR Delphi 0,1 % crème Acétonide de triamcinolone Veuillez lire attentivement cette notice avant d utiliser ce médicament car elle contient des informations importantes
Les Infections Associées aux Soins
 Les Infections Associées aux Soins Dr Catherine Sartor EOH Conception Assistance Publique Hôpitaux de Marseille Ecole IFSI, Marseille, 12 septembre 2014 Définitions 2007 Infection Nosocomiale (IN) 1999
Les Infections Associées aux Soins Dr Catherine Sartor EOH Conception Assistance Publique Hôpitaux de Marseille Ecole IFSI, Marseille, 12 septembre 2014 Définitions 2007 Infection Nosocomiale (IN) 1999
COMMISSION DE LA TRANSPARENCE AVIS. 18 janvier 2006
 COMMISSION DE LA TRANSPARENCE AVIS 18 janvier 2006 ADVATE 1500 UI, poudre et solvant pour solution injectable 1 flacon(s) en verre de 1 500 UI - 1 flacon(s) en verre de 5 ml avec matériel(s) de perfusion(s)
COMMISSION DE LA TRANSPARENCE AVIS 18 janvier 2006 ADVATE 1500 UI, poudre et solvant pour solution injectable 1 flacon(s) en verre de 1 500 UI - 1 flacon(s) en verre de 5 ml avec matériel(s) de perfusion(s)
HEPATITES VIRALES 22/09/09. Infectieux. Mme Daumas
 HEPATITES VIRALES 22/09/09 Mme Daumas Infectieux Introduction I. Hépatite aigu II. Hépatite chronique III. Les différents types d hépatites A. Hépatite A 1. Prévention de la transmission 2. Vaccination
HEPATITES VIRALES 22/09/09 Mme Daumas Infectieux Introduction I. Hépatite aigu II. Hépatite chronique III. Les différents types d hépatites A. Hépatite A 1. Prévention de la transmission 2. Vaccination
KARDEGIC 75 mg, poudre pour solution buvable en sachet-dose Acétylsalicylate de DL-Lysine
 KARDEGIC 75 mg, poudre pour solution buvable en sachet-dose Acétylsalicylate de DL-Lysine Veuillez lire attentivement cette notice avant d'utiliser ce médicament. Elle contient des informations importantes
KARDEGIC 75 mg, poudre pour solution buvable en sachet-dose Acétylsalicylate de DL-Lysine Veuillez lire attentivement cette notice avant d'utiliser ce médicament. Elle contient des informations importantes
Détermination de la sensibilité aux antibiotiques. Méthode EUCAST de diffusion en gélose
 Détermination de la sensibilité aux antibiotiques Méthode EUCAST de diffusion en gélose Version Sommaire Page Modifications des documents Abréviations et terminologie 1 Introduction 4 2 Préparation des
Détermination de la sensibilité aux antibiotiques Méthode EUCAST de diffusion en gélose Version Sommaire Page Modifications des documents Abréviations et terminologie 1 Introduction 4 2 Préparation des
ANNEXE I RESUME DES CARACTERISTIQUES DU PRODUIT
 ANNEXE I RESUME DES CARACTERISTIQUES DU PRODUIT 1 1. DENOMINATION DU MÉDICAMENT Betaferon 250 microgrammes/ml, poudre et solvant pour solution injectable. 2. COMPOSITION QUALITATIVE ET QUANTITATIVE Interféron
ANNEXE I RESUME DES CARACTERISTIQUES DU PRODUIT 1 1. DENOMINATION DU MÉDICAMENT Betaferon 250 microgrammes/ml, poudre et solvant pour solution injectable. 2. COMPOSITION QUALITATIVE ET QUANTITATIVE Interféron
NOTICE : INFORMATION DE L UTILISATEUR. Bisolax 5 mg comprimés enrobés Bisacodyl
 NOTICE : INFORMATION DE L UTILISATEUR Bisolax 5 mg comprimés enrobés Bisacodyl Veuillez lire attentivement cette notice avant d utiliser ce médicament. Elle contient des informations importante s pour
NOTICE : INFORMATION DE L UTILISATEUR Bisolax 5 mg comprimés enrobés Bisacodyl Veuillez lire attentivement cette notice avant d utiliser ce médicament. Elle contient des informations importante s pour
COMMISSION DE LA TRANSPARENCE AVIS. 10 mai 2006
 COMMISSION DE LA TRANSPARENCE AVIS 10 mai 2006 METOJECT 10 mg/ml, solution injectable en seringue pré-remplie 1 seringue pré-remplie en verre de 0,75 ml avec aiguille : 371 754-3 1 seringue pré- remplie
COMMISSION DE LA TRANSPARENCE AVIS 10 mai 2006 METOJECT 10 mg/ml, solution injectable en seringue pré-remplie 1 seringue pré-remplie en verre de 0,75 ml avec aiguille : 371 754-3 1 seringue pré- remplie
Notice publique PERDOLAN - PÉDIATRIE
 Notice publique PERDOLAN - PÉDIATRIE Lisez attentivement cette notice jusqu'à la fin car elle contient des informations importantes pour vous. Ce médicament est délivré sans ordonnance. Néanmoins, vous
Notice publique PERDOLAN - PÉDIATRIE Lisez attentivement cette notice jusqu'à la fin car elle contient des informations importantes pour vous. Ce médicament est délivré sans ordonnance. Néanmoins, vous
QU EST-CE QUE LA PROPHYLAXIE?
 QU EST-CE QUE LA PROPHYLAXIE? TABLES DES MATIÈRES Publié par la Fédération mondiale de l hémophilie (FMH) Fédération mondiale de l hémophilie, 2014 La FMH encourage la traduction et la redistribution de
QU EST-CE QUE LA PROPHYLAXIE? TABLES DES MATIÈRES Publié par la Fédération mondiale de l hémophilie (FMH) Fédération mondiale de l hémophilie, 2014 La FMH encourage la traduction et la redistribution de
Bien vous soigner. avec des médicaments disponibles sans ordonnance. juin 2008. Douleur. de l adulte
 Bien vous soigner avec des médicaments disponibles sans ordonnance juin 2008 Douleur de l adulte Douleur de l adulte Ce qu il faut savoir La douleur est une expérience sensorielle et émotionnelle désagréable,
Bien vous soigner avec des médicaments disponibles sans ordonnance juin 2008 Douleur de l adulte Douleur de l adulte Ce qu il faut savoir La douleur est une expérience sensorielle et émotionnelle désagréable,
Carnet de suivi Lithium
 Carnet de suivi Lithium Brochure d information sur les troubles bipolaires et leur traitement par lithium Nom : Ce carnet est important Si vous le trouvez, merci de le faire parvenir à l adresse cidessous
Carnet de suivi Lithium Brochure d information sur les troubles bipolaires et leur traitement par lithium Nom : Ce carnet est important Si vous le trouvez, merci de le faire parvenir à l adresse cidessous
NOTICE : INFORMATIONS DESTINÉES A L UTILISATEUR. Firazyr 30 mg solution injectable en seringue pré-remplie Icatibant
 B. NOTICE 1 NOTICE : INFORMATIONS DESTINÉES A L UTILISATEUR Firazyr 30 mg solution injectable en seringue pré-remplie Icatibant Veuillez lire attentivement l intégralité de cette notice avant d utiliser
B. NOTICE 1 NOTICE : INFORMATIONS DESTINÉES A L UTILISATEUR Firazyr 30 mg solution injectable en seringue pré-remplie Icatibant Veuillez lire attentivement l intégralité de cette notice avant d utiliser
Item 182 : Accidents des anticoagulants
 Item 182 : Accidents des anticoagulants COFER, Collège Français des Enseignants en Rhumatologie Date de création du document 2010-2011 Table des matières ENC :...3 SPECIFIQUE :...3 I Cruralgie par hématome
Item 182 : Accidents des anticoagulants COFER, Collège Français des Enseignants en Rhumatologie Date de création du document 2010-2011 Table des matières ENC :...3 SPECIFIQUE :...3 I Cruralgie par hématome
L EMEA accepte d évaluer la demande d autorisation de mise sur le marché de la LENALIDOMIDE
 L EMEA accepte d évaluer la demande d autorisation de mise sur le marché de la LENALIDOMIDE NEUCHATEL, Suisse, 7 avril/prnewswire/ -- - LA LENALIDOMIDE est évaluée par l EMEA comme thérapie orale pour
L EMEA accepte d évaluer la demande d autorisation de mise sur le marché de la LENALIDOMIDE NEUCHATEL, Suisse, 7 avril/prnewswire/ -- - LA LENALIDOMIDE est évaluée par l EMEA comme thérapie orale pour
FIPROTEC, PIPETTES CONTRE PUCES ET TIQUES :
 FIPROTEC, PIPETTES CONTRE PUCES ET TIQUES : FIPROTEC 50 MG SOLUTION SPOT-ON POUR CHAT Composition :Une pipette de 0,50 ml contient 50 mg de Fipronil. Indications d utilisation : Chez les chats : - Traitement
FIPROTEC, PIPETTES CONTRE PUCES ET TIQUES : FIPROTEC 50 MG SOLUTION SPOT-ON POUR CHAT Composition :Une pipette de 0,50 ml contient 50 mg de Fipronil. Indications d utilisation : Chez les chats : - Traitement
La lutte contre la tuberculose est régie par l arrêté royal du 17 octobre 2002.
 Le diagnostic de la tuberculose bovine La lutte contre la tuberculose est régie par l arrêté royal du 17 octobre 2002. 1. Tuberculination Dans la première phase d une infection de tuberculose bovine (Mycobacterium
Le diagnostic de la tuberculose bovine La lutte contre la tuberculose est régie par l arrêté royal du 17 octobre 2002. 1. Tuberculination Dans la première phase d une infection de tuberculose bovine (Mycobacterium
NOTICE : INFORMATION DE L UTILISATEUR Version 3.0, 04/2013
 NOTICE : INFORMATION DE L UTILISATEUR Version 3.0, 04/2013 1 NOTICE : INFORMATION DE L UTILISATEUR ALEVE 220 mg, comprimés pelliculés Naproxène sodique Veuillez lire attentivement cette notice avant de
NOTICE : INFORMATION DE L UTILISATEUR Version 3.0, 04/2013 1 NOTICE : INFORMATION DE L UTILISATEUR ALEVE 220 mg, comprimés pelliculés Naproxène sodique Veuillez lire attentivement cette notice avant de
Le VIH et votre foie
 Le VIH et votre foie Le VIH et votre foie Que dois-je savoir au sujet de mon foie? Votre foie joue un rôle incroyablement important. Il filtre votre sang en éliminant les substances nocives (toxiques)
Le VIH et votre foie Le VIH et votre foie Que dois-je savoir au sujet de mon foie? Votre foie joue un rôle incroyablement important. Il filtre votre sang en éliminant les substances nocives (toxiques)
ACTUALITES THERAPEUTIQUES. Dr Sophie PITTION (CHU Nancy) Metz, le 2 Juin 2012
 ACTUALITES THERAPEUTIQUES Dr Sophie PITTION (CHU Nancy) Metz, le 2 Juin 2012 Traitement de fond Objectifs: Réduire le nombre de poussées Arrêter ou freiner la progression du handicap Les traitements disponibles
ACTUALITES THERAPEUTIQUES Dr Sophie PITTION (CHU Nancy) Metz, le 2 Juin 2012 Traitement de fond Objectifs: Réduire le nombre de poussées Arrêter ou freiner la progression du handicap Les traitements disponibles
CONCOURS DE L INTERNAT EN PHARMACIE
 Ministère de l enseignement supérieur et de la recherche Ministère de la santé et des sports CONCOURS DE L INTERNAT EN PHARMACIE Valeurs biologiques usuelles Edition de Novembre 2009 (6 pages) Conseil
Ministère de l enseignement supérieur et de la recherche Ministère de la santé et des sports CONCOURS DE L INTERNAT EN PHARMACIE Valeurs biologiques usuelles Edition de Novembre 2009 (6 pages) Conseil
Résistance aux Antimicrobiens: Ensemble, nous pouvons réduire ce risque
 Résistance aux Antimicrobiens: Ensemble, nous pouvons réduire ce risque Débats de Santé Publique 2014 Carmem Lúcia Pessoa-Silva, MD, PhD Health Security and Environment, WHO Headquarters, Geneva [email protected]
Résistance aux Antimicrobiens: Ensemble, nous pouvons réduire ce risque Débats de Santé Publique 2014 Carmem Lúcia Pessoa-Silva, MD, PhD Health Security and Environment, WHO Headquarters, Geneva [email protected]
GONADOTROPHINE CHORIONIQUE ENDO 5000 U.I./1 ml, lyophilisat et solution pour usage parentéral intramusculaire
 ésumé des Caractéristiques du Produit 1 sur 5 21/09/2010 14:31 Mis à jour : 16/02/2010 1. DENOMINATION DU MEDICAMENT GONADOTROPHINE CHORIONIQUE ENDO 5000 U.I./1 ml, lyophilisat et solution pour usage parentéral
ésumé des Caractéristiques du Produit 1 sur 5 21/09/2010 14:31 Mis à jour : 16/02/2010 1. DENOMINATION DU MEDICAMENT GONADOTROPHINE CHORIONIQUE ENDO 5000 U.I./1 ml, lyophilisat et solution pour usage parentéral
E03 - Héparines non fractionnées (HNF)
 E03-1 E03 - Héparines non fractionnées (HNF) Les héparines sont des anticoagulants agissant par voie parentérale. 1. Modalités d u tilisation Mode d action : l héparine est un cofacteur de l antithrombine
E03-1 E03 - Héparines non fractionnées (HNF) Les héparines sont des anticoagulants agissant par voie parentérale. 1. Modalités d u tilisation Mode d action : l héparine est un cofacteur de l antithrombine
Traitement des calculs urinaires par fragmentation (Lithotripsie par ondes de choc extracorporelle)
 Traitement des calculs urinaires par fragmentation (Lithotripsie par ondes de choc extracorporelle) Le traitement des calculs urétéraux et rénaux a beaucoup changé depuis 1980 avec la venue d un appareil
Traitement des calculs urinaires par fragmentation (Lithotripsie par ondes de choc extracorporelle) Le traitement des calculs urétéraux et rénaux a beaucoup changé depuis 1980 avec la venue d un appareil
INFECTIONS POST- TRAUMATIQUES SUR MATÉRIEL D'OSTÉOSYNTHÈSE. Accidentologie et épidémiologie bactérienne
 INFECTIONS POST- TRAUMATIQUES SUR MATÉRIEL D'OSTÉOSYNTHÈSE Accidentologie et épidémiologie bactérienne SOMMAIRE Accidentologie Qualité de vie Conséquences médico-économiques Particularités épidémiologiques
INFECTIONS POST- TRAUMATIQUES SUR MATÉRIEL D'OSTÉOSYNTHÈSE Accidentologie et épidémiologie bactérienne SOMMAIRE Accidentologie Qualité de vie Conséquences médico-économiques Particularités épidémiologiques
SURVEILLANCE DES SALARIES MANIPULANT DES DENREES ALIMENTAIRES
 SURVEILLANCE DES SALARIES MANIPULANT DES DENREES ALIMENTAIRES Dr Virginie NAEL Service de Santé au travail du personnel hospitalier CHU Nantes 44èmes journées FMC ANMTEPH / SOHF - Lausanne - Septembre
SURVEILLANCE DES SALARIES MANIPULANT DES DENREES ALIMENTAIRES Dr Virginie NAEL Service de Santé au travail du personnel hospitalier CHU Nantes 44èmes journées FMC ANMTEPH / SOHF - Lausanne - Septembre
Carte de soins et d urgence
 Direction Générale de la Santé Carte de soins et d urgence Emergency and Healthcare Card Porphyries Aiguës Hépatiques Acute Hepatic Porphyrias Type de Porphyrie* Déficit en Ala déhydrase Ala Dehydrase
Direction Générale de la Santé Carte de soins et d urgence Emergency and Healthcare Card Porphyries Aiguës Hépatiques Acute Hepatic Porphyrias Type de Porphyrie* Déficit en Ala déhydrase Ala Dehydrase
Information pour les patients dialysés qui prennent du chlorhydrate de sévélamer (RENAGEL)
 Les autorités de santé de l Union Européenne ont assorti la mise sur le marché du médicament RENAGEL de certaines conditions. Le plan obligatoire de minimalisation des risques en Belgique, dont cette information
Les autorités de santé de l Union Européenne ont assorti la mise sur le marché du médicament RENAGEL de certaines conditions. Le plan obligatoire de minimalisation des risques en Belgique, dont cette information
Livret des nouveaux anticoagulants oraux. Ce qu il faut savoir pour bien gérer leur utilisation
 Livret des nouveaux anticoagulants oraux Ce qu il faut savoir pour bien gérer leur utilisation DONNÉES DU PATIENT Nom Adresse Tél MÉDECIN TRAITANT Nom Adresse Tél SPÉCIALISTE Nom Hôpital Tél MÉDICAMENT
Livret des nouveaux anticoagulants oraux Ce qu il faut savoir pour bien gérer leur utilisation DONNÉES DU PATIENT Nom Adresse Tél MÉDECIN TRAITANT Nom Adresse Tél SPÉCIALISTE Nom Hôpital Tél MÉDICAMENT
ANTIBIOGRAMME VETERINAIRE DU COMITE DE L ANTIBIOGRAMME DE LA SOCIETE FRANCAISE DE MICROBIOLOGIE
 1 ANTIBIOGRAMME VETERINAIRE DU COMITE DE L ANTIBIOGRAMME DE LA SOCIETE FRANCAISE DE MICROBIOLOGIE Membres (2012 2013) MADEC Jean-Yves Coordonnateur, Anses Lyon DECOUSSER Jean-Winoc CHU Antoine Béclère
1 ANTIBIOGRAMME VETERINAIRE DU COMITE DE L ANTIBIOGRAMME DE LA SOCIETE FRANCAISE DE MICROBIOLOGIE Membres (2012 2013) MADEC Jean-Yves Coordonnateur, Anses Lyon DECOUSSER Jean-Winoc CHU Antoine Béclère
ANNEXE I RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
 ANNEXE I RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT 1 Ce médicament fait l objet d une surveillance supplémentaire qui permettra l identification rapide de nouvelles informations relatives à la sécurité. Les
ANNEXE I RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT 1 Ce médicament fait l objet d une surveillance supplémentaire qui permettra l identification rapide de nouvelles informations relatives à la sécurité. Les
Stelara (ustekinumab)
 Les autorités de santé de l Union européenne ont assorti la mise sur le marché du médicament Stelara de certaines conditions. Le plan obligatoire de minimisation des risques en Belgique, dont cette information
Les autorités de santé de l Union européenne ont assorti la mise sur le marché du médicament Stelara de certaines conditions. Le plan obligatoire de minimisation des risques en Belgique, dont cette information
La vaccination, une bonne protection
 Vaccin contre l hépatite A et l hépatite B La personne qui reçoit ce vaccin se protège contre l hépatite A, l hépatite B et leurs complications. L hépatite A et l hépatite B sont des infections du foie
Vaccin contre l hépatite A et l hépatite B La personne qui reçoit ce vaccin se protège contre l hépatite A, l hépatite B et leurs complications. L hépatite A et l hépatite B sont des infections du foie
Nouveaux anticoagulants oraux (NOAC)
 Nouveaux anticoagulants oraux (NOAC) Mécanisme d action Suivi biologique: comment et quand? A.Demulder IRIS-Lab 15/05/2013 1 Anticoagulants «traditionnels»: HNF Parentéral Suivi biologique avec ajustement
Nouveaux anticoagulants oraux (NOAC) Mécanisme d action Suivi biologique: comment et quand? A.Demulder IRIS-Lab 15/05/2013 1 Anticoagulants «traditionnels»: HNF Parentéral Suivi biologique avec ajustement
Acides et bases. Acides et bases Page 1 sur 6
 Acides et bases Acides et bases Page 1 sur 6 Introduction Sont réputés acides et bases au sens des règles de sécurité en vigueur en Suisse, les solides ou liquides qui ont une réaction acide ou alcaline
Acides et bases Acides et bases Page 1 sur 6 Introduction Sont réputés acides et bases au sens des règles de sécurité en vigueur en Suisse, les solides ou liquides qui ont une réaction acide ou alcaline
IMIJECT 6 mg/0,5 ml, solution injectable pour voie sous-cutanée en seringue pré-remplie
 1 sur 6 13/09/2010 16:58 Mis à jour : 23/02/2009 1. DENOMINATION DU MEDICAMENT IMIJECT 6 mg/0,5 ml, solution injectable pour voie sous-cutanée en seringue pré-remplie 2. COMPOSITION QUALITATIVE ET QUANTITATIVE
1 sur 6 13/09/2010 16:58 Mis à jour : 23/02/2009 1. DENOMINATION DU MEDICAMENT IMIJECT 6 mg/0,5 ml, solution injectable pour voie sous-cutanée en seringue pré-remplie 2. COMPOSITION QUALITATIVE ET QUANTITATIVE
Traiter la goutte sans être débordé
 Fédération des médecins omnipraticiens du Québec Traiter la goutte sans être débordé Hélène Demers et Michel Lapierre Vous voulez traiter et prévenir la goutte? Lisez ce qui suit! Les différentes phases
Fédération des médecins omnipraticiens du Québec Traiter la goutte sans être débordé Hélène Demers et Michel Lapierre Vous voulez traiter et prévenir la goutte? Lisez ce qui suit! Les différentes phases
Peroxyacide pour l'hygiène dans les industries agroalimentaires
 P3-oxonia active Description Peroxyacide pour l'hygiène dans les industries agroalimentaires Qualités Le P3-oxonia active est efficace à froid. Il n'est ni rémanent ni polluant. Il ne contient pas d'acide
P3-oxonia active Description Peroxyacide pour l'hygiène dans les industries agroalimentaires Qualités Le P3-oxonia active est efficace à froid. Il n'est ni rémanent ni polluant. Il ne contient pas d'acide
Insuffisance rénale. Définition. o Insuffisance rénale aiguë
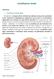 Insuffisance rénale Définition o Insuffisance rénale aiguë Se traduit par un brusque arrêt de la filtration des déchets du sang et de la production d urine. Associée à un déséquilibre de l organisme en
Insuffisance rénale Définition o Insuffisance rénale aiguë Se traduit par un brusque arrêt de la filtration des déchets du sang et de la production d urine. Associée à un déséquilibre de l organisme en
NOTICE: INFORMATION DE L UTILISATEUR. Dulcolax bisacodyl 5 mg comprimés enrobés (bisacodyl)
 NOTICE: INFORMATION DE L UTILISATEUR Dulcolax bisacodyl 5 mg comprimés enrobés (bisacodyl) Veuillez lire attentivement cette notice avant de prendre ce médicament. Elle contient des informations importantes
NOTICE: INFORMATION DE L UTILISATEUR Dulcolax bisacodyl 5 mg comprimés enrobés (bisacodyl) Veuillez lire attentivement cette notice avant de prendre ce médicament. Elle contient des informations importantes
COMMISSION DE LA TRANSPARENCE. Avis. 23 mai 2007
 COMMISSION DE LA TRANSPARENCE Avis 23 mai 2007 SUTENT 12,5 mg, gélule Flacon de 30 (CIP: 376 265-0) SUTENT 25 mg, gélule Flacon de 30 (CIP: 376 266-7) SUTENT 50 mg, gélule Flacon de 30 (CIP: 376 267-3)
COMMISSION DE LA TRANSPARENCE Avis 23 mai 2007 SUTENT 12,5 mg, gélule Flacon de 30 (CIP: 376 265-0) SUTENT 25 mg, gélule Flacon de 30 (CIP: 376 266-7) SUTENT 50 mg, gélule Flacon de 30 (CIP: 376 267-3)
NOTICE: INFORMATION DE L UTILISATEUR. Bisolax 5 mg comprimés enrobés. Bisacodyl
 NOTICE: INFORMATION DE L UTILISATEUR Bisolax 5 mg comprimés enrobés Bisacodyl Veuillez lire attentivement cette notice avant d utiliser ce médicament car elle contient des informations importantes pour
NOTICE: INFORMATION DE L UTILISATEUR Bisolax 5 mg comprimés enrobés Bisacodyl Veuillez lire attentivement cette notice avant d utiliser ce médicament car elle contient des informations importantes pour
Conseils aux patients* Lutter activement. *pour les patients ayant subi une opération de remplacement de la hanche ou du genou
 Conseils aux patients* Lutter activement contre la thrombose *pour les patients ayant subi une opération de remplacement de la hanche ou du genou 2 Mentions légales Directeur de la publication : Bayer
Conseils aux patients* Lutter activement contre la thrombose *pour les patients ayant subi une opération de remplacement de la hanche ou du genou 2 Mentions légales Directeur de la publication : Bayer
Point d Information. Le PRAC a recommandé que le RCP soit modifié afin d inclure les informations suivantes:
 Point d Information Médicaments à base d ivabradine, de codéine, médicaments contenant du diméthyl fumarate, du mycophénolate mofétil/acide mycophénolique, de l octocog alpha, spécialité Eligard (contenant
Point d Information Médicaments à base d ivabradine, de codéine, médicaments contenant du diméthyl fumarate, du mycophénolate mofétil/acide mycophénolique, de l octocog alpha, spécialité Eligard (contenant
Information professionnelle du Compendium Suisse des Médicaments. Aridol TRIMEDAL
 Aridol TRIMEDAL OEMéd Composition Principe actif: Mannitol. Excipients Gélules de 5, 10, 20 et 40 mg: Colorant: dioxyde de titane E 171. Gélules de 10, 20 et 40 mg: Colorant: oxyde de fer E 172. Forme
Aridol TRIMEDAL OEMéd Composition Principe actif: Mannitol. Excipients Gélules de 5, 10, 20 et 40 mg: Colorant: dioxyde de titane E 171. Gélules de 10, 20 et 40 mg: Colorant: oxyde de fer E 172. Forme
1 - Que faut-il retenir sur les anticoagulants oraux?
 La nouvelle convention pharmaceutique offre l opportunité aux pharmaciens d accompagner les patients traités par anticoagulants oraux au long cours afin de prévenir les risques iatrogéniques. Les anticoagulants
La nouvelle convention pharmaceutique offre l opportunité aux pharmaciens d accompagner les patients traités par anticoagulants oraux au long cours afin de prévenir les risques iatrogéniques. Les anticoagulants
Transfusions sanguines, greffes et transplantations
 Transfusions sanguines, greffes et transplantations Chiffres clés en 2008 La greffe d organes est pratiquée depuis plus de 50 ans. 4 620 malades ont été greffés. 1 563 personnes ont été prélevées. 222
Transfusions sanguines, greffes et transplantations Chiffres clés en 2008 La greffe d organes est pratiquée depuis plus de 50 ans. 4 620 malades ont été greffés. 1 563 personnes ont été prélevées. 222
Plan. Introduction. Les Nouveaux Anticoagulants Oraux et le sujet âgé. Audit de prescription au Centre Hospitalier Geriatrique du Mont d Or
 Plan Introduction Les Nouveaux Anticoagulants Oraux et le sujet âgé Audit de prescription au Centre Hospitalier Geriatrique du Mont d Or Introduction NACO: une actualité brûlante! AVK: Plus forte incidence
Plan Introduction Les Nouveaux Anticoagulants Oraux et le sujet âgé Audit de prescription au Centre Hospitalier Geriatrique du Mont d Or Introduction NACO: une actualité brûlante! AVK: Plus forte incidence
Maternité et activités sportives
 Maternité et activités sportives L obstétricien est de plus en plus souvent interrogé sur les avantages et les risques de maintenir ou de débuter une APS ou de loisir pendant la grossesse. Transformations
Maternité et activités sportives L obstétricien est de plus en plus souvent interrogé sur les avantages et les risques de maintenir ou de débuter une APS ou de loisir pendant la grossesse. Transformations
L ACCÈS VEINEUX DE COURTE DURÉE CHEZ L ENFANT ET LE NOUVEAU-NÉ
 L ACCÈS VEINEUX DE COURTE DURÉE CHEZ L ENFANT ET LE NOUVEAU-NÉ Plan de la présentation Introduction L enfant Le cathéter court La voie veineuse centrale La voie intra-osseuse Plan de la présentation Le
L ACCÈS VEINEUX DE COURTE DURÉE CHEZ L ENFANT ET LE NOUVEAU-NÉ Plan de la présentation Introduction L enfant Le cathéter court La voie veineuse centrale La voie intra-osseuse Plan de la présentation Le
CLINIMIX AVIS DE LA COMMISSION DE LA TRANSPARENCE
 CLINIMIX AVIS DE LA COMMISSION DE LA TRANSPARENCE BAXTER_CLINIMIX N9G15 E et N12G20E_Avis CT_14-02-2007.pdf BAXTER_CLINIMIX N9G15E N12G20E N14G30 N17G35_Avis CT_12-12-2001.pdf BAXTER_CLINIMIX changement
CLINIMIX AVIS DE LA COMMISSION DE LA TRANSPARENCE BAXTER_CLINIMIX N9G15 E et N12G20E_Avis CT_14-02-2007.pdf BAXTER_CLINIMIX N9G15E N12G20E N14G30 N17G35_Avis CT_12-12-2001.pdf BAXTER_CLINIMIX changement
Nurofen 400 Fastcaps, 400 mg capsules (molles) Ibuprofène
 NOTICE : INFORMATION DE L UTILISATEUR Nurofen 400 Fastcaps, 400 mg capsules (molles) Ibuprofène Veuillez lire attentivement cette notice avant de prendre ce médicament. Elle contient des informations importantes
NOTICE : INFORMATION DE L UTILISATEUR Nurofen 400 Fastcaps, 400 mg capsules (molles) Ibuprofène Veuillez lire attentivement cette notice avant de prendre ce médicament. Elle contient des informations importantes
LISTE DES ACTES ET PRESTATIONS - AFFECTION DE LONGUE DURÉE HÉPATITE CHRONIQUE B
 LISTE DES ACTES ET PRESTATIONS - AFFECTION DE LONGUE DURÉE HÉPATITE CHRONIQUE B Actualisation février 2009 Ce document est téléchargeable sur www.has-sante.fr Haute Autorité de santé Service communication
LISTE DES ACTES ET PRESTATIONS - AFFECTION DE LONGUE DURÉE HÉPATITE CHRONIQUE B Actualisation février 2009 Ce document est téléchargeable sur www.has-sante.fr Haute Autorité de santé Service communication
1. Identification de la substance ou préparation et de la Société. 2. Composition/ informations sur les composants
 Date d impression : 23/08/02 Valable à partir du : 08.08.01 Page: 1/7 1. Identification de la substance ou préparation et de la Société Données relatives au produit : Nom commercial : KNAUF ZADUR Mortier
Date d impression : 23/08/02 Valable à partir du : 08.08.01 Page: 1/7 1. Identification de la substance ou préparation et de la Société Données relatives au produit : Nom commercial : KNAUF ZADUR Mortier
Tuberculose bovine. Situation actuelle
 Tuberculose bovine Situation actuelle 21 mai 2013 Dr G. Peduto Vétérinaire cantonal Service de la consommation et des affaires vétérinaires 1 Tuberculose bovine La Suisse est indemne depuis 1959 Dernier
Tuberculose bovine Situation actuelle 21 mai 2013 Dr G. Peduto Vétérinaire cantonal Service de la consommation et des affaires vétérinaires 1 Tuberculose bovine La Suisse est indemne depuis 1959 Dernier
PARTIE II : RISQUE INFECTIEUX ET PROTECTION DE L ORGANISME. Chapitre 1 : L Homme confronté aux microbes de son environnement
 PARTIE II : RISQUE INFECTIEUX ET PROTECTION DE L ORGANISME Chapitre 1 : L Homme confronté aux microbes de son environnement I- Les microbes dans notre environnement Qu est-ce qu un microbe? Où se trouvent-ils?
PARTIE II : RISQUE INFECTIEUX ET PROTECTION DE L ORGANISME Chapitre 1 : L Homme confronté aux microbes de son environnement I- Les microbes dans notre environnement Qu est-ce qu un microbe? Où se trouvent-ils?
Pseudotumor cerebri. Anatomie Le cerveau et la moelle épinière baignent dans un liquide clair, appelé le liquide céphalo-rachidien (LCR).
 Hypertension intracrânienne idiopathique Pseudotumor cerebri Votre médecin pense que vous pouvez souffrir d hypertension intracrânienne idiopathique connue aussi sous le nom de «pseudotumeur cérébrale».
Hypertension intracrânienne idiopathique Pseudotumor cerebri Votre médecin pense que vous pouvez souffrir d hypertension intracrânienne idiopathique connue aussi sous le nom de «pseudotumeur cérébrale».
Que sont les. inhibiteurs?
 Que sont les inhibiteurs? TABLE DES MATIÈRES Publié par la Fédération mondiale de l hémophilie (FMH) Fédération mondiale de l hémophilie, 2010 La FMH encourage la redistribution de ses publications à des
Que sont les inhibiteurs? TABLE DES MATIÈRES Publié par la Fédération mondiale de l hémophilie (FMH) Fédération mondiale de l hémophilie, 2010 La FMH encourage la redistribution de ses publications à des
Vivre en santé après le traitement pour un cancer pédiatrique
 PRÉCAUTIONS POUR LES INDIVIDUS SANS RATE FONCTIONNELLE La rate, c est quoi? La rate est un organe situé du coté gauche, vers le haut de l abdomen, sous les côtes, derrière l estomac. Une rate normale a
PRÉCAUTIONS POUR LES INDIVIDUS SANS RATE FONCTIONNELLE La rate, c est quoi? La rate est un organe situé du coté gauche, vers le haut de l abdomen, sous les côtes, derrière l estomac. Une rate normale a
La maladie de Berger Néphropathie à IgA
 Néphropathie à IgA La maladie Le diagnostic Les aspects génétiques Le traitement, la prise en charge, la prévention Vivre avec En savoir plus Madame, Monsieur, Cette fiche est destinée à vous informer
Néphropathie à IgA La maladie Le diagnostic Les aspects génétiques Le traitement, la prise en charge, la prévention Vivre avec En savoir plus Madame, Monsieur, Cette fiche est destinée à vous informer
I - CLASSIFICATION DU DIABETE SUCRE
 I - CLASSIFICATION DU DIABETE SUCRE 1- Définition : Le diabète sucré se définit par une élévation anormale et chronique de la glycémie. Cette anomalie est commune à tous les types de diabète sucré, mais
I - CLASSIFICATION DU DIABETE SUCRE 1- Définition : Le diabète sucré se définit par une élévation anormale et chronique de la glycémie. Cette anomalie est commune à tous les types de diabète sucré, mais
Parasites externes du chat et du chien
 Parasites externes du chat et du chien Identification, prévention et traitement Les tiques Les tiques transmettent des maladies parfois mortelles. La prévention est la meilleure arme. 1 - Où les trouve-t-on?
Parasites externes du chat et du chien Identification, prévention et traitement Les tiques Les tiques transmettent des maladies parfois mortelles. La prévention est la meilleure arme. 1 - Où les trouve-t-on?
Il est bien établi que le réseau d eau hospitalier peut
 Les micro-organismes de l eau impliqués dans les infections nosocomiales Depuis 2001 chez Pall, en charge de l information scientifique et réglementaire dans les domaines d applications couverts par la
Les micro-organismes de l eau impliqués dans les infections nosocomiales Depuis 2001 chez Pall, en charge de l information scientifique et réglementaire dans les domaines d applications couverts par la
Hémostase et Endocardite Surveillance des anticoagulants. Docteur Christine BOITEUX
 Hémostase et Endocardite Surveillance des anticoagulants Docteur Christine BOITEUX Théorie Endocardites et anticoagulation POUR Thromboses Emboles septiques CONTRE Favorise emboles septiques et diffusion
Hémostase et Endocardite Surveillance des anticoagulants Docteur Christine BOITEUX Théorie Endocardites et anticoagulation POUR Thromboses Emboles septiques CONTRE Favorise emboles septiques et diffusion
TenderWet active, le pansement irrigo-absorbant unique pour une détersion active!
 aide à guérir. TenderWet active, le pansement irrigo-absorbant unique pour une détersion active! Soin de plaies Tenderwet active, le pansement irrigopour la détersion efficace et pratique de toutes La
aide à guérir. TenderWet active, le pansement irrigo-absorbant unique pour une détersion active! Soin de plaies Tenderwet active, le pansement irrigopour la détersion efficace et pratique de toutes La
Principales causes de décès selon le groupe d âge. 0 24 25 44 45 64 65 84 85 et plus
 Module 2 Exercice 1: Cellules souches hématopoïétiques 1. Causes de décès en Suisse (2010) La figure suivante montre les causes de décès les plus fréquentes en Suisse en 2010, telles qu elles ont été relevées
Module 2 Exercice 1: Cellules souches hématopoïétiques 1. Causes de décès en Suisse (2010) La figure suivante montre les causes de décès les plus fréquentes en Suisse en 2010, telles qu elles ont été relevées
Le don de moelle osseuse :
 DON DE MOELLE OSSEUSE Le don de moelle osseuse : se décider aujourd hui, s engager pour longtemps LA MOELLE OSSEUSE ET SA GREFFE La moelle osseuse C est le tissu mou dans le centre du corps des os qui
DON DE MOELLE OSSEUSE Le don de moelle osseuse : se décider aujourd hui, s engager pour longtemps LA MOELLE OSSEUSE ET SA GREFFE La moelle osseuse C est le tissu mou dans le centre du corps des os qui
La drépanocytose. Sikkelcelziekte (Frans)
 La drépanocytose Sikkelcelziekte (Frans) Qu est-ce que la drépanocytose? La drépanocytose est une maladie causée par un changement héréditaire du pigment rouge dans les globules rouges : l hémoglobine.
La drépanocytose Sikkelcelziekte (Frans) Qu est-ce que la drépanocytose? La drépanocytose est une maladie causée par un changement héréditaire du pigment rouge dans les globules rouges : l hémoglobine.
Protégeons-nous ensemble!
 Grippe saisonnière. Protégeons-nous ensemble! Informations importantes pour vous et votre famille. www.sevaccinercontrelagrippe.ch www.ofsp.admin.ch B C Qu est-ce que la grippe saisonnière et quels en
Grippe saisonnière. Protégeons-nous ensemble! Informations importantes pour vous et votre famille. www.sevaccinercontrelagrippe.ch www.ofsp.admin.ch B C Qu est-ce que la grippe saisonnière et quels en
