Alemtuzumab (Lemtrada * ) réduit significativement les rechutes dans la sclérose en plaques comparé à l interféron Bêta-1a dans une étude de Phase III
|
|
|
- Paul Marchand
- il y a 8 ans
- Total affichages :
Transcription
1 COMMUNIQUE DE PRESSE Alemtuzumab (Lemtrada * ) réduit significativement les rechutes dans la sclérose en plaques comparé à l interféron Bêta-1a dans une étude de Phase III - Présentation de nouvelles données de CARE-MS I au 5 ème Congrès de l ECTRIMS/ACTRIMS - - Ces données montrent que 78% des patients traités par alemtuzumab n ont pas présenté de rechutes pendant deux ans par rapport à IFNß-1a à forte dose - Paris, France Le 22 Octobre 2011 Sanofi (EURONEXT : SAN et NYSE : SNY) et sa filiale Genzyme annoncent aujourd hui de nouvelles données tirées de CARE-MS I, la première de deux études cliniques randomisées de Phase III comparant le médicament expérimental alemtuzumab (Lemtrada ) à Rebif (forte dose d interféron bêta-1a par voie sous-cutanée) chez des patients atteints de sclérose en plaques de type récurrente-rémittente (SEP). Ces nouvelles données montrent que 78 % des patients traités par alemtuzumab n ont pas présenté de rechutes pendant deux ans, ce qui constitue une amélioration statistiquement significative par rapport à l interféron bêta-1a (78 % contre 59 % à deux ans, p<0,0001), satisfaisant ainsi à un critère secondaire d évaluation de l étude. Les résultats de CARE-MS I ont été présentés aujourd hui au 5 ème Congrès triennal de l ECTRIMS/ACTRIMS sur la sclérose en plaques (European and Americas Committees for Treatment and Research in Multiple Sclerosis). Genzyme développe alemtuzumab pour le traitement de la sclérose en plaques récurrente en collaboration avec Bayer HealthCare. Comme annoncé précédemment, le traitement par deux cycles annuels d alemtuzumab a entraîné une réduction de 55 % du taux de rechutes par rapport à l interféron bêta-1a au cours des deux ans de l'étude (p<0,0001), satisfaisant ainsi au premier critère d évaluation principal et donc aux critères prédéterminés du protocole pour déclarer que l'étude est un succès. Après deux ans, très peu de patients (8 %) traités par alemtuzumab ont présenté une augmentation (ou détérioration) durable du handicap, mesurée au moyen de l échelle EDSS (Expanded Disability Status Scale), comparativement à 11 % des patients du groupe interféron bêta-1a. Toutefois, la différence entre les groupes au titre de ce deuxième critère d évaluation principal n était pas statistiquement significative (p=0,22) et aucune différence n a été relevé dans le score EDSS moyen entre les deux groupes. L étude CARE-MS I a comparé un traitement par alemtuzumab (12 mg/jour par injection intraveineuse pendant 5 jours suivi d une seconde injection intraveineuse puis pendant 3 jours un an plus tard) à trois injections souscutanées d interféron bêta-1a (44 µg) trois fois par semaine, chez 581 patients atteints de SEP de type récurrente-rémittente n ayant jamais reçu de traitement de fond pour leur SEP auparavant, à l exception de corticoïdes. «CARE-MS I confirme que dans le cadre d une comparaison directe avec Rebif, l activité de la maladie est significativement réduite chez les patients présentant une SEP récurrente précoce traités par alemtuzumab, sur une période d observation de deux ans», a déclaré le professeur Alastair Compston, Président du Comité de pilotage de l étude et Directeur du Département de neurosciences cliniques à l Université de Cambridge au Royaume-Uni. «Ces données confirment le solide profil d efficacité et le potentiel d alemtuzumab pour les patients atteints de sclérose en plaques récurrente nécessitant un traitement plus efficace que les options thérapeutiques disponibles actuellement.» 1/5
2 «Les effets remarquables de Lemtrada sur les rechutes et divers critères cliniques et d imagerie, par rapport à ceux de Rebif, confirment le potentiel de ce médicament et son efficacité pour les patients atteints de sclérose en plaques», a déclaré le Dr. David Meeker, Chief Operating Officer, Genzyme. «Nous attendons avec impatience les résultats de CARE-MS II, notre deuxième étude de Phase III, plus tard cette année, pour confirmer les effets positifs de Lemtrada chez des patients dont la maladie a continué de progresser sous traitement.» Parmi les données complémentaires de l étude CARE-MS I présentées aujourd hui figurent les résultats applicables à d autres critères d évaluation secondaires soulignant le rôle positif d alemtuzumab. Ainsi, comparés aux patients traités par interféron bêta-1a, les patients traités par alemtuzumab ont obtenu de meilleurs scores MSFC (Multiple Sclerosis Functional Composite ; changement moyen par rapport au score de référence de 0,12 contre 0,05 à l année deux, p=0,012). Le score MSFC est une mesure composite des fonctions physiques et cognitives. Le changement médian en pourcentage du volume des lésions hyperintenses visibles en T2 par imagerie par résonance magnétique (IRM) à l année deux s est établi à -9,3 pour l alemtuzumab, contre -6,5 pour l interféron bêta-1a (p=0,31). Les autres résultats IRM donnent à penser que l alemtuzumab a permis d enregistrer des améliorations pour plusieurs critères d imagerie qui vont, d une manière générale, dans le même sens que les améliorations cliniques observées. Une amélioration statistiquement significative a ainsi été observée pour l alemtuzumab par rapport à l interféron bêta-1a dans le pourcentage de patients présentant de nouvelles lésions hyperintenses visibles en T2 ou des lésions plus volumineuses (49 contre 58, p=0,035), de nouvelles lésions rehaussées par injection de gadolinium (15 contre 27, p=0,0006) et de nouvelles lésions hypo-intenses visibles en T1 (24 contre 31, p=0,05). De plus, les patients traités par alemtuzumab ont présenté moins de changement au niveau de la fraction du parenchyme cérébral, une mesure de l atrophie cérébrale, comparativement à l interféron bêta-1a (changement médian par rapport au départ -0,87 contre - 1,49, p<0,0001), ce qui d un point de vue statistique constitue un résultat hautement significatif. Données de tolérance de CARE-MS I Les événements indésirables fréquents associés à alemtuzumab dans l étude CARE-MS I ont inclus des réactions liées à la perfusion, généralement légères à modérées. L incidence des infections a augmenté, les plus fréquentes comprenant des infections des voies respiratoires supérieures et des voies urinaires et un herpès buccal. Les infections étaient essentiellement légères à modérées et aucune n a engagé le pronostic vital ou ne s est révélée fatale. L incidence des événements indésirables graves a été similaire dans les deux groupes de traitement (18,4 % pour l alemtuzumab contre 14,4 % pour l interféron bêta-1a). En ce qui concerne les troubles auto-immuns, 18,1 % des patients traités par alemtuzumab ont développé un dysfonctionnement thyroïdien auto-immun et 0,8 % une thrombocytopénie immunitaire pendant les 2 ans de l étude. Il n'y a eu aucun cas de glomérulonéphrite auto-immune. Les cas d'auto-immunité ont été détectés et pris en charge par des traitements conventionnels. La surveillance de la survenue de cytopénies immunitaires et de dysfonctionnements thyroïdiens ou rénaux fait partie intégrante de tous les essais d alemtuzumab dans le traitement expérimental de la sclérose en plaques que sponsorise Genzyme. Informations complémentaires Un autre essai clinique de Phase III, CARE-MS II, est actuellement en cours pour évaluer et comparer alemtuzumab à l interféron bêta 1a dans le traitement de patients atteints de sclérose en plaques récurrenterémittente, ayant présenté une rechute sous traitement. Les premiers résultats de cette étude sont attendus au quatrième trimestre de Le Groupe entend déposer des demandes d homologation aux États-Unis et dans l Union européenne pour alemtuzumab dans la sclérose en plaques au cours du premier trimestre de 2012 et a obtenu de la FDA une évaluation accélérée dans le cadre de la procédure dite de «fast track». Dans la mesure où alemtuzumab n est pas encore approuvé dans le traitement de la sclérose en plaques, ce médicament ne peut être 2/5
3 administré aux patients atteints de cette maladie en dehors du cadre d un essai clinique officiel et réglementé prévoyant des mesures de surveillance appropriées. *Lemtrada est le nom de marque soumis aux autorités de santé pour alemtuzumab. A propos de l étude CARE-MS I CARE-MS I (comparaison de l efficacité d alemtuzumab et de Rebif dans la sclérose en plaques) avait pour but de déterminer si le médicament expérimental alemtuzumab permettait d obtenir des améliorations notables en termes d efficacité et de tolérance par rapport à un comparateur actif traditionnellement prescrit dans le traitement de la sclérose en plaques récurrente (interféron bêta 1a). CARE-MS I était un essai clinique international de Phase III, randomisé, comparant deux cycles annuels d alemtuzumab par voie intraveineuse, 12 mg/jour pendant 5 jours au départ puis pendant 3 jours un an plus tard, à trois injections sous-cutanées par semaine d interféron bêta-1a (44 µg) chez des patients naïfs de traitement atteints de SEP de type récurrente-rémittente. L étude a inclus 581 patients qui n avaient jamais reçu de traitement de fond pour leur sclérose en plaques, à l exception de corticoïdes. Les patients ont été randomisés selon un rapport de 2 pour 1, soit dans le groupe alemtuzumab, soit dans le groupe interféron bêta-1a. L évaluation des critères d efficacité principaux de l étude a été réalisée à intervalles réguliers par des neurologues indépendants qui ignoraient le traitement attribué aux patients. L étude comportait deux critères d évaluation principaux : réduction du taux de poussées et délai écoulé jusqu'à une accumulation durable du handicap pendant six mois (SAD). Sur la base des critères énoncés dans le protocole de l étude, l atteinte des deux critères d évaluation principaux (p<0,05) ou d un des deux critères moyennant une mesure plus stricte de la significativité statistique (p<0,025) permettait de déclarer l étude CARE-MS I un succès. Les critères d évaluation secondaires étaient les suivants : proportion de patients n ayant pas présenté de poussées à l année deux ; changement du score sur l échelle EDSS (Expended Disability Status Scale) par rapport au départ ; pourcentage de changement par rapport au départ du volume des lésions hyperintenses visibles en T2 par imagerie par résonance magnétique à l année deux, et acquisition d un handicap mesurée par les changements dans le score Multiple Sclerosis Functional Composite par rapport au départ. Accumulation durable du handicap (SAD) Représentation clinique de l aggravation du handicap du patient ; CARE-MS I a suivi ce critère pendant une durée de six mois. A propos d alemtuzumab Alemtuzumab est un anticorps monoclonal humanisé étudié dans le traitement de la sclérose en plaques récurrente. Lemtrada cible la glycoprotéine de surface CD52, souvent exprimée sur les lymphocytes B et T. Les résultats de recherches préliminaires donnent à penser que Lemtrada neutralise les lymphocytes B et T qui pourraient être responsables des lésions cellulaires caractéristiques de la sclérose en plaques. Cette neutralisation est suivie d un mode de reconstitution différent des lymphocytes. Lemtrada semble avoir peu ou pas d effet sur les autres cellules du système immunitaire. En plus des données de l étude CARE-MS I, une autre étude de Phase III, CARE-MS II, évaluera Lemtrada par rapport à l interféron bêta-1a chez des patients atteints de SEP récurrente-rémittente ayant rechuté sous traitement. 3/5
4 Genzyme possède les droits internationaux sur alemtuzumab et est le principal responsable de son développement et de sa commercialisation dans le traitement de la sclérose en plaques (SEP). Bayer HealthCare assure le codéveloppement d alemtuzumab dans la SEP avec Genzyme. Bayer HealthCare conserve une option de co-promotion d alemtuzumab dans le traitement de la SEP et recevra des paiements en fonction du chiffre d affaires de ce produit après l approbation de ce médicament par les autorités de santé et sa commercialisation. A propos de Genzyme Genzyme, entreprise pionnière en biotechnologies, a vocation à avoir un impact positif important sur la vie des patients atteints de maladies graves. Depuis sa création en 1981, l entreprise a développé des traitements innovants dans plusieurs domaines thérapeutiques, redonnant espoir aux patients. Ses produits et services se concentrent sur les maladies génétiques rares, les maladies rénales, l orthopédie, le cancer, la transplantation d organes et les maladies immunes. Genzyme fait partie du Groupe Sanofi. Les communiqués de presse de Genzyme et d autres informations sur l entreprise sont disponibles sur A propos de Sanofi Sanofi est un leader mondial et diversifié de la santé qui recherche, développe et commercialise des solutions thérapeutiques centrées sur les besoins des patients. Sanofi possède des atouts fondamentaux dans le domaine de la santé avec sept plateformes de croissance : la prise en charge du diabète, les vaccins humains, les produits innovants, les maladies rares, la santé grand public, les marchés émergents, et la santé animale. Sanofi est coté à Paris (EURONEXT : SAN) et à New York (NYSE : SNY). A propos de Bayer HealthCare Le Groupe Bayer est une entreprise internationale spécialisée dans les soins de santé, la nutrition et les matériaux hautes performances. Pilier santé du groupe Bayer AG, Bayer HealthCare est, avec un chiffre d'affaires de 16,913 milliards d'euros pour l'année 2010, l'une des toutes premières entreprises innovantes dans le secteur de la santé et des produits médicaux. Basée à Leverkusen, en Allemagne, l entreprise compte collaborateurs dans plus de 100 pays et elle est présente au niveau international au travers de quatre divisions opérant dans les secteurs de la santé animale, de la santé grand public, des soins médicaux et de la pharmacie. Elle a pour objectif de mettre au point et de fabriquer des produits destinés à améliorer la santé humaine et la santé animale dans le monde. Pour plus d informations, consultez Déclarations prospectives pour Sanofi Ce communiqué contient des déclarations prospectives. Ces déclarations ne constituent pas des faits historiques. Ces déclarations comprennent des projections et des estimations ainsi que les hypothèses sur lesquelles celles-ci reposent, des déclarations portant sur des projets, des objectifs, des intentions et des attentes concernant des résultats financiers, des événements, des opérations, des services futurs, le développement de produits et leur potentiel ou les performances futures. Ces déclarations prospectives peuvent souvent être identifiées par les mots «s'attendre à», «anticiper», «croire», «avoir l intention de», «estimer» ou «planifier», ainsi que par d autres termes similaires. Bien que la direction de Sanofi estime que ces déclarations prospectives sont raisonnables, les investisseurs sont alertés sur le fait que ces déclarations prospectives sont soumises à de nombreux risques et incertitudes, difficilement prévisibles et généralement en dehors du contrôle de Sanofi, qui peuvent impliquer que les résultats et événements effectifs réalisés diffèrent significativement de ceux qui sont exprimés, induits ou prévus dans les informations et déclarations prospectives. Ces risques et incertitudes comprennent notamment les incertitudes inhérentes à la recherche et développement, les futures données cliniques et analyses, y compris postérieures à la mise sur le marché, les décisions des autorités réglementaires, telles que la FDA ou l EMA, d approbation ou non, et à quelle date, de la demande de dépôt d un médicament, d un procédé ou d un produit biologique pour l un de ces produits candidats, ainsi que leurs décisions relatives à l étiquetage et d autres facteurs qui peuvent affecter la disponibilité ou le potentiel commercial de ces produits candidats, l absence de garantie que les produits candidats s ils sont approuvés seront un succès commercial, l approbation future et le succès commercial d alternatives thérapeutiques, la capacité du Groupe à saisir des opportunités de croissance externe ainsi que ceux qui sont développés ou identifiés dans les documents publics déposés par Sanofi auprès de l'amf et de la SEC, y compris ceux énumérés dans les rubriques «Facteurs de risque» et «Déclarations prospectives» du document de référence 2010 de Sanofi, qui a été déposé auprès de l AMF ainsi que dans les rubriques «Risk Factors» et «Cautionary Statement Concerning Forward-Looking Statements» du rapport annuel 2010 sur Form 20-F de Sanofi, qui a été déposé auprès de la SEC. Sanofi ne prend aucun engagement de mettre à jour les informations et déclarations prospectives sous réserve de la réglementation applicable notamment les articles et suivants du règlement général de l Autorité des marchés financiers. 4/5
5 Genzyme est une marque déposée et CARE-MS est la marque d un service de Genzyme Corporation. Tous droits réservés. Rebif est une marque déposée d EMD Serono, Inc. ou de ses filiales. Contacts : Genzyme Relations Presse Sanofi Relations Investisseurs Bo Piela Sébastien Martel Tél. : Tél. : +33 (0) Mobile : ir@sanofi.com bo.piela@genzyme.com Sanofi Relations Presse Marisol Péron Tél. : +33 (0) Mobile : +33 (0) marisol.peron@sanofi.com 5/5
Recommandation finale du Comité canadien d expertise sur les médicaments Version en langage clair
 Recommandation finale du Comité canadien d expertise sur les médicaments Version en langage clair FINGOLIMOD (Gilenya Novartis Pharmaceuticals Canada Inc.) Indication: sclérose en plaques Recommandation
Recommandation finale du Comité canadien d expertise sur les médicaments Version en langage clair FINGOLIMOD (Gilenya Novartis Pharmaceuticals Canada Inc.) Indication: sclérose en plaques Recommandation
Communiqué de presse. Merck Serono. 18 septembre 2008
 Communiqué de presse 18 septembre 2008 Merck Serono annonce le lancement de l'essai clinique ORACLE MS destiné à évaluer la cladribine en comprimés chez des patients à risque de développer une sclérose
Communiqué de presse 18 septembre 2008 Merck Serono annonce le lancement de l'essai clinique ORACLE MS destiné à évaluer la cladribine en comprimés chez des patients à risque de développer une sclérose
Les nouveaux traitements de fond de la SEP
 Sclérose en plaques : les nouveaux traitements Guillaume MATHEY, Hôpital de Metz-Mercy Les nouveaux traitements de fond de la SEP Le but des traitements de fond Forme par poussées 2 ième ligne TYSABRI
Sclérose en plaques : les nouveaux traitements Guillaume MATHEY, Hôpital de Metz-Mercy Les nouveaux traitements de fond de la SEP Le but des traitements de fond Forme par poussées 2 ième ligne TYSABRI
ACTUALITES THERAPEUTIQUES. Dr Sophie PITTION (CHU Nancy) Metz, le 2 Juin 2012
 ACTUALITES THERAPEUTIQUES Dr Sophie PITTION (CHU Nancy) Metz, le 2 Juin 2012 Traitement de fond Objectifs: Réduire le nombre de poussées Arrêter ou freiner la progression du handicap Les traitements disponibles
ACTUALITES THERAPEUTIQUES Dr Sophie PITTION (CHU Nancy) Metz, le 2 Juin 2012 Traitement de fond Objectifs: Réduire le nombre de poussées Arrêter ou freiner la progression du handicap Les traitements disponibles
Acquisition visant à renforcer significativement notre position dans le secteur des produits de santé grand public
 Communiqué de presse Bayer SAS 16 rue Jean-Marie Leclair CS 90106 69266 LYON 09 France Tél. : +33.4.72.85.43.21 www.bayer.fr Acquisition visant à renforcer significativement notre position dans le secteur
Communiqué de presse Bayer SAS 16 rue Jean-Marie Leclair CS 90106 69266 LYON 09 France Tél. : +33.4.72.85.43.21 www.bayer.fr Acquisition visant à renforcer significativement notre position dans le secteur
Information transmise sous l autorité de l Agence fédérale des médicaments et des produits de santé
 Les Direct Healthcare Professional Communications (DHPC) sont des courriers envoyés aux professionnels de la santé par les firmes pharmaceutiques, afin de les informer de risques potentiels apparus lors
Les Direct Healthcare Professional Communications (DHPC) sont des courriers envoyés aux professionnels de la santé par les firmes pharmaceutiques, afin de les informer de risques potentiels apparus lors
MISSION PARTENARIALE IMMUNOLOGIE - VACCINATION & INFECTIOLOGIE A l occasion de BIOPHARM AMERICA 2015 BOSTON, ETATS-UNIS 14 au 18 septembre 2015
 SAVE THE DATE! MISSION PARTENARIALE IMMUNOLOGIE - VACCINATION & INFECTIOLOGIE A l occasion de BIOPHARM AMERICA 2015 BOSTON, ETATS-UNIS 14 au 18 2015 BioPharm America est le plus grand événement de partenariats
SAVE THE DATE! MISSION PARTENARIALE IMMUNOLOGIE - VACCINATION & INFECTIOLOGIE A l occasion de BIOPHARM AMERICA 2015 BOSTON, ETATS-UNIS 14 au 18 2015 BioPharm America est le plus grand événement de partenariats
COMMISSION DE LA TRANSPARENCE AVIS DE LA COMMISSION. 10 octobre 2001
 COMMISSION DE LA TRANSPARENCE AVIS DE LA COMMISSION 10 octobre 2001 VIRAFERONPEG 50 µg 80 µg 100 µg 120 µg 150 µg, poudre et solvant pour solution injectable B/1 B/4 Laboratoires SCHERING PLOUGH Peginterféron
COMMISSION DE LA TRANSPARENCE AVIS DE LA COMMISSION 10 octobre 2001 VIRAFERONPEG 50 µg 80 µg 100 µg 120 µg 150 µg, poudre et solvant pour solution injectable B/1 B/4 Laboratoires SCHERING PLOUGH Peginterféron
Innovations thérapeutiques en transplantation
 Innovations thérapeutiques en transplantation 3èmes Assises de transplantation pulmonaire de la région Est Le 16 octobre 2010 Dr Armelle Schuller CHU Strasbourg Etat des lieux en transplantation : 2010
Innovations thérapeutiques en transplantation 3èmes Assises de transplantation pulmonaire de la région Est Le 16 octobre 2010 Dr Armelle Schuller CHU Strasbourg Etat des lieux en transplantation : 2010
Anticorps neutralisants des Interférons dans la Sclérose En Plaques en Bretagne
 Anticorps neutralisants des Interférons dans la Sclérose En Plaques en Bretagne Pr Gilles EDAN, Dr Emmanuelle LEPAGE, Morgane PIHAN (Interne), Virginie OLIVE, (Attaché de recherche clinique), Neurologie,
Anticorps neutralisants des Interférons dans la Sclérose En Plaques en Bretagne Pr Gilles EDAN, Dr Emmanuelle LEPAGE, Morgane PIHAN (Interne), Virginie OLIVE, (Attaché de recherche clinique), Neurologie,
LIGNES DIRECTRICES CLINIQUES TOUT AU LONG DU CONTINUUM DE SOINS : Objectif de ce chapitre. 6.1 Introduction 86
 LIGNES DIRECTRICES CLINIQUES TOUT AU LONG DU CONTINUUM DE SOINS : ÉTABLISSEMENT DE LIENS ENTRE LES PERSONNES CHEZ QUI UN DIAGNOSTIC D INFECTION À VIH A ÉTÉ POSÉ ET LES SERVICES DE SOINS ET DE TRAITEMENT
LIGNES DIRECTRICES CLINIQUES TOUT AU LONG DU CONTINUUM DE SOINS : ÉTABLISSEMENT DE LIENS ENTRE LES PERSONNES CHEZ QUI UN DIAGNOSTIC D INFECTION À VIH A ÉTÉ POSÉ ET LES SERVICES DE SOINS ET DE TRAITEMENT
Hiver 2013. Paysages changeants, produits en voie de commercialisation et conséquences pour les promoteurs de régimes
 Hiver 2013 Paysages changeants, produits en voie de commercialisation et conséquences pour les promoteurs de régimes Paysages changeants, produits en voie de commercialisation et conséquences pour les
Hiver 2013 Paysages changeants, produits en voie de commercialisation et conséquences pour les promoteurs de régimes Paysages changeants, produits en voie de commercialisation et conséquences pour les
Numéro 18 l 2011. l Traitements pharmacologiques et SEP
 Numéro 18 l 2011 l Traitements pharmacologiques et SEP Comité de Rédaction Fédération Internationale contre la Sclérose en Plaques (MSIF) La mission de la MSIF est de diriger le mouvement international
Numéro 18 l 2011 l Traitements pharmacologiques et SEP Comité de Rédaction Fédération Internationale contre la Sclérose en Plaques (MSIF) La mission de la MSIF est de diriger le mouvement international
Bulletin. Le mot du président Quel avenir pour les interférons et le Copaxone?
 Bulletin Numéro 34 I Novembre 2013 Vaincre la Sclérose en Plaques par la recherche Le mot du président Quel avenir pour les interférons et le Copaxone? Depuis 1992, les interférons (IFNs) et le Copaxone
Bulletin Numéro 34 I Novembre 2013 Vaincre la Sclérose en Plaques par la recherche Le mot du président Quel avenir pour les interférons et le Copaxone? Depuis 1992, les interférons (IFNs) et le Copaxone
TRAITEMENTS MODIFICATEURS DE L ÉVOLUTION DE LA SP AU CANADA
 175, rue Bloor Est Bureau 700, tour nord Toronto (Ontario) M4W 3R8 Téléphone : 416 922-6065 Télécopieur : 416 922-7538 www.scleroseenplaques.ca Juin 2007 TRAITEMENTS MODIFICATEURS DE L ÉVOLUTION DE LA
175, rue Bloor Est Bureau 700, tour nord Toronto (Ontario) M4W 3R8 Téléphone : 416 922-6065 Télécopieur : 416 922-7538 www.scleroseenplaques.ca Juin 2007 TRAITEMENTS MODIFICATEURS DE L ÉVOLUTION DE LA
Annick.robinson@merck.com dquirion@national.ca 514 428-2890 514 843-2302
 Communiqué de presse Relations avec les médias : Annick Robinson Dominique Quirion Merck NATIONAL Annick.robinson@merck.com dquirion@national.ca 514 428-2890 514 843-2302 Relations avec les investisseurs
Communiqué de presse Relations avec les médias : Annick Robinson Dominique Quirion Merck NATIONAL Annick.robinson@merck.com dquirion@national.ca 514 428-2890 514 843-2302 Relations avec les investisseurs
GTT annonce un excellent premier semestre 2014 avec un résultat net en hausse de 18 % Confirmation des objectifs 2014
 GTT annonce un excellent premier semestre 2014 avec un résultat net en hausse de 18 % Confirmation des objectifs 2014 Forte croissance du chiffre d affaires semestriel qui reflète les prises de commandes
GTT annonce un excellent premier semestre 2014 avec un résultat net en hausse de 18 % Confirmation des objectifs 2014 Forte croissance du chiffre d affaires semestriel qui reflète les prises de commandes
ANNEXE I RESUME DES CARACTERISTIQUES DU PRODUIT
 ANNEXE I RESUME DES CARACTERISTIQUES DU PRODUIT 1 1. DENOMINATION DU MÉDICAMENT Betaferon 250 microgrammes/ml, poudre et solvant pour solution injectable. 2. COMPOSITION QUALITATIVE ET QUANTITATIVE Interféron
ANNEXE I RESUME DES CARACTERISTIQUES DU PRODUIT 1 1. DENOMINATION DU MÉDICAMENT Betaferon 250 microgrammes/ml, poudre et solvant pour solution injectable. 2. COMPOSITION QUALITATIVE ET QUANTITATIVE Interféron
Item 169 : Évaluation thérapeutique et niveau de preuve
 Item 169 : Évaluation thérapeutique et niveau de preuve COFER, Collège Français des Enseignants en Rhumatologie Date de création du document 2010-2011 Table des matières ENC :...3 SPECIFIQUE :...3 I Différentes
Item 169 : Évaluation thérapeutique et niveau de preuve COFER, Collège Français des Enseignants en Rhumatologie Date de création du document 2010-2011 Table des matières ENC :...3 SPECIFIQUE :...3 I Différentes
Vue d ensemble : Office of Cellular, Tissue and Gene Therapies
 Vue d ensemble : Office of Cellular, Tissue and Gene Therapies DIAPOSITIVE 1 Cette présentation fournit une vue d ensemble de l Office of Cellular, Tissue, and Gene Therapies (bureau des thérapies cellulaires,
Vue d ensemble : Office of Cellular, Tissue and Gene Therapies DIAPOSITIVE 1 Cette présentation fournit une vue d ensemble de l Office of Cellular, Tissue, and Gene Therapies (bureau des thérapies cellulaires,
ALTO : des outils d information sur les pathologies thromboemboliques veineuses ou artérielles et leur traitement
 Communiqué de presse Bayer HealthCare S.A.S. Parc Eurasanté 220, avenue de la Recherche 59120 LOOS France Tel.+333 28 16 34 00 www.bayerhealthcare.fr Favoriser l observance avec ALTO : l engagement de
Communiqué de presse Bayer HealthCare S.A.S. Parc Eurasanté 220, avenue de la Recherche 59120 LOOS France Tel.+333 28 16 34 00 www.bayerhealthcare.fr Favoriser l observance avec ALTO : l engagement de
Y a-t-il une place pour un vaccin thérapeutique contre l hépatite B? H. Fontaine, Unité d Hépatologie Médicale, Hôpital Cochin
 Y a-t-il une place pour un vaccin thérapeutique contre l hépatite B? H. Fontaine, Unité d Hépatologie Médicale, Hôpital Cochin Objectifs thérapeutiques Inhibition de la réplication virale Négativation
Y a-t-il une place pour un vaccin thérapeutique contre l hépatite B? H. Fontaine, Unité d Hépatologie Médicale, Hôpital Cochin Objectifs thérapeutiques Inhibition de la réplication virale Négativation
Prise de position sur les biosimilaires. Résumé
 Prise de position sur les biosimilaires Résumé Les médicaments biotechnologiques, appelés également biomédicaments, occupent une place importante dans le traitement de maladies comme le cancer, la polyarthrite
Prise de position sur les biosimilaires Résumé Les médicaments biotechnologiques, appelés également biomédicaments, occupent une place importante dans le traitement de maladies comme le cancer, la polyarthrite
L EMEA accepte d évaluer la demande d autorisation de mise sur le marché de la LENALIDOMIDE
 L EMEA accepte d évaluer la demande d autorisation de mise sur le marché de la LENALIDOMIDE NEUCHATEL, Suisse, 7 avril/prnewswire/ -- - LA LENALIDOMIDE est évaluée par l EMEA comme thérapie orale pour
L EMEA accepte d évaluer la demande d autorisation de mise sur le marché de la LENALIDOMIDE NEUCHATEL, Suisse, 7 avril/prnewswire/ -- - LA LENALIDOMIDE est évaluée par l EMEA comme thérapie orale pour
DIAPOSITIVE 1 Cette présentation a trait à la réglementation sur les thérapies cellulaires.
 Produits de thérapie cellulaire DIAPOSITIVE 1 Cette présentation a trait à la réglementation sur les thérapies cellulaires. DIAPOSITIVE 2 La fabrication des thérapies cellulaires est examinée par la Division
Produits de thérapie cellulaire DIAPOSITIVE 1 Cette présentation a trait à la réglementation sur les thérapies cellulaires. DIAPOSITIVE 2 La fabrication des thérapies cellulaires est examinée par la Division
vaccin pneumococcique polyosidique conjugué (13-valent, adsorbé)
 EMA/90006/2015 EMEA/H/C/001104 Résumé EPAR à l intention du public vaccin pneumococcique polyosidique conjugué (13-valent, adsorbé) Le présent document est un résumé du rapport européen public d évaluation
EMA/90006/2015 EMEA/H/C/001104 Résumé EPAR à l intention du public vaccin pneumococcique polyosidique conjugué (13-valent, adsorbé) Le présent document est un résumé du rapport européen public d évaluation
ANNEXE I RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT
 ANNEXE I RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT 1 1. DÉNOMINATION DU MÉDICAMENT Extavia 250 microgrammes/ml, poudre et solvant pour solution injectable. 2. COMPOSITION QUALITATIVE ET QUANTITATIVE Un flacon
ANNEXE I RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT 1 1. DÉNOMINATION DU MÉDICAMENT Extavia 250 microgrammes/ml, poudre et solvant pour solution injectable. 2. COMPOSITION QUALITATIVE ET QUANTITATIVE Un flacon
Transgene accorde une option de licence exclusive pour le développement et la commercialisation de son produit d immunothérapie TG4010
 Parc d Innovation d Illkirch, France, le 10 mars 2010 Transgene accorde une option de licence exclusive pour le développement et la commercialisation de son produit d immunothérapie TG4010 Transgene (Euronext
Parc d Innovation d Illkirch, France, le 10 mars 2010 Transgene accorde une option de licence exclusive pour le développement et la commercialisation de son produit d immunothérapie TG4010 Transgene (Euronext
Quelles sont les options?
 Quelles sont les options? Un DVD et un livret d information de Choisir un traitement contre la SP Quelles sont les options? Si votre médecin vous a recommandé de commencer un traitement modificateur de
Quelles sont les options? Un DVD et un livret d information de Choisir un traitement contre la SP Quelles sont les options? Si votre médecin vous a recommandé de commencer un traitement modificateur de
COMMISSION DE LA TRANSPARENCE. Avis. 23 mai 2007
 COMMISSION DE LA TRANSPARENCE Avis 23 mai 2007 SUTENT 12,5 mg, gélule Flacon de 30 (CIP: 376 265-0) SUTENT 25 mg, gélule Flacon de 30 (CIP: 376 266-7) SUTENT 50 mg, gélule Flacon de 30 (CIP: 376 267-3)
COMMISSION DE LA TRANSPARENCE Avis 23 mai 2007 SUTENT 12,5 mg, gélule Flacon de 30 (CIP: 376 265-0) SUTENT 25 mg, gélule Flacon de 30 (CIP: 376 266-7) SUTENT 50 mg, gélule Flacon de 30 (CIP: 376 267-3)
Plan. Introduction. Les Nouveaux Anticoagulants Oraux et le sujet âgé. Audit de prescription au Centre Hospitalier Geriatrique du Mont d Or
 Plan Introduction Les Nouveaux Anticoagulants Oraux et le sujet âgé Audit de prescription au Centre Hospitalier Geriatrique du Mont d Or Introduction NACO: une actualité brûlante! AVK: Plus forte incidence
Plan Introduction Les Nouveaux Anticoagulants Oraux et le sujet âgé Audit de prescription au Centre Hospitalier Geriatrique du Mont d Or Introduction NACO: une actualité brûlante! AVK: Plus forte incidence
COMMISSION DE LA TRANSPARENCE AVIS. 18 janvier 2006
 COMMISSION DE LA TRANSPARENCE AVIS 18 janvier 2006 ADVATE 1500 UI, poudre et solvant pour solution injectable 1 flacon(s) en verre de 1 500 UI - 1 flacon(s) en verre de 5 ml avec matériel(s) de perfusion(s)
COMMISSION DE LA TRANSPARENCE AVIS 18 janvier 2006 ADVATE 1500 UI, poudre et solvant pour solution injectable 1 flacon(s) en verre de 1 500 UI - 1 flacon(s) en verre de 5 ml avec matériel(s) de perfusion(s)
La lutte contre la tuberculose est régie par l arrêté royal du 17 octobre 2002.
 Le diagnostic de la tuberculose bovine La lutte contre la tuberculose est régie par l arrêté royal du 17 octobre 2002. 1. Tuberculination Dans la première phase d une infection de tuberculose bovine (Mycobacterium
Le diagnostic de la tuberculose bovine La lutte contre la tuberculose est régie par l arrêté royal du 17 octobre 2002. 1. Tuberculination Dans la première phase d une infection de tuberculose bovine (Mycobacterium
CE QU IL FAUT SAVOIR PARTICIPATION À UN ESSAI CLINIQUE SUR UN MÉDICAMENT
 CE QU IL FAUT SAVOIR PARTICIPATION À UN ESSAI CLINIQUE SUR UN MÉDICAMENT Sommaire Comment se fait la recherche sur un nouveau médicament? (page 1) A quoi sert la recherche sur un nouveau médicament? (page
CE QU IL FAUT SAVOIR PARTICIPATION À UN ESSAI CLINIQUE SUR UN MÉDICAMENT Sommaire Comment se fait la recherche sur un nouveau médicament? (page 1) A quoi sert la recherche sur un nouveau médicament? (page
Description Synthétique des Principaux Termes et Conditions de l Offre
 4 octobre 2010, Description Synthétique des Principaux Termes et Conditions de l Offre GC Merger Corp., est une société immatriculée dans l État du Massachusetts, États-Unis (l «Acquéreur»), dont le capital
4 octobre 2010, Description Synthétique des Principaux Termes et Conditions de l Offre GC Merger Corp., est une société immatriculée dans l État du Massachusetts, États-Unis (l «Acquéreur»), dont le capital
Résultats du premier trimestre 2015. SCOR enregistre un résultat net de grande qualité de EUR 175 millions et un ROE annualisé de 12,1 %
 SCOR enregistre un résultat net de grande qualité de EUR 175 millions et un ROE annualisé de 12,1 % SCOR démarre l année avec de solides performances grâce à la mise en œuvre rigoureuse de son plan stratégique
SCOR enregistre un résultat net de grande qualité de EUR 175 millions et un ROE annualisé de 12,1 % SCOR démarre l année avec de solides performances grâce à la mise en œuvre rigoureuse de son plan stratégique
La prise en charge de votre polyarthrite rhumatoïde
 G U I D E - A F F E C T I O N D E L O N G U E D U R É E La prise en charge de votre polyarthrite rhumatoïde Vivre avec une polyarthrite rhumatoïde Décembre 2008 Pourquoi ce guide? Votre médecin traitant
G U I D E - A F F E C T I O N D E L O N G U E D U R É E La prise en charge de votre polyarthrite rhumatoïde Vivre avec une polyarthrite rhumatoïde Décembre 2008 Pourquoi ce guide? Votre médecin traitant
Variation totale en %
 jeudi 16 février 2012 Kingfisher annonce un chiffre d'affaires en progression de 2,2 % au quatrième trimestre, en hausse de 4,0 % à taux de change constants (+ 0,9 % à surface comparable). Le groupe prévoit
jeudi 16 février 2012 Kingfisher annonce un chiffre d'affaires en progression de 2,2 % au quatrième trimestre, en hausse de 4,0 % à taux de change constants (+ 0,9 % à surface comparable). Le groupe prévoit
Fondation PremUp. Mieux naître pour mieux vivre
 Fondation PremUp Mieux naître pour mieux vivre Une fondation de coopération scientifique initiée par les pouvoirs publics en 2007 6 membres fondateurs : L Assistance Publique des Hôpitaux de Paris, l Inserm,
Fondation PremUp Mieux naître pour mieux vivre Une fondation de coopération scientifique initiée par les pouvoirs publics en 2007 6 membres fondateurs : L Assistance Publique des Hôpitaux de Paris, l Inserm,
Montréal, 24 mars 2015. David Levine Président et chef de la direction DL Strategic Consulting. DL Consulting Strategies in Healthcare
 Montréal, 24 mars 2015 David Levine Président et chef de la direction DL Strategic Consulting 1 RSSPQ, 2013 2 MÉDECINE INDIVIDUALISÉE Médecine personnalisée Médecine de précision Biomarqueurs Génomique
Montréal, 24 mars 2015 David Levine Président et chef de la direction DL Strategic Consulting 1 RSSPQ, 2013 2 MÉDECINE INDIVIDUALISÉE Médecine personnalisée Médecine de précision Biomarqueurs Génomique
MINISTERE DE LA SANTE ET DES SOLIDARITES DIRECTION GENERALE DE LA SANTE- DDASS DE SEINE MARITIME
 Département des situations d urgence sanitaire Personne chargée du dossier : Evelyne FALIP/Nicole BOHIC Tél : 01 40 56 59 65/02 32 18 31 66 evelyne.falip@sante.gouv.fr MINISTERE DE LA SANTE ET DES SOLIDARITES
Département des situations d urgence sanitaire Personne chargée du dossier : Evelyne FALIP/Nicole BOHIC Tél : 01 40 56 59 65/02 32 18 31 66 evelyne.falip@sante.gouv.fr MINISTERE DE LA SANTE ET DES SOLIDARITES
Point d Information. Le PRAC a recommandé que le RCP soit modifié afin d inclure les informations suivantes:
 Point d Information Médicaments à base d ivabradine, de codéine, médicaments contenant du diméthyl fumarate, du mycophénolate mofétil/acide mycophénolique, de l octocog alpha, spécialité Eligard (contenant
Point d Information Médicaments à base d ivabradine, de codéine, médicaments contenant du diméthyl fumarate, du mycophénolate mofétil/acide mycophénolique, de l octocog alpha, spécialité Eligard (contenant
Anticorps, vaccins, immunothérapies allergéniques tout savoir sur les progrès de l immunothérapie en 20 questions
 Anticorps, vaccins, immunothérapies allergéniques tout savoir sur les progrès de l immunothérapie en 20 questions De quoi se compose le système immunitaire? Chaque jour, des substances étrangères, appelées
Anticorps, vaccins, immunothérapies allergéniques tout savoir sur les progrès de l immunothérapie en 20 questions De quoi se compose le système immunitaire? Chaque jour, des substances étrangères, appelées
Chapitre III Le phénotype immunitaire au cours de la vie
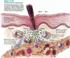 Chapitre III Le phénotype immunitaire au cours de la vie Le phénotype immunitaire d un individu caractérise sa capacité à répondre, grâce aux effecteurs de l immunité adaptative, aux différents agents
Chapitre III Le phénotype immunitaire au cours de la vie Le phénotype immunitaire d un individu caractérise sa capacité à répondre, grâce aux effecteurs de l immunité adaptative, aux différents agents
Chiffre d affaires du premier trimestre 2015
 Chiffre d affaires du premier trimestre 2015 Chiffre d affaires : 286,6 millions d euros, croissance organique de +4,0% Flux de trésorerie disponible : 31,9 millions d euros, en progression de +10,4% Croissance
Chiffre d affaires du premier trimestre 2015 Chiffre d affaires : 286,6 millions d euros, croissance organique de +4,0% Flux de trésorerie disponible : 31,9 millions d euros, en progression de +10,4% Croissance
Point sur la stratégie
 Point sur la stratégie Marc de Garidel Président-Directeur Général Christel Bories Directeur Général Délégué Conférence de presse 02/07/2015 Introduction Marc de Garidel La stratégie engagée depuis 2011
Point sur la stratégie Marc de Garidel Président-Directeur Général Christel Bories Directeur Général Délégué Conférence de presse 02/07/2015 Introduction Marc de Garidel La stratégie engagée depuis 2011
Thérapies par cellules souches dans la SEP
 Thérapies par cellules souches dans la SEP Rédigé en partenariat avec Sommaire Introduction 3 Qu est-ce que la SEP? 4 Que sont les cellules souches? 5 Qu est-ce qu une thérapie par cellules souches? 6
Thérapies par cellules souches dans la SEP Rédigé en partenariat avec Sommaire Introduction 3 Qu est-ce que la SEP? 4 Que sont les cellules souches? 5 Qu est-ce qu une thérapie par cellules souches? 6
- 2 - faire industriel dans la mise au point des produits biologiques. L Institut Roche de Recherche et Médecine Translationnelle (IRRMT, basé à
 Information presse Roche, l Agence Nationale de Recherches sur le Sida et les hépatites virales (ANRS), le Baylor Research Institute (BRI) et Inserm Transfert mettent en place une coopération stratégique
Information presse Roche, l Agence Nationale de Recherches sur le Sida et les hépatites virales (ANRS), le Baylor Research Institute (BRI) et Inserm Transfert mettent en place une coopération stratégique
Révision des descriptions génériques Comment monter un dossier?
 DISPOSITIFS MEDICAUX Révision des descriptions génériques Comment monter un dossier? Guide pour le dossier déposé par les fabricants/distributeurs Adopté en séance de la CEPP* le 13 juillet 2005 *CEPP
DISPOSITIFS MEDICAUX Révision des descriptions génériques Comment monter un dossier? Guide pour le dossier déposé par les fabricants/distributeurs Adopté en séance de la CEPP* le 13 juillet 2005 *CEPP
Conférence téléphonique
 Conférence téléphonique T2-2015 Énoncés prospectifs et mesure non établie selon les IFRS Mise en garde concernant les déclarations prospectives Cette présentation peut contenir des énoncés prospectifs
Conférence téléphonique T2-2015 Énoncés prospectifs et mesure non établie selon les IFRS Mise en garde concernant les déclarations prospectives Cette présentation peut contenir des énoncés prospectifs
L axe 5 du Cancéropole Nord Ouest
 L axe 5 du Cancéropole Nord Ouest Cancers, Individu id & Société L état des lieux d un pari Le Rapport Cordier 1 Biomarqueurs prédictifs 2 L axe 5 du Cancéropole Nord Ouest Cancers, Individu & Société
L axe 5 du Cancéropole Nord Ouest Cancers, Individu id & Société L état des lieux d un pari Le Rapport Cordier 1 Biomarqueurs prédictifs 2 L axe 5 du Cancéropole Nord Ouest Cancers, Individu & Société
Guide à l intention des patients sur les thérapies à base de cellules souches
 Guide à l intention des patients sur les thérapies à base de cellules souches Appendice I des Lignes directrices pour l application en clinique des cellules souches Traduction fournie par le Réseau de
Guide à l intention des patients sur les thérapies à base de cellules souches Appendice I des Lignes directrices pour l application en clinique des cellules souches Traduction fournie par le Réseau de
COMMISSION DE LA TRANSPARENCE
 COMMISSION DE LA TRANSPARENCE Avis 2 avril 2014 DERMOVAL, gel flacon de 20 ml (CIP : 34009 326 130 4 5) DERMOVAL 0,05 POUR CENT, crème tube de 10 g (CIP : 34009 320 432 9 3) Laboratoire GLAXOSMITHKLINE
COMMISSION DE LA TRANSPARENCE Avis 2 avril 2014 DERMOVAL, gel flacon de 20 ml (CIP : 34009 326 130 4 5) DERMOVAL 0,05 POUR CENT, crème tube de 10 g (CIP : 34009 320 432 9 3) Laboratoire GLAXOSMITHKLINE
Bayer : améliorer la qualité de vie grâce à l innovation
 Communiqué de presse Bayer AG Communications 51368 Leverkusen Allemagne Tél. : +49 214 30-1 www.press.bayer.com Perspectives sur l innovation 2012 Bayer : améliorer la qualité de vie grâce à l innovation
Communiqué de presse Bayer AG Communications 51368 Leverkusen Allemagne Tél. : +49 214 30-1 www.press.bayer.com Perspectives sur l innovation 2012 Bayer : améliorer la qualité de vie grâce à l innovation
Liste de vérification de la mise en œuvre d une équipe de santé familiale
 Équipes de santé familiale Améliorer les soins de santé familiale Liste de vérification de la mise en œuvre d une équipe de santé familiale Juillet 2009 Version 2.0 Table des matières Introduction...3
Équipes de santé familiale Améliorer les soins de santé familiale Liste de vérification de la mise en œuvre d une équipe de santé familiale Juillet 2009 Version 2.0 Table des matières Introduction...3
LE TRAITEMENT DES POUSSEES
 5 novembre 2011 LE TRAITEMENT DES POUSSEES Les corticoïdes à fortes doses permettent d accélérer la récupération de la poussée. Ils sont prescrits en perfusion à la dose de 1g par jour pendant 3 jours.
5 novembre 2011 LE TRAITEMENT DES POUSSEES Les corticoïdes à fortes doses permettent d accélérer la récupération de la poussée. Ils sont prescrits en perfusion à la dose de 1g par jour pendant 3 jours.
Galenica: 2015 augmentation du bénéfice attendue pour la 20 e fois consécutive
 COMMUNIQUÉ DE PRESSE Date Contact Investor Relations: Julien Vignot, Responsable des Relations avec les investisseurs, Groupe Galenica Media Relations: Christina Hertig Responsable de la Communication
COMMUNIQUÉ DE PRESSE Date Contact Investor Relations: Julien Vignot, Responsable des Relations avec les investisseurs, Groupe Galenica Media Relations: Christina Hertig Responsable de la Communication
Succès de l introduction en bourse de Cardio3 BioSciences :
 Le présent communiqué ne constitue pas une offre de vente, ni une sollicitation d'offre d'acquisition de titres. Ce communiqué est une publicité et non un prospectus. Les investisseurs ne doivent fonder
Le présent communiqué ne constitue pas une offre de vente, ni une sollicitation d'offre d'acquisition de titres. Ce communiqué est une publicité et non un prospectus. Les investisseurs ne doivent fonder
PARTICIPATION À UN ESSAI CLINIQUE SUR UN MÉDICAMENT CE QU IL FAUT SAVOIR
 PARTICIPATION À UN ESSAI CLINIQUE SUR UN MÉDICAMENT CE QU IL FAUT SAVOIR SOMMAIRE COMMENT SE FAIT LA RECHERCHE SUR UN NOUVEAU MÉDICAMENT?...p. 3 À QUOI SERT LA RECHERCHE?...p. 4 QUELLES SONT LES GARANTIES?...p.
PARTICIPATION À UN ESSAI CLINIQUE SUR UN MÉDICAMENT CE QU IL FAUT SAVOIR SOMMAIRE COMMENT SE FAIT LA RECHERCHE SUR UN NOUVEAU MÉDICAMENT?...p. 3 À QUOI SERT LA RECHERCHE?...p. 4 QUELLES SONT LES GARANTIES?...p.
Spondylarthropathies : diagnostic, place des anti-tnf et surveillance par le généraliste. Pr P. Claudepierre CHU Henri Mondor - Créteil
 Spondylarthropathies : diagnostic, place des anti-tnf et surveillance par le généraliste Pr P. Claudepierre CHU Henri Mondor - Créteil Le Diagnostic Objectif de la démarche diagnostique Diagnostic de SPONDYLARTHROPATHIE
Spondylarthropathies : diagnostic, place des anti-tnf et surveillance par le généraliste Pr P. Claudepierre CHU Henri Mondor - Créteil Le Diagnostic Objectif de la démarche diagnostique Diagnostic de SPONDYLARTHROPATHIE
COMMISSION DE LA TRANSPARENCE. Avis. 3 septembre 2008
 COMMISSION DE LA TRANSPARENCE Avis 3 septembre 2008 PRIVIGEN 100 mg/ml, solution pour perfusion Flacon en verre de 50 ml (CIP: 572 790-7 Flacon en verre de 100 ml (CIP: 572 791-3) Flacon en verre de 200
COMMISSION DE LA TRANSPARENCE Avis 3 septembre 2008 PRIVIGEN 100 mg/ml, solution pour perfusion Flacon en verre de 50 ml (CIP: 572 790-7 Flacon en verre de 100 ml (CIP: 572 791-3) Flacon en verre de 200
Validation clinique des marqueurs prédictifs le point de vue du méthodologiste. Michel Cucherat UMR CNRS 5558 - Lyon
 Validation clinique des marqueurs prédictifs le point de vue du méthodologiste Michel Cucherat UMR CNRS 5558 - Lyon Marqueur prédictif - Définition Un marqueur prédictif est un marqueur qui prédit le bénéfice
Validation clinique des marqueurs prédictifs le point de vue du méthodologiste Michel Cucherat UMR CNRS 5558 - Lyon Marqueur prédictif - Définition Un marqueur prédictif est un marqueur qui prédit le bénéfice
Cellectis présente ses résultats financiers pour le premier trimestre 2015
 COMMUNIQUÉ DE PRESSE Cellectis présente ses résultats financiers pour le premier trimestre 2015 Paris (France) le 9 juin 2015 Cellectis (Alternext : ALCLS Nasdaq Global Market : CLLS), se met en conformité
COMMUNIQUÉ DE PRESSE Cellectis présente ses résultats financiers pour le premier trimestre 2015 Paris (France) le 9 juin 2015 Cellectis (Alternext : ALCLS Nasdaq Global Market : CLLS), se met en conformité
Cellnovo lance son introduction en bourse sur le marché réglementé d Euronext à Paris
 Communiqué de presse Cellnovo lance son introduction en bourse sur le marché réglementé d Euronext à Paris Augmentation de capital d un montant d environ 35,0 M, pouvant être porté à un maximum de 46,3
Communiqué de presse Cellnovo lance son introduction en bourse sur le marché réglementé d Euronext à Paris Augmentation de capital d un montant d environ 35,0 M, pouvant être porté à un maximum de 46,3
COMMISSION DE LA TRANSPARENCE AVIS. 10 mai 2006
 COMMISSION DE LA TRANSPARENCE AVIS 10 mai 2006 METOJECT 10 mg/ml, solution injectable en seringue pré-remplie 1 seringue pré-remplie en verre de 0,75 ml avec aiguille : 371 754-3 1 seringue pré- remplie
COMMISSION DE LA TRANSPARENCE AVIS 10 mai 2006 METOJECT 10 mg/ml, solution injectable en seringue pré-remplie 1 seringue pré-remplie en verre de 0,75 ml avec aiguille : 371 754-3 1 seringue pré- remplie
Un métier en évolution pour répondre aux nouvelles. Face à ces évolutions, un nouveau métier
 Les métiers de la pharmacovigilance Des métiers en évolution dans une industrie de haute technologie et d'innovation Une mission d'évaluation et de gestion des risques liés à l'utilisation des médicaments
Les métiers de la pharmacovigilance Des métiers en évolution dans une industrie de haute technologie et d'innovation Une mission d'évaluation et de gestion des risques liés à l'utilisation des médicaments
Que représentent les Spondyloarthrites Axiales Non Radiographiques? Pascal Claudepierre CHU Mondor - Créteil
 Que représentent les Spondyloarthrites Axiales Non Radiographiques? Pascal Claudepierre CHU Mondor - Créteil Liens d intérêt Intérêts financiers : aucun Liens durables ou permanents : aucun Interventions
Que représentent les Spondyloarthrites Axiales Non Radiographiques? Pascal Claudepierre CHU Mondor - Créteil Liens d intérêt Intérêts financiers : aucun Liens durables ou permanents : aucun Interventions
Gemalto annonce le dépôt d une offre publique d achat entièrement en numéraire sur Wavecom
 Gemalto annonce le dépôt d une offre publique d achat entièrement en numéraire sur Wavecom Une acquisition qui permet à Gemalto de se développer sur le marché en croissance du «Machine-to-Machine» (M2M)
Gemalto annonce le dépôt d une offre publique d achat entièrement en numéraire sur Wavecom Une acquisition qui permet à Gemalto de se développer sur le marché en croissance du «Machine-to-Machine» (M2M)
82 collaborateurs 52 millions
 Édito Chiffre d affaires à fin Septembre 2007 Assemblée générale du 26 juin 2007 Réponses aux questions des actionnaires * Actualité R&D et produits I 2 : la science d Innate * Innate Pharma et ses actionnaires
Édito Chiffre d affaires à fin Septembre 2007 Assemblée générale du 26 juin 2007 Réponses aux questions des actionnaires * Actualité R&D et produits I 2 : la science d Innate * Innate Pharma et ses actionnaires
Anémie et maladie rénale chronique. Phases 1-4
 Anémie et maladie rénale chronique Phases 1-4 Initiative de qualité en matière d issue des maladies rénales de la National Kidney Foundation Saviez-vous que l initiative de qualité en matière d issue des
Anémie et maladie rénale chronique Phases 1-4 Initiative de qualité en matière d issue des maladies rénales de la National Kidney Foundation Saviez-vous que l initiative de qualité en matière d issue des
Ce document ne doit pas être publié, distribué ou diffusé, directement ou indirectement aux Etats-Unis, au Canada, en Australie ou au Japon.
 27 mars 2014 MAINSTAY MEDICAL INTERNATIONAL PLC MAINSTAY MEDICAL ANNONCE SON INTENTION DE DEMANDER L ADMISSION DE SES ACTIONS SUR EURONEXT PARIS ET SUR L ENTREPRISE SECURITIES MARKET DE L IRISH STOCK EXCHANGE
27 mars 2014 MAINSTAY MEDICAL INTERNATIONAL PLC MAINSTAY MEDICAL ANNONCE SON INTENTION DE DEMANDER L ADMISSION DE SES ACTIONS SUR EURONEXT PARIS ET SUR L ENTREPRISE SECURITIES MARKET DE L IRISH STOCK EXCHANGE
First Line and Maintenance in Nonsquamous NSCLC: What Do the Data Tell Us?
 Dr Jean-Charles Soria : Bonjour et bienvenue dans ce programme. Je suis Jean Charles Soria, Professeur de Médecine et Directeur du programme de développement précoce des médicaments à l université Paris
Dr Jean-Charles Soria : Bonjour et bienvenue dans ce programme. Je suis Jean Charles Soria, Professeur de Médecine et Directeur du programme de développement précoce des médicaments à l université Paris
Document d orientation sur les allégations issues d essais de non-infériorité
 Document d orientation sur les allégations issues d essais de non-infériorité Février 2013 1 Liste de contrôle des essais de non-infériorité N o Liste de contrôle (les clients peuvent se servir de cette
Document d orientation sur les allégations issues d essais de non-infériorité Février 2013 1 Liste de contrôle des essais de non-infériorité N o Liste de contrôle (les clients peuvent se servir de cette
Compliance (syn. Adhérence - Observance) IFMT-MS-Sémin.Médict.Nov.05 1
 Compliance (syn. Adhérence - Observance) IFMT-MS-Sémin.Médict.Nov.05 1 Qu est ce que la compliance? Une maladie a été diagnostiquée Le diagnostic est correct Le traitement a été bien indiqué, bien choisi,
Compliance (syn. Adhérence - Observance) IFMT-MS-Sémin.Médict.Nov.05 1 Qu est ce que la compliance? Une maladie a été diagnostiquée Le diagnostic est correct Le traitement a été bien indiqué, bien choisi,
INFORMATION À DESTINATION DES PROFESSIONNELS DE SANTÉ LE DON DU VIVANT
 INFORMATION À DESTINATION DES PROFESSIONNELS DE SANTÉ LE DON DU VIVANT QUELS RÉSULTATS POUR LE RECEVEUR? QUELS RISQUES POUR LE DONNEUR? DONNER UN REIN DE SON VIVANT PEUT CONCERNER CHACUN /////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////
INFORMATION À DESTINATION DES PROFESSIONNELS DE SANTÉ LE DON DU VIVANT QUELS RÉSULTATS POUR LE RECEVEUR? QUELS RISQUES POUR LE DONNEUR? DONNER UN REIN DE SON VIVANT PEUT CONCERNER CHACUN /////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////
Communiqué. Abbott présente à Santé Canada une demande d homologation d HUMIRA pour le traitement du psoriasis POUR PUBLICATION IMMÉDIATE
 POUR PUBLICATION IMMÉDIATE Communiqué Abbott présente à Santé Canada une demande d homologation d HUMIRA pour le traitement du psoriasis Media: Sylvie Légaré (514) 832-7268 Abbott Gabrielle Collu 514)
POUR PUBLICATION IMMÉDIATE Communiqué Abbott présente à Santé Canada une demande d homologation d HUMIRA pour le traitement du psoriasis Media: Sylvie Légaré (514) 832-7268 Abbott Gabrielle Collu 514)
La Banque Nationale divulgue des résultats record au premier trimestre de 2014
 COMMUNIQUÉ PREMIER TRIMESTRE 2014 La Banque Nationale divulgue des résultats record au premier trimestre de 2014 L information financière contenue dans le présent document est basée sur les états financiers
COMMUNIQUÉ PREMIER TRIMESTRE 2014 La Banque Nationale divulgue des résultats record au premier trimestre de 2014 L information financière contenue dans le présent document est basée sur les états financiers
Voyages et sclérose en plaques
 Voyages et sclérose en plaques Merck Serono Maladies Neurodégénératives 2 Nous remercions le Docteur Dominique Audry, présidente du réseau Bourguignon de la SEP pour sa collaboration à la rédaction de
Voyages et sclérose en plaques Merck Serono Maladies Neurodégénératives 2 Nous remercions le Docteur Dominique Audry, présidente du réseau Bourguignon de la SEP pour sa collaboration à la rédaction de
Projections des coûts des médicaments pour les régimes privés d assurance-médicaments de IMS Brogan Rapport commandité par Rx&D
 Plus de 20 millions de Canadiens comptent sur les nouveaux médicaments et vaccins pour les aider à rester en bonne santé et productifs, tant au travail qu à la maison. Les employeurs profitent aussi de
Plus de 20 millions de Canadiens comptent sur les nouveaux médicaments et vaccins pour les aider à rester en bonne santé et productifs, tant au travail qu à la maison. Les employeurs profitent aussi de
Lymphome non hodgkinien
 Lymphome non hodgkinien Ce que vous devez savoir Le cancer : une lutte à finir 1 888 939-3333 www.cancer.ca LYMPHOME NON HODGKINIEN Ce que vous devez savoir Même si vous entendez parler du cancer presque
Lymphome non hodgkinien Ce que vous devez savoir Le cancer : une lutte à finir 1 888 939-3333 www.cancer.ca LYMPHOME NON HODGKINIEN Ce que vous devez savoir Même si vous entendez parler du cancer presque
TROISIÈME PARTIE : INFORMATION POUR LE PATIENT
 TROISIÈME PARTIE : INFORMATION POUR LE PATIENT REBIF (Interféron bêta-1a) Solution pour injection dans des seringues préremplies Ce livret représente la troisième partie de la «Monographie de produit»
TROISIÈME PARTIE : INFORMATION POUR LE PATIENT REBIF (Interféron bêta-1a) Solution pour injection dans des seringues préremplies Ce livret représente la troisième partie de la «Monographie de produit»
Plan de travail du Bureau de l audit et de la surveillance du FIDA pour 2011
 Cote du document: EB 2010/101/R.41 Point de l'ordre du jour: 17 b) Date: 9 novembre 2010 Distribution: Publique Original: Anglais F Plan de travail du Bureau de l audit et de la surveillance du FIDA pour
Cote du document: EB 2010/101/R.41 Point de l'ordre du jour: 17 b) Date: 9 novembre 2010 Distribution: Publique Original: Anglais F Plan de travail du Bureau de l audit et de la surveillance du FIDA pour
Mécanismes moléculaires à l origine des maladies autoimmunes
 Mécanismes moléculaires à l origine des maladies autoimmunes Sébastien Lacroix-Desmazes INSERM UMRS 1138 Immunopathology and herapeutic Immunointervention CRC - Paris, France Ma connaissance d un patient
Mécanismes moléculaires à l origine des maladies autoimmunes Sébastien Lacroix-Desmazes INSERM UMRS 1138 Immunopathology and herapeutic Immunointervention CRC - Paris, France Ma connaissance d un patient
Essais précoces non comparatifs : principes et calcul du nombre de sujets nécessaire
 Essais précoces non comparatifs : principes et calcul du nombre de sujets nécessaire Sylvie CHABAUD Direction de la Recherche Clinique et de l Innovation : Centre Léon Bérard - Lyon Unité de Biostatistique
Essais précoces non comparatifs : principes et calcul du nombre de sujets nécessaire Sylvie CHABAUD Direction de la Recherche Clinique et de l Innovation : Centre Léon Bérard - Lyon Unité de Biostatistique
l interféron-bêta Quelle signification? Faut-il les doser?
 1 Les anticorps neutralisant l interféron-bêta Quelle signification? Faut-il les doser? n Si à l échelle d un groupe de patients les NAB ont un effet sur l efficacité du traitement, à l échelle de l individu
1 Les anticorps neutralisant l interféron-bêta Quelle signification? Faut-il les doser? n Si à l échelle d un groupe de patients les NAB ont un effet sur l efficacité du traitement, à l échelle de l individu
Les nouveaux traitements du psoriasis
 Les nouveaux traitements du psoriasis Ci-après, vous trouverez 3 articles, parus récemment, parmi d'autres tout aussi intéressants, dans notre bulletin trimestriel Pso Magazine: - un extrait de l'exposé
Les nouveaux traitements du psoriasis Ci-après, vous trouverez 3 articles, parus récemment, parmi d'autres tout aussi intéressants, dans notre bulletin trimestriel Pso Magazine: - un extrait de l'exposé
G U I D E - A F F E C T I O N D E L O N G U E D U R É E. La prise en charge de votre mélanome cutané
 G U I D E - A F F E C T I O N D E L O N G U E D U R É E La prise en charge de votre mélanome cutané Mars 2010 Pourquoi ce guide? Votre médecin traitant vous a remis ce guide pour vous informer sur le mélanome
G U I D E - A F F E C T I O N D E L O N G U E D U R É E La prise en charge de votre mélanome cutané Mars 2010 Pourquoi ce guide? Votre médecin traitant vous a remis ce guide pour vous informer sur le mélanome
Y-a-t-il des raisons médicales qui
 é NQUÊTE Programmes industriels d observance : sans justification médicale L analyse Prescrire des programmes à mi-mai 2007 révèle que les programmes industriels d observance ne sont pas justifiés par
é NQUÊTE Programmes industriels d observance : sans justification médicale L analyse Prescrire des programmes à mi-mai 2007 révèle que les programmes industriels d observance ne sont pas justifiés par
admission directe du patient en UNV ou en USINV
 Société française de neurologie RÉFÉRENTIEL D AUTO-ÉVALUATION DES PRATIQUES EN NEUROLOGIE Prise en charge hospitalière initiale des personnes ayant fait un accident vasculaire cérébral (AVC) : admission
Société française de neurologie RÉFÉRENTIEL D AUTO-ÉVALUATION DES PRATIQUES EN NEUROLOGIE Prise en charge hospitalière initiale des personnes ayant fait un accident vasculaire cérébral (AVC) : admission
COMMUNIQUÉ DE PRESSE
 COMMUNIQUÉ DE PRESSE Chiffre d affaires du 3 ème trimestre et des 9 premiers mois 2013 16 octobre 2013 Croissance organique des 9 premiers mois : +5,5% Tendances solides dans l ensemble du Groupe Impact
COMMUNIQUÉ DE PRESSE Chiffre d affaires du 3 ème trimestre et des 9 premiers mois 2013 16 octobre 2013 Croissance organique des 9 premiers mois : +5,5% Tendances solides dans l ensemble du Groupe Impact
Transgene : résultats annuels 2013 et point sur l avancée des produits
 Transgene : résultats annuels 2013 et point sur l avancée des produits Dépenses et consommation de trésorerie 2013 conformes aux attentes Consolidation significative de la trésorerie suite aux opérations
Transgene : résultats annuels 2013 et point sur l avancée des produits Dépenses et consommation de trésorerie 2013 conformes aux attentes Consolidation significative de la trésorerie suite aux opérations
3.2. RAPPORT DU PRÉSIDENT DU CONSEIL D ADMINISTRATION (ARTICLE L. 225-37 DU CODE DE COMMERCE)
 3 3.2. RAPPORT DU PRÉSIDENT DU CONSEIL D ADMINISTRATION (ARTICLE L. 225-37 DU CODE DE COMMERCE) Pour l élaboration du présent rapport, le Président a consulté le Vice-Président Exécutif, Directeur Financier
3 3.2. RAPPORT DU PRÉSIDENT DU CONSEIL D ADMINISTRATION (ARTICLE L. 225-37 DU CODE DE COMMERCE) Pour l élaboration du présent rapport, le Président a consulté le Vice-Président Exécutif, Directeur Financier
Traitement de l hépatite C: données récentes
 Traitement de l hépatite C: données récentes J.-P. BRONOWICKI (Vandœuvre-lès-Nancy) Tirés à part : Jean-Pierre Bronowicki Service d Hépatogastroentérologie, CHU de Nancy, 54500 Vandœuvre-lès-Nancy. Le
Traitement de l hépatite C: données récentes J.-P. BRONOWICKI (Vandœuvre-lès-Nancy) Tirés à part : Jean-Pierre Bronowicki Service d Hépatogastroentérologie, CHU de Nancy, 54500 Vandœuvre-lès-Nancy. Le
Actualités IRM dans la SEP Thomas Tourdias 1, 2
 Actualités IRM dans la SEP Thomas Tourdias 1, 2 (1) Service de NeuroImagerie Diagnostique et Thérapeutique, CHU Bordeaux, Université de Bordeaux (2) Neurocentre Magendie, INSERM U 862, Université de Bordeaux
Actualités IRM dans la SEP Thomas Tourdias 1, 2 (1) Service de NeuroImagerie Diagnostique et Thérapeutique, CHU Bordeaux, Université de Bordeaux (2) Neurocentre Magendie, INSERM U 862, Université de Bordeaux
Commentant le niveau d activité du groupe sur l année 2012, Luc Oursel, Président du Directoire d AREVA, a déclaré :
 Au 31 décembre 2012 : Croissance du chiffre d affaires à 9 342 M (+ 5,3 % vs. 2011), tirée par les activités nucléaires et renouvelables Carnet de commandes renouvelé sur l année 2012 à 45,4 Mds grâce
Au 31 décembre 2012 : Croissance du chiffre d affaires à 9 342 M (+ 5,3 % vs. 2011), tirée par les activités nucléaires et renouvelables Carnet de commandes renouvelé sur l année 2012 à 45,4 Mds grâce
EVALUATION DES TECHNOLOGIES DE SANTÉ ANALYSE MÉDICO-ÉCONOMIQUE. Efficacité et efficience des hypolipémiants Une analyse centrée sur les statines
 EVALUATION DES TECHNOLOGIES DE SANTÉ ANALYSE MÉDICO-ÉCONOMIQUE Efficacité et efficience des hypolipémiants Une analyse centrée sur les statines Juillet 2010 Mise à jour Septembre 2010 1 Le rapport complet
EVALUATION DES TECHNOLOGIES DE SANTÉ ANALYSE MÉDICO-ÉCONOMIQUE Efficacité et efficience des hypolipémiants Une analyse centrée sur les statines Juillet 2010 Mise à jour Septembre 2010 1 Le rapport complet
METHODOLOGIE GENERALE DE LA RECHERCHE EPIDEMIOLOGIQUE : LES ENQUETES EPIDEMIOLOGIQUES
 Enseignement du Deuxième Cycle des Etudes Médicales Faculté de Médecine de Toulouse Purpan et Toulouse Rangueil Module I «Apprentissage de l exercice médical» Coordonnateurs Pr Alain Grand Pr Daniel Rougé
Enseignement du Deuxième Cycle des Etudes Médicales Faculté de Médecine de Toulouse Purpan et Toulouse Rangueil Module I «Apprentissage de l exercice médical» Coordonnateurs Pr Alain Grand Pr Daniel Rougé
Leucémie Lymphoïde Chronique
 Sur la Leucémie Lymphoïde Chronique Coordination : Pierre Feugier, Nancy Avec le soutien de Sur la Leucémie Lymphoïde Chronique Sommaire Qu est-ce que la leucémie lymphoïde chronique?..........................
Sur la Leucémie Lymphoïde Chronique Coordination : Pierre Feugier, Nancy Avec le soutien de Sur la Leucémie Lymphoïde Chronique Sommaire Qu est-ce que la leucémie lymphoïde chronique?..........................
