Thermodynamique : les fondamentaux
|
|
|
- Pierre-Antoine Chassé
- il y a 9 ans
- Total affichages :
Transcription
1 Thermodynamique : les fondamentaux Extrait du programme Thermodynamique : fondamentaux Notions et contenus Capacités exigibles Énergie interne U d un système Vocabulaire et définitions : système, état d équilibre, variables d état, divers types de transformations. Premier principe de la thermodynamique. Identifier les grandeurs physiques caractérisant l'état d'un système. Établir un bilan d énergie lors d un transfert thermique ou d'un travail entre deux systèmes en phase condensées. Exploiter le premier principe de la thermodynamique dans des cas simples. La thermodynamique est l étude d un système en fonction des échanges d énergie mécanique (travail noté W) et thermique (chaleur notée Q) avec le milieu extérieur au système. Il s agit d une branche récente de la physique, elle date du début du XIX siècle. Ce développement est lié à l invention et la mise au point des machines à vapeur de James WATT ( ). C est la science de tous les phénomènes qui dépendent de la température et de ses changements. 1. Qu est ce que la température. 2. Vocabulaire et définition 2.1 Système thermodynamique Système ouvert Système fermé Système isolé Équilibre thermodynamique 2.2 Variables d état Les paramètres intensifs Les paramètres extensifs 2.3. Transformation d un système thermodynamique Transformation irréversible Transformation réversible Transformation isobare Transformation isochore Transformation isotherme Transformation adiabatique Transformation cyclique 3. L énergie qu est ce que c est? 3.1 Convention de signe des échanges d énergie 3.2 Énergie et puissance 3.3 Différentes formes de l énergie L énergie cinétique L énergie potentielle L énergie interne 4. Le premier principe de la thermodynamique 5. Les échanges d énergie sous forme de travail 5.1 Travail de force mécanique 5.2 Travail de pression 5.3 Travail électrique 6. Les échanges d énergie sous forme de chaleur Sandrine Cerantola LP Alpes et Durance Page 1/ 7
2 1. Qu est ce que la température? Nous sommes tous capables de dire «comment un corps est chaud ou froid» mais le succès du XIX siècle est d avoir donné une définition de la température absolu d un corps. Cette définition conduit à la création de l échelle Kelvin. Sur cette échelle la température minimale pour tous les corps est le zéro absolu soit 0 K ou encore -273,15 C. Le zéro absolu est la température la plus basse qui puisse exister ; elle correspond à l'absence d'agitation thermique, mais elle est inaccessible L échelle Celsius est construite par rapport à la température de fusion de l eau à 0 C et la température d ébullition de l eau à 100 C Il existe aussi l échelle Fahrenheit telle que T( F) = 1,8 T( C) + 32 Donner la position du point de fusion de l eau sur cette échelle et celle du point d ébullition. 2. Vocabulaire et définition 2.1 Système thermodynamique C est une portion de l'univers que l'on isole par la pensée du reste de l'univers que l'on baptise alors milieu extérieur. C est un ensemble de corps limité par une surface (Σ) (réelle ou fictive) à travers laquelle se font les échanges d énergie et de matière avec l extérieur. système extérieur Système ouvert ou fermé Un système thermodynamique est ouvert lorsqu il échange de l énergie et de la matière avec l extérieur. Exemple : une ballon qui se dégonfle Système fermé Un système thermodynamique est fermé s il échange de l énergie mais pas de matière avec l extérieur. Exemple : une bouillote Système isolé Un système thermodynamique est isolé lorsqu il échange ni énergie ni matière avec l extérieur. Exemple : un vase de wear ou un calorimètre ou un thermos Équilibre thermodynamique Un système thermodynamique est en équilibre thermodynamique s il est à la fois en équilibre thermique, mécanique et chimique. (Σ) 2.2 Variables d état On a besoin de variables pour décrire l état d un système appelées paramètres ou variables d état. Pour les fluides (qui prennent la forme du récipient qui les contient) on utilisera la pression (notée p), le volume (noté V) et la température (notée T). À l état d équilibre, ces trois variables n évoluent pas sans intervention extérieur. Ce qui a de l intérêt pour le physicien c est la relation qui relie les variables d états appelée ÉQUATION D ÉTAT D UN FLUIDE. La pression p sera donnée en pascal Pa (1bar = 10 5 Pa = 1atm) Le volume V sera donnée en mètre cube m 3 (1m 3 = 1000L) La température sera donnée en kelvin K (0K = 273 C) Sandrine Cerantola LP Alpes et Durance Page 2/ 7
3 2.2.1 Les paramètres intensifs Ils ne dépendent pas de la taille du système ie de la quantité de matière (n en mol). Si on associe deux systèmes identiques pour en obtenir un plus grand, leurs valeurs restent inchangées. Exemple : T ;p ;d ;Cm ;Cv ;Vm Les paramètres extensifs Ils dépendent de la taille du système. Si on associe deux systèmes identiques pour en obtenir un plus grand, leurs valeurs seront multipliées par deux. Exemple : V ; m ;n ;E Exemple : si on mélange deux bouteilles contenant 1L d eau chacune, à la température de 20 C, la température finale est 20 C et non pas 40 C. Il en serait de même avec la pression qui restera la même. En revanche, le volume V final sera égal à 2 L, et la quantité de matière globale sera doublée. Calculer la quantité de matière contenue dans 2L d eau pure Transformation d un système thermodynamique Une intervention extérieur fait évoluer un système en équilibre thermodynamique : on dit qu il subit une transformation d un état A (défini par p A ;V A ;T A ) à un état B(défini par p b ;V B ;T B ) Transformation irréversible Lorsque l évolution est brutale la transformation est dite irréversible. On ne peut donc appliquer l équation d état qu à l état initial et à l état final Transformation réversible Elle se résume à une suite continue d états d équilibres voisins et si l évolution inverse est possible. En réalité, les transformations réversibles ne doivent être considérées que comme des modèles vers lesquels tendent les transformations lorsque les effets de frottements cause d irréversibilité, peuvent être considérées comme négligeables! Transformation isobare C est une transformation qui a lieu à pression constante. (Exemple : réaction chimique dans un tube à essai, le système est en contact avec la pression atmosphérique) Transformation isochore C est une transformation qui a lieu à volume constant. (Exemple : récipient indilatable et inextensible : bouteille métallique avec gaz) Transformation isotherme C est une transformation qui a lieu à température constante (Exemple : réaction chimique dans un tube à essai avec bain marie) Transformation adiabatique C est une transformation au cours de laquelle il n y a pas d échange de chaleur Q A B = 0. C est un cas limite idéal mais on peut s en approcher avec un vase Dewar (ou calorimètre) (Exemple : explosion d un mélange air/essence dans un moteur à explosion il n y pas le temps d avoir des échanges thermiques avec le milieu extérieur) Transformation cyclique Un système thermodynamique subit une transformation cyclique quand l état initial du système (état A) coïncide à l état final du système (état B). On dit que le système subit un cycle. Sandrine Cerantola LP Alpes et Durance Page 3/ 7
4 3. L énergie qu est ce que c est? Extrait du livre : Précis de physique-chimie de Pierre-François Thomas édition Bréal Sandrine Cerantola LP Alpes et Durance Page 4/ 7
5 3.1 Convention de signe des échanges d énergie Un système peut recevoir ou céder de l énergie du ou au milieu extérieur. Toute énergie gagnée par le système est comptée positivement. Toute énergie cédée au milieu extérieur est comptée négativement. (Idem qu un compte en banque) 3.2 Énergie et puissance La puissance représente la rapidité avec laquelle l énergie est échangée. Un système reçoit ou cède de l énergie à une certaine puissance. E : l énergie en J E = P t P : puissance en W t : temps écoulé en s 3.3 Différentes formes de l énergie Un système possède toujours de l énergie sous différentes formes : L énergie microscopique liée aux mouvements et interactions des atomes L énergie macroscopique liée à la position au mouvement global du système L énergie cinétique C est l énergie que possède un corps du fait de son mouvement. Elle dépend de la vitesse du mouvement d un objet. Elle peut être macroscopique (mouvement globale d un objet ) ou microscopique (vitesse d agitation des atomes constituant l objet) En translation : Ec = mv² Calculer l'énergie emmagasinée par une voiture de 835kg roulant en ligne droite à la vitesse constante de 50,0km.h -1. Même question si la vitesse vaut 100km.h -1. Expliquer pourquoi la distance de freinage est quatre fois plus élevée à 100km.h -1 qu'à 50km.h L énergie potentielle Cette énergie est liée aux interactions avec le milieu extérieur qui ont le potentiel de se transformer en Ec. L énergie potentielle de pesanteur est l énergie que possède un corps du fait de sa position dans un champ de pesanteur (due à son altitude) L énergie potentielle élastique est l énergie emmagasinée dans un corps à caractère élastique lorsque ce dernier est compressé ou étiré par rapport à sa position naturelle. Calculer l'énergie potentielle emmagasinée par un objet de masse 0,6kg à la hauteur h de 4m L énergie interne Elle représente les énergies cinétique et potentielle au niveau microscopique. Elle est notée U. Elle ne dépend que des paramètres du système (T ;n ;V ) Sa différentielle U est une différentielle totale ie que ses variations ne dépendent que de l état initial et final après transformation. Sandrine Cerantola LP Alpes et Durance Page 5/ 7
6 W ( F) A B : travail de la force F (en J) 1 ère année BTS SCBH 4. Le premier principe de la thermodynamique Il met en évidence la conservation de l énergie. Entre un état initial et un état final, la somme des variations de l énergie interne U, l Ecmacro et l Epmacro est égale à la somme des travaux des forces extérieures au système à laquelle on ajoute la somme des énergies échangées par transfert thermique ou rayonnement. U + Ec + Ep = Wext + Qext ie U = Ufinal Uinitial Conséquence des différents types de transformation Transformation isochore sans échange d'énergie avec l'extérieur sous forme de travail : U = Qv Transformation cyclique d'un système isolé : U cycle = 0 Système isolé en équilibre mécanique sans variation d'énergie interne : Ec + Ep = 0 = Em 5. Les échanges d énergie sous forme de travail 5.1 Travail de force mécanique Pour une force constante, suivant un mouvement rectiligne entre deux points A et B W ( F) A B =F AB cos(α) F : Intensité de la force (en N) α : angle entre la direction de la force et la direction AB (en rad) Calculer le travail du poids que l'on doit fournir pour élever (à la verticale) un objet de masse 0,6kg à la hauteur h de 4m. 5.2 Travail de pression Pour un système en équilibre, ou la variation de volume intérieur est égale à celle de l'extérieur. W : travail de la force de pression (en J) W=P ext V P ext : Pression extérieur (en Pa) V : Variation du volume (en m 3 ) Calculer le travail de la force de pression une variation de volume de 0,4L, à une pression extérieure de 1bar. 5.3 Travail électrique En régime continue, ou sinusoïdal permanent. W : travail électrique (en J) W=U I t U : Tension efficace aux bornes du dipôle (en V) I : Intensité du courant traversant le dipôle (en A) t : temps de fonctionnement (en s) Sandrine Cerantola LP Alpes et Durance Page 6/ 7
7 Calculer le travail électrique reçu par ce dipôle branché sur le secteur, avec I=8,3A pendant 1 heure. Données : U eff secteur = 220V NB : si le dipôle est un radiateur, assimilable à une résistance, l'ensemble du travail électrique est converti en chaleur Q, en joule. La Loi d'ohm s'applique. 6. Les échanges d énergie sous forme de chaleur Il est possible de calculer les énergies reçues par transfert thermique à partir des valeurs de températures, et de l'aptitude des matériaux à emmagasiner la chaleur (la capacité thermique C v ou C p, en J.kg -1 ). Les capacités thermiques sont connues à volume constant ou pression constante. Qv = Cv T ou Qp = Cp T Le plus souvent, on utilise les capacités thermiques massiques des matériaux (c v ou c p ; Cv = m c v ou Cp = m c p ). Quelle est l'énergie reçue par un morceau de fer de 800g chauffé de 80 C à 140 C? Données : capacité thermique massique du fer = 460J.kg -1.K -1. Sandrine Cerantola LP Alpes et Durance Page 7/ 7
Chapitre 11 Bilans thermiques
 DERNIÈRE IMPRESSION LE 30 août 2013 à 15:40 Chapitre 11 Bilans thermiques Table des matières 1 L état macroscopique et microcospique de la matière 2 2 Énergie interne d un système 2 2.1 Définition.................................
DERNIÈRE IMPRESSION LE 30 août 2013 à 15:40 Chapitre 11 Bilans thermiques Table des matières 1 L état macroscopique et microcospique de la matière 2 2 Énergie interne d un système 2 2.1 Définition.................................
CHAÎNES ÉNERGÉTIQUES I CHAÎNES ÉNERGÉTIQUES. II PUISSANCE ET ÉNERGIE
 CHAÎNES ÉNERGÉTIQUES I CHAÎNES ÉNERGÉTIQUES. II PUISSANCE ET ÉNERGIE I Chaine énergétique a- Les différentes formes d énergie L énergie se mesure en Joules, elle peut prendre différentes formes : chimique,
CHAÎNES ÉNERGÉTIQUES I CHAÎNES ÉNERGÉTIQUES. II PUISSANCE ET ÉNERGIE I Chaine énergétique a- Les différentes formes d énergie L énergie se mesure en Joules, elle peut prendre différentes formes : chimique,
Premier principe : bilans d énergie
 MPSI - Thermodynamique - Premier principe : bilans d énergie page 1/5 Premier principe : bilans d énergie Table des matières 1 De la mécanique à la thermodynamique : formes d énergie et échanges d énergie
MPSI - Thermodynamique - Premier principe : bilans d énergie page 1/5 Premier principe : bilans d énergie Table des matières 1 De la mécanique à la thermodynamique : formes d énergie et échanges d énergie
Premier principe de la thermodynamique - conservation de l énergie
 Chapitre 5 Premier principe de la thermodynamique - conservation de l énergie 5.1 Bilan d énergie 5.1.1 Énergie totale d un système fermé L énergie totale E T d un système thermodynamique fermé de masse
Chapitre 5 Premier principe de la thermodynamique - conservation de l énergie 5.1 Bilan d énergie 5.1.1 Énergie totale d un système fermé L énergie totale E T d un système thermodynamique fermé de masse
PHYSIQUE Discipline fondamentale
 Examen suisse de maturité Directives 2003-2006 DS.11 Physique DF PHYSIQUE Discipline fondamentale Par l'étude de la physique en discipline fondamentale, le candidat comprend des phénomènes naturels et
Examen suisse de maturité Directives 2003-2006 DS.11 Physique DF PHYSIQUE Discipline fondamentale Par l'étude de la physique en discipline fondamentale, le candidat comprend des phénomènes naturels et
Mesure de la dépense énergétique
 Mesure de la dépense énergétique Bioénergétique L énergie existe sous différentes formes : calorifique, mécanique, électrique, chimique, rayonnante, nucléaire. La bioénergétique est la branche de la biologie
Mesure de la dépense énergétique Bioénergétique L énergie existe sous différentes formes : calorifique, mécanique, électrique, chimique, rayonnante, nucléaire. La bioénergétique est la branche de la biologie
ÉNERGIE : DÉFINITIONS ET PRINCIPES
 DÉFINITION DE L ÉNERGIE FORMES D ÉNERGIE LES GRANDS PRINCIPES DE L ÉNERGIE DÉCLINAISONS DE L ÉNERGIE RENDEMENT ET EFFICACITÉ DÉFINITION DE L ÉNERGIE L énergie (du grec : force en action) est ce qui permet
DÉFINITION DE L ÉNERGIE FORMES D ÉNERGIE LES GRANDS PRINCIPES DE L ÉNERGIE DÉCLINAISONS DE L ÉNERGIE RENDEMENT ET EFFICACITÉ DÉFINITION DE L ÉNERGIE L énergie (du grec : force en action) est ce qui permet
LA PUISSANCE DES MOTEURS. Avez-vous déjà feuilleté le catalogue d un grand constructeur automobile?
 LA PUISSANCE DES MOTEURS Avez-vous déjà feuilleté le catalogue d un grand constructeur automobile? Chaque modèle y est décliné en plusieurs versions, les différences portant essentiellement sur la puissance
LA PUISSANCE DES MOTEURS Avez-vous déjà feuilleté le catalogue d un grand constructeur automobile? Chaque modèle y est décliné en plusieurs versions, les différences portant essentiellement sur la puissance
L énergie sous toutes ses formes : définitions
 L énergie sous toutes ses formes : définitions primaire, énergie secondaire, utile ou finale. Quelles sont les formes et les déclinaisons de l énergie? D après le dictionnaire de l Académie française,
L énergie sous toutes ses formes : définitions primaire, énergie secondaire, utile ou finale. Quelles sont les formes et les déclinaisons de l énergie? D après le dictionnaire de l Académie française,
MESURE DE LA TEMPERATURE
 145 T2 MESURE DE LA TEMPERATURE I. INTRODUCTION Dans la majorité des phénomènes physiques, la température joue un rôle prépondérant. Pour la mesurer, les moyens les plus couramment utilisés sont : les
145 T2 MESURE DE LA TEMPERATURE I. INTRODUCTION Dans la majorité des phénomènes physiques, la température joue un rôle prépondérant. Pour la mesurer, les moyens les plus couramment utilisés sont : les
Initiation à la Mécanique des Fluides. Mr. Zoubir HAMIDI
 Initiation à la Mécanique des Fluides Mr. Zoubir HAMIDI Chapitre I : Introduction à la mécanique des fluides 1 Introduction La mécanique des fluides(mdf) a pour objet l étude du comportement des fluides
Initiation à la Mécanique des Fluides Mr. Zoubir HAMIDI Chapitre I : Introduction à la mécanique des fluides 1 Introduction La mécanique des fluides(mdf) a pour objet l étude du comportement des fluides
document proposé sur le site «Sciences Physiques en BTS» : http://nicole.cortial.net BTS AVA 2015
 BT V 2015 (envoyé par Frédéric COTTI - Professeur d Electrotechnique au Lycée Régional La Floride Marseille) Document 1 - Etiquette énergie Partie 1 : Voiture à faible consommation - Une étiquette pour
BT V 2015 (envoyé par Frédéric COTTI - Professeur d Electrotechnique au Lycée Régional La Floride Marseille) Document 1 - Etiquette énergie Partie 1 : Voiture à faible consommation - Une étiquette pour
Exercice 1. Exercice n 1 : Déséquilibre mécanique
 Exercice 1 1. a) Un mobile peut-il avoir une accélération non nulle à un instant où sa vitesse est nulle? donner un exemple illustrant la réponse. b) Un mobile peut-il avoir une accélération de direction
Exercice 1 1. a) Un mobile peut-il avoir une accélération non nulle à un instant où sa vitesse est nulle? donner un exemple illustrant la réponse. b) Un mobile peut-il avoir une accélération de direction
ALFÉA HYBRID DUO FIOUL BAS NOX
 ALFÉA HYBRID BAS NOX POMPE À CHALEUR HYBRIDE AVEC APPOINT FIOUL INTÉGRÉ HAUTE TEMPÉRATURE 80 C DÉPART D EAU JUSQU À 60 C EN THERMODYNAMIQUE SOLUTION RÉNOVATION EN REMPLACEMENT DE CHAUDIÈRE FAITES CONNAISSANCE
ALFÉA HYBRID BAS NOX POMPE À CHALEUR HYBRIDE AVEC APPOINT FIOUL INTÉGRÉ HAUTE TEMPÉRATURE 80 C DÉPART D EAU JUSQU À 60 C EN THERMODYNAMIQUE SOLUTION RÉNOVATION EN REMPLACEMENT DE CHAUDIÈRE FAITES CONNAISSANCE
Champ électromagnétique?
 Qu est-ce qu un Champ électromagnétique? Alain Azoulay Consultant, www.radiocem.com 3 décembre 2013. 1 Définition trouvée à l article 2 de la Directive «champs électromagnétiques» : des champs électriques
Qu est-ce qu un Champ électromagnétique? Alain Azoulay Consultant, www.radiocem.com 3 décembre 2013. 1 Définition trouvée à l article 2 de la Directive «champs électromagnétiques» : des champs électriques
Chap 1: Toujours plus vite... Introduction: Comment déterminer la vitesse d une voiture?
 Thème 2 La sécurité Chap 1: Toujours plus vite... Introduction: Comment déterminer la vitesse d une voiture?! Il faut deux informations Le temps écoulé La distance parcourue Vitesse= distance temps > Activité
Thème 2 La sécurité Chap 1: Toujours plus vite... Introduction: Comment déterminer la vitesse d une voiture?! Il faut deux informations Le temps écoulé La distance parcourue Vitesse= distance temps > Activité
Etudier le diagramme température-pression, en particulier le point triple de l azote.
 K4. Point triple de l azote I. BUT DE LA MANIPULATION Etudier le diagramme température-pression, en particulier le point triple de l azote. II. BASES THEORIQUES Etats de la matière La matière est constituée
K4. Point triple de l azote I. BUT DE LA MANIPULATION Etudier le diagramme température-pression, en particulier le point triple de l azote. II. BASES THEORIQUES Etats de la matière La matière est constituée
Unités: m 3. 1,3 kg m 3 * V = πr 2 h.
 1. Masse volumique Définition: La masse volumique ρ est définie comme étant la masse M par unité de volume V: ρ = M V Unités: kg ou éventuellement 3 m g cm 3. Ordres de grandeur: Matière Eau Air * Aluminium
1. Masse volumique Définition: La masse volumique ρ est définie comme étant la masse M par unité de volume V: ρ = M V Unités: kg ou éventuellement 3 m g cm 3. Ordres de grandeur: Matière Eau Air * Aluminium
AIDE-MÉMOIRE LA THERMOCHIMIE TABLE DES MATIERES
 Collège Voltaire, 2014-2015 AIDE-MÉMOIRE LA THERMOCHIMIE http://dcpe.net/poii/sites/default/files/cours%20et%20ex/cours-ch2-thermo.pdf TABLE DES MATIERES 3.A. Introduction...2 3.B. Chaleur...3 3.C. Variation
Collège Voltaire, 2014-2015 AIDE-MÉMOIRE LA THERMOCHIMIE http://dcpe.net/poii/sites/default/files/cours%20et%20ex/cours-ch2-thermo.pdf TABLE DES MATIERES 3.A. Introduction...2 3.B. Chaleur...3 3.C. Variation
LES LOIS PHYSIQUES APPLIQUÉES AUX DEUX-ROUES : 1. LA FORCE DE GUIDAGE
 LES LOIS PHYSIQUES APPLIQUÉES AUX DEUX-ROUES : 1. LA FORCE DE GUIDAGE 2. L EFFET GYROSCOPIQUE Les lois physiques qui régissent le mouvement des véhicules terrestres sont des lois universelles qui s appliquent
LES LOIS PHYSIQUES APPLIQUÉES AUX DEUX-ROUES : 1. LA FORCE DE GUIDAGE 2. L EFFET GYROSCOPIQUE Les lois physiques qui régissent le mouvement des véhicules terrestres sont des lois universelles qui s appliquent
Chapitre 02. La lumière des étoiles. Exercices :
 Chapitre 02 La lumière des étoiles. I- Lumière monochromatique et lumière polychromatique. )- Expérience de Newton (642 727). 2)- Expérience avec la lumière émise par un Laser. 3)- Radiation et longueur
Chapitre 02 La lumière des étoiles. I- Lumière monochromatique et lumière polychromatique. )- Expérience de Newton (642 727). 2)- Expérience avec la lumière émise par un Laser. 3)- Radiation et longueur
Thermodynamique (Échange thermique)
 Thermodynamique (Échange thermique) Introduction : Cette activité est mise en ligne sur le site du CNRMAO avec l autorisation de la société ERM Automatismes Industriels, détentrice des droits de publication
Thermodynamique (Échange thermique) Introduction : Cette activité est mise en ligne sur le site du CNRMAO avec l autorisation de la société ERM Automatismes Industriels, détentrice des droits de publication
Physique, chapitre 8 : La tension alternative
 Physique, chapitre 8 : La tension alternative 1. La tension alternative 1.1 Différence entre une tension continue et une tension alternative Une tension est dite continue quand sa valeur ne change pas.
Physique, chapitre 8 : La tension alternative 1. La tension alternative 1.1 Différence entre une tension continue et une tension alternative Une tension est dite continue quand sa valeur ne change pas.
Les puissances 4. 4.1. La notion de puissance. 4.1.1. La puissance c est l énergie pendant une seconde CHAPITRE
 4. LES PUISSANCES LA NOTION DE PUISSANCE 88 CHAPITRE 4 Rien ne se perd, rien ne se crée. Mais alors que consomme un appareil électrique si ce n est les électrons? La puissance pardi. Objectifs de ce chapitre
4. LES PUISSANCES LA NOTION DE PUISSANCE 88 CHAPITRE 4 Rien ne se perd, rien ne se crée. Mais alors que consomme un appareil électrique si ce n est les électrons? La puissance pardi. Objectifs de ce chapitre
Cours d électricité. Introduction. Mathieu Bardoux. 1 re année. IUT Saint-Omer / Dunkerque Département Génie Thermique et Énergie
 Cours d électricité Introduction Mathieu Bardoux [email protected] IUT Saint-Omer / Dunkerque Département Génie Thermique et Énergie 1 re année Le terme électricité provient du grec ἤλεκτρον
Cours d électricité Introduction Mathieu Bardoux [email protected] IUT Saint-Omer / Dunkerque Département Génie Thermique et Énergie 1 re année Le terme électricité provient du grec ἤλεκτρον
À propos d ITER. 1- Principe de la fusion thermonucléaire
 À propos d ITER Le projet ITER est un projet international destiné à montrer la faisabilité scientifique et technique de la fusion thermonucléaire contrôlée. Le 8 juin 005, les pays engagés dans le projet
À propos d ITER Le projet ITER est un projet international destiné à montrer la faisabilité scientifique et technique de la fusion thermonucléaire contrôlée. Le 8 juin 005, les pays engagés dans le projet
U-31 CHIMIE-PHYSIQUE INDUSTRIELLES
 Session 200 BREVET de TECHNICIEN SUPÉRIEUR CONTRÔLE INDUSTRIEL et RÉGULATION AUTOMATIQUE E-3 SCIENCES PHYSIQUES U-3 CHIMIE-PHYSIQUE INDUSTRIELLES Durée : 2 heures Coefficient : 2,5 Durée conseillée Chimie
Session 200 BREVET de TECHNICIEN SUPÉRIEUR CONTRÔLE INDUSTRIEL et RÉGULATION AUTOMATIQUE E-3 SCIENCES PHYSIQUES U-3 CHIMIE-PHYSIQUE INDUSTRIELLES Durée : 2 heures Coefficient : 2,5 Durée conseillée Chimie
Exercice n 1: La lampe ci-dessous comporte 2 indications: Exercice n 2: ( compléter les réponses sans espaces)
 Exercice n 1: La lampe ci-dessous comporte 2 indications: Complétez le tableau en indiquant quelle est la grandeur indiquée et son unité: indication grandeur unité 12 V 25W Pour cela je dois appliquer
Exercice n 1: La lampe ci-dessous comporte 2 indications: Complétez le tableau en indiquant quelle est la grandeur indiquée et son unité: indication grandeur unité 12 V 25W Pour cela je dois appliquer
1 Thermodynamique: première loi
 1 hermodynamique: première loi 1.1 Énoncé L énergie d un système isolé est constante, L énergie de l univers est constante, de univers = de syst + de env. = 0 1 L énergie d un système est une fonction
1 hermodynamique: première loi 1.1 Énoncé L énergie d un système isolé est constante, L énergie de l univers est constante, de univers = de syst + de env. = 0 1 L énergie d un système est une fonction
BREVET DE TECHNICIEN SUPÉRIEUR AGRICOLE SUJET
 SESSION 2010 France métropolitaine BREVET DE TECHNICIEN SUPÉRIEUR AGRICOLE ÉPREUVE N 2 DU PREMIER GROUPE ÉPREUVE SCIENTIFIQUE ET TECHNIQUE Option : Génie des équipements agricoles Durée : 3 heures 30 Matériel
SESSION 2010 France métropolitaine BREVET DE TECHNICIEN SUPÉRIEUR AGRICOLE ÉPREUVE N 2 DU PREMIER GROUPE ÉPREUVE SCIENTIFIQUE ET TECHNIQUE Option : Génie des équipements agricoles Durée : 3 heures 30 Matériel
DROUHIN Bernard. Le chauffe-eau solaire
 DROUHIN Bernard Le chauffe-eau solaire DROUHIN Bernard Le chauffe-eau solaire Principe de fonctionnement Les Capteurs Les ballons Les organes de sécurité Les besoins L ensoleillement dimensionnement Comment
DROUHIN Bernard Le chauffe-eau solaire DROUHIN Bernard Le chauffe-eau solaire Principe de fonctionnement Les Capteurs Les ballons Les organes de sécurité Les besoins L ensoleillement dimensionnement Comment
Chapitre 2 : Caractéristiques du mouvement d un solide
 Chapitre 2 : Caractéristiques du mouvement d un solide I Rappels : Référentiel : Le mouvement d un corps est décris par rapport à un corps de référence et dépend du choix de ce corps. Ce corps de référence
Chapitre 2 : Caractéristiques du mouvement d un solide I Rappels : Référentiel : Le mouvement d un corps est décris par rapport à un corps de référence et dépend du choix de ce corps. Ce corps de référence
La gravitation universelle
 La gravitation universelle Pourquoi les planètes du système solaire restent-elles en orbite autour du Soleil? 1) Qu'est-ce que la gravitation universelle? activité : Attraction universelle La cohésion
La gravitation universelle Pourquoi les planètes du système solaire restent-elles en orbite autour du Soleil? 1) Qu'est-ce que la gravitation universelle? activité : Attraction universelle La cohésion
Chapitre 5 : Le travail d une force :
 Classe de 1èreS Chapitre 5 Physique Chapitre 5 : Le travail d une force : Introduction : fiche élève Considérons des objets qui subissent des forces dont le point d application se déplace : Par exemple
Classe de 1èreS Chapitre 5 Physique Chapitre 5 : Le travail d une force : Introduction : fiche élève Considérons des objets qui subissent des forces dont le point d application se déplace : Par exemple
Les unités de mesure en physique
 Les unités de mesure en physique Historique Équations aux dimensions Le système international Définitions des unités fondamentales Grandeurs supplémentaires Unités dérivées Espace Masse Temps Quantité
Les unités de mesure en physique Historique Équations aux dimensions Le système international Définitions des unités fondamentales Grandeurs supplémentaires Unités dérivées Espace Masse Temps Quantité
1 ère partie : tous CAP sauf hôtellerie et alimentation CHIMIE ETRE CAPABLE DE. PROGRAMME - Atomes : structure, étude de quelques exemples.
 Référentiel CAP Sciences Physiques Page 1/9 SCIENCES PHYSIQUES CERTIFICATS D APTITUDES PROFESSIONNELLES Le référentiel de sciences donne pour les différentes parties du programme de formation la liste
Référentiel CAP Sciences Physiques Page 1/9 SCIENCES PHYSIQUES CERTIFICATS D APTITUDES PROFESSIONNELLES Le référentiel de sciences donne pour les différentes parties du programme de formation la liste
1 000 W ; 1 500 W ; 2 000 W ; 2 500 W. La chambre que je dois équiper a pour dimensions : longueur : 6 m largeur : 4 m hauteur : 2,50 m.
 EXERCICES SUR LA PUISSANCE DU COURANT ÉLECTRIQUE Exercice 1 En zone tempérée pour une habitation moyennement isolée il faut compter 40 W/m 3. Sur un catalogue, 4 modèles de radiateurs électriques sont
EXERCICES SUR LA PUISSANCE DU COURANT ÉLECTRIQUE Exercice 1 En zone tempérée pour une habitation moyennement isolée il faut compter 40 W/m 3. Sur un catalogue, 4 modèles de radiateurs électriques sont
4.14 Influence de la température sur les résistances
 nfluence de la température sur la résistance 4.14 nfluence de la température sur les résistances ne résistance R, parcourue par un courant pendant un certain temps t, dissipe une énergie calorifique (W
nfluence de la température sur la résistance 4.14 nfluence de la température sur les résistances ne résistance R, parcourue par un courant pendant un certain temps t, dissipe une énergie calorifique (W
DYNAMIQUE DE FORMATION DES ÉTOILES
 A 99 PHYS. II ÉCOLE NATIONALE DES PONTS ET CHAUSSÉES, ÉCOLES NATIONALES SUPÉRIEURES DE L'AÉRONAUTIQUE ET DE L'ESPACE, DE TECHNIQUES AVANCÉES, DES TÉLÉCOMMUNICATIONS, DES MINES DE PARIS, DES MINES DE SAINT-ÉTIENNE,
A 99 PHYS. II ÉCOLE NATIONALE DES PONTS ET CHAUSSÉES, ÉCOLES NATIONALES SUPÉRIEURES DE L'AÉRONAUTIQUE ET DE L'ESPACE, DE TECHNIQUES AVANCÉES, DES TÉLÉCOMMUNICATIONS, DES MINES DE PARIS, DES MINES DE SAINT-ÉTIENNE,
de faible capacité (inférieure ou égale à 75 litres) doivent être certifiés et porter la marque NF électricité performance.
 9.5. PRODUCTION D EAU CHAUDE sanitaire Les équipements doivent être dimensionnés au plus juste en fonction du projet et une étude de faisabilité doit être réalisée pour les bâtiments collectifs d habitation
9.5. PRODUCTION D EAU CHAUDE sanitaire Les équipements doivent être dimensionnés au plus juste en fonction du projet et une étude de faisabilité doit être réalisée pour les bâtiments collectifs d habitation
Optimisation des systèmes énergétiques Master 1 : GSI Génie Energétique et Thermique
 Optimisation des systèmes énergétiques Master 1 : GSI Génie Energétique et Thermique Année 2009-2010 2008-09 Stéphane LE PERSON Maître de Conférences Université Joseph Fourier Jean-Paul THIBAULT LEGI UMR
Optimisation des systèmes énergétiques Master 1 : GSI Génie Energétique et Thermique Année 2009-2010 2008-09 Stéphane LE PERSON Maître de Conférences Université Joseph Fourier Jean-Paul THIBAULT LEGI UMR
Annexe 3 Captation d énergie
 1. DISPOSITIONS GENERALES 1.a. Captation d'énergie. Annexe 3 Captation Dans tous les cas, si l exploitation de la ressource naturelle est soumise à l octroi d un permis d urbanisme et/ou d environnement,
1. DISPOSITIONS GENERALES 1.a. Captation d'énergie. Annexe 3 Captation Dans tous les cas, si l exploitation de la ressource naturelle est soumise à l octroi d un permis d urbanisme et/ou d environnement,
GENERALITES SUR LA MESURE DE TEMPERATURE
 Distributeur exclusif de GENERALITES SUR LA MESURE DE TEMPERATURE INTRODUCTION...2 GENERALITES SUR LA MESURE DE TEMPERATURE...2 La température...2 Unités de mesure de température...3 Echelle de température...3
Distributeur exclusif de GENERALITES SUR LA MESURE DE TEMPERATURE INTRODUCTION...2 GENERALITES SUR LA MESURE DE TEMPERATURE...2 La température...2 Unités de mesure de température...3 Echelle de température...3
Fiche explicative pour la saisie des équipements du génie climatique dans la RT2012
 Fiche explicative pour la saisie des équipements du génie climatique dans la RT2012 LES CHAUFFE-EAU THERMODYNAMIQUES I/ PRINCIPE GENERAL Un chauffe-eau thermodynamique (CET) est un générateur thermodynamique
Fiche explicative pour la saisie des équipements du génie climatique dans la RT2012 LES CHAUFFE-EAU THERMODYNAMIQUES I/ PRINCIPE GENERAL Un chauffe-eau thermodynamique (CET) est un générateur thermodynamique
CONCOURS COMMUN 2010 PHYSIQUE
 CONCOUS COMMUN SUJET A DES ÉCOLES DES MINES D ALBI, ALÈS, DOUAI, NANTES Épreuve de Physique-Chimie (toutes filières) Corrigé Barème total points : Physique points - Chimie 68 points PHYSIQUE Partie A :
CONCOUS COMMUN SUJET A DES ÉCOLES DES MINES D ALBI, ALÈS, DOUAI, NANTES Épreuve de Physique-Chimie (toutes filières) Corrigé Barème total points : Physique points - Chimie 68 points PHYSIQUE Partie A :
Energie et conversions d énergie
 Chapitre 6 et conversions d énergie I) NOTIONS GENERALES Les différentes formes d énergie : électrique (liée aux courants et tensions) lumineuse (liée à un mouvement ou à l altitude) thermique (liée à
Chapitre 6 et conversions d énergie I) NOTIONS GENERALES Les différentes formes d énergie : électrique (liée aux courants et tensions) lumineuse (liée à un mouvement ou à l altitude) thermique (liée à
1 Définition. 2 Systèmes matériels et solides. 3 Les actions mécaniques. Le système matériel : Il peut être un ensemble.un sous-ensemble..
 1 Définition GÉNÉRALITÉS Statique 1 2 Systèmes matériels et solides Le système matériel : Il peut être un ensemble.un sous-ensemble..une pièce mais aussi un liquide ou un gaz Le solide : Il est supposé
1 Définition GÉNÉRALITÉS Statique 1 2 Systèmes matériels et solides Le système matériel : Il peut être un ensemble.un sous-ensemble..une pièce mais aussi un liquide ou un gaz Le solide : Il est supposé
Mesures calorimétriques
 TP N 11 Mesures calorimétriques - page 51 - - T.P. N 11 - Ce document rassemble plusieurs mesures qui vont faire l'objet de quatre séances de travaux pratiques. La quasi totalité de ces manipulations utilisent
TP N 11 Mesures calorimétriques - page 51 - - T.P. N 11 - Ce document rassemble plusieurs mesures qui vont faire l'objet de quatre séances de travaux pratiques. La quasi totalité de ces manipulations utilisent
Manuel d'utilisation de la maquette
 Manuel d'utilisation de la maquette PANNEAU SOLAIRE AUTO-PILOTE Enseignement au lycée Article Code Panneau solaire auto-piloté 14740 Document non contractuel L'énergie solaire L'énergie solaire est l'énergie
Manuel d'utilisation de la maquette PANNEAU SOLAIRE AUTO-PILOTE Enseignement au lycée Article Code Panneau solaire auto-piloté 14740 Document non contractuel L'énergie solaire L'énergie solaire est l'énergie
BREVET 2 * Principes physiques régissant la plongée. Première partie
 BREVET 2 * Principes physiques régissant la plongée Première partie Objectifs de ce cours: 1. Introduction à la formation du 2* 2. Comprendre les lois fondamentales régissant : la flottabilité (Archimède)
BREVET 2 * Principes physiques régissant la plongée Première partie Objectifs de ce cours: 1. Introduction à la formation du 2* 2. Comprendre les lois fondamentales régissant : la flottabilité (Archimède)
Test : principe fondamental de la dynamique et aspect énergétique
 Durée : 45 minutes Objectifs Test : principe fondamental de la dynamique et aspect énergétique Projection de forces. Calcul de durée d'accélération / décélération ou d'accélération / décélération ou de
Durée : 45 minutes Objectifs Test : principe fondamental de la dynamique et aspect énergétique Projection de forces. Calcul de durée d'accélération / décélération ou d'accélération / décélération ou de
L ÉLECTROCUTION Intensité Durée Perception des effets 0,5 à 1 ma. Seuil de perception suivant l'état de la peau 8 ma
 TP THÈME LUMIÈRES ARTIFICIELLES 1STD2A CHAP.VI. INSTALLATION D ÉCLAIRAGE ÉLECTRIQUE SÉCURISÉE I. RISQUES D UNE ÉLECTROCUTION TP M 02 C PAGE 1 / 4 Courant Effets électriques 0,5 ma Seuil de perception -
TP THÈME LUMIÈRES ARTIFICIELLES 1STD2A CHAP.VI. INSTALLATION D ÉCLAIRAGE ÉLECTRIQUE SÉCURISÉE I. RISQUES D UNE ÉLECTROCUTION TP M 02 C PAGE 1 / 4 Courant Effets électriques 0,5 ma Seuil de perception -
Physique : Thermodynamique
 Correction du Devoir urveillé n o 8 Physique : hermodynamique I Cycle moteur [Véto 200] Cf Cours : C P m C V m R relation de Mayer, pour un GP. C P m γr γ 29, 0 J.K.mol et C V m R γ 20, 78 J.K.mol. 2 Une
Correction du Devoir urveillé n o 8 Physique : hermodynamique I Cycle moteur [Véto 200] Cf Cours : C P m C V m R relation de Mayer, pour un GP. C P m γr γ 29, 0 J.K.mol et C V m R γ 20, 78 J.K.mol. 2 Une
C3. Produire de l électricité
 C3. Produire de l électricité a. Electricité : définition et génération i. Définition La matière est constituée d. Au centre de l atome, se trouve un noyau constitué de charges positives (.) et neutres
C3. Produire de l électricité a. Electricité : définition et génération i. Définition La matière est constituée d. Au centre de l atome, se trouve un noyau constitué de charges positives (.) et neutres
véhicule hybride (première
 La motorisation d un véhicule hybride (première HERVÉ DISCOURS [1] La cherté et la raréfaction du pétrole ainsi que la sensibilisation du public à l impact de son exploitation sur l environnement conduisent
La motorisation d un véhicule hybride (première HERVÉ DISCOURS [1] La cherté et la raréfaction du pétrole ainsi que la sensibilisation du public à l impact de son exploitation sur l environnement conduisent
ÉCONOMIES D ÉNERGIE, ÉNERGIES RENOUVELABLES ET PRATIQUES ÉCOLOGIQUES
 ÉCONOMIES D ÉNERGIE, ÉNERGIES RENOUVELABLES ET PRATIQUES ÉCOLOGIQUES Comment réduire ma facture énergétique et en même temps mon impact sur l environnement. Sommaire 1 COMBIEN CONSOMMONS NOUS CHACUN?...2
ÉCONOMIES D ÉNERGIE, ÉNERGIES RENOUVELABLES ET PRATIQUES ÉCOLOGIQUES Comment réduire ma facture énergétique et en même temps mon impact sur l environnement. Sommaire 1 COMBIEN CONSOMMONS NOUS CHACUN?...2
Rencontre des savoirs. L énergie électrique est-elle bien adaptée à une mobilité durable?
 Institut français des sciences et technologies des transports, de l aménagement et des réseaux Rencontre des savoirs Bron 14 mai 2013 L énergie électrique est-elle bien adaptée à une mobilité durable?
Institut français des sciences et technologies des transports, de l aménagement et des réseaux Rencontre des savoirs Bron 14 mai 2013 L énergie électrique est-elle bien adaptée à une mobilité durable?
Technologie des contacteurs gaz liquide : cas des colonnes à plateaux et à garnissage. M. Prévost
 Technologie des contacteurs gaz liquide : cas des colonnes à plateaux et à garnissage M. Prévost Version V2/ nov 2006 Structure du cours Partie 1 : Introduction Partie 2 : Mise en contact de Gaz et de
Technologie des contacteurs gaz liquide : cas des colonnes à plateaux et à garnissage M. Prévost Version V2/ nov 2006 Structure du cours Partie 1 : Introduction Partie 2 : Mise en contact de Gaz et de
Réduction de la pollution d un moteur diesel
 AUBERT Maxime SUP B Professeur accompagnateur : DELOFFRE Maximilien SUP B Mr Françcois BOIS PAGES Simon SUP E Groupe n Réduction de la pollution d un moteur diesel Introduction L Allemand Rudolf Diesel
AUBERT Maxime SUP B Professeur accompagnateur : DELOFFRE Maximilien SUP B Mr Françcois BOIS PAGES Simon SUP E Groupe n Réduction de la pollution d un moteur diesel Introduction L Allemand Rudolf Diesel
Chapitre 7: Dynamique des fluides
 Chapitre 7: Dynamique des fluides But du chapitre: comprendre les principes qui permettent de décrire la circulation sanguine. Ceci revient à étudier la manière dont les fluides circulent dans les tuyaux.
Chapitre 7: Dynamique des fluides But du chapitre: comprendre les principes qui permettent de décrire la circulation sanguine. Ceci revient à étudier la manière dont les fluides circulent dans les tuyaux.
LA MESURE DE LA PRESSION
 LA MESURE DE LA PRESSION La mesure de la pression s effectue à l aide d un baromètre. Il s agit d un instrument permettant de repérer la pression de l atmosphère dans laquelle il se trouve et ses variations
LA MESURE DE LA PRESSION La mesure de la pression s effectue à l aide d un baromètre. Il s agit d un instrument permettant de repérer la pression de l atmosphère dans laquelle il se trouve et ses variations
COURS DE THERMODYNAMIQUE
 I.U.T. de Saint-Omer Dunkerque Département Génie Thermique et énergie COURS DE THERMODYNAMIQUE eme Semestre Olivier PERROT 010-011 1 Avertissement : Ce cours de thermodynamique présente quelques applications
I.U.T. de Saint-Omer Dunkerque Département Génie Thermique et énergie COURS DE THERMODYNAMIQUE eme Semestre Olivier PERROT 010-011 1 Avertissement : Ce cours de thermodynamique présente quelques applications
POLY-PREPAS Centre de Préparation aux Concours Paramédicaux. - Section Orthoptiste / stage i-prépa intensif -
 POLY-PREPAS Centre de Préparation aux Concours Paramédicaux - Section Orthoptiste / stage i-prépa intensif - 1 Suite énoncé des exos du Chapitre 14 : Noyaux-masse-énergie I. Fission nucléaire induite (provoquée)
POLY-PREPAS Centre de Préparation aux Concours Paramédicaux - Section Orthoptiste / stage i-prépa intensif - 1 Suite énoncé des exos du Chapitre 14 : Noyaux-masse-énergie I. Fission nucléaire induite (provoquée)
Mesures et incertitudes
 En physique et en chimie, toute grandeur, mesurée ou calculée, est entachée d erreur, ce qui ne l empêche pas d être exploitée pour prendre des décisions. Aujourd hui, la notion d erreur a son vocabulaire
En physique et en chimie, toute grandeur, mesurée ou calculée, est entachée d erreur, ce qui ne l empêche pas d être exploitée pour prendre des décisions. Aujourd hui, la notion d erreur a son vocabulaire
Chapitre 6 ÉNERGIE PUISSANCE - RENDEMENT. W = F * d. Sommaire
 Chapitre 6 ÉNERGIE PUISSANCE - RENDEMENT Sommaire 1. Définitions symboles - unités 2. Chute de tension dans les conducteurs 3. Effets calorifiques du courant 1. DÉFINITIONS SYMBOLES - UNITÉS 1.1 Force
Chapitre 6 ÉNERGIE PUISSANCE - RENDEMENT Sommaire 1. Définitions symboles - unités 2. Chute de tension dans les conducteurs 3. Effets calorifiques du courant 1. DÉFINITIONS SYMBOLES - UNITÉS 1.1 Force
Module 3 : L électricité
 Sciences 9 e année Nom : Classe : Module 3 : L électricité Partie 1 : Électricité statique et courant électrique (chapitre 7 et début du chapitre 8) 1. L électrostatique a. Les charges et les décharges
Sciences 9 e année Nom : Classe : Module 3 : L électricité Partie 1 : Électricité statique et courant électrique (chapitre 7 et début du chapitre 8) 1. L électrostatique a. Les charges et les décharges
Page : 1 de 6 MAJ: 01.03.2010. 2-10_Chaudieresbuches_serie VX_FR_010310.odt. Gamme de chaudières VX avec régulation GEFIcontrol :
 Page : 1 de 6 Gamme de chaudières VX avec régulation GEFIcontrol : Référence article 058.01.250: VX18 Référence article 058.01.251: VX20 Référence article 058.01.252: VX30 Chaudière spéciale à gazéification
Page : 1 de 6 Gamme de chaudières VX avec régulation GEFIcontrol : Référence article 058.01.250: VX18 Référence article 058.01.251: VX20 Référence article 058.01.252: VX30 Chaudière spéciale à gazéification
Gamme 2010-2011 Véhicules électriques et hybrides
 Exposant Ecomobilys, partenaire de votre mobilité urbaine. 251 avenue Saint-Exupéry 62100 Calais Gamme 2010-2011 Véhicules électriques et hybrides Little 4 version fermée, sur le port de la ville de Calais.
Exposant Ecomobilys, partenaire de votre mobilité urbaine. 251 avenue Saint-Exupéry 62100 Calais Gamme 2010-2011 Véhicules électriques et hybrides Little 4 version fermée, sur le port de la ville de Calais.
Chapitre 5 : Noyaux, masse et énergie
 Chapitre 5 : Noyaux, masse et énergie Connaissances et savoir-faire exigibles : () () (3) () (5) (6) (7) (8) Définir et calculer un défaut de masse et une énergie de liaison. Définir et calculer l énergie
Chapitre 5 : Noyaux, masse et énergie Connaissances et savoir-faire exigibles : () () (3) () (5) (6) (7) (8) Définir et calculer un défaut de masse et une énergie de liaison. Définir et calculer l énergie
MATIE RE DU COURS DE PHYSIQUE
 MATIE RE DU COURS DE PHYSIQUE Titulaire : A. Rauw 5h/semaine 1) MÉCANIQUE a) Cinématique ii) Référentiel Relativité des notions de repos et mouvement Relativité de la notion de trajectoire Référentiel
MATIE RE DU COURS DE PHYSIQUE Titulaire : A. Rauw 5h/semaine 1) MÉCANIQUE a) Cinématique ii) Référentiel Relativité des notions de repos et mouvement Relativité de la notion de trajectoire Référentiel
Séquence 14 : puissance et énergie électrique Cours niveau troisième
 Séquence 14 : puissance et énergie électrique Cours niveau troisième Objectifs : - Savoir que : o Le watt (W) est l unité de puissance o Le joule (J) est l unité de l énergie o L intensité du courant électrique
Séquence 14 : puissance et énergie électrique Cours niveau troisième Objectifs : - Savoir que : o Le watt (W) est l unité de puissance o Le joule (J) est l unité de l énergie o L intensité du courant électrique
Atelier : L énergie nucléaire en Astrophysique
 Atelier : L énergie nucléaire en Astrophysique Elisabeth Vangioni Institut d Astrophysique de Paris Fleurance, 8 Août 2005 Une calculatrice, une règle et du papier quadrillé sont nécessaires au bon fonctionnement
Atelier : L énergie nucléaire en Astrophysique Elisabeth Vangioni Institut d Astrophysique de Paris Fleurance, 8 Août 2005 Une calculatrice, une règle et du papier quadrillé sont nécessaires au bon fonctionnement
Système de surveillance vidéo
 Conrad sur INTERNET www.conrad.fr N O T I C E Version 12/01 Entretien Pour un fonctionnement correct de votre système de surveillance vidéo, prenez note des conseils suivants : 1/ Tenez la caméra et le
Conrad sur INTERNET www.conrad.fr N O T I C E Version 12/01 Entretien Pour un fonctionnement correct de votre système de surveillance vidéo, prenez note des conseils suivants : 1/ Tenez la caméra et le
L énergie grâce à l eau ça coule de source!
 Bacheliers en Electromécanique Implantation de Seraing L énergie grâce à l eau ça coule de source! Mars 2013 - Quai Van Beneden Par B. Jansen, A. Hay, F. Laureiro, V. Rosso, E. Simon et F. Simonis Contact:
Bacheliers en Electromécanique Implantation de Seraing L énergie grâce à l eau ça coule de source! Mars 2013 - Quai Van Beneden Par B. Jansen, A. Hay, F. Laureiro, V. Rosso, E. Simon et F. Simonis Contact:
PETIT GUIDE D ÉCO-CONDUITE
 PETIT GUIDE D ÉCO-CONDUITE L éco-conduite : notre collectivité s engage Rouler dans «le bon sens» aujourd hui, c est utiliser sa voiture de manière écologique, économique et sûre. Ce guide vous permettra
PETIT GUIDE D ÉCO-CONDUITE L éco-conduite : notre collectivité s engage Rouler dans «le bon sens» aujourd hui, c est utiliser sa voiture de manière écologique, économique et sûre. Ce guide vous permettra
LYCEE TECHNIQUE PIERRE EMILE MARTIN - 18 026 BOURGES ETUDE D UN TRAITEMENT DE SURFACE
 TP. TET LYCEE TECHNIQUE PIERRE EMILE MARTIN - 18 026 BOURGES GENIE ELECTROTECHNIQUE Durée : 3 heures Tp relais statique 10-11 RELAIS STATIQUE S.T.I. Pré-requis : Laboratoire des systèmes Cours sur les
TP. TET LYCEE TECHNIQUE PIERRE EMILE MARTIN - 18 026 BOURGES GENIE ELECTROTECHNIQUE Durée : 3 heures Tp relais statique 10-11 RELAIS STATIQUE S.T.I. Pré-requis : Laboratoire des systèmes Cours sur les
SCIENCES TECHNOLOGIES
 R essources MICHEL WAUTELET SCIENCES TECHNOLOGIES et SOCIÉTÉ Questions et réponses pour illustrer les cours de sciences De Boeck Introduction générale 5 Sciences, technologies, société 1. Quels sont les
R essources MICHEL WAUTELET SCIENCES TECHNOLOGIES et SOCIÉTÉ Questions et réponses pour illustrer les cours de sciences De Boeck Introduction générale 5 Sciences, technologies, société 1. Quels sont les
Les rayons X. Olivier Ernst
 Les rayons X Olivier Ernst Lille La physique pour les nuls 1 Une onde est caractérisée par : Sa fréquence F en Hertz (Hz) : nombre de cycle par seconde Sa longueur λ : distance entre 2 maximum Sa vitesse
Les rayons X Olivier Ernst Lille La physique pour les nuls 1 Une onde est caractérisée par : Sa fréquence F en Hertz (Hz) : nombre de cycle par seconde Sa longueur λ : distance entre 2 maximum Sa vitesse
NOTICE TECHNIQUE SSC : Système Solaire Combiné eau chaude sanitaire / appui chauffage maison / appui eau chaude piscine
 NOTICE TECHNIQUE SSC : Système Solaire Combiné eau chaude sanitaire / appui chauffage maison / appui eau chaude piscine «Capteur autonome eau chaude» Choix de la gamme ECOAUTONOME a retenu un capteur solaire
NOTICE TECHNIQUE SSC : Système Solaire Combiné eau chaude sanitaire / appui chauffage maison / appui eau chaude piscine «Capteur autonome eau chaude» Choix de la gamme ECOAUTONOME a retenu un capteur solaire
Stockage de chaleur solaire par sorption : Analyse et contrôle du système à partir de sa simulation dynamique
 Stockage de chaleur solaire par sorption : Analyse et contrôle du système à partir de sa simulation dynamique Kokouvi Edem N TSOUKPOE 1, Nolwenn LE PIERRÈS 1*, Lingai LUO 1 1 LOCIE, CNRS FRE3220-Université
Stockage de chaleur solaire par sorption : Analyse et contrôle du système à partir de sa simulation dynamique Kokouvi Edem N TSOUKPOE 1, Nolwenn LE PIERRÈS 1*, Lingai LUO 1 1 LOCIE, CNRS FRE3220-Université
Mathématiques et petites voitures
 Mathématiques et petites voitures Thomas Lefebvre 10 avril 2015 Résumé Ce document présente diérentes applications des mathématiques dans le domaine du slot-racing. Table des matières 1 Périmètre et circuit
Mathématiques et petites voitures Thomas Lefebvre 10 avril 2015 Résumé Ce document présente diérentes applications des mathématiques dans le domaine du slot-racing. Table des matières 1 Périmètre et circuit
Mesures du coefficient adiabatique γ de l air
 Mesures du oeffiient adiabatique γ de l air Introdution : γ est le rapport des apaités alorifiques massiques d un gaz : γ = p v Le gaz étudié est l air. La mesure de la haleur massique à pression onstante
Mesures du oeffiient adiabatique γ de l air Introdution : γ est le rapport des apaités alorifiques massiques d un gaz : γ = p v Le gaz étudié est l air. La mesure de la haleur massique à pression onstante
Mécanique. 1 Forces. 1.1 Rappel. 1.2 Mesurer des forces. 3BC - AL Mécanique 1
 3BC - AL Mécanique 1 Mécanique 1 Forces 1.1 Rappel Pour décrire les effets d une force, nous devons préciser toutes ses propriétés : son point d application ; sa droite d action, c est-à-dire sa direction
3BC - AL Mécanique 1 Mécanique 1 Forces 1.1 Rappel Pour décrire les effets d une force, nous devons préciser toutes ses propriétés : son point d application ; sa droite d action, c est-à-dire sa direction
Athénée royal Jules Delot, Ciney Energie Thermique
 6G3 - Energie thermique page 1 Athénée royal Jules Delot, Ciney Energie Thermique Physique 6ème Générale 3h/semaine Ir Jacques COLLOT 1 6G3 - Energie thermique page Energie Thermique 1. Calorimétrie 1.1
6G3 - Energie thermique page 1 Athénée royal Jules Delot, Ciney Energie Thermique Physique 6ème Générale 3h/semaine Ir Jacques COLLOT 1 6G3 - Energie thermique page Energie Thermique 1. Calorimétrie 1.1
CHAPITRE. Le mouvement en une dimension CORRIGÉ DES EXERCICES
 CHAPITRE Le mouvement en une dimension CORRIGÉ DES EXERCICES Exercices. Le mouvement rectiligne uniforme SECTION. 5. Le graphique suivant représente la vitesse d une cycliste en fonction du temps. Quelle
CHAPITRE Le mouvement en une dimension CORRIGÉ DES EXERCICES Exercices. Le mouvement rectiligne uniforme SECTION. 5. Le graphique suivant représente la vitesse d une cycliste en fonction du temps. Quelle
Exemples d utilisation de G2D à l oral de Centrale
 Exemples d utilisation de G2D à l oral de Centrale 1 Table des matières Page 1 : Binaire liquide-vapeur isotherme et isobare Page 2 : Page 3 : Page 4 : Page 5 : Page 6 : intéressant facile facile sauf
Exemples d utilisation de G2D à l oral de Centrale 1 Table des matières Page 1 : Binaire liquide-vapeur isotherme et isobare Page 2 : Page 3 : Page 4 : Page 5 : Page 6 : intéressant facile facile sauf
Incitants relatifs à l installation de pompes à chaleur en Région wallonne
 Incitants relatifs à l installation de pompes à chaleur en Région wallonne G. FALLON Energie Facteur 4 asbl - Chemin de Vieusart 175-1300 Wavre Tél: 010/23 70 00 - Site web: www.ef4.be email: [email protected]
Incitants relatifs à l installation de pompes à chaleur en Région wallonne G. FALLON Energie Facteur 4 asbl - Chemin de Vieusart 175-1300 Wavre Tél: 010/23 70 00 - Site web: www.ef4.be email: [email protected]
A retenir : A Z m n. m noyau MASSE ET ÉNERGIE RÉACTIONS NUCLÉAIRES I) EQUIVALENCE MASSE-ÉNERGIE
 CP7 MASSE ET ÉNERGIE RÉACTIONS NUCLÉAIRES I) EQUIVALENCE MASSE-ÉNERGIE 1 ) Relation d'équivalence entre la masse et l'énergie -énergie de liaison 2 ) Une unité d énergie mieux adaptée 3 ) application 4
CP7 MASSE ET ÉNERGIE RÉACTIONS NUCLÉAIRES I) EQUIVALENCE MASSE-ÉNERGIE 1 ) Relation d'équivalence entre la masse et l'énergie -énergie de liaison 2 ) Une unité d énergie mieux adaptée 3 ) application 4
SOLUTIONS TECHNOLOGIQUES D AVENIR
 CPTF et CSC CYCLES COMBINES A GAZ (CCG) COGÉNÉRATION DÉVELOPPEMENT DES RENOUVELABLES SOLUTIONS DE STOCKAGE CPTF ET CSC Le parc thermique est un outil essentiel pour ajuster l offre et la demande, indispensable
CPTF et CSC CYCLES COMBINES A GAZ (CCG) COGÉNÉRATION DÉVELOPPEMENT DES RENOUVELABLES SOLUTIONS DE STOCKAGE CPTF ET CSC Le parc thermique est un outil essentiel pour ajuster l offre et la demande, indispensable
Physique 1 TEMPÉRATURE, CHALEUR
 hysique EMÉRAURE, CHALEUR rof. André errenoud Edition mai 8 Andre.errenoud (at) heig-vd.ch HEIG-D / AD A B L E D E S M A I E R E S AGE. INRODUCION.... NOIONS DE EMÉRAURE E DE CHALEUR.... LES ÉCHANGES
hysique EMÉRAURE, CHALEUR rof. André errenoud Edition mai 8 Andre.errenoud (at) heig-vd.ch HEIG-D / AD A B L E D E S M A I E R E S AGE. INRODUCION.... NOIONS DE EMÉRAURE E DE CHALEUR.... LES ÉCHANGES
Chapitre 1: Facteurs d'échelle
 Chapitre 1: Facteurs d'échelle Des considérations générales sur la taille des objets ou des êtres vivants et leur influence sur différents paramètres, permettent d'établir simplement quelques lois ou tendances,
Chapitre 1: Facteurs d'échelle Des considérations générales sur la taille des objets ou des êtres vivants et leur influence sur différents paramètres, permettent d'établir simplement quelques lois ou tendances,
L offre DualSun pour l eau chaude et le chauffage (SSC)
 L offre DualSun pour l eau chaude et le chauffage (SSC) SSC signifie : Système Solaire Combiné. Une installation SSC, est une installation solaire qui est raccordée au circuit de chauffage de la maison,
L offre DualSun pour l eau chaude et le chauffage (SSC) SSC signifie : Système Solaire Combiné. Une installation SSC, est une installation solaire qui est raccordée au circuit de chauffage de la maison,
Cours d électricité. Circuits électriques en courant constant. Mathieu Bardoux. 1 re année
 Cours d électricité Circuits électriques en courant constant Mathieu Bardoux [email protected] IUT Saint-Omer / Dunkerque Département Génie Thermique et Énergie 1 re année Objectifs du chapitre
Cours d électricité Circuits électriques en courant constant Mathieu Bardoux [email protected] IUT Saint-Omer / Dunkerque Département Génie Thermique et Énergie 1 re année Objectifs du chapitre
La relève de chaudière, une solution intermédiaire économique et fiable.
 111 39 240 1812 906 La relève de chaudière, une solution intermédiaire économique et fiable. La relève de chaudière, qu est ce que c est? On parle de relève de chaudière lorsqu on installe une pompe à
111 39 240 1812 906 La relève de chaudière, une solution intermédiaire économique et fiable. La relève de chaudière, qu est ce que c est? On parle de relève de chaudière lorsqu on installe une pompe à
Continuité et dérivabilité d une fonction
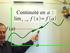 DERNIÈRE IMPRESSIN LE 7 novembre 014 à 10:3 Continuité et dérivabilité d une fonction Table des matières 1 Continuité d une fonction 1.1 Limite finie en un point.......................... 1. Continuité
DERNIÈRE IMPRESSIN LE 7 novembre 014 à 10:3 Continuité et dérivabilité d une fonction Table des matières 1 Continuité d une fonction 1.1 Limite finie en un point.......................... 1. Continuité
Transformations nucléaires
 I Introduction Activité p286 du livre Transformations nucléaires II Les transformations nucléaires II.a Définition La désintégration radioactive d un noyau est une transformation nucléaire particulière
I Introduction Activité p286 du livre Transformations nucléaires II Les transformations nucléaires II.a Définition La désintégration radioactive d un noyau est une transformation nucléaire particulière
Le triac en commutation : Commande des relais statiques : Princ ipe électronique
 LES RELAIS STATIQUES (SOLID STATE RELAY : SSR) Princ ipe électronique Les relais statiques sont des contacteurs qui se ferment électroniquement, par une simple commande en appliquant une tension continue
LES RELAIS STATIQUES (SOLID STATE RELAY : SSR) Princ ipe électronique Les relais statiques sont des contacteurs qui se ferment électroniquement, par une simple commande en appliquant une tension continue
METEOROLOGIE CAEA 1990
 METEOROLOGIE CAEA 1990 1) Les météorologistes mesurent et prévoient le vent en attitude à des niveaux exprimés en pressions atmosphériques. Entre le niveau de la mer et 6000 m d'altitude, quels sont les
METEOROLOGIE CAEA 1990 1) Les météorologistes mesurent et prévoient le vent en attitude à des niveaux exprimés en pressions atmosphériques. Entre le niveau de la mer et 6000 m d'altitude, quels sont les
C 248-02. Nias Dual. Chaudières murales à tirage forcé, foyer étanche et ballon eau chaude sanitaire. chaleur à vivre. Nord Africa
 C 248-02 made in Italy Nias Dual Chaudières murales à tirage forcé, foyer étanche et ballon eau chaude sanitaire chaleur à vivre FR Nord Africa Chaudières murales à tirage forcé, foyer étanche et ballon
C 248-02 made in Italy Nias Dual Chaudières murales à tirage forcé, foyer étanche et ballon eau chaude sanitaire chaleur à vivre FR Nord Africa Chaudières murales à tirage forcé, foyer étanche et ballon
PHYSIQUE-CHIMIE. Partie I - Propriétés de l atome
 PHYSIQUE-CHIMIE Ce sujet traite de quelques propriétés de l aluminium et de leurs applications. Certaines données fondamentales sont regroupées à la fin du texte. Partie I - Propriétés de l atome I.A -
PHYSIQUE-CHIMIE Ce sujet traite de quelques propriétés de l aluminium et de leurs applications. Certaines données fondamentales sont regroupées à la fin du texte. Partie I - Propriétés de l atome I.A -
