Premier principe : bilans d énergie
|
|
|
- Francine Beaudoin
- il y a 10 ans
- Total affichages :
Transcription
1 MPSI - Thermodynamique - Premier principe : bilans d énergie page 1/5 Premier principe : bilans d énergie Table des matières 1 De la mécanique à la thermodynamique : formes d énergie et échanges d énergie Système fermé et isolé Non conservation de l énergie mécanique Le point de vue de la thermo Échanges d énergie Résumé Le premier principe Énoncé Commentaires Un exemple de travail : le travail des forces de pression Pression extérieure et pression dans le fluide Travail des forces de pression au cours d une évolution élémentaire Travail au cours d une évolution non élémentaire Quelques travaux classiques Exemple : la détente de Joule - Gay Lussac Une nouvelle fonction d état : l enthalpie Définition Capacité thermique à pression constante Enthalpie et capacité thermique de quelques fluides modèles GPM Gaz parfait Fluides réels Phases condensées Calorimétrie Exemple : la détente de Joule-Kelvin De la mécanique à la thermodynamique : formes d énergie et échanges d énergie 1.1 Système fermé et isolé Toute la thermodynamique est construite sur deux principes; la validité d un principe repose sur la cohérence et l exactitude des conséquences que l on en tire Le premier principe affirme que l énergie est une grandeur conservative c est à dire que l énergie d un système fermé et isolé est constante, elle ne peut-être ni créée, ni détruite Un système fermé n échange pas de matière avec l extérieur Un système isolé n échange pas d énergie avec l extérieur 1.2 Non conservation de l énergie mécanique Considérons un pendule élastique constitué d une masse m fixée à un ressort vertical de raideur k, le tout enfermé dans une enceinte en verre remplie d air sous faible pression; on étudie le système {pendule+air} fermé et isolé Dans l état initial, le ressort est comprimé de a et l air est au repos E I = 1 2 ka2 + mga On abandonne la masse sans vitesse initiale, la masse effectue des oscillations amorties Dans l état final, le pendule et l air sont au repos E F = 0 Cette dissipation d énergie mécanique est associée à l existence de forces de frottements non conservatives décrivant à l échelle macroscopique les interactions pendule et air E F E I = W nc = W f
2 MPSI - Thermodynamique - Premier principe : bilans d énergie page 2/5 1.3 Le point de vue de la thermo En mesurant la température de l air T F > T I. La pression étant faible, on peut utiliser le modèle du GP U F > U I Il y a donc conversion d énergie mécanique en énergie interne via les chocs des molécules d air sur le pendule; des mesures précises montreraient que cette conversion est parfaite L énergie mécanique n a pas disparue, elle a pris une autre forme C est donc la somme E + U qui est une grandeur conservative; si E diminue U augmente et inversement 1.4 Échanges d énergie E + U = 0 Considérons de l air dans un cylindre fermé par un piston mobile; un thermomètre permet de mesurer la température de l air Lorsque V diminue T augmente et donc U augmente or E = 0 puisque l air est au repos dans l état initial et dans l état final L augmentation de U n est pas due à une diminution de E ; le système n étant pas isolé, il a reçu de l énergie de la part du piston; un tel transfert est familier en mécanique, il s agit du travail W des forces de pression lors du déplacement de leur point d application Si maintenant nous bloquons le piston et que nous plaçons le récipient dans un bain d eau chaude T et U augmente L air a donc reçu de l énergie sans que les forces de pression aient travaillé puisque leurs points d application ne sont pas déplacés; un tel transfert est appelé chaleur ou mieux transfert thermique On dit que l évolution d un système est adiabatique si le système n échange pas de chaleur avec l extérieur; on dit aussi dans ce cas que le système est calorifugé ou encore thermiquement isolé 1.5 Résumé En résumé, le passage du point de vue de la méca au point de vue de la thermo conduit à distinguer : - deux formes d énergie, l énergie mécanique et l énergie interne - deux formes d échanges d énergie, le travail et le transfert thermique mécanique macroscopique microscopique perception par un observateur perceptible dissimulé énergie énergie mécanique E énergie interne U transfert d énergie travail W transfert thermique Q 2 Le premier principe 2.1 Énoncé i) L énergie interne U est extensive c est à dire additive pour toute partition d un système (Σ) en deux sous-systèmes disjoints (Σ 1 ) et (Σ 2 ) U Σ = U Σ1 + U Σ2 ii) soit un système fermé (Σ) évoluant entre deux états (I) et (F) en recevant algébriquement de l extérieur un travail W et un transfert thermique Q ; soit E = E F E I et U = U F U I les variations d énergie mécanique et d énergie interne au cours de l évolution, le bilan d énergie du système (Σ) s écrit E + U = W + Q iii) l énergie interne U est une fonction d état : dans un état d équilibre thermodynamique, elle ne dépend que d un petit nombre de paramètres d état caractérisant le système
3 MPSI - Thermodynamique - Premier principe : bilans d énergie page 3/5 2.2 Commentaires Pour un système fermé (on peut appliquer le premier principe) et isolé (W = 0 et Q = 0) E + U = 0 La somme E + U est une grandeur conservative Très souvent, E est nulle ou négligeable U = W + Q Nous savons calculer U entre deux états d équilibre thermodynamique (1er chapitre) et nous savons en général calculer W ; le premier principe permet donc de calculer Q Q = U W La somme W +Q égale à U ne dépend pas du chemin suivi; comme W dépend en général du chemin suivi, Q aussi; pour une évolution infinitésimale du = δw + δq Il résulte immédiatement du premier principe qu un travail ou un transfert thermique positif contribue à augmenter l énergie d un système fermé; dans ce cas W ou Q sont effectivement reçu par le système, cédé par le système dans le cas négatif 2.3 Un exemple de travail : le travail des forces de pression Pression extérieure et pression dans le fluide Considérons un fluide contenu dans un cylindre d axe Ox et de section S fermé par un piston mobile La pression p dans le fluide n est définie qu à l équilibre thermodynamique, en général uniquement dans l état initial et dans l état final On peut en revanche en général considérer que l atmosphère extérieure reste en équilibre thermodynamique à la pression constante et uniforme p 0 ; elle exerce donc sur le système (via le piston de masse négligeable que l on inclut dans le système, on néglige aussi les frottements) une force p 0 Se x avec p ext = p 0 pression extérieure F = p ext Se x Lorsque le système est en équilibre thermodynamique la pression dans le fluide est défini par la force qu il exerce sur le piston F = p Se x l équilibre mécanique du piston s écrit alors p = p ext Travail des forces de pression au cours d une évolution élémentaire Déplaçons le piston de dxe x Le système reçoit (algébriquement) le travail δw = F.dxe x = p ext Sdx Au cours du déplacement le volume du système varie de dv δw = p ext dv δw > 0, dv < 0 (compression) le travail est effectivement reçu, les forces subies par le fluide sont motrices δw < 0, dv > 0 (détente) le travail est effectivement cédé, les forces subies par le fluide sont résistantes Nous admettrons la généralisation de ce résultat à un récipient de forme quelconque soumis à une pression extérieure sur ses parties mobiles δw = p ext dv Travail au cours d une évolution non élémentaire Considérons l évolution d un fluide entre un état d équilibre (I) et un état d équilibre (F) soumis à une pression extérieure p ext constante et uniforme
4 MPSI - Thermodynamique - Premier principe : bilans d énergie page 4/5 Cette évolution peut-être décomposée en évolutions élémentaires au cours desquelles le volume varie de dv VF W = p ext dv Considérons une évolution suffisamment lente pour que tout état intermédiaire soit infiniment proche d un état d équilibre thermodynamique, la pression p du fluide est alors définie; on parle aussi d évolution quasi-statique; nous dirons en outre qu elle est mécaniquement réversible si p = p ext (ce qui est évident dans le cas particulier du piston mobile libre) p = p ext VF W = pdv La pression étant définie au cours de l évolution, on peut représenter p en fonction de V (diagramme de Watt) dans lequel l aire sous la courbe donne W ou p en fonction de v volume massique (diagramme de Clapeyron) Quelques travaux classiques Lors d une évolution isochore, V = cte W = 0 Lors d une évolution monobare, pression extérieure constante et uniforme W = p ext (V F ) Lors d une évolution quasi-statique, mécaniquement réversible et isobare, p = cte (attention : p = p ext mais p ext pas forcément constante) W = p(v F ) Lors d une évolution quasi-statique et isotherme d un GP, T = cte ( ) VF W = nrt ln 2.4 Exemple : la détente de Joule - Gay Lussac (voir TD) U = 0 T F = T I pour un GP, diminution de température sinon 3 Une nouvelle fonction d état : l enthalpie 3.1 Définition De nombreuses évolutions thermo ont lieu au contact de l atmosphère qui maintient une pression extérieure p ext constante; elles sont donc monobares p F = p I = p ext W = p ext(v F ) le premier principe appliqué au système fermé ce qui permet de calculer Q U F U I = W + Q Q = U F U I + p ext (V F ) = (U F + p F V F ) (U I + p I ) Q apparaît comme la variation d une nouvelle fonction H appelée enthalpie H = U + pv Au cours d une évolution monobare entre deux états d équilibre, le transfert thermique algébriquement reçu par un système fermé est égal à la variation d enthalpie du système Q = H Ce résultat s applique aussi a fortiori au cas d une évolution quasi-statique mécaniquement réversible et isobare Par construction, l enthalpie H ne dépend, comme U, que d un petit nombre de paramètres d état; c est une fonction d état
5 MPSI - Thermodynamique - Premier principe : bilans d énergie page 5/5 3.2 Capacité thermique à pression constante Expérimentalement, on accède plus facilement aux dérivées partielles de l enthalpie, plutôt qu à l enthalpie elle-même p T Nous utiliserons surtout la capacité thermique à pression constante C p = T p et T p on utilise aussi la capacité thermique massique à pression constante c p = C p m et la capacité thermique molaire à pression constante C pm = C p n 3.3 Enthalpie et capacité thermique de quelques fluides modèles GPM Gaz parfait H = U + pv = 3 2 nrt + nrt = 5 2 nrt C V = 3 2 nr C p = 5 2 nr H = U + pv = U + nrt L enthalpie H d un gaz parfait ne dépend que de la température et en faisant apparaître le coefficient γ = C p C V C p = nrγ γ 1 C V = nr γ 1 Par exemple pour un gaz parfait diatomique dans les conditions usuelles de température C V 5 2 nr C p 7 2 nr γ 7 5 = 1, 4 ces valeurs sont souvent utilisées pour l air Fluides réels Aucun résultat général pour les gaz réels Phases condensées Pour ce qui est des phases condensées (solides ou liquides) leur volume est suffisamment faible pour qu on puisse souvent en première approximation négliger pv devant U H U C p C V C 3.4 Calorimétrie (voir TD) 3.5 Exemple : la détente de Joule-Kelvin (voir TD) La détente de Joule-Kelvin est isenthalpique H = 0 On dit d un fluide possédant cette propriété qu il vérifie la deuxième loi de Joule on en déduit la relation de Mayer C p C V = nr
Premier principe de la thermodynamique - conservation de l énergie
 Chapitre 5 Premier principe de la thermodynamique - conservation de l énergie 5.1 Bilan d énergie 5.1.1 Énergie totale d un système fermé L énergie totale E T d un système thermodynamique fermé de masse
Chapitre 5 Premier principe de la thermodynamique - conservation de l énergie 5.1 Bilan d énergie 5.1.1 Énergie totale d un système fermé L énergie totale E T d un système thermodynamique fermé de masse
Chapitre 4 Le deuxième principe de la thermodynamique
 Chapitre 4 Le deuxième principe de la thermodynamique 43 4.1. Evolutions réversibles et irréversibles 4.1.1. Exemples 4.1.1.1. Exemple 1 Reprenons l exemple 1 du chapitre précédent. Une masse est placée
Chapitre 4 Le deuxième principe de la thermodynamique 43 4.1. Evolutions réversibles et irréversibles 4.1.1. Exemples 4.1.1.1. Exemple 1 Reprenons l exemple 1 du chapitre précédent. Une masse est placée
Physique : Thermodynamique
 Correction du Devoir urveillé n o 8 Physique : hermodynamique I Cycle moteur [Véto 200] Cf Cours : C P m C V m R relation de Mayer, pour un GP. C P m γr γ 29, 0 J.K.mol et C V m R γ 20, 78 J.K.mol. 2 Une
Correction du Devoir urveillé n o 8 Physique : hermodynamique I Cycle moteur [Véto 200] Cf Cours : C P m C V m R relation de Mayer, pour un GP. C P m γr γ 29, 0 J.K.mol et C V m R γ 20, 78 J.K.mol. 2 Une
Exercice 1. Exercice n 1 : Déséquilibre mécanique
 Exercice 1 1. a) Un mobile peut-il avoir une accélération non nulle à un instant où sa vitesse est nulle? donner un exemple illustrant la réponse. b) Un mobile peut-il avoir une accélération de direction
Exercice 1 1. a) Un mobile peut-il avoir une accélération non nulle à un instant où sa vitesse est nulle? donner un exemple illustrant la réponse. b) Un mobile peut-il avoir une accélération de direction
1 Thermodynamique: première loi
 1 hermodynamique: première loi 1.1 Énoncé L énergie d un système isolé est constante, L énergie de l univers est constante, de univers = de syst + de env. = 0 1 L énergie d un système est une fonction
1 hermodynamique: première loi 1.1 Énoncé L énergie d un système isolé est constante, L énergie de l univers est constante, de univers = de syst + de env. = 0 1 L énergie d un système est une fonction
Chapitre 3 LES GAZ PARFAITS : EXEMPLES DE CALCULS DE GRANDEURS THERMODYNAMIQUES
 Chapitre 3 LES GAZ PARFAITS : EXEMPLES DE CALCULS DE GRANDEURS THERMODYNAMIQUES Entropie de mélange. - Evolution adiabatique. - Autres évolutions réversibles et irréversibles. L ensemble de ce chapitre
Chapitre 3 LES GAZ PARFAITS : EXEMPLES DE CALCULS DE GRANDEURS THERMODYNAMIQUES Entropie de mélange. - Evolution adiabatique. - Autres évolutions réversibles et irréversibles. L ensemble de ce chapitre
Contenu pédagogique des unités d enseignement Semestre 1(1 ère année) Domaine : Sciences et techniques et Sciences de la matière
 Contenu pédagogique des unités d enseignement Semestre 1(1 ère année) Domaine : Sciences et techniques et Sciences de la matière Algèbre 1 : (Volume horaire total : 63 heures) UE1 : Analyse et algèbre
Contenu pédagogique des unités d enseignement Semestre 1(1 ère année) Domaine : Sciences et techniques et Sciences de la matière Algèbre 1 : (Volume horaire total : 63 heures) UE1 : Analyse et algèbre
Optimisation des systèmes énergétiques Master 1 : GSI Génie Energétique et Thermique
 Optimisation des systèmes énergétiques Master 1 : GSI Génie Energétique et Thermique Année 2009-2010 2008-09 Stéphane LE PERSON Maître de Conférences Université Joseph Fourier Jean-Paul THIBAULT LEGI UMR
Optimisation des systèmes énergétiques Master 1 : GSI Génie Energétique et Thermique Année 2009-2010 2008-09 Stéphane LE PERSON Maître de Conférences Université Joseph Fourier Jean-Paul THIBAULT LEGI UMR
COURS DE THERMODYNAMIQUE
 I.U.T. de Saint-Omer Dunkerque Département Génie Thermique et énergie COURS DE THERMODYNAMIQUE eme Semestre Olivier PERROT 010-011 1 Avertissement : Ce cours de thermodynamique présente quelques applications
I.U.T. de Saint-Omer Dunkerque Département Génie Thermique et énergie COURS DE THERMODYNAMIQUE eme Semestre Olivier PERROT 010-011 1 Avertissement : Ce cours de thermodynamique présente quelques applications
BREVET DE TECHNICIEN SUPÉRIEUR AGRICOLE SUJET
 SESSION 2010 France métropolitaine BREVET DE TECHNICIEN SUPÉRIEUR AGRICOLE ÉPREUVE N 2 DU PREMIER GROUPE ÉPREUVE SCIENTIFIQUE ET TECHNIQUE Option : Génie des équipements agricoles Durée : 3 heures 30 Matériel
SESSION 2010 France métropolitaine BREVET DE TECHNICIEN SUPÉRIEUR AGRICOLE ÉPREUVE N 2 DU PREMIER GROUPE ÉPREUVE SCIENTIFIQUE ET TECHNIQUE Option : Génie des équipements agricoles Durée : 3 heures 30 Matériel
Chapitre 11 Bilans thermiques
 DERNIÈRE IMPRESSION LE 30 août 2013 à 15:40 Chapitre 11 Bilans thermiques Table des matières 1 L état macroscopique et microcospique de la matière 2 2 Énergie interne d un système 2 2.1 Définition.................................
DERNIÈRE IMPRESSION LE 30 août 2013 à 15:40 Chapitre 11 Bilans thermiques Table des matières 1 L état macroscopique et microcospique de la matière 2 2 Énergie interne d un système 2 2.1 Définition.................................
À propos d ITER. 1- Principe de la fusion thermonucléaire
 À propos d ITER Le projet ITER est un projet international destiné à montrer la faisabilité scientifique et technique de la fusion thermonucléaire contrôlée. Le 8 juin 005, les pays engagés dans le projet
À propos d ITER Le projet ITER est un projet international destiné à montrer la faisabilité scientifique et technique de la fusion thermonucléaire contrôlée. Le 8 juin 005, les pays engagés dans le projet
THERMODYNAMIQUE: LIQUEFACTION D UN GAZ
 THERMODYNAMIQUE: LIQUEFACTION D UN GAZ B. AMANA et J.-L. LEMAIRE 2 LIQUEFACTION D'UN GAZ Cette expérience permet d'étudier la compressibilité et la liquéfaction d'un fluide en fonction des variables P,
THERMODYNAMIQUE: LIQUEFACTION D UN GAZ B. AMANA et J.-L. LEMAIRE 2 LIQUEFACTION D'UN GAZ Cette expérience permet d'étudier la compressibilité et la liquéfaction d'un fluide en fonction des variables P,
Initiation à la Mécanique des Fluides. Mr. Zoubir HAMIDI
 Initiation à la Mécanique des Fluides Mr. Zoubir HAMIDI Chapitre I : Introduction à la mécanique des fluides 1 Introduction La mécanique des fluides(mdf) a pour objet l étude du comportement des fluides
Initiation à la Mécanique des Fluides Mr. Zoubir HAMIDI Chapitre I : Introduction à la mécanique des fluides 1 Introduction La mécanique des fluides(mdf) a pour objet l étude du comportement des fluides
Chapitre 5. Le ressort. F ext. F ressort
 Chapitre 5 Le ressort Le ressort est un élément fondamental de plusieurs mécanismes. Il existe plusieurs types de ressorts (à boudin, à lame, spiral etc.) Que l on comprime ou étire un ressort, tel que
Chapitre 5 Le ressort Le ressort est un élément fondamental de plusieurs mécanismes. Il existe plusieurs types de ressorts (à boudin, à lame, spiral etc.) Que l on comprime ou étire un ressort, tel que
1 Mise en application
 Université Paris 7 - Denis Diderot 2013-2014 TD : Corrigé TD1 - partie 2 1 Mise en application Exercice 1 corrigé Exercice 2 corrigé - Vibration d une goutte La fréquence de vibration d une goutte d eau
Université Paris 7 - Denis Diderot 2013-2014 TD : Corrigé TD1 - partie 2 1 Mise en application Exercice 1 corrigé Exercice 2 corrigé - Vibration d une goutte La fréquence de vibration d une goutte d eau
Trépier avec règle, ressort à boudin, chronomètre, 5 masses de 50 g.
 PHYSQ 130: Hooke 1 LOI DE HOOKE: CAS DU RESSORT 1 Introduction La loi de Hooke est fondamentale dans l étude du mouvement oscillatoire. Elle est utilisée, entre autres, dans les théories décrivant les
PHYSQ 130: Hooke 1 LOI DE HOOKE: CAS DU RESSORT 1 Introduction La loi de Hooke est fondamentale dans l étude du mouvement oscillatoire. Elle est utilisée, entre autres, dans les théories décrivant les
AIDE-MÉMOIRE LA THERMOCHIMIE TABLE DES MATIERES
 Collège Voltaire, 2014-2015 AIDE-MÉMOIRE LA THERMOCHIMIE http://dcpe.net/poii/sites/default/files/cours%20et%20ex/cours-ch2-thermo.pdf TABLE DES MATIERES 3.A. Introduction...2 3.B. Chaleur...3 3.C. Variation
Collège Voltaire, 2014-2015 AIDE-MÉMOIRE LA THERMOCHIMIE http://dcpe.net/poii/sites/default/files/cours%20et%20ex/cours-ch2-thermo.pdf TABLE DES MATIERES 3.A. Introduction...2 3.B. Chaleur...3 3.C. Variation
U-31 CHIMIE-PHYSIQUE INDUSTRIELLES
 Session 200 BREVET de TECHNICIEN SUPÉRIEUR CONTRÔLE INDUSTRIEL et RÉGULATION AUTOMATIQUE E-3 SCIENCES PHYSIQUES U-3 CHIMIE-PHYSIQUE INDUSTRIELLES Durée : 2 heures Coefficient : 2,5 Durée conseillée Chimie
Session 200 BREVET de TECHNICIEN SUPÉRIEUR CONTRÔLE INDUSTRIEL et RÉGULATION AUTOMATIQUE E-3 SCIENCES PHYSIQUES U-3 CHIMIE-PHYSIQUE INDUSTRIELLES Durée : 2 heures Coefficient : 2,5 Durée conseillée Chimie
Mesures du coefficient adiabatique γ de l air
 Mesures du oeffiient adiabatique γ de l air Introdution : γ est le rapport des apaités alorifiques massiques d un gaz : γ = p v Le gaz étudié est l air. La mesure de la haleur massique à pression onstante
Mesures du oeffiient adiabatique γ de l air Introdution : γ est le rapport des apaités alorifiques massiques d un gaz : γ = p v Le gaz étudié est l air. La mesure de la haleur massique à pression onstante
Système formé de deux points
 MPSI - 2005/2006 - Mécanique II - Système formé de deux points matériels page /5 Système formé de deux points matériels Table des matières Éléments cinétiques. Éléments cinétiques dans R.......................2
MPSI - 2005/2006 - Mécanique II - Système formé de deux points matériels page /5 Système formé de deux points matériels Table des matières Éléments cinétiques. Éléments cinétiques dans R.......................2
PHYSIQUE Discipline fondamentale
 Examen suisse de maturité Directives 2003-2006 DS.11 Physique DF PHYSIQUE Discipline fondamentale Par l'étude de la physique en discipline fondamentale, le candidat comprend des phénomènes naturels et
Examen suisse de maturité Directives 2003-2006 DS.11 Physique DF PHYSIQUE Discipline fondamentale Par l'étude de la physique en discipline fondamentale, le candidat comprend des phénomènes naturels et
Etudier le diagramme température-pression, en particulier le point triple de l azote.
 K4. Point triple de l azote I. BUT DE LA MANIPULATION Etudier le diagramme température-pression, en particulier le point triple de l azote. II. BASES THEORIQUES Etats de la matière La matière est constituée
K4. Point triple de l azote I. BUT DE LA MANIPULATION Etudier le diagramme température-pression, en particulier le point triple de l azote. II. BASES THEORIQUES Etats de la matière La matière est constituée
DYNAMIQUE DE FORMATION DES ÉTOILES
 A 99 PHYS. II ÉCOLE NATIONALE DES PONTS ET CHAUSSÉES, ÉCOLES NATIONALES SUPÉRIEURES DE L'AÉRONAUTIQUE ET DE L'ESPACE, DE TECHNIQUES AVANCÉES, DES TÉLÉCOMMUNICATIONS, DES MINES DE PARIS, DES MINES DE SAINT-ÉTIENNE,
A 99 PHYS. II ÉCOLE NATIONALE DES PONTS ET CHAUSSÉES, ÉCOLES NATIONALES SUPÉRIEURES DE L'AÉRONAUTIQUE ET DE L'ESPACE, DE TECHNIQUES AVANCÉES, DES TÉLÉCOMMUNICATIONS, DES MINES DE PARIS, DES MINES DE SAINT-ÉTIENNE,
L énergie sous toutes ses formes : définitions
 L énergie sous toutes ses formes : définitions primaire, énergie secondaire, utile ou finale. Quelles sont les formes et les déclinaisons de l énergie? D après le dictionnaire de l Académie française,
L énergie sous toutes ses formes : définitions primaire, énergie secondaire, utile ou finale. Quelles sont les formes et les déclinaisons de l énergie? D après le dictionnaire de l Académie française,
Précis de thermodynamique
 M. Hubert N. Vandewalle Précis de thermodynamique Année académique 2013-2014 PHYS2010-1 Thermodynamique 2 Ce précis a été créé dans le but d offrir à l étudiant une base solide pour l apprentissage de
M. Hubert N. Vandewalle Précis de thermodynamique Année académique 2013-2014 PHYS2010-1 Thermodynamique 2 Ce précis a été créé dans le but d offrir à l étudiant une base solide pour l apprentissage de
CHAÎNES ÉNERGÉTIQUES I CHAÎNES ÉNERGÉTIQUES. II PUISSANCE ET ÉNERGIE
 CHAÎNES ÉNERGÉTIQUES I CHAÎNES ÉNERGÉTIQUES. II PUISSANCE ET ÉNERGIE I Chaine énergétique a- Les différentes formes d énergie L énergie se mesure en Joules, elle peut prendre différentes formes : chimique,
CHAÎNES ÉNERGÉTIQUES I CHAÎNES ÉNERGÉTIQUES. II PUISSANCE ET ÉNERGIE I Chaine énergétique a- Les différentes formes d énergie L énergie se mesure en Joules, elle peut prendre différentes formes : chimique,
Physique 1 TEMPÉRATURE, CHALEUR
 hysique EMÉRAURE, CHALEUR rof. André errenoud Edition mai 8 Andre.errenoud (at) heig-vd.ch HEIG-D / AD A B L E D E S M A I E R E S AGE. INRODUCION.... NOIONS DE EMÉRAURE E DE CHALEUR.... LES ÉCHANGES
hysique EMÉRAURE, CHALEUR rof. André errenoud Edition mai 8 Andre.errenoud (at) heig-vd.ch HEIG-D / AD A B L E D E S M A I E R E S AGE. INRODUCION.... NOIONS DE EMÉRAURE E DE CHALEUR.... LES ÉCHANGES
Stockage de chaleur solaire par sorption : Analyse et contrôle du système à partir de sa simulation dynamique
 Stockage de chaleur solaire par sorption : Analyse et contrôle du système à partir de sa simulation dynamique Kokouvi Edem N TSOUKPOE 1, Nolwenn LE PIERRÈS 1*, Lingai LUO 1 1 LOCIE, CNRS FRE3220-Université
Stockage de chaleur solaire par sorption : Analyse et contrôle du système à partir de sa simulation dynamique Kokouvi Edem N TSOUKPOE 1, Nolwenn LE PIERRÈS 1*, Lingai LUO 1 1 LOCIE, CNRS FRE3220-Université
Cours d électricité. Circuits électriques en courant constant. Mathieu Bardoux. 1 re année
 Cours d électricité Circuits électriques en courant constant Mathieu Bardoux [email protected] IUT Saint-Omer / Dunkerque Département Génie Thermique et Énergie 1 re année Objectifs du chapitre
Cours d électricité Circuits électriques en courant constant Mathieu Bardoux [email protected] IUT Saint-Omer / Dunkerque Département Génie Thermique et Énergie 1 re année Objectifs du chapitre
Oscillations libres des systèmes à deux degrés de liberté
 Chapitre 4 Oscillations libres des systèmes à deux degrés de liberté 4.1 Introduction Les systèmes qui nécessitent deux coordonnées indépendantes pour spécifier leurs positions sont appelés systèmes à
Chapitre 4 Oscillations libres des systèmes à deux degrés de liberté 4.1 Introduction Les systèmes qui nécessitent deux coordonnées indépendantes pour spécifier leurs positions sont appelés systèmes à
Erratum de MÉCANIQUE, 6ème édition. Introduction Page xxi (milieu de page) G = 6, 672 59 10 11 m 3 kg 1 s 2
 Introduction Page xxi (milieu de page) G = 6, 672 59 1 11 m 3 kg 1 s 2 Erratum de MÉCANIQUE, 6ème édition Page xxv (dernier tiers de page) le terme de Coriolis est supérieur à 1% du poids) Chapitre 1 Page
Introduction Page xxi (milieu de page) G = 6, 672 59 1 11 m 3 kg 1 s 2 Erratum de MÉCANIQUE, 6ème édition Page xxv (dernier tiers de page) le terme de Coriolis est supérieur à 1% du poids) Chapitre 1 Page
Chapitre XIV BASES PHYSIQUES QUANTITATIVES DES LOIS DE COMPORTEMENT MÉCANIQUE. par S. CANTOURNET 1 ELASTICITÉ
 Chapitre XIV BASES PHYSIQUES QUANTITATIVES DES LOIS DE COMPORTEMENT MÉCANIQUE par S. CANTOURNET 1 ELASTICITÉ Les propriétés mécaniques des métaux et alliages sont d un grand intérêt puisqu elles conditionnent
Chapitre XIV BASES PHYSIQUES QUANTITATIVES DES LOIS DE COMPORTEMENT MÉCANIQUE par S. CANTOURNET 1 ELASTICITÉ Les propriétés mécaniques des métaux et alliages sont d un grand intérêt puisqu elles conditionnent
TP 7 : oscillateur de torsion
 TP 7 : oscillateur de torsion Objectif : étude des oscillations libres et forcées d un pendule de torsion 1 Principe général 1.1 Définition Un pendule de torsion est constitué par un fil large (métallique)
TP 7 : oscillateur de torsion Objectif : étude des oscillations libres et forcées d un pendule de torsion 1 Principe général 1.1 Définition Un pendule de torsion est constitué par un fil large (métallique)
Fonctions de plusieurs variables
 Module : Analyse 03 Chapitre 00 : Fonctions de plusieurs variables Généralités et Rappels des notions topologiques dans : Qu est- ce que?: Mathématiquement, n étant un entier non nul, on définit comme
Module : Analyse 03 Chapitre 00 : Fonctions de plusieurs variables Généralités et Rappels des notions topologiques dans : Qu est- ce que?: Mathématiquement, n étant un entier non nul, on définit comme
NOTICE DOUBLE DIPLÔME
 NOTICE DOUBLE DIPLÔME MINES ParisTech / HEC MINES ParisTech/ AgroParisTech Diplômes obtenus : Diplôme d ingénieur de l Ecole des Mines de Paris Diplôme de HEC Paris Ou Diplôme d ingénieur de l Ecole des
NOTICE DOUBLE DIPLÔME MINES ParisTech / HEC MINES ParisTech/ AgroParisTech Diplômes obtenus : Diplôme d ingénieur de l Ecole des Mines de Paris Diplôme de HEC Paris Ou Diplôme d ingénieur de l Ecole des
COURS DE MACHINES FRIGORIFIQUES
 I.U.. de Saint-Omer Dunkerque Département Génie hermique et énergie COURS DE MACHINES FRIGORIFIQUES Olivier ERRO 200-20 2 Avertissement : Ce cours de machines frigorifiques propose d aborder le principe
I.U.. de Saint-Omer Dunkerque Département Génie hermique et énergie COURS DE MACHINES FRIGORIFIQUES Olivier ERRO 200-20 2 Avertissement : Ce cours de machines frigorifiques propose d aborder le principe
LA MESURE DE LA PRESSION
 LA MESURE DE LA PRESSION La mesure de la pression s effectue à l aide d un baromètre. Il s agit d un instrument permettant de repérer la pression de l atmosphère dans laquelle il se trouve et ses variations
LA MESURE DE LA PRESSION La mesure de la pression s effectue à l aide d un baromètre. Il s agit d un instrument permettant de repérer la pression de l atmosphère dans laquelle il se trouve et ses variations
PHYSIQUE-CHIMIE. Partie I - Propriétés de l atome
 PHYSIQUE-CHIMIE Ce sujet traite de quelques propriétés de l aluminium et de leurs applications. Certaines données fondamentales sont regroupées à la fin du texte. Partie I - Propriétés de l atome I.A -
PHYSIQUE-CHIMIE Ce sujet traite de quelques propriétés de l aluminium et de leurs applications. Certaines données fondamentales sont regroupées à la fin du texte. Partie I - Propriétés de l atome I.A -
ÉJECTEURS. CanmetÉNERGIE Juillet 2009
 ÉJECTEURS CanmetÉNERGIE Juillet 2009 ÉJECTEURS 1 ÉJECTEURS INTRODUCTION Les éjecteurs sont activés par la chaleur perdue ou la chaleur provenant de sources renouvelables. Ils sont actionnés directement
ÉJECTEURS CanmetÉNERGIE Juillet 2009 ÉJECTEURS 1 ÉJECTEURS INTRODUCTION Les éjecteurs sont activés par la chaleur perdue ou la chaleur provenant de sources renouvelables. Ils sont actionnés directement
LA PUISSANCE DES MOTEURS. Avez-vous déjà feuilleté le catalogue d un grand constructeur automobile?
 LA PUISSANCE DES MOTEURS Avez-vous déjà feuilleté le catalogue d un grand constructeur automobile? Chaque modèle y est décliné en plusieurs versions, les différences portant essentiellement sur la puissance
LA PUISSANCE DES MOTEURS Avez-vous déjà feuilleté le catalogue d un grand constructeur automobile? Chaque modèle y est décliné en plusieurs versions, les différences portant essentiellement sur la puissance
Exemples d utilisation de G2D à l oral de Centrale
 Exemples d utilisation de G2D à l oral de Centrale 1 Table des matières Page 1 : Binaire liquide-vapeur isotherme et isobare Page 2 : Page 3 : Page 4 : Page 5 : Page 6 : intéressant facile facile sauf
Exemples d utilisation de G2D à l oral de Centrale 1 Table des matières Page 1 : Binaire liquide-vapeur isotherme et isobare Page 2 : Page 3 : Page 4 : Page 5 : Page 6 : intéressant facile facile sauf
Fiche de lecture du projet de fin d étude
 GENIE CLIMATIQUE ET ENERGETIQUE Fiche de lecture du projet de fin d étude Analyse du phénomène de condensation sur l aluminium Par Marine SIRE Tuteurs : J.C. SICK Manager du Kawneer Innovation Center &
GENIE CLIMATIQUE ET ENERGETIQUE Fiche de lecture du projet de fin d étude Analyse du phénomène de condensation sur l aluminium Par Marine SIRE Tuteurs : J.C. SICK Manager du Kawneer Innovation Center &
MESURE DE LA TEMPERATURE
 145 T2 MESURE DE LA TEMPERATURE I. INTRODUCTION Dans la majorité des phénomènes physiques, la température joue un rôle prépondérant. Pour la mesurer, les moyens les plus couramment utilisés sont : les
145 T2 MESURE DE LA TEMPERATURE I. INTRODUCTION Dans la majorité des phénomènes physiques, la température joue un rôle prépondérant. Pour la mesurer, les moyens les plus couramment utilisés sont : les
CONCOURS COMMUN 2010 PHYSIQUE
 CONCOUS COMMUN SUJET A DES ÉCOLES DES MINES D ALBI, ALÈS, DOUAI, NANTES Épreuve de Physique-Chimie (toutes filières) Corrigé Barème total points : Physique points - Chimie 68 points PHYSIQUE Partie A :
CONCOUS COMMUN SUJET A DES ÉCOLES DES MINES D ALBI, ALÈS, DOUAI, NANTES Épreuve de Physique-Chimie (toutes filières) Corrigé Barème total points : Physique points - Chimie 68 points PHYSIQUE Partie A :
1 ère partie : tous CAP sauf hôtellerie et alimentation CHIMIE ETRE CAPABLE DE. PROGRAMME - Atomes : structure, étude de quelques exemples.
 Référentiel CAP Sciences Physiques Page 1/9 SCIENCES PHYSIQUES CERTIFICATS D APTITUDES PROFESSIONNELLES Le référentiel de sciences donne pour les différentes parties du programme de formation la liste
Référentiel CAP Sciences Physiques Page 1/9 SCIENCES PHYSIQUES CERTIFICATS D APTITUDES PROFESSIONNELLES Le référentiel de sciences donne pour les différentes parties du programme de formation la liste
La fonction exponentielle
 DERNIÈRE IMPRESSION LE 2 novembre 204 à :07 La fonction exponentielle Table des matières La fonction exponentielle 2. Définition et théorèmes.......................... 2.2 Approche graphique de la fonction
DERNIÈRE IMPRESSION LE 2 novembre 204 à :07 La fonction exponentielle Table des matières La fonction exponentielle 2. Définition et théorèmes.......................... 2.2 Approche graphique de la fonction
Plan du chapitre «Milieux diélectriques»
 Plan du chapitre «Milieux diélectriques» 1. Sources microscopiques de la polarisation en régime statique 2. Etude macroscopique de la polarisation en régime statique 3. Susceptibilité diélectrique 4. Polarisation
Plan du chapitre «Milieux diélectriques» 1. Sources microscopiques de la polarisation en régime statique 2. Etude macroscopique de la polarisation en régime statique 3. Susceptibilité diélectrique 4. Polarisation
MOTO ELECTRIQUE. CPGE / Sciences Industrielles pour l Ingénieur TD06_08 Moto électrique DIAGRAMME DES INTER-ACTEURS UTILISATEUR ENVIRONNEMENT HUMAIN
 MOTO ELECTRIQUE MISE EN SITUATION La moto électrique STRADA EVO 1 est fabriquée par une société SUISSE, située à LUGANO. Moyen de transport alternatif, peut-être la solution pour concilier contraintes
MOTO ELECTRIQUE MISE EN SITUATION La moto électrique STRADA EVO 1 est fabriquée par une société SUISSE, située à LUGANO. Moyen de transport alternatif, peut-être la solution pour concilier contraintes
Cours de Mécanique du point matériel
 Cours de Mécanique du point matériel SMPC1 Module 1 : Mécanique 1 Session : Automne 2014 Prof. M. EL BAZ Cours de Mécanique du Point matériel Chapitre 1 : Complément Mathématique SMPC1 Chapitre 1: Rappels
Cours de Mécanique du point matériel SMPC1 Module 1 : Mécanique 1 Session : Automne 2014 Prof. M. EL BAZ Cours de Mécanique du Point matériel Chapitre 1 : Complément Mathématique SMPC1 Chapitre 1: Rappels
Compte rendu de LA37 B, TP numéro 1. Evolution de la température et du degrée d'hydratation
 4 6 8 2 4 8 22 26 3 34 38 42 46 5 54 58 62 66 7 74 78 83 89 96 8 44 Bertin Morgan Compte rendu de LA37 B, TP numéro. Les essais effectués par le laboratoire des ponts et chaussés nous ont fournis la température
4 6 8 2 4 8 22 26 3 34 38 42 46 5 54 58 62 66 7 74 78 83 89 96 8 44 Bertin Morgan Compte rendu de LA37 B, TP numéro. Les essais effectués par le laboratoire des ponts et chaussés nous ont fournis la température
EES : Engineering Equation Solver Fiche récapitulative - Marie-Sophie Cabot
 EES : Engineering Equation Solver Fiche récapitulative - Marie-Sophie Cabot Permet la résolution de systèmes d équations algébriques, non linéaires Contient différentes bases de données thermodynamiques.
EES : Engineering Equation Solver Fiche récapitulative - Marie-Sophie Cabot Permet la résolution de systèmes d équations algébriques, non linéaires Contient différentes bases de données thermodynamiques.
Les correcteurs accorderont une importance particulière à la rigueur des raisonnements et aux représentations graphiques demandées.
 Les correcteurs accorderont une importance particulière à la rigueur des raisonnements et aux représentations graphiques demandées. 1 Ce sujet aborde le phénomène d instabilité dans des systèmes dynamiques
Les correcteurs accorderont une importance particulière à la rigueur des raisonnements et aux représentations graphiques demandées. 1 Ce sujet aborde le phénomène d instabilité dans des systèmes dynamiques
Programme Pédagogique National du DUT «Génie thermique et énergie»
 Programme Pédagogique National du DUT «Génie thermique et énergie» Présentation de la formation PPN Génie Thermique et Energie publié par arrêté du 1 er juillet 2010 1 PROGRAMME PEDAGOGIQUE NATIONAL ----------------
Programme Pédagogique National du DUT «Génie thermique et énergie» Présentation de la formation PPN Génie Thermique et Energie publié par arrêté du 1 er juillet 2010 1 PROGRAMME PEDAGOGIQUE NATIONAL ----------------
K W = [H 3 O + ] [OH - ] = 10-14 = K a K b à 25 C. [H 3 O + ] = [OH - ] = 10-7 M Solution neutre. [H 3 O + ] > [OH - ] Solution acide
![K W = [H 3 O + ] [OH - ] = 10-14 = K a K b à 25 C. [H 3 O + ] = [OH - ] = 10-7 M Solution neutre. [H 3 O + ] > [OH - ] Solution acide K W = [H 3 O + ] [OH - ] = 10-14 = K a K b à 25 C. [H 3 O + ] = [OH - ] = 10-7 M Solution neutre. [H 3 O + ] > [OH - ] Solution acide](/thumbs/20/420627.jpg) La constante d autoprotolyse de l eau, K W, est égale au produit de K a par K b pour un couple acide/base donné : En passant en échelle logarithmique, on voit donc que la somme du pk a et du pk b d un
La constante d autoprotolyse de l eau, K W, est égale au produit de K a par K b pour un couple acide/base donné : En passant en échelle logarithmique, on voit donc que la somme du pk a et du pk b d un
TD 9 Problème à deux corps
 PH1ME2-C Université Paris 7 - Denis Diderot 2012-2013 TD 9 Problème à deux corps 1. Systèmes de deux particules : centre de masse et particule relative. Application à l étude des étoiles doubles Une étoile
PH1ME2-C Université Paris 7 - Denis Diderot 2012-2013 TD 9 Problème à deux corps 1. Systèmes de deux particules : centre de masse et particule relative. Application à l étude des étoiles doubles Une étoile
Concours EPITA 2009 Epreuve de Sciences Industrielles pour l ingénieur La suspension anti-plongée de la motocyclette BMW K1200S
 Concours EPIT 2009 Epreuve de Sciences Industrielles pour l ingénieur La suspension anti-plongée de la motocyclette MW K1200S Durée : 2h. Calculatrices autorisées. Présentation du problème Le problème
Concours EPIT 2009 Epreuve de Sciences Industrielles pour l ingénieur La suspension anti-plongée de la motocyclette MW K1200S Durée : 2h. Calculatrices autorisées. Présentation du problème Le problème
T.I.P.E. Optimisation d un. moteur
 LEPLOMB Romain Année universitaire 2004-2005 LE ROI Gautier VERNIER Marine Groupe Sup B, C, D Professeur accompagnateur : M. Guerrier T.I.P.E Optimisation d un moteur 1 1. Présentation du fonctionnement
LEPLOMB Romain Année universitaire 2004-2005 LE ROI Gautier VERNIER Marine Groupe Sup B, C, D Professeur accompagnateur : M. Guerrier T.I.P.E Optimisation d un moteur 1 1. Présentation du fonctionnement
Économie d énergie dans les centrales frigorifiques : La haute pression flottante
 Économie d énergie dans les centrales frigorifiques : La haute pression flottante Juillet 2011/White paper par Christophe Borlein membre de l AFF et de l IIF-IIR Make the most of your energy Sommaire Avant-propos
Économie d énergie dans les centrales frigorifiques : La haute pression flottante Juillet 2011/White paper par Christophe Borlein membre de l AFF et de l IIF-IIR Make the most of your energy Sommaire Avant-propos
Continuité et dérivabilité d une fonction
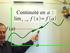 DERNIÈRE IMPRESSIN LE 7 novembre 014 à 10:3 Continuité et dérivabilité d une fonction Table des matières 1 Continuité d une fonction 1.1 Limite finie en un point.......................... 1. Continuité
DERNIÈRE IMPRESSIN LE 7 novembre 014 à 10:3 Continuité et dérivabilité d une fonction Table des matières 1 Continuité d une fonction 1.1 Limite finie en un point.......................... 1. Continuité
CHAPITRE IV Oscillations libres des systèmes à plusieurs degrés de liberté
 CHAPITE IV Oscillations ibres des Systèmes à plusieurs derés de liberté 010-011 CHAPITE IV Oscillations libres des systèmes à plusieurs derés de liberté Introduction : Dans ce chapitre, nous examinons
CHAPITE IV Oscillations ibres des Systèmes à plusieurs derés de liberté 010-011 CHAPITE IV Oscillations libres des systèmes à plusieurs derés de liberté Introduction : Dans ce chapitre, nous examinons
Mario Geiger octobre 08 ÉVAPORATION SOUS VIDE
 ÉVAPORATION SOUS VIDE 1 I SOMMAIRE I Sommaire... 2 II Évaporation sous vide... 3 III Description de l installation... 5 IV Travail pratique... 6 But du travail... 6 Principe... 6 Matériel... 6 Méthodes...
ÉVAPORATION SOUS VIDE 1 I SOMMAIRE I Sommaire... 2 II Évaporation sous vide... 3 III Description de l installation... 5 IV Travail pratique... 6 But du travail... 6 Principe... 6 Matériel... 6 Méthodes...
Mesures calorimétriques
 TP N 11 Mesures calorimétriques - page 51 - - T.P. N 11 - Ce document rassemble plusieurs mesures qui vont faire l'objet de quatre séances de travaux pratiques. La quasi totalité de ces manipulations utilisent
TP N 11 Mesures calorimétriques - page 51 - - T.P. N 11 - Ce document rassemble plusieurs mesures qui vont faire l'objet de quatre séances de travaux pratiques. La quasi totalité de ces manipulations utilisent
Chapitre 7 : CHARGES, COURANT, TENSION S 3 F
 Chapitre 7 : CHARGES, COURANT, TENSION S 3 F I) Electrostatique : 1) Les charges électriques : On étudie l électricité statique qui apparaît par frottement sur un barreau d ébonite puis sur un barreau
Chapitre 7 : CHARGES, COURANT, TENSION S 3 F I) Electrostatique : 1) Les charges électriques : On étudie l électricité statique qui apparaît par frottement sur un barreau d ébonite puis sur un barreau
Mesure du volume d'un gaz, à pression atmosphérique, en fonction de la température. Détermination expérimentale du zéro absolu.
 Mesure du volume d'un gaz, à pression atmosphérique, en fonction de la température. Détermination expérimentale du zéro absolu. Auteur : Dr. Wulfran FORTIN Professeur Agrégé de Sciences Physiques TZR -
Mesure du volume d'un gaz, à pression atmosphérique, en fonction de la température. Détermination expérimentale du zéro absolu. Auteur : Dr. Wulfran FORTIN Professeur Agrégé de Sciences Physiques TZR -
Contribution à la conception par la simulation en électronique de puissance : application à l onduleur basse tension
 Contribution à la conception par la simulation en électronique de puissance : application à l onduleur basse tension Cyril BUTTAY CEGELY VALEO 30 novembre 2004 Cyril BUTTAY Contribution à la conception
Contribution à la conception par la simulation en électronique de puissance : application à l onduleur basse tension Cyril BUTTAY CEGELY VALEO 30 novembre 2004 Cyril BUTTAY Contribution à la conception
1 Savoirs fondamentaux
 Révisions sur l oscillogramme, la puissance et l énergie électrique 1 Savoirs fondamentaux Exercice 1 : choix multiples 1. Quelle est l unité de la puissance dans le système international? Volt Watt Ampère
Révisions sur l oscillogramme, la puissance et l énergie électrique 1 Savoirs fondamentaux Exercice 1 : choix multiples 1. Quelle est l unité de la puissance dans le système international? Volt Watt Ampère
Le moteur de Stirling : Conception et Performances
 BOULANT Anthony VIVET Nicolas Licence Physique 2003 Université du Maine (le Mans) Le moteur de Stirling : Conception et Performances VIVET Nicolas et BOULANT Anthony, mis à jour le 12_01_2009 Table des
BOULANT Anthony VIVET Nicolas Licence Physique 2003 Université du Maine (le Mans) Le moteur de Stirling : Conception et Performances VIVET Nicolas et BOULANT Anthony, mis à jour le 12_01_2009 Table des
Exemples de dynamique sur base modale
 Dynamique sur base modale 1 Exemples de dynamique sur base modale L. CHAMPANEY et Ph. TROMPETTE Objectifs : Dynamique sur base modale réduite, Comparaison avec solution de référence, Influence des modes
Dynamique sur base modale 1 Exemples de dynamique sur base modale L. CHAMPANEY et Ph. TROMPETTE Objectifs : Dynamique sur base modale réduite, Comparaison avec solution de référence, Influence des modes
Physique - Résumés de cours PCSI. Harold Erbin
 Physique - Résumés de cours PCSI Harold Erbin Ce texte est publié sous la licence libre Licence Art Libre : http://artlibre.org/licence/lal/ Contact : [email protected] Version : 8 avril 2009 Table
Physique - Résumés de cours PCSI Harold Erbin Ce texte est publié sous la licence libre Licence Art Libre : http://artlibre.org/licence/lal/ Contact : [email protected] Version : 8 avril 2009 Table
OM 1 Outils mathématiques : fonction de plusieurs variables
 Outils mathématiques : fonction de plusieurs variables PCSI 2013 2014 Certaines partie de ce chapitre ne seront utiles qu à partir de l année prochaine, mais une grande partie nous servira dès cette année.
Outils mathématiques : fonction de plusieurs variables PCSI 2013 2014 Certaines partie de ce chapitre ne seront utiles qu à partir de l année prochaine, mais une grande partie nous servira dès cette année.
GENERALITES SUR LA MESURE DE TEMPERATURE
 Distributeur exclusif de GENERALITES SUR LA MESURE DE TEMPERATURE INTRODUCTION...2 GENERALITES SUR LA MESURE DE TEMPERATURE...2 La température...2 Unités de mesure de température...3 Echelle de température...3
Distributeur exclusif de GENERALITES SUR LA MESURE DE TEMPERATURE INTRODUCTION...2 GENERALITES SUR LA MESURE DE TEMPERATURE...2 La température...2 Unités de mesure de température...3 Echelle de température...3
Mesure de la dépense énergétique
 Mesure de la dépense énergétique Bioénergétique L énergie existe sous différentes formes : calorifique, mécanique, électrique, chimique, rayonnante, nucléaire. La bioénergétique est la branche de la biologie
Mesure de la dépense énergétique Bioénergétique L énergie existe sous différentes formes : calorifique, mécanique, électrique, chimique, rayonnante, nucléaire. La bioénergétique est la branche de la biologie
Chapitre 1 Régime transitoire dans les systèmes physiques
 Chapitre 1 Régime transitoire dans les systèmes physiques Savoir-faire théoriques (T) : Écrire l équation différentielle associée à un système physique ; Faire apparaître la constante de temps ; Tracer
Chapitre 1 Régime transitoire dans les systèmes physiques Savoir-faire théoriques (T) : Écrire l équation différentielle associée à un système physique ; Faire apparaître la constante de temps ; Tracer
CAPTEURS - CHAINES DE MESURES
 CAPTEURS - CHAINES DE MESURES Pierre BONNET Pierre Bonnet Master GSI - Capteurs Chaînes de Mesures 1 Plan du Cours Propriétés générales des capteurs Notion de mesure Notion de capteur: principes, classes,
CAPTEURS - CHAINES DE MESURES Pierre BONNET Pierre Bonnet Master GSI - Capteurs Chaînes de Mesures 1 Plan du Cours Propriétés générales des capteurs Notion de mesure Notion de capteur: principes, classes,
Chapitre 1: Facteurs d'échelle
 Chapitre 1: Facteurs d'échelle Des considérations générales sur la taille des objets ou des êtres vivants et leur influence sur différents paramètres, permettent d'établir simplement quelques lois ou tendances,
Chapitre 1: Facteurs d'échelle Des considérations générales sur la taille des objets ou des êtres vivants et leur influence sur différents paramètres, permettent d'établir simplement quelques lois ou tendances,
8 Ensemble grand-canonique
 Physique Statistique I, 007-008 8 Ensemble grand-canonique 8.1 Calcul de la densité de probabilité On adopte la même approche par laquelle on a établi la densité de probabilité de l ensemble canonique,
Physique Statistique I, 007-008 8 Ensemble grand-canonique 8.1 Calcul de la densité de probabilité On adopte la même approche par laquelle on a établi la densité de probabilité de l ensemble canonique,
Repérage d un point - Vitesse et
 PSI - écanique I - Repérage d un point - Vitesse et accélération page 1/6 Repérage d un point - Vitesse et accélération Table des matières 1 Espace et temps - Référentiel d observation 1 2 Coordonnées
PSI - écanique I - Repérage d un point - Vitesse et accélération page 1/6 Repérage d un point - Vitesse et accélération Table des matières 1 Espace et temps - Référentiel d observation 1 2 Coordonnées
Manuel de validation Fascicule v4.25 : Thermique transitoire des structures volumiques
 Titre : TTLV100 - Choc thermique dans un tuyau avec condit[...] Date : 02/03/2010 Page : 1/10 Manuel de Validation Fascicule V4.25 : Thermique transitoire des structures volumiques Document : V4.25.100
Titre : TTLV100 - Choc thermique dans un tuyau avec condit[...] Date : 02/03/2010 Page : 1/10 Manuel de Validation Fascicule V4.25 : Thermique transitoire des structures volumiques Document : V4.25.100
Thermodynamique (Échange thermique)
 Thermodynamique (Échange thermique) Introduction : Cette activité est mise en ligne sur le site du CNRMAO avec l autorisation de la société ERM Automatismes Industriels, détentrice des droits de publication
Thermodynamique (Échange thermique) Introduction : Cette activité est mise en ligne sur le site du CNRMAO avec l autorisation de la société ERM Automatismes Industriels, détentrice des droits de publication
ANALYSE SPECTRALE. monochromateur
 ht ANALYSE SPECTRALE Une espèce chimique est susceptible d interagir avec un rayonnement électromagnétique. L étude de l intensité du rayonnement (absorbé ou réémis) en fonction des longueurs d ode s appelle
ht ANALYSE SPECTRALE Une espèce chimique est susceptible d interagir avec un rayonnement électromagnétique. L étude de l intensité du rayonnement (absorbé ou réémis) en fonction des longueurs d ode s appelle
Cours de mécanique des fluides. Olivier LOUISNARD
 Cours de mécanique des fluides Olivier LOUISNARD 25 septembre 2012 Cette création est mise à disposition selon le Contrat Paternité-Pas d Utilisation Commerciale-Pas de Modification 2.0 France disponible
Cours de mécanique des fluides Olivier LOUISNARD 25 septembre 2012 Cette création est mise à disposition selon le Contrat Paternité-Pas d Utilisation Commerciale-Pas de Modification 2.0 France disponible
Chapitre 3 Les régimes de fonctionnement de quelques circuits linéaires
 Chapitre 3 Les régimes de fonctionnement de quelques circuits linéaires 25 Lechapitreprécédent avait pour objet l étude decircuitsrésistifsalimentéspar dessourcesde tension ou de courant continues. Par
Chapitre 3 Les régimes de fonctionnement de quelques circuits linéaires 25 Lechapitreprécédent avait pour objet l étude decircuitsrésistifsalimentéspar dessourcesde tension ou de courant continues. Par
Utilisation des 7 cartes d intensité jointes en annexe du règlement. A- Protection d une construction vis-à-vis des effets toxiques :
 ANNEXE 7 Utilisation des 7 cartes d intensité jointes en annexe du règlement A- Protection d une construction vis-à-vis des effets toxiques : 1 carte est fournie pour l effet toxique : Carte N 1 «Taux
ANNEXE 7 Utilisation des 7 cartes d intensité jointes en annexe du règlement A- Protection d une construction vis-à-vis des effets toxiques : 1 carte est fournie pour l effet toxique : Carte N 1 «Taux
Vis à billes de précision à filets rectifiés
 sommaire Calculs : - Capacités de charges / Durée de vie - Vitesse et charges moyennes 26 - Rendement / Puissance motrice - Vitesse critique / Flambage 27 - Précharge / Rigidité 28 Exemples de calcul 29
sommaire Calculs : - Capacités de charges / Durée de vie - Vitesse et charges moyennes 26 - Rendement / Puissance motrice - Vitesse critique / Flambage 27 - Précharge / Rigidité 28 Exemples de calcul 29
Variantes du cycle à compression de vapeur
 Variantes du cycle à compression de vapeur Froid indirect : circuit à frigoporteur Cycle mono étagé et alimentation par regorgement Cycle bi-étagé en cascade Froid direct et froid indirect Froid direct
Variantes du cycle à compression de vapeur Froid indirect : circuit à frigoporteur Cycle mono étagé et alimentation par regorgement Cycle bi-étagé en cascade Froid direct et froid indirect Froid direct
DES ÉCOLES DES MINES D ALBI, ALÈS, DOUAI, NANTES. Épreuve de Physique-Chimie. (toutes filières) Mardi 18 mai 2004 de 08h00 à 12h00
 CONCOURS COMMUN 004 DES ÉCOLES DES MINES D ALBI, ALÈS, DOUAI, NANTES Épreuve de Physique-Chimie (toutes filières) Mardi 18 mai 004 de 08h00 à 1h00 Barème indicatif : Physique environ /3 - Chimie environ
CONCOURS COMMUN 004 DES ÉCOLES DES MINES D ALBI, ALÈS, DOUAI, NANTES Épreuve de Physique-Chimie (toutes filières) Mardi 18 mai 004 de 08h00 à 1h00 Barème indicatif : Physique environ /3 - Chimie environ
Rupture et plasticité
 Rupture et plasticité Département de Mécanique, Ecole Polytechnique, 2009 2010 Département de Mécanique, Ecole Polytechnique, 2009 2010 25 novembre 2009 1 / 44 Rupture et plasticité : plan du cours Comportements
Rupture et plasticité Département de Mécanique, Ecole Polytechnique, 2009 2010 Département de Mécanique, Ecole Polytechnique, 2009 2010 25 novembre 2009 1 / 44 Rupture et plasticité : plan du cours Comportements
Technologie des contacteurs gaz liquide : cas des colonnes à plateaux et à garnissage. M. Prévost
 Technologie des contacteurs gaz liquide : cas des colonnes à plateaux et à garnissage M. Prévost Version V2/ nov 2006 Structure du cours Partie 1 : Introduction Partie 2 : Mise en contact de Gaz et de
Technologie des contacteurs gaz liquide : cas des colonnes à plateaux et à garnissage M. Prévost Version V2/ nov 2006 Structure du cours Partie 1 : Introduction Partie 2 : Mise en contact de Gaz et de
de faible capacité (inférieure ou égale à 75 litres) doivent être certifiés et porter la marque NF électricité performance.
 9.5. PRODUCTION D EAU CHAUDE sanitaire Les équipements doivent être dimensionnés au plus juste en fonction du projet et une étude de faisabilité doit être réalisée pour les bâtiments collectifs d habitation
9.5. PRODUCTION D EAU CHAUDE sanitaire Les équipements doivent être dimensionnés au plus juste en fonction du projet et une étude de faisabilité doit être réalisée pour les bâtiments collectifs d habitation
SCIENCES PHYSIQUES. Durée : 3 heures. L usage d une calculatrice est interdit pour cette épreuve. CHIMIE
 Banque «Agro-Véto» Technologie et Biologie AT - 0310 SCIECES PYSIQUES Durée : 3 heures L usage d une calculatrice est interdit pour cette épreuve. Si, au cours de l épreuve, un candidat repère ce qui lui
Banque «Agro-Véto» Technologie et Biologie AT - 0310 SCIECES PYSIQUES Durée : 3 heures L usage d une calculatrice est interdit pour cette épreuve. Si, au cours de l épreuve, un candidat repère ce qui lui
P M L R O G W. sylomer. Gamme de Sylomer Standard. Propriétés Méthode de test Commentaires. Polyuréthane (PUR) Cellulaire mixte
 Matière : Couleur : Polyuréthane (PUR) Cellulaire mixte Gris Recommandations d usage : Pression (dépend du facteur de forme) Déflexion Pression statique maximum :. N/mm ~ % Pression dyn. maximum :. N/mm
Matière : Couleur : Polyuréthane (PUR) Cellulaire mixte Gris Recommandations d usage : Pression (dépend du facteur de forme) Déflexion Pression statique maximum :. N/mm ~ % Pression dyn. maximum :. N/mm
Quantité de mouvement et moment cinétique
 6 Quantité de mouvement et moment cinétique v7 p = mv L = r p 1 Impulsion et quantité de mouvement Une force F agit sur un corps de masse m, pendant un temps Δt. La vitesse du corps varie de Δv = v f -
6 Quantité de mouvement et moment cinétique v7 p = mv L = r p 1 Impulsion et quantité de mouvement Une force F agit sur un corps de masse m, pendant un temps Δt. La vitesse du corps varie de Δv = v f -
Projet SETHER Appel à projets 2008. Adrien Patenôtre, POWEO [email protected]
 Projet SETHER Appel à projets 2008 Adrien Patenôtre, POWEO [email protected] SETHER STOCKAGE D ELECTRICITÉ SOUS FORME THERMIQUE À HAUTE TEMPÉRATURE Partenaires : POWEO, SAIPEM, CEA, CNAM, GEMH,
Projet SETHER Appel à projets 2008 Adrien Patenôtre, POWEO [email protected] SETHER STOCKAGE D ELECTRICITÉ SOUS FORME THERMIQUE À HAUTE TEMPÉRATURE Partenaires : POWEO, SAIPEM, CEA, CNAM, GEMH,
Chapitre 0 Introduction à la cinématique
 Chapitre 0 Introduction à la cinématique Plan Vitesse, accélération Coordonnées polaires Exercices corrigés Vitesse, Accélération La cinématique est l étude du mouvement Elle suppose donc l existence à
Chapitre 0 Introduction à la cinématique Plan Vitesse, accélération Coordonnées polaires Exercices corrigés Vitesse, Accélération La cinématique est l étude du mouvement Elle suppose donc l existence à
STI2D : Enseignements Technologiques Transversaux
 STI2D : Enseignements Technologiques Transversaux Activité : Etude des transfert énergétiques dans la cafetière Nespresso Problématique : On calcule la puissance électrique consommée, on détermine l énergie
STI2D : Enseignements Technologiques Transversaux Activité : Etude des transfert énergétiques dans la cafetière Nespresso Problématique : On calcule la puissance électrique consommée, on détermine l énergie
I - Quelques propriétés des étoiles à neutrons
 Formation Interuniversitaire de Physique Option de L3 Ecole Normale Supérieure de Paris Astrophysique Patrick Hennebelle François Levrier Sixième TD 14 avril 2015 Les étoiles dont la masse initiale est
Formation Interuniversitaire de Physique Option de L3 Ecole Normale Supérieure de Paris Astrophysique Patrick Hennebelle François Levrier Sixième TD 14 avril 2015 Les étoiles dont la masse initiale est
Mécanique. 1 Forces. 1.1 Rappel. 1.2 Mesurer des forces. 3BC - AL Mécanique 1
 3BC - AL Mécanique 1 Mécanique 1 Forces 1.1 Rappel Pour décrire les effets d une force, nous devons préciser toutes ses propriétés : son point d application ; sa droite d action, c est-à-dire sa direction
3BC - AL Mécanique 1 Mécanique 1 Forces 1.1 Rappel Pour décrire les effets d une force, nous devons préciser toutes ses propriétés : son point d application ; sa droite d action, c est-à-dire sa direction
Les puissances 4. 4.1. La notion de puissance. 4.1.1. La puissance c est l énergie pendant une seconde CHAPITRE
 4. LES PUISSANCES LA NOTION DE PUISSANCE 88 CHAPITRE 4 Rien ne se perd, rien ne se crée. Mais alors que consomme un appareil électrique si ce n est les électrons? La puissance pardi. Objectifs de ce chapitre
4. LES PUISSANCES LA NOTION DE PUISSANCE 88 CHAPITRE 4 Rien ne se perd, rien ne se crée. Mais alors que consomme un appareil électrique si ce n est les électrons? La puissance pardi. Objectifs de ce chapitre
Rappels sur les couples oxydantsréducteurs
 CHAPITRE 1 TRANSFORMATIONS LENTES ET RAPIDES 1 Rappels sur les couples oxydantsréducteurs 1. Oxydants et réducteurs Un réducteur est une espèce chimique capable de céder au moins un électron Demi-équation
CHAPITRE 1 TRANSFORMATIONS LENTES ET RAPIDES 1 Rappels sur les couples oxydantsréducteurs 1. Oxydants et réducteurs Un réducteur est une espèce chimique capable de céder au moins un électron Demi-équation
