DENOMINATION DU MEDICAMENT
|
|
|
- Lucie Fleury
- il y a 10 ans
- Total affichages :
Transcription
1 DENOMINATION DU MEDICAMENT Matrifen 12 microgrammes/heure, dispositif transdermique Matrifen 25 microgrammes/heure, dispositif transdermique Matrifen 50 microgrammes/heure, dispositif transdermique Matrifen 75 microgrammes/heure, dispositif transdermique Matrifen 100 microgrammes/heure, dispositif transdermique COMPOSITION QUALITATIVE ET QUANTITATIVE Matrifen 12 microgrammes/heure (mcg/h) : chaque dispositif transdermique contient 1,38 mg de fentanyl dans un dispositif de 4,2 cm 2 et libère 12 microgrammes/heure de fentanyl. Matrifen 25 microgrammes/heure (mcg/h) : chaque dispositif transdermique contient 2,75 mg de fentanyl dans un dispositif de 8,4 cm 2 et libère 25 microgrammes/heure de fentanyl. Matrifen 50 microgrammes/heure (mcg/h) : chaque dispositif transdermique contient 5,50 mg de fentanyl dans un dispositif de 16,8 cm 2 et libère 50 microgrammes/heure de fentanyl. Matrifen 75 microgrammes/heure (mcg/h) : chaque dispositif transdermique contient 8,25 mg de fentanyl dans un dispositif de 25,2 cm 2 et libère 75 microgrammes/heure de fentanyl. Matrifen 100 microgrammes/heure (mcg/h) : chaque dispositif transdermique contient 11,00 mg de fentanyl dans un dispositif de 33,6 cm 2 et libère 100 microgrammes/heure de fentanyl. FORME PHARMACEUTIQUE Dispositif transdermique. Dispositif rectangulaire, transparent, pourvu d un film protecteur amovible de taille supérieure à celle du dispositif. Le nom de marque et le dosage sont imprimés sur chaque dispositif à l aide d une encre colorée : Matrifen 12 microgrammes/heure, dispositif transdermique: marron Matrifen 25 microgrammes/heure, dispositif transdermique: rouge Matrifen 50 microgrammes/heure, dispositif transdermique: verte Matrifen 75 microgrammes/heure, dispositif transdermique: bleu clair Matrifen 100 microgrammes/heure, dispositif transdermique: grise INDICATIONS THERAPEUTIQUES Adultes : Douleur chronique sévère qui ne peut être efficacement traitée que par des analgésiques opiacés. Enfants : Gestion à long terme de la douleur chronique sévère chez les enfants sous traitement opioïde à partir de l'âge de 2 ans. POSOLOGIE ET MODE D ADMINISTRATION Les dispositifs transdermiques de fentanyl libèrent la substance active durant 72 heures. La quantité libérée de fentanyl est de 12, 25, 50, 75 ou 100 microgrammes/heure et la surface active correspondante est de 4,2 / 8,4 / 16,8 / 25,2 et 33,6 cm 2. Mode d'administration A usage transdermique. Le dispositif transdermique de fentanyl doit être appliqué sur une peau non irritée et non irradiée, sur une zone plane du torse ou du gras du bras. Chez les jeunes enfants, le haut du dos est l endroit préféré pour appliquer le patch, afin de minimiser le risque que l enfant ne l arrache. Les poils présents au site d'application (préférer une zone glabre) doivent être coupés (et non pas rasés) avant d'appliquer le dispositif. Au besoin, nettoyer à l'eau claire la zone d'application du dispositif. Ne pas utiliser savon, huile, lotion, alcool ou autres produits susceptibles d'irriter la peau ou de modifier les caractéristiques du produit. La peau doit être totalement sèche avant d'appliquer le dispositif. La face externe du dispositif transdermique étant protégée par un film étanche, celui-ci peut être porté lors d'une douche de courte durée. Le dispositif transdermique de fentanyl doit être mis en place aussi rapidement que possible après ouverture de l'emballage individuel. Après enlèvement de la couche de protection, le dispositif transdermique doit être maintenu fermement avec la paume de la main pendant 30 secondes environ, pour assurer un contact total, surtout sur les bords. Une fixation supplémentaire du dispositif transdermique est parfois nécessaire. Le dispositif transdermique de fentanyl doit être porté en continu pendant 72 heures puis remplacé. Le nouveau dispositif transdermique doit toujours être appliqué à un endroit différent du précédent. Il faut attendre au moins 7 jours avant de réutiliser un endroit donné. Le dispositif transdermique ne doit jamais être déchiré ni coupé. La dose nécessaire de fentanyl est établie individuellement et doit être régulièrement évaluée après chaque administration. Adultes : Sélection de la dose initiale La dose de fentanyl dépend de l'utilisation antérieure d'opiacés et du développement possible d'une tolérance, de l'utilisation concomitante d'autres médicaments et de l'état de santé général du patient, ainsi que de la sévérité de l'affection. La dose initiale ne doit pas dépasser 25 microgrammes/heure si la réponse de la douleur à l'opiacé n'est pas totalement connue. Passage d'un autre opiacé Lorsque l'on passe des opiacés par voie orale ou parentérale au fentanyl, la dose initiale est calculée comme suit : 1. Déterminer la quantité d'analgésiques dont le patient a eu besoin au cours des dernières 24 heures. 2. Convertir ensuite la somme en la dose correspondante de morphine par voie orale (tableau 1).
2 3. Voir au tableau 2 la dose correspondante de fentanyl. Tableau 1 : Efficacité équianalgésique des médicaments Toutes les doses i.m. et orales mentionnées dans le tableau ont la même action analgésique que 10 mg de morphine en intramusculaire. Nom du médicament Dose analgésique équivalente (mg) i.m.* Orale Morphine (en cas d administration répétée)** 60 (en cas d administration unique ou intermittente) Hydromorphone 1,5 7,5 Méthadone Oxycodone Lévorphanol 2 4 Oxymorphine 1 10 (rectal) Diamorphine 5 60 Péthidine 75 - Codéine Buprénorphine 0,4 0,8 (sublingual) Kétobémidone * Sur base des études réalisées avec des doses uniques, au cours desquelles l'administration i.m. du produit susmentionné a été comparée avec la morphine pour obtenir une efficacité équivalente. Les doses orales sont les doses recommandées quand on passe de l'administration parentérale à l'administration orale. ** Le rapport d'efficacité de 3:1 pour la morphine i.m./per os repose sur une étude réalisée chez des patients souffrant de douleur chronique. Tableau 2 : Dose initiale recommandée de Matrifen sur base de la dose orale quotidienne de morphine Dose orale de morphine Dosage de Matrifen dispositif transdermique Par 24h (mg/jour) (microgramme/heure) < Les schémas de conversion reposent sur des études cliniques. Les schémas basés sur d'autres études se sont avérés utiles en pratique clinique et peuvent dès lors être appliqués. La première évaluation de l effet analgésique maximum de Matrifen ne doit être effectuée qu après un délai d au moins 24 heures après la pose de ce dispositif. Ceci est dû à l augmentation progressive des concentrations sériques de fentanyl pendant les 24 premières heures après l application du dispositif. Toute thérapie aux opioïdes préexistante doit donc être arrêtée de façon progressive à partir de la pose du premier dispositif et ce jusqu à l obtention d une analgésie efficace avec les dispositifs Matrifen. Ajustement de la dose et traitement d entretien Le dispositif doit être remplacé toutes les 72 heures. La posologie doit être adaptée individuellement jusqu à l obtention d une analgésie efficace. Chez les patients qui notent une forte diminution de l'effet analgésique entre 48 et 72 heures après l'application, il peut être nécessaire de remplacer le fentanyl déjà après 48 heures. Le dosage à 12 microgrammes/heure est indiqué pour la titration posologique dans les zones de faibles concentrations. Si l analgésie est insuffisante à la fin de la période initiale, la dose pourra être augmentée 3 jours après l application du dispositif jusqu à ce que l effet désiré soit obtenu pour chaque patient. Les ajustements posologiques supplémentaires doivent se faire par paliers de 12 microgrammes/heure à 25 microgrammes/heure, bien qu il faille tenir compte des besoins analgésiques supplémentaires et du niveau de douleur du patient. Il est possible d utiliser plusieurs dispositifs pour l adaptation posologique et pour les doses supérieures à 100 microgrammes/heure. Des besoins supplémentaires périodiques d antalgiques à courte durée d action peuvent être nécessaire pour soulager une poussée de douleur. Des méthodes analgésiques additionnelles ou alternatives, ainsi que des administrations alternatives aux opioïdes devront être étudiées lorsque la dose de Matrifen dépasse 300 microgrammes/heure.
3 Des symptômes de sevrage peuvent apparaître lors du passage du traitement morphinique chronique antérieur aux dispositifs transdermiques, malgré une efficacité analgésique adéquate. En cas d apparition de symptômes de sevrage, il est recommandé de mettre en place un traitement à faibles doses d un morphine à courte durée d action. Arrêt du Matrifen Si l arrêt du traitement par dispositif transdermique est nécessaire, il est recommandé de mettre en place progressivement tout autre traitement par des morphiniques, en commençant par des doses faibles et en augmentant lentement les doses. Ceci est dû à la baisse progressive des taux sériques après retrait du dispositif transdermique, on observe une diminution de 50% après une période de temps égale ou supérieure à 17 heures. En règle générale, l arrêt de l analgésie par morphiniques doit être progressif, afin d éviter un syndrome de sevrage (nausées, vomissements, diarrhée, angoisses et tremblements). Utilisation chez le sujet âgé Les sujets âgés ou cachectiques devront être surveiller étroitement et les doses réduites si nécessaire. Utilisation chez des patients avec insuffisance hépatique ou rénale Les patients dont la fonction hépatique ou rénale est diminuée doivent être attentivement suivis afin de détecter tout symptôme de surdosage et une diminution de la dose peut s'avérer nécessaire. Utilisation chez des patients fébriles Il peut s'avérer nécessaire d'adapter la dose durant les périodes fébriles. Usage chez les enfants Les enfants âgés de 16 ans et plus: suivre la posologie adulte. Les enfants âgés de 2 à 16 ans: Matrifen doit être administré uniquement à des patients pédiatriques qui tolèrent les opioïdes (d un âge compris entre 2 et 16 ans) et qui reçoivent déjà au moins l équivalent de 30 mg de morphine par voie orale par jour. Pour remplacer des opioïdes oraux ou parentéraux par Matrifen chez des patients pédiatriques, se référer à l Efficacité équianalgésique des médicaments (Tableau 1), et à la dose initiale recommandée de Matrifen sur base de la dose orale quotidienne de morphine (Tableau 3). Tableau 3 : Dose initiale recommandée de Matrifen sur base de la dose orale quotidienne de morphine 1 Dose orale de morphine Dosage de Matrifen dispositif transdermique Par 24 h (mg/jour) (microgramme/heure) Pour patients pédiatriques 2 Pour patients pédiatriques Dans les études cliniques, ces fourchettes de doses journalières de morphine orale ont été utilisées comme base pour la conversion vers Matrifen. 2 La conversion en des doses de Matrifen supérieures à 25 microgrammes/heure est la même pour les patients adultes et pour les patients pédiatriques. Pour les enfants qui reçoivent plus de 90 mg de morphine orale par jour, seules des informations limitées découlant des essais cliniques sont actuellement disponibles. Dans les études pédiatriques, on a calculé la dose du patch transdermique au fentanyl de manière conventionnelle : une dose de 30 mg à 44 mg de morphine orale par jour, ou sa dose d opioïde équivalente, a été remplacée par un patch au fentanyl à 12 microgrammes/heure. Il est à noter que ce tableau de conversion pour enfants n'est valable que lorsqu'on remplace la morphine orale (ou son équivalent) par les patchs au fentanyl. Le tableau de conversion ne pourrait pas servir pour remplacer le fentanyl par d autres opioïdes, car un surdosage pourrait alors se produire. Pendant les premières 24 heures, l effet analgésique de la première dose des patchs Matrifen ne sera pas optimal. De ce fait, durant les premières 12 heures suivant le passage au Matrifen, les patients doivent recevoir leur dose régulière antérieure d'analgésiques. Au cours des 12 prochaines heures, ces analgésiques doivent être administrés en fonction des besoins cliniques. Etant donné que le taux maximum de fentanyl est atteint après 12 à 24 heures de traitement, il est recommandé de surveiller les patients pendant au moins 48 heures après l instauration de la thérapie par Matrifen ou après l augmentation de la dose, afin de détecter tout effet indésirable éventuel, entre autres une hypoventilation. Ajustement de la dose et entretien Si l effet analgésique de Matrifen est insuffisant, un supplément de morphine ou un autre opioïde à courte durée d action doit être administré. En fonction des besoins supplémentaires en analgésiques et de l intensité de la douleur ressentie par l enfant, on décidera parfois d augmenter la dose. Les ajustements des doses doivent être effectués par paliers de 12 microgrammes/heure. CONTRE-INDICATIONS Matrifen est contre-indiqué chez les patients souffrant d hypersensibilité au fentanyl ou aux excipients présents dans le patch. La douleur aiguë ou postopératoire, étant donné que la titration de la dose n est pas possible pour une utilisation à court terme. Dépression respiratoire sévère Déficience sévère du système nerveux central. EFFETS INDESIRABLES
4 La sécurité du fentanyl transdermique a été évaluée sur 1854 sujets qui ont participé à 11 essais cliniques (fentanyl transdermique en double aveugle [placebo ou contrôle actif] et/ou fentanyl transdermique à étiquetage en clair [pas de contrôle ou contrôle actif]) utilisés dans la prise en charge de la douleur non maligne ou maligne chronique. Ces sujets ont pris au moins 1 dose de fentanyl transdermique et ont apporté des données sur la sécurité. Selon les données de sécurité regroupées de ces essais cliniques, les effets indésirables rapportés les plus courants sont (en % d incidence) : nausées (35.7%), vomissement (23.2%), constipation (23.1%), somnolence (15.0%), vertiges (13.1%) et maux de têtes (11.8%). Les effets indésirables, notamment les effets susmentionnés, reportés sur l usage de fentanyl transdermique mis en évidence par ces essais cliniques et par les expériences post-marketing sont repris ci-dessous. Les catégories de fréquences suivantes sont utilisées dans la présente convention : très fréquents ( 1/10), fréquents ( 1/100, <1/10), peu fréquents ( 1/1 000, <1/100), rares ( 1/10 000, <1/1 000), très rares (< 1/10.000) ; fréquence indéterminée (ne peut être estimée sur la base des données disponibles) Classe de système d organe du système immunitaire Troubles du métabolisme et de la nutrition psychiatriques du système nerveux Effets indésirables Catégorie des fréquences Fréquents Peu fréquents Rare Fréquence Très fréquents indéterminée Choc anaphylactique, Réaction Hypersensibilité anaphylactique, Réaction anaphylactoïde Anorexie Insomnie, Dépression, Anxiété, État confusionnel, Hallucination Somnolence, Tremblement, vertige, céphalées Paresthésie Agitation, Désorientation, humeur euphorique Hypoesthésie, Convulsion (notamment convulsions cloniques et tonicocloniques), Amnésie oculaires Myosis de l'oreille et du labyrinthe cardiaques Vertige Palpitations, Tachycardie Bradycardie, Cyanose vasculaires respiratoires, thoraciques et médiastinales gastrointestinales de la peau et du tissus souscutané musculosquelettiques et systémiques Nausée, Vomissement, Constipation Hypertension Dyspnée Diarrhée, bouche sèche, douleur abdominale, douleur Iléus abdominal supérieure, Dyspepsie Hyperhydrose, Prurit, érythème, éruptions Spasmes musculaires Hypotension Dépressions Apnée, respiratoire, détresse Hypoventilation respiratoire Eczéma, Dermatite allergique, problèmes de peau, Dermatite, Dermatite de contact Contractions musculaires Subiléus Bradypnée
5 Classe de système d organe du rein et des voies urinaires des organes de reproduction et du sein Troubles généraux et anomalies au site d'administration Effets indésirables Catégorie des fréquences Fréquents Peu fréquents Rare Fréquence Très fréquents indéterminée Rétention urinaire Fatigue, Œdème périphérique, Asthénie, Malaise, sensation de froid Dysfonction érectile, Dysfonction sexuelle Réaction au site d application, maladie de type grippe, sensation de changement de la température corporelle, Hypersensibilité au site d application, Syndrome de sevrage du médicament Dermatite au site d application, eczéma au site d application Tout comme d autres analgésiques opioïdes, la tolérance, la dépendance physique et la dépendance psychologique peuvent se développer suite à une utilisation répétée du fentanyl. Les symptômes de sevrage aux opioïdes (comme la nausée, les vomissements, la diarrhée, l anxiété et les frissons) peuvent apparaître chez certains patients après le passage du traitement aux analgésiques opioïdes au dispositif transdermique de fentanyl ou si le traitement est brusquement interrompu. Certains très rares cas de syndrome de sevrage néonatal chez des nouveau-nés ont été constatés lorsque la mère était traitées de manière chronique au fentanyl transdermique lors de sa grossesse. Sujets pédiatriques Le profil des effets indésirables chez les enfants et les adolescents traités avec le dispositif transdermique au fentanyl était analogue à celui observé chez les adultes. Aucun risque n a été identifié dans la population pédiatrique, si ce n est celui auquel on peut s attendre lorsqu on utilise des opioïdes pour soulager la douleur associée à une maladie grave ; en outre, il ne semble pas y avoir de risque spécifique à cette population associé à l usage du patch transdermique au fentanyl chez des enfants aussi jeunes que 2 ans, dans la mesure où il est utilisé tel qu indiqué. Les effets indésirables très fréquents rapportés durant les essais cliniques pédiatriques étaient : fièvre, vomissements et nausées. NATURE ET CONTENU DE L EMBALLAGE EXTERIEUR Chaque dispositif est conditionné dans un emballage thermosoudé en papier, aluminium et polyacrylonitrile (PAN). Contenance des présentations : 2 dispositifs, 5 dispositifs et 10 dispositifs. Toutes les présentations peuvent ne pas être commercialisées. TITULAIRE DE L AUTORISATION DE MISE SUR LE MARCHE Nycomed Belgium Chaussée de Gand 615 BE-1080 Bruxelles NUMEROS D AUTORISATION DE MISE SUR LE MARCHE 12 microgrammes/heure: BE microgrammes/heure: BE microgrammes/heure: BE microgrammes/heure: BE microgrammes/heure: BE MODE DE DELIVRANCE Médicament soumis à prescription médicale DATE DE MISE A JOUR DU TEXTE 08/2011
ANNEXE IIIB NOTICE : INFORMATION DE L UTILISATEUR
 Dénomination du médicament ANNEXE IIIB NOTICE : INFORMATION DE L UTILISATEUR LYSOPAÏNE MAUX DE GORGE AMBROXOL CITRON 20 mg SANS SUCRE, pastille édulcorée au sorbitol et au sucralose. Chlorhydrate d ambroxol
Dénomination du médicament ANNEXE IIIB NOTICE : INFORMATION DE L UTILISATEUR LYSOPAÏNE MAUX DE GORGE AMBROXOL CITRON 20 mg SANS SUCRE, pastille édulcorée au sorbitol et au sucralose. Chlorhydrate d ambroxol
NOTICE : INFORMATION DE L UTILISATEUR MS Direct 10 mg comprimé enrobé MS Direct 20 mg comprimé enrobé sulfate de morphine
 NOTICE : INFORMATION DE L UTILISATEUR MS Direct 10 mg comprimé enrobé MS Direct 20 mg comprimé enrobé sulfate de morphine Veuillez lire attentivement l intégralité de cette notice avant de prendre ce médicament.
NOTICE : INFORMATION DE L UTILISATEUR MS Direct 10 mg comprimé enrobé MS Direct 20 mg comprimé enrobé sulfate de morphine Veuillez lire attentivement l intégralité de cette notice avant de prendre ce médicament.
Patchs contre la douleur contenant des dérivés de morphine. Réponses aux questions les plus fréquentes
 Patchs contre la douleur contenant des dérivés de morphine Réponses aux questions les plus fréquentes Introduction Quel objectif? Ce document constitue une aide dans la gestion au quotidien de votre douleur.
Patchs contre la douleur contenant des dérivés de morphine Réponses aux questions les plus fréquentes Introduction Quel objectif? Ce document constitue une aide dans la gestion au quotidien de votre douleur.
Médicaments contre la douleur Ce que vous devez savoir au sujet des analgésiques opiacés
 Médicaments contre la douleur Ce que vous devez savoir au sujet des analgésiques opiacés Médicaments contre la douleur Ce que vous devez savoir au sujet des analgésiques opiacés Developé pour le Centre
Médicaments contre la douleur Ce que vous devez savoir au sujet des analgésiques opiacés Médicaments contre la douleur Ce que vous devez savoir au sujet des analgésiques opiacés Developé pour le Centre
Atrovent HFA 20 mcg/bouffée solution pour inhalation en flacon pressurisé (bromure d'ipratropium)
 NOTICE ATROVENT HFA 20 MCG/BOUFFEE SOLUTION POUR INHALATION EN FLACON PRESSURISE (BPI n 0250-03 du 27.07.2005) Veuillez lire attentivement l'intégralité de cette notice avant d'utiliser ce médicament.
NOTICE ATROVENT HFA 20 MCG/BOUFFEE SOLUTION POUR INHALATION EN FLACON PRESSURISE (BPI n 0250-03 du 27.07.2005) Veuillez lire attentivement l'intégralité de cette notice avant d'utiliser ce médicament.
PIL Décembre 2009. Autres composants: acide tartrique, macrogol 4000, macrogol 1000, macrogol 400, butylhydroxyanisol.
 Notice publique MOTILIUM Veuillez lire attentivement l intégralité de cette notice avant d utiliser ce médicament. Gardez cette notice, vous pourriez avoir besoin de la relire. Si vous avez d autres questions,
Notice publique MOTILIUM Veuillez lire attentivement l intégralité de cette notice avant d utiliser ce médicament. Gardez cette notice, vous pourriez avoir besoin de la relire. Si vous avez d autres questions,
NOTICE : INFORMATION DE L'UTILISATEUR. DAKTOZIN 2,5 mg/150 mg pommade Nitrate de miconazole et oxyde de zinc
 NOTICE : INFORMATION DE L'UTILISATEUR DAKTOZIN 2,5 mg/150 mg pommade Nitrate de miconazole et oxyde de zinc Veuillez lire attentivement cette notice avant d utiliser ce médicament car elle contient des
NOTICE : INFORMATION DE L'UTILISATEUR DAKTOZIN 2,5 mg/150 mg pommade Nitrate de miconazole et oxyde de zinc Veuillez lire attentivement cette notice avant d utiliser ce médicament car elle contient des
NOTICE : INFORMATIONS DESTINÉES A L UTILISATEUR. Firazyr 30 mg solution injectable en seringue pré-remplie Icatibant
 B. NOTICE 1 NOTICE : INFORMATIONS DESTINÉES A L UTILISATEUR Firazyr 30 mg solution injectable en seringue pré-remplie Icatibant Veuillez lire attentivement l intégralité de cette notice avant d utiliser
B. NOTICE 1 NOTICE : INFORMATIONS DESTINÉES A L UTILISATEUR Firazyr 30 mg solution injectable en seringue pré-remplie Icatibant Veuillez lire attentivement l intégralité de cette notice avant d utiliser
NOTICE: INFORMATION DE L UTILISATEUR. Immukine 100 microgrammes/0,5 ml solution injectable (Interféron gamma-1b recombinant humain)
 NOTICE: INFORMATION DE L UTILISATEUR Immukine 100 microgrammes/0,5 ml solution injectable (Interféron gamma-1b recombinant humain) Veuillez lire attentivement l'intégralité de cette notice avant d'utiliser
NOTICE: INFORMATION DE L UTILISATEUR Immukine 100 microgrammes/0,5 ml solution injectable (Interféron gamma-1b recombinant humain) Veuillez lire attentivement l'intégralité de cette notice avant d'utiliser
NOTICE : INFORMATION DE L UTILISATEUR. Delphi 0,1 % crème Acétonide de triamcinolone
 NOTICE : INFORMATION DE L UTILISATEUR Delphi 0,1 % crème Acétonide de triamcinolone Veuillez lire attentivement cette notice avant d utiliser ce médicament car elle contient des informations importantes
NOTICE : INFORMATION DE L UTILISATEUR Delphi 0,1 % crème Acétonide de triamcinolone Veuillez lire attentivement cette notice avant d utiliser ce médicament car elle contient des informations importantes
RELPAX. hydrobromure d élétriptan
 RELPAX hydrobromure d élétriptan * Pharmacocinétique * Toxicologie * Formulation galénique * Essais cliniques * Conclusion * Pharmacocinétique * Toxicologie * Formulation galénique * Essais cliniques *
RELPAX hydrobromure d élétriptan * Pharmacocinétique * Toxicologie * Formulation galénique * Essais cliniques * Conclusion * Pharmacocinétique * Toxicologie * Formulation galénique * Essais cliniques *
ANNEXE I RESUME DES CARACTERISTIQUES DU PRODUIT
 ANNEXE I RESUME DES CARACTERISTIQUES DU PRODUIT 1. DENOMINATION DU MEDICAMENT 2. COMPOSITION QUALITATIVE ET QUANTITATIVE 3. FORME PHARMACEUTIQUE 4. DONNEES CLINIQUES 4.1. Indications thérapeutiques 4.2.
ANNEXE I RESUME DES CARACTERISTIQUES DU PRODUIT 1. DENOMINATION DU MEDICAMENT 2. COMPOSITION QUALITATIVE ET QUANTITATIVE 3. FORME PHARMACEUTIQUE 4. DONNEES CLINIQUES 4.1. Indications thérapeutiques 4.2.
Bien vous soigner. avec des médicaments disponibles sans ordonnance. juin 2008. Douleur. de l adulte
 Bien vous soigner avec des médicaments disponibles sans ordonnance juin 2008 Douleur de l adulte Douleur de l adulte Ce qu il faut savoir La douleur est une expérience sensorielle et émotionnelle désagréable,
Bien vous soigner avec des médicaments disponibles sans ordonnance juin 2008 Douleur de l adulte Douleur de l adulte Ce qu il faut savoir La douleur est une expérience sensorielle et émotionnelle désagréable,
Carte de soins et d urgence
 Direction Générale de la Santé Carte de soins et d urgence Emergency and Healthcare Card Porphyries Aiguës Hépatiques Acute Hepatic Porphyrias Type de Porphyrie* Déficit en Ala déhydrase Ala Dehydrase
Direction Générale de la Santé Carte de soins et d urgence Emergency and Healthcare Card Porphyries Aiguës Hépatiques Acute Hepatic Porphyrias Type de Porphyrie* Déficit en Ala déhydrase Ala Dehydrase
NOTICE : INFORMATION DE L UTILISATEUR Version 3.0, 04/2013
 NOTICE : INFORMATION DE L UTILISATEUR Version 3.0, 04/2013 1 NOTICE : INFORMATION DE L UTILISATEUR ALEVE 220 mg, comprimés pelliculés Naproxène sodique Veuillez lire attentivement cette notice avant de
NOTICE : INFORMATION DE L UTILISATEUR Version 3.0, 04/2013 1 NOTICE : INFORMATION DE L UTILISATEUR ALEVE 220 mg, comprimés pelliculés Naproxène sodique Veuillez lire attentivement cette notice avant de
EVALUATION DES METHODES D AIDE A L ARRET DU TABAGISME
 EVALUATION DES METHODES D AIDE A L ARRET DU TABAGISME Docteur Jean PERRIOT Dispensaire Emile Roux Clermont-Ferrand [email protected] DIU Tabacologie Clermont-Ferrand - 2015 NOTIONS GENERALES INTRODUCTION.
EVALUATION DES METHODES D AIDE A L ARRET DU TABAGISME Docteur Jean PERRIOT Dispensaire Emile Roux Clermont-Ferrand [email protected] DIU Tabacologie Clermont-Ferrand - 2015 NOTIONS GENERALES INTRODUCTION.
NOTICE : INFORMATION DE L UTILISATEUR. Flunarizine
 NOTICE : INFORMATION DE L UTILISATEUR SIBELIUM 10 mg, comprimé sécable Flunarizine Veuillez lire attentivement l'intégralité de cette notice avant de prendre ce médicament. Gardez cette notice, vous pourriez
NOTICE : INFORMATION DE L UTILISATEUR SIBELIUM 10 mg, comprimé sécable Flunarizine Veuillez lire attentivement l'intégralité de cette notice avant de prendre ce médicament. Gardez cette notice, vous pourriez
RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT. Bisolax 5 mg comprimés enrobés contient 5 mg de bisacodyl par comprimé enrobé.
 RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT 1. Dé nomination du mé dicame nt Bisolax 5 mg comprimés enrobés. 2. Composition qualitative e t quantitative Bisolax 5 mg comprimés enrobés contient 5 mg de bisacodyl
RÉSUMÉ DES CARACTÉRISTIQUES DU PRODUIT 1. Dé nomination du mé dicame nt Bisolax 5 mg comprimés enrobés. 2. Composition qualitative e t quantitative Bisolax 5 mg comprimés enrobés contient 5 mg de bisacodyl
NOTICE : INFORMATION DE L UTILISATEUR. Bisolax 5 mg comprimés enrobés Bisacodyl
 NOTICE : INFORMATION DE L UTILISATEUR Bisolax 5 mg comprimés enrobés Bisacodyl Veuillez lire attentivement cette notice avant d utiliser ce médicament. Elle contient des informations importante s pour
NOTICE : INFORMATION DE L UTILISATEUR Bisolax 5 mg comprimés enrobés Bisacodyl Veuillez lire attentivement cette notice avant d utiliser ce médicament. Elle contient des informations importante s pour
Le traitement du paludisme d importation de l enfant est une urgence
 Le traitement du paludisme d importation de l enfant est une urgence Dominique GENDREL Necker-Enfants Malades Traiter en urgence en présence de trophozoïtes Plus de 80% des paludismes d importation en
Le traitement du paludisme d importation de l enfant est une urgence Dominique GENDREL Necker-Enfants Malades Traiter en urgence en présence de trophozoïtes Plus de 80% des paludismes d importation en
KARDEGIC 75 mg, poudre pour solution buvable en sachet-dose Acétylsalicylate de DL-Lysine
 KARDEGIC 75 mg, poudre pour solution buvable en sachet-dose Acétylsalicylate de DL-Lysine Veuillez lire attentivement cette notice avant d'utiliser ce médicament. Elle contient des informations importantes
KARDEGIC 75 mg, poudre pour solution buvable en sachet-dose Acétylsalicylate de DL-Lysine Veuillez lire attentivement cette notice avant d'utiliser ce médicament. Elle contient des informations importantes
Maternité et activités sportives
 Maternité et activités sportives L obstétricien est de plus en plus souvent interrogé sur les avantages et les risques de maintenir ou de débuter une APS ou de loisir pendant la grossesse. Transformations
Maternité et activités sportives L obstétricien est de plus en plus souvent interrogé sur les avantages et les risques de maintenir ou de débuter une APS ou de loisir pendant la grossesse. Transformations
Point d Information. Le PRAC a recommandé que le RCP soit modifié afin d inclure les informations suivantes:
 Point d Information Médicaments à base d ivabradine, de codéine, médicaments contenant du diméthyl fumarate, du mycophénolate mofétil/acide mycophénolique, de l octocog alpha, spécialité Eligard (contenant
Point d Information Médicaments à base d ivabradine, de codéine, médicaments contenant du diméthyl fumarate, du mycophénolate mofétil/acide mycophénolique, de l octocog alpha, spécialité Eligard (contenant
Protégeons-nous ensemble!
 Grippe saisonnière. Protégeons-nous ensemble! Informations importantes pour vous et votre famille. www.sevaccinercontrelagrippe.ch www.ofsp.admin.ch B C Qu est-ce que la grippe saisonnière et quels en
Grippe saisonnière. Protégeons-nous ensemble! Informations importantes pour vous et votre famille. www.sevaccinercontrelagrippe.ch www.ofsp.admin.ch B C Qu est-ce que la grippe saisonnière et quels en
Carnet de suivi Lithium
 Carnet de suivi Lithium Brochure d information sur les troubles bipolaires et leur traitement par lithium Nom : Ce carnet est important Si vous le trouvez, merci de le faire parvenir à l adresse cidessous
Carnet de suivi Lithium Brochure d information sur les troubles bipolaires et leur traitement par lithium Nom : Ce carnet est important Si vous le trouvez, merci de le faire parvenir à l adresse cidessous
FIPROTEC, PIPETTES CONTRE PUCES ET TIQUES :
 FIPROTEC, PIPETTES CONTRE PUCES ET TIQUES : FIPROTEC 50 MG SOLUTION SPOT-ON POUR CHAT Composition :Une pipette de 0,50 ml contient 50 mg de Fipronil. Indications d utilisation : Chez les chats : - Traitement
FIPROTEC, PIPETTES CONTRE PUCES ET TIQUES : FIPROTEC 50 MG SOLUTION SPOT-ON POUR CHAT Composition :Une pipette de 0,50 ml contient 50 mg de Fipronil. Indications d utilisation : Chez les chats : - Traitement
Bijsluiter FR versie Collier Propoxur Halsband B. NOTICE 1/5
 B. NOTICE 1/5 NOTICE COLLIER PROPOXUR HALSBAND pour chiens de petite taille et chats COLLIER PROPOXUR HALSBAND pour chiens de grande et moyenne taille 1. NOM ET ADRESSE DU TITULAIRE DE L AUTORISATION DE
B. NOTICE 1/5 NOTICE COLLIER PROPOXUR HALSBAND pour chiens de petite taille et chats COLLIER PROPOXUR HALSBAND pour chiens de grande et moyenne taille 1. NOM ET ADRESSE DU TITULAIRE DE L AUTORISATION DE
LA MÉTHAMPHÉTAMINE LE CRYSTAL C EST QUOI
 LA MÉTHAMPHÉTAMINE LE CRYSTAL C EST QUOI? LA MÉTHAMPHÉTAMINE est un produit stupéfiant illicite, synthétisé à partir de substances chimiques, également connu sous le nom de «crystal» ou «crystalmet», «ice»,
LA MÉTHAMPHÉTAMINE LE CRYSTAL C EST QUOI? LA MÉTHAMPHÉTAMINE est un produit stupéfiant illicite, synthétisé à partir de substances chimiques, également connu sous le nom de «crystal» ou «crystalmet», «ice»,
A healthy decision LA DOULEUR
 A healthy decision Mieux vivre avec LA DOULEUR Tout à propos de la douleur, de ses causes et de ses possibilités de traitement. Parlez-en avec votre médecin ou pharmacien. Contenu Qu est-ce que la douleur
A healthy decision Mieux vivre avec LA DOULEUR Tout à propos de la douleur, de ses causes et de ses possibilités de traitement. Parlez-en avec votre médecin ou pharmacien. Contenu Qu est-ce que la douleur
d a n s l e t r a i t e m e n t d e
 La buprénorphine d a n s l e t r a i t e m e n t d e la dépendance aux opioïdes Lignes directrices du Collège des médecins du Québec et de l Ordre des pharmaciens du Québec juin 2009 table des matières
La buprénorphine d a n s l e t r a i t e m e n t d e la dépendance aux opioïdes Lignes directrices du Collège des médecins du Québec et de l Ordre des pharmaciens du Québec juin 2009 table des matières
L EMEA accepte d évaluer la demande d autorisation de mise sur le marché de la LENALIDOMIDE
 L EMEA accepte d évaluer la demande d autorisation de mise sur le marché de la LENALIDOMIDE NEUCHATEL, Suisse, 7 avril/prnewswire/ -- - LA LENALIDOMIDE est évaluée par l EMEA comme thérapie orale pour
L EMEA accepte d évaluer la demande d autorisation de mise sur le marché de la LENALIDOMIDE NEUCHATEL, Suisse, 7 avril/prnewswire/ -- - LA LENALIDOMIDE est évaluée par l EMEA comme thérapie orale pour
Douleur et gestion de la douleur. Renseignez-vous sur les services de soutien et de soins sur www.palliativecare.org.au
 Douleur et gestion de la douleur Renseignez-vous sur les services de soutien et de soins sur www.palliativecare.org.au French - Pain Management Department of Health and Ageing Financé par le gouvernement
Douleur et gestion de la douleur Renseignez-vous sur les services de soutien et de soins sur www.palliativecare.org.au French - Pain Management Department of Health and Ageing Financé par le gouvernement
Questions / Réponses. Troubles du sommeil : stop à la prescription systématique de somnifères chez les personnes âgées
 Questions / Réponses Troubles du sommeil : stop à la prescription systématique de somnifères chez les personnes âgées Quelques chiffres sur les troubles du sommeil et la consommation de benzodiazépines
Questions / Réponses Troubles du sommeil : stop à la prescription systématique de somnifères chez les personnes âgées Quelques chiffres sur les troubles du sommeil et la consommation de benzodiazépines
COMMISSION DE LA TRANSPARENCE AVIS DE LA COMMISSION. 10 octobre 2001
 COMMISSION DE LA TRANSPARENCE AVIS DE LA COMMISSION 10 octobre 2001 VIRAFERONPEG 50 µg 80 µg 100 µg 120 µg 150 µg, poudre et solvant pour solution injectable B/1 B/4 Laboratoires SCHERING PLOUGH Peginterféron
COMMISSION DE LA TRANSPARENCE AVIS DE LA COMMISSION 10 octobre 2001 VIRAFERONPEG 50 µg 80 µg 100 µg 120 µg 150 µg, poudre et solvant pour solution injectable B/1 B/4 Laboratoires SCHERING PLOUGH Peginterféron
1- Parmi les affirmations suivantes, quelles sont les réponses vraies :
 1- Parmi les affirmations suivantes, quelles sont les réponses vraies : a. Les troubles fonctionnels digestifs sont définis par les critères de Paris b. En France, le syndrome de l intestin irritable touche
1- Parmi les affirmations suivantes, quelles sont les réponses vraies : a. Les troubles fonctionnels digestifs sont définis par les critères de Paris b. En France, le syndrome de l intestin irritable touche
Nurofen 400 Fastcaps, 400 mg capsules (molles) Ibuprofène
 NOTICE : INFORMATION DE L UTILISATEUR Nurofen 400 Fastcaps, 400 mg capsules (molles) Ibuprofène Veuillez lire attentivement cette notice avant de prendre ce médicament. Elle contient des informations importantes
NOTICE : INFORMATION DE L UTILISATEUR Nurofen 400 Fastcaps, 400 mg capsules (molles) Ibuprofène Veuillez lire attentivement cette notice avant de prendre ce médicament. Elle contient des informations importantes
Notice publique PERDOLAN - PÉDIATRIE
 Notice publique PERDOLAN - PÉDIATRIE Lisez attentivement cette notice jusqu'à la fin car elle contient des informations importantes pour vous. Ce médicament est délivré sans ordonnance. Néanmoins, vous
Notice publique PERDOLAN - PÉDIATRIE Lisez attentivement cette notice jusqu'à la fin car elle contient des informations importantes pour vous. Ce médicament est délivré sans ordonnance. Néanmoins, vous
NOTICE. ANSM - Mis à jour le : 25/03/2014. Dénomination du médicament. PANTOPRAZOLE RATIOPHARM CONSEIL 20 mg, comprimé gastro-résistant Pantoprazole
 NOTICE ANSM - Mis à jour le : 25/03/2014 Dénomination du médicament PANTOPRAZOLE RATIOPHARM CONSEIL 20 mg, comprimé gastro-résistant Pantoprazole Encadré Veuillez lire attentivement cette notice avant
NOTICE ANSM - Mis à jour le : 25/03/2014 Dénomination du médicament PANTOPRAZOLE RATIOPHARM CONSEIL 20 mg, comprimé gastro-résistant Pantoprazole Encadré Veuillez lire attentivement cette notice avant
Migraine et Abus de Médicaments
 Migraine et Abus de Médicaments Approches diagnostiques et thérapeutiques des Céphalées Chroniques Quotidiennes Pr D. DEPLANQUE Département de Pharmacologie médicale EA 1046, Institut de Médecine Prédictive
Migraine et Abus de Médicaments Approches diagnostiques et thérapeutiques des Céphalées Chroniques Quotidiennes Pr D. DEPLANQUE Département de Pharmacologie médicale EA 1046, Institut de Médecine Prédictive
NOTICE: INFORMATION DE L UTILISATEUR. Bisolax 5 mg comprimés enrobés. Bisacodyl
 NOTICE: INFORMATION DE L UTILISATEUR Bisolax 5 mg comprimés enrobés Bisacodyl Veuillez lire attentivement cette notice avant d utiliser ce médicament car elle contient des informations importantes pour
NOTICE: INFORMATION DE L UTILISATEUR Bisolax 5 mg comprimés enrobés Bisacodyl Veuillez lire attentivement cette notice avant d utiliser ce médicament car elle contient des informations importantes pour
NOTICE. DEBRICALM 100 mg, comprimé pelliculé Maléate de trimébutine
 NOTICE ANSM Mis à jour le : 08/06/2010 Dénomination du médicament DEBRICALM 100 mg, comprimé pelliculé Maléate de trimébutine Encadré Veuillez lire attentivement cette notice avant de prendre ce médicament.
NOTICE ANSM Mis à jour le : 08/06/2010 Dénomination du médicament DEBRICALM 100 mg, comprimé pelliculé Maléate de trimébutine Encadré Veuillez lire attentivement cette notice avant de prendre ce médicament.
Recommandations après le retrait des associations dextropropoxyphène/paracétamol et dextropropoxyphène/paracétamol/caféine
 Groupe Référent Médecins Généralistes de l Afssaps Mise au point Prise en charge des douleurs de l adulte modérées à intenses Recommandations après le retrait des associations dextropropoxyphène/paracétamol
Groupe Référent Médecins Généralistes de l Afssaps Mise au point Prise en charge des douleurs de l adulte modérées à intenses Recommandations après le retrait des associations dextropropoxyphène/paracétamol
Notice : information de l utilisateur. Vesicare 5 mg, comprimés pelliculés Vesicare 10 mg, comprimés pelliculés succinate de solifénacine
 Notice : information de l utilisateur Vesicare 5 mg, comprimés pelliculés Vesicare 10 mg, comprimés pelliculés succinate de solifénacine Veuillez lire attentivement cette notice avant de prendre ce médicament
Notice : information de l utilisateur Vesicare 5 mg, comprimés pelliculés Vesicare 10 mg, comprimés pelliculés succinate de solifénacine Veuillez lire attentivement cette notice avant de prendre ce médicament
ÉVALUATION DE LA PERSONNE ATTEINTE D HYPERTENSION ARTÉRIELLE
 ÉVALUATION DE LA PERSONNE ATTEINTE D HYPERTENSION ARTÉRIELLE PRISE EN CHARGE SYSTÉMATISÉE DES PERSONNES ATTEINTES D HYPERTENSION ARTÉRIELLE SOCIÉTÉ QUÉBÉCOISE D HYPERTENSION ARTÉRIELLE 23 ÉVALUATION DE
ÉVALUATION DE LA PERSONNE ATTEINTE D HYPERTENSION ARTÉRIELLE PRISE EN CHARGE SYSTÉMATISÉE DES PERSONNES ATTEINTES D HYPERTENSION ARTÉRIELLE SOCIÉTÉ QUÉBÉCOISE D HYPERTENSION ARTÉRIELLE 23 ÉVALUATION DE
La migraine : une maladie qui se traite
 La migraine : une maladie qui se traite L évolution natuelle de la migraine Maladie fluctuante+++ Modification des symptômes avec l âge ++ : Moins de crises sévères Caractère pulsatile moins fréquent Plus
La migraine : une maladie qui se traite L évolution natuelle de la migraine Maladie fluctuante+++ Modification des symptômes avec l âge ++ : Moins de crises sévères Caractère pulsatile moins fréquent Plus
Protéger. son animal. la gamme FRONTLINE. grâce à la gamme. Contre les puces et les tiques. Efficace plusieurs semaines (1) Résistant à la pluie,
 la gamme Frontline Contre les puces et les tiques Efficace plusieurs semaines (1) Résistant à la pluie, aux bains et aux shampooings (2) Protéger son animal grâce à la gamme FRONTLINE La gamme FRONTLINE
la gamme Frontline Contre les puces et les tiques Efficace plusieurs semaines (1) Résistant à la pluie, aux bains et aux shampooings (2) Protéger son animal grâce à la gamme FRONTLINE La gamme FRONTLINE
NOTICE. TRIMEBUTINE MYLAN CONSEIL 100 mg, comprimé
 NOTICE ANSM Mis à jour le : 15/07/2014 Dénomination du médicament Encadré TRIMEBUTINE MYLAN CONSEIL 100 mg, comprimé Veuillez lire attentivement cette notice avant de prendre ce médicament. Elle contient
NOTICE ANSM Mis à jour le : 15/07/2014 Dénomination du médicament Encadré TRIMEBUTINE MYLAN CONSEIL 100 mg, comprimé Veuillez lire attentivement cette notice avant de prendre ce médicament. Elle contient
NOTICE : INFORMATIONS DU PATIENT. Keforal 500 mg comprimés pelliculés. Céfalexine monohydratée
 NOTICE : INFORMATIONS DU PATIENT Keforal 500 mg comprimés pelliculés Céfalexine monohydratée Veuillez lire attentivement cette notice avant de prendre ce médicament car elle contient des informations importantes
NOTICE : INFORMATIONS DU PATIENT Keforal 500 mg comprimés pelliculés Céfalexine monohydratée Veuillez lire attentivement cette notice avant de prendre ce médicament car elle contient des informations importantes
DU BON USAGE DES TRIPTANS DANS LA MIGRAINE
 DU BON USAGE DES TRIPTANS DANS LA MIGRAINE SEPTEMBRE 2009 A. AUTRET, TOURS au moins 5 crises : de MIGRAINE SANS AURA 4 72 heures, 2 des caractères : 1 signe d accompagnement : modérée ou sévère, pulsatile,
DU BON USAGE DES TRIPTANS DANS LA MIGRAINE SEPTEMBRE 2009 A. AUTRET, TOURS au moins 5 crises : de MIGRAINE SANS AURA 4 72 heures, 2 des caractères : 1 signe d accompagnement : modérée ou sévère, pulsatile,
Thérapeutique anti-vhc et travail maritime. O. Farret HIA Bégin
 Thérapeutique anti-vhc et travail maritime O. Farret HIA Bégin Introduction «L hépatite C est une maladie le plus souvent mineure, mais potentiellement cancérigène, qu on peut ne pas traiter et surveiller
Thérapeutique anti-vhc et travail maritime O. Farret HIA Bégin Introduction «L hépatite C est une maladie le plus souvent mineure, mais potentiellement cancérigène, qu on peut ne pas traiter et surveiller
Traitements topiques. Utiliser conformément aux instructions figurant sur l emballage. Aident à éliminer les squames. Soulagent les démangeaisons.
 SANS ORDONNANCE Solutions pour le bain et la douche : Huiles Farine d avoine Sels d Epsom Sels de al Mer Morte Utiliser conformément aux instructions figurant sur l emballage. Aident à éliminer les squames.
SANS ORDONNANCE Solutions pour le bain et la douche : Huiles Farine d avoine Sels d Epsom Sels de al Mer Morte Utiliser conformément aux instructions figurant sur l emballage. Aident à éliminer les squames.
1 - Que faut-il retenir sur les anticoagulants oraux?
 La nouvelle convention pharmaceutique offre l opportunité aux pharmaciens d accompagner les patients traités par anticoagulants oraux au long cours afin de prévenir les risques iatrogéniques. Les anticoagulants
La nouvelle convention pharmaceutique offre l opportunité aux pharmaciens d accompagner les patients traités par anticoagulants oraux au long cours afin de prévenir les risques iatrogéniques. Les anticoagulants
La migraine. Foramen ovale perméable. Infarctus cérébral (surtout chez la femme)
 La migraine 1/Introduction : Céphalée primaire (sans lésion sous-jacente). Deux variétés principales: Migraine sans aura (migraine commune). Migraine avec aura (migraine accompagnée). Diagnostic: interrogatoire
La migraine 1/Introduction : Céphalée primaire (sans lésion sous-jacente). Deux variétés principales: Migraine sans aura (migraine commune). Migraine avec aura (migraine accompagnée). Diagnostic: interrogatoire
PRISE EN CHARGE DES PRE ECLAMPSIES. Jérôme KOUTSOULIS. IADE DAR CHU Kremlin-Bicêtre. 94 Gérard CORSIA. PH DAR CHU Pitié-Salpétrière.
 PRISE EN CHARGE DES PRE ECLAMPSIES Jérôme KOUTSOULIS. IADE DAR CHU Kremlin-Bicêtre. 94 Gérard CORSIA. PH DAR CHU Pitié-Salpétrière. 75 Pas de conflits d intérêts. Définitions Pré éclampsie Définitions
PRISE EN CHARGE DES PRE ECLAMPSIES Jérôme KOUTSOULIS. IADE DAR CHU Kremlin-Bicêtre. 94 Gérard CORSIA. PH DAR CHU Pitié-Salpétrière. 75 Pas de conflits d intérêts. Définitions Pré éclampsie Définitions
Le guide du bon usage des médicaments
 Le guide du bon usage des médicaments Les médicaments sont là pour vous aider mais......ils ont parfois du mal à vivre ensemble. Votre médecin et votre pharmacien peuvent adapter votre traitement pour
Le guide du bon usage des médicaments Les médicaments sont là pour vous aider mais......ils ont parfois du mal à vivre ensemble. Votre médecin et votre pharmacien peuvent adapter votre traitement pour
NOTICE : INFORMATION DE L UTILISATEUR. Asaflow 80 mg, comprimés gastro-résistants Asaflow 160 mg, comprimés gastro-résistants. Acide acétylsalicylique
 NOTICE : INFORMATION DE L UTILISATEUR Asaflow 80 mg, comprimés gastro-résistants Asaflow 160 mg, comprimés gastro-résistants Acide acétylsalicylique Veuillez lire attentivement cette notice avant d utiliser
NOTICE : INFORMATION DE L UTILISATEUR Asaflow 80 mg, comprimés gastro-résistants Asaflow 160 mg, comprimés gastro-résistants Acide acétylsalicylique Veuillez lire attentivement cette notice avant d utiliser
NOTICE : INFORMATION DE L UTILISATEUR. Sumatriptan Sandoz 50 mg comprimés Sumatriptan Sandoz 100 mg comprimés. sumatriptan
 NOTICE : INFORMATION DE L UTILISATEUR Sumatriptan Sandoz 50 mg comprimés Sumatriptan Sandoz 100 mg comprimés sumatriptan Veuillez lire attentivement cette notice avant de prendre ce médicament. - Gardez
NOTICE : INFORMATION DE L UTILISATEUR Sumatriptan Sandoz 50 mg comprimés Sumatriptan Sandoz 100 mg comprimés sumatriptan Veuillez lire attentivement cette notice avant de prendre ce médicament. - Gardez
NOTICE : INFORMATIONS DE L'UTILISATEUR. PANTOZOL Control 20 mg, comprimé gastrorésistant Pantoprazole
 NOTICE : INFORMATIONS DE L'UTILISATEUR PANTOZOL Control 20 mg, comprimé gastrorésistant Pantoprazole Veuillez lire attentivement l'intégralité de cette notice car elle contient des informations importantes
NOTICE : INFORMATIONS DE L'UTILISATEUR PANTOZOL Control 20 mg, comprimé gastrorésistant Pantoprazole Veuillez lire attentivement l'intégralité de cette notice car elle contient des informations importantes
L APS ET LE DIABETE. Le diabète se caractérise par un taux de glucose ( sucre ) trop élevé dans le sang : c est l hyperglycémie.
 1. Qu est-ce que le diabète? L APS ET LE DIABETE Le diabète se caractérise par un taux de glucose ( sucre ) trop élevé dans le sang : c est l hyperglycémie. Cette hyperglycémie est avérée si à 2 reprises
1. Qu est-ce que le diabète? L APS ET LE DIABETE Le diabète se caractérise par un taux de glucose ( sucre ) trop élevé dans le sang : c est l hyperglycémie. Cette hyperglycémie est avérée si à 2 reprises
IMIJECT 6 mg/0,5 ml, solution injectable pour voie sous-cutanée en seringue pré-remplie
 1 sur 6 13/09/2010 16:58 Mis à jour : 23/02/2009 1. DENOMINATION DU MEDICAMENT IMIJECT 6 mg/0,5 ml, solution injectable pour voie sous-cutanée en seringue pré-remplie 2. COMPOSITION QUALITATIVE ET QUANTITATIVE
1 sur 6 13/09/2010 16:58 Mis à jour : 23/02/2009 1. DENOMINATION DU MEDICAMENT IMIJECT 6 mg/0,5 ml, solution injectable pour voie sous-cutanée en seringue pré-remplie 2. COMPOSITION QUALITATIVE ET QUANTITATIVE
MONOGRAPHIE DE PRODUIT
 MONOGRAPHIE DE PRODUIT Pr Aranesp MD (darbépoétine alfa) Fioles unidoses (15, 25, 40, 60, 100, 200, 325 et 500 µg/fiole) Seringues préremplies SingleJect MD (10, 15, 20, 30, 40, 50, 60, 80, 100, 130, 150,
MONOGRAPHIE DE PRODUIT Pr Aranesp MD (darbépoétine alfa) Fioles unidoses (15, 25, 40, 60, 100, 200, 325 et 500 µg/fiole) Seringues préremplies SingleJect MD (10, 15, 20, 30, 40, 50, 60, 80, 100, 130, 150,
La vaccination, une bonne protection
 Vaccin contre l hépatite A et l hépatite B La personne qui reçoit ce vaccin se protège contre l hépatite A, l hépatite B et leurs complications. L hépatite A et l hépatite B sont des infections du foie
Vaccin contre l hépatite A et l hépatite B La personne qui reçoit ce vaccin se protège contre l hépatite A, l hépatite B et leurs complications. L hépatite A et l hépatite B sont des infections du foie
Troubles psychiques de la grossesse et du post-partum Q19. Psychiatrie adulte Module D Pr Jean Louis Senon Année universitaire 2002-2003
 Troubles psychiques de la grossesse et du post-partum Q19 Psychiatrie adulte Module D Pr Jean Louis Senon Année universitaire 2002-2003 Plans et objectifs Pendant la grossesse Troubles mineurs, dépressions
Troubles psychiques de la grossesse et du post-partum Q19 Psychiatrie adulte Module D Pr Jean Louis Senon Année universitaire 2002-2003 Plans et objectifs Pendant la grossesse Troubles mineurs, dépressions
COMMISSION DE LA TRANSPARENCE. AVIS 1 er février 2012
 COMMISSION DE LA TRANSPARENCE AVIS 1 er février 2012 Le projet d avis adopté par la Commission de la Transparence le 16 novembre 2011 a fait l objet d une audition le 1 février 2012 XEPLION 25 mg, suspension
COMMISSION DE LA TRANSPARENCE AVIS 1 er février 2012 Le projet d avis adopté par la Commission de la Transparence le 16 novembre 2011 a fait l objet d une audition le 1 février 2012 XEPLION 25 mg, suspension
Céphalées. 1- Mise au point sur la migraine 2- Quand s inquiéter face à une céphalée. APP du DENAISIS
 Céphalées 1- Mise au point sur la migraine 2- Quand s inquiéter face à une céphalée EPU DENAIN -14 novembre 2006 Dr Kubat-Majid14 novembre 2006 Dr KUBAT-MAJID Céphalées 1 Mise au point sur la migraine
Céphalées 1- Mise au point sur la migraine 2- Quand s inquiéter face à une céphalée EPU DENAIN -14 novembre 2006 Dr Kubat-Majid14 novembre 2006 Dr KUBAT-MAJID Céphalées 1 Mise au point sur la migraine
Conseils pour le traitement des douleurs persistantes
 Page -1- Conseils pour le traitement des douleurs persistantes Ce qu'il faut savoir avant tout, c'est que les douleurs persistantes sont des "douleurs particulières", qui doivent donc être traitées en
Page -1- Conseils pour le traitement des douleurs persistantes Ce qu'il faut savoir avant tout, c'est que les douleurs persistantes sont des "douleurs particulières", qui doivent donc être traitées en
Résumé des Caractéristiques du Produit 1. DENOMINATION DU MEDICAMENT PARONAL 2. COMPOSITION QUALITATIVE ET QUANTITATIVE
 Résumé des Caractéristiques du Produit 1. DENOMINATION DU MEDICAMENT PARONAL 2. COMPOSITION QUALITATIVE ET QUANTITATIVE Par fiole: L - asparaginase 10.000 U.I. Pour les excipients, cfr section 6.1. 3.
Résumé des Caractéristiques du Produit 1. DENOMINATION DU MEDICAMENT PARONAL 2. COMPOSITION QUALITATIVE ET QUANTITATIVE Par fiole: L - asparaginase 10.000 U.I. Pour les excipients, cfr section 6.1. 3.
EXEMPLE DE METHODOLOGIE POUR L ELABORATION D UN PROTOCOLE DOULEUR Marie AUBRY Infirmière référente douleur Hôpital TENON AP-HP Paris XX e SOMMAIRE
 EXEMPLE DE METHODOLOGIE POUR L ELABORATION D UN PROTOCOLE DOULEUR Marie AUBRY Infirmière référente douleur Hôpital TENON AP-HP Paris XX e SOMMAIRE Etape n 1 : Faire l état des lieux Identifier la situation
EXEMPLE DE METHODOLOGIE POUR L ELABORATION D UN PROTOCOLE DOULEUR Marie AUBRY Infirmière référente douleur Hôpital TENON AP-HP Paris XX e SOMMAIRE Etape n 1 : Faire l état des lieux Identifier la situation
LIGNES DIRECTRICES CLINIQUES TOUT AU LONG DU CONTINUUM DE SOINS : Objectif de ce chapitre. 6.1 Introduction 86
 LIGNES DIRECTRICES CLINIQUES TOUT AU LONG DU CONTINUUM DE SOINS : ÉTABLISSEMENT DE LIENS ENTRE LES PERSONNES CHEZ QUI UN DIAGNOSTIC D INFECTION À VIH A ÉTÉ POSÉ ET LES SERVICES DE SOINS ET DE TRAITEMENT
LIGNES DIRECTRICES CLINIQUES TOUT AU LONG DU CONTINUUM DE SOINS : ÉTABLISSEMENT DE LIENS ENTRE LES PERSONNES CHEZ QUI UN DIAGNOSTIC D INFECTION À VIH A ÉTÉ POSÉ ET LES SERVICES DE SOINS ET DE TRAITEMENT
o Anxiété o Dépression o Trouble de stress post-traumatique (TSPT) o Autre
 Page 1 Garantie Responsabilité civile - Lésions corporelles de l assurance automobile - Étude des dossiers de demande d indemnisation fermés en Ontario Descriptions des blessures Élaborées à partir des
Page 1 Garantie Responsabilité civile - Lésions corporelles de l assurance automobile - Étude des dossiers de demande d indemnisation fermés en Ontario Descriptions des blessures Élaborées à partir des
Diabète Type 2. Épidémiologie Aspects physiques Aspects physiologiques
 Diabète Type 2 Épidémiologie Aspects physiques Aspects physiologiques Épidémiologie 90% de tous les cas de diabètes Environ 1 personne sur 20 est atteinte Diabète gras Facteur de risque majeur pour les
Diabète Type 2 Épidémiologie Aspects physiques Aspects physiologiques Épidémiologie 90% de tous les cas de diabètes Environ 1 personne sur 20 est atteinte Diabète gras Facteur de risque majeur pour les
Comment ça va? Quand ça ne va pas. 4 comment ça va?
 Comment ça va? 1 Voici quatre dialogues. Dites à quelle situation de communication correspond chacun d eux. Situation a) : consultation chez un médecin. Situation b) : salutations dans la rue, par simple
Comment ça va? 1 Voici quatre dialogues. Dites à quelle situation de communication correspond chacun d eux. Situation a) : consultation chez un médecin. Situation b) : salutations dans la rue, par simple
COMMISSION DE LA TRANSPARENCE AVIS. 10 mai 2006
 COMMISSION DE LA TRANSPARENCE AVIS 10 mai 2006 METOJECT 10 mg/ml, solution injectable en seringue pré-remplie 1 seringue pré-remplie en verre de 0,75 ml avec aiguille : 371 754-3 1 seringue pré- remplie
COMMISSION DE LA TRANSPARENCE AVIS 10 mai 2006 METOJECT 10 mg/ml, solution injectable en seringue pré-remplie 1 seringue pré-remplie en verre de 0,75 ml avec aiguille : 371 754-3 1 seringue pré- remplie
La drépanocytose. Sikkelcelziekte (Frans)
 La drépanocytose Sikkelcelziekte (Frans) Qu est-ce que la drépanocytose? La drépanocytose est une maladie causée par un changement héréditaire du pigment rouge dans les globules rouges : l hémoglobine.
La drépanocytose Sikkelcelziekte (Frans) Qu est-ce que la drépanocytose? La drépanocytose est une maladie causée par un changement héréditaire du pigment rouge dans les globules rouges : l hémoglobine.
Algorithme d utilisation des anti-inflammatoires non stéroïdiens (AINS)
 Algorithme d utilisation des anti-inflammatoires non stéroïdiens (AINS) Édition Conseil du médicament www.cdm.gouv.qc.ca Coordination Anne Fortin, pharmacienne Élaboration Conseil du médicament Fédération
Algorithme d utilisation des anti-inflammatoires non stéroïdiens (AINS) Édition Conseil du médicament www.cdm.gouv.qc.ca Coordination Anne Fortin, pharmacienne Élaboration Conseil du médicament Fédération
Institut WanXiang Historique de santé du patient
 Institut WanXiang Historique de santé du patient Merci de remplir ce questionnaire aussi complètement que possible et d indiquer les zones d incompréhension avec un point d'interrogation. En plus de toutes
Institut WanXiang Historique de santé du patient Merci de remplir ce questionnaire aussi complètement que possible et d indiquer les zones d incompréhension avec un point d'interrogation. En plus de toutes
HEPATITES VIRALES 22/09/09. Infectieux. Mme Daumas
 HEPATITES VIRALES 22/09/09 Mme Daumas Infectieux Introduction I. Hépatite aigu II. Hépatite chronique III. Les différents types d hépatites A. Hépatite A 1. Prévention de la transmission 2. Vaccination
HEPATITES VIRALES 22/09/09 Mme Daumas Infectieux Introduction I. Hépatite aigu II. Hépatite chronique III. Les différents types d hépatites A. Hépatite A 1. Prévention de la transmission 2. Vaccination
MONOGRAPHIE DE PRODUIT
 MONOGRAPHIE DE PRODUIT Pr AXERT comprimés de malate d almotriptan 6,25 mg et 12,5 mg d almotriptan Agoniste des récepteurs 5-HT 1 Traitement antimigraineux Cette monographie de produit est la propriété
MONOGRAPHIE DE PRODUIT Pr AXERT comprimés de malate d almotriptan 6,25 mg et 12,5 mg d almotriptan Agoniste des récepteurs 5-HT 1 Traitement antimigraineux Cette monographie de produit est la propriété
Placebo Effet Placebo. Pr Claire Le Jeunne Hôtel Dieu- Médecine Interne et Thérapeutique Faculté de Médecine Paris Descartes
 Placebo Effet Placebo Pr Claire Le Jeunne Hôtel Dieu- Médecine Interne et Thérapeutique Faculté de Médecine Paris Descartes Plan Définitions Placebo dans les essais thérapeutiques Effet placebo Médicaments
Placebo Effet Placebo Pr Claire Le Jeunne Hôtel Dieu- Médecine Interne et Thérapeutique Faculté de Médecine Paris Descartes Plan Définitions Placebo dans les essais thérapeutiques Effet placebo Médicaments
Notice : Informations de l utilisateur. Pantomed 20 mg comprimés gastro-résistants. Pantoprazole
 Notice : Informations de l utilisateur Pantomed 20 mg comprimés gastro-résistants Pantoprazole Veuillez lire attentivement cette notice avant d utiliser ce médicament car elle contient des informations
Notice : Informations de l utilisateur Pantomed 20 mg comprimés gastro-résistants Pantoprazole Veuillez lire attentivement cette notice avant d utiliser ce médicament car elle contient des informations
COMMISSION DE LA TRANSPARENCE. Avis. 23 mai 2007
 COMMISSION DE LA TRANSPARENCE Avis 23 mai 2007 SUTENT 12,5 mg, gélule Flacon de 30 (CIP: 376 265-0) SUTENT 25 mg, gélule Flacon de 30 (CIP: 376 266-7) SUTENT 50 mg, gélule Flacon de 30 (CIP: 376 267-3)
COMMISSION DE LA TRANSPARENCE Avis 23 mai 2007 SUTENT 12,5 mg, gélule Flacon de 30 (CIP: 376 265-0) SUTENT 25 mg, gélule Flacon de 30 (CIP: 376 266-7) SUTENT 50 mg, gélule Flacon de 30 (CIP: 376 267-3)
ORDONNANCE COLLECTIVE
 ORDONNANCE COLLECTIVE Assurer le suivi des personnes recevant un Page 1 de 12 O.C. 6.5 Professionnels visés : Les infirmières qui possèdent la formation, les connaissances et les compétences nécessaires,
ORDONNANCE COLLECTIVE Assurer le suivi des personnes recevant un Page 1 de 12 O.C. 6.5 Professionnels visés : Les infirmières qui possèdent la formation, les connaissances et les compétences nécessaires,
ACTUALITES THERAPEUTIQUES. Dr Sophie PITTION (CHU Nancy) Metz, le 2 Juin 2012
 ACTUALITES THERAPEUTIQUES Dr Sophie PITTION (CHU Nancy) Metz, le 2 Juin 2012 Traitement de fond Objectifs: Réduire le nombre de poussées Arrêter ou freiner la progression du handicap Les traitements disponibles
ACTUALITES THERAPEUTIQUES Dr Sophie PITTION (CHU Nancy) Metz, le 2 Juin 2012 Traitement de fond Objectifs: Réduire le nombre de poussées Arrêter ou freiner la progression du handicap Les traitements disponibles
Les triptans. quel casse-tête! Kim Messier et Michel Lapierre. Vous voulez prescrire des triptans? Lisez ce qui suit!
 Fédération des médecins omnipraticiens du Québec Les triptans quel casse-tête! Kim Messier et Michel Lapierre Vous voulez prescrire des triptans? Lisez ce qui suit! Les triptans, des agonistes sélectifs
Fédération des médecins omnipraticiens du Québec Les triptans quel casse-tête! Kim Messier et Michel Lapierre Vous voulez prescrire des triptans? Lisez ce qui suit! Les triptans, des agonistes sélectifs
MONOGRAPHIE DE PRODUIT
 MONOGRAPHIE DE PRODUIT Pr ESBRIET Capsules de pirfénidone 267 mg Antifibrosant et anti-inflammatoire Hoffmann-La Roche Limitée 7070 Mississauga Road Mississauga (Ontario) L5N 5M8 Canada Date de révision
MONOGRAPHIE DE PRODUIT Pr ESBRIET Capsules de pirfénidone 267 mg Antifibrosant et anti-inflammatoire Hoffmann-La Roche Limitée 7070 Mississauga Road Mississauga (Ontario) L5N 5M8 Canada Date de révision
Vivez votre féminité sans souffrir.
 Vivez votre féminité sans souffrir. PERDOFEMINA (lysinate d ibuprofène) est un médicament pour les adultes et les enfants à partir de 12 ans. Pas d utilisation prolongée sans avis médical. Ne pas administrer
Vivez votre féminité sans souffrir. PERDOFEMINA (lysinate d ibuprofène) est un médicament pour les adultes et les enfants à partir de 12 ans. Pas d utilisation prolongée sans avis médical. Ne pas administrer
vaccin pneumococcique polyosidique conjugué (13-valent, adsorbé)
 EMA/90006/2015 EMEA/H/C/001104 Résumé EPAR à l intention du public vaccin pneumococcique polyosidique conjugué (13-valent, adsorbé) Le présent document est un résumé du rapport européen public d évaluation
EMA/90006/2015 EMEA/H/C/001104 Résumé EPAR à l intention du public vaccin pneumococcique polyosidique conjugué (13-valent, adsorbé) Le présent document est un résumé du rapport européen public d évaluation
NOTICE: INFORMATION DE L UTILISATEUR. Dulcolax bisacodyl 5 mg comprimés enrobés (bisacodyl)
 NOTICE: INFORMATION DE L UTILISATEUR Dulcolax bisacodyl 5 mg comprimés enrobés (bisacodyl) Veuillez lire attentivement cette notice avant de prendre ce médicament. Elle contient des informations importantes
NOTICE: INFORMATION DE L UTILISATEUR Dulcolax bisacodyl 5 mg comprimés enrobés (bisacodyl) Veuillez lire attentivement cette notice avant de prendre ce médicament. Elle contient des informations importantes
Notice : ROACCUTANE. AcnéFight. Consultez :
 Consultez : Notice : ROACCUTANE AcnéFight Retrouvez l évolution de mes traitements Roaccutane sur ce site : http://montraitementroaccutane.over-blog.com/ NOTICE : INFORMATION DE L UTILISATEUR ISOCURAL
Consultez : Notice : ROACCUTANE AcnéFight Retrouvez l évolution de mes traitements Roaccutane sur ce site : http://montraitementroaccutane.over-blog.com/ NOTICE : INFORMATION DE L UTILISATEUR ISOCURAL
NOTICE: INFORMATION DE L UTILISATEUR
 NOTICE: INFORMATION DE L UTILISATEUR LANSOPRAZOLE TEVA 15 mg GÉLULES GASTRO-RÉSISTANTES LANSOPRAZOLE TEVA 30 mg GÉLULES GASTRO-RÉSISTANTES lansoprazole Veuillez lire attentivement cette notice avant de
NOTICE: INFORMATION DE L UTILISATEUR LANSOPRAZOLE TEVA 15 mg GÉLULES GASTRO-RÉSISTANTES LANSOPRAZOLE TEVA 30 mg GÉLULES GASTRO-RÉSISTANTES lansoprazole Veuillez lire attentivement cette notice avant de
NOTICE. PANTOPRAZOLE MYLAN CONSEIL 20 mg, comprimé gastro résistant
 NOTICE ANSM Mis à jour le : 05/09/2014 Dénomination du médicament Encadré PANTOPRAZOLE MYLAN CONSEIL 20 mg, comprimé gastro résistant Veuillez lire attentivement cette notice avant de prendre ce médicament.
NOTICE ANSM Mis à jour le : 05/09/2014 Dénomination du médicament Encadré PANTOPRAZOLE MYLAN CONSEIL 20 mg, comprimé gastro résistant Veuillez lire attentivement cette notice avant de prendre ce médicament.
IMPORTANT : VEUILLEZ LIRE ATTENTIVEMENT
 PARTIE III : RENSEIGNEMENTS POUR LE CONSOMMATEUR REMERON RD (mirtazapine) Le présent dépliant constitue la troisième et dernière partie de la monographie du produit publiée à la suite de l approbation
PARTIE III : RENSEIGNEMENTS POUR LE CONSOMMATEUR REMERON RD (mirtazapine) Le présent dépliant constitue la troisième et dernière partie de la monographie du produit publiée à la suite de l approbation
LE GRAND LIVRE Du. Pr Jean-Jacques Altman Dr Roxane Ducloux Dr Laurence Lévy-Dutel. Prévenir les complications. et surveiller la maladie
 Pr Jean-Jacques Altman Dr Roxane Ducloux Dr Laurence Lévy-Dutel LE GRAND LIVRE Du diabète Vivre avec le diabète à tout âge Traiter et surveiller la maladie Prévenir les complications, 2012 ISBN : 978-2-212-55509-7
Pr Jean-Jacques Altman Dr Roxane Ducloux Dr Laurence Lévy-Dutel LE GRAND LIVRE Du diabète Vivre avec le diabète à tout âge Traiter et surveiller la maladie Prévenir les complications, 2012 ISBN : 978-2-212-55509-7
Observation. Merci à l équipe de pharmaciens FormUtip iatro pour ce cas
 Cas clinique M. ZAC Observation Mr ZAC ans, 76 ans, 52 kg, est admis aux urgences pour des algies fessières invalidantes, résistantes au AINS. Ses principaux antécédents sont les suivants : une thrombopénie
Cas clinique M. ZAC Observation Mr ZAC ans, 76 ans, 52 kg, est admis aux urgences pour des algies fessières invalidantes, résistantes au AINS. Ses principaux antécédents sont les suivants : une thrombopénie
DIABÈTe De TYPe 1 Petit guide pour les parents et les enfants.
 DIABÈTe De TYPe 1 Petit guide pour les parents et les enfants. Guide pour comprendre et aborder sereinement l apparition du diabète de type 1. Sommaire Le contrôle glycémique 04 Qu est-ce que le taux d
DIABÈTe De TYPe 1 Petit guide pour les parents et les enfants. Guide pour comprendre et aborder sereinement l apparition du diabète de type 1. Sommaire Le contrôle glycémique 04 Qu est-ce que le taux d
ANNEXE I RESUME DES CARACTERISTIQUES DU PRODUIT
 ANNEXE I RESUME DES CARACTERISTIQUES DU PRODUIT 1 1. DÉNOMINATION DU MÉDICAMENT AVONEX 30 microgrammes poudre et solvant pour solution injectable 2. COMPOSITION QUALITATIVE ET QUANTITATIVE Chaque flacon
ANNEXE I RESUME DES CARACTERISTIQUES DU PRODUIT 1 1. DÉNOMINATION DU MÉDICAMENT AVONEX 30 microgrammes poudre et solvant pour solution injectable 2. COMPOSITION QUALITATIVE ET QUANTITATIVE Chaque flacon
LA CHOLÉCYSTECTOMIE PAR LAPAROSCOPIE
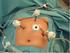 LA CHOLÉCYSTECTOMIE PAR LAPAROSCOPIE Une technique chirurgicale Pour vous, pour la vie Qu est-ce que la cholécystectomie? C est l intervention chirurgicale pratiquée pour enlever la vésicule biliaire.
LA CHOLÉCYSTECTOMIE PAR LAPAROSCOPIE Une technique chirurgicale Pour vous, pour la vie Qu est-ce que la cholécystectomie? C est l intervention chirurgicale pratiquée pour enlever la vésicule biliaire.
Semaine de la sécurité des patients: novembre 2012
 Semaine de la sécurité des patients: novembre 2012 Qu'est-ce-que la douleur? La douleur est une sensation désagréable et complexe (sensorielle et émotionnelle). Cette sensation provient de l'excitation
Semaine de la sécurité des patients: novembre 2012 Qu'est-ce-que la douleur? La douleur est une sensation désagréable et complexe (sensorielle et émotionnelle). Cette sensation provient de l'excitation
