COMMISSION DE LA TRANSPARENCE AVIS. 11 avril 2012
|
|
|
- Hubert Boutin
- il y a 7 ans
- Total affichages :
Transcription
1 COMMISSION DE LA TRANSPARENCE AVIS 11 avril 2012 Le projet d avis adopté par la Commission de la Transparence le 14 mars 2012 a fait l objet d'observations examinées à la séance du 11 avril 2012 XGEVA 120 mg, solution injectable 1 flacon en verre de 120 mg / 1,7 ml (CIP ) 4 flacons en verre de 120 mg / 1,7 ml (CIP ) Laboratoire AMGEN SAS Denosumab Liste I Prescription réservée aux spécialistes et services CANCEROLOGIE Prescription réservée aux spécialistes et services ONCOLOGIE MEDICALE Prescription réservée aux spécialistes et services RHUMATOLOGIE Code ATC: M05BX04 (Autres médicaments agissant sur la minéralisation) Date de l'amm (procédure centralisée): 13 juillet 2011 Motif de la demande : Inscription Sécurité Sociale et Collectivités. Direction de l'evaluation Médicale, Economique et de Santé Publique 1/14
2 1 CARACTERISTIQUES DU MEDICAMENT 1.1. Principe actif Dénosumab 1.2. Originalité Le dénosumab est un anticorps monoclonal humain de type IgG2 qui a pour cible le système RANK/RANKL. Il inhibe la formation, la fonction et la survie des ostéoclastes, diminuant ainsi la résorption osseuse dans l os cortical et trabéculaire. Il s agit d une nouvelle classe thérapeutique pour prévenir les complications des métastases osseuses Indication thérapeutique «Prévention des complications osseuses (fractures pathologiques, irradiation osseuse, compression médullaire ou chirurgie osseuse) chez des patients adultes atteints de tumeurs solides présentant des métastases osseuses.» 1.4. Posologie «La posologie recommandée est de 120 mg de XGEVA, administrée une fois toutes les quatre semaines, par injection sous-cutanée dans la cuisse, l abdomen ou le bras. Une supplémentation apportant au moins 500 mg de calcium et 400 UI de vitamine D est requise chez tous les patients, sauf en cas d hypercalcémie. Patients insuffisants rénaux Aucune adaptation de la posologie n est nécessaire chez les patients atteints d insuffisance rénale. L expérience chez les patients dialysés ou présentant une insuffisance rénale sévère (clairance de la créatinine <30 ml/min) est limitée. Patients insuffisants hépatiques La tolérance et l efficacité du dénosumab n ont pas été étudiées chez les patients présentant une insuffisance hépatique. Patients âgés ( 65 ans) Aucune adaptation de la posologie n est nécessaire chez les patients âgés. Population pédiatrique XGEVA n est pas recommandé chez les patients âgés de moins de 18 ans, car sa tolérance et son efficacité n ont pas été établies dans cette population. Chez l animal, l inhibition de RANK/RANK-ligand (RANKL) a été associée à une inhibition de la croissance osseuse et à une absence de poussée dentaire. Ces modifications ont été partiellement réversibles à l arrêt de l inhibition de RANKL. Mode d administration Injection sous-cutanée. XGEVA doit être administré sous la responsabilité d un professionnel de santé.» 2/14
3 2 MEDICAMENTS COMPARABLES 2.1. Classement ATC (2011) M M05 M05B M05BX M05BAX04 : muscle et squelette : médicaments pour le traitement des désordres osseux : médicaments agissant sur la structure osseuse et la minéralisation : autres médicaments agissant sur la structure osseuse et la minéralisation : denosumab 2.2. Médicaments de même classe pharmaco-thérapeutique Il n existe aucun autre médicament de la même classe (anticorps monoclonal) ayant la même indication Médicaments à même visée thérapeutique Ce sont les bisphosphonates qui ont une indication dans la prévention des complications des métastases osseuses. Spécialité DCI Indications SMR / ASMR ZOMETA 4 mg/5ml solution à diluer pour perfusion Acide zolédronique Prévention des complications osseuses (fractures pathologiques, compression médullaire, irradiation ou chirurgie osseuse, hypercalcémie induite par des tumeurs) chez des patients adultes atteints de pathologie maligne à un stade avancé avec atteinte osseuse. Traitement de l'hypercalcémie induite par des tumeurs (TIH) chez des patients adultes. SMR Important / ASMR III en termes d efficacité dans la prise en charge des métastases osseuses du cancer de la prostate vis-à-vis de la prise en charge habituelle. PAMIDRONATE DE SODIUM ACTAVIS et HOSPIRA, 3 mg/ml 6 mg/ml 9 mg/ml solution à diluer pour perfusion Acide pamidronique Traitement de l'hypercalcémie d'origine maligne. Prévention des complications osseuses (fractures pathologiques, compression médullaire ou chirurgie osseuse, hypercalcémie) chez des patients atteints de cancer du sein avec métastases osseuses ou myélomes multiples avec lésions osseuses, en complément du traitement spécifique de la tumeur. SMR Important / ASMR V par rapport à Aredia BONDRONAT 2 mg 6mg solution à diluer pour perfusion Acide ibandronique La prévention des complications osseuses (fractures pathologiques, complications osseuses nécessitant une radiothérapie ou une chirurgie) chez les patients atteints de cancer du sein et de métastases osseuses. SMR Important / ASMR V par rapport à Zometa 3/14
4 3 ANALYSE DES DONNEES DISPONIBLES L apport thérapeutique du dénosumab pour prévenir les complications osseuses associées à la présence de métastases chez des patients adultes a été évalué dans trois études de phase III : Etude réalisée chez des patients atteints de métastases osseuses d un cancer du sein, Etude réalisée chez des patients atteints de métastases osseuses d un cancer de la prostate, Etude réalisée chez des patients atteints de métastases osseuses de tumeurs solides (hors cancer du sein ou de la prostate) ou de myélome multiple avec atteinte osseuse. Le schéma expérimental des trois études était similaire. Il s agissait d études randomisées comparatives versus acide zolédronique, réalisées en double aveugle. Les patients ont reçu l un des deux traitements suivants : dénosumab 120 mg par voie sous cutanée (SC) et placebo IV toutes les 4 semaines acide zolédronique 4 mg par voie IV et placebo SC toutes les 4 semaines. La posologie de l acide zolédronique était ajustée si la clairance de la créatinine était 60 ml/min et arrêté en cas de détérioration de la fonction rénale. Une administration de calcium 500 mg et de vitamine D 400 UI tous les jours était recommandée pour tous les patients sauf en cas d hypercalcémie documentée. Une analyse groupée prévue au protocole de ces 3 études comparant le dénosumab à l acide zolédronique a été fournie. Méthodologie La non-infériorité était établie si le hazard-ratio observé était 0,90 de manière à préserver au moins 50% du bénéfice clinique de l acide zolédronique comparativement à un placebo, estimé à partir d études antérieures. Une fois la non-infériorité établie, un test de supériorité était prévu. La durée de traitement en double aveugle était déterminée par la survenue de la première complication osseuse chez 745 patients afin d assurer une puissance statistique de 97%. Critère de jugement principal : survenue du premier événement osseux, critère composite regroupant : les fractures pathologiques, les compressions médullaires, la radiothérapie osseuse, la chirurgie osseuse. Critères de jugement secondaires, notamment la survenue du premier événement osseux et des suivants (événements multiples). 4/14
5 3.1. Efficacité Etude : dans le cancer du sein avancé avec des métastases osseuses 1 Principaux critères d inclusion patients ayant un cancer du sein histologiquement ou cytologiquement prouvé présence d au moins une métastase osseuse radiologiquement prouvée statut ECOG (indice de performance) 2 clairance de la créatinine 30 ml/min Principaux critères de non inclusion traitement en cours ou antécédent de traitement par bisphosphonate par voie IV ou par voie orale ayant une indication dans les métastases osseuses espérance de vie < 6 mois présence ou antécédent d ostéonécrose ou ostéomyélite de la mâchoire chirurgie dentaire ou buccale non cicatrisée ou nécessaire Caractéristiques des patients Parmi les patients inclus dans cette étude, 1026 ont été randomisés dans le groupe dénosumab et 1020 dans le groupe acide zolédronique. Les caractéristiques des patients à l inclusion étaient comparables. L âge médian était de 57,0 ans dans le groupe dénosumab versus 56,0 ans dans le groupe acide zolédronique. Les délais médians entre le diagnostic initial de cancer et celui de la première métastase osseuse étaient de 32,8 mois versus 35,4 mois. Des métastases viscérales étaient présentes chez 552 (54%) versus 525 (51%) patients. Avant la randomisation, 81% des patients avaient été traités par chimiothérapie et 3 lésions métastatiques osseuses ou plus ont été objectivées chez 24% des patients dans chacun des deux groupes. Le pourcentage de patients ayant eu une complication d une métastase osseuse (fracture, compression médullaire, chirurgie ou radiothérapie osseuse) avant inclusion dans l étude était similaire dans les deux groupes (37%). Résultats L étude a été réalisée pendant 34 mois pour atteindre le nombre d événements nécessaires. Une adaptation de la dose initiale a été nécessaire chez 131 (12,9%) patients traités par l acide zolédronique et l administration d au moins une dose d acide zolédronique a dû être suspendue chez 56 patients (5,5%) en raison d une insuffisance rénale. Le dénosumab a été non inférieur à l acide zolédronique pour prévenir le premier événement osseux (HR : 0,82 [0,71 ; 0,95]). La supériorité du dénosumab par rapport à l acide zolédronique sur ce critère a été démontrée. Le délai médian de survenue du premier événement osseux a été de 26,4 mois avec l acide zolédronique et non atteint avec le dénosumab. Un «premier événement osseux» a été observé chez 315/1026 patients (30,7%) dans le groupe dénosumab versus 372/1020 patients (36,5%) dans le groupe acide zolédronique soit une réduction absolue de 5,8% sur un suivi de 34 mois. Le risque de développer un «premier événement osseux et les suivants» a été plus faible dans le groupe dénosumab que dans le groupe acide zolédronique (HR : 0,77 [0,66-0,89]) (tableau 1). Au total 474 événements osseux ont été rapportés dans le groupe dénosumab et 608 dans le groupe acide zolédronique. La survie globale (HR: 0,95 [0,81-1,11]) et le délai de progression de la maladie (HR: 1,00 [0,89-1,11]) ont été similaires dans les deux groupes. 1 Stopeck AT et al. Denosumab compared with zoledronic acid for the treatment of bone metastases in patients with advanced breast cancer: a randomized, double-blind study. J Clin Oncol ;28: /14
6 Tableau 1 : Résultats sur les critères d efficacité (population ITT) Critères Dénosumab vs. Acide Zolédronique p Critère de jugement principal Hazard Ratio du premier événement osseux (Test de non infériorité) 0,82 [0,71 ; 0,95] <0,0001 Critères de jugement secondaires Hazard Ratio du premier événement osseux (Test de supériorité) Hazard Ratio du premier événement osseux et des suivants (Test de supériorité) 0,82 [0,71 ; 0,95] 0,01 0,77 [0,66-0,89] 0, Etude : dans le cancer de la prostate résistant à la castration avec des métastases osseuses 2 Principaux critères d inclusion cancer de la prostate hormono-résistant histologiquement prouvé présence ou antécédent d au moins une métastase osseuse radiologiquement prouvée statut ECOG 2 clairance de la créatinine 30 ml/min Principaux critères de non inclusion traitement en cours ou antécédents de traitement par bisphosphonate par voie IV ou par voie orale ayant une indication dans les métastases osseuses radiothérapie osseuse ou chirurgie osseuse planifiée présence ou antécédent d ostéonécrose ou ostéomyélite de la mâchoire espérance de vie 6 mois chirurgie dentaire ou buccale non cicatrisée intervention dentaire programmée Caractéristiques des patients Parmi les patients inclus dans cette étude, 950 ont été randomisés dans le groupe dénosumab et 951 dans le groupe acide zolédronique. Les caractéristiques des patients à l inclusion étaient comparables. L âge médian était de 71 ans dans les deux groupes. Les délais médians entre le diagnostic initial de cancer et la première métastase osseuse étaient similaires dans les deux groupes (24,5 mois). Le score de Gleason était supérieur à 8 chez 394 (41,5%) patients du groupe dénosumab versus 408 (42,9%) patients du groupe acide zolédronique. Des métastases viscérales étaient présentes chez 161 (17%) versus 181 (19%) patients. Trois lésions métastatiques osseuses ou plus ont été objectivées chez 318 (33,5%) patients du groupe dénosumab versus 328 (34,5%) patients du groupe acide zolédronique. Le pourcentage de patients ayant déjà eu une complication d une métastase osseuse (fracture, compression médullaire, chirurgie ou radiothérapie osseuse) avant l inclusion dans l étude était similaire dans les deux groupes (24%). 2 Fizazi K et al. Denosumab versus zoledronic acid for treatment of bone metastases in men with castrationresistant prostate cancer: a randomised, double-blind study. Lancet 2011 ;377: /14
7 Résultats L étude a été réalisée pendant 41 mois pour atteindre le nombre d événements nécessaires. Dans le groupe acide zolédronique, un ajustement de posologie en raison d une fonction rénale altérée à l inclusion a été fait chez 213 (22%) patients. Chez 143 (15%) des patients du groupe traité par acide zolédronique, des perfusions n ont pas été réalisées à cause d une élévation de la créatinine plasmatique. Le dénosumab a été non inférieur à l acide zolédronique pour prévenir le premier événement osseux (HR: 0,82 [0,71 ; 0,95]). La supériorité du dénosumab par rapport à l acide zolédronique sur ce critère a été démontrée. Le délai médian de survenue du premier événement osseux a été de 20,7 mois avec le dénosumab versus 17,1 mois avec l acide zolédronique. Un «premier événement osseux» a été observé chez 341/950 patients (35,9%) dans le groupe dénosumab versus 386/951 (40,6%) dans le groupe acide zolédronique soit une baisse absolue de 4,7% sur un suivi de 41 mois. Le risque de développer un «premier événement osseux et les suivants» a été plus faible dans le groupe dénosumab que dans le groupe acide zolédronique (HR : 0,82 [0,71-0,94]) (tableau 2). Au total 494 événements osseux ont été rapportés dans le groupe dénosumab et 584 dans le groupe acide zolédronique. La survie globale (HR: 1,03 [0,91-1,17]) et le délai de progression de la maladie (HR: 1,06 [0,95-1,18]) ont été similaires dans les deux groupes. Tableau 2 : Résultats sur les critères d efficacité (population ITT) Critères Dénosumab vs. Acide Zolédronique p Critère de jugement principal Hazard Ratio du premier événement osseux (Test de non infériorité) 0,82 [0,71 ; 0,95] 0,0002 Critères de jugement secondaires Hazard Ratio du premier événement osseux (Test de supériorité) Hazard Ratio du premier événement osseux et des suivants (Test de supériorité) 0,82 [0,71 ; 0,95] 0,008 0,82 [0,71-0,94] 0, Etude : dans les tumeurs solides avancées (hors cancer du sein et de la prostate) ou le myélome multiple avec des métastases osseuses 3 Principaux critères d inclusion patients adultes avec cancer histologiquement ou cytologiquement confirmé incluant les tumeurs solides, le myélome multiple, le lymphome. présence ou antécédent d au moins une métastase osseuse statut ECOG inférieur ou égal à 2 clairance de la créatinine 30ml/min 3 Henry DH et al. Randomized, double-blind study of denosumab versus zoledronic acid in the treatment of bone metastases in patients with advanced cancer (excluding breast and prostate cancer) or multiple myeloma. J Clin Oncol Mar 20; 29(9): /14
8 Principaux critères de non inclusion traitement en cours ou antécédent de traitement par bisphosphonate par voie IV ou par voie orale ayant une indication dans le traitement des métastases osseuses métastases cérébrales radiothérapie osseuse ou chirurgie osseuse planifiée espérance de vie < 6 mois présence ou antécédent d ostéonécrose ou ostéomyélite de la mâchoire Caractéristiques des patients Parmi les patients inclus dans cette étude, 886 ont été randomisés dans le groupe dénosumab et 890 dans le groupe acide zolédronique. Les caractéristiques des patients à l inclusion étaient comparables. La proportion d hommes était de 588/886 (66%) dans le groupe dénosumab versus 552/890 (62%) dans le groupe acide zolédronique. L âge médian était de 60 ans versus 61 ans. Le cancer primitif était un cancer pulmonaire non à petites cellules chez 350 (39%) patients du groupe dénosumab versus 352 (40%) patients du groupe acide zolédronique, un myélome multiple chez 87 (10%) versus 93 (10%) patients. Les délais médians entre le diagnostic initial de cancer et la première métastase osseuse étaient de 2,1 mois dans le groupe dénosumab versus 2,9 mois dans le groupe acide zolédronique. Une chimiothérapie avait été réalisée chez 84% des patients, de façon similaire dans les deux groupes. Des métastases viscérales étaient présentes chez 474 (54%) versus 448 (50%) patients. Trois lésions métastatiques osseuses ou plus ont été objectivées chez 137 (15,5%) versus 144 (16,2%) patients. La proportion de patients ayant expérimenté une complication d une métastase osseuse (fracture, compression médullaire, chirurgie ou radiothérapie osseuse) avant l inclusion dans l étude était similaire dans les deux groupes (50%). Résultats L étude a été réalisée sur 34 mois pour atteindre le nombre d événements nécessaires. Dans le groupe acide zolédronique, un ajustement de posologie en raison d une fonction rénale altérée à l inclusion a été fait chez 152 (17,3%) patients. Chez 78 (8,9%) des patients du groupe traité par acide zolédronique, des perfusions n ont pas été réalisées à cause d une élévation de la créatinine plasmatique. Le dénosumab a été non inférieur à l acide zolédronique pour prévenir le premier événement osseux, sans que la supériorité n ait été démontrée : le HR a été de 0,84 [0,72 ; 1,00] (p=0,0011) dans la population per protocol (PP) et de 0,84 [0,71 ; 0,98] (p=0,0007) dans la population en ITT. Le délai médian de survenue du premier événement osseux a été de 20,6 mois avec le dénosumab versus 16,3 mois avec l acide zolédronique. Un «premier événement osseux» a été observé chez 278/886 patients (31,4%) dans le groupe dénosumab versus 323/890 (36,3%) dans le groupe acide zolédronique. Le risque de développer un «premier événement osseux et les suivants» a été similaire dans les deux groupes (HR : 0,90 [0,77-1,04]). Au total 392 événements osseux ont été rapportés dans le groupe dénosumab et 436 dans le groupe acide zolédronique. La survie globale (HR: 0,95 [0,83-1,08]) et le délai de progression de la maladie (HR: 1,00 [0,89-1,12]) ont été similaires dans les deux groupes. Une analyse post-hoc a suggéré une surmortalité chez les patients ayant un myélome multiple traité par dénosumab (23/87) par rapport à l acide zolédronique (13/93) Analyse regroupée des trois études de phase III Un regroupement des données d efficacité chez 5723 patients issues des 3 études de phase III a été effectué : 2862 dans le groupe dénosumab et 2861 dans le groupe acide zolédronique. Aucune interaction traitement-efficacité/étude sur le délai jusqu au premier 4 La prévention de complications osseuses chez les patients atteints d un myélome multiple n est pas une indication thérapeutique de XGEVA selon le libellé de l AMM européenne. 8/14
9 évènement osseux et le délai de survenue du premier évènement osseux et des événements osseux ultérieurs n a été mise en évidence. Au total, le dénosumab a été supérieur à l acide zolédronique pour retarder la survenue du premier événement osseux (HR : 0,83 [0,76 0,90]). Le délai médian du premier événement osseux a été de 27,7 mois dans le groupe dénosumab versus 19,4 mois dans le groupe acide zolédronique. Le risque du «premier événement osseux et des événements ultérieurs» a été plus faible dans le groupe dénosumab que dans le groupe acide zolédronique (HR : 0,82 [0,75-0,89]). Le dénosumab a été plus efficace que l acide zolédronique pour prévenir le risque de fracture pathologique et le recours à la radiothérapie osseuse. Les risques de compression médullaire et de recours à la chirurgie osseuse, qui sont des événements moins fréquents, n ont pas été significativement différents entre les deux groupes (figure 1). Figure 1 : Effets spécifiques du dénosumab versus acide zolédronique sur chacun des risques composant le critère «événement osseux». La Commission de la transparence souligne que la réalisation d une analyse regroupée des données permet de vérifier l homogénéité de la quantité d effet du dénosumab entre les trois essais, de vérifier l homogénéité de l effet du dénosumab sur les différents événements qui composent le critère de jugement principal, et d estimer une quantité d effet sur la population des trois essais. Cependant, la Commission rappelle que trois essais indépendants ont été réalisés. Trois démarches hypothético-déductives distinctes ont été suivies pour soumettre à l épreuve de la réfutation trois hypothèses distinctes. Seulement deux études ont démontré la supériorité du dénosumab par rapport à l acide zolédronique. Une étude des données regroupées ne saurait faire conclure dans une démarche fréquentiste à la supériorité du dénosumab sur l acide zolédronique dans chacune des populations étudiées, notamment dans la population de l étude où seule la non-infériorité a été démontrée Tolérance Données issues des études cliniques de phase III Dans le cadre des 3 études de phase III, 2841 patients ont été exposés au dénosumab utilisé comme traitement de support d une pathologie tumorale et 2836 patients à l acide zolédronique. L exposition au dénosumab a dépassé 2 ans chez 540 patients (19%), très rarement 3 ans (0,4%). 9/14
10 Le nombre de patients ayant eu un événement indésirable considéré comme lié à l utilisation du médicament a été de 827 (29,1%) dans le groupe dénosumab versus 940 (33,1%) dans le groupe acide zolédronique. Ces effets indésirables ont été graves chez 147 (5,2%) patients du groupe dénosumab versus 108 (3,8%) patients du groupe acide zolédronique. Ils ont conduits au décès chez 16 (0,6%) patients ayant reçu le dénosumab versus 10 (0,4%) patients ayant reçu l acide zolédronique. Un arrêt de traitement a été motivé par un événement indésirable chez 12,4 % des patients du groupe dénosumab et 13,1% des patients du groupe acide zolédronique. Les hypocalcémies (9,6% versus 5,0%) et les dyspnées (20,6% versus 17,9%) ont été plus souvent rapportées avec le dénosumab qu avec l acide zolédronique. A l inverse, il y a eu moins de fièvre (14,4% versus 19,8%), d anémie (27,1% versus 30,3%), de douleurs osseuses (19,9% versus 22,5%), de constipation (21,2% versus 23,6%), de douleurs articulaires (20,1% versus 22,3%) et de frissons (1,9% versus 4,1%) dans le groupe dénosumab que dans le groupe acide zolédronique. Ostéonécroses de la mâchoire : les patients à plus haut risque de développer cette complication n ont pas été inclus dans ces études de phase III. L incidence des ostéonécroses de la mâchoire a été de 52/2841 (1,8%) chez les patients traités par dénosumab et de 37/2836 (1,3%) chez ceux traités par l acide zolédronique. Cette différence n est pas statistiquement significative. L incidence des cas sévères de grade 3 a été similaire de 0,4% dans chaque bras. Tableau 13 : incidences des ostéonécroses de la mâchoire. Dénosumab Acide Zolédronique Etude (cancer du sein) 20/1020 (2,0%) 14/1013 (1,4%) Etude (cancer de la prostate) 22/943 (2,3%) 12/945 (0,8%) Etude (autres tumeurs et myélome multiple) 10/878 (1,1%) 11/878 (1,3%) Analyse des données groupées 52/2841 (1,8%) 37/2836 (1,3%) Infections : les incidences dans les deux groupes ont été similaires à l exception des infections staphylococciques plus fréquentes avec le dénosumab que l acide zolédronique (0,5% versus 0,2%). Toxicité rénale : il y a eu moins d événements indésirables rénaux avec le dénosumab que l acide zolédronique. Chez les patients avec une clairance de la créatinine > 60 ml/min, 7,6% des patients ont expérimenté un événement de néphrotoxicité versus 9,0% avec l acide zolédronique. Les proportions d insuffisance rénale apparue sous traitement ont été de 2,1% versus 2,7%. Chez les patients avec une clairance de la créatinine 60 ml/min, 16,9% des patients ont expérimenté un événement de néphrotoxicité avec le dénosumab versus 24,7% avec l acide zolédronique. Les proportions d insuffisance rénale apparue sous traitement ont été de 5,2% versus 8,1%. L insuffisance rénale sévère définie par une clairance de la créatinine 30 ml/min était un critère de non inclusion dans les trois études de phase III afin de respecter la clause d ambivalence 5. Les données de tolérance du dénosumab dans cette population sont limitées Plan de gestion des risques Le plan européen de gestion des risques prévoit, en complément de la pharmacovigilance de routine, la mise en place de questionnaire spécifique pour les risques identifiés que sont les 5 L'utilisation de l acide zolédronique n'est pas recommandée chez des patients ayant une atteinte rénale sévère. 10/14
11 hypocalcémies, les ostéonécroses de la mâchoire et les infections. En complément, un registre post-marketing des ostéonécroses de la mâchoire est prévu aux Etats-Unis, en Scandinavie (étude ) et dans plusieurs pays européens dont la France (étude ). Enfin, un dépistage des anticorps anti-dénosumab sera mis à disposition des médecins qui le demandent Conclusions sur les données cliniques Le dénosumab a été évalué dans trois études randomisées de phase III, réalisées en double aveugle versus l acide zolédronique respectivement dans le cancer du sein, dans le cancer de la prostate et dans le myélome multiple ou les autres tumeurs solides. Le critère de jugement principal «événement osseux» est un critère composite regroupant «la survenue d une fracture pathologique ou d une, compression médullaire ou la nécessité d une radiothérapie osseuse ou d une chirurgie osseuse». La non-infériorité devait d abord être établie puis en cas de non infériorité du dénosumab par rapport à l acide zolédronique la supériorité était testée. Dans les trois études, pour être inclus les patients devaient avoir au moins une métastase osseuse. Les critères de non inclusion étaient essentiellement liés à la sécurité d emploi des traitements (maladie bucco-dentaire et fonction rénale). Les patients devaient avoir une espérance de vie > 6 mois et un indice de performance < 3. Dans l étude chez 2046 patients ayant un cancer du sein, sur un suivi de 34 mois.le dénosumab a été supérieur à l acide zolédronique pour prévenir le premier événement osseux (HR 0,82 [0,71-0,95]). Le délai médian de survenue d un événement osseux a été de 26,4 mois dans le groupe acide zolédronique et n a pas été atteint dans le groupe dénosumab Dans l étude chez 1901 patients ayant un cancer de la prostate, le dénosumab a été supérieur à l acide zolédronique pour prévenir le premier événement osseux (HR 0,82 [0,71-0,95]). Le délai médian de survenue d un événement osseux a été de 17,1 mois dans le groupe acide zolédronique et 20,7 mois dans le groupe dénosumab. Dans l étude chez 1776 patients ayant une tumeur solide autre que mammaire et prostatique ou ayant un myélome multiple, le dénosumab a été non inférieur à l acide zolédronique pour prévenir le premier événement osseux (HR 0,84 [0,71-0,98]). Le délai médian de survenue d un événement osseux a été de 16,3 mois dans le groupe acide zolédronique et 20,6 mois dans le groupe dénosumab. Dans ces trois études, la survie globale et la durée de progression de la maladie ont été similaires dans les groupes dénosumab et acide zolédronique. Une analyse post-hoc a suggéré une surmortalité chez les patients ayant un myélome multiple traité par dénosumab (23/87) par rapport à l acide zolédronique (13/93). En conséquence, la prévention des complications osseuses chez les patients atteints d un myélome multiple ne fait pas partie de l indication thérapeutique de la spécialité. Des événements indésirables ont été rapportés chez 29,1% patients du groupe dénosumab et 33,1% dans le groupe acide zolédronique. Ils ont motivé l arrêt du médicament chez respectivement 12,4 % et 13,1% des patients. Les événements indésirables plus souvent rapportés avec le dénosumab qu avec l acide zolédronique ont été : hypocalcémie, dyspnée, ostéonécrose de la mâchoire, réaction d hypersensibilité. 11/14
12 4 CONCLUSIONS DE LA COMMISSION DE LA TRANSPARENCE 4.1. Service médical rendu Les complications osseuses (fracture pathologique, irradiation osseuse, compression médullaire ou chirurgie osseuse) chez les patients ayant des tumeurs solides avec métastases osseuses sont fréquentes, notamment dans le cancer du sein et le cancer de la prostate à des stades avancés. Ces complications peuvent lourdement affecter la qualité de vie des patients. Elles peuvent mettre en jeu le pronostic vital, notamment les compressions médullaires. La radiothérapie et la chirurgie osseuse peuvent être associées à un sur-risque de morbi-mortalité. XGEVA est un traitement préventif des complications osseuses chez les patients ayant une tumeur solide avec métastase osseuse. Le rapport efficacité/effets indésirables est important. Il s agit d un traitement de première intention. Intérêt de santé publique. Le fardeau de santé publique représenté par les patients relevant de l'indication (patients atteints de tumeurs solides avec métastases osseuses) peut être considéré comme important. Retarder, chez ces patients, les complications liées à la présence de métastases osseuses et réduire la douleur liée à l ostéolyse est un besoin de santé publique s inscrivant dans le cadre de priorités établies (Loi de santé publique 6, Plan cancer ). Au vu des données des essais cliniques, il est attendu de la spécialité XGEVA un impact faible en termes de morbidité par rapport aux traitements existants notamment au ZOMETA. La spécialité XGEVA devrait donc être en mesure d apporter une réponse supplémentaire au besoin de santé publique identifié. En conséquence, il est attendu un intérêt de santé publique pour cette spécialité dans cette indication. Cet intérêt est faible. Il existe des alternatives médicamenteuses. Le service médical rendu par XGEVA est important Amélioration du service médical rendu XGEVA apporte une amélioration du service médical rendu mineure (niveau IV) par rapport à l acide zolédronique, en termes d efficacité sur les complications osseuses des métastases chez les patients ayant un cancer du sein ou un cancer de la prostate avec des métastases osseuses. XGEVA n apporte pas d amélioration du service médical rendu (niveau V) par rapport à l acide zolédronique dans la prévention des complications osseuses chez les patients ayant d autres types de tumeurs solides avec des métastases osseuses. 6 Loi de Santé Publique 2004 : Loi n du 9 ao ût 2004 relative à la politique de Santé Publique : objectif 49 [rapport_drees_indicateurs - juillet 2005] 12/14
13 4.3. Place dans la stratégie thérapeutique Stratégie thérapeutique de référence : La prise en charge des métastases osseuses repose sur les traitements spécifiques de la tumeur primitive (cytotoxiques, thérapies ciblées), les traitements locaux par chirurgie et/ou radiothérapie (en cas de douleur osseuse non contrôlée par les antalgiques ou de métastase osseuse à haut risque fracturaire ou risque de compression médullaire) et les médicaments agissant spécifiquement sur la minéralisation (bisphosphonates). Les bisphosphonates sont indiqués en cas de métastase osseuse confirmée radiologiquement pour : traiter l hypercalcémie maligne et/ou la douleur prévenir les complications osseuses des métastases (fractures, compressions médullaires, nécessité de recourir à une chirurgie osseuse ou une radiothérapie osseuse). Les bisphosphonates les plus utilisés en pratique dans cette situation sont l acide zolédronique et l acide pamidronique administré en perfusion I.V. La durée de perfusion de 15 minutes environ nécessaire pour administrer l acide zolédronique le fait préférer à l acide pamidronique qui doit être administré sur au moins 2 heures. Une supplémentation calcique et en vitamine D doit être associée aux bisphosphonates. Il n existe pas de durée de traitement recommandée à ce jour. En cas d insuffisance rénale sévère, l acide zolédronique et l acide pamidronique n étant pas recommandés, le choix est l acide ibandronique administré à une posologie adaptée. Place du dénosumab 120 mg (XGEVA) dans la stratégie thérapeutique : XGEVA constitue une alternative aux bisphosphonates avec cependant une démonstration d un niveau d efficacité supérieur sur les complications osseuses des métastases du cancer du sein et de la prostate Population cible En 2010, l incidence des tumeurs solides a été de nouveaux cas, dont cancers de la prostate, cancers du sein et cancers du poumon 7. Cancer de la prostate Le stade métastatique est de l ordre de 20% dans le cancer de la prostate 8 soit cas. La proportion de patients ayant une localisation osseuse parmi l ensemble des patients au stade métastatique est estimée entre 63 et 79% (données Louis Harris 2007). L incidence des patients ayant un cancer de la prostate et relevant de l indication est estimée entre et patients. Cancer du sein Le stade métastatique d emblée représente 5% à 15% des cas, soit environ nouveaux cas et le stade métastatique après évolution locale représente 28% des cas, soit cas 9,10. La proportion de patients ayant une localisation osseuse parmi l ensemble des patients au stade métastatique est estimée entre 41 et 57% (données Louis Harris 2007). L incidence des patients ayant un cancer du sein et relevant de l indication est estimée entre et patients. 7 La situation du cancer en France en InCA. 8 Bauvin E, Soulie M, Menegoz F, Mace-Lesec'h J, Buemi A, Velten M, Villers A, Grosclaude P. Medical and nonmedical determinants of prostate cancer management: a population-based study. Eur J Cancer Nov;39(16): enquête FNCLCC 10 FRANCIM 13/14
14 Autres tumeurs solides, notamment cancer du poumon L incidence des patients ayant une tumeur solide, hors cancer du sein et prostate, et relevant de l indication est estimée à environ patients, dont sont des cancers du poumon (données Louis Harris 2007). Au total, la population cible du XGEVA est comprise entre et patients Recommandations de la commission de la transparence Avis favorable à l'inscription sur la liste des spécialités remboursables aux assurés sociaux et sur la liste des médicaments agréés à l'usage des collectivités et divers services publics dans l indication et à la posologie de l AMM Conditionnement : il est adapté aux conditions de prescription Taux de remboursement : 100 % 14/14
COMMISSION DE LA TRANSPARENCE. Avis. 23 mai 2007
 COMMISSION DE LA TRANSPARENCE Avis 23 mai 2007 SUTENT 12,5 mg, gélule Flacon de 30 (CIP: 376 265-0) SUTENT 25 mg, gélule Flacon de 30 (CIP: 376 266-7) SUTENT 50 mg, gélule Flacon de 30 (CIP: 376 267-3)
COMMISSION DE LA TRANSPARENCE Avis 23 mai 2007 SUTENT 12,5 mg, gélule Flacon de 30 (CIP: 376 265-0) SUTENT 25 mg, gélule Flacon de 30 (CIP: 376 266-7) SUTENT 50 mg, gélule Flacon de 30 (CIP: 376 267-3)
INTERFERON Traitement adjuvant du mélanome à haut risque de récidive. Dr Ingrid KUPFER-BESSAGUET Dermatologue CH de quimper
 INTERFERON Traitement adjuvant du mélanome à haut risque de récidive Dr Ingrid KUPFER-BESSAGUET Dermatologue CH de quimper Pourquoi proposer un TTT adjuvant? Probabilité de survie à 10 ans en fonction
INTERFERON Traitement adjuvant du mélanome à haut risque de récidive Dr Ingrid KUPFER-BESSAGUET Dermatologue CH de quimper Pourquoi proposer un TTT adjuvant? Probabilité de survie à 10 ans en fonction
COMMISSION DE LA TRANSPARENCE AVIS. 4 novembre 2009
 COMMISSION DE LA TRANSPARENCE AVIS 4 novembre 2009 IRESSA 250 mg, comprimé pelliculé Boîte de 30 (CIP 395 950-7) ASTRAZENECA géfitinib Liste I Médicament soumis à prescription hospitalière. Prescription
COMMISSION DE LA TRANSPARENCE AVIS 4 novembre 2009 IRESSA 250 mg, comprimé pelliculé Boîte de 30 (CIP 395 950-7) ASTRAZENECA géfitinib Liste I Médicament soumis à prescription hospitalière. Prescription
CLINIMIX AVIS DE LA COMMISSION DE LA TRANSPARENCE
 CLINIMIX AVIS DE LA COMMISSION DE LA TRANSPARENCE BAXTER_CLINIMIX N9G15 E et N12G20E_Avis CT_14-02-2007.pdf BAXTER_CLINIMIX N9G15E N12G20E N14G30 N17G35_Avis CT_12-12-2001.pdf BAXTER_CLINIMIX changement
CLINIMIX AVIS DE LA COMMISSION DE LA TRANSPARENCE BAXTER_CLINIMIX N9G15 E et N12G20E_Avis CT_14-02-2007.pdf BAXTER_CLINIMIX N9G15E N12G20E N14G30 N17G35_Avis CT_12-12-2001.pdf BAXTER_CLINIMIX changement
NAVELBINE voie orale
 DENOMINATION DU MEDICAMENT & FORME PHARMACEUTIQUE NAVELBINE voie orale CARACTERISTIQUES Dénomination commune : vinorelbine Composition qualitative et quantitative : Statut : A.M.M. A.T.U. Classe ATC :
DENOMINATION DU MEDICAMENT & FORME PHARMACEUTIQUE NAVELBINE voie orale CARACTERISTIQUES Dénomination commune : vinorelbine Composition qualitative et quantitative : Statut : A.M.M. A.T.U. Classe ATC :
Avis 29 mai 2013. XYZALL 5 mg, comprimé B/14 (CIP : 34009 358 502 4-9) B/28 (CIP : 34009 358 505 3-9) Laboratoire UCB PHARMA SA.
 COMMISSION DE LA TRANSPARENCE Avis 29 mai 2013 XYZALL 5 mg, comprimé B/14 (CIP : 34009 358 502 4-9) B/28 (CIP : 34009 358 505 3-9) Laboratoire UCB PHARMA SA DCI Code ATC (2012) Motif de l examen Liste
COMMISSION DE LA TRANSPARENCE Avis 29 mai 2013 XYZALL 5 mg, comprimé B/14 (CIP : 34009 358 502 4-9) B/28 (CIP : 34009 358 505 3-9) Laboratoire UCB PHARMA SA DCI Code ATC (2012) Motif de l examen Liste
COMMISSION DE LA TRANSPARENCE AVIS. 18 janvier 2006
 COMMISSION DE LA TRANSPARENCE AVIS 18 janvier 2006 ADVATE 1500 UI, poudre et solvant pour solution injectable 1 flacon(s) en verre de 1 500 UI - 1 flacon(s) en verre de 5 ml avec matériel(s) de perfusion(s)
COMMISSION DE LA TRANSPARENCE AVIS 18 janvier 2006 ADVATE 1500 UI, poudre et solvant pour solution injectable 1 flacon(s) en verre de 1 500 UI - 1 flacon(s) en verre de 5 ml avec matériel(s) de perfusion(s)
Les nouveaux anticoagulants oraux (NAC)
 Les nouveaux anticoagulants oraux (NAC) Dr Jean-Marie Vailloud Cardiologue libéral/ salarié (CHU/clinique) Pas de lien d'intérêt avec une entreprise pharmaceutique Adhérent à l'association Mieux Prescrire
Les nouveaux anticoagulants oraux (NAC) Dr Jean-Marie Vailloud Cardiologue libéral/ salarié (CHU/clinique) Pas de lien d'intérêt avec une entreprise pharmaceutique Adhérent à l'association Mieux Prescrire
COMMISSION DE LA TRANSPARENCE. Avis. 10 mars 2010
 COMMISSION DE LA TRANSPARENCE Avis 10 mars 2010 ARIXTRA 1,5 mg/0,3 ml, solution injectable en seringue pré-remplie - Boîte de 2 (CIP : 363 500-6) - Boîte de 7 (CIP : 363 501-2) - Boîte de 10 (CIP : 564
COMMISSION DE LA TRANSPARENCE Avis 10 mars 2010 ARIXTRA 1,5 mg/0,3 ml, solution injectable en seringue pré-remplie - Boîte de 2 (CIP : 363 500-6) - Boîte de 7 (CIP : 363 501-2) - Boîte de 10 (CIP : 564
COMMISSION DE LA TRANSPARENCE
 COMMISSION DE LA TRANSPARENCE Avis 2 avril 2014 DERMOVAL, gel flacon de 20 ml (CIP : 34009 326 130 4 5) DERMOVAL 0,05 POUR CENT, crème tube de 10 g (CIP : 34009 320 432 9 3) Laboratoire GLAXOSMITHKLINE
COMMISSION DE LA TRANSPARENCE Avis 2 avril 2014 DERMOVAL, gel flacon de 20 ml (CIP : 34009 326 130 4 5) DERMOVAL 0,05 POUR CENT, crème tube de 10 g (CIP : 34009 320 432 9 3) Laboratoire GLAXOSMITHKLINE
COMMISSION DE LA TRANSPARENCE AVIS. 10 mai 2006
 COMMISSION DE LA TRANSPARENCE AVIS 10 mai 2006 METOJECT 10 mg/ml, solution injectable en seringue pré-remplie 1 seringue pré-remplie en verre de 0,75 ml avec aiguille : 371 754-3 1 seringue pré- remplie
COMMISSION DE LA TRANSPARENCE AVIS 10 mai 2006 METOJECT 10 mg/ml, solution injectable en seringue pré-remplie 1 seringue pré-remplie en verre de 0,75 ml avec aiguille : 371 754-3 1 seringue pré- remplie
Le RIVAROXABAN (XARELTO ) dans l embolie pulmonaire
 Le RIVAROXABAN (XARELTO ) dans l embolie pulmonaire Dr Florence Parent Service de Pneumologie et Soins Intensifs de Pneumologie Hôpital Bicêtre, AP-HP Inserm U999. Université Paris-Sud Traitement anticoagulant
Le RIVAROXABAN (XARELTO ) dans l embolie pulmonaire Dr Florence Parent Service de Pneumologie et Soins Intensifs de Pneumologie Hôpital Bicêtre, AP-HP Inserm U999. Université Paris-Sud Traitement anticoagulant
COMMISSION DE LA TRANSPARENCE. Avis. 3 septembre 2008
 COMMISSION DE LA TRANSPARENCE Avis 3 septembre 2008 PRIVIGEN 100 mg/ml, solution pour perfusion Flacon en verre de 50 ml (CIP: 572 790-7 Flacon en verre de 100 ml (CIP: 572 791-3) Flacon en verre de 200
COMMISSION DE LA TRANSPARENCE Avis 3 septembre 2008 PRIVIGEN 100 mg/ml, solution pour perfusion Flacon en verre de 50 ml (CIP: 572 790-7 Flacon en verre de 100 ml (CIP: 572 791-3) Flacon en verre de 200
Assurance Maladie Obligatoire Commission de la Transparence des médicaments. Avis 2 23 Octobre 2012
 Assurance Maladie Obligatoire Commission de la Transparence des médicaments Avis 2 23 Octobre 2012 Titre I : Nom du médicament, DCI, forme pharmaceutique, dosage, présentation HUMIRA (DCI : Adalimumab
Assurance Maladie Obligatoire Commission de la Transparence des médicaments Avis 2 23 Octobre 2012 Titre I : Nom du médicament, DCI, forme pharmaceutique, dosage, présentation HUMIRA (DCI : Adalimumab
COMMISSION DE LA TRANSPARENCE AVIS DE LA COMMISSION. 10 octobre 2001
 COMMISSION DE LA TRANSPARENCE AVIS DE LA COMMISSION 10 octobre 2001 VIRAFERONPEG 50 µg 80 µg 100 µg 120 µg 150 µg, poudre et solvant pour solution injectable B/1 B/4 Laboratoires SCHERING PLOUGH Peginterféron
COMMISSION DE LA TRANSPARENCE AVIS DE LA COMMISSION 10 octobre 2001 VIRAFERONPEG 50 µg 80 µg 100 µg 120 µg 150 µg, poudre et solvant pour solution injectable B/1 B/4 Laboratoires SCHERING PLOUGH Peginterféron
Traitement de l hépatite C: données récentes
 Traitement de l hépatite C: données récentes J.-P. BRONOWICKI (Vandœuvre-lès-Nancy) Tirés à part : Jean-Pierre Bronowicki Service d Hépatogastroentérologie, CHU de Nancy, 54500 Vandœuvre-lès-Nancy. Le
Traitement de l hépatite C: données récentes J.-P. BRONOWICKI (Vandœuvre-lès-Nancy) Tirés à part : Jean-Pierre Bronowicki Service d Hépatogastroentérologie, CHU de Nancy, 54500 Vandœuvre-lès-Nancy. Le
Validation clinique des marqueurs prédictifs le point de vue du méthodologiste. Michel Cucherat UMR CNRS 5558 - Lyon
 Validation clinique des marqueurs prédictifs le point de vue du méthodologiste Michel Cucherat UMR CNRS 5558 - Lyon Marqueur prédictif - Définition Un marqueur prédictif est un marqueur qui prédit le bénéfice
Validation clinique des marqueurs prédictifs le point de vue du méthodologiste Michel Cucherat UMR CNRS 5558 - Lyon Marqueur prédictif - Définition Un marqueur prédictif est un marqueur qui prédit le bénéfice
ALK et cancers broncho-pulmonaires. Laurence Bigay-Gamé Unité d oncologie thoracique Hôpital Larrey, Toulouse
 ALK et cancers broncho-pulmonaires Laurence Bigay-Gamé Unité d oncologie thoracique Hôpital Larrey, Toulouse Toulouse, le 19 Février 2013 Adénocarcinomes : Lung Cancer Mutation Consortium Identification
ALK et cancers broncho-pulmonaires Laurence Bigay-Gamé Unité d oncologie thoracique Hôpital Larrey, Toulouse Toulouse, le 19 Février 2013 Adénocarcinomes : Lung Cancer Mutation Consortium Identification
COMMISSION DE LA TRANSPARENCE AVIS. 14 mars 2012
 COMMISSION DE LA TRANSPARENCE AVIS 14 mars 2012 XARELTO 15 mg, comprimés pelliculés B/14 (CIP: 34009 219 225 1 6) B/28 (CIP: 34009 219 226 8 4) B/42 (CIP: 34009 219 227 4 5) B/10 (CIP: 34009 219 228 0
COMMISSION DE LA TRANSPARENCE AVIS 14 mars 2012 XARELTO 15 mg, comprimés pelliculés B/14 (CIP: 34009 219 225 1 6) B/28 (CIP: 34009 219 226 8 4) B/42 (CIP: 34009 219 227 4 5) B/10 (CIP: 34009 219 228 0
Hémostase et Endocardite Surveillance des anticoagulants. Docteur Christine BOITEUX
 Hémostase et Endocardite Surveillance des anticoagulants Docteur Christine BOITEUX Théorie Endocardites et anticoagulation POUR Thromboses Emboles septiques CONTRE Favorise emboles septiques et diffusion
Hémostase et Endocardite Surveillance des anticoagulants Docteur Christine BOITEUX Théorie Endocardites et anticoagulation POUR Thromboses Emboles septiques CONTRE Favorise emboles septiques et diffusion
COMMISSION DE LA TRANSPARENCE AVIS. 1 er octobre 2008
 COMMISSION DE LA TRANSPARENCE AVIS 1 er octobre 2008 Examen dans le cadre de la réévaluation du service médical rendu de la classe des IMAO B, en application de l article R 163-21 du code de la sécurité
COMMISSION DE LA TRANSPARENCE AVIS 1 er octobre 2008 Examen dans le cadre de la réévaluation du service médical rendu de la classe des IMAO B, en application de l article R 163-21 du code de la sécurité
Avis 17 octobre 2012
 COMMISSION DE LA TRANSPARENCE Avis 17 octobre 2012 BETESIL 2,25 mg, emplâtre médicamenteux Boite de 8 emplâtres médicamenteux en sachets (CIP : 34009 377 977 4 0) Laboratoire GENEVRIER DCI Code ATC (2012)
COMMISSION DE LA TRANSPARENCE Avis 17 octobre 2012 BETESIL 2,25 mg, emplâtre médicamenteux Boite de 8 emplâtres médicamenteux en sachets (CIP : 34009 377 977 4 0) Laboratoire GENEVRIER DCI Code ATC (2012)
Item 169 : Évaluation thérapeutique et niveau de preuve
 Item 169 : Évaluation thérapeutique et niveau de preuve COFER, Collège Français des Enseignants en Rhumatologie Date de création du document 2010-2011 Table des matières ENC :...3 SPECIFIQUE :...3 I Différentes
Item 169 : Évaluation thérapeutique et niveau de preuve COFER, Collège Français des Enseignants en Rhumatologie Date de création du document 2010-2011 Table des matières ENC :...3 SPECIFIQUE :...3 I Différentes
Prévention osseuse dans le traitement du cancer de la prostate
 73 Volume 1 - Février 11 - Supplément 1 Progrès en urologie (11) 1, supplément, S5-S Journées d Onco-Urologie Médicale : La pratique, les protocoles 5 et juin 1 ISSN 11-77 Prévention osseuse dans le traitement
73 Volume 1 - Février 11 - Supplément 1 Progrès en urologie (11) 1, supplément, S5-S Journées d Onco-Urologie Médicale : La pratique, les protocoles 5 et juin 1 ISSN 11-77 Prévention osseuse dans le traitement
LES NOUVEAUX ANTICOAGULANTS
 LES NOUVEAUX ANTICOAGULANTS Pr. Alessandra Bura-Rivière, Service de Médecine Vasculaire Hôpital Rangueil, 1 avenue Jean Poulhès, 31059 Toulouse cedex 9 INTRODUCTION Depuis plus de cinquante ans, les héparines
LES NOUVEAUX ANTICOAGULANTS Pr. Alessandra Bura-Rivière, Service de Médecine Vasculaire Hôpital Rangueil, 1 avenue Jean Poulhès, 31059 Toulouse cedex 9 INTRODUCTION Depuis plus de cinquante ans, les héparines
Pemetrexed, pionnier de la chimiothérapie histoguidée. Dr Olivier CASTELNAU Institut Arnault TZANCK ST Laurent du Var
 Pemetrexed, pionnier de la chimiothérapie histoguidée Dr Olivier CASTELNAU Institut Arnault TZANCK ST Laurent du Var SFPO Octobre 2009 EPIDEMIOLOGIE Incidence : 1.35 M par an dans le monde (12,4%) 28 000
Pemetrexed, pionnier de la chimiothérapie histoguidée Dr Olivier CASTELNAU Institut Arnault TZANCK ST Laurent du Var SFPO Octobre 2009 EPIDEMIOLOGIE Incidence : 1.35 M par an dans le monde (12,4%) 28 000
Cancer bronchique primitif: données épidémiologiques récentes
 Cancer bronchique primitif: données épidémiologiques récentes Pr Jean Trédaniel Service de pneumologie et oncologie thoracique Groupe Hospitalier Paris Saint Joseph Université Paris Descartes Sources Données
Cancer bronchique primitif: données épidémiologiques récentes Pr Jean Trédaniel Service de pneumologie et oncologie thoracique Groupe Hospitalier Paris Saint Joseph Université Paris Descartes Sources Données
Création de procédures inter-services pour la gestion des essais de phase I à l Institut Gustave Roussy
 Création de procédures inter-services pour la gestion des essais de phase I à l Institut Gustave Roussy A.A. MOUSSA D. SCHWOB Institut de cancérologie Gustave-Roussy 94805 Villejuif cedex - FRANCE Plan
Création de procédures inter-services pour la gestion des essais de phase I à l Institut Gustave Roussy A.A. MOUSSA D. SCHWOB Institut de cancérologie Gustave-Roussy 94805 Villejuif cedex - FRANCE Plan
Avis 23 avril 2014. BARITEKAL 20 mg/ml, solution injectable Boîte de 10 ampoules de 5 ml (CIP : 34009 585 896 3 8) Laboratoire NORDIC PHARMA
 COMMISSION DE LA TRANSPARENCE Avis 23 avril 2014 BARITEKAL 20 mg/ml, solution injectable Boîte de 10 ampoules de 5 ml (CIP : 34009 585 896 3 8) Laboratoire NORDIC PHARMA DCI Code ATC (2012) Motif de l
COMMISSION DE LA TRANSPARENCE Avis 23 avril 2014 BARITEKAL 20 mg/ml, solution injectable Boîte de 10 ampoules de 5 ml (CIP : 34009 585 896 3 8) Laboratoire NORDIC PHARMA DCI Code ATC (2012) Motif de l
Avis 15 mai 2013. B01AX05 (Antithrombotique). Inhibiteur sélectif indirect du facteur Xa
 COMMISSION DE LA TRANSPARENCE Avis 15 mai 2013 L avis adopté par la Commission de la Transparence le 23 janvier 2013 a fait l objet d une audition le 17 avril 2013 et d un examen des observations du laboratoire
COMMISSION DE LA TRANSPARENCE Avis 15 mai 2013 L avis adopté par la Commission de la Transparence le 23 janvier 2013 a fait l objet d une audition le 17 avril 2013 et d un examen des observations du laboratoire
Les soins infirmiers en oncologie : une carrière faite pour vous! Nom de la Présentatrice et section de l'acio
 Les soins infirmiers en oncologie : une carrière faite pour vous! Nom de la Présentatrice et section de l'acio Grandes lignes Pourquoi les soins en cancérologie sont-ils un enjeu de santé important? Les
Les soins infirmiers en oncologie : une carrière faite pour vous! Nom de la Présentatrice et section de l'acio Grandes lignes Pourquoi les soins en cancérologie sont-ils un enjeu de santé important? Les
Les renseignements suivants sont destinés uniquement aux personnes qui ont reçu un diagnostic de cancer
 Information importante pour les personnes atteintes d un cancer du poumon non à petites cellules de stade avancé Les renseignements suivants sont destinés uniquement aux personnes qui ont reçu un diagnostic
Information importante pour les personnes atteintes d un cancer du poumon non à petites cellules de stade avancé Les renseignements suivants sont destinés uniquement aux personnes qui ont reçu un diagnostic
COMMISSION DE LA TRANSPARENCE. AVIS 1 er février 2012
 COMMISSION DE LA TRANSPARENCE AVIS 1 er février 2012 Le projet d avis adopté par la Commission de la Transparence le 16 novembre 2011 a fait l objet d une audition le 1 février 2012 XEPLION 25 mg, suspension
COMMISSION DE LA TRANSPARENCE AVIS 1 er février 2012 Le projet d avis adopté par la Commission de la Transparence le 16 novembre 2011 a fait l objet d une audition le 1 février 2012 XEPLION 25 mg, suspension
Observation. Merci à l équipe de pharmaciens FormUtip iatro pour ce cas
 Cas clinique M. ZAC Observation Mr ZAC ans, 76 ans, 52 kg, est admis aux urgences pour des algies fessières invalidantes, résistantes au AINS. Ses principaux antécédents sont les suivants : une thrombopénie
Cas clinique M. ZAC Observation Mr ZAC ans, 76 ans, 52 kg, est admis aux urgences pour des algies fessières invalidantes, résistantes au AINS. Ses principaux antécédents sont les suivants : une thrombopénie
E04a - Héparines de bas poids moléculaire
 E04a - 1 E04a - Héparines de bas poids moléculaire Les héparines de bas poids moléculaire (HBPM) sont un mélange inhomogène de chaînes polysaccharidiques obtenues par fractionnement chimique ou enzymatique
E04a - 1 E04a - Héparines de bas poids moléculaire Les héparines de bas poids moléculaire (HBPM) sont un mélange inhomogène de chaînes polysaccharidiques obtenues par fractionnement chimique ou enzymatique
Ordonnance collective
 Centre de Santé et de Services sociaux de Québec-Nord NUMÉRO DE L ORDONNANCE: OC-31 Ordonnance collective Nom de l ordonnance: Initier des analyses de laboratoire pour le suivi de la clientèle présentant
Centre de Santé et de Services sociaux de Québec-Nord NUMÉRO DE L ORDONNANCE: OC-31 Ordonnance collective Nom de l ordonnance: Initier des analyses de laboratoire pour le suivi de la clientèle présentant
COMMISSION DE LA TRANSPARENCE AVIS. 7 janvier 2009
 COMMISSION DE LA TRANSPARENCE AVIS 7 janvier 2009 ZANEXTRA 20 mg/10 mg, comprimés pelliculés B/30, code CIP : 385 967.4 B/90, code CIP : 387 392.9 Laboratoires BOUCHARA RECORDATI Enalapril/Lercanidipine
COMMISSION DE LA TRANSPARENCE AVIS 7 janvier 2009 ZANEXTRA 20 mg/10 mg, comprimés pelliculés B/30, code CIP : 385 967.4 B/90, code CIP : 387 392.9 Laboratoires BOUCHARA RECORDATI Enalapril/Lercanidipine
Qu est-ce qu un sarcome?
 Qu est-ce qu un sarcome? Qu est-ce qu une tumeur? Une tumeur est une prolifération anormale de cellules. Les tumeurs ne devraient donc pas automatiquement être associées à un cancer. Certaines tumeurs
Qu est-ce qu un sarcome? Qu est-ce qu une tumeur? Une tumeur est une prolifération anormale de cellules. Les tumeurs ne devraient donc pas automatiquement être associées à un cancer. Certaines tumeurs
ESMO 14. L oncogériatrie d un coup d éventail! Dr Elisabeth Carola UCOG Picardie
 ESMO 14 L oncogériatrie d un coup d éventail! Dr Elisabeth Carola UCOG Picardie Cancer du SEIN Taxotere hebdo pas mieux et plus toxique Perrone F et al Ann Oncol 2014 Phase III : CMF vs Taxotere hebdo
ESMO 14 L oncogériatrie d un coup d éventail! Dr Elisabeth Carola UCOG Picardie Cancer du SEIN Taxotere hebdo pas mieux et plus toxique Perrone F et al Ann Oncol 2014 Phase III : CMF vs Taxotere hebdo
Cas clinique 2. Florence JOLY, Caen François IBORRA, Montpellier
 Cas clinique 2 Florence JOLY, Caen François IBORRA, Montpellier Cas clinique Patient de 60 ans, ATCD: HTA, IDM en 2007, hypercholestérolémie Juin 2008: Toux, dyspnée (sous 02) et anorexie progressive Bilan
Cas clinique 2 Florence JOLY, Caen François IBORRA, Montpellier Cas clinique Patient de 60 ans, ATCD: HTA, IDM en 2007, hypercholestérolémie Juin 2008: Toux, dyspnée (sous 02) et anorexie progressive Bilan
Rapport sur les nouveaux médicaments brevetés Iressa
 Rapport sur les nouveaux médicaments brevetés Iressa Au titre de son initiative de transparence, le CEPMB publie les résultats des examens des prix des nouveaux médicaments brevetés effectués par les membres
Rapport sur les nouveaux médicaments brevetés Iressa Au titre de son initiative de transparence, le CEPMB publie les résultats des examens des prix des nouveaux médicaments brevetés effectués par les membres
Pharmacologie des «nouveaux» anticoagulants oraux
 Pharmacologie des «nouveaux» anticoagulants oraux Apixaban, Dabigatran, Rivaroxaban Pr D. DEPLANQUE Département de Pharmacologie médicale EA 1046 et CIC 9301 INSERM-CHRU, Institut de Médecine Prédictive
Pharmacologie des «nouveaux» anticoagulants oraux Apixaban, Dabigatran, Rivaroxaban Pr D. DEPLANQUE Département de Pharmacologie médicale EA 1046 et CIC 9301 INSERM-CHRU, Institut de Médecine Prédictive
Spondylarthropathies : diagnostic, place des anti-tnf et surveillance par le généraliste. Pr P. Claudepierre CHU Henri Mondor - Créteil
 Spondylarthropathies : diagnostic, place des anti-tnf et surveillance par le généraliste Pr P. Claudepierre CHU Henri Mondor - Créteil Le Diagnostic Objectif de la démarche diagnostique Diagnostic de SPONDYLARTHROPATHIE
Spondylarthropathies : diagnostic, place des anti-tnf et surveillance par le généraliste Pr P. Claudepierre CHU Henri Mondor - Créteil Le Diagnostic Objectif de la démarche diagnostique Diagnostic de SPONDYLARTHROPATHIE
Evaluer le risque fracturaire: l outil FRAX (Fracture Risk Assessment Tool)
 Evaluer le risque fracturaire: l outil FRAX (Fracture Risk Assessment Tool) F. FLAISLER Service de Rhumatologie Groupe Hospitalo-Universitaire CAREMEAU, Nîmes OSTÉOPOROSE DEFINITION AFSSAPS «Maladie diffuse
Evaluer le risque fracturaire: l outil FRAX (Fracture Risk Assessment Tool) F. FLAISLER Service de Rhumatologie Groupe Hospitalo-Universitaire CAREMEAU, Nîmes OSTÉOPOROSE DEFINITION AFSSAPS «Maladie diffuse
Votre guide des définitions des maladies graves de l Assurance maladies graves express
 Votre guide des définitions des maladies graves de l Assurance maladies graves express Votre guide des définitions des maladies graves de l Assurance maladies graves express Ce guide des définitions des
Votre guide des définitions des maladies graves de l Assurance maladies graves express Votre guide des définitions des maladies graves de l Assurance maladies graves express Ce guide des définitions des
Pierre OLIVIER - Médecine Nucléaire
 Diplôme Universitaire Corrélations anatomo-physio-pathologiques en imagerie thoracique 25 mai 2011 Imagerie TEP et pathologie tumorale bronchique Pierre OLIVIER - Médecine Nucléaire Détection en coincidence
Diplôme Universitaire Corrélations anatomo-physio-pathologiques en imagerie thoracique 25 mai 2011 Imagerie TEP et pathologie tumorale bronchique Pierre OLIVIER - Médecine Nucléaire Détection en coincidence
COMMISSION DE LA TRANSPARENCE. 10 décembre 2008
 COMMISSION DE LA TRANSPARENCE AVIS 10 décembre 2008 VIRAFERONPEG 50 µg/ 0.5 ml, poudre et solvant pour solution injectable B/1 : code CIP 355 189.3 B/4 : code CIP 355 191.8 VIRAFERONPEG, stylo pré-rempli
COMMISSION DE LA TRANSPARENCE AVIS 10 décembre 2008 VIRAFERONPEG 50 µg/ 0.5 ml, poudre et solvant pour solution injectable B/1 : code CIP 355 189.3 B/4 : code CIP 355 191.8 VIRAFERONPEG, stylo pré-rempli
Plan. Introduction. Les Nouveaux Anticoagulants Oraux et le sujet âgé. Audit de prescription au Centre Hospitalier Geriatrique du Mont d Or
 Plan Introduction Les Nouveaux Anticoagulants Oraux et le sujet âgé Audit de prescription au Centre Hospitalier Geriatrique du Mont d Or Introduction NACO: une actualité brûlante! AVK: Plus forte incidence
Plan Introduction Les Nouveaux Anticoagulants Oraux et le sujet âgé Audit de prescription au Centre Hospitalier Geriatrique du Mont d Or Introduction NACO: une actualité brûlante! AVK: Plus forte incidence
Essais cliniques de phase 0 : état de la littérature 2006-2009
 17 èmes Journées des Statisticiens des Centres de Lutte contre le Cancer 4 ème Conférence Francophone d Epidémiologie Clinique Essais cliniques de phase 0 : état de la littérature 2006-2009 Q Picat, N
17 èmes Journées des Statisticiens des Centres de Lutte contre le Cancer 4 ème Conférence Francophone d Epidémiologie Clinique Essais cliniques de phase 0 : état de la littérature 2006-2009 Q Picat, N
27 ème JOURNEE SPORT ET MEDECINE Dr Roukos ABI KHALIL Digne Les Bains 23 novembre 2013
 27 ème JOURNEE SPORT ET MEDECINE Dr Roukos ABI KHALIL Digne Les Bains 23 novembre 2013 Les Nouveaux Anticoagulants Oraux (NACO) dans la maladie thrombo embolique veineuse INTRODUCTION Thrombose veineuse
27 ème JOURNEE SPORT ET MEDECINE Dr Roukos ABI KHALIL Digne Les Bains 23 novembre 2013 Les Nouveaux Anticoagulants Oraux (NACO) dans la maladie thrombo embolique veineuse INTRODUCTION Thrombose veineuse
Avis 6 novembre 2013
 COMMISSION DE LA TRANSPARENCE Avis 6 novembre 2013 ISENTRESS, comprimé à croquer 25 mg Flacon de 60 comprimés (CIP : 3400926992408) ISENTRESS, comprimé à croquer sécable 100 mg Flacon de 60 comprimés (CIP
COMMISSION DE LA TRANSPARENCE Avis 6 novembre 2013 ISENTRESS, comprimé à croquer 25 mg Flacon de 60 comprimés (CIP : 3400926992408) ISENTRESS, comprimé à croquer sécable 100 mg Flacon de 60 comprimés (CIP
Essais précoces non comparatifs : principes et calcul du nombre de sujets nécessaire
 Essais précoces non comparatifs : principes et calcul du nombre de sujets nécessaire Sylvie CHABAUD Direction de la Recherche Clinique et de l Innovation : Centre Léon Bérard - Lyon Unité de Biostatistique
Essais précoces non comparatifs : principes et calcul du nombre de sujets nécessaire Sylvie CHABAUD Direction de la Recherche Clinique et de l Innovation : Centre Léon Bérard - Lyon Unité de Biostatistique
ANEMIE ET THROMBOPENIE CHEZ LES PATIENTS ATTEINTS D UN CANCER
 ANEMIE ET THROMBOPENIE CHEZ LES PATIENTS ATTEINTS D UN CANCER Dr Michael Hummelsberger, Pr Jean-Gabriel Fuzibet, Service de Médecine Interne, Hôpital l Archet, CHU Nice 1. ANEMIE L étiologie de l anémie
ANEMIE ET THROMBOPENIE CHEZ LES PATIENTS ATTEINTS D UN CANCER Dr Michael Hummelsberger, Pr Jean-Gabriel Fuzibet, Service de Médecine Interne, Hôpital l Archet, CHU Nice 1. ANEMIE L étiologie de l anémie
COMMISSION DE LA TRANSPARENCE AVIS. 14 mars 2012
 COMMISSION DE LA TRANSPARENCE AVIS 14 mars 2012 XARELTO 15 mg, comprimés pelliculés B/14 (CIP: 34009 219 225 1 6) B/28 (CIP: 34009 219 226 8 4) B/42 (CIP: 34009 219 227 4 5) B/10 (CIP: 34009 219 228 0
COMMISSION DE LA TRANSPARENCE AVIS 14 mars 2012 XARELTO 15 mg, comprimés pelliculés B/14 (CIP: 34009 219 225 1 6) B/28 (CIP: 34009 219 226 8 4) B/42 (CIP: 34009 219 227 4 5) B/10 (CIP: 34009 219 228 0
COMMISSION DE LA TRANSPARENCE AVIS. 23 mai 2012
 COMMISSION DE LA TRANSPARENCE AVIS 23 mai 2012 SEGLOR 5 mg, gélule B/30 (CIP: 321 899-8) SEGLOR LYOC 5 mg, lyophilisat oral B/30 (CIP: 334 062-4) Laboratoire UCB PHARMA dihydroergotamine (mésilate de)
COMMISSION DE LA TRANSPARENCE AVIS 23 mai 2012 SEGLOR 5 mg, gélule B/30 (CIP: 321 899-8) SEGLOR LYOC 5 mg, lyophilisat oral B/30 (CIP: 334 062-4) Laboratoire UCB PHARMA dihydroergotamine (mésilate de)
Nouveaux anticoagulants oraux : aspects pratiques
 Nouveaux anticoagulants oraux : aspects pratiques Christelle MARQUIE CHRU de Lille Clinique de Cardiologie L i l l e 2 Université du Droit et de la Santé Les NOAG: QCM 1. ont les mêmes indications que
Nouveaux anticoagulants oraux : aspects pratiques Christelle MARQUIE CHRU de Lille Clinique de Cardiologie L i l l e 2 Université du Droit et de la Santé Les NOAG: QCM 1. ont les mêmes indications que
COMMISSION DE LA TRANSPARENCE AVIS. 18 novembre 2009
 COMMISSION DE LA TRANSPARENCE AVIS 18 novembre 2009 LEDERTREXATE 5 mg, solution injectable B/1 ampoule de 2 ml (Code CIP : 315 012-5) LEDERTREXATE 25 mg, solution injectable B/1 ampoule de 1 ml (Code CIP
COMMISSION DE LA TRANSPARENCE AVIS 18 novembre 2009 LEDERTREXATE 5 mg, solution injectable B/1 ampoule de 2 ml (Code CIP : 315 012-5) LEDERTREXATE 25 mg, solution injectable B/1 ampoule de 1 ml (Code CIP
COMMISSION DE LA TRANSPARENCE AVIS. 19 octobre 2011
 COMMISSION DE LA TRANSPARENCE AVIS 19 octobre 2011 PEDIAVEN AP-HP G15, solution pour perfusion 1000 ml de solution en poche bi-compartiment, boîte de 4 (CIP: 419 999-0) PEDIAVEN AP-HP G20, solution pour
COMMISSION DE LA TRANSPARENCE AVIS 19 octobre 2011 PEDIAVEN AP-HP G15, solution pour perfusion 1000 ml de solution en poche bi-compartiment, boîte de 4 (CIP: 419 999-0) PEDIAVEN AP-HP G20, solution pour
Point d information Avril 2012. Les nouveaux anticoagulants oraux (dabigatran et rivaroxaban) dans la fibrillation auriculaire : ce qu il faut savoir
 Point d information Avril 2012 Les nouveaux anticoagulants oraux (dabigatran et rivaroxaban) dans la fibrillation auriculaire : ce qu il faut savoir Le dabigatran (PRADAXA), inhibiteur direct de la thrombine,
Point d information Avril 2012 Les nouveaux anticoagulants oraux (dabigatran et rivaroxaban) dans la fibrillation auriculaire : ce qu il faut savoir Le dabigatran (PRADAXA), inhibiteur direct de la thrombine,
Prise en charge de l embolie pulmonaire
 Prise en charge de l embolie pulmonaire Dr Serge Motte Liège 06.12.14 - Laack TA et Goyal DG, Emerg Med Clin N Am 2004; 961-983 2 PLAN Diagnostic Prise en charge: Phase aiguë: analyse de gravité Choix
Prise en charge de l embolie pulmonaire Dr Serge Motte Liège 06.12.14 - Laack TA et Goyal DG, Emerg Med Clin N Am 2004; 961-983 2 PLAN Diagnostic Prise en charge: Phase aiguë: analyse de gravité Choix
Professeur Diane GODIN-RIBUOT
 UE3-2 - Physiologie rénale Chapitre 5 : Mesure de la fonction rénale : la clairance rénale Professeur Diane GODIN-RIBUOT Année universitaire 2011/2012 Université Joseph Fourier de Grenoble - Tous droits
UE3-2 - Physiologie rénale Chapitre 5 : Mesure de la fonction rénale : la clairance rénale Professeur Diane GODIN-RIBUOT Année universitaire 2011/2012 Université Joseph Fourier de Grenoble - Tous droits
COMPARAISON DE QUATRE PROTOCOLES DE CHIMIOTHERAPIE POUR DES CANCERS DU POUMON NON A PETITES CELLULES (CBP NAPC) AVANCES
 COMPARAISON DE QUATRE PROTOCOLES DE CHIMIOTHERAPIE POUR DES CANCERS DU POUMON NON A PETITES CELLULES (CBP NAPC) AVANCES Approximativement, un tiers de tous les décès dus au cancer sont en relation avec
COMPARAISON DE QUATRE PROTOCOLES DE CHIMIOTHERAPIE POUR DES CANCERS DU POUMON NON A PETITES CELLULES (CBP NAPC) AVANCES Approximativement, un tiers de tous les décès dus au cancer sont en relation avec
AVIS DE LA COMMISSION. 30 juin 2004
 COMMISSION DE LA TRANSPARENCE REPUBLIQUE FRANÇAISE AVIS DE LA COMMISSION 30 juin 2004 BIPERIDYS 20 mg, comprimé pelliculé sécable (Boîtes de 20 et 40) Laboratoires PIERRE FABRE MEDICAMENT dompéridone Liste
COMMISSION DE LA TRANSPARENCE REPUBLIQUE FRANÇAISE AVIS DE LA COMMISSION 30 juin 2004 BIPERIDYS 20 mg, comprimé pelliculé sécable (Boîtes de 20 et 40) Laboratoires PIERRE FABRE MEDICAMENT dompéridone Liste
Assurance Maladie Obligatoire Commission de la Transparence des médicaments. Avis 1 23 Octobre 2012
 Assurance Maladie Obligatoire Commission de la Transparence des médicaments Avis 1 23 Octobre 2012 Titre I : Nom du médicament, DCI, Forme pharmaceutique, Dosage, Présentation - ARANESP 10 µg, Darbépoétine
Assurance Maladie Obligatoire Commission de la Transparence des médicaments Avis 1 23 Octobre 2012 Titre I : Nom du médicament, DCI, Forme pharmaceutique, Dosage, Présentation - ARANESP 10 µg, Darbépoétine
Point d Information. Le PRAC a recommandé que le RCP soit modifié afin d inclure les informations suivantes:
 Point d Information Médicaments à base d ivabradine, de codéine, médicaments contenant du diméthyl fumarate, du mycophénolate mofétil/acide mycophénolique, de l octocog alpha, spécialité Eligard (contenant
Point d Information Médicaments à base d ivabradine, de codéine, médicaments contenant du diméthyl fumarate, du mycophénolate mofétil/acide mycophénolique, de l octocog alpha, spécialité Eligard (contenant
COMMISSION DE LA TRANSPARENCE AVIS. 31 janvier 2007
 COMMISSION DE LA TRANSPARENCE AVIS 31 janvier 2007 NEUPRO 2 mg/24 h dispositif transdermique Sachet-dose, B/30 : 377 209-7 Sachet-dose, B/90 : 570 143-4 NEUPRO 4 mg/24 h dispositif transdermique Sachet-dose,
COMMISSION DE LA TRANSPARENCE AVIS 31 janvier 2007 NEUPRO 2 mg/24 h dispositif transdermique Sachet-dose, B/30 : 377 209-7 Sachet-dose, B/90 : 570 143-4 NEUPRO 4 mg/24 h dispositif transdermique Sachet-dose,
Nouveaux Anti-thrombotiques. Prof. Emmanuel OGER Pharmacovigilance Pharmaco-épidémiologie Faculté de Médecine Université de Rennes 1
 Nouveaux Anti-thrombotiques Prof. Emmanuel OGER Pharmacovigilance Pharmaco-épidémiologie Faculté de Médecine Université de Rennes 1 Classification Antithrombines directes o Ximélagatran EXANTA o Désirudine
Nouveaux Anti-thrombotiques Prof. Emmanuel OGER Pharmacovigilance Pharmaco-épidémiologie Faculté de Médecine Université de Rennes 1 Classification Antithrombines directes o Ximélagatran EXANTA o Désirudine
Nouveaux anticoagulants oraux (NOAC)
 Nouveaux anticoagulants oraux (NOAC) Mécanisme d action Suivi biologique: comment et quand? A.Demulder IRIS-Lab 15/05/2013 1 Anticoagulants «traditionnels»: HNF Parentéral Suivi biologique avec ajustement
Nouveaux anticoagulants oraux (NOAC) Mécanisme d action Suivi biologique: comment et quand? A.Demulder IRIS-Lab 15/05/2013 1 Anticoagulants «traditionnels»: HNF Parentéral Suivi biologique avec ajustement
Livret des nouveaux anticoagulants oraux. Ce qu il faut savoir pour bien gérer leur utilisation
 Livret des nouveaux anticoagulants oraux Ce qu il faut savoir pour bien gérer leur utilisation DONNÉES DU PATIENT Nom Adresse Tél MÉDECIN TRAITANT Nom Adresse Tél SPÉCIALISTE Nom Hôpital Tél MÉDICAMENT
Livret des nouveaux anticoagulants oraux Ce qu il faut savoir pour bien gérer leur utilisation DONNÉES DU PATIENT Nom Adresse Tél MÉDECIN TRAITANT Nom Adresse Tél SPÉCIALISTE Nom Hôpital Tél MÉDICAMENT
journées chalonnaises de la thrombose
 Nos connaissances certaines et notre pratique journalière : Les Nouveaux Anticoagulants dans la thromboprophylaxie de la chirurgie prothétique du MI Benoit Cots et Jean Marc Royer le 29/11/12-1 Recommandations
Nos connaissances certaines et notre pratique journalière : Les Nouveaux Anticoagulants dans la thromboprophylaxie de la chirurgie prothétique du MI Benoit Cots et Jean Marc Royer le 29/11/12-1 Recommandations
Accidents des anticoagulants
 30 Item 182 Accidents des anticoagulants Insérer les T1 Objectifs pédagogiques ENC Diagnostiquer un accident des anticoagulants. Identifier les situations d urgence et planifier leur prise en charge. COFER
30 Item 182 Accidents des anticoagulants Insérer les T1 Objectifs pédagogiques ENC Diagnostiquer un accident des anticoagulants. Identifier les situations d urgence et planifier leur prise en charge. COFER
Deux nouveaux anticoagulants oraux : Dabigatran et Rivaroxaban
 Deux nouveaux anticoagulants oraux : Dabigatran et Rivaroxaban Améliorations attendues et problèmes M.M. Samama, M-H. Horellou, J. Conard Groupe Hémostase-Thrombose Hôtel-Dieu L. Le Flem, C. Guinet, F.
Deux nouveaux anticoagulants oraux : Dabigatran et Rivaroxaban Améliorations attendues et problèmes M.M. Samama, M-H. Horellou, J. Conard Groupe Hémostase-Thrombose Hôtel-Dieu L. Le Flem, C. Guinet, F.
LISTE DES SPECIALITÉS A BASE DE FLUOR, UTILISÉES DANS LA PREVENTION DE LA CARIE DENTAIRE
 LISTE DES SPECIALITÉS A BASE DE FLUOR, UTILISÉES DANS LA PREVENTION DE LA CARIE DENTAIRE BIFLUORID, suspension pour usage dentaire 6,00 g 6,00 g Teneur en élément Fluor : 5,60mg pour 100g CALCIFLUOR, comprimé
LISTE DES SPECIALITÉS A BASE DE FLUOR, UTILISÉES DANS LA PREVENTION DE LA CARIE DENTAIRE BIFLUORID, suspension pour usage dentaire 6,00 g 6,00 g Teneur en élément Fluor : 5,60mg pour 100g CALCIFLUOR, comprimé
Maladie de Hodgkin ou lymphome de Hodgkin
 Maladie de Hodgkin ou lymphome de Hodgkin Ce que vous devez savoir Le cancer : une lutte à finir 1 888 939-3333 www.cancer.ca MALADIE DE HODGKIN Ce que vous devez savoir Même si vous entendez parler du
Maladie de Hodgkin ou lymphome de Hodgkin Ce que vous devez savoir Le cancer : une lutte à finir 1 888 939-3333 www.cancer.ca MALADIE DE HODGKIN Ce que vous devez savoir Même si vous entendez parler du
La nouvelle classification TNM en pratique
 La nouvelle classification TNM en pratique Thierry Berghmans Département des Soins Intensifs et Oncologie Thoracique Institut Jules Bordet Bruxelles, Belgique Bases historiques 1946 : Denoix invente le
La nouvelle classification TNM en pratique Thierry Berghmans Département des Soins Intensifs et Oncologie Thoracique Institut Jules Bordet Bruxelles, Belgique Bases historiques 1946 : Denoix invente le
Contenu et format des fichiers téléchargeables de la base de données publique des médicaments. Base de données publique des médicaments
 Contenu et format des fichiers téléchargeables de la base de données publique des médicaments Base de données publique des médicaments Date de mise à jour : 15/12/2014 Table des matières : 1. Présentation
Contenu et format des fichiers téléchargeables de la base de données publique des médicaments Base de données publique des médicaments Date de mise à jour : 15/12/2014 Table des matières : 1. Présentation
Programme AcSé. Accès Sécurisé aux Innovations Thérapeutiques Deux études pilotes : AcSé - crizotinib et AcSé - vémurafenib
 Programme AcSé Accès Sécurisé aux Innovations Thérapeutiques Deux études pilotes : AcSé - crizotinib et AcSé - vémurafenib G. Vassal, J.Y. Blay, C. Cailliot, N. Hoog-Labouret, F. Denjean, M. Jimenez, A.L.
Programme AcSé Accès Sécurisé aux Innovations Thérapeutiques Deux études pilotes : AcSé - crizotinib et AcSé - vémurafenib G. Vassal, J.Y. Blay, C. Cailliot, N. Hoog-Labouret, F. Denjean, M. Jimenez, A.L.
UE2 CANCEROLOGIE Place de la Médecine Nucléaire
 UE2 CANCEROLOGIE Place de la Médecine Nucléaire Imagerie Imagerie de Gamma Caméra Tomographie d émission monophotoniqueou TEMP: radiopharmaceutiqueémetteurs de rayonnement Gamma Imagerie de Caméra TEP
UE2 CANCEROLOGIE Place de la Médecine Nucléaire Imagerie Imagerie de Gamma Caméra Tomographie d émission monophotoniqueou TEMP: radiopharmaceutiqueémetteurs de rayonnement Gamma Imagerie de Caméra TEP
Épidémiologie des maladies interstitielles diffuses
 Épidémiologie des maladies interstitielles diffuses 3 à 5/100 000 habitants Augmente avec l age 175 /100 000 >70 ans Notre file active toutes les maladies interstitielles confondues plus de 120 patients
Épidémiologie des maladies interstitielles diffuses 3 à 5/100 000 habitants Augmente avec l age 175 /100 000 >70 ans Notre file active toutes les maladies interstitielles confondues plus de 120 patients
COMMISSION DE LA TRANSPARENCE
 COMMISSION DE LA TRANSPARENCE Avis 17 décembre 2014 ELIQUIS 2,5 mg, comprimés pelliculés B/60 (CIP : 34009 419 456 7 0) B/60 blister unitaire (CIP : 34009 419 457 3 1) ELIQUIS 5 mg, comprimés pelliculés
COMMISSION DE LA TRANSPARENCE Avis 17 décembre 2014 ELIQUIS 2,5 mg, comprimés pelliculés B/60 (CIP : 34009 419 456 7 0) B/60 blister unitaire (CIP : 34009 419 457 3 1) ELIQUIS 5 mg, comprimés pelliculés
Les différents types de cancers et leurs stades. Dr Richard V Oncologie MédicaleM RHMS Baudour et Erasme La Hulpe 1/12/07
 Les différents types de cancers et leurs stades Dr Richard V Oncologie MédicaleM RHMS Baudour et Erasme La Hulpe 1/12/07 CARCINOGENESE multiple steps, accumulation d altd altérations continuum lésionnel
Les différents types de cancers et leurs stades Dr Richard V Oncologie MédicaleM RHMS Baudour et Erasme La Hulpe 1/12/07 CARCINOGENESE multiple steps, accumulation d altd altérations continuum lésionnel
Cancer du sein. Du CA15-3 à la tomographie à émission de positons.
 Cancer du sein. Du CA15-3 à la tomographie à émission de positons. Un taux de récidive de 30% dans les dix premières années chez des patientes en rémission complète après un traitement curatif, requiert
Cancer du sein. Du CA15-3 à la tomographie à émission de positons. Un taux de récidive de 30% dans les dix premières années chez des patientes en rémission complète après un traitement curatif, requiert
Format de l avis d efficience
 AVIS D EFFICIENCE Format de l avis d efficience Juillet 2013 Commission évaluation économique et de santé publique Ce document est téléchargeable sur www.has-sante.fr Haute Autorité de santé Service documentation
AVIS D EFFICIENCE Format de l avis d efficience Juillet 2013 Commission évaluation économique et de santé publique Ce document est téléchargeable sur www.has-sante.fr Haute Autorité de santé Service documentation
Fiche Produit Profils Médicalisés PHMEV
 Guide méthodologique développé par l équipe de projets ci-dessous : Fiche Produit Profils Médicalisés PHMEV EQUIPE PROJET Chef de projet : Maryline CHARRA, Pharmacien Conseil Responsable de la mission
Guide méthodologique développé par l équipe de projets ci-dessous : Fiche Produit Profils Médicalisés PHMEV EQUIPE PROJET Chef de projet : Maryline CHARRA, Pharmacien Conseil Responsable de la mission
Présentation de l IPhEB
 Présentation de l IPhEB L Institut Pharmaco-épidémiologique belge (IPhEB) est une asbl, cogérée par des représentants de médecins et de pharmaciens. Elle a pour objectif de contribuer à l interprétation
Présentation de l IPhEB L Institut Pharmaco-épidémiologique belge (IPhEB) est une asbl, cogérée par des représentants de médecins et de pharmaciens. Elle a pour objectif de contribuer à l interprétation
COMMISSION DE LA TRANSPARENCE AVIS. 18 janvier 2012
 COMMISSION DE LA TRANSPARENCE AVIS 18 janvier 2012 ELIQUIS 2,5 mg, comprimés pelliculés B/10 (CIP: 419 454-4) B/20 (CIP: 419 455-0) B/60 (CIP: 419 456-7) B/60x1 (CIP: 419 457-3) Laboratoire Bristol-Myers
COMMISSION DE LA TRANSPARENCE AVIS 18 janvier 2012 ELIQUIS 2,5 mg, comprimés pelliculés B/10 (CIP: 419 454-4) B/20 (CIP: 419 455-0) B/60 (CIP: 419 456-7) B/60x1 (CIP: 419 457-3) Laboratoire Bristol-Myers
LIGNES DIRECTRICES CLINIQUES TOUT AU LONG DU CONTINUUM DE SOINS : Objectif de ce chapitre. 6.1 Introduction 86
 LIGNES DIRECTRICES CLINIQUES TOUT AU LONG DU CONTINUUM DE SOINS : ÉTABLISSEMENT DE LIENS ENTRE LES PERSONNES CHEZ QUI UN DIAGNOSTIC D INFECTION À VIH A ÉTÉ POSÉ ET LES SERVICES DE SOINS ET DE TRAITEMENT
LIGNES DIRECTRICES CLINIQUES TOUT AU LONG DU CONTINUUM DE SOINS : ÉTABLISSEMENT DE LIENS ENTRE LES PERSONNES CHEZ QUI UN DIAGNOSTIC D INFECTION À VIH A ÉTÉ POSÉ ET LES SERVICES DE SOINS ET DE TRAITEMENT
La Maladie Thrombo-Embolique Veineuse (MTEV) et sa prise en charge médicamenteuse
 La Société de Pharmacie de Lyon, le 17 novembre 2011 Le risque thrombo-embolique : actualités thérapeutiques et sa prise en charge La Maladie Thrombo-Embolique Veineuse (MTEV) et sa prise en charge médicamenteuse
La Société de Pharmacie de Lyon, le 17 novembre 2011 Le risque thrombo-embolique : actualités thérapeutiques et sa prise en charge La Maladie Thrombo-Embolique Veineuse (MTEV) et sa prise en charge médicamenteuse
Implantologie et Bisphosphonates
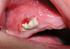 Société Française de Stomatologie et Chirurgie Maxillo-Faciale DD Implantologie et Bisphosphonates Recommandations de Bonne Pratique Juillet 2012 1 SOMMAIRE INTRODUCTION... 3 CONTEXTE... 5 BISPHOSPHONATES
Société Française de Stomatologie et Chirurgie Maxillo-Faciale DD Implantologie et Bisphosphonates Recommandations de Bonne Pratique Juillet 2012 1 SOMMAIRE INTRODUCTION... 3 CONTEXTE... 5 BISPHOSPHONATES
Lymphome non hodgkinien
 Lymphome non hodgkinien Ce que vous devez savoir Le cancer : une lutte à finir 1 888 939-3333 www.cancer.ca LYMPHOME NON HODGKINIEN Ce que vous devez savoir Même si vous entendez parler du cancer presque
Lymphome non hodgkinien Ce que vous devez savoir Le cancer : une lutte à finir 1 888 939-3333 www.cancer.ca LYMPHOME NON HODGKINIEN Ce que vous devez savoir Même si vous entendez parler du cancer presque
Cancer du rein métastatique Nouvelles approches thérapeutiques. Sophie Abadie-Lacourtoisie 20 mai 2006
 Cancer du rein métastatique Nouvelles approches thérapeutiques Sophie Abadie-Lacourtoisie 20 mai 2006 Cancer du rein à cellules claires métastatique (CRM) Plus de 30 % des CR deviendront métastatiques
Cancer du rein métastatique Nouvelles approches thérapeutiques Sophie Abadie-Lacourtoisie 20 mai 2006 Cancer du rein à cellules claires métastatique (CRM) Plus de 30 % des CR deviendront métastatiques
EVALUATION DES TECHNOLOGIES DE SANTÉ ANALYSE MÉDICO-ÉCONOMIQUE. Efficacité et efficience des hypolipémiants Une analyse centrée sur les statines
 EVALUATION DES TECHNOLOGIES DE SANTÉ ANALYSE MÉDICO-ÉCONOMIQUE Efficacité et efficience des hypolipémiants Une analyse centrée sur les statines Juillet 2010 Mise à jour Septembre 2010 1 Le rapport complet
EVALUATION DES TECHNOLOGIES DE SANTÉ ANALYSE MÉDICO-ÉCONOMIQUE Efficacité et efficience des hypolipémiants Une analyse centrée sur les statines Juillet 2010 Mise à jour Septembre 2010 1 Le rapport complet
Place de la chirurgie à l heure des thérapies ciblées. The role of surgery in the era of targeted therapy. * Non ouvert en France.
 dossier thématique Place de la chirurgie à l heure des thérapies ciblées The role of surgery in the era of targeted therapy P. Bigot*, J.C. Bernhard** Points forts» En association avec l immunothérapie,
dossier thématique Place de la chirurgie à l heure des thérapies ciblées The role of surgery in the era of targeted therapy P. Bigot*, J.C. Bernhard** Points forts» En association avec l immunothérapie,
Les nouveaux anticoagulants ont ils une place aux Urgences?
 Les nouveaux anticoagulants ont ils une place aux Urgences? Emmanuel Andrès Service de Médecine Interne Diabète et Maladies métabolique Clinique Médicale B - CHRU de Strasbourg Remerciements au Professeur
Les nouveaux anticoagulants ont ils une place aux Urgences? Emmanuel Andrès Service de Médecine Interne Diabète et Maladies métabolique Clinique Médicale B - CHRU de Strasbourg Remerciements au Professeur
EXERCICE N 10 : Modifier le protocole d'un essai pour mieux réussir ; mais réussir quoi?
 EXERCICE N 10 : Modifier le protocole d'un essai pour mieux réussir ; mais réussir quoi? Le bévacizumab (Avastin ) est un anticorps monoclonal qui a fait l objet d une autorisation supplémentaire pour
EXERCICE N 10 : Modifier le protocole d'un essai pour mieux réussir ; mais réussir quoi? Le bévacizumab (Avastin ) est un anticorps monoclonal qui a fait l objet d une autorisation supplémentaire pour
Les nouveaux anticoagulants oraux sont arrivé! Faut il une surveillance biologique?
 Les nouveaux anticoagulants oraux sont arrivé! Faut il une surveillance biologique? Références : Pr Samama Journée de Biologie Praticienne Décembre 2011 I. Gouin-Thibault Journée de Biologie Clinique 2012
Les nouveaux anticoagulants oraux sont arrivé! Faut il une surveillance biologique? Références : Pr Samama Journée de Biologie Praticienne Décembre 2011 I. Gouin-Thibault Journée de Biologie Clinique 2012
TUMEURS DU BAS APPAREIL URINAIRE
 1 Plan de cours I - TUMEURS PRIMITIVES DE LA VESSIE c1 - Tumeurs papillaires non infiltrantes c2 - Tumeurs papillaires infiltrantes c3 - Carcinome in-situ en muqueuse plane D - Pronostic : II - TUMEURS
1 Plan de cours I - TUMEURS PRIMITIVES DE LA VESSIE c1 - Tumeurs papillaires non infiltrantes c2 - Tumeurs papillaires infiltrantes c3 - Carcinome in-situ en muqueuse plane D - Pronostic : II - TUMEURS
Recommandation Pour La Pratique Clinique
 Recommandation Pour La Pratique Clinique Prise en charge diagnostique et thérapeutique de la migraine chez l adulte ( et chez l enfant) : aspects cliniques (et économiques) Octobre 2002 1 La migraine de
Recommandation Pour La Pratique Clinique Prise en charge diagnostique et thérapeutique de la migraine chez l adulte ( et chez l enfant) : aspects cliniques (et économiques) Octobre 2002 1 La migraine de
Anticoagulation chez le sujet âgé cancéreux en traitement. PE Morange Lab.Hématologie Inserm U1062 CHU Timone Marseille
 Anticoagulation chez le sujet âgé cancéreux en traitement PE Morange Lab.Hématologie Inserm U1062 CHU Timone Marseille Le cancer est un FDR établi de TV X 4.1 Heit JA Arch Int Med 2000 Délai diagnostic
Anticoagulation chez le sujet âgé cancéreux en traitement PE Morange Lab.Hématologie Inserm U1062 CHU Timone Marseille Le cancer est un FDR établi de TV X 4.1 Heit JA Arch Int Med 2000 Délai diagnostic
INTERET PRATIQUE DU MDRD AU CHU DE RENNES
 INTERET PRATIQUE DU MDRD AU CHU DE RENNES QU EST-CE QUE LE MDRD? Il s agit d une formule permettant d estimer le débit de filtration glomérulaire et donc la fonction rénale La formule est la suivante :
INTERET PRATIQUE DU MDRD AU CHU DE RENNES QU EST-CE QUE LE MDRD? Il s agit d une formule permettant d estimer le débit de filtration glomérulaire et donc la fonction rénale La formule est la suivante :
