Avis 4 février Laboratoire ROCHE. Rituximab. Extension d indication. Motif de l examen. Collectivités (CSP L ) Listes concernées
|
|
|
- Raoul Pelletier
- il y a 8 ans
- Total affichages :
Transcription
1 COMMISSION DE LA TRANSPARENCE Avis 4 février 2015 MABTHERA 100 mg, solution à diluer pour perfusion Conditionnement B/2 (CIP : ) MABTHERA 500 mg, solution à diluer pour perfusion Conditionnement B/1 (CIP : ) Laboratoire ROCHE DCI Code ATC (2013) Rituximab L01XC02 (anticorps monoclonaux) Motif de l examen Extension d indication Listes concernées Collectivités (CSP L ) Indication concernée «MABTHERA, en association aux glucocorticoïdes, est indiqué pour le traitement d induction de la rémission des patients adultes atteints de granulomatose avec polyangéite (GPA) (maladie de Wegener) et de polyangéite microscopique (PAM) sévères et actives.» HAS - Direction de l'evaluation Médicale, Economique et de Santé Publique 1/22
2 A Place dans la stratégie thérapeutique Compte-tenu de l intérêt potentiel du rituximab par rapport au cyclophosphamide oral chez les patients en rechute et de l absence d impact du rituximab sur la fertilité des patients en âge de procréer, MABTHERA apporte une amélioration du service médical rendu mineure (A IV) dans la stratégie thérapeutique d'induction de la rémission des patients atteints de GPA et PAM sévères et actives. En 1 ère intention, le rituximab peut être prescrit au même titre que le cyclophosphamide. Le rituximab doit être prescrit de manière préférentielle chez les femmes en âge de procréer, particulièrement lorsqu elles sont âgées de plus de 30 ans. En traitement d induction de 2 ème intention d une GPA ou d une PAM, le rituximab est désormais recommandé à la place du cyclophosphamide oral dans les situations en rechute, d échec ou de réponse incomplète au cyclophosphamide IV prescrit selon les recommandations du PNDS ainsi qu aux patients intolérants au cyclophosphamide ou qui ont développé une complication liée à l exposition préalable à ce dernier (cystite hémorragique par exemple). Le rituximab est préféré au cyclophosphamide chez les patients en rechute de GPA ou de PAM ayant déjà reçu un immunosuppresseur conventionnel. HAS - Direction de l'evaluation Médicale, Economique et de Santé Publique 2/22
3 01 INFORMATIONS ADMINISTRATIVES ET REGLEMENTAIRES AMM (procédure) Conditions de prescription et de délivrance / statut particulier Date initiale (procédure centralisée) : 02/06/1998 Extension d indication : 22 avril 2013 Plan de gestion des risques Demande d études complémentaires Liste I Médicament soumis à prescription hospitalière. Prescription réservée aux spécialistes en hématologie, aux médecins compétents en maladies du sang, aux spécialistes en rhumatologie, en médecine interne ou en néphrologie. Médicament nécessitant une surveillance particulière pendant le traitement. La première administration doit être effectuée en milieu hospitalier. Médicament inscrit sur la liste "rétrocession" et sur la liste des spécialités prises en charge en sus des GHS. Classification ATC 2013 L L01 L01X L01XC L01XC02 Antinéoplasiques et immunomodulateurs Agents antinéoplasiques Autres antinéoplasiques Anticorps monoclonaux Rituximab 02 CONTEXTE Le laboratoire sollicite l inscription de MABTHERA sur la liste des médicaments agréés à l usage des collectivités et divers services publics dans une nouvelle indication, en association aux glucocorticoïdes, pour le traitement d induction de la rémission des patients adultes atteints de granulomatose avec polyangéite (GPA ou anciennement maladie de Wegener) et de polyangéite microscopique (PAM) sévères et actives. Un protocole thérapeutique temporaire (PTT) du rituximab dans les vascularites à autoanticorps dirigés contre le cytoplasme des polynucléaires neutrophiles (ANCA) réfractaires ou en rechutes après traitement immunosuppresseur chez les patients ne pouvant être inclus dans les études cliniques avait été délivré le 1 er avril 2008 par l Afssaps (désormais ANSM) 1. Le rituximab est une immunoglobuline glycosylée se liant spécifiquement à l'antigène transmembranaire CD20 des lymphocytes B, induisant leur apoptose. MABTHERA a déjà l AMM dans d autres indications telles que les lymphomes non hodgkiniens, la leucémie lymphoïde chronique, la polyarthrite rhumatoïde qui bénéficient toutes d un important. Pour les niveaux d A de chacune des indications déjà évaluées par la Commission de transparence, se reporter au tableau du chapitre «08 Rappel des précédentes évaluations». 1 Situation temporairement acceptable. RITUXIMAB Vascularites cryoglobulinémiques réfractaires aux antiviraux et /ou aux immunosuppresseurs et/ou aux échanges plasmatiques. HAS - Direction de l'evaluation Médicale, Economique et de Santé Publique 3/22
4 03 INDICATIONS THERAPEUTIQUES «MABTHERA est indiqué chez les patients adultes dans les indications suivantes : Lymphomes non-hodgkiniens (LNH) MABTHERA est indiqué en association à une chimiothérapie pour le traitement des patients présentant un lymphome folliculaire de stade III-IV n ayant jamais été précédemment traités. MABTHERA en traitement d entretien est indiqué chez les patients présentant un lymphome folliculaire répondant à un traitement d induction. MABTHERA en monothérapie est indiqué pour le traitement des patients atteints de lymphomes folliculaires de stade III-IV en cas de chimiorésistance ou à partir de la deuxième rechute après chimiothérapie. MABTHERA est indiqué en association à une chimiothérapie "CHOP" (cyclophosphamide, doxorubicine, vincristine, prednisolone) pour le traitement des patients présentant un lymphome non-hodgkinien agressif diffus à grandes cellules B, CD20 positif. Leucémie lymphoïde chronique (LLC) MABTHERA en association à une chimiothérapie est indiqué pour le traitement des patients atteints de leucémie lymphoïde chronique, non précédemment traités et en rechute ou réfractaires. Polyarthrite rhumatoïde MABTHERA en association au méthotrexate est indiqué pour le traitement de la polyarthrite rhumatoïde active, sévère, chez les patients adultes qui ont présenté une réponse inadéquate ou une intolérance aux traitements de fond, dont au moins un inhibiteur du facteur de nécrose tumorale (anti-tnf). Granulomatose avec polyangéite et polyangéite microscopique MABTHERA, en association aux glucocorticoïdes, est indiqué pour le traitement d induction de la rémission des patients adultes atteints de granulomatose avec polyangéite (GPA) (maladie de Wegener) et de polyangéite microscopique (PAM) sévères et actives.» 04 POSOLOGIE «Les patients traités par MABTHERA doivent recevoir la carte de surveillance du patient lors de chaque perfusion. [ ] La dose recommandée de MABTHERA pour le traitement d induction de la rémission de la granulomatose avec polyangéite et de la polyangéite microscopique est de 375 mg/m² de surface corporelle, administrés en perfusion intraveineuse une fois par semaine pendant 4 semaines (quatre perfusions au total). L administration de la méthylprednisolone par voie intraveineuse à une posologie de mg par jour est recommandée pendant 1 à 3 jours avant la première perfusion de MABTHERA (la dernière dose de méthylprednisolone peut être administrée le même jour que la première perfusion de MABTHERA). Ce traitement doit être poursuivi par l administration de prednisone orale à la dose de 1 mg/kg/jour (sans dépasser 80 mg/jour, et avec réduction progressive de la posologie aussi rapide que possible en fonction de la clinique) pendant et après le traitement par MABTHERA. Un traitement prophylactique de la pneumonie à Pneumocystis jirovecii est recommandé chez les patients atteints de granulomatose avec polyangéite ou de polyangéite microscopique pendant et après le traitement par MABTHERA, de manière appropriée.» HAS - Direction de l'evaluation Médicale, Economique et de Santé Publique 4/22
5 05 BESOIN THERAPEUTIQUE Les vascularites systémiques sont un groupe d affections caractérisées par une atteinte inflammatoire des vaisseaux sanguins artériels, capillaires ou veineux avec altération de la paroi vasculaire 2. Tous les vaisseaux, de l aorte jusqu aux capillaires, peuvent être concernés, d où une expression clinique très polymorphe. La nomenclature actualisée de Chapel Hill 3, système de classification de référence, organise les vascularites selon le calibre des vaisseaux atteints. Les vascularites nécrosantes affectant les vaisseaux de petit calibre sont subdivisées selon les mécanismes pathogéniques impliqués : associées à des dépôts de complexes immuns d une part et à des autoanticorps dirigés contre le cytoplasme des polynucléaires neutrophiles (ANCA) d autre part 2. La granulomatose avec polyangéite (GPA) anciennement dénommée granulomatose de Wegener et la polyangéite microscopique (PAM) sont des vascularites associées aux ANCA. Il s agit de maladies auto-immunes rares, graves, mettant en jeu le pronostic vital en l absence de traitement 4. L'âge moyen de survenue est de 50 à 60 ans. Sur le plan clinique, les atteintes pulmonaires, à la symptomatologie hétérogène (toux, dyspnée et hémorragies alvéolaires) sont fréquentes, ainsi que les atteintes rénales, rapidement progressives pouvant conduire à une insuffisance rénale terminale 5. Des nodules pulmonaires multiples sont aussi caractéristiques de la GPA. Les tableaux les plus sévères associent les atteintes pulmonaires et rénales (syndrome pneumo-rénal). Des manifestations systémiques neurologiques (mononévrites multiples principalement), dermatologiques (purpura, ulcérations ou nécroses cutanées), rhumatologiques (arthralgies, myalgies) ou ORL sont également observées. Le groupe européen d étude des vascularites (EUVAS) a défini 5 catégories de vascularites à ANCA en fonction de la nature des atteintes cliniques : les formes localisées, systémiques, généralisées, sévères et réfractaires 6. Le diagnostic doit être évoqué devant l association de signes cliniques et de signes biologiques (syndrome inflammatoire et détection d ANCA) et nécessite dans la mesure du possible une confirmation histologique de la vascularite 5. Des échelles et des scores de sévérité des vascularites permettent de déterminer le degré d activité de la maladie et de suivre l efficacité des traitements. Le Birmingham Vasculitis Activity Score for Wegener's Granulomatosis (BVAS/WG) a été spécifiquement conçu pour évaluer la sévérité des GPA 7. Une version proche de ce score, le BVAS, est applicable à la PAM. Le score pronostique «Five Factor Score» (FFS) actualisé reflète l'impact de 4 paramètres cliniques et d un paramètre biologique et permet d évaluer le taux de mortalité des patients atteints de vascularites systémiques 8. Les objectifs de la prise en charge des vascularites à ANCA sont d induire la rémission et de prévenir les rechutes, tout en limitant les effets indésirables liés au traitement et les séquelles de la maladie. En France, la stratégie thérapeutique d induction de la rémission des GPA et PAM sévères et actives se fonde sur les recommandations françaises du Groupe Français d Etude des 2 Guillevin L, Terrier B. Classification des vascularites systémiques, Presse Med 2012; 41: Jennette JC, Falk RJ, Bacon PA et al Revised International Chapel Hill Consensus Conference Nomenclature of Vasculitides. Arthritis & Rheumatism 2013 ; 65: Site en ligne du Groupe Français d'etude des Vascularites, GFEV, consulté en février HAS. Guide affection de longue durée, Vascularites nécrosantes systémiques, Protocole national de diagnostic et de soins, Novembre Mukhtyar C, Guillevin L. Cid MC et al. EULAR recommendations for the management of primary small and medium vessel vasculitis, Ann Rheum Dis 2009;68: Stone JH, Hoffman GS, Merkel PA et al. A Disease-Specific Activity Index for Wegener s Granulomatosis, Arthritis & Rheumatism 2001; 44: Guillevin L, Pagnoux C, Seror R. et al. The Five-Factor Score revisited: assessment of prognoses of systemic necrotizing vasculitides based on the French Vasculitis Study Group (FVSG) cohort, Medicine (Baltimore) 2011 ;90: HAS - Direction de l'evaluation Médicale, Economique et de Santé Publique 5/22
6 Vascularites (GFEV) 9 (2013), européennes de l EULAR 6 (2009) et le protocole national de diagnostic et de soins (PNDS) de la HAS 5 (2007). La prise en charge est multidisciplinaire et coordonnée par un médecin hospitalier en lien avec un centre de référence des maladies auto-immunes et maladies systémiques rares ou un centre de compétences. Le traitement des formes sévères de GPA et PAM associe les corticoïdes aux immunosuppresseurs prescrits au long cours, pour une durée supérieure à 18 mois 6,9,10. Une première phase de traitement d induction d environ 3 à 6 mois vise à obtenir la rémission de la maladie. Le traitement standard actuel d induction de la rémission des GPA et PAM sévères et actives repose sur l association prednisone par voie orale, éventuellement précédé de bolus de méthylprednisolone, et cyclophosphamide IV durant 3 mois au minimum (habituellement 6 perfusions). Le cyclophosphamide est susceptible de favoriser la survenue d infections, de cancers avec au premier plan les cancers de la vessie et, à forte dose d induire une stérilité, parfois définitive, notamment lorsque le cyclophosphamide est prescrit par voie orale, car les doses cumulées sont plus fortes que lors d une administration intraveineuse 5. A efficacité similaire, il en résulte une moins bonne tolérance 11 de la forme orale par rapport à la forme IV 12. Le traitement d induction actuel permet d obtenir une rémission dans plus de 80% des cas de GPA et de PAM 5. Après obtention de la rémission, les rechutes, qui surviennent chez plus de la moitié des patients atteints de GPA et chez environ 30% des patients atteints de PAM à 5 ans 4,5, justifient la mise en place d un traitement d entretien à base d azathioprine ou de méthotrexate 5,13 durant 12 à 24 mois dans l objectif de consolider la rémission et de limiter le risque de rechute 5,6. Par rapport à la population générale, il existe une surmortalité dans les 18 premiers mois suivant le diagnostic de vascularite 4, imputable soit à la vascularite soit aux traitements administrés 14. Dans toutes les vascularites, le décès peut résulter de l'atteinte d'un organe noble. Dans les GPA et PAM, les principales causes de décès sont l'insuffisance rénale et l'hémorragie alvéolaire. 9 Charles P, Bienvenu B, Bonnotte B. et al. Rituximab: Recommendations of the French Vasculitis Study Group (FVSG) for induction and maintenance treatments of adult, antineutrophil cytoplasm antibodyassociated necrotizing vasculitidis. Presse Med 2013; 42: Lapraik C, Watts R, Bacon P. BSR and BHPR guidelines for the management of adults with ANCA associated vasculitis, Rheumatology 2007;46: de Groot K, Harper L, Jayne D RW. et al. Pulse Versus Daily Oral Cyclophosphamide for Induction of Remission in Antineutrophil Cytoplasmic Antibody Associated Vasculitis, Ann Intern Med 2009;150 : Harper L, Morgan MD, Walsh M,et al. Pulse versus daily oral cyclophosphamide for induction of remission in ANCA-associated vasculitis: long-term follow-up Ann Rheum Dis 2012;71: Pagnoux C Mahr A, Hamidou MA. Azathioprine or Methotrexate Maintenance for ANCA-Associated Vasculitis. N Engl J Med 2008;359: Karras A, Guiard E, Lévi C et al. Granulomatose avec polyangéite (maladie de Wegener). Presse Med 2012;41: HAS - Direction de l'evaluation Médicale, Economique et de Santé Publique 6/22
7 06 COMPARATEURS CLINIQUEMENT PERTINENTS 06.1 Médicaments NOM (DCI) Laboratoire ENDOXAN 50 mg comprimé (Cyclophosphamide) Bayer CPT* identique Non Indications A faible dose, traitement des polyarthrites rhumatoïdes, granulomatose de Wegener, de certaines formes sévères de lupus érythémateux aigus disséminés, de néphropathies autoimmunes corticorésistantes. Date de l avis A (Libellé) 15/02/2006 Sans objet Prise en charge Oui/non Oui ENDOXAN 500 et 1000 mg, poudre pour solution injectable (Cyclophosphamide) Bayer Non A faible dose, traitement des polyarthrites rhumatoïdes, granulomatose de Wegener, de certaines formes sévères de lupus érythémateux aigus disséminés, de néphropathies autoimmunes corticorésistantes. Non renseigné Non renseigné Non renseigné Oui *classe pharmaco-thérapeutique 06.2 Autres technologies de santé Les échanges plasmatiques peuvent être utilisés dans le traitement d induction des vascularites à ANCA, en association aux traitements par corticoïdes et immunosuppresseurs, pour répondre à des situations cliniques particulières dont les atteintes rénales sévères (créatininémie > 500 µmol/l) ou les hémorragies alvéolaires graves sur le plan clinique 5,15. Conclusion Il existe un comparateur médicamenteux cliniquement pertinent pour induire la rémission des patients adultes atteints de GPA et PAM sévères et actives : le cyclophosphamide par voie injectable ou orale. 07 INFORMATIONS SUR LE MEDICAMENT AU NIVEAU INTERNATIONAL Hors Union-Européenne, en Australie, au Canada, aux Etats-Unis, MABTHERA a aussi l AMM dans la nouvelle indication, objet du présent avis. 15 Mahr A, Chaigne-Delalande S, De Menthon M. Therapeutic plasma exchange in systemic vasculitis:an update on indications and results. Curr Opin Rheumatol 2012; 24: HAS - Direction de l'evaluation Médicale, Economique et de Santé Publique 7/22
8 08 RAPPEL DES PRECEDENTES EVALUATIONS Date de l avis (motif de la demande) Indication A Date de l avis (motif de la demande) Indication A Date de l avis (motif de la demande) Indication A Date de l avis (motif de la demande) Indication 04/11/1998 (Inscription sur la liste des spécialités agréées aux collectivités) MABTHERA est indiqué pour le traitement des patients atteints de lymphomes folliculaires de stade III-IV en cas de chimiorésistance ou à partir de la deuxième rechute après chimiothérapie. MABTHERA apporte une amélioration du service médical rendu notable dans le traitement des lymphomes folliculaires de stade III-IV en cas de chimiorésistance ou à partir de la deuxième rechute après chimiothérapie. 29/10/2003 (Inscription sur la liste des spécialités agréées aux collectivités d une extension d indication) MABTHERA est indiqué en association à une chimiothérapie CHOP pour le traitement des patients présentant un lymphome non hodgkinien agressif diffus à grande cellule B, CD20 positif. MABTHERA, en association à une chimiothérapie CHOP apporte une amélioration majeure de niveau I du service médical rendu par rapport à la chimiothérapie CHOP seule. 14/01/2004 (réévaluation d une indication) MABTHERA est indiqué en association à une chimiothérapie CHOP pour le traitement des patients présentant un lymphome non hodgkinien agressif diffus à grande cellule B, CD20 positif. MABTHERA, en association à une chimiothérapie CHOP apporte une amélioration majeure de niveau I du service médical rendu par rapport à la chimiothérapie CHOP seule. 08/06/2005 (Inscription sur la liste des spécialités agréées aux collectivités d une extension d indication) MABTHERA est indiqué en association à une chimiothérapie «CVP» pour le traitement des patients présentant un lymphome folliculaire de stade III-IV n ayant jamais été précédemment traités. A Etudes demandées - MABTHERA en association à une chimiothérapie «CVP» apporte une A importante (niveau II) dans la stratégie thérapeutique en termes d efficacité. Date de l avis (motif de la demande) Indication A 08/11/2006 (Inscription sur la liste des spécialités agréées aux collectivités d une extension d indication) MABTHERA en traitement d entretien est indiqué chez les patients présentant un lymphome folliculaire en rechute ou réfractaire répondant à un traitement d induction par chimiothérapie avec ou sans MABTHERA. En traitement d entretien du lymphome folliculaire en rechute ou réfractaire, MABTHERA apporte une A majeure (de niveau I) en termes d efficacité par HAS - Direction de l'evaluation Médicale, Economique et de Santé Publique 8/22
9 rapport à la stratégie thérapeutique actuelle. Date de l avis (motif de la demande) Indication A Date de l avis (motif de la demande) Indication A Date de l avis (motif de la demande) Indication A Date de l avis (motif de la demande) Indication 13/12/2006 (Inscription sur la liste des spécialités agréées aux collectivités d une extension d indication) MABTHERA est indiqué dans la PR active, sévère, chez les patients adultes qui ont présenté une réponse inadéquate ou une intolérance aux traitements de fond, dont au moins un anti-tnf (inhibiteur du facteur de nécrose tumorale. Dans le traitement de la polyarthrite rhumatoïde active, sévère, MABTHERA en association au méthotrexate apporte une amélioration du service médical rendu importante (niveau II) par rapport à la stratégie actuelle chez les patients qui ont eu une réponse inadéquate ou une intolérance aux traitements de fond, dont au moins un anti-tnf. 01/10/2008 (Inscription sur la liste des spécialités agréées aux collectivités d une extension d indication) MABTHERA est indiqué en association à une chimiothérapie pour le traitement des patients présentant un lymphome folliculaire de stade III-IV n ayant jamais été précédemment traités. En traitement du lymphome folliculaire de stade III-IV n ayant jamais été précédemment traités, MABTHERA en association à une chimiothérapie apporte une A majeure (niveau I) en termes d efficacité par rapport à la chimiothérapie seule. 27/01/2010 (Inscription sur la liste des spécialités agréées aux collectivités d une extension d indication) MABTHERA est indiqué dans le traitement de première ligne chez les patients atteints de leucémie lymphoïde chronique (LLC) en association à une chimiothérapie. Dans le traitement de première ligne de la leucémie lymphoïde chronique, MABTHERA en association à une chimiothérapie par fludarabine plus cyclophosphamide apporte une A mineure (niveau IV) en termes d'efficacité par rapport à cette chimiothérapie seule. 25/05/2011 (réévaluation de l A dans la LLC) MABTHERA en association à une chimiothérapie est indiqué pour le traitement des patients atteints de leucémie lymphoïde chronique, non précédemment traités et en rechute ou réfractaires. A Compte tenu : - des données actualisées de l étude ML17102 en faveur, malgré des réserves méthodologiques (étude ouverte, analyse complémentaire non prévue au protocole), de la supériorité de MABTHERA en association à fludarabine/cyclophosphamide (RFC) par rapport à fludarabine/cyclophosphamide (FC), - de la place de cette association R-FC comme traitement de référence en particulier chez les patients ayant peu de comorbidités, La Commission de la Transparence, considère que MABTHERA en association à fludarabine/cyclophosphamide apporte une A modérée de niveau III, en termes d efficacité par rapport à fludarabine/cyclophosphamide chez les patients HAS - Direction de l'evaluation Médicale, Economique et de Santé Publique 9/22
10 atteints de leucémie lymphoïde chronique non précédemment traités. Date de l avis (motif de la demande) Indication A Date de l avis (motif de la demande) Indication A 18/07/2012 (Inscription sur la liste des spécialités agréées aux collectivités d une extension d indication) MABTHERA en association à une chimiothérapie est indiqué pour le traitement des patients atteints de leucémie lymphoïde chronique, non précédemment traités et en rechute ou réfractaires. MABTHERA en association à une chimiothérapie apporte une amélioration du service médical rendu modérée (A III), en termes d efficacité dans la stratégie thérapeutique. 18/07/2012 (Inscription sur la liste des spécialités agréées aux collectivités d une extension d indication) Traitement d entretien du lymphome folliculaire chez les patients non précédemment traités. A noter : l ancien libellé d indication du 6/07/2006 dans le traitement d entretien du lymphome folliculaire était limité au lymphome folliculaire en rechute ou réfractaire répondant à un traitement d induction par chimiothérapie avec ou sans MABTHERA. Il a été élargi au lymphome folliculaire non précédemment traité. En traitement d entretien du lymphome folliculaire non précédemment traité, MABTHERA apporte une amélioration du service médical rendu importante (A II) en termes d efficacité dans la prise en charge des patients répondeurs à un traitement d induction de première ligne. HAS - Direction de l'evaluation Médicale, Economique et de Santé Publique 10/22
11 09 ANALYSE DES DONNEES DISPONIBLES Le dossier du laboratoire est étayé par une étude de phase II/III (RAVE) 16 de non infériorité du rituximab par rapport au cyclophosphamide administré par voie orale, avec évaluation du critère principal à 6 mois. Par ailleurs, une étude de phase II (RITUXVAS) 17 a comparé efficacité d un traitement standard par corticoïdes associé soit à rituximab IV (375 mg/m²/semaine durant 4 semaines consécutives) plus cyclophosphamide (CYC) IV (15 mg/kg J1 et J15) soit à CYC IV (15 mg/kg) durant 3 à 6 mois suivi d azathioprine, pour induire une rémission complète prolongée (BVAS=0 à 6 mois et prolongé durant au moins 6 mois) chez des patients atteints de GPA ou PAM avec atteinte rénale sévère nouvellement diagnostiquée. Mais dans la mesure où l association de RTX à CYC IV à faible dose n est pas validée par l AMM, les résultats de cette étude ne sont pas présentés dans le cadre du présent avis. 16 Stone H, Merkel PA, Spiera R et al. Rituximab versus Cyclophosphamide for ANCA-Associated Vasculitis, N Engl J Med 2010;363: Jones RB, Cohen W, Tervaert J, Hauser T et al. Rituximab versus Cyclophosphamide in ANCA Associated Renal Vasculitis, N Engl J Med 2010;363: HAS - Direction de l'evaluation Médicale, Economique et de Santé Publique 11/22
12 Etude RAVE 16 RITUXVAS 17 Type d étude Phase II/III, multicentrique, randomisée, en double aveugle, comparative versus comparateur actif Etude de phase II, prospective, multicentrique, ouverte, randomisée comparative versus comparateur actif Effectifs N N=197 dont : 147 avec GPA 48 avec PAM Randomisation 1:1 N=44 Randomisation 3:1 AZA : azathioprine, CYC : cyclophosphamide, RTX : rituximab Population étudiée/ critères d inclusion Patient atteints de GPA ou PAM sévères (BVAS/WG 3) Patients atteints de GPA ou PAM avec atteintes rénales nouvellement diagnostiquées. Schémas thérapeutiques Groupe RTX (N=99): 375 g/m²/sem. durant 4 semaines. Groupe contrôle CYC/AZA (N=98) CYC oral (2 mg/kg/j) durant 3 à 6 mois, suivi d AZA oral en entretien (2mg/kg/j). Traitements associés : glucocorticoïdes Groupe RTX/CYC faible dose (N=33) RTX IV (375 mg/m²/sem. durant 4 semaines) associé à CYC IV faible dose totale (15 mg/kg J1 et J15). Groupe CYC/AZA (N=11) CYC IV (15 mg/kg) durant 3 à 6 mois suivi d AZA oral (2 mg/kg/j) en maintenance. Traitements associés : glucocorticoïdes Critère principal d évaluation Taux de patients ayant obtenu une rémission complète à 6 mois BVAS/WG= 0 et arrêt des glucocorticoïdes. Hypothèse de non infériorité (20%). Taux de patients ayant obtenu une rémission complète prolongée (BVAS=0 à 6 mois et prolongé durant au moins 6 mois). HAS - Direction de l'evaluation Médicale, Economique et de Santé Publique 12/22
13 09.1 Efficacité Etude RAVE Objectif principal de l étude Méthode Population étudiée Principaux critères d inclusion Principaux critères de non inclusion Groupes de traitement Déroulement de l étude Traitements associés Critère de jugement principal Etude RAVE Evaluer l efficacité de rituximab (375 mg/m², 1 perfusion par semaine durant 4 semaines consécutives) associé aux glucocorticoïdes oraux pour induire la rémission complète (définie par un score BVAS/WG=0 et l arrêt des glucocorticoïdes 6 mois après la randomisation), chez des patients atteints de GPA ou PAM sévères et actives (étude de non infériorité). L étude a été conçue de façon à démontrer la non-infériorité de RTX par rapport au traitement conventionnel de CYC oral durant 3 à 6 mois (suivi d AZA en traitement d entretien) - tous deux associés aux glucocorticoïdes oraux - dans l induction de la rémission complète à 6 mois chez des patients avec GPA ou PAM sévères et actives. Phase II/III, en groupes parallèles, comparative versus comparateur actif, randomisée, en double aveugle et double placebo. Patients atteints de GPA ou PAM selon la conférence de consensus de Chapel Hill 3, avec une poussée initiale ou une rechute, avec des formes cliniques actives et sévères. L activité a été définie par un score BVAS/WG 3 à l inclusion et la sévérité par la présence de manifestations cliniques menaçant le pronostic vital et/ou fonctionnel et nécessitant un traitement par cyclophosphamide, avec une positivité pour les ANCA- PR3 ou ANCA-MPO. Granulomatose éosinophilique avec polyangéite (anciennement syndrome de Churg et Strauss), hémorragie alvéolaire nécessitant une assistance respiratoire, atteintes rénales sévères (créatinine sérique >4,0mg/dL). Randomisation selon un ratio 1:1, dans les deux groupes : Groupe RTX : Au cours de la phase d induction : 1 perfusion par semaine de RTX (375mg/m²) durant 4 semaines consécutives et CYC placebo par voie orale durant 3 à 6 mois. Au cours de la phase de maintien de la rémission, arrêt du CYC placebo et administration de AZA placebo par voie orale (équivalent à 2mg/kg/jour) jusqu au 18 ème mois. Groupe CYC/AZA ou groupe contrôle : Au cours de la phase d induction de la rémission : CYC par voie orale 1 fois par jour (2mg/kg/jour sans dépasser 200 mg/j avec adaptation à la fonction rénale si besoin) durant 3 à 6 mois et une perfusion par semaine de RTX placebo durant 4 semaines consécutives. Au cours de la phase de maintien de la rémission, c est-à-dire après obtention de la rémission clinique (BVAS =0 et arrêt complet des glucocorticoïdes) : arrêt du CYC oral et administration de AZA oral (2mg/kg/jour) jusqu au 18 ème mois. 2 phases : phase d induction de la rémission d une durée de 3 à 6 mois, phase de maintien de la rémission jusqu à 18 mois Les patients avec une rémission complète (définie par BVAS/WG=0 et arrêt complet des glucocorticoïdes) entre le 3 ème et le 6 ème mois de traitement entraient en phase de maintenance et arrêtaient CYC ou CYC placebo pour commencer respectivement AZA ou AZA placebo. La modification CYC vers AZA (groupe contrôle) ou CYC placebo vers AZA placebo (groupe RTX) avant la fin du 3 ème mois après la randomisation n était pas permise. Les patients avec une poussée sévère ou limitée nécessitant du CYC entre la 5 ème visite (1 semaine après la dernière perfusion de RTX/RTX placebo) et la 8 ème visite (visite du 6 ème mois) pouvaient changer de groupe de traitement avec maintien de l aveugle. Dans les 2 groupes : mg par jour de méthylprednisolone en bolus intraveineux les jours 1 à 3, suivi par prednisone par voie orale (1 mg/kg/jour, sans dépasser 80 mg/jour). La diminution progressive de la dose de prednisone devait être terminée dans un délai de six mois après la randomisation. Obtention d une rémission complète à 6 mois, définie par un score d activité des vascularites de Birmingham pour la Granulomatose de Wegener (BVAS/WG) de 0, et l arrêt du traitement par les glucocorticoïdes à 6 mois. HAS - Direction de l'evaluation Médicale, Economique et de Santé Publique 13/22
14 Parmi les critères de jugement secondaires Calcul du nombre de sujets nécessaires Analyse statistique Taux d événements indésirables parmi 9 EI prédéfinis exprimé en EI par patient/année à 6 mois après la randomisation. Intervalle de confiance à 95% (IC 95%) du taux de patients présentant une rémission complète et l IC 95,1% de la différence de ce taux entre les groupes RTX et CYC, 6 mois après la randomisation. Durée de la rémission complète et délai entre l obtention de la rémission complète et l apparition d une poussée partielle ou sévère. Tolérance clinique Hypothèses : marge de non infériorité de 20%, risque alpha unilatéral de 0,025, 70% de rémission complète dans les 2 groupes, taux de sortie d étude de 10% également distribué entre les 2 bras. Un échantillon de 100 patients par groupe permettait de démontrer la non infériorité de RTX versus CYC/AZA avec une puissance de 83%. La borne de non infériorité retenue était de -20%. La non infériorité de RTX versus CYC/AZA était démontrée si la borne inférieure de l intervalle de confiance à 95,1% (IC 95,1%) de la différence entre les taux de rémission complète à 6 mois était supérieure à -20%. L analyse finale du critère principal a été menée à la date du 9 janvier 2009, soit 6 mois après la randomisation de l ensemble des patients, sur la population en intention de traiter (ITT) correspondant à tous les patients ayant été randomisés. Afin de conforter les résultats, des analyses de sensibilité du critère principal ont été menées sur la population en intention de traiter (ITT) en appliquant la méthode du «biais maximum» pour l imputation des données manquantes et sur la population per protocole (PP). Une analyse intermédiaire du critère principal était prévue lorsque la moitié des patients inclus avait atteint le 6 ème mois de traitement. L objectif était d avoir la possibilité d arrêter l étude en cas d efficacité inférieure du groupe RTX par rapport au groupe contrôle. Afin de prendre en compte la multiplicité des tests liée à l analyse intermédiaire, un ajustement du risque alpha a été réalisé à l aide de la procédure de Lan-DeMets avec limite d arrêt de O Brien-Fleming : le seuil de significativité statistique de l analyse intermédiaire a été fixé à 0,003 et celui de l analyse principale à 0,049. Résultats : L étude s est déroulée entre décembre 2004 et janvier 2010 dans 8 centres aux Etats-Unis et 1 centre aux Pays-Bas. Un total de 198 patients a été randomisé, dont un patient du groupe CYC/AZA qui a retiré son consentement après la randomisation. La population ITT était de 197 patients avec 99 patients dans le groupe RTX et 98 patients dans le groupe CYC/AZA. La population PP était de 188 patients (4 patients exclus du groupe RTX et 5 patients du groupe CYC/AZA). A la date du 9 janvier 2009 (soit 6 mois après la randomisation de l ensemble des patients) : - 82 patients (82,8%) du groupe RTX et 79 (81%) du groupe CYC/AZA étaient encore sous traitement, et recevaient le traitement attribué lors de la randomisation (pas de cross over), - 5 patients du groupe RTX et 7 du groupe CYC/AZA avaient changé de groupe de traitement (cross-over), - 6 patients du groupe RTX et 5 du groupe CYC/AZA étaient traités selon un traitement choisi par l investigateur. A la fin de l étude, 61 patients (61,6%) du groupe RTX et 63 (64,3%) du groupe CYC/AZA étaient encore sous traitement et recevaient le traitement attribué lors de la randomisation. Caractéristiques des patients Les caractéristiques démographiques des patients inclus étaient similaires entre les 2 groupes de traitement. L âge médian était de 52 ans [15,92], avec 8,7% de patients âgés de moins de 30 ans, 11,2% entre 31 et 40 ans, 23,4% entre 41 et 50 ans, 25,4% entre 51 et 60 ans, 31,5% de plus de 60 ans. Un total de 99 patients (50,3%) était de sexe masculin et 98 (49,7%) de sexe féminin. En majorité les patients (n=147, 74,6%) avaient une GPA et 24,4% (n=48) avaient une PAM. Tous les patients avaient des ANCA par test Elisa, excepté un patient du groupe RTX. Environ 2/3 des patients de chaque groupe avaient des ANCA-PR3 et 1/3 des ANCA-MPO. A l inclusion et lors de l évaluation du BVAS/WG initial, les patients avaient des formes actives (BVAS/WG>8) et sévères de GPA et PAM avec notamment des atteintes rénales, pulmonaires et ORL. Pour près de la moitié des patients inclus (n=96, 48,8%), il s agissait d une poussée initiale de la maladie. HAS - Direction de l'evaluation Médicale, Economique et de Santé Publique 14/22
15 Résultat sur le critère principal Les résultats à la date du 9 janvier 2009, soit 6 mois après la randomisation de l ensemble des patients figurent dans le tableau 1. Tableau 1 : résultats sur le critère principal (population ITT) RTX N=99 N (%) CYC N=98 N (%) Différence de taux de rémission complète N Rémission IC 95,1% de la différence 63 (64,3) 52 (54,7) 9,5% [-4,30%; 23,40%] complète IC 95,1% 54,76 ; 73,81 44,68 ; 64,79 Les analyses sont faites sur les patients avec des résultats en termes de rémission complète au 6 ème mois d analyse. La borne inférieure de l IC 95,1% étant supérieure à la borne de non infériorité prédéfinie de -20%, la non infériorité de RTX (375mg/m²/semaine en perfusion IV durant 4 semaines) par rapport à CYC (2mg/kg/jour par voie orale durant 3 à 6 mois), tous deux associés aux glucocorticoïdes, a été démontrée sur la population en ITT. Les analyses de sensibilité ont mis en évidence une différence entre les 2 groupes de traitement sur la population PP de 9,9%, IC 95,1% [-4,1%; 23,9%] et celle sur la population en ITT avec application de la méthode du biais maximum pour l imputation des données manquantes de 10,6%, IC 95,1% [-3,2%; 24,3%], confirmant la non infériorité. Des analyses en sous-groupes dans la population des patients en rechute de GPA et de PAM ont été faites à titre exploratoire. Dans cette sous-population de patients, le taux de rémission complète à 6 mois a été de 66,7% (n=34/51) dans le bras RTX et de 42,0% (n=21/50) dans le bras CYC/AZA lorsque l on applique la méthode du biais maximum pour l imputation des données manquantes (différence de 24,7% (IC 95,1% [5,8%; 43,6%]) en faveur de RTX (p=0,013). Résultats sur les critères secondaires Evaluation de la supériorité de RTX : La proportion de patients en rémission complète à 6 mois a été de 64,3% (n=63/99) dans le groupe RTX et de 54,7% (n=52/98) dans le groupe contrôle (différence non statistiquement significative et borne inférieure de l IC 95,1% non supérieure à 0%). Durée de la rémission complète : Aucune différence statistiquement significative n a été mise en évidence entre les 2 groupes de traitement en termes de taux de rechute après obtention de la rémission Tolérance Données de l étude RAVE La population pour l analyse de la tolérance (correspondant aux patients ayant reçu au moins une dose du traitement de l étude) comprenait 99 patients dans le groupe RTX et 98 patients dans le groupe CYC/AZA. Tous les événements indésirables ont été collectés et l analyse a notamment porté sur 9 catégories d événements indésirables prédéfinis avant le début de l étude, à savoir : décès (toutes causes confondues), leucopénies ou thrombopénies de grade 2, infections de grade 3, cystites hémorragiques de grade 2 (confirmés par cystoscopie), pathologies malignes, événements thromboemboliques veineux (incluant thromboses veineuses profondes ou embolies pulmonaires), hospitalisations liées à la maladie ou à une complication du traitement d étude, réactions liées à la perfusion (incluant les syndromes de relargage des cytokines dans les 24 heures suivant la perfusion), accidents vasculaires cérébraux. Les taux d EI prédéfinis à 6 mois ont été comparés par une régression de Poisson. Tous les patients ont été suivis jusqu à la date de clôture générale de l étude. Le temps moyen de suivi a été de 1,4 an (16,8 mois) dans les 2 groupes de traitement. HAS - Direction de l'evaluation Médicale, Economique et de Santé Publique 15/22
16 Tolérance à 6 mois Arrêt de traitement pour intolérance : La proportion de patients ayant arrêté leur traitement en raison d un EI a été plus faible dans le groupe RTX avec 8 patients (8,1%) que dans le groupe CYC/AZA avec 13 (13,3%) patients. Les EI conduisant le plus fréquemment à un arrêt de traitement dans le groupe RTX ont été les insuffisances rénales aigues (n=2 ; 2,0%). Dans le groupe CYC/AZA, il s agissait principalement de leucopénies (n=3 ; 3,1%), de réactions d hypersensibilité (n=2 ; 2,0%) et d insuffisances rénales y compris aiguës (n=2 ; 2,0%). EI tous grades confondus : Il a été notifié EI chez 191 patients (97,0%), dont 997 chez 94 patients (94,9%) du groupe RTX et 978 chez 97 patients (99,0%) du groupe CYC/AZA. La majorité (75,0%, événements) de ces EI ont été de grade 1, et 18,7% (369 événements) ont été de grade 2. L incidence des EI et des EI sévères au cours des 6 premiers mois a été comparable entre les 2 groupes. La majorité des EI (64,6%) ont été considérés comme non imputables aux traitements selon le jugement de l investigateur. EI les plus fréquents ( 10%) : Les EI les plus fréquents ( 10%) ont été similaires entre les 2 groupes de traitement à l exception des leucopénies (10,1% pour RTX versus 26,5% pour CYC/AZA), des diarrhées (17,2% versus 12,2%), des rashs (10,1% versus 17,3%), des diminutions des globules blancs (4,0% versus 19,4%), et des œdèmes périphériques (16,2% versus 6,1%). EI graves : Un total de 33 patients (33,3%) du groupe RTX et 33 patients (33,7%) du groupe CYC/AZA ont présenté au moins un EIG. Le taux d EIG par patient-année a été numériquement plus faible dans le groupe RTX (0,97) ([IC 95,1% 0,72-1,26]) que dans le groupe CYC/AZA (1,15) ([IC 95,1% 0,88-1,50]). Les EIG les plus fréquemment décrits dans les 2 groupes de traitement étaient des infections, avec une fréquence comparable entre le groupe RTX (n=11, 11,1%) et le groupe CYC/AZA (n=10, 10,2%). Les EIG du système gastro-intestinal ont été rapportés chez 4 patients (4%) du groupe RTX versus aucun patient du groupe CYC/AZA. Il s agissait de diarrhées (2,0%), d une colite ischémique (1,0%), et d une hémorragie gastrointestinale (1,0%). La proportion de patients avec un événement indésirable vasculaire grave a été plus faible dans le groupe RTX (2,0%) par rapport au groupe CYC/AZA (8,2%) en raison de la différence du nombre de patients présentant des thromboses veineuses profondes graves (2 versus 8 patients). Pour les autres classes de systèmes-organes, la fréquence des EIG a été similaire entre les 2 groupes de traitement. EI prédéfinis : Une proportion plus faible de patients du groupe RTX (n=22 ; 22,2%) a présenté des EI prédéfinis par rapport au groupe CYC/AZA (n=34, 34,7%). Le taux d EI prédéfinis par patient/année a été similaire entre le groupe RTX et le groupe CYC/AZA (0,78 et 0,96, p=0,250). Le nombre de patients atteints de leucopénies de grade 2 a été plus faible dans le groupe RTX que dans le groupe CYC/AZA (5 versus 17 patients soit 5,1% versus 17,3%). Le nombre de patients présentant des infections de grade 3 a été identique dans les deux groupes de traitement (10 patients dans chaque groupe). Le nombre d hospitalisations liées à la maladie ou aux complications des traitements a été plus élevé dans le groupe RTX que dans le groupe CYC/AZA (10 patients (10,1%) versus 4 patients (4,1%)). Les motifs d hospitalisation des patients du groupe RTX étaient une leucopénie (n=3), une pneumonie (n=1), une hémorragie pulmonaire (n=1), une insuffisance rénale (n=1), une embolie pulmonaire (n=1), une ostéomyélite (n=1), une bronchite (n=1) et une hypersensibilité évaluée par l investigateur comme étant probablement en rapport avec le traitement (n=1). Ceux du groupe CYC/AZA étaient pneumonies (n=2), syndromes de détresse respiratoire aiguë (n=2), et infections des voies respiratoires supérieures (n=2). Trois décès sont survenus au cours des 6 premiers mois : un dans le groupe RTX lié à une défaillance multi-viscérale et 2 dans le groupe CYC/AZA liés à des infections. HAS - Direction de l'evaluation Médicale, Economique et de Santé Publique 16/22
17 Tolérance à 18 mois La fréquence et la nature des EI à 18 mois ont été cohérentes avec celles observées à 6 mois Données issues des PSUR Sur la période allant du 18 mai 2011 au 17 novembre 2013, cas d effets indésirables médicalement confirmés avec le rituximab (toutes indications confondues) ont été rapportés dans le monde, dont cas graves incluant cas d évolution fatale, soit un total de effets indésirables dont effets indésirables graves. L estimation du nombre de patients exposés au rituximab toutes indications confondues sur les périodes de chacun des PSUR/PBRER est de patients sur 6 mois (18 mai 2011 au 17 nov. 2011), patients sur 1 an (18 nov au 17 nov. 2012), patients sur 1 an (18 nov au 17 nov. 2013). Les systèmes-organes les plus fréquemment concernés par des effets indésirables sur la période étaient : - «Troubles généraux et anomalies au site d administration» avec 18,2% des EI, - «Infections et infections invasives» avec 12,6% des EI, - «Affections respiratoires, thoraciques et médiastinales» avec 8,2% des EI, - «Affections hématologiques et du système lymphatique» avec 6,9% des EI, - «Affections de la peau et du tissu sous-cutané» avec 6,8% des EI, - «Affections gastro-intestinales» avec 6,5% des EI, - «Investigations» avec 6,0% des EI. Les systèmes-organes les plus fréquemment concernés par les effets indésirables graves (EIG) sur la période étaient : - «Infections et infections invasives» représentant 20,4% des EIG, - «Troubles généraux et anomalies au site d administration» avec 14,7% des EIG, - «Affections hématologiques et du système lymphatique» avec 9,0% des EIG, - «Affections respiratoires, thoraciques et médiastinales» avec 8,9% des EIG. Sur la période, cas d évolution fatale et 192 cas médicalement confirmés de grossesse exposée ont été rapportés dans le monde. Leur analyse n a pas révélé de nouveaux signaux nécessitant une mise à jour des mentions légales. En France, sur la période, il y a eu cas d effets indésirables médicalement confirmés avec le rituximab (toutes indications confondues), dont cas graves incluant 171 cas d évolution fatale, ce qui représente un total de effets indésirables dont effets indésirables graves. Les effets indésirables rapportés en France étaient cohérents avec ceux rapportés dans le reste du monde, en termes de systèmes-organes les plus fréquemment concernés par des effets indésirables y compris les graves. Les données françaises et internationales sont cohérentes avec le profil de tolérance décrit dans le Résumé des Caractéristiques du Produit Données issues du RCP Expérience acquise dans la granulomatose avec polyangéite et la polyangéite microscopique : Selon le RCP, les effets indésirables survenus à 6 mois chez 10 % des patients traités par MABTHERA, et à une fréquence plus importante que pour le comparateur, dans l étude clinique pivot sont : diarrhée (18%), œdèmes périphériques (16%), spasmes musculaires (18%), arthralgies (15%), insomnie (14%), toux (12%), hypertension (12%), dyspnée (11%), épistaxis (11%), douleurs dorsales (10%), vertiges (10%), tremblements (10%). HAS - Direction de l'evaluation Médicale, Economique et de Santé Publique 17/22
18 9.2.4 Plan de gestion des risques 18 Des risques identifiés et des risques potentiels importants ont été mis en évidence selon les indications 19 du médicament : Risques identifiés importants : Réactions liées à la perfusion (a), infections (a), réponse altérée à une immunisation (a), leucoencéphalopathie multifocale progressive (a), neutropénie (y compris neutropénie prolongée) (a), réactivation d hépatite B (a), hypogammaglobulinémie (b), syndrome de Stevens-Johnson / nécrolyse épidermique toxique (a), Risques potentiels importants : hépatite virale B de novo (b), infections opportunistes (a), affections malignes (c), impact sur les maladies cardiovasculaires (b), perforation gastro-intestinale (b), déplétion prolongée en lymphocytes B (a), usage hors AMM dans des maladies auto-immunes (b), usage hors AMM en pédiatrie (a), récidives (c) Informations manquantes importantes : usage pendant la grossesse et l allaitement (a), immunogénicité et maladies auto-immunes (b), utilisation à long terme chez les patients avec GPA/PAM (c). Le plan de pharmacovigilance comprend en plus de la pharmacovigilance de routine : - l analyse des données d études cliniques de long terme ; - des registres : BSRBR en Grande-Bretagne, ARTIS en Suède, RABBIT en Allemagne ; - l envoi d un questionnaire spécifique aux professionnels de santé pour documenter au mieux et de façon standardisée les cas de leucoencéphalopathie multifocale progressive dans toutes les indications du rituximab, les cas de réactivation d hépatite B dans l indication des maladies auto-immunes uniquement; - des études ad hoc sur certains risques identifiés ou potentiels dans certaines indications notamment chez les patients traités pour GPA/PAM Résumé & discussion Une étude de phase II/III (étude RAVE) a concerné 197 patients atteints en majorité de granulomatose avec polyangéite (GPA) (n=147, 74,6%) et pour 24,4 % (n=48) de polyangéite microscopique (PAM), sévères. Tous, excepté un patient du groupe rituximab, avaient des autoanticorps dirigés contre le cytoplasme des polynucléaires neutrophiles (ANCA) par test Elisa. A l inclusion et lors de l évaluation du score BVAS/WG 20 initial, les patients avaient des formes actives (BVAS/WG>8) et sévères de GPA et PAM avec notamment des atteintes rénales, pulmonaires et ORL. Pour près de la moitié des patients inclus (n=96, 48,8%), il s agissait d une poussée initiale de la maladie. L âge médian des patients était de 52 ans [15,92], avec 8,7% de patients âgés de moins de 30 ans, 11,2% entre 31 et 40 ans, 23,4% entre 41 et 50 ans, 25,4% entre 51 et 60 ans, 31,5% de plus de 60 ans. Le ratio homme/femme était équilibré (50,3% d hommes et 49,7% de femmes). Dans l induction de la rémission complète de GPA et PAM sévères et actives à 6 mois, la non infériorité du rituximab administré durant 4 semaines consécutives par rapport au cyclophosphamide administré par voie orale durant 3 à 6 mois suivi d azathioprine par voie orale jusqu au 18 ème mois, en association aux glucocorticoïdes, a été démontrée avec une différence de 9,5% (IC 95,1% [-4,30%; 23,40%]). Le cyclophosphamide, comparateur de l étude, a été administré exclusivement par voie orale en conformité avec les recommandations européennes (EULAR) 6 qui laissent le choix de la voie d administration au prescripteur. Les recommandations françaises du GFEV et de la HAS 5 préconisent de préférer l emploi de la voie IV et de réserver l emploi de la voie orale, plus toxique, 18 Version 9.3 du 24 juin (a) Toutes les indications (b) PR et GPA (Granulomatose avec Polyangéite microscopique) et PAM (Polyangéite Microscopique) (c) GPA/PAM 20 Birmingham Vasculitis Activity Score for Wegener's Granulomatosis HAS - Direction de l'evaluation Médicale, Economique et de Santé Publique 18/22
19 aux situations d échec de la voie IV 21. Il n a pas été mis en évidence de supériorité de RTX par rapport au CYC par voie orale. Alors que les patients du bras RTX n ont pas reçu de traitement d entretien par AZA, aucune différence statistiquement significative n a été mise en évidence entre les 2 bras de traitement en termes de taux de rechute après obtention de la rémission. Une analyse du sous-groupe des patients en rechute de GPA et de PAM, au moment de l inclusion dans l étude, suggère que le rituximab est plus efficace que le CYC par voie orale sur le taux de rémission complète à 6 mois. Il a été notifié 997 EI chez 94 patients (94,9%) du groupe RTX et 978 chez 97 patients (99,0%) du groupe CYC/AZA. La majorité (75,0%, événements) de ces EI ont été de grade 1, et 18,7% (369 événements) ont été de grade 2. La majorité des EI (64,6%) ont été considérés comme non imputables aux traitements selon le jugement de l investigateur. Les EI les plus fréquents ( 10%) étaient comparables dans les 2 groupes de traitement à l exception : - de la leucopénie (10,1% pour RTX versus 26,5% pour CYC/AZA), - de la diarrhée (17,2% versus 12,2%), - des rashs (10,1% versus 17,3%), - d une baisse des globules blancs (4,0% versus 19,4%). Un total de 33 patients (33,3%) du groupe RTX et 33 patients (33,7%) du groupe CYC/AZA ont rapporté au moins un EIG. Les EIG les plus fréquemment décrits dans les 2 groupes de traitement étaient des infections, avec une fréquence comparable entre le groupe RTX (n=11, 11,1%) et le groupe CYC/AZA (n=10, 10,2%). Les EIG gastro-intestinaux ont été rapportés chez 4 patients (4%) du groupe RTX versus aucun patient du groupe CYC/AZA. Il s agissait de diarrhée (2,0%), d une colite ischémique (1,0%), et d une hémorragie gastrointestinale (1,0%). La proportion de patients ayant développé un événement indésirable vasculaire grave a été plus faible dans le groupe RTX (2,0%) par rapport au groupe CYC/AZA (8,2%) en raison de la différence du nombre de patients présentant des thromboses veineuses profondes graves (2 versus 8 patients). Pour les autres classes de systèmes-organes, la fréquence des EIG a été similaire entre les 2 groupes de traitement. Trois décès sont survenus au cours des 6 premiers mois : un dans le groupe RTX lié à une défaillance multi-viscérale et 2 dans le groupe CYC/AZA liés à des infections Programme d études Les études MAINRITSAN (publiée) 22, MAINRITSAN 2 et RITAZAREM (en cours) visent notamment à établir l indication, le mode optimal d administration et la durée du traitement du rituximab en traitement d entretien des vascularites. 21 Les recommandations actuellement en vigueur placent l emploi du CYC par voie orale en 3 ème intention (cf paragraphe 010 Place dans la stratégie thérapeutique). 22 Guillevin L, Pagnoux C, Karras A, et al. Rituximab versus azathioprine for maintenance in ANCAassociated vasculitis. N Engl J Med 2014 ;371: HAS - Direction de l'evaluation Médicale, Economique et de Santé Publique 19/22
20 010 PLACE DANS LA STRATEGIE THERAPEUTIQUE Dans le traitement d induction de la rémission de la GPA et de la PAM systémiques : Sur la base des résultats de l étude RAVE de non infériorité du rituximab par rapport au cyclophosphamide oral pour induire la rémission de certaines formes de GPA et de PAM, le GFEV 9 a formulé des recommandations pour la prescription du rituximab. En 1 ère intention, le rituximab peut être prescrit au même titre que le cyclophosphamide. Le choix du traitement est laissé à l appréciation du clinicien lorsque les malades sont pris en charge pour une 1 ère poussée de la maladie. La décision prend en compte les antécédents du patient, les facteurs de morbidité préexistants, de la maladie à traiter et de l opinion du patient. Le rituximab doit être prescrit de manière préférentielle chez les femmes en âge de procréer, particulièrement lorsqu elles sont âgées de plus de 30 ans. Conformément à l AMM, une contraception dans l année qui suit l administration du rituximab est recommandée, en l absence de données sur l effet prolongé du rituximab sur la descendance. En traitement d induction de 2 ème intention d une GPA ou d une PAM, le rituximab est désormais recommandé à la place du cyclophosphamide par voie orale dans les situations en rechute, d échec ou de réponse incomplète au cyclophosphamide IV prescrit selon les recommandations du PNDS 5 ainsi qu aux patients intolérants au cyclophosphamide ou qui ont développé une complication liée à l exposition préalable à ce dernier (cystite hémorragique par exemple). Ainsi, la forme orale de cyclophosphamide ne doit désormais être prescrite qu en 3 ème ligne de traitement, c est-à-dire après échec total ou partiel du rituximab. Sur la base des résultats du sous-groupe des patients pris en charge pour le traitement d une rechute dans l étude RAVE, le rituximab est préféré au cyclophosphamide chez les patients en rechute de GPA ou de PAM ayant déjà reçu un immunosuppresseur conventionnel. Recommandations concernant les traitements associés au rituximab : MABTHERA est associé à des réactions liées à la perfusion, probablement imputables au relargage de cytokines et/ou d autres médiateurs chimiques. Une prémédication par un analgésique/antipyrétique et un antihistaminique doit systématiquement être administrée avant chaque perfusion de MABTHERA. La prémédication comprend aussi une dose de 100 mg de méthylprednisolone administrée à chaque injection. Le traitement de la GPA et de la PAM sévère peut comprendre l administration de méthylprednisolone par voie intraveineuse à une posologie de mg par jour pendant 1 à 3 jours avant la première perfusion de MABTHERA (la dernière dose pouvant être administrée le même jour que la première perfusion de MABTHERA), avec un relai par la prednisone orale (à dose maximale de 80 mg/jour) pendant et après le traitement par MABTHERA. MABTHERA ne sera administré qu après une prémédication avec une corticothérapie injectable. HAS - Direction de l'evaluation Médicale, Economique et de Santé Publique 20/22
COMMISSION DE LA TRANSPARENCE AVIS DE LA COMMISSION. 10 octobre 2001
 COMMISSION DE LA TRANSPARENCE AVIS DE LA COMMISSION 10 octobre 2001 VIRAFERONPEG 50 µg 80 µg 100 µg 120 µg 150 µg, poudre et solvant pour solution injectable B/1 B/4 Laboratoires SCHERING PLOUGH Peginterféron
COMMISSION DE LA TRANSPARENCE AVIS DE LA COMMISSION 10 octobre 2001 VIRAFERONPEG 50 µg 80 µg 100 µg 120 µg 150 µg, poudre et solvant pour solution injectable B/1 B/4 Laboratoires SCHERING PLOUGH Peginterféron
Assurance Maladie Obligatoire Commission de la Transparence des médicaments. Avis 2 23 Octobre 2012
 Assurance Maladie Obligatoire Commission de la Transparence des médicaments Avis 2 23 Octobre 2012 Titre I : Nom du médicament, DCI, forme pharmaceutique, dosage, présentation HUMIRA (DCI : Adalimumab
Assurance Maladie Obligatoire Commission de la Transparence des médicaments Avis 2 23 Octobre 2012 Titre I : Nom du médicament, DCI, forme pharmaceutique, dosage, présentation HUMIRA (DCI : Adalimumab
COMMISSION DE LA TRANSPARENCE
 COMMISSION DE LA TRANSPARENCE Avis 2 avril 2014 DERMOVAL, gel flacon de 20 ml (CIP : 34009 326 130 4 5) DERMOVAL 0,05 POUR CENT, crème tube de 10 g (CIP : 34009 320 432 9 3) Laboratoire GLAXOSMITHKLINE
COMMISSION DE LA TRANSPARENCE Avis 2 avril 2014 DERMOVAL, gel flacon de 20 ml (CIP : 34009 326 130 4 5) DERMOVAL 0,05 POUR CENT, crème tube de 10 g (CIP : 34009 320 432 9 3) Laboratoire GLAXOSMITHKLINE
VASCULARITES NÉCROSANTES SYSTÉMIQUES
 GUIDE AFFECTION DE LONGUE DURÉE VASCULARITES NÉCROSANTES SYSTÉMIQUES Protocole national de diagnostic et de soins Novembre 2007 Ce document est téléchargeable sur www.has-sante.fr Haute Autorité de santé
GUIDE AFFECTION DE LONGUE DURÉE VASCULARITES NÉCROSANTES SYSTÉMIQUES Protocole national de diagnostic et de soins Novembre 2007 Ce document est téléchargeable sur www.has-sante.fr Haute Autorité de santé
Avis 29 mai 2013. XYZALL 5 mg, comprimé B/14 (CIP : 34009 358 502 4-9) B/28 (CIP : 34009 358 505 3-9) Laboratoire UCB PHARMA SA.
 COMMISSION DE LA TRANSPARENCE Avis 29 mai 2013 XYZALL 5 mg, comprimé B/14 (CIP : 34009 358 502 4-9) B/28 (CIP : 34009 358 505 3-9) Laboratoire UCB PHARMA SA DCI Code ATC (2012) Motif de l examen Liste
COMMISSION DE LA TRANSPARENCE Avis 29 mai 2013 XYZALL 5 mg, comprimé B/14 (CIP : 34009 358 502 4-9) B/28 (CIP : 34009 358 505 3-9) Laboratoire UCB PHARMA SA DCI Code ATC (2012) Motif de l examen Liste
ACTUALITES THERAPEUTIQUES. Dr Sophie PITTION (CHU Nancy) Metz, le 2 Juin 2012
 ACTUALITES THERAPEUTIQUES Dr Sophie PITTION (CHU Nancy) Metz, le 2 Juin 2012 Traitement de fond Objectifs: Réduire le nombre de poussées Arrêter ou freiner la progression du handicap Les traitements disponibles
ACTUALITES THERAPEUTIQUES Dr Sophie PITTION (CHU Nancy) Metz, le 2 Juin 2012 Traitement de fond Objectifs: Réduire le nombre de poussées Arrêter ou freiner la progression du handicap Les traitements disponibles
COMMISSION DE LA TRANSPARENCE. Avis. 23 mai 2007
 COMMISSION DE LA TRANSPARENCE Avis 23 mai 2007 SUTENT 12,5 mg, gélule Flacon de 30 (CIP: 376 265-0) SUTENT 25 mg, gélule Flacon de 30 (CIP: 376 266-7) SUTENT 50 mg, gélule Flacon de 30 (CIP: 376 267-3)
COMMISSION DE LA TRANSPARENCE Avis 23 mai 2007 SUTENT 12,5 mg, gélule Flacon de 30 (CIP: 376 265-0) SUTENT 25 mg, gélule Flacon de 30 (CIP: 376 266-7) SUTENT 50 mg, gélule Flacon de 30 (CIP: 376 267-3)
COMMISSION DE LA TRANSPARENCE AVIS. 18 janvier 2006
 COMMISSION DE LA TRANSPARENCE AVIS 18 janvier 2006 ADVATE 1500 UI, poudre et solvant pour solution injectable 1 flacon(s) en verre de 1 500 UI - 1 flacon(s) en verre de 5 ml avec matériel(s) de perfusion(s)
COMMISSION DE LA TRANSPARENCE AVIS 18 janvier 2006 ADVATE 1500 UI, poudre et solvant pour solution injectable 1 flacon(s) en verre de 1 500 UI - 1 flacon(s) en verre de 5 ml avec matériel(s) de perfusion(s)
Association lymphome malin-traitement par Interféron-α- sarcoïdose
 Association lymphome malin-traitement par Interféron-α- sarcoïdose Auteurs Cendrine Godet (*) Jean-Pierre Frat (**) Cédric Landron (*) Lydia Roy (***) Paul Ardilouze (****) Jean-Pierre Tasu (****) (*)
Association lymphome malin-traitement par Interféron-α- sarcoïdose Auteurs Cendrine Godet (*) Jean-Pierre Frat (**) Cédric Landron (*) Lydia Roy (***) Paul Ardilouze (****) Jean-Pierre Tasu (****) (*)
PLACE DU RITUXIMAB DANS LE TRAITEMENT DES VASCULARITES AANCA : ETUDE RETROSPECTIVE MULTICENTRIQUE
 ROYAUME DU MAROC UNIVERSITE SIDI MOHAMMED BENABDELLAH FACULTE DE MEDECINE ET DE PHARMACIE FES UNIVERSITESIDI MOHAMMED BENABDELLAH FES PLACE DU RITUXIMAB DANS LE TRAITEMENT DES VASCULARITES AANCA : ETUDE
ROYAUME DU MAROC UNIVERSITE SIDI MOHAMMED BENABDELLAH FACULTE DE MEDECINE ET DE PHARMACIE FES UNIVERSITESIDI MOHAMMED BENABDELLAH FES PLACE DU RITUXIMAB DANS LE TRAITEMENT DES VASCULARITES AANCA : ETUDE
INDUCTION DES LYMPHOCYTES T- RÉGULATEURS PAR IL2 A TRÈS FAIBLE DOSE DANS LES PATHOLOGIES AUTO- IMMUNES ET INFLAMMATOIRES APPROCHE TRANSNOSOGRAPHIQUE
 INDUCTION DES LYMPHOCYTES T- RÉGULATEURS PAR IL2 A TRÈS FAIBLE DOSE DANS LES PATHOLOGIES AUTO- IMMUNES ET INFLAMMATOIRES APPROCHE TRANSNOSOGRAPHIQUE Etude clinique N NCT01988506 Inves9gateur coordinateur
INDUCTION DES LYMPHOCYTES T- RÉGULATEURS PAR IL2 A TRÈS FAIBLE DOSE DANS LES PATHOLOGIES AUTO- IMMUNES ET INFLAMMATOIRES APPROCHE TRANSNOSOGRAPHIQUE Etude clinique N NCT01988506 Inves9gateur coordinateur
1289($8;75$,7(0(176 '(69$6&8/$5,7(6
 1289($8;75$,7(0(176 '(69$6&8/$5,7(6 M De Bandt. La découverte de la présence des ANCA, au cours de certaines formes de vascularites systémiques a il y a une quinzaine d année, a provoqué de nombreux travaux
1289($8;75$,7(0(176 '(69$6&8/$5,7(6 M De Bandt. La découverte de la présence des ANCA, au cours de certaines formes de vascularites systémiques a il y a une quinzaine d année, a provoqué de nombreux travaux
COMMISSION DE LA TRANSPARENCE. Avis. 3 septembre 2008
 COMMISSION DE LA TRANSPARENCE Avis 3 septembre 2008 PRIVIGEN 100 mg/ml, solution pour perfusion Flacon en verre de 50 ml (CIP: 572 790-7 Flacon en verre de 100 ml (CIP: 572 791-3) Flacon en verre de 200
COMMISSION DE LA TRANSPARENCE Avis 3 septembre 2008 PRIVIGEN 100 mg/ml, solution pour perfusion Flacon en verre de 50 ml (CIP: 572 790-7 Flacon en verre de 100 ml (CIP: 572 791-3) Flacon en verre de 200
La périartérite noueuse Maladie de Küssmaul-Maier
 Maladie de Küssmaul-Maier La maladie Le diagnostic Les aspects génétiques Le traitement, la prise en charge, la prévention Vivre avec En savoir plus Madame, Monsieur, Cette fiche est destinée à vous informer
Maladie de Küssmaul-Maier La maladie Le diagnostic Les aspects génétiques Le traitement, la prise en charge, la prévention Vivre avec En savoir plus Madame, Monsieur, Cette fiche est destinée à vous informer
COMMISSION DE LA TRANSPARENCE AVIS. 18 novembre 2009
 COMMISSION DE LA TRANSPARENCE AVIS 18 novembre 2009 LEDERTREXATE 5 mg, solution injectable B/1 ampoule de 2 ml (Code CIP : 315 012-5) LEDERTREXATE 25 mg, solution injectable B/1 ampoule de 1 ml (Code CIP
COMMISSION DE LA TRANSPARENCE AVIS 18 novembre 2009 LEDERTREXATE 5 mg, solution injectable B/1 ampoule de 2 ml (Code CIP : 315 012-5) LEDERTREXATE 25 mg, solution injectable B/1 ampoule de 1 ml (Code CIP
COMMISSION DE LA TRANSPARENCE AVIS. 10 mai 2006
 COMMISSION DE LA TRANSPARENCE AVIS 10 mai 2006 METOJECT 10 mg/ml, solution injectable en seringue pré-remplie 1 seringue pré-remplie en verre de 0,75 ml avec aiguille : 371 754-3 1 seringue pré- remplie
COMMISSION DE LA TRANSPARENCE AVIS 10 mai 2006 METOJECT 10 mg/ml, solution injectable en seringue pré-remplie 1 seringue pré-remplie en verre de 0,75 ml avec aiguille : 371 754-3 1 seringue pré- remplie
COMMISSION DE LA TRANSPARENCE. 10 décembre 2008
 COMMISSION DE LA TRANSPARENCE AVIS 10 décembre 2008 VIRAFERONPEG 50 µg/ 0.5 ml, poudre et solvant pour solution injectable B/1 : code CIP 355 189.3 B/4 : code CIP 355 191.8 VIRAFERONPEG, stylo pré-rempli
COMMISSION DE LA TRANSPARENCE AVIS 10 décembre 2008 VIRAFERONPEG 50 µg/ 0.5 ml, poudre et solvant pour solution injectable B/1 : code CIP 355 189.3 B/4 : code CIP 355 191.8 VIRAFERONPEG, stylo pré-rempli
CLINIMIX AVIS DE LA COMMISSION DE LA TRANSPARENCE
 CLINIMIX AVIS DE LA COMMISSION DE LA TRANSPARENCE BAXTER_CLINIMIX N9G15 E et N12G20E_Avis CT_14-02-2007.pdf BAXTER_CLINIMIX N9G15E N12G20E N14G30 N17G35_Avis CT_12-12-2001.pdf BAXTER_CLINIMIX changement
CLINIMIX AVIS DE LA COMMISSION DE LA TRANSPARENCE BAXTER_CLINIMIX N9G15 E et N12G20E_Avis CT_14-02-2007.pdf BAXTER_CLINIMIX N9G15E N12G20E N14G30 N17G35_Avis CT_12-12-2001.pdf BAXTER_CLINIMIX changement
Plan. Introduction. Les Nouveaux Anticoagulants Oraux et le sujet âgé. Audit de prescription au Centre Hospitalier Geriatrique du Mont d Or
 Plan Introduction Les Nouveaux Anticoagulants Oraux et le sujet âgé Audit de prescription au Centre Hospitalier Geriatrique du Mont d Or Introduction NACO: une actualité brûlante! AVK: Plus forte incidence
Plan Introduction Les Nouveaux Anticoagulants Oraux et le sujet âgé Audit de prescription au Centre Hospitalier Geriatrique du Mont d Or Introduction NACO: une actualité brûlante! AVK: Plus forte incidence
COMMISSION DE LA TRANSPARENCE AVIS. 23 mai 2012
 COMMISSION DE LA TRANSPARENCE AVIS 23 mai 2012 SEGLOR 5 mg, gélule B/30 (CIP: 321 899-8) SEGLOR LYOC 5 mg, lyophilisat oral B/30 (CIP: 334 062-4) Laboratoire UCB PHARMA dihydroergotamine (mésilate de)
COMMISSION DE LA TRANSPARENCE AVIS 23 mai 2012 SEGLOR 5 mg, gélule B/30 (CIP: 321 899-8) SEGLOR LYOC 5 mg, lyophilisat oral B/30 (CIP: 334 062-4) Laboratoire UCB PHARMA dihydroergotamine (mésilate de)
COMMISSION DE LA TRANSPARENCE AVIS. 1 er octobre 2008
 COMMISSION DE LA TRANSPARENCE AVIS 1 er octobre 2008 Examen dans le cadre de la réévaluation du service médical rendu de la classe des IMAO B, en application de l article R 163-21 du code de la sécurité
COMMISSION DE LA TRANSPARENCE AVIS 1 er octobre 2008 Examen dans le cadre de la réévaluation du service médical rendu de la classe des IMAO B, en application de l article R 163-21 du code de la sécurité
Point d Information. Le PRAC a recommandé que le RCP soit modifié afin d inclure les informations suivantes:
 Point d Information Médicaments à base d ivabradine, de codéine, médicaments contenant du diméthyl fumarate, du mycophénolate mofétil/acide mycophénolique, de l octocog alpha, spécialité Eligard (contenant
Point d Information Médicaments à base d ivabradine, de codéine, médicaments contenant du diméthyl fumarate, du mycophénolate mofétil/acide mycophénolique, de l octocog alpha, spécialité Eligard (contenant
L EMEA accepte d évaluer la demande d autorisation de mise sur le marché de la LENALIDOMIDE
 L EMEA accepte d évaluer la demande d autorisation de mise sur le marché de la LENALIDOMIDE NEUCHATEL, Suisse, 7 avril/prnewswire/ -- - LA LENALIDOMIDE est évaluée par l EMEA comme thérapie orale pour
L EMEA accepte d évaluer la demande d autorisation de mise sur le marché de la LENALIDOMIDE NEUCHATEL, Suisse, 7 avril/prnewswire/ -- - LA LENALIDOMIDE est évaluée par l EMEA comme thérapie orale pour
TYNDALL. 13 rue Dubrunfaut 75012 PARIS Tél. : 01 74 05 74 23 >SIREN N 451 386 544 APE N 00014. Bulletin d Informations. et d échanges N 24 MARS 2009
 TYNDALL Bulletin d Informations 13 rue Dubrunfaut 75012 PARIS Tél. : 01 74 05 74 23 >SIREN N 451 386 544 APE N 00014 Site internet : www.inflamoeil.org SOMMAIRE 1. L éditorial de la Présidente 2. Des immunosuppresseurs
TYNDALL Bulletin d Informations 13 rue Dubrunfaut 75012 PARIS Tél. : 01 74 05 74 23 >SIREN N 451 386 544 APE N 00014 Site internet : www.inflamoeil.org SOMMAIRE 1. L éditorial de la Présidente 2. Des immunosuppresseurs
27 ème JOURNEE SPORT ET MEDECINE Dr Roukos ABI KHALIL Digne Les Bains 23 novembre 2013
 27 ème JOURNEE SPORT ET MEDECINE Dr Roukos ABI KHALIL Digne Les Bains 23 novembre 2013 Les Nouveaux Anticoagulants Oraux (NACO) dans la maladie thrombo embolique veineuse INTRODUCTION Thrombose veineuse
27 ème JOURNEE SPORT ET MEDECINE Dr Roukos ABI KHALIL Digne Les Bains 23 novembre 2013 Les Nouveaux Anticoagulants Oraux (NACO) dans la maladie thrombo embolique veineuse INTRODUCTION Thrombose veineuse
Une forte dynamique des prescriptions de ces nouveaux anti-coagulants oraux
 27 novembre 2013 Nouveaux anti-coagulants oraux : une étude de l Assurance Maladie souligne la dynamique forte de ces nouveaux médicaments et la nécessité d une vigilance accrue dans leur utilisation Les
27 novembre 2013 Nouveaux anti-coagulants oraux : une étude de l Assurance Maladie souligne la dynamique forte de ces nouveaux médicaments et la nécessité d une vigilance accrue dans leur utilisation Les
Fiche Produit Profils Médicalisés PHMEV
 Guide méthodologique développé par l équipe de projets ci-dessous : Fiche Produit Profils Médicalisés PHMEV EQUIPE PROJET Chef de projet : Maryline CHARRA, Pharmacien Conseil Responsable de la mission
Guide méthodologique développé par l équipe de projets ci-dessous : Fiche Produit Profils Médicalisés PHMEV EQUIPE PROJET Chef de projet : Maryline CHARRA, Pharmacien Conseil Responsable de la mission
Création de procédures inter-services pour la gestion des essais de phase I à l Institut Gustave Roussy
 Création de procédures inter-services pour la gestion des essais de phase I à l Institut Gustave Roussy A.A. MOUSSA D. SCHWOB Institut de cancérologie Gustave-Roussy 94805 Villejuif cedex - FRANCE Plan
Création de procédures inter-services pour la gestion des essais de phase I à l Institut Gustave Roussy A.A. MOUSSA D. SCHWOB Institut de cancérologie Gustave-Roussy 94805 Villejuif cedex - FRANCE Plan
La maladie de Wegener La granulomatose de Wegener
 La granulomatose de Wegener La maladie Le diagnostic Les aspects génétiques Le traitement, la prise en charge, la prévention Vivre avec En savoir plus Madame, Monsieur, Cette fiche est destinée à vous
La granulomatose de Wegener La maladie Le diagnostic Les aspects génétiques Le traitement, la prise en charge, la prévention Vivre avec En savoir plus Madame, Monsieur, Cette fiche est destinée à vous
LES NOUVEAUX ANTICOAGULANTS
 LES NOUVEAUX ANTICOAGULANTS Pr. Alessandra Bura-Rivière, Service de Médecine Vasculaire Hôpital Rangueil, 1 avenue Jean Poulhès, 31059 Toulouse cedex 9 INTRODUCTION Depuis plus de cinquante ans, les héparines
LES NOUVEAUX ANTICOAGULANTS Pr. Alessandra Bura-Rivière, Service de Médecine Vasculaire Hôpital Rangueil, 1 avenue Jean Poulhès, 31059 Toulouse cedex 9 INTRODUCTION Depuis plus de cinquante ans, les héparines
PRINTEMPS MEDICAL DE BOURGOGNE ASSOCIATIONS ANTIAGREGANTS ET ANTICOAGULANTS : INDICATIONS ET CONTRE INDICATIONS
 PRINTEMPS MEDICAL DE BOURGOGNE ASSOCIATIONS ANTIAGREGANTS ET ANTICOAGULANTS : INDICATIONS ET CONTRE INDICATIONS Dr Mourot cardiologue Hôpital d Auxerre le 31 mars 2012 PLAN DE LA PRESENTATION ASSOCIATION
PRINTEMPS MEDICAL DE BOURGOGNE ASSOCIATIONS ANTIAGREGANTS ET ANTICOAGULANTS : INDICATIONS ET CONTRE INDICATIONS Dr Mourot cardiologue Hôpital d Auxerre le 31 mars 2012 PLAN DE LA PRESENTATION ASSOCIATION
Traitement de l hépatite C: données récentes
 Traitement de l hépatite C: données récentes J.-P. BRONOWICKI (Vandœuvre-lès-Nancy) Tirés à part : Jean-Pierre Bronowicki Service d Hépatogastroentérologie, CHU de Nancy, 54500 Vandœuvre-lès-Nancy. Le
Traitement de l hépatite C: données récentes J.-P. BRONOWICKI (Vandœuvre-lès-Nancy) Tirés à part : Jean-Pierre Bronowicki Service d Hépatogastroentérologie, CHU de Nancy, 54500 Vandœuvre-lès-Nancy. Le
COMMISSION DE LA TRANSPARENCE. Avis. 10 mars 2010
 COMMISSION DE LA TRANSPARENCE Avis 10 mars 2010 ARIXTRA 1,5 mg/0,3 ml, solution injectable en seringue pré-remplie - Boîte de 2 (CIP : 363 500-6) - Boîte de 7 (CIP : 363 501-2) - Boîte de 10 (CIP : 564
COMMISSION DE LA TRANSPARENCE Avis 10 mars 2010 ARIXTRA 1,5 mg/0,3 ml, solution injectable en seringue pré-remplie - Boîte de 2 (CIP : 363 500-6) - Boîte de 7 (CIP : 363 501-2) - Boîte de 10 (CIP : 564
NOTICE: INFORMATION DE L UTILISATEUR. Immukine 100 microgrammes/0,5 ml solution injectable (Interféron gamma-1b recombinant humain)
 NOTICE: INFORMATION DE L UTILISATEUR Immukine 100 microgrammes/0,5 ml solution injectable (Interféron gamma-1b recombinant humain) Veuillez lire attentivement l'intégralité de cette notice avant d'utiliser
NOTICE: INFORMATION DE L UTILISATEUR Immukine 100 microgrammes/0,5 ml solution injectable (Interféron gamma-1b recombinant humain) Veuillez lire attentivement l'intégralité de cette notice avant d'utiliser
Item 169 : Évaluation thérapeutique et niveau de preuve
 Item 169 : Évaluation thérapeutique et niveau de preuve COFER, Collège Français des Enseignants en Rhumatologie Date de création du document 2010-2011 Table des matières ENC :...3 SPECIFIQUE :...3 I Différentes
Item 169 : Évaluation thérapeutique et niveau de preuve COFER, Collège Français des Enseignants en Rhumatologie Date de création du document 2010-2011 Table des matières ENC :...3 SPECIFIQUE :...3 I Différentes
La maladie de Still de l adulte
 La maladie de Still de l adulte Syndrome de Wissler-Fanconi La maladie Le diagnostic Le traitement, la prise en charge, la prévention Vivre avec En savoir plus Madame, Monsieur Cette fiche est destinée
La maladie de Still de l adulte Syndrome de Wissler-Fanconi La maladie Le diagnostic Le traitement, la prise en charge, la prévention Vivre avec En savoir plus Madame, Monsieur Cette fiche est destinée
ALK et cancers broncho-pulmonaires. Laurence Bigay-Gamé Unité d oncologie thoracique Hôpital Larrey, Toulouse
 ALK et cancers broncho-pulmonaires Laurence Bigay-Gamé Unité d oncologie thoracique Hôpital Larrey, Toulouse Toulouse, le 19 Février 2013 Adénocarcinomes : Lung Cancer Mutation Consortium Identification
ALK et cancers broncho-pulmonaires Laurence Bigay-Gamé Unité d oncologie thoracique Hôpital Larrey, Toulouse Toulouse, le 19 Février 2013 Adénocarcinomes : Lung Cancer Mutation Consortium Identification
Le RIVAROXABAN (XARELTO ) dans l embolie pulmonaire
 Le RIVAROXABAN (XARELTO ) dans l embolie pulmonaire Dr Florence Parent Service de Pneumologie et Soins Intensifs de Pneumologie Hôpital Bicêtre, AP-HP Inserm U999. Université Paris-Sud Traitement anticoagulant
Le RIVAROXABAN (XARELTO ) dans l embolie pulmonaire Dr Florence Parent Service de Pneumologie et Soins Intensifs de Pneumologie Hôpital Bicêtre, AP-HP Inserm U999. Université Paris-Sud Traitement anticoagulant
Spondylarthropathies : diagnostic, place des anti-tnf et surveillance par le généraliste. Pr P. Claudepierre CHU Henri Mondor - Créteil
 Spondylarthropathies : diagnostic, place des anti-tnf et surveillance par le généraliste Pr P. Claudepierre CHU Henri Mondor - Créteil Le Diagnostic Objectif de la démarche diagnostique Diagnostic de SPONDYLARTHROPATHIE
Spondylarthropathies : diagnostic, place des anti-tnf et surveillance par le généraliste Pr P. Claudepierre CHU Henri Mondor - Créteil Le Diagnostic Objectif de la démarche diagnostique Diagnostic de SPONDYLARTHROPATHIE
Syndrome de Churg et Strauss
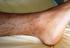 Syndrome de Churg et Strauss Auteurs : François Lhote*, Pascal Cohen**, Philippe Guilpain**, Loïc Guillevin** * Service de médecine interne, centre hospitalier de Saint-Denis, 93200 Saint-Denis. ** Département
Syndrome de Churg et Strauss Auteurs : François Lhote*, Pascal Cohen**, Philippe Guilpain**, Loïc Guillevin** * Service de médecine interne, centre hospitalier de Saint-Denis, 93200 Saint-Denis. ** Département
Le traitement du paludisme d importation de l enfant est une urgence
 Le traitement du paludisme d importation de l enfant est une urgence Dominique GENDREL Necker-Enfants Malades Traiter en urgence en présence de trophozoïtes Plus de 80% des paludismes d importation en
Le traitement du paludisme d importation de l enfant est une urgence Dominique GENDREL Necker-Enfants Malades Traiter en urgence en présence de trophozoïtes Plus de 80% des paludismes d importation en
COMMISSION DE LA TRANSPARENCE. AVIS 1 er février 2012
 COMMISSION DE LA TRANSPARENCE AVIS 1 er février 2012 Le projet d avis adopté par la Commission de la Transparence le 16 novembre 2011 a fait l objet d une audition le 1 février 2012 XEPLION 25 mg, suspension
COMMISSION DE LA TRANSPARENCE AVIS 1 er février 2012 Le projet d avis adopté par la Commission de la Transparence le 16 novembre 2011 a fait l objet d une audition le 1 février 2012 XEPLION 25 mg, suspension
Avis 23 avril 2014. BARITEKAL 20 mg/ml, solution injectable Boîte de 10 ampoules de 5 ml (CIP : 34009 585 896 3 8) Laboratoire NORDIC PHARMA
 COMMISSION DE LA TRANSPARENCE Avis 23 avril 2014 BARITEKAL 20 mg/ml, solution injectable Boîte de 10 ampoules de 5 ml (CIP : 34009 585 896 3 8) Laboratoire NORDIC PHARMA DCI Code ATC (2012) Motif de l
COMMISSION DE LA TRANSPARENCE Avis 23 avril 2014 BARITEKAL 20 mg/ml, solution injectable Boîte de 10 ampoules de 5 ml (CIP : 34009 585 896 3 8) Laboratoire NORDIC PHARMA DCI Code ATC (2012) Motif de l
Assurance Maladie Obligatoire Commission de la Transparence des médicaments. Avis 1 23 Octobre 2012
 Assurance Maladie Obligatoire Commission de la Transparence des médicaments Avis 1 23 Octobre 2012 Titre I : Nom du médicament, DCI, Forme pharmaceutique, Dosage, Présentation - ARANESP 10 µg, Darbépoétine
Assurance Maladie Obligatoire Commission de la Transparence des médicaments Avis 1 23 Octobre 2012 Titre I : Nom du médicament, DCI, Forme pharmaceutique, Dosage, Présentation - ARANESP 10 µg, Darbépoétine
La maladie de Horton Artérite temporale Artérite à cellules géantes
 Artérite temporale Artérite à cellules géantes La maladie Le diagnostic Les aspects génétiques Le traitement, la prise en charge, la prévention Vivre avec En savoir plus Madame, Monsieur, Cette fiche est
Artérite temporale Artérite à cellules géantes La maladie Le diagnostic Les aspects génétiques Le traitement, la prise en charge, la prévention Vivre avec En savoir plus Madame, Monsieur, Cette fiche est
ALTO : des outils d information sur les pathologies thromboemboliques veineuses ou artérielles et leur traitement
 Communiqué de presse Bayer HealthCare S.A.S. Parc Eurasanté 220, avenue de la Recherche 59120 LOOS France Tel.+333 28 16 34 00 www.bayerhealthcare.fr Favoriser l observance avec ALTO : l engagement de
Communiqué de presse Bayer HealthCare S.A.S. Parc Eurasanté 220, avenue de la Recherche 59120 LOOS France Tel.+333 28 16 34 00 www.bayerhealthcare.fr Favoriser l observance avec ALTO : l engagement de
{ Introduction. Proposition GIHP 05/12/2014
 Etude descriptive des accidents hémorragiques sous Nouveaux Anticoagulants Oraux au Service d Accueil des Urgences du CHU de Besançon entre janvier 2012 et janvier 2014 { Dr Claire KANY SAMU Besançon KEPKA
Etude descriptive des accidents hémorragiques sous Nouveaux Anticoagulants Oraux au Service d Accueil des Urgences du CHU de Besançon entre janvier 2012 et janvier 2014 { Dr Claire KANY SAMU Besançon KEPKA
Nouvelle option thérapeutique pour les enfants présentant cette forme rare et sévère d arthrite
 Communiqué de presse Bâle, 18 avril 2011 La FDA homologue Actemra dans le traitement de l arthrite juvénile idiopathique systémique (AJIS) Nouvelle option thérapeutique pour les enfants présentant cette
Communiqué de presse Bâle, 18 avril 2011 La FDA homologue Actemra dans le traitement de l arthrite juvénile idiopathique systémique (AJIS) Nouvelle option thérapeutique pour les enfants présentant cette
Le don de moelle osseuse :
 DON DE MOELLE OSSEUSE Le don de moelle osseuse : se décider aujourd hui, s engager pour longtemps LA MOELLE OSSEUSE ET SA GREFFE La moelle osseuse C est le tissu mou dans le centre du corps des os qui
DON DE MOELLE OSSEUSE Le don de moelle osseuse : se décider aujourd hui, s engager pour longtemps LA MOELLE OSSEUSE ET SA GREFFE La moelle osseuse C est le tissu mou dans le centre du corps des os qui
Innovations thérapeutiques en transplantation
 Innovations thérapeutiques en transplantation 3èmes Assises de transplantation pulmonaire de la région Est Le 16 octobre 2010 Dr Armelle Schuller CHU Strasbourg Etat des lieux en transplantation : 2010
Innovations thérapeutiques en transplantation 3èmes Assises de transplantation pulmonaire de la région Est Le 16 octobre 2010 Dr Armelle Schuller CHU Strasbourg Etat des lieux en transplantation : 2010
LIGNES DIRECTRICES CLINIQUES TOUT AU LONG DU CONTINUUM DE SOINS : Objectif de ce chapitre. 6.1 Introduction 86
 LIGNES DIRECTRICES CLINIQUES TOUT AU LONG DU CONTINUUM DE SOINS : ÉTABLISSEMENT DE LIENS ENTRE LES PERSONNES CHEZ QUI UN DIAGNOSTIC D INFECTION À VIH A ÉTÉ POSÉ ET LES SERVICES DE SOINS ET DE TRAITEMENT
LIGNES DIRECTRICES CLINIQUES TOUT AU LONG DU CONTINUUM DE SOINS : ÉTABLISSEMENT DE LIENS ENTRE LES PERSONNES CHEZ QUI UN DIAGNOSTIC D INFECTION À VIH A ÉTÉ POSÉ ET LES SERVICES DE SOINS ET DE TRAITEMENT
Pharmacovigilance des nouveaux anticoagulants oraux
 Pharmacovigilance des nouveaux anticoagulants oraux Dr A.Lillo-Le Louët, Centre Régional de Pharmacovigilance (CRPV) Paris-HEGP Avec avec Dr P.Lainé, CRPV - Angers Préambule Directeur du Centre Régional
Pharmacovigilance des nouveaux anticoagulants oraux Dr A.Lillo-Le Louët, Centre Régional de Pharmacovigilance (CRPV) Paris-HEGP Avec avec Dr P.Lainé, CRPV - Angers Préambule Directeur du Centre Régional
Arthralgies persistantes après une infection à chikungunya: évolution après plus d un an chez 88 patients adultes
 Arthralgies persistantes après une infection à chikungunya: évolution après plus d un an chez 88 patients adultes G Borgherini 1, A Gouix 1, F Paganin 1, A Jossaume 1, L Cotte 2, C Arvin-Berod 1, A Michault
Arthralgies persistantes après une infection à chikungunya: évolution après plus d un an chez 88 patients adultes G Borgherini 1, A Gouix 1, F Paganin 1, A Jossaume 1, L Cotte 2, C Arvin-Berod 1, A Michault
Communiqué. Abbott présente à Santé Canada une demande d homologation d HUMIRA pour le traitement du psoriasis POUR PUBLICATION IMMÉDIATE
 POUR PUBLICATION IMMÉDIATE Communiqué Abbott présente à Santé Canada une demande d homologation d HUMIRA pour le traitement du psoriasis Media: Sylvie Légaré (514) 832-7268 Abbott Gabrielle Collu 514)
POUR PUBLICATION IMMÉDIATE Communiqué Abbott présente à Santé Canada une demande d homologation d HUMIRA pour le traitement du psoriasis Media: Sylvie Légaré (514) 832-7268 Abbott Gabrielle Collu 514)
Fibrillation atriale chez le sujet âgé
 Dr Benoit Blanchard LE HAVRE Le 18 MARS 2014 Fibrillation atriale chez le sujet âgé Le plus fréquent des trouble du rythme cardiaque, 750,000 personnes atteintes de FA en France, 100,000 nouveaux cas chaque
Dr Benoit Blanchard LE HAVRE Le 18 MARS 2014 Fibrillation atriale chez le sujet âgé Le plus fréquent des trouble du rythme cardiaque, 750,000 personnes atteintes de FA en France, 100,000 nouveaux cas chaque
Numéro 18 l 2011. l Traitements pharmacologiques et SEP
 Numéro 18 l 2011 l Traitements pharmacologiques et SEP Comité de Rédaction Fédération Internationale contre la Sclérose en Plaques (MSIF) La mission de la MSIF est de diriger le mouvement international
Numéro 18 l 2011 l Traitements pharmacologiques et SEP Comité de Rédaction Fédération Internationale contre la Sclérose en Plaques (MSIF) La mission de la MSIF est de diriger le mouvement international
COMMISSION DE LA TRANSPARENCE AVIS. 4 novembre 2009
 COMMISSION DE LA TRANSPARENCE AVIS 4 novembre 2009 IRESSA 250 mg, comprimé pelliculé Boîte de 30 (CIP 395 950-7) ASTRAZENECA géfitinib Liste I Médicament soumis à prescription hospitalière. Prescription
COMMISSION DE LA TRANSPARENCE AVIS 4 novembre 2009 IRESSA 250 mg, comprimé pelliculé Boîte de 30 (CIP 395 950-7) ASTRAZENECA géfitinib Liste I Médicament soumis à prescription hospitalière. Prescription
Leucémies de l enfant et de l adolescent
 Janvier 2014 Fiche tumeur Prise en charge des adolescents et jeunes adultes Leucémies de l enfant et de l adolescent GENERALITES COMMENT DIAGNOSTIQUE-T-ON UNE LEUCEMIE AIGUË? COMMENT TRAITE-T-ON UNE LEUCEMIE
Janvier 2014 Fiche tumeur Prise en charge des adolescents et jeunes adultes Leucémies de l enfant et de l adolescent GENERALITES COMMENT DIAGNOSTIQUE-T-ON UNE LEUCEMIE AIGUË? COMMENT TRAITE-T-ON UNE LEUCEMIE
Hémostase et Endocardite Surveillance des anticoagulants. Docteur Christine BOITEUX
 Hémostase et Endocardite Surveillance des anticoagulants Docteur Christine BOITEUX Théorie Endocardites et anticoagulation POUR Thromboses Emboles septiques CONTRE Favorise emboles septiques et diffusion
Hémostase et Endocardite Surveillance des anticoagulants Docteur Christine BOITEUX Théorie Endocardites et anticoagulation POUR Thromboses Emboles septiques CONTRE Favorise emboles septiques et diffusion
Accidents des anticoagulants
 30 Item 182 Accidents des anticoagulants Insérer les T1 Objectifs pédagogiques ENC Diagnostiquer un accident des anticoagulants. Identifier les situations d urgence et planifier leur prise en charge. COFER
30 Item 182 Accidents des anticoagulants Insérer les T1 Objectifs pédagogiques ENC Diagnostiquer un accident des anticoagulants. Identifier les situations d urgence et planifier leur prise en charge. COFER
LES ANTI-TNF DANS LES MALADIES AUTO-IMMUNES ET LES VASCULARITES
 LES ANTI-TNF DANS LES MALADIES AUTO-IMMUNES ET LES VASCULARITES par X. MARIETTE* Les inhibiteurs du TNFα représentent une révolution thérapeutique en rhumatologie dans le traitement de la polyarthrite
LES ANTI-TNF DANS LES MALADIES AUTO-IMMUNES ET LES VASCULARITES par X. MARIETTE* Les inhibiteurs du TNFα représentent une révolution thérapeutique en rhumatologie dans le traitement de la polyarthrite
Maladies systémiques et auto-immunes rares. Actes du Colloque de la Fondation Groupama pour la santé Paris, le 12 mai 2009
 Maladies systémiques et auto-immunes rares Actes du Colloque de la Fondation Groupama pour la santé Paris, le 12 mai 2009 Éditeur : Fondation d entreprise Groupama pour la santé Siège social : 8-10 rue
Maladies systémiques et auto-immunes rares Actes du Colloque de la Fondation Groupama pour la santé Paris, le 12 mai 2009 Éditeur : Fondation d entreprise Groupama pour la santé Siège social : 8-10 rue
Les facteurs de croissance lignée blanche Polynucléaires neutrophiles Grastims
 Les facteurs de croissance lignée blanche Polynucléaires neutrophiles Grastims 12 2014 HEMATOPOIESE Progéniteurs puis précurseurs Stimulation par facteur : activation spécifique de leur récepteur Moelle
Les facteurs de croissance lignée blanche Polynucléaires neutrophiles Grastims 12 2014 HEMATOPOIESE Progéniteurs puis précurseurs Stimulation par facteur : activation spécifique de leur récepteur Moelle
Livret des nouveaux anticoagulants oraux. Ce qu il faut savoir pour bien gérer leur utilisation
 Livret des nouveaux anticoagulants oraux Ce qu il faut savoir pour bien gérer leur utilisation DONNÉES DU PATIENT Nom Adresse Tél MÉDECIN TRAITANT Nom Adresse Tél SPÉCIALISTE Nom Hôpital Tél MÉDICAMENT
Livret des nouveaux anticoagulants oraux Ce qu il faut savoir pour bien gérer leur utilisation DONNÉES DU PATIENT Nom Adresse Tél MÉDECIN TRAITANT Nom Adresse Tél SPÉCIALISTE Nom Hôpital Tél MÉDICAMENT
ANEMIE ET THROMBOPENIE CHEZ LES PATIENTS ATTEINTS D UN CANCER
 ANEMIE ET THROMBOPENIE CHEZ LES PATIENTS ATTEINTS D UN CANCER Dr Michael Hummelsberger, Pr Jean-Gabriel Fuzibet, Service de Médecine Interne, Hôpital l Archet, CHU Nice 1. ANEMIE L étiologie de l anémie
ANEMIE ET THROMBOPENIE CHEZ LES PATIENTS ATTEINTS D UN CANCER Dr Michael Hummelsberger, Pr Jean-Gabriel Fuzibet, Service de Médecine Interne, Hôpital l Archet, CHU Nice 1. ANEMIE L étiologie de l anémie
Infospot. Les nouveaux anticoagulants oraux (NACOs) Octobre - Novembre - Decembre 2014
 Infospot Les nouveaux anticoagulants oraux (NACOs) Octobre - Novembre - Decembre 2014 Les nouveaux anticoagulants oraux (NACOs) - Octobre - Novembre - Decembre 2014 1 I. Définition Il est actuellement
Infospot Les nouveaux anticoagulants oraux (NACOs) Octobre - Novembre - Decembre 2014 Les nouveaux anticoagulants oraux (NACOs) - Octobre - Novembre - Decembre 2014 1 I. Définition Il est actuellement
Que représentent les Spondyloarthrites Axiales Non Radiographiques? Pascal Claudepierre CHU Mondor - Créteil
 Que représentent les Spondyloarthrites Axiales Non Radiographiques? Pascal Claudepierre CHU Mondor - Créteil Liens d intérêt Intérêts financiers : aucun Liens durables ou permanents : aucun Interventions
Que représentent les Spondyloarthrites Axiales Non Radiographiques? Pascal Claudepierre CHU Mondor - Créteil Liens d intérêt Intérêts financiers : aucun Liens durables ou permanents : aucun Interventions
Prise en charge de l embolie pulmonaire
 Prise en charge de l embolie pulmonaire Dr Serge Motte Liège 06.12.14 - Laack TA et Goyal DG, Emerg Med Clin N Am 2004; 961-983 2 PLAN Diagnostic Prise en charge: Phase aiguë: analyse de gravité Choix
Prise en charge de l embolie pulmonaire Dr Serge Motte Liège 06.12.14 - Laack TA et Goyal DG, Emerg Med Clin N Am 2004; 961-983 2 PLAN Diagnostic Prise en charge: Phase aiguë: analyse de gravité Choix
UTILISATION DES C.C.P DANS LES HEMORRAGIES SOUS AVK ET SOUS NACO : RECOMMANDATIONS DE L HAS COPACAMU 2014
 UTILISATION DES C.C.P DANS LES HEMORRAGIES SOUS AVK ET SOUS NACO : RECOMMANDATIONS DE L HAS SYMPOSIUM CSL BEHRING COPACAMU 2014 PROFESSEUR François BERTRAND CHU DE NICE CHRONOLOGIE DES RECOMMANDATIONS
UTILISATION DES C.C.P DANS LES HEMORRAGIES SOUS AVK ET SOUS NACO : RECOMMANDATIONS DE L HAS SYMPOSIUM CSL BEHRING COPACAMU 2014 PROFESSEUR François BERTRAND CHU DE NICE CHRONOLOGIE DES RECOMMANDATIONS
COMMISSION DE LA TRANSPARENCE AVIS. 31 janvier 2007
 COMMISSION DE LA TRANSPARENCE AVIS 31 janvier 2007 NEUPRO 2 mg/24 h dispositif transdermique Sachet-dose, B/30 : 377 209-7 Sachet-dose, B/90 : 570 143-4 NEUPRO 4 mg/24 h dispositif transdermique Sachet-dose,
COMMISSION DE LA TRANSPARENCE AVIS 31 janvier 2007 NEUPRO 2 mg/24 h dispositif transdermique Sachet-dose, B/30 : 377 209-7 Sachet-dose, B/90 : 570 143-4 NEUPRO 4 mg/24 h dispositif transdermique Sachet-dose,
2.4. Les médicaments de la «liste en sus»
 2.4. Les médicaments de la «liste en sus» Dans le cadre de la tarification à l activité (T2A), le financement des médicaments administrés au cours d un séjour hospitalier est assuré selon plusieurs modalités.
2.4. Les médicaments de la «liste en sus» Dans le cadre de la tarification à l activité (T2A), le financement des médicaments administrés au cours d un séjour hospitalier est assuré selon plusieurs modalités.
Anticorps, vaccins, immunothérapies allergéniques tout savoir sur les progrès de l immunothérapie en 20 questions
 Anticorps, vaccins, immunothérapies allergéniques tout savoir sur les progrès de l immunothérapie en 20 questions De quoi se compose le système immunitaire? Chaque jour, des substances étrangères, appelées
Anticorps, vaccins, immunothérapies allergéniques tout savoir sur les progrès de l immunothérapie en 20 questions De quoi se compose le système immunitaire? Chaque jour, des substances étrangères, appelées
Validation clinique des marqueurs prédictifs le point de vue du méthodologiste. Michel Cucherat UMR CNRS 5558 - Lyon
 Validation clinique des marqueurs prédictifs le point de vue du méthodologiste Michel Cucherat UMR CNRS 5558 - Lyon Marqueur prédictif - Définition Un marqueur prédictif est un marqueur qui prédit le bénéfice
Validation clinique des marqueurs prédictifs le point de vue du méthodologiste Michel Cucherat UMR CNRS 5558 - Lyon Marqueur prédictif - Définition Un marqueur prédictif est un marqueur qui prédit le bénéfice
MYÉLOME MULTIPLE PRÉSENTATION DU TRAITEMENT. Multiple Myeloma Research Foundation 383 Main Avenue, 5th Floor Norwalk, CT 06851 États-Unis
 MYÉLOME MULTIPLE PRÉSENTATION DU TRAITEMENT Multiple Myeloma Research Foundation 383 Main Avenue, 5th Floor Norwalk, CT 06851 États-Unis www.themmrf.org email : info@themmrf.org MM.TO.11.2010 Des idées
MYÉLOME MULTIPLE PRÉSENTATION DU TRAITEMENT Multiple Myeloma Research Foundation 383 Main Avenue, 5th Floor Norwalk, CT 06851 États-Unis www.themmrf.org email : info@themmrf.org MM.TO.11.2010 Des idées
SYNOPSIS INFORMATIONS GÉNÉRALES
 Evaluation de l utilisation d un anticoagulant anti-xa direct oral, Apixaban, dans la prévention de la maladie thromboembolique veineuse chez les patients traités par IMiDs au cours du myélome : étude
Evaluation de l utilisation d un anticoagulant anti-xa direct oral, Apixaban, dans la prévention de la maladie thromboembolique veineuse chez les patients traités par IMiDs au cours du myélome : étude
Avis 17 octobre 2012
 COMMISSION DE LA TRANSPARENCE Avis 17 octobre 2012 BETESIL 2,25 mg, emplâtre médicamenteux Boite de 8 emplâtres médicamenteux en sachets (CIP : 34009 377 977 4 0) Laboratoire GENEVRIER DCI Code ATC (2012)
COMMISSION DE LA TRANSPARENCE Avis 17 octobre 2012 BETESIL 2,25 mg, emplâtre médicamenteux Boite de 8 emplâtres médicamenteux en sachets (CIP : 34009 377 977 4 0) Laboratoire GENEVRIER DCI Code ATC (2012)
ALLOGREFFE DE CELLULES SOUCHES HEMATOPOÏETIQUES (CSH) CHEZ 26 PATIENTS ATTEINTS DE β THALASSEMIES MAJEURES
 ALLOGREFFE DE CELLULES SOUCHES HEMATOPOÏETIQUES (CSH) CHEZ 26 PATIENTS ATTEINTS DE β THALASSEMIES MAJEURES R. Belhadj, R.Ahmed Nacer, F.Mehdid, M.Benakli, N.Rahmoune, M.Baazizi, F. Kaci, F.Harieche, F.Zerhouni,
ALLOGREFFE DE CELLULES SOUCHES HEMATOPOÏETIQUES (CSH) CHEZ 26 PATIENTS ATTEINTS DE β THALASSEMIES MAJEURES R. Belhadj, R.Ahmed Nacer, F.Mehdid, M.Benakli, N.Rahmoune, M.Baazizi, F. Kaci, F.Harieche, F.Zerhouni,
Les nouveaux anticoagulants oraux, FA et AVC. Docteur Thalie TRAISSAC Hôpital Saint André CAPCV 15 février 2014
 Les nouveaux anticoagulants oraux, FA et AVC Docteur Thalie TRAISSAC Hôpital Saint André CAPCV 15 février 2014 Un AVC toutes les 4 minutes 1 130 000 AVC par an en France 1 770 000 personnes ont été victimes
Les nouveaux anticoagulants oraux, FA et AVC Docteur Thalie TRAISSAC Hôpital Saint André CAPCV 15 février 2014 Un AVC toutes les 4 minutes 1 130 000 AVC par an en France 1 770 000 personnes ont été victimes
Alemtuzumab (Lemtrada * ) réduit significativement les rechutes dans la sclérose en plaques comparé à l interféron Bêta-1a dans une étude de Phase III
 COMMUNIQUE DE PRESSE Alemtuzumab (Lemtrada * ) réduit significativement les rechutes dans la sclérose en plaques comparé à l interféron Bêta-1a dans une étude de Phase III - Présentation de nouvelles données
COMMUNIQUE DE PRESSE Alemtuzumab (Lemtrada * ) réduit significativement les rechutes dans la sclérose en plaques comparé à l interféron Bêta-1a dans une étude de Phase III - Présentation de nouvelles données
Études épidémiologiques analytiques et biais
 Master 1 «Conception, évaluation et gestion des essais thérapeutiques» Études épidémiologiques analytiques et biais Roxane Schaub Médecin de santé publique Octobre 2013 1 Objectifs pédagogiques Connaitre
Master 1 «Conception, évaluation et gestion des essais thérapeutiques» Études épidémiologiques analytiques et biais Roxane Schaub Médecin de santé publique Octobre 2013 1 Objectifs pédagogiques Connaitre
Vaccinations pour les professionnels : actualités
 Vaccinations pour les professionnels : actualités Dominique Abiteboul Service de Santé au Travail Hôpital Bichat - Claude Bernard Paris GERES Les vaccins A (H1N1)v 4QUESTIONS +++++ Pas assez de recul???
Vaccinations pour les professionnels : actualités Dominique Abiteboul Service de Santé au Travail Hôpital Bichat - Claude Bernard Paris GERES Les vaccins A (H1N1)v 4QUESTIONS +++++ Pas assez de recul???
TITRE : «Information et consentement du patient en réadaptation cardiovasculaire»
 TITRE : «Information et consentement du patient en réadaptation cardiovasculaire» MC Iliou, R Brion, C Monpère, B Pavy, B Vergès-Patois, G Bosser, F Claudot Au nom du bureau du GERS Un programme de réadaptation
TITRE : «Information et consentement du patient en réadaptation cardiovasculaire» MC Iliou, R Brion, C Monpère, B Pavy, B Vergès-Patois, G Bosser, F Claudot Au nom du bureau du GERS Un programme de réadaptation
EVALUATION DES METHODES D AIDE A L ARRET DU TABAGISME
 EVALUATION DES METHODES D AIDE A L ARRET DU TABAGISME Docteur Jean PERRIOT Dispensaire Emile Roux Clermont-Ferrand jean.perriot@cg63.fr DIU Tabacologie Clermont-Ferrand - 2015 NOTIONS GENERALES INTRODUCTION.
EVALUATION DES METHODES D AIDE A L ARRET DU TABAGISME Docteur Jean PERRIOT Dispensaire Emile Roux Clermont-Ferrand jean.perriot@cg63.fr DIU Tabacologie Clermont-Ferrand - 2015 NOTIONS GENERALES INTRODUCTION.
I - CLASSIFICATION DU DIABETE SUCRE
 I - CLASSIFICATION DU DIABETE SUCRE 1- Définition : Le diabète sucré se définit par une élévation anormale et chronique de la glycémie. Cette anomalie est commune à tous les types de diabète sucré, mais
I - CLASSIFICATION DU DIABETE SUCRE 1- Définition : Le diabète sucré se définit par une élévation anormale et chronique de la glycémie. Cette anomalie est commune à tous les types de diabète sucré, mais
Le dropéridol n est pas un traitement à considérer pour le traitement de la migraine à l urgence
 Le dropéridol n est pas un traitement à considérer pour le traitement de la migraine à l urgence On pose fréquemment le diagnostic de migraine sévère à l urgence. Bien que ce soit un diagnostic commun,
Le dropéridol n est pas un traitement à considérer pour le traitement de la migraine à l urgence On pose fréquemment le diagnostic de migraine sévère à l urgence. Bien que ce soit un diagnostic commun,
DÉFICITS IMMUNITAIRE COMMUN VARIABLE
 DÉFICITS IMMUNITAIRE COMMUN VARIABLE Le présent livret a été rédigé à l attention des patients et de leurs familles. Il ne doit pas remplacer les conseils d un spécialiste en immunologie. 1 Egalement Disponible
DÉFICITS IMMUNITAIRE COMMUN VARIABLE Le présent livret a été rédigé à l attention des patients et de leurs familles. Il ne doit pas remplacer les conseils d un spécialiste en immunologie. 1 Egalement Disponible
Cas clinique 2. Florence JOLY, Caen François IBORRA, Montpellier
 Cas clinique 2 Florence JOLY, Caen François IBORRA, Montpellier Cas clinique Patient de 60 ans, ATCD: HTA, IDM en 2007, hypercholestérolémie Juin 2008: Toux, dyspnée (sous 02) et anorexie progressive Bilan
Cas clinique 2 Florence JOLY, Caen François IBORRA, Montpellier Cas clinique Patient de 60 ans, ATCD: HTA, IDM en 2007, hypercholestérolémie Juin 2008: Toux, dyspnée (sous 02) et anorexie progressive Bilan
Soins infirmiers et gestion des risques
 Soins infirmiers et gestion des risques I. Principe de précaution Hippocrate disait «soulager le malade et ne pas lui nuire» Cet adage «primun non cere» est le principe de la base de la médecine II. La
Soins infirmiers et gestion des risques I. Principe de précaution Hippocrate disait «soulager le malade et ne pas lui nuire» Cet adage «primun non cere» est le principe de la base de la médecine II. La
S. Kernéis, T. Ancelle, V. Naneix-Laroche, N. Amrane, JP. Leroy, T. Hanslik, O. Launay
 Etude AMARCOR Tolérance et immunogénicité du vaccin contre la fièvre jaune chez des sujets recevant une corticothérapie par voie générale : étude de cohorte observationnelle S. Kernéis, T. Ancelle, V.
Etude AMARCOR Tolérance et immunogénicité du vaccin contre la fièvre jaune chez des sujets recevant une corticothérapie par voie générale : étude de cohorte observationnelle S. Kernéis, T. Ancelle, V.
journées chalonnaises de la thrombose
 Nos connaissances certaines et notre pratique journalière : Les Nouveaux Anticoagulants dans la thromboprophylaxie de la chirurgie prothétique du MI Benoit Cots et Jean Marc Royer le 29/11/12-1 Recommandations
Nos connaissances certaines et notre pratique journalière : Les Nouveaux Anticoagulants dans la thromboprophylaxie de la chirurgie prothétique du MI Benoit Cots et Jean Marc Royer le 29/11/12-1 Recommandations
L anémie hémolytique auto-immune
 L anémie hémolytique auto-immune La maladie Le diagnostic Les aspects génétiques Le traitement, la prise en charge, la prévention Vivre avec En savoir plus Madame, Monsieur, Cette fiche est destinée à
L anémie hémolytique auto-immune La maladie Le diagnostic Les aspects génétiques Le traitement, la prise en charge, la prévention Vivre avec En savoir plus Madame, Monsieur, Cette fiche est destinée à
chronique La maladie rénale Un risque pour bon nombre de vos patients Document destiné aux professionnels de santé
 Document destiné aux professionnels de santé Agence relevant du ministère de la santé La maladie rénale chronique Un risque pour bon nombre de vos patients Clés pour la dépister et ralentir sa progression
Document destiné aux professionnels de santé Agence relevant du ministère de la santé La maladie rénale chronique Un risque pour bon nombre de vos patients Clés pour la dépister et ralentir sa progression
Pharmacologie des «nouveaux» anticoagulants oraux
 Pharmacologie des «nouveaux» anticoagulants oraux Apixaban, Dabigatran, Rivaroxaban Pr D. DEPLANQUE Département de Pharmacologie médicale EA 1046 et CIC 9301 INSERM-CHRU, Institut de Médecine Prédictive
Pharmacologie des «nouveaux» anticoagulants oraux Apixaban, Dabigatran, Rivaroxaban Pr D. DEPLANQUE Département de Pharmacologie médicale EA 1046 et CIC 9301 INSERM-CHRU, Institut de Médecine Prédictive
prise en charge paramédicale dans une unité de soins
 Société française de neurologie RÉFÉRENTIEL D AUTO-ÉVALUATION DES PRATIQUES EN NEUROLOGIE Prise en charge hospitalière initiale des personnes ayant fait un accident vasculaire cérébral (AVC) : prise en
Société française de neurologie RÉFÉRENTIEL D AUTO-ÉVALUATION DES PRATIQUES EN NEUROLOGIE Prise en charge hospitalière initiale des personnes ayant fait un accident vasculaire cérébral (AVC) : prise en
COMMISSION DE LA TRANSPARENCE AVIS. 19 octobre 2011
 COMMISSION DE LA TRANSPARENCE AVIS 19 octobre 2011 PEDIAVEN AP-HP G15, solution pour perfusion 1000 ml de solution en poche bi-compartiment, boîte de 4 (CIP: 419 999-0) PEDIAVEN AP-HP G20, solution pour
COMMISSION DE LA TRANSPARENCE AVIS 19 octobre 2011 PEDIAVEN AP-HP G15, solution pour perfusion 1000 ml de solution en poche bi-compartiment, boîte de 4 (CIP: 419 999-0) PEDIAVEN AP-HP G20, solution pour
Guide de Mobilisation. de cellules souches pour mon. Autogreffe AVEC LE SOUTIEN DE. Carnet d informations et de suivi pour le patient et sa famille
 Guide de Mobilisation de cellules souches pour mon Autogreffe Carnet d informations et de suivi Carnets pour d informations le patient et sa et famille de suivi pour le patient et sa famille AVEC LE SOUTIEN
Guide de Mobilisation de cellules souches pour mon Autogreffe Carnet d informations et de suivi Carnets pour d informations le patient et sa et famille de suivi pour le patient et sa famille AVEC LE SOUTIEN
QU EST-CE QUE LA PROPHYLAXIE?
 QU EST-CE QUE LA PROPHYLAXIE? TABLES DES MATIÈRES Publié par la Fédération mondiale de l hémophilie (FMH) Fédération mondiale de l hémophilie, 2014 La FMH encourage la traduction et la redistribution de
QU EST-CE QUE LA PROPHYLAXIE? TABLES DES MATIÈRES Publié par la Fédération mondiale de l hémophilie (FMH) Fédération mondiale de l hémophilie, 2014 La FMH encourage la traduction et la redistribution de
La prise en charge de votre polyarthrite rhumatoïde
 G U I D E - A F F E C T I O N D E L O N G U E D U R É E La prise en charge de votre polyarthrite rhumatoïde Vivre avec une polyarthrite rhumatoïde Décembre 2008 Pourquoi ce guide? Votre médecin traitant
G U I D E - A F F E C T I O N D E L O N G U E D U R É E La prise en charge de votre polyarthrite rhumatoïde Vivre avec une polyarthrite rhumatoïde Décembre 2008 Pourquoi ce guide? Votre médecin traitant
EVALUATION DE L AUTOSURVEILLANCE DE
 EVALUATION DE L AUTOSURVEILLANCE DE L INR CHEZ LES PATIENTS ADULTES TRAITES PAR ANTIVITAMINES K EN VUE DE LA PRISE EN CHARGE PAR L ASSURANCE MALADIE DES DISPOSITIFS D AUTOMESURE DE L INR OCTOBRE 2008 Service
EVALUATION DE L AUTOSURVEILLANCE DE L INR CHEZ LES PATIENTS ADULTES TRAITES PAR ANTIVITAMINES K EN VUE DE LA PRISE EN CHARGE PAR L ASSURANCE MALADIE DES DISPOSITIFS D AUTOMESURE DE L INR OCTOBRE 2008 Service
