T H E S E en COTUTELLE. Pour obtenir le grade de
|
|
|
- Florine Leboeuf
- il y a 9 ans
- Total affichages :
Transcription
1 République Tunisienne Ministère de l Enseignement Supérieur, de la Recherche Scientifique Université de Sfax École Nationale d Ingénieurs de Sfax Université de Reims Champagne- Ardenne Ecole Doctorale SFAX Sciences et Technologies Thèse de DOCTORAT En Génie Electrique Ecole Doctorale URCA Sciences Technologie Santé Thèse de DOCTORAT En Traitement et Analyse d image N d ordre : T H E S E en COTUTELLE Pour obtenir le grade de DOCTEUR DE L'UNIVERSITE DE SFAX Discipline : Génie électrique et DOCTEUR DE L'UNIVERSITE DE REIMS CHAMPAGNE-ARDENNE Discipline : Traitement et Analyse d image - Mathématiques Appliquées THESE en Cotutelle Présentée et Présentée soutenue publiquement à à L École Nationale d Ingénieurs de Sfax Par (Mastère ENT) Extraction et Modélisation de la Cinétique du Traceur en Imagerie TEP pour la Caractérisation des Tissus Tumoraux KETATA Ines Soutenu le 6 Décembre 2013, devant le jury composé de : Prévue le 6 décembre 2013 Mme. Dorra SALLEMI MASMOUDI (Pr. ENIS, Université de Sfax, Tunisie), Président M. Mounir SAYADI (MC. ESSTT, Université de Tunis, Tunisie), Rapporteur M. Yvon VOISIN (Pr. UB, Université de Bourgogne, France), Rapporteur Mme. Nawres KHLIFA (MC. ISTMS, Université de Tunis, Tunisie), Examinateur M. Alexandre COCHET (MC. HDR, Centre CGFL de Dijon, France), Examinateur M. Ahmed BEN HAMIDA (Pr. ENIS, Université de Sfax, Tunisie), Directeur de Thèse Mme. Su RUAN (Pr. UR, Université de Rouen, France), Co-Directeur de Thèse M. Frédéric MORAIN-NICOLIER (Pr. URCA, Université de Reims, France), Co-Directeur de Thèse M. Khalil CHTOUROU (Pr Ag, Centre Hospitalier Universitaire, CHU Sfax, Tunisie), Invité M. Hedi KALLEL (Pr Ag, Centre Hospitalier Universitaire, CHU Sfax, Tunisie), Invité Mme. Salwa KAMOUN (Enseignante ENIS, Université de Sfax, Tunisie), Invitée
2 Dédicaces Je dédie ce manuscrit à mon cher mari Anis ainsi que mes beaux parents et mes beaux frères pour leur soutien indéfectible, tout ce qu'ils ont fait pour que j'en sois là, et surtout pour leur Amour. Une pensée particulière à mes parents, mes frères et ma sœur qui m ont toujours soutenu, qui m ont fait confiance dans le choix de mes études tout en m encourageant à poursuivre quelles que soient les difficultés. Je les remercie pour l amour et la tendresse qu ils m ont témoignés pendant toute cette période. Un grand merci pour tout et cette thèse leur est dédiée. Je dédie cette thèse Ines
3 REMERCIEMENTS Ce travail faisant l objet de la présente thèse de doctorat, s inscrit dans le cadre d une thèse en co-tutelle entre l Unité de recherche «ATMS» Advanced Technologies for Medicine & Signals de l Ecole Nationale des Ingénieurs de Sfax, le Centre de Recherche en Science et Technologie de l Information et de la Communication «CReSTIC», le service de médecine nucléaire du CHU Sfax, et le Centre Georges-François Leclerc à Dijon, France. J adresse l expression de ma très grande reconnaissance à mon Directeur de thèse, Monsieur Ahmed BEN HAMIDA, Professeur à l Ecole Nationale des Ingénieurs de Sfax et Directeur de recherche de l Unité ATMS, pour la confiance qu il m a accordé en acceptant d encadrer et diriger mes travaux, pour ses conseils judicieux, et pour l attention qu il a bien apportée à ce travail à divers stades de son élaboration. Je tiens également à remercier mes Directeurs de thèse Français : Madame Su RUAN, Professeur à l Université de Rouen (France) et Monsieur Frédéric MORAIN-NICOLIER, Professeur à l IUT de Troyes (France) et Responsable de l'équipe Image à Troyes (Groupe SIC), pour la confiance qu ils m ont accordé, pour leurs conseils et pour l attention qu ils ont bien voulu apporter à ma thèse à divers stades de son élaboration. Je tiens à remercier vivement mes deux superviseurs : Madame Lamia SELLAMI, MA à l ISECS Sfax (Tunisie) et Membre de l UR ATMS et Monsieur Mohamed BEN SLIMA, MA ISECS Sfax (Tunisie) et Membre de l UR ATMS, qui ont tout essayé pour avancer et réussir ce travail depuis son début. J adresse également mes remerciements à Monsieur Khalil CHTOUROU, Professeur Agrégé au Service de Médecine Nucléaire du CHU de Sfax (Tunisie), Responsable des validations cliniques au sein de notre UR ATMS, pour son aide incessant, sa disponibilité ainsi que ses conseils et ses informations constructives qui ont renforcé la qualité de ce travail de recherche. J exprime tout de même ma gratitude à Monsieur François BRUNOTTE, Professeur et chef du service de Médecine nucléaire au Centre Georges-François Leclerc à Dijon (France), et Monsieur Alexandre COCHET, Maitre de conférences HDR et praticien hospitalier au Centre Georges-François Leclerc à Dijon (France), pour leur aide précieuse ainsi que pour les données cliniques très utiles dans la validation de nos travaux. Je tiens à exprimer mon profond respect à Madame Dorra SALLEMI MASMOUDI, Professeur à l Ecole Nationale d Ingénieurs de Sfax (Tunisie), qui m a fait l honneur d accepter la présidence de mon jury. J exprime ma gratitude à Monsieur Mounir SAYADI, Maître des Conférences à l Ecole Supérieure des Sciences et Techniques de Tunis (Tunisie), et Monsieur Yvon VOISIN, Professeur à l Université de Bourgogne (France), d avoir accepté la lourde tâche de rapporteur et d avoir consacré un temps précieux à l examen de ce rapport. Pour la même occasion, j adresse mes remerciements Nawrès KHLIFA, Maître des Conférences à l Institut Supérieur des Technologies Médicales de Tunis (Tunisie), d avoir accepté d examiner et juger cette thèse. Je désire aussi remercier Monsieur Hèdi KALLEL, Professeur au CHU de Sfax (Tunisie), ainsi que Madame Salwa KAMOUN, Enseignante à l ENIS Sfax (Tunisie), d avoir accepté de siéger à ce jury. J adresse également mes remerciements aux différents membres de notre UR-ATMS, ainsi qu à tout le personnel du département Génie Electrique de l ENIS, pour leurs encouragements, leurs aides, leurs soutiens, ainsi que leurs disponibilités. Je m adresse également des expressions de reconnaissance aux membres de l équipe de recherche «CReSTIC», ainsi que tout le personnel de l Université de Reims Champagne- Ardenne pour leurs aides, ainsi que leurs disponibilités.
4 Résumé L examen Tomographie par Emission de positons (TEP) au 18 F-fluorodésoxyglucose ( 18 F- FDG) est l'étalon in vivo pour l'évaluation du métabolisme glucidique dans la tumeur et largement utilisé en oncologie clinique. Plusieurs paramètres empiriques ont été proposés dans le but de caractériser quantitativement les résultats d un examen TEP au 18 F-FDG, particulièrement le calcul du flux sanguin BF (Blood Flow) et la valeur de fixation normalisée SUV (Standardized Uptake Value). Ce paramètre est souvent déterminé à partir d images tardives (après 90 minutes de l injection du traceur 18 F-FDG) dans un mélange de compartiments vasculaire et tumoral. Dans cette thèse, nous proposons une nouvelle approche, pour la quantification automatique et précoce (après 11 minutes) du métabolisme glucidique du traceur 18 F-FDG, basée sur l analyse factorielle des séquences d'images médicales (AFSIM) pour déterminer un nouveau paramètre empirique K FPQ (K First Pass Quantification) calculé à partir des deux compartiments obtenus dans la région d intérêt tumorale (ROI, en anglais Region Of Interest), déterminée au moyen d une extension de la mesure de dissimilarité locale en niveaux de gris, et tel que évalué durant le premier passage du traceur 18 F-FDG à partir des images TEP précoces. Cette approche commence par une identification automatisée de la région d'intérêt tumorale à partir de la séquence des images dynamiques TEP. Ensuite, l approche AFSIM est appliquée à la ROI obtenue pour estimer l'évolution temporelle de la concentration de 18F-FDG dans les deux compartiments physiologiques : purement tumoral et vasculaire. À partir du compartiment tumoral, nous pouvons alors évaluer la quantification précoce du métabolisme du glucose et donc le suivi de la lésion des patients durant le traitement. Les résultats obtenus montrent que le nouveau paramètre proposé K FPQ est corrélé avec le paramètre SUV, l indice de la valeur maximale normalisée de la fixation du 18 F-FDG dans le tissu d intérêt. Le paramètre K FPQ peut être donc considéré comme une indication importante pour la prédiction précoce du métabolisme du glucose dans la tumeur. Mots clés Tomographie par Emission de Positrons (TEP), Méthode de la Carte de Dissimilarité Locale (CDL), Méthode AFSIM, SUV, Métabolisme, Quantification Précoce au Premier passage. 1
5 Abstract Factor Analysis of Medical Image Sequences (FAMIS) is recognized as one pioneer successfully used approach for analyzing especially dynamic images sequence for estimating kinetics and associated compartments having a physiological meaning. Some studies tried to extend the exploring of this approach to analyze Positron Emission Tomography (PET) image modality for dynamic sequences. PET images with 18 F- FluoroDesoxyGlucose ( 18 F-FDG) is the gold standard for in vivo, evaluation of tumor glucose metabolism and is widely used in clinical oncology. In this thesis, a novel approach is proposed to obtain an automated quantification method for early accumulation of 18 F-FDG tracer in order to explore breast cancer, by applying FAMIS tool on dynamic first pass 18 F-FDG PET dynamic sequences. This approach starts by an automated identification of a tumor Region of Interest (ROI) from PET dynamic images sequence using an extension of the Local Dissimilarity Map grayscale. Then, a FAMIS approach is applied to separate two compartments: one compartment is associated to the vascular and a second one is associated to the purely tumor compartment. The latter allows the evaluation of the temporal evolution of the glucose tracer metabolism and therefore for pursuing cancer characterization. A new empiric parameter K FPQ (First Pass Quantification), computed from the evolution of the 18 F-FDG radiotracer accumulation using the first 11 minutes PET early images, is proposed. This parameter is found to be correlated to standardized uptake value maximal index (SUV max ) metabolism tumor. The proposed framework is tested using image sequences database for 25 different pathology cases, which is considered as largely sufficient by the clinical team. Among clinicians experience, using a large dataset permits the possibility to obtain accurate information and precise early diagnosis. Pearson correlation coefficient is computed to evaluate as well as to analyze the relationship between the proposed empiric parameter K FPQ and glucose tracer metabolism SUV max for the overall pathology cases. K FPQ is successfully evaluated by the dynamic first-pass 18 F-FDG PET image sequences for exploring early breast cancer diagnosis. Quantitative evaluations, as discussed and validated by clinicians, confirmed the efficiency of the modeling and the usefulness of the new empiric parameter K FPQ to predict tumor glucose metabolism for early uptake. This can be considered as a significant indication for quantification as well as evaluation of early relapse and disease progression during the therapy. Keywords Breast cancer diagnostic, dynamic PET images, CDL method, FAMIS method, First Pass Quantification (K FPQ ) 2
6 Sommaire 3
7 Résumé Abstract Glossaire Introduction Générale Chapitre 1 : Imagerie TEP pour la caractérisation des tissus tumoraux mammaires Introduction 1. Imagerie fonctionnelle 2. Physique de l imagerie fonctionnelle 3. Facteurs de dégradation des images TEP 4. Principe d utilisation de la TEP au 18 F-FDG en oncologie 5. Spécificités de l imagerie TEP au 18 F-FDG en cancer du sein Conclusion Chapitre 2 : Méthodes d analyse et de paramètrisation pour la modélisation et l extraction de la cinétique du traceur en imagerie TEP en vue d une caractérisation des tissus tumoraux Introduction 1. Paramètres cliniques 2. Méthodologie d analyse des séquences d images dynamiques TEP Conclusion Chapitre 3 : Approche d analyse proposée pour l extraction et la modélisation de la cinétique du traceur en imagerie TEP pour la caractérisation des tissus tumoraux Introduction 1. Description générale de l approche d analyse proposée 2. Description détaillée de la méthodologie de l approche d analyse proposée pour l extraction et la modélisation de la cinétique du traceur en imagerie TEP pour la caractérisation du cancer du sein Conclusion Chapitre 4 : Validation et Performances de l Approche Développée Dans les Applications Cliniques Introduction 1. Données pour l évaluation : Du synthétique vers des cas pathologiques 2. Validation de la méthode d analyse proposée pour l estimation du tissu d intérêt 3. Validation de la méthode d analyse proposée AFSIM 4. Validation de la méthode de paramètrisation proposée pour l estimation de la cinétique du traceur en TEP au moyen des méthodes d analyse développées Conclusion Conclusion Générale Annexes 4
8 Liste des figures Figure 1. Evolution de la qualité des radiographies Figure 2. Fonctionnement d une radiographie Figure 3. Principe de fonctionnement de la tomodensitométrie X...27 Figure 4. Principe de fonctionnement de l échographie Figure 5. Principe de fonctionnement de l IRM Figure 6. Principe de fonctionnement de l IRMf Figure 7. Principe de fonctionnement de la scintigraphie Figure 8. Principe de fonctionnement de la TEP Figure 9. Les émetteurs de positons Figure 10. Exemple d une fixation physiologique sur une image TEP Figure 11. Illustration de la correction d atténuation en TEP avec l acquisition TEP noncorrigée en atténuation sur l image de gauche. Le scan TDM, acquis pour établir des cartes d atténuation, est représenté sur l image de centre. L acquisition TEP corrigée du phénomène d atténuation est illustrée sur l image de droite Figure 12. Ensemble des coïncidences détectées : coïncidences vraies, coïncidences fortuites, et les coïncidences diffusées Figure 13. Influence du mouvement respiratoire en TEP (a) sans mouvements respiratoires, (b) avec un mouvement moyenné sur l image TEP, (c) avec une image TEP corrigée par des transformations élastiques Figure 14. Illustration de la résolution avec deux images représentant deux objets ponctuels éloignés (a) ou très proches (c) l un de l autre. Les profils d intensité associés aux deux configurations sont représentés (b) et (d). La résolution d une image est définie par la distance D permettant de distinguer deux objets ponctuels Figure 15. Illustration des effets de volume partiel. En haut à gauche, un objet idéal contenant des sphères. A droite, l'image acquise par un scanner TEP de cet objet (simulation). En bas, les profils correspondants aux barres rouges sur chaque image illustrent la perte d'intensité et l'étalement du signal dus aux effets de volume partiel Figure 16. Illustration de la résolution spatiale limitée du détecteur : un signal correspond à des mélanges différents entre compartiments
9 Figure 17. Anatomie du sein Figure 18. Les stades du cancer du sein Figure 19. Quantité de données pour un seul examen Figure 20. Exemple d un examen TEP avec 61 coupes pour un seul point temps Figure points temps pour chaque coupe Figure 22. Représentation synthétique du contenu d une séquence d image Figure 23. Représentation concrète du contenu d une séquence d images Figure 24. Modèle résolu par l analyse factorielle Figure 25. Exemple de tracé d une région d intérêt Figure 26. Valeur moyenne dans la région en fonction du temps Figure 27. Représentation simplifiée d un système biologique Figure 28. Un décours temporel : évolution du signal dans un pixel Figure 29. Ajustement sinusoïdal des décours temporels Figure 30. Exemple d analyse de phase en imagerie cardiaque Figure 31. Examen cardiaque TEP-FDG synchronisé à l ECG (analyse factorielle pour l analyse de mouvement) Figure 32. Etude Oncologique : ostéosarcome en imagerie planaire (analyse factorielle pour caractériser la réponse à une chimiothérapie) Figure 33. Examen hépatique en scintigraphie planaire (analyse factorielle pour détecter le disfonctionnement d un organe) Figure 34. Analyse factorielle d une séquence d images IRM cardiaque avec produit de contraste Figure 35. Analyse factorielle appliquée à l imagerie de l IRM fonctionnelle Figure 36. Interface du logiciel Pixies Figure 37. Résultat de l application de l'afsim sur une séquence d images rénales Figure 38. Résultat de l application de l'afsim sur une séquence d images rénales (mode multichrome) Figure 39. Résultat de l application d une région d intérêt sur une séquence d images rénales et visualisation de la courbe moyenne associée Figure 40. Résultat de l application de l'analyse factorielle sur une région d intérêt: Affichage multi chrome Figure 41. Les lettres CO et ET et leur CDL, illustrant leurs dissimilarités locales Figure 42. Exemples d impressions anciennes originales de la base d application Figure 43. Impressions anciennes (binarisées) et leur CDL
10 Figure 44. Approche d analyse proposée pour l extraction et la modélisation de la cinétique du traceur en imagerie TEP pour la caractérisation automatique et précoce du cancer du sein Figure 45. Matrice des données originales Figure 46. Estimation des données non bruitées Figure 47. Matrice des données (individu-variable) Figure 48. Les points [C i ] sont les barycentres des points [B j ] dans l espace d origine y moy et engendré par les vecteurs (W 1, W 2 ) (cas de trois fonctions physiologiques) Figure 49. Durant l algorithme itératif, les points Ci sont, de plus en plus, inclus dans le triangle défini par les points Bj (cas de trois fonctions physiologiques) Figure 50. Un exemple des images clés avec la méthode MTVC Figure 51. Courbes synthétiques reflétant les compartiments A(t) et tumoral T(t) Figure 52. Exemple d une séquence d images synthétiques Figure 53. Un examen TEP au FDG : 12 Volumes de données de 45 coupes chacun Figure 54. Quelques coupes d une séquence d images TEP pour un patient Figure 55. Les composantes de chaque image TEP Figure 56. Diverses images clés : (a,b) la méthode MTVC, (c,d) la méthode M - M, (e,f) la méthode GM-QM et (g,h) la méthode MAGMA Figure 57. Un exemple de résultats des comparaisons locales pour différentes méthodes avec les mêmes images affichées dans figure 56. La première colonne contient les résultats des comparaisons locales avec l'approche DPP. La deuxième colonne contient les résultats des comparaisons locales avec l'approche SSIM et la dernière colonne contient les résultats des comparaisons locales avec l'approche CDLVR. La première ligne contient les résultats de la méthode MTVC pour les différentes approches. La deuxième ligne contient les résultats de la méthode M - M pour les différentes approches. La troisième ligne contient les résultats de la méthode GM-QM pour les différentes approches et la dernière ligne contient résultats de la méthode MAGMA pour les différentes approches Figure 58. Injection de l a priori de localisation Figure 59. Un exemple de résultats d une localisation favorable pour l approche DPP avec les mêmes images affichées dans les figures 56 et 57. La première colonne contient l injection de l a priori de localisation avec l'approche DPP. La deuxième colonne contient le résultat de l image finale seuillée avec l approche DPP pour les différentes méthodes
11 Figure 60. Un exemple de résultats d une localisation favorable pour l approche SSIM avec les mêmes images affichées dans les figures 56 et 57. La première colonne contient l injection de l a priori de localisation avec l'approche SSIM. La deuxième colonne contient le résultat de l image finale seuillée avec l approche SSIM pour les différentes méthodes Figure 61. Un exemple de résultats d une localisation favorable pour l approche CDLVR avec les mêmes images affichées dans les figures 56 et 57. La première colonne contient l injection de l a priori de localisation avec l'approche CDLVR. La deuxième colonne contient le résultat de l image finale seuillée avec l approche CDLVR pour les différentes méthodes Figure 62. Un exemple patient d un résultat défavorable des images clés présentant la comparaison locale avec l approche DPP dont la région tumorale n est pas détectable par seuillage avec les différentes méthodes Figure 63. Un exemple patient d un résultat défavorable des images clés présentant la comparaison locale avec l approche SSIM dont la région tumorale n est pas détectable par seuillage avec les différentes méthodes Figure 64. Résultat de l analyse factorielle (AFSIM) Figure 65. Simulation de l'effet de volume partiel en utilisant un filtre gaussien de taille 3x3. I 1 est le compartiment de disque et I 2 est le compartiment carré Figure 66. Simulation de l'effet de volume partiel en utilisant deux fois un filtre gaussien de taille 3x3. I 1 est le compartiment de disque et I 2 est le compartiment carré Figure 67. Simulation de l'effet de volume partiel en utilisant trois fois un filtre gaussien de taille 3x3. I 1 est le compartiment de disque et I 2 est le compartiment carré Figure 68. Résultats de AFSIM appliquée à la séquence des images synthétiques avec l EVP utilisant un filtre gaussien de taille 3x3: (a), (c) Image & Facteur du compartiment carré et (b), (d) l'image et facteur du compartiment de disque Figure 69. Résultats de AFSIM appliquée à la séquence des images synthétiques avec l EVP utilisant deux fois un filtre gaussien de taille 3x3: (a), (c) Image & Facteur du compartiment carré et (b), (d) l'image et facteur du compartiment de disque Figure 70. Résultats de AFSIM appliquée à la séquence des images synthétiques avec l EVP utilisant trois fois un filtre gaussien de taille 3x3: (a), (c) Image & Facteur du compartiment carré et (b), (d) l'image et facteur du compartiment de disque Figure 71. Validation métrique obtenue à partir des variations de niveau du bruit: un bruit de moyenne = 0 et de variance = 0,5 (trait rouge), un bruit de moyenne = 0 et de variance = 1 8
12 (trait bleue), un bruit de moyenne = 0 et de variance = 1,5 (trait pointillé bleu). À gauche: erreur absolue moyenne. A droite: indice Kappa Figure 72. Affichage du vecteur moyen (première courbe en haut à gauche) et des vecteurs propres issus du calcul de l AC Figure 73. Affichage de l image moyenne (première image en haut à gauche) et des 12 images propres issues du calcul de l AC Figure 74. Résultat de l analyse factorielle basée sur l analyse des correspondances appliquée sur une séquence d images TEP au FDG Figure 75. Courbe moyenne relative à la tumeur Figure 76. Evolution de la méthode «Level set». A gauche : Initialisation de la courbe. A droite : résultat obtenu par la méthode «Level set» Figure 77. Résultat de l analyse factorielle appliquée sur une ROI d une séquence d images TEP Figure 78. Choix du temps du t m Figure 79. Validation du paramètre proposé K FPQ pour l'évaluation du SUVmax à l'aide d'un modèle du premier passage. Excellente corrélation linéaire est trouvée entre ces deux paramètres
13 Liste des figures de l annexe Figure A. 1. Variation du paramètre α sur une image TEP (a) Contour initial. (b) Image segmentée avec α = Figure A. 2. Variation du paramètre α sur une image TEP (a) Contour initial. (b) Image segmentée avec α = Figure A. 3. Variation du paramètre α sur une image TEP (a) Contour initial. (b) Image segmentée avec α = Figure A. 4. Variation du paramètre β sur une image TEP (a) Contour initial. (b) Image segmentée avec β = Figure A. 5. Variation du paramètre β sur une image TEP (a) Contour initial. (b) Image segmentée avec β = Figure A. 6. Variation du paramètre β sur une image TEP (a) Contour initial. (b) Image segmentée avec β = Figure A. 7. Variation du paramètre γ sur une image TEP (a) Contour initial. (b) Image segmentée avec γ = Figure A. 8. Variation du paramètre γ sur une image TEP (a) Contour initial. (b) Image segmentée avec γ = Figure A. 9. Variation du contour initial sur une image TEP (a) Contour initial. (b) Image segmentée Figure A. 10. Variation du contour initial sur une image TEP (a) Contour initial. (b) Image segmentée
14 Liste des tableaux Tableau 1. Les principaux émetteurs de positons Tableau 2. Nombre de patients dont la tumeur est bien localisée sans l a priori de l injection sur un total de 27 examinés, analysés à la fois par les méthodes MTVC, MAGMA, GM-QM et M - M présentant la comparaison efficace avec les approches DPP, SSIM et CDLVR Tableau 3. Nombre de patients dont la tumeur est bien localisée avec l a priori de l injection sur un total de 27 examinés, analysés à la fois par les méthodes MTVC, MAGMA, GM-QM et M - M présentant la comparaison efficace avec les approches DPP, SSIM et CDLVR Tableau 4. Nombre de patients bien localisés sur un total de 27 examinés, analysés à la fois par les méthodes MTVC, MAGMA et GM-QM présentant la comparaison efficace avec les approches DPP et CDLVR. L avant dernière ligne présente le nombre de patients analysés à la fois par les méthodes MTVC et MAGMA. La dernière ligne présente le nombre de patients analysés à la fois par les méthodes GM-QM et MAGMA. La dernière colonne présente le nombre d examens analysés à la fois par les approches DPP et CDLVR Tableau 5. Mesures de variance associées à l analyse des correspondances Tableau 6. Contribution relative de chacun des compartiments Tableau 7. Etude des cas évaluant les différents paramètres médicaux empirqiues et le paramètre empirique proposé K FPQ chez les patients ayant un cancer du sein localement avancé
15 Glossaire des Acronymes 12
16 A AC ACP AF AFSIM : Analyse des Correspondances : Analyse des Correspondances Principales : Analyse Factorielle : Analyse Factorielle d une Séquence d Images Médicales B BF BGO BOLD : Blood Flow : Oxyde de Germanium de Bismuth : Blood Oxygenation Level Dependent C CDL CDLVR CT-scan : Carte des Dissimilarité Locale : Carte des Dissimilarité Locale à Valeurs Réelles : Computerized Tomography scan D DH DPP : Distance de Hausdorff : Différence Pixel à Pixel E EVP ECG : Effet de Volume Partiel : ElectroCardioGramme F 18 F-FDG : FluoroDéoxyGlucose 18 9 F : Fluor 18 FPQ : First Pass Quantification 13
17 FWHM : Full Width at Half Maximum G GM-QM GSO : Geometric Means Quadratic Means Analysis : Gadolinium OxyorthoSilicate I IRM IRMf : Imagerie par Résonance Magnétique : Imagerie par Résonance Magnétique fonctionnelle L LSO LOR : Lutetium OxyorthoSilicate : Ligne de Réponse M MAGMA MEG MTVC M M : Method for Arithmetic and Geometric Means Analysis : MagnétoEncéphaloGraphie : Method for Temporal Volumes Comparison : Minimum Means Maximum Means Analysis P PMs PSF : PhotoMultiplicateurs : Point Spread Function R ROI S SONAR : Region Of Interest : SOund NAvigation Ranging 14
18 SPECT SSIM SUV : Single Photon Emission Computed Tomography : Indice de Similarité Structurelle : Standardized Uptake Value T TD : Tableau de Distances TDM : TomoDensitoMétrie TD PEC : Transformée en Distance Pondérée sur Espace Courbe (page 81) TD PG TDVR TDW TeD TEP TOF : Transformée en Distance Pondérée par le niveau de Gris : Transformée en Distance à Valeurs Réelles : Transformée en Distance de Wilson : Transformée en Distance : Tomographie par Emission de Positons : Time Of Flight 15
19 Introduction Générale 16
20 L imagerie médicale, surtout la plus récente et la plus développée, est un outil diagnostique essentiel en cancérologie. L objectif primordial de telles technologies médicales est le dépistage précoce du cancer avant d atteindre des phases pathologiques néfastes. L imagerie médicale, qui ne cesse de se développer technologiquement, est un moyen efficace pour l élaboration du bilan d extension tumorale. En fait, une telle image est capable de fournir au clinicien des informations anatomiques précises lorsque la modalité d imagerie est statique telle que la tomodensitométrie, l échographie, l Imagerie par Résonance Magnétique (IRM), et des informations fonctionnelles et/ou métaboliques très importantes lorsque la modalité utilisée est dynamique telles que l Imagerie par Résonance Magnétique fonctionnelle (IRMf), la scintigraphie et la Tomographie par Emission de Positons (TEP). La taille et la localisation des lésions tumorales, primaires et secondaires, sont traditionnellement obtenues par la radiographie, par l échographie à ultrasons, par la tomodensitométrie aux rayons X et par les images IRM. Cependant, ces modalités d imagerie anatomique ont une sensibilité de détection limitée aux lésions supérieures au cm 3, et ne peuvent fréquemment pas bien distinguer une masse tumorale nécrosée ou une maladie résiduelle active. L utilisation de la médecine nucléaire en cancérologie est complémentaire de ces explorations morphologiques, supposées statiques. Fondée sur l utilisation de radiopharmaceutiques s accumulant préférentiellement sur ou dans les cellules tumorales, elle permet le diagnostic précoce d une telle pathologie. Un exemple de traceur à base du glucose se fixe immédiatement sur la cellule cancéreuse considérée comme consommatrice de ce produit, et la modalité dite dynamique permettra alors de l imager plus clairement. L utilisation du traceur en imagerie médicale favorise entre autres des études plus spécifiques à savoir la détermination de la morphologie d un organe ou le suivi du cheminement d un radio-isotope le long des vaisseaux sanguins ou des voies lymphatiques. En médecine nucléaire, la TEP, il serait également possible de faire une étude diagnostique de la plupart des organes ou des tissus du corps humain avec de très bons pronostics quant à leur pathologie. L imagerie médicale dynamique concerne aussi l IRMf qui est une évolution considérable de la modalité IRM, là ou il serait possible d imager des vaisseaux en action, et parfois même des cellules, avec plus d intérêt aux cellules cancéreuses. S ajoute à la modalité avancée IRMf la modalité TEP, qui est considérée comme la plus sophistiquée, la plus couteuse, et la plus efficace en cancérologie. 17
21 Le traitement d images médicales fonctionnelles est un domaine actif et récent qui suscite l'intérêt des cliniciens. Le but de cette modalité d'images est de renforcer le diagnostic et de proposer des aides pour la décision clinique et / ou pour la poursuite de la thérapie. En médecine nucléaire, la TEP est considérée comme un outil très utile et efficace, largement exploité dans les explorations en oncologie. Ce travail de recherche en imagerie médicale concerne plus spécifiquement l imagerie fonctionnelle, là ou l appareillage considéré est plus sophistiqué d une part, et utilisant un traceur marqueur de poursuite d autre part. La modalité ciblée est la TEP pour le dépistage du cancer du sein qui est considéré comme le deuxième cancer le plus fréquent dans le monde et qui occupe l intérêt de la majorité des travaux de recherche en médecine et en technologie d imagerie médicale. Les séquences d'images TEP peuvent fournir des informations importantes qui doivent être soigneusement étudiées pour la surveillance des patients en cours de traitement. Plusieurs outils et approches ont été proposés pour le traitement des diverses modalités fonctionnelles pour plusieurs tâches d automatisation. En effet, parmi les tâches cliniques, celles qui sont manuelles consomment beaucoup de temps et ne sont pas efficaces pour un diagnostic précis. Ces tâches manuelles peuvent être effectuées efficacement de manière automatisée et peuvent être améliorées en utilisant des outils de traitements puissants. Notre travail s inscrit dans le cadre de cette thématique. Un projet de recherche en co-tutelle a été établit à cet effet entre l unité de recherche ATMS «Advanced Technologies for Medicine and Signals» et le Centre de Recherche en Science et Technologie de l'information et de la Communication «CReSTIC». Un projet a été proposé au départ par le centre Georges François LECLERC de Dijon «CGFL», un centre de lutte contre le cancer. Le projet en question concerne la réalisation d un outil de diagnostic assisté par ordinateur permettant l extraction et la modélisation de la cinétique du traceur en imagerie TEP caractérisant la tumeur et en particulier le cancer du sein. Les images TEP au 18 F-fluorodésoxyglucose ( 18 F-FDG) sont considérées comme l étalon pour l'évaluation in vivo du métabolisme du glucose dans la tumeur. Elles sont largement utilisées dans les explorations cliniques d'oncologie. Les tumeurs malignes sont généralement associées à un accroissement du flux sanguin BF (Blood Flow) et du métabolisme cellulaire SUV (SUV en anglais pour Standardized Uptake Value). Dans les cancers du sein localement avancé, l augmentation du métabolisme glucidique ou un déséquilibre entre le métabolisme glucidique et le flux sanguin permet de prédire une mauvaise réponse à la chimiothérapie 18
22 néoadjuvante. Le SUV reste l indice de référence le plus utile à la pratique clinique pour déterminer les résultats quantitatifs d un examen TEP au 18 F-FDG. L idée est de proposer un nouveau modèle paramétrique qui permettra de corriger les limites du SUV. La faible qualité des images d'émission (liée notamment au bruit, les effets de volume partiels ainsi que variabilité des protocoles d'acquisition et de reconstruction des images et le grand nombre de procédures proposées pour définir les volumes) en sont la cause. Un paramètre clinique reflète une quantification automatique et précoce du métabolisme glucidique ; c'est-à-dire à partir d images précoces (après les 11 premières minutes), contrairement au paramètre SUV qui est calculé à partir d images tardives (après 90 minutes de l injection du traceur 18 F-FDG). Ce nouveau modèle paramétrique doit être déterminé à partir de l évolution temporelle du traceur 18 F-FDG dans le compartiment purement tumoral, estimée à l aide des outils de traitements puissants appliqués à la région d intérêt tumorale, contrairement au paramètre SUV qui est souvent déterminé dans un mélange de compartiments vasculaire et tumoral. Cette information métabolique proposée est accessible à l aide d une nouvelle approche pour l extraction et la modélisation de la cinétique du traceur en imagerie TEP caractérisant la tumeur et en particulier le cancer du sein. Notre approche proposée [64] commence par une identification automatisée de la région d'intérêt (ROI, en anglais pour Region Of Interest) tumorale, dans un cas particulier : le cancer du sein, à partir de la séquence des images dynamiques TEP. Ensuite, la méthode d analyse proposée basée sur l analyse factorielle des séquences d'images médicales (AFSIM) est appliquée à la ROI obtenue au moyen d une extension de la carte des dissimilarités locales à Valeurs Réelles (CDLVR) proposée en niveaux de gris afin d estimer l'évolution temporelle de la concentration du traceur 18 F-FDG dans les deux compartiments physiologiques : purement tumoral et vasculaire. L objectif est bien évidemment arrivé à évaluer la cinétique du traceur caractérisant le cancer du sein. Plus spécifiquement, il s agit de déterminer un nouveau paramètre empirique K FPQ (K FPQ en anglais K First Pass Quantification ). Il est calculé à partir des deux compartiments obtenus dans la région d intérêt tumorale et évalué durant le premier passage du traceur 18 F-FDG dans les images TEP précoces. Nous essayons par ce travail de développer la méthode de mesure de dissimilarité locale et la méthode de l analyse factorielle des séquences d'images médicales appliquée à l imagerie TEP plus précisément, là ou une analyse compartimentale est considérée comme une bonne faveur à faire le suivi du tissu tumoral dans le sein. La méthode d analyse AFSIM présente un intérêt particulier pour les études cliniques pour estimer certaines fonctions physiologiques. Certaines publications discutent de l'utilité 19
23 clinique de cette technique dans l'analyse quantitative des différents types d'études dynamiques: «gated» cardiaque et la scintigraphie rénale. Plus récemment, l AFSIM a été utilisé avec succès pour analyser une séquence dynamique des images TEP. Elle vise à estimer la variation de concentration d'un traceur dans différentes fonctions physiologiques. Une étude précédente [63] a montré que l'analyse des séquences d'images médicales (AFSIM) appliquée à une séquence d'images dynamiques TEP ne pouvait pas être discriminante pour évaluer l'évolution temporelle dynamique du traceur, afin de préciser les compartiments d'une tumeur. Pour mieux comprendre l'importance de l'analyse factorielle (AFSIM), nous essayons d'analyser ses spécificités par rapport aux zones des régions d'intérêt. Dans notre cas, l approche de l analyse factorielle (AFSIM), appliquée à chaque zone tumorale, sert à séparer le compartiment vasculaire, ainsi que le compartiment purement tumoral et à évaluer leurs activités et leurs variations dans le temps caractérisant la tumeur. L estimation de la région d'intérêt (ROI), dans un cas particulier : le cancer du sein, présente deux avantages : la première est de permettre une bonne séparation des compartiments physiologiques. La seconde est une quantification automatique et précoce du métabolisme glucidique durant le premier passage du traceur 18 F-FDG, mesurée dans le tissu d intérêt des images dynamiques TEP afin de caractériser le cancer du sein. L approche classique et la plus intuitive en routine clinique pour l estimation de la région d intérêt repose sur une segmentation manuelle des tumeurs. Cette approche est longue et fastidieuse. Différentes méthodes automatiques ont été proposées pour déterminer un volume d intérêt en images fonctionnelle. La dépendance à la partie clinique pour l initiation du contour présente l inconvénient principal pour les modèles déformables. En effet, les performances de ces algorithmes sont souvent sensibles aux variations de l intensité du bruit ou aux changements de contraste dans les images. Elles sont de plus généralement, dépendantes d initialisations et de pré- ou post-traitements gérés par l utilisateur, ainsi que d informations a priori supplémentaires. L évolution spatio-temporelle du traceur est exploitée pour identifier automatiquement la région d intérêt tumorale dans le sein. Certaines approches de comparaison locale permettent la détection des changements dans l organisation spatiale entre deux images TEP. Nous rappelons tout d abord la Différence Pixel à Pixel (DPP) et de l Indice de Similarité Structurelle (SSIM). La Différence Pixel à Pixel est une mesure classique et simple, avec des mesures locales bien définies. SSIM est un bon exemple d une mesure locale, construit à partir d une approche globale, localement limitée. Puis, une définition d une Carte des Dissimilarités Locales à Valeurs Réelles (CDLVR) sur des images en niveaux de gris que 20
24 nous la proposons dans ce travail de recherche. L extension aux niveaux de gris d une carte des dissimilarités locales, initialement définie sur des images binaires, permet d obtenir aisément une bonne localisation. En effet, une CDLVR robuste au bruit et aux faibles distorsions, est définie par extension de la notion de transformée en distance. Son application permet de mettre en évidence l activité tumorale, plus efficacement qu avec la différence pixel à pixel. La CDLVR fournit des mesures locales bien définie et efficace. Ce manuscrit de thèse est organisé de la façon suivante : le premier chapitre décrit le fonctionnement et la raison d être l imagerie fonctionnelle TEP, en commençant par un rapide historique et les principes, modes de fonctionnement, et les facteurs qui dégradent les performances de la TEP. La suite du chapitre se concentre sur le FluoroDéoxyGlucose ( 18 F- FDG), radiotraceur le plus utilisé en routine clinique pour l'oncologie y est décrit. La fin du chapitre est consacrée à son utilisation en routine clinique ainsi que le rôle que peuvent jouer dans leur application en oncologie dans un cas particulier : le cancer du sein, qui est la pathologie sur laquelle nous avons été amenés à travailler. Le second chapitre propose un état d art des paramètres cliniques accessibles par la partie clinique en imagerie TEP comme le métabolisme glucidique et le flux sanguin ainsi que leurs performances et leurs limites. La partie suivante est consacrée à la méthode d analyse basée sur l AFSIM d une part et la méthode d analyse basée sur des approches de comparaison locale d images comme la CDL d autre part. Et, nous mettons l accent sur la relation de la méthode d analyse de séquences d images fonctionnelles avec la méthode d estimation de la région d intérêt. Le troisième chapitre détaille notre approche proposée pour déterminer un nouveau paramètre empirique K FPQ (K FPQ en anglais K First Pass Quantification ) permettant l extraction et la modélisation automatique et précoce de la cinétique du traceur en vue de la caractérisation de la tumeur au moyen de la méthode d analyse proposée AFSIM appliquée sur une ROI tumorale et d une extension d une mesure de dissimilarité locale proposée en niveaux de gris. Le quatrième chapitre est une concrétisation de notre étude. Nous commençons par les études de validation de la méthode d analyse proposée AFSIM basée sur une séquence d images synthétiques, puis nous passons à une séquence d images dynamiques TEP. Puis, nous passons à la validation de la méthode d analyse basée sur la mesure de dissimilarité sur une séquence d images synthétiques, puis nous passons à une séquence d images TEP. Enfin, nous clôturons en présentant d abord un récapitulatif des résultats obtenus, puis la validation de l approche originale de l estimation de la cinétique du traceur qui se dégagent de l ensemble de ce travail. 21
25 Chapitre I : Imagerie TEP pour la caractérisation des tissus tumoraux Introduction Imagerie fonctionnelle Historique de l imagerie médicale Présentation des modalités d imagerie médicale Modalités en imagerie anatomique Modalités en imagerie fonctionnelle La TEP par rapport aux autres techniques d imagerie fonctionnelle Physique de l imagerie fonctionnelle Fluor Annihilation Radiotraceurs Fluoro-deoxy-glucose 18 F-FDG Développement de nouveaux traceurs Chaîne de détection Facteurs de dégradation des images TEP Atténuation Diffusion Coïncidence Mouvements Bruit Résolution spatiale Effet de volume partiel Principe d utilisation de la TEP au 18 F-FDG en oncologie : contexte clinique, besoins et objectifs Déroulement d un examen TEP Diagnostic en cancérologie Spécificités de l imagerie TEP en oncologie Intérêt et spécificité du 18 F-FDG en cancérologie Spécificités de l imagerie TEP au 18 F-FDG en cancer du sein Anatomie du sein Les stades du cancer du sein Statistiques du cancer du sein Traitements du cancer du sein Diagnostic médical du cancer du sein Conclusion
26 Introduction La Tomographie par Emission de Positons (TEP) est une modalité d imagerie médicale de type fonctionnelle qui existe depuis les années 1970, mais dont l utilisation en recherche et clinique ne date que des années La TEP est utilisée en recherche pour la cardiologie et l exploration cérébrale. Elle est de plus en plus préconisée en clinique pour la prise en charge des cancers. Ce chapitre présente une revue générale des technologies, techniques et état de l'art en relation avec le sujet. Il résume brièvement les principes et les éléments importants de la TEP. Nous détaillons aussi les principes, modes de fonctionnement, et les facteurs qui dégradent les performances de la TEP. Ce chapitre expose brièvement les principes de détection, de reconstruction et d'analyse des images TEP dans un contexte global. Ensuite, le FluoroDéoxyGlucose ( 18 F-FDG), radiotraceur le plus utilisé en routine clinique pour l'oncologie y est décrit, ainsi que le rôle que peuvent jouer les examens TEP dans leur application en oncologie dans un cas particulier : le cancer du sein, qui est la pathologie sur laquelle nous avons été amenés à travailler. 1. Imagerie fonctionnelle 1.1. Historique de l imagerie médicale La première technique d imagerie médicale est la radiographie, née à la fin du 19ème siècle grâce aux travaux du physicien allemand Wilhelm Conrad Röntgen ( ). Dans l obscurité de son laboratoire, ce dernier étudiait l électricité dans un tube cathodique quand il vit par hasard, en interposant sa main devant le tube, ses propres os. En 1895, Il a réalisé la première radiographie sur l une des mains de sa femme. Les rayons X sont alors découverts, permettant de voir à l intérieur du corps humain sans avoir besoin de l ouvrir. Depuis, de nombreuses améliorations ont été apportées à ce principe révolutionnaire, jusqu à la radiographie aux rayons X telle que nous la connaissons aujourd hui [118]. L apport de l informatique et du traitement numérisé des images a abouti à la mise au point du scanner en 1972 par les radiologues britanniques Allan Mc Cornack ( ) et Godfrey N. Hounsfield (né en 1918). À côté des rayons X, d autres principes physiques ont été découverts tout au long du 20 ème siècle, inspirant de nouvelles techniques d imagerie médicale. Ainsi, la propagation des ultrasons était utilisée par les SONAR (SOund NAvigation Ranging) dès
27 pour détecter les icebergs suite au naufrage du Titanic. Un demi-siècle plus tard (en 1955) qu Inge Edler ( ), un cardiologue suédois, a eu l idée de mettre au point sur ce principe, l échographie pour diagnostiquer les sténoses mitrales. La résonance des noyaux des atomes soumis à un champ magnétique a été découverte en 1945 par les physiciens américains Edward Purcell et Felix Bloch. En 1973, le chimiste américain Paul C.Lauterbur obtient, chez un animal, le premier cliché en Imagerie par Résonance Magnétique (IRM). De la résonance des noyaux des atomes a également découlé la spectroscopie par résonance magnétique, disponible depuis les années Enfin, la découverte de la radioactivité naturelle par Henri Becquerel, Pierre et Marie Curie en 1898, puis de la radioactivité artificielle par Irène et Frédéric Joliot- Curie en 1934, ont conduit au développement de la médecine nucléaire, avec la scintigraphie puis la Tomographie par Emission de Positons (TEP) [118]. Figure 1. Evolution de la qualité des radiographies [110] Le premier tomographe à émission de positons a été construit au début des années 1950 par Rankovitch et al. Il était constitué d un anneau de détection en iodure de sodium [36]. La TEP est utilisée dans le cadre de la localisation des tumeurs cérébrales [51]. La figure 1 montre l image obtenue de cette première machine en action [51], [15]. Après plusieurs versions de ce premier modèle, un scanner «hybride» fut développé dans les années 60 [16]. Ce modèle permet d obtenir une image bidimensionnelle. Puis le premier tomographe assisté par ordinateur (modèle à anneaux) a été décrit en 1975 [96], [82], [36]. En parallèle, les radiopharmaceutiques furent également développés à partir des années 70. Ils ont initialement débuté avec l utilisation de l oxygène 15, le carbone 11, le fluor 18 et l azote 13. Plus de détails sur l histoire de l imagerie par positons sont disponibles dans [15]. 24
28 1.2. Présentation des modalités d imagerie médicale Les modalités d imagerie médicale peuvent être classées en deux grandes familles : l imagerie anatomique permettant de montrer les organes, donc l anatomie du corps humain. Quant à l imagerie fonctionnelle, celle-ci permet plutôt de déterminer certains paramètres fonctionnels. La détection des zones pathologiques ayant une activité physiologique est difficile en analysant uniquement les images anatomiques. Par ailleurs, la localisation d une zone pathologique visualisée avec les images fonctionnelles est difficile en absence des images anatomiques [35]. L imagerie fonctionnelle utilisant l injection des marqueurs radioactifs souffre d une résolution spatiale médiocre par rapport à l imagerie anatomique comme par exemple l IRM. En effet, la résolution spatiale des images TEP est de l ordre de 4-5 mm pour les études chez l homme. En IRM, on atteint 1 mm chez l homme. Les imageries anatomique et fonctionnelle n ont pas les mêmes indications cliniques, mais fournissent des informations complémentaires. L exploitation de ces deux modalités d imagerie peut être optimisée de façon complémentaire à l aide de techniques sophistiquées comme la fusion d images [36] telles que les systèmes multimodaux TEP/TDM (TomoDensitoMétrie). Ces systèmes permettent de combiner les informations anatomiques, fournies par la TDM, aux informations fonctionnelles délivrées par la TEP. La combinaison des images fonctionnelles TEP avec les images anatomiques TDM améliore la détection des zones pathologiques et notamment l interprétation des scans. La combinaison de deux modalités d imagerie permet la correction de l Effet de Volume Partiel (EVP) dû à l acquisition TEP qui sera présenté dans la suite de ce chapitre [35] Modalités en imagerie anatomique L'imagerie anatomique, appelée aussi structurelle ou morphologique, regroupe la radiologie X, le scanner ou la TDM, l'échographie et l'imagerie par résonance magnétique nucléaire. Ces techniques permettent d'obtenir des informations sur l anatomie des organes, à savoir, leurs formes et leurs limites. Radiologie X La radiologie X repose sur les inégalités d atténuation des rayons X par les différents organes et structures. Le patient est placé entre une source de rayons X et un détecteur (figure 2). Le faisceau transmis est le résultat d une atténuation inégale d un milieu contenant différentes 25
29 structures. L atténuation dépend de la densité électronique des tissus traversés et de l énergie des rayons X. A titre d exemple, les rayons X, qui au cours de leurs parcours ne rencontrent que de l'air ou des tissus de densité faible (densité électronique), sont peu arrêtés dans l'organisme et imprègnent fortement le film radiologique (zone noire sur le film ou hyper clarté, c'est le cas par exemple des poumons). A l'opposé, lorsque les rayons X traversent des structures de haute densité, telles que les os, ils sont en grande partie arrêtés, et peu d'entre eux atteignent le film radiologique (partie blanche sur la radiographie, ou opacité). Entre ces deux extrêmes, les rayons rencontrant des structures de densité intermédiaire comme le cœur et les muscles sont partiellement arrêtés dans l'organisme et forment sur le film toute une variété de contrastes [25]. Figure 2. Fonctionnement d une radiographie [110] Tomodensitométrie X La scannographie, la TomoDensitoMétrie (TDM) ou «computerized tomography CT-scan» est une technique d imagerie médicale qui est basée sur le principe d atténuation des rayons X comme la radiologie [70]. Elle permet d obtenir des images de coupes transversales reconstruites à partir des mesures des coefficients d atténuation du faisceau de rayons X dans le volume considéré (figure 3). 26
30 Figure 3. Principe de fonctionnement de la tomodensitométrie X [110] Echographie Elle n'utilise pas les rayons X, mais se sert des propriétés des ultrasons. Un faisceau d'ultrasons émis par une sonde qui traverse l'organisme (figure 4) et interagit avec les différentes structures anatomiques. L image échographique résulte de la détection des ondes réfléchies au niveau des interfaces et des ondes rétrodiffusées provenant des petites structures. Il s agit d une technique d'imagerie anatomique, mais dans certains cas, elle permet d'appréhender certaines fonctions : l échographie cardiaque et l évaluation de la fonction ventriculaire gauche [52]. Figure 4. Principe de fonctionnement de l échographie [112] 27
31 Imagerie par résonance magnétique L Imagerie par Résonance Magnétique nucléaire (IRM) est une technique d imagerie non irradiante. Elle est basée sur l excitation des noyaux d hydrogène placés dans un champ magnétique par des ondes radiofréquences [53]. Le signal est mesuré après l arrêt des ondes de radiofréquence puis traité par un ordinateur et présenté sous forme d images (figure 5). Figure 5. Principe de fonctionnement de l IRM [113] Modalités en imagerie fonctionnelle L imagerie fonctionnelle permet de visualiser le fonctionnement et la physiologie des organes. Elle regroupe l'imagerie par résonance magnétique fonctionnelle, la scintigraphie et la tomographie par émission de positons, qui sera présentée en détail au cours de ce chapitre. Actuellement, d autres modalités d imagerie anatomique permettent la visualisation des images fonctionnelles comme l IRM fonctionnelle (IRMf) ou la TDM fonctionnelle [35]. Imagerie par résonance magnétique fonctionnelle La technique d Imagerie par Résonance Magnétique fonctionnelle (IRMf) est un outil majeur qui permet l exploration du cerveau en fonctionnement de façon non invasive. L IRMf permet de visualiser indirectement les réseaux neuronaux activés lors d une tâche cognitive (figure 6), en les comparants à une tâche de référence. L activation neuronale s accompagne localement d une augmentation du débit sanguin, du volume sanguin, et de l oxygénation de l hémoglobine entre les deux états dans le cortex activé. L IRMf permet l étude de cette réponse hémodynamique locale, grâce à l effet BOLD (Blood oxygenation level dependent) 28
32 qui repose sur la différence intrinsèque de contraste du sang capillaire entre l activation et le repos [92]. Figure 6. Principe de fonctionnement de l IRMf [114] Scintigraphie La scintigraphie est une méthode d'imagerie fonctionnelle qui procède par l'administration, dans l'organisme de radiopharmaceutiques, une complexe molécule biologique-radioisotope émetteur de rayonnements gamma (figure 7). L image est obtenue par la détection des rayonnements émis par ces isotopes après leur fixation par les organes à examiner. Figure 7. Principe de fonctionnement de la scintigraphie [115] 29
33 Tomographie par émission de positons De même que la scintigraphie, la Tomographie par Emission de Positons (TEP) est une méthode d'imagerie médicale pratiquée par les spécialistes en médecine nucléaire. Toutefois, la mesure de la distribution volumique et temporelle d un radio-pharmaceutique spécifique permet d obtenir, in vivo chez l homme, la cartographie 3D au sein des organes d un paramètre physiologique comme l activité métabolique du glucose, le débit sanguin, ou la densité de récepteurs d'un organe grâce aux émissions produites par les positons (ou positrons) issus de la désintégration d'un produit radioactif injecté au préalable. Le principe de la TEP repose sur la détection des deux photons de 511 kev, émis suite à la réaction d annihilation survenant lors de la rencontre dans la matière d un positon positif et d un électron (figure 8) [84]. Ces deux photons sont émis selon la même ligne droite dans des directions opposées. La détection des deux photons provenant de la même annihilation doit intervenir dans un bref intervalle de temps appelé fenêtre temporelle. Un événement en coïncidence permet de tracer une ligne de réponse entre les deux points de détection (figure 8). Les intersections de ces lignes amènent à reconstruire une image tomographique, d où le nom de tomographie par émission de positons donné à cette méthode d imagerie nucléaire [40]. L acquisition est réalisée par un ensemble de détecteurs répartis autour du patient. Les détecteurs sont constitués d un scintillateur qui est choisi en fonction de nombreuses propriétés, pour améliorer l efficacité et le rapport signal sur bruit. Pour détecter les photons, le patient est placé dans une couronne de détecteurs élémentaires (modules de détection) répartis en anneau. Chaque détecteur élémentaire est composé d un cristal scintillateur et d un photomultiplicateur ou d un réseau de petits cristaux et de photomultiplicateurs optimisés par la détection des photons gamma. Arrivé dans le cristal, le photon gamma primaire interagit en émettant des photons lumineux. Nous collectons au niveau des photomultiplicateurs la lumière résultante. La quantité de lumière est proportionnelle à la quantité d énergie du rayonnement. Les rayonnements lumineux doivent décroître très rapidement dans le cristal [40]. Les modules de détection sont reliés avec ceux qui leur font face par un circuit électronique, ou le circuit de coïncidence, définissant la détection simultanée d un couple de gamma dans un intervalle de 5 à 50 ns [84], [29]. Cette méthode dite de collimation électronique permet de déterminer au moyen de deux détecteurs élémentaires la projection du lieu d annihilation (figure 8). 30
34 Figure 8. Principe de fonctionnement de la TEP [116] Cette technique connaît une permanente évolution, tant du point de vue du détecteur que de celui des algorithmes. Ces développements font de la TEP un outil pleinement opérationnel, qui a toute sa place au sein de l imagerie médicale [29] La TEP par rapport aux autres techniques d imagerie fonctionnelle L autre technique d exploration fonctionnelle qui utilise des radiopharmaceutiques est la tomographie d émission monophotonique. Ces deux modalités d imagerie diffèrent par le marquage de la molécule injectée au patient et par les caractéristiques des systèmes de détection associés. La TEP utilise comme marqueurs des émetteurs de positons. Ces marqueurs ont une durée de vie brève allant de 2 minutes à 109 minutes, qui nécessite leur production par un cyclotron et leur incorporation dans le radio-pharmaceutique sur le site même du tomographe pour les isotopes de plus courte période. La tomographie d émission monophotonique utilise comme marqueurs des émetteurs gamma : l isotope utilisé de plus courte période a 6 heures de période et est facilement disponible grâce à un générateur. Cette modalité d imagerie 31
35 médicale ne nécessite donc par la présence d un cyclotron au voisinage du centre d imagerie contrairement à la TEP. La TEP est environ 100 fois plus sensible que la tomographie d émission monophotonique grâce à la suppression des collimateurs physiques remplacés par une collimation électronique. Par ailleurs, la suppression des collimateurs physiques permet d obtenir une résolution spatiale uniforme sur l ensemble du champ de vue et non pas variable avec la distance au collimateur. Pour des raisons de coût de production des traceurs essentiellement, la TEP est longtemps restée un outil dédié à la recherche clinique [58]. Son succès a été assuré par la grande variété de radiopharmaceutiques disponibles. Celle-ci résulte de la facilité d intégration des marqueurs dans des molécules biologiques en TEP. Cela a permis à la TEP d être utilisée pour valider de nouvelles thérapeutiques comme la greffe de neurones capables de suppléer la production de dopamine par le système dopaminergique dans la maladie de Parkinson [85]. Nous décrirons brièvement comment la TEP permet l imagerie in vivo du système de transmission dopaminergique. La TEP est également devenue un outil privilégié pour l imagerie de l expression des gènes [94] Elle a permis d entreprendre une cartographie fonctionnelle du cerveau en comparant le débit sanguin des régions du cerveau mesuré lors d une stimulation motrice, sensorielle ou cognitive au débit sanguin mesuré au repos [45]. De telles études d activation sont maintenant réalisées par deux autres techniques d imagerie fonctionnelle, l imagerie par résonance magnétique nucléaire fonctionnelle (IRMf) et la MagnétoEncéphaloGraphie (MEG), qui ont une résolution temporelle supérieure à celle de la TEP. Depuis le milieu des années 1990, l imagerie TEP du métabolisme du glucose connaît un grand succès pour la détection et la localisation des tumeurs et pour le suivi des patients après la mise en œuvre des traitements en oncologie. L'intérêt de la TEP en oncologie est lié au fait que les cellules cancéreuses ont un métabolisme du glucose plus important que les cellules des tissus hotes [81], et cette technique fournit grâce à cela une information complémentaire de celle fournie par les études radiologiques (TDM et IRM). Il existe quatre centres TEP en France équipés d un laboratoire de radiochimie et quatre centres équipés de caméras dédiées aux investigations cliniques du métabolisme du glucose en oncologie [36]. 32
36 2. Physique de l imagerie fonctionnelle 2.1. Fluor 18 Différentes molécules sont des isotopes émetteurs de positons tels que l oxygène 15, l azote 13 et le carbone 11. Ils constituent la quasi-totalité de la matière vivante, et permettent de faire des marquages très intéressants mais dont la limite physique de période (2, 10 et 20 minutes respectivement) exige d avoir un lieu de production à côté du lieu d examens [78]. Leur utilisation est limitée dans les centres de recherche ayant des cyclotrons qui produisent les traceurs. Le fluor 18 ( 18 9F) est un marqueur intéressant nouvellement synthétisé. Le fluor 18 est un isotope radioactif de nombre de masse 18. Son noyau est composé de neuf protons et 9 neutrons. Sa durée de vie est égale à 110 minutes. La production de ( 18 9F) est réalisée par un bombardement de particules chargées sur des cibles de noyaux stables dans des cyclotrons. Il constitue un radio-isotope optimal. En effet, sa durée de demi-vie est d environ deux heures. Cette propriété lui permet d être utilisé plus loin du lieu de production ce qui représente un avantage majeur. De plus, il s'associe bien avec désoxy-glucose pour former le fluorodésoxy-glucose ( 18 F-FDG) [33]. Nous pouvons ainsi mesurer l activité métabolique dans les cellules. Cette caractéristique biologique est la base de l apport de cette technologie à l évaluation et le suivi des cancers [78] Annihilation Le radiotraceur est une molécule biologique naturellement présentée dans le corps humain dont un atome a été remplacé par un de ses isotopes. Ceci est appelé un émetteur de positons. La molécule injectée dans le corps humain va, grâce à l isotope introduit, émettre des positons. Ce sont des particules, notée e +, de même masse que l électron mais de charge positive. Le positon est une particule chargée qui va être émise avec une certaine énergie cinétique et qui va parcourir une certaine distance avant de perdre cette énergie cinétique. Lorsque le positon (e + ) aura une énergie cinétique quasi nulle, il va se combiner avec un électron (e ) de charge opposée du milieu. Ces deux particules vont disparaître et pour conserver la quantité de mouvement et d énergie, cette rencontre donne une annihilation au cours de laquelle la masse des deux particules se transforme en deux photons d énergie hν égale à 511KeV qui vont être émis sur la même direction en sens opposé (figure 9). C est ce 33
37 mode de désintégration très particulier qui va directement être utilisé lors de la localisation avec la caméra TEP [40]. Ce n est pas le positon qui va être détecté, mais les photons qui résultent de l annihilation. Ce ne sont pas donc les lignes de projection du lieu de la désintégration qui vont être mesurées, mais les lignes de projection de photons. La distance entre ces deux lieux est appelée libre parcours moyen du positon. Elle est relativement faible et elle est déterminée en fonction de l émetteur de positon utilisé. Elle constitue une limite en terme de résolution spatiale. Une autre limite en terme de résolution spatiale en TEP provient de la non-colinéarité des deux photons de 511 kev, résultant de l annihilation d un positon qui n a pas intégralement perdu son énergie cinétique [40]. Figure 9. Les émetteurs de positons [29] 2.3. Radiotraceurs Fluoro-deoxy-glucose 18 F-FDG En oncologie, un des radiotraceurs les plus répandus en routine clinique en imagerie TEP est le fluorodéoxyglucose (appelé couramment 18 F-FDG). Le traceur biologique est un analogue du glucose couplé à un isotope radioactif de fluor 18, mais il possède un atome d oxygène de moins que la molécule de glucose, sur le deuxième carbone. Cette modification a un effet très important à l examen TEP, dans le sens où ce composé se fixe en conséquence plus longtemps dans les cellules concernées, ce qui entraîne une accumulation du traceur au sein des cellules [29]. 34
38 Les examens TEP sont réalisés une heure après injection pour laisser le temps à une accumulation suffisante de radiotraceur dans les cellules de se réaliser, qui sera visualisée sur l image TEP [50]. Le 18 F-FDG n est pas un traceur spécifique du cancer car il est métabolisé par tout organe absorbant du sucre. La prolifération cellulaire qui est une caractéristique des cellules cancéreuses, nécessite la consommation de sucre. L une des principales caractéristiques des cellules tumorales est l hyperconsommation de glucose, établie dès 1920 par les travaux de Warburg [95], [89], [107]. L augmentation de la glycolyse dans les cellules tumorales est caractérisée par une augmentation de la captation cellulaire du glucose. Il arrive néanmoins que certaines tumeurs ne fixent pas le 18 F-FDG. C est pourquoi le médecin demande aux patients d être le plus calme et immobile avant et au cours de l examen TEP pour éviter une fixation importante sur les muscles qui peut être gênante pour le diagnostic [35]. Ces accumulations du traceur dans le corps sont toutes considérées comme des fixations physiologiques (figure 10), ou normales que l on distingue des fixations pathologiques que l examen TEP a pour objectif de détecter. Notre but est d effectuer une analyse plus approfondie de l évolution temporelle de la cinétique du traceur en exploitant l information spatio-temporelle des séquences d images dynamiques TEP. Ainsi, nous pouvons supposer que le facteur qui augmente au cours du temps puis se stabilise ; serait plutôt lié au facteur tissulaire. Ceci est du principalement à l accumulation du radiotraceur dans ce compartiment à la fin de l acquisition. Nous cherchons d extraire et modéliser la cinétique du traceur en imagerie TEP pour la caractérisation du cancer du sein. Figure 10. Exemple d une fixation physiologique sur une image TEP [116] 35
39 L image TEP obtenue est une représentation tridimensionnelle de la distribution du glucose. Ceci permet d analyser et de détecter les anomalies fonctionnelles comme les tumeurs [51]. Le 18 F-FDG constitue actuellement la pierre angulaire de la médecine nucléaire en cancérologie. Il est utilisé pour le diagnostic des cancers broncho-pulmonaires, les cancers ORL, le cancer du sein, les sarcomes [60], [56] Développement de nouveaux traceurs Notons qu il existe d autres radiopharmaceutiques que le 18 F-FDG qui furent développés dans différentes applications médicales de la TEP (cardiologie, neurologie) et surtout en cancérologie pour mesurer certaines caractéristiques tumorales. La prise en compte de certaines caractéristiques tumorales peut être un intérêt majeur dans l interprétation des images TEP [35]. De nombreux autres traceurs sont en cours d évaluation, ce qui permet le suivi de différents métabolismes, comme les caractéristiques d oxygénation, de radiosensibilité, de vascularisation ou de radiorésistance [51]. Le tableau 1 montre les caractéristiques des principaux émetteurs de positons utilisés en médecine nucléaire [89]. Il figure également le processus qu ils caractérisent et les localisations des tumeurs pour lesquelles ils ont été validés. Chaque radiotraceur a ses caractéristiques propres de cinétique, de spécificité et de contraintes d utilisation [100]. Tableau 1. Les principaux émetteurs de positons [29], [100] Energie du positon (MeV) Parcours moyen (mm) T (mm) 11 C N O F Ces traceurs, 18 F-FDG, font encore l objet dans la recherche clinique. Ils ne sont pas utilisés couramment en routine [100]. Pour l avenir de l oncologie, la tendance actuelle est l obtention d une carte d identité biologique d une région d intérêt en fusionnant les informations obtenues avec différents traceurs. Il a également un intérêt particulier dans le cas de suivi des tumeurs et dans la radiothérapie [49], [51]. 36
40 2.4. Chaîne de détection Le principe de la TEP repose sur la détection de photons en coïncidences, de manière à créer la ligne qui relie les points où les deux photons ont été détectés sur la même direction en sens opposé, appelée ligne de réponse (LOR). Nous savons que l annihilation a eu lieu le long de cette ligne, mais nous ne connaissons pas la position exactement [51]. Des systèmes TEP spécifiques, appelés temps de vol (Time Of Flight ou TOF), exploitent l information temporelle lors de la détection des deux photons pour affiner la position de l annihilation le long de la LOR lors de la reconstruction [100]. Le détecteur est plus souvent formé de cristaux scintillateurs inorganiques possédant des propriétés spécifiques couplés à des photomultiplicateurs. La détection des photons nécessite l utilisation des cristaux rapides, denses (en terme de capacité d arrêt d un photon de 511keV) et résolus en énergie pour collecter tous les évènements [35], qui permet d obtenir à la fois une bonne résolution spatiale et une détection efficace. Il existe plusieurs types de cristaux utilisés en TEP. Le cristal le plus répandu en TEP est le BGO (oxyde de germanium de bismuth), possédant des propriétés adaptées aux photons de 511 kev [35]. Les cristaux BGO ont un coefficient d atténuation linéaire très élevé et une bonne densité, malgré leur faible rendement lumineux [78]. Cet avantage permet de maximiser la probabilité de détection des photons. La recherche de cristaux mieux adaptés a entraîné l utilisation récente du LSO (lutetium oxyorthosilicate) et du GSO (gadolinium oxyorthosilicate). Ils ont un pouvoir d une réduction des détections de coïncidences aléatoires et de coïncidences diffusées à celui du BGO. Les cristaux LSO ont comme principal avantage d avoir une meilleure capacité d arrêt des photons, une décroissance de scintillation de 40% par rapport à celle du BGO. Ce dernier permet d avoir une meilleure précision de détection et la réduction du nombre de coïncidences fortuites [78]. LSO a aussi une plus courte durée d émission que GSO, mais sa résolution énergétique est inférieure [102], [51]. 3. Facteurs de dégradation des images TEP 3.1. Atténuation A la suite de l annihilation de positons, une proportion importante des photons de 511keV est atténuée par les tissus du patient. L atténuation est un phénomène non isotrope dans l organisme. Il dépend également de la composition et de l épaisseur des milieux traversés, 37
41 des tissus biologiques du patient traversés par les photons ainsi que de leur énergie [40], [100]. En effet, les photons doivent parcourir une certaine distance entre leur lieu d émission (l annihilation entre le positon et l électron) et le détecteur [51]. Lors de cette traversée, le photon traverse une certaine distance dans le patient et dans l air avant d être détecté par le scanner [35]. Par conséquent, le problème classique de compensation des phénomènes d atténuation du signal induit par les tissus se pose notamment en médecine nucléaire [86], [17]. Le photon peut être dévié, ralenti ou absorbé. Son effet le plus important est une diminution du signal au centre des images, notamment pour les fixations [86], [41]. Une compensation et une correction de ce phénomène est donc nécessaire et indispensable sur les images TEP [57], [35], [86]. Si l on ne tient pas compte de ces problèmes d atténuation des tissus du patient, les images résultantes sont incorrectes tant qualitativement que quantitativement [51]. Elles sont bruitées et sous-évaluent les tissus profonds (figure 11), ce qui provoque une perte d information et par conséquent une mauvaise qualité d image TEP [78], [79]. La correction de ces artéfacts nécessite l acquisition d une carte de distribution de densité représentant les coefficients d absorption des tissus (figure 11). Ainsi, on peut compenser cette quantité pour chaque photon en fonction de la zone où il est émis [35], [78]. Figure 11. Illustration de la correction d atténuation en TEP avec l acquisition TEP noncorrigée en atténuation sur l image de gauche. Le scan TDM, acquis pour établir des cartes d atténuation, est représenté sur l image de centre. L acquisition TEP corrigée du phénomène d atténuation est illustrée sur l image de droite [35] 38
42 3.2. Diffusion Les photons peuvent avoir subi une ou plusieurs diffusions avant d atteindre le détecteur. Ce phénomène de diffusion dégrade la qualité de l image, réduit son contraste et provoque une mauvaise localisation de l annihilation. De plus, une partie du signal est localisée à l extérieur du patient. La probabilité du phénomène de la diffusion varie avec la corpulence du patient, elle est d autant plus grande que l épaisseur de milieu diffusant est forte. Ceci explique la mauvaise qualité obtenue en TEP chez l obèse. D autres effets sont liés à la région explorée et à la résolution en énergie du détecteur. En effet, l énergie du photon diffusé est inférieure à 511keV, d autant plus basse que l angle de diffusion est important [93], [100]. De très nombreuses méthodes de correction de la diffusion ont été développées. Plus de détails sur la correction de la diffusion sont disponibles dans [100] Coïncidence Environ 40% des photons s échappent du corps. Ils sont détectés par des détecteurs situés autour du patient. La détection simultanée, ou en coïncidence, de deux photons indique qu ils proviennent d une annihilation qui s est produite à l intérieur de la ligne de réponse (LOR) définie par l ensemble de toutes les lignes droites reliant les deux détecteurs [36]. Ces LOR satisfaisant les conditions des fenêtres énergétiques et temporelles, sont collectés par un système de comptage. Cependant, certaines coïncidences détectées ne correspondent pas à l annihilation de deux photons. Ces événements sont issus de l interaction des photos dans le patient [35]. Il existe trois types de coïncidences indésirables peuvent en détecter : les coïncidences vraies, les coïncidences fortuites, et les coïncidences diffusées (figure 12). Si on ne les élimine pas, elles causeront des artéfacts qui dégradent l image reconstruite [78], [79]. Figure 12. Ensemble des coïncidences détectées : coïncidences vraies, coïncidences fortuites, et les coïncidences diffusées [35] 39
43 Coïncidences vraies Le système de détection en coïncidence recueille le signal de deux photons émis à la suite de la même annihilation d un positon et correspondant à des photons d énergie 511keV n ayant subi aucune diffusion sur leur parcours [100], [93]. Elles sont bien localisées sur la ligne de projection (figure 12). Elles constituent une information utile pour la reconstruction [35]. Coïncidences fortuites Les coïncidences fortuites (ou aléatoires) correspondent à la détection dans la même fenêtre temporelle de deux photons émis en fait lors de l annihilation de deux positons différents (figure 12). Le taux de comptage de ces coïncidences dépend linéairement de la largeur de la fenêtre de coïncidence [36], [78]. Ce type de coïncidence entraîne une mauvaise localisation de l annihilation et une réduction des capacités de comptage du détecteur [35]. La LOR ne passe par aucune des deux sources radioactives. Ceci conduit à dégrader la qualité de l image par augmentation du bruit de fond. De très nombreuses méthodes pour la correction des problèmes issus des coïncidences fortuites ont été développées. La réduction de la fenêtre temporelle impose une électronique plus chère. Une autre solution consiste à réduire le flux des photons en réduisant l activité de radiopharmaceutique injectée au patient [93]. Coïncidences diffusées Ce sont des évènements détectés simultanément qui sont issus de la même annihilation. Mais, comme l un ou l autre des deux photons peut subir une déviation angulaire de manière élastique sur des électrons de la matière (appelée effet Compton [30]). Lorsque l un des deux photons d annihilation subit cette interaction, une coïncidence dite diffusée est bien enregistrée [36]. La diffusion Compton entraîne une perte d énergie et un changement de direction du photon incident. Ce changement de trajectoire entraîne une mauvaise localisation de l annihilation sur une ligne de réponse virtuelle détectée, puisqu elle n est plus corrélée à son lieu d émission (figure 12) [40], [35]. Cela se traduit au niveau des images par une diminution du contraste, du rapport signal sur bruit et par une perte en résolution spatiale [40]. La fenêtre de coïncidence énergétique permet de supprimer les LORs diffusées ayant interagit avec le milieu [35] Mouvements Lors d une acquisition TEP, deux types de mouvements sont observés : les mouvements fortuits, comme un déplacement du patient et les mouvements physiologiques liés au rythme 40
44 cardiaque. Si les mouvements fortuits peuvent être éliminés avec la réduction de la durée des acquisitions, les mouvements physiologiques interviennent et dégradent la qualité de l image TEP en générant des artéfacts [103]. Les mouvements liés à la respiration en TEP (figure 13) conduisent à la fois à une sous-estimation de la fixation de radiotraceur et à une surestimation du volume tumoral [73]. Les examens anatomiques ne durent que quelques secondes. Il est donc possible de bloquer la respiration du patient pour réaliser les acquisitions. Par contre, la TEP est caractérisée par une longue durée d examen, environ 30 minutes pour acquérir tout le corps. En conséquence, l acquisition se déroule pendant plusieurs cycles respiratoires qui seront par la suite moyennés sur l image TEP reconstruite a posteriori [35]. (a) (b) (c) Figure 13. Influence du mouvement respiratoire en TEP (a) sans mouvements respiratoires, (b) avec un mouvement moyenné sur l image TEP, (c) avec une image TEP corrigée par des transformations élastiques [35] 3.5. Bruit En traitement du signal, le bruit caractérise des signaux parasites, qui perturbent les signaux utiles. Il provient dans les images TEP de deux sources différentes. La première est issue de la nature statistique du phénomène physique observé : la désintégration radioactive du marqueur associé au radiotraceur injecté au patient. La deuxième source est introduite lors la reconstruction itérative de l image. Chaque méthode de reconstruction induit un bruit et des artéfacts dépendant des modes opératoires utilisés [35]. Dans la mesure où notre approche consiste à séparer les sources dans l image TEP et à localiser et segmenter les images reconstruites, une étude de robustesse spécifique aux ces images est nécessaire. Dans la suite de cette thèse, lorsque nous parlerons de bruit, il s'agira en général de la variation des valeurs des voxels dans une région d intérêt (variance), et une moyenne éventuellement biaisée, par rapport à une valeur réelle supposée. Par ailleurs, pour le choix des valeurs de variance du bruit «speckle», nous évaluons la variance dans la région 41
45 tumorale des séquences d images TEP et nous avons trouvé une valeur maximale de l ordre de dans ces régions d intérêt (ROI) pour une base de 20 patients. En particulier, dans le contexte des méthodes de segmentation statistique pour développer les algorithmes de localisation et segmentation des images TEP, le bruit désigne la façon dont les valeurs des voxels se répartissent dans une classe donnée, caractérisée en général par un type de distribution statistique définie par des paramètres tels que la moyenne et la variance [51] Résolution spatiale La résolution spatiale définit la capacité d un imageur à séparer deux sources voisines [40]. Avec une résolution spatiale moins précise, les deux objets seront fusionnés en seule tache. Pour définir la résolution spatiale, nous utilisons généralement la notion de largeur à mihauteur (ou FWHM pour Full Width at Half Maximum) de la réponse impulsionnelle (ou PSF pour Point Spread Function) de l imageur. La notion de largeur à mi-hauteur permet de visualiser la résolution spatiale et de considérer l image obtenue comme une convolution par cette PSF de l objet observé (figure 14). Le principal défaut de l imagerie TEP est sa résolution spatiale relativement médiocre par rapport aux autres modalités d imagerie médicale [51]. En effet, la résolution spatiale des images TEP est égale à environ 5mm, alors que celle associée aux images anatomiques sont de l ordre du millimètre. Cette résolution faible explique la mauvaise qualité de l image TEP [35]. Une telle résolution a plusieurs effets gênants, en particulier pour le domaine de l oncologie [51]. La résolution spatiale dépend essentiellement des propriétés physiques du système d imageries telles que la conception du TEP, en particulier de la taille des détecteurs élémentaires ainsi que de leur positionnement et de leur orientation, de la taille du champ de vue et du diamètre de l anneau [40]. Cette résolution est à distinguer de la taille des voxels de l image. En effet, lors de la reconstruction, des filtres de reconstruction utilisés en particulier effectuent un compromis entre la résolution et le bruit [40]. D autre part, elle dépend d effets physiques comme la distance parcourue par le positon entre le lieu d émission et le lieu d annihilation avec les électrons engendrant l émission des deux photons [35]. En effet, l imageur détecte le lieu d annihilation avec l électron et non pas la source de l émission. Un troisième effet physique est la non colinéarité des deux photons qui ne sont pas émis exactement à 180, ce qui génère une erreur sur le lieu d annihilation [78]. 42
46 (a) (b) (c) (d) Figure 14. Illustration de la résolution avec deux images représentant deux objets ponctuels éloignés (a) ou très proches (c) l un de l autre. Les profils d intensité associés aux deux configurations sont représentés (b) et (d). La résolution d une image est définie par la distance D permettant de distinguer deux objets ponctuels [35] Effet de volume partiel Les effets de volume partiel résultant des résolutions spatiales médiocres des modalités d imagerie fonctionnelle constituent une des limites les plus importantes nuisant à l'utilisation quantitative de l'imagerie d émission. L effet de volume partiel (EVP, ou PVE pour Partial Volume Effect) est la conséquence de la résolution spatiale limitée (l effet flou) et de l échantillonnage grossier choisi des images qui biaise les mesures réalisées sur les images [90], [100]. L'EVP désigne deux phénomènes distincts et particulièrement importants en imagerie d'émission. Le premier concerne l'effet de la faible résolution spatiale sur l'aspect visuel des frontières entre différentes régions de l'image. Les transitions entre les régions sont floues et étalées au lieu d'être nettes et brusques. Cet effet induit une sous-estimation de la concentration dans les petites structures (spill-out effect) puisqu une partie de l activité se trouve située en dehors de la structure [40]. Le deuxième phénomène est nommé spécifiquement spill-over effect ou contamination croisée et concerne l'impact quantitatif des EVP. Il désigne le fait que deux régions d'intensités différentes se contaminent mutuellement. Par exemple, si un tissu situé à proximité de la structure d intérêt et fixant fortement le traceur, une partie de l activité peut augmenter artificiellement la fixation de la structure [100]. L'EVP est illustré sur la figure 15. Nous observons dans cette figure les deux effets : d'une part, le profil de la structure imagée est étalé, les frontières de l'objet sont rendues difficiles à discerner. D'autre part le signal de l'objet dans son ensemble, est réduit [51]. L impact de l effet de volume partiel est fortement dépendant de la taille des lésions et de la résolution spatiale du système [91]. L EVP se traduit par une sous-estimation des concentrations radioactives mesurées pour toutes les lésions ayant des petites structures [40]. 43
47 Ces dernières sont plus soumises à l EVP et surtout les structures ayant une taille inférieure à deux ou trois fois la résolution spatiale du système [100], [54]. L effet de volume partiel n est pas gênant lorsqu il s agit de tissus ayant les mêmes cinétiques. Par contre, le problème se pose lorsqu il y a un mélange entre le signal artériel et tissulaire, notamment lorsqu il intervient sur la mesure de la fonction artérielle pour déterminer le débit sanguin ou sur la mesure de la fonction tissulaire pour quantifier l activité métabolique [86]. Figure 15. Illustration des effets de volume partiel. En haut à gauche, un objet idéal contenant des sphères. A droite, l'image acquise par un scanner TEP de cet objet (simulation). En bas, les profils correspondants aux barres rouges sur chaque image illustrent la perte d'intensité et l'étalement du signal dus aux effets de volume partiel. [51] Nous pouvons déduire, alors, l influence considérable de l effet de volume partiel sur la valeur du signal dans un pixel. Celle-ci est un mélange de signaux issus de différentes structures fonctionnelles. Nous prenons comme exemple synthétique (Figure 16), une structure formée de deux compartiments et présentant alors deux niveaux de signal. Elle sera présentée devant un détecteur. Vue sa résolution spatiale limitée, le résultat obtenu est une structure de trois niveaux de signal correspondant à des mélanges différents entre compartiments. En conclusion, un signal dans un pixel d une image fonctionnelle émane de plusieurs compartiments. X = Détecteur Figure 16. Illustration de la résolution spatiale limitée du détecteur : un signal correspond à des mélanges différents entre compartiments 44
48 4. Principe d utilisation de la TEP au 18 F-FDG en oncologie : contexte clinique, besoins et objectifs 4.1. Déroulement d un examen TEP Pour limiter l interaction entre le glucose et le traceur dans les cellules, on demande au patient d être à jeun depuis au moins six heures [100]. Un examen TEP se déroule de la façon suivante : on injecte au patient, typiquement en oncologie, une quantité du traceur 18 F-FDG par voie intraveineuse pour permettre une diffusion de ce traceur dans l organisme [35] et pour poursuivre la consommation du sucre [51]. Le patient doit rester calme et immobile pour éviter l accumulation de 18 F-FDG dans les muscles [35] et pour que le traceur se répartisse dans l organisme [100]. Environ une heure après l injection, le patient est placé dans le tomographe et doit rester au repos pendant les acquisitions dynamiques qui durent beaucoup plus longtemps : environ cinq minutes par «pas» de 15 à 18 cm, ce qui signifie typiquement 20 à 30 minutes pour un examen «corps entier», c'est-à-dire des cuisses jusqu à la tête. Il est nécessaire d enregistrer suffisamment de LORs pour obtenir une image exploitable par la partie clinique, ce qui signifie un contraste et un rapport signal sur bruit suffisants [51]. Les acquisitions dynamiques ne sont généralement pratiquées que dans le cadre de la recherche clinique [35]. Après l acquisition, les images TEP sont reconstruites puis interprétées par le clinicien. Les images donnent des informations concernant la tumeur qui permettent de suivre son évolution lors d une thérapie [100] Diagnostic en cancérologie L imagerie TEP en oncologie est dédiée principalement à la détection des tumeurs, permettant des localisations des lésions [57], [61]. L objectif est le suivi des patients atteints du cancer par la mesure de la taille de la tumeur après chaque essai thérapeutique. La réponse tumorale caractérise l efficacité d un traitement par rapport à un autre lors la thérapie. En conséquence, ces conclusions déterminent l arrêt ou la poursuite du traitement [100]. 45
49 4.3. Spécificités de l imagerie TEP en oncologie La TEP est une technique d'imagerie permettant l'étude de la distribution d'émetteurs e+ dans un objet. Les positons ont un parcours moyen très réduit dans la matière. Après dissipation de son énergie cinétique par collisions, le positon s'annihile avec un électron en émettant deux photons gamma de 511 kev. Les rayonnements émis lors de l'annihilation fournissent des informations sur la localisation et la quantité des émetteurs e+ dans l'objet. En recherche, l imagerie TEP permet l exploration fonctionnelle afin de favoriser une meilleure connaissance des maladies dégénératives (Alzheimer ). Elle est appliquée dans les centres cliniques en oncologie depuis quelques années. Elle permet d apporter les informations fonctionnelles utiles dans des cas où l imagerie anatomique telle que le scanner ou l IRM atteint ses limites dans la détection des tumeurs, notamment celles de petite taille [99] Intérêt et spécificité du 18 F-FDG en cancérologie Le 18 F-FDG est un sucre semblable au glucose rendu radioactif. C est la radioactivité de ce fluor particulier rajouté au glucose qui permet sa détection par la caméra TEP. Pour vivre, fonctionner et se reproduire, les cellules ont besoin d énergie sous forme de glucose, sucre assimilable par l organisme. Cette source énergétique est essentielle aux nombreuses cellules de l organisme et elle se trouve naturellement dans le sang. Plus l activité des cellules est importante, plus leur consommation de glucose augmente. Les cellules cancéreuses se multiplient sans cesse. Ces nombreuses multiplications nécessitent beaucoup d énergie. Elles ont donc une consommation anormalement élevée de glucose par rapport aux cellules normales. C est grâce à ce taux de métabolisme du glucose permettant de définir le 18 F-FDG que l on peut marquer l agressivité de la tumeur avec la caméra TEP [106]. Par son métabolisme et son importance pour les cellules cancéreuses, le 18 F-FDG est préconisé en clinique pour les examens en oncologie Spécificités de l imagerie TEP au 18 F-FDG en cancer du sein Anatomie du sein Le sein est un organe composé de graisses, de glandes et de canaux. Les glandes sont agencées en lobules (de petits lobes) et sont à l'origine de la lactation. Les canaux servent à transporter le lait jusqu'au mamelon. Le sein est sous l'influence d'hormones sexuelles 46
50 (œstrogène, progestérone,...) fabriquées par les ovaires. Leur quantité varie tout au long de la vie pendant la puberté, les grossesses, la ménopause... Le sein est parcouru de vaisseaux sanguins et de vaisseaux lymphatiques. Les ganglions et les vaisseaux lymphatiques composent le système lymphatique qui aide à combattre les infections (figure 17). Figure 17. Anatomie du sein [117] Les stades du cancer du sein Les médecins distinguent les différents stades de cancer, qui correspondent au développement de la tumeur. Les stades sont au nombre de 5 (figure 18) : Stade 0 : Le cancer est «in situ». On parle de carcinome canalaire in situ (si les cellules sont localisées dans un canal et n ont pas migré à l extérieur), et de carcinome lobulaire in situ (si les cellules sont localisées dans la membrane d un lobule). Le cancer n a pas envahi les tissus situés autour de l'organe concerné. Stade 1 : Les cellules ont franchi la membrane basale. À partir de ce stade, le cancer est dit «invasif». La tumeur mesure jusqu'à 2 centimètres et le cancer ne s est pas propagé aux ganglions. Stade 2 : la tumeur mesure entre 2 et 5 centimètres. Elle a atteint des ganglions lymphatiques voisins Stade 3 : le cancer s est propagé aux ganglions et aux tissus voisins du muscle, de l'organe ou de la peau. 47
51 Stade 4 : le cancer a produit des métastases dans d autres parties du corps, c'est à dire qu'il s'est propagé plus loin dans le corps du malade. Figure 18. Les stades du cancer du sein [117] Statistiques du cancer du sein Le cancer du sein est considéré comme le deuxième cancer le plus fréquent dans le monde. En effet, près de 1,6 millions de nouveaux cas ont été évalués dans le monde en 2010 avec plus de décès. Une étude statistique a montré que le cancer du sein est le premier cancer féminin en Tunisie. Il représente 30% des cancers de la femme. Son incidence ne cesse pas d augmenter avec plus de 1000 nouveaux cas par an [12] Traitements du cancer du sein Les cancers invasifs ou infiltrants sont des cancers qui, faute de traitement, quittent leurs tissus d'origine pour envahir les tissus voisins. Les cellules des cancers infiltrants se propagent par les vaisseaux sanguins ou lymphatiques et s'accumulent dans les ganglions lymphatiques. Lorsque les cellules cancéreuses migrent dans d'autres organes (poumon, os, foie, cerveau) et y développent de nouvelles tumeurs (appelées métastases), on parle alors de cancer métastatique. Ces cancers sont traités avec des thérapies systémiques, qui contrôlent ou détruisent les cellules cancéreuses dans le flux sanguin. 48
52 La chimiothérapie est le traitement le plus utilisé pour les cancers du sein invasifs. Elle consiste à injecter, par voie orale ou intraveineuse, des substances chimiques qui enrayent ou ralentissent l'évolution des cellules tumorales. Il existe plusieurs types de chimiothérapie qui varient selon la patiente. La chimiothérapie est utilisée pour les cancers invasifs, mais aussi pour éviter les rechutes (traitement adjuvant) ou bien pour réduire la taille de la tumeur avant de l'enlever (traitement néoadjuvent) Diagnostic médical du cancer du sein Un cancer du sein est le plus souvent diagnostiqué à trois occasions. Une femme peut découvrir une boule ou une anomalie au niveau du sein (écoulement par le mamelon, mamelon rétracté, asymétrie ou ride), ou dans une aisselle. Il est important de consulter pour que le médecin réalise les examens nécessaires. Lors d'une consultation habituelle chez un médecin Il peut aussi être découvert, lors du dépistage La femme fait ensuite une mammographie: technique d'imagerie qui utilise des rayons X en très faible quantité. C'est une radiographie qui permet d'obtenir des images de la structure interne du sein. Elle se fait à l'aide d'un appareil particulier qui va "aplatir" le sein dans différents plans pour mieux l'analyser. Une mammographie détecte des anomalies de petites tailles, dont certaines seulement se révéleront être un cancer. Ces anomalies sont parfois détectées même si l'examen clinique est normal. Si une anomalie est découverte, le médecin prescrit alors des examens complémentaires afin de confirmer ou d'éliminer le diagnostic de cancer, de déterminer si les cellules cancéreuses se sont propagées ou non, et de choisir le traitement le mieux adapté. Les examens complémentaires sont variés comme La mammographie (des 2 seins) ou L'échographie mammaire ou le scanner ou l IRM ou la TEP. Dans ce cadre, certaines études montrent les potentialités d'une association de l imagerie médicale par émissions de positons et d'un traceur radioactif au glucose fluoré, le 18 F-FDG, dans l évaluation très précoce de l efficacité de la chimiothérapie des patientes traitées pour un cancer du sein. La TEP permet de visualiser en 3D l'activité d'un organe grâce aux émissions produites par les positons provenant de la désintégration d'un produit radioactif injecté au préalable. 49
53 Il s'agit donc d'une imagerie fonctionnelle qui permet de voir à la fois la morphologie des tumeurs et l activité des cellules tumorales. Dans le cancer du sein, traité par une chimiothérapie, l évaluation du traitement se fait en général après plusieurs cycles de chimiothérapie. Mais les études avancées montrent que l'imagerie par TEP associée à ce nouveau marqueur permet d évaluer très précocement, après une seule cure de chimiothérapie, la baisse d activité des cellules cancéreuses, ce qui constitue un gain de temps précieux pour le patient et les médecins. L'imagerie par TEP sera de plus en plus utilisée pour évaluer l efficacité d un traitement et plus seulement pour localiser une tumeur ou déceler des métastases. Conclusion Dans ce chapitre, nous avons réalisé un aperçu sur les différentes modalités de l imagerie médicale toute en s intéressant à l imagerie fonctionnelle TEP. La TEP en tant que modalité d'imagerie fonctionnelle permet de quantifier des processus physiologiques in vivo et de fournir des informations métaboliques précises. Ces informations sont accessibles par les médecins et peuvent être améliorées en utilisant des outils de traitement puissants que nous détaillons dans les chapitres suivants. 50
54 Chapitre II : Méthodes d analyse et de paramètrisation pour la modélisation et l extraction de la cinétique du traceur en imagerie TEP en vue d une caractérisation des tissus tumoraux Introduction Paramètres cliniques Estimation de l activité tumorale en imagerie TEP Modèle de Mullani : calcul du flux sanguin Principe de la quantification : détermination du paramètre SUV Les limites du calcul du débit sanguin et du SUV max Méthodologie d analyse des séquences d images dynamiques TEP Méthodologie d analyse des séquences d images dynamiques TEP basée sur l analyse factorielle Méthodes d analyse de séquences d images fonctionnelles Travaux de recherche utilisant l analyse factorielle Méthodologie d analyse des séquences d images dynamiques TEP basée sur la comparaison locale Objectif Approches de segmentation automatiques Approches de comparaison locale Travaux de recherche utilisant la mesure de dissimilarité locale Conclusion
55 Introduction L interprétation visuelle d une séquence d images fonctionnelles est longue, fastidieuse, subjective et souffre de la variabilité intra et inter observateur. D où la nécessité des méthodes d analyse qui visent à extraire des paramètres quantitatifs pour l extraction et la modélisation de la cinétique du traceur en imagerie TEP caractérisant les tissus tumoraux et assurant ainsi une analyse objective et uniforme facilitant par conséquent le suivi thérapeutique. Les méthodes d analyse menant à son interprétation sont diverses à savoir la méthode d estimation de région d intérêt et l analyse factorielle. Durant ce chapitre, nous allons détailler les paramètres cliniques accessibles par les médecins en imagerie TEP comme le métabolisme glucidique et le flux sanguin ainsi que leurs performances et leurs limites. Dans le but de l extraction et la modélisation de la cinétique du traceur en imagerie TEP, ce chapitre expose les méthodes d analyse de séquences d images fonctionnelles tels que la méthode d imagerie paramétrique, l analyse compartimentale et principalement l'analyse factorielle ainsi que les travaux de recherche utilisant l analyse factorielle (AF). De plus, nous montrons la relation de la méthode d analyse de séquences d images fonctionnelles avec la méthode d estimation de la région d intérêt (ROI). En effet, la détermination manuelle de la ROI peut être effectuée d une manière automatisée et peut être améliorée en utilisant des outils de traitement puissants basés sur des approches de comparaison locale d images, comme la différence pixel par pixel, (DPP), l indice de similarité structurelle (SSIM) et une extension proposée de la carte des dissimilarités locales (CDL) des images à valeurs réelles en niveaux de gris ainsi que les travaux de recherche utilisant la mesure de dissimilarité locale. 1. Paramètres cliniques Différentes études cliniques ont été proposées pour la caractérisation du cancer du sein. Nous citons quelques paramètres en imagerie TEP au 18 F-FDG, particulièrement le calcul du flux sanguin BF (BF en anglais Blood Flow) et la quantification SUV (SUV en anglais pour Standardized Uptake Value). Un exemple de technique est proposé en imagerie de perfusion tumorale basée sur la mesure de la coloration immunohistochimique de l'angiogenèse avec deux anticorps anti-cd34 et CD105 utilisés pour évaluer la vascularisation tumorale [101]. CD34 est un marqueur panendothelia qui reflète le degré de vascularisation, alors que CD105 est un marqueur 52
56 endothélial lié à la prolifération [108]. Le métabolisme tumoral semble être plus associé avec des marqueurs de prolifération, comme ki Estimation de l activité tumorale en imagerie TEP Les images TEP au 18 F-FDG sont considérées comme l étalon pour l'évaluation in vivo du métabolisme du glucose dans la tumeur. Elles sont largement utilisées dans les explorations cliniques d'oncologie. Les tumeurs malignes sont généralement associées à un accroissement du flux sanguin BF et du métabolisme cellulaire SUV qui est l indice le plus fréquemment utilisé pour la caractérisation de la fixation du 18 F-FDG en imagerie TEP. Ces deux paramètres sont accessibles par les médecins en imagerie par émission de positons. Dans les cancers du sein localement avancé, l augmentation du métabolisme glucidique ou un déséquilibre entre le métabolisme glucidique et le flux sanguin permet de prédire une mauvaise réponse à la chimiothérapie néoadjuvante Modèle de Mullani : calcul du flux sanguin Un exemple est le modèle du premier passage de «Mullani». Il est conçu pour extraire une mesure de la perfusion tumorale pendant le premier passage du traceur 18 F-FDG dans le tissu tumoral manuellement segmenté. L'analyse de la fixation du glucose 18 F-FDG pendant son premier passage [71], [77], c est-à-dire après deux minutes de son injection (à partir des images TEP précoces), est utilisée pour calculer le flux sanguin «BF». Son calcul est basé sur l'hypothèse selon laquelle durant le premier passage d un bolus d'activité à travers l'organe (à l instant tm), il existe une durée où le traceur reste dans la région de la tumeur, de telle sorte que la concentration veineuse du traceur est nulle [71], [77]. L équation du flux est définie comme suit [28]: BF ( t m tt1 Q( tm), C ( t). t) a (1) où Q(tm) est la concentration du traceur dans la tumeur à l instant tm et Ca(t) est la concentration artérielle du traceur de l instant t1 à l instant tm. Le BF est donc une quantité sans dimension. 53
57 Principe de la quantification : détermination du paramètre SUV Il existe plusieurs facteurs physiques dégradant la qualité d images en TEP. L atténuation, les coïncidences diffusées et la variation de réponse des détecteurs sont les principales sources de bruit dans l image et produisent des erreurs de quantification. La quantification en imagerie TEP [27] consiste à extraire, à partir d un tissu d intérêt d une image TEP, une mesure exacte ou relative de la concentration radioactive au sein d une tumeur. En pratique, la connaissance précise de la quantité du traceur fixée par la zone tumorale doit permettre de fournir des indications quantitatives sur l'évolution métabolique de la lésion durant le traitement. Cela permet de faciliter la caractérisation d'une anomalie par une valeur chiffrée et également pour le suivi des patients durant la thérapie. Dans ce but, les différents phénomènes physiques décrits dans le chapitre précédent doivent être parfaitement corrigés afin d'obtenir une information réellement représentative de la distribution du traceur dans l'organisme. Dans la définition classique de SUV, le calcul de la valeur de fixation normalisée, SUV est calculée selon la formule suivante [27] : SUV activité Image[ Bq / ml] [ Bq]/ volume patient patient, [ ml] (2) où Image est la région d intérêt tumorale, l activité est la concentration radioactive qui tient compte de l'activité injectée et volume est le volume du patient. Par simplification, le volume du patient est généralement assimilé à sa masse, en supposant une densité moyenne de 1 g/ml. Une valeur de SUV égale à 1 signifie que l'activité mesurée dans une région d'intérêt est identique à la dilution volumique uniforme de l'activité injectée au patient. En pratique clinique, on utilise la concentration radioactive qui tient compte de l'activité injectée au poids du patient. Le paramètre SUV est calculé dans un tissu d intérêt selon cette équation [27] : fixation dans la région d'intérêt [ Bq / ml] SUV. (3) dose injectée[ Bq]/ poids [ g] Le SUV est donc une quantité sans dimension. L'hypothèse selon laquelle le volume du patient équivaut au poids est une des limites de la validité du paramètre SUV. La mesure de la valeur SUV d'une lésion permet de disposer d'une information quantitative qui peut être utilisée pour évaluer la réponse thérapeutique. 54
58 Le paramètre SUVmax Le paramètre clinique SUVmax permet de quantifier la fixation du radiotraceur dans la tumeur. Ce paramètre est utilisé en routine clinique. L avantage de cette mesure est d être indépendant de l opérateur. Le calcul du SUVmax nécessite la définition d une région d intérêt, dans laquelle une valeur moyenne de SUVmax est estimée à partir des voxels inclus dans ces régions [35] Les limites du calcul du débit sanguin et du SUVmax Parmi les résultats cliniques, les tumeurs malignes sont généralement associées à un accroissement du flux sanguin et une augmentation notable du métabolisme glucidique. Le calcul du flux ne possède pas jusqu à ce moment un modèle de référence. La faible qualité des images d'émission (liée notamment au bruit, les effets de volume partiels ainsi que variabilité des protocoles d'acquisition et de reconstruction des images et le grand nombre de procédures proposées pour définir les volumes) en sont la cause. Cela motive de nombreuses recherches visant à développer encore une méthode plus précise et fiable. L évaluation du métabolisme glucidique (SUVmax) [13] est souvent déterminée à partir d images tardives (après 90 minutes de l injection du traceur 18 F-FDG) dans un mélange de compartiments vasculaire et tumoral. Cette détermination est longue, fastidieuse et n est pas précise. La normalisation de la fixation tumorale du traceur 18 F-FDG par la quantité de 18 F-FDG disponible à la tumeur estimée comme étant le rapport entre dose injectée et poids est grossière. D autres normalisations plus sophistiquées, mais empiriques, ont été proposées. Des études suggèrent cependant que l impact de cette normalisation est modeste. Il a été rapporté que la prise en compte du taux de glucose sanguin est le facteur qui affecte le plus les valeurs de SUVmax. Enfin, la constante localisée, qui rend compte des différences entre le métabolisme du glucose et le métabolisme du 18 F-FDG est totalement ignorée dans l expression du SUVmax. Ces propriétés peuvent être exploitées cliniquement à l'aide d outils de traitement efficaces et sophistiqués appliqués à la modalité d imagerie TEP telles que la méthode d analyse basée sur l analyse factorielle et la méthode d analyse basée sur la comparaison locale [18]. 55
59 2. Méthodologie d analyse des séquences d images dynamiques TEP En médecine nucléaire, la TEP est considérée comme un outil très utile et efficace, largement exploité dans les explorations en oncologie. Les séquences d'images TEP peuvent fournir des informations importantes pour le suivi des patients pendant le traitement. Afin d automatiser les tâches, plusieurs approches ont été proposées pour le traitement des diverses modalités fonctionnelles. En fait, parmi les tâches cliniques, il existe des tâches manuelles qui sont longues et non efficaces pour un diagnostic précis. Ces tâches manuelles peuvent être effectuées efficacement d une manière automatisée, et peuvent être améliorées en utilisant des outils de traitement puissants Méthodologie d analyse des séquences d images dynamiques TEP basée sur l analyse factorielle Plusieurs méthodes de traitement pour l analyse des images ont été proposées dans la littérature pour l'aide au diagnostic afin d identifier les maladies [4], [9], [38], [76] et [88]. Parmi ces méthodes, l'analyse factorielle (AF) présente un intérêt particulier dans les études cliniques étant donné une méthode de séparation de sources pour évaluer certaines fonctions physiologiques. Dans [119], l AF a été utilisée pour analyser une séquence dynamique d'images médicales obtenues par la modalité d'imagerie nucléaire, les images TEP Méthodes d analyse de séquences d images fonctionnelles La radiothérapie et le suivi des patients pendant et après traitement sont l une des applications bénéficiant des séquences d images fonctionnelles. Pour un examen, nous pouvons avoir plusieurs centaines d images (figure 19). Les méthodes d analyse sont alors nécessaires pour extraire efficacement l information pertinente des images sous forme synthétique et faciliter son stockage. 56
60 Volume d images y z x Figure 19. Quantité de données pour un seul examen t Nous prenons comme exemple (figure 20), un examen TEP dynamique cérébral. Cet examen nécessite 61 coupes, de taille 128*128 chacune, et 40 points de temps (figure 21), ce qui donne 2440 images. D où une capacité de stockage de données presque égale à 40 M Octets. Figure 20. Exemple d un examen TEP avec 61 coupes pour un seul point temps [111] Figure points temps pour chaque coupe [111] 57
61 Parmi les méthodes de traitement de l analyse de séquences d images dans les études métaboliques pour l extraction et la modélisation de la cinétique du traceur, nous trouvons principalement l analyse factorielle (AF) et la méthode des régions d intérêt. Analyse factorielle L analyse factorielle (AF) a été introduite dans les années quatre-vingt en médecine nucléaire comme un outil pour résumer l'information pertinente qui sous-tend une dynamique spectrale ou des séquences d'images en quelques images et des courbes associées, appelées facteurs. Principe théorique de l analyse factorielle L AF des séquences d images dynamiques est une méthode d analyse qui résume le contenu d une séquence d images indexées par le temps en un petit nombre d images et de courbes associées. Chaque image correspond à une composante, représentant un compartiment physiologique, dans lequel le signal change d une manière caractéristique au cours du temps. La courbe associée est l évolution du signal au cours du temps dans le compartiment (figure 22) [46], [1], [119], [21], [47]. K images factorielles et facteurs associés temps y Analyse Factorielle Signal Signal Signal x Séquence d images dynamiques Temps Temps Temps Figure 22. Représentation synthétique du contenu d une séquence d image [111] 58
62 cavité droite cavité gauche myocarde temps y Analyse Factorielle x TEP cardiaque à Signal Signal Signal l H2O-15 Temps Temps Temps Figure 23. Représentation concrète du contenu d une séquence d images [111] Pour illustrer la représentation synthétique d une séquence d images (Figure 22), nous considérons l exemple d une séquence d images TEP cardiaque à l eau marquée (Figure 23). A partir de la séquence d images initiale, l analyse factorielle extrait trois composantes. La première correspond au ventricule droit, et la cinétique du traceur est donnée par la courbe associée. Le second compartiment correspond au ventricule gauche, dans lequel le traceur arrive un peu plus tardivement puis est évacué. Enfin, le troisième compartiment correspond au tissu myocardique, dans lequel le traceur s accumule. Ainsi, la séquence d images originale est résumée par ces trois images et les trois courbes associées. Cette représentation permet de déterminer le recouvrement partiel des compartiments physiologiques. Modèle résolu par l analyse factorielle temps y Modèle de l Analyse Factorielle xi(t) ak(i)fk(t) ε i(t) k Pixel x Signal i = Signal a 1 (i) Signal + + a 2 (i) a 3 Signal (i) Temps Temps Temps Temps Figure 24. Modèle résolu par l analyse factorielle [111] 59
63 Le modèle utilisé pour réaliser la décomposition opérée par l analyse factorielle est un modèle de superposition linéaire (figure 24). La cinétique enregistrée dans chaque pixel s exprime comme une combinaison linéaire d un petit nombre de cinétiques dites «fondamentales», qui auront une interprétation physiologique. Pour le pixel considéré, le coefficient associé à chacune de ces cinétiques fondamentales correspond à la proportion du signal, dans le pixel, qui suit la cinétique fondamentale. L image de ces coefficients ou poids donne l image du compartiment présentant la cinétique fondamentale décrite par la courbe. Un point très important est que le modèle suppose ces cinétiques fondamentales communes à l ensemble des pixels. Autrement dit, les cinétiques enregistrées dans chaque pixel sont supposées pouvoir s exprimer comme une combinaison linéaire des cinétiques fondamentales, avec des poids qui varient d un pixel à l autre. Les cinétiques fondamentales sont estimées par ce que nous définissons comme étant les «facteurs», tandis que les images associées sont appelées «images factorielles» [4], [22], [55], [47]. L analyse factorielle permet d introduire des connaissances a priori sur les caractéristiques des courbes physiologiques ou des compartiments physiologiques recherchés. Ces a priori peuvent être le nombre approximatif de compartiments physiologiques et la positivité des facteurs sur chaque compartiment [120], [46]. Enfin, l analyse factorielle peut fréquemment être mise en œuvre à des fins exploratoires, pour révéler les cinétiques et les compartiments sous-tendant une séquence d images, lorsqu il est difficile de les identifier visuellement. En ce sens, elle peut être une première étape d analyse de séquences d images, orientant vers une méthode d analyse de la séquence plus appropriée [19]. Evolution de l analyse factorielle La méthode d analyse factorielle a été mise au point un peu plus de 20 ans, conjointement par l équipe de Di Paola à Villejuif en France et par l équipe de Barber à Sheffield en Angleterre. Pourtant cette méthode n a jamais réellement réussi à s imposer et à obtenir la notoriété qu elle mérite certainement, de par sa puissance en tant que technique exploratoire d analyse et la grande variété des applications pour lesquelles elle peut être utile. Ceci s explique en partie par un certain nombre de limites dont souffrait la méthode à ces débuts. Il est donc intéressant de répertorier les évolutions qu a connues l analyse factorielle depuis les premiers travaux des années 80 [111]. Initialement, la méthode a été proposée pour traiter des séquences d images en médecine nucléaire planaire, et en particulier des examens dynamiques de médecine nucléaire. Les 60
64 séquences d images traitées étaient donc tridimensionnelles, avec deux dimensions spatiales et une dimension temporelle. En outre, il a été montré que l analyse factorielle n était pas utile uniquement en médecine nucléaire, mais pouvait aussi résoudre des problèmes en tomodensitométrie dynamique ou en IRM fonctionnelle par exemple. La méthode continue bien sûr d être appliquée en médecine nucléaire, mais maintenant sur des données tomographiques TEP. Pour utiliser l analyse factorielle à bon escient, il est important de bien en comprendre un certain nombre d indications permettant de déterminer quand il est a priori pertinent de faire appel à l analyse factorielle. Tout d abord, il faut bien comprendre que l analyse factorielle n a de sens, en général, que si chaque pixel correspond toujours à la même région anatomique dans une image. Pour mieux comprendre l'importance de l analyse factorielle, nous essayons d analyser ses spécificités par rapport à la méthode bien connue des régions d intérêt (ROI). Lorsque le médecin trace une région d intérêt sur une image et qu il regarde l évolution du signal dans cette région au cours du temps, il obtient une courbe. L analyse factorielle permet de savoir si cette courbe résulte en fait d un mélange de courbes «fondamentales», ou «pures», ayant chacune une interprétation physiologique. La méthode de l analyse factorielle appliquée sur une ROI correspond donc à une analyse locale exploratoire. Elle s oppose ainsi à l analyse factorielle, qui permet une analyse globale de toute l image. Etant donné une séquence d images fonctionnelles, une région d intérêt (ROI) est définie sur chacune des images. Le but de cette méthode est d estimer la variation du signal moyen de la région d intérêt en fonction du temps (ce qui correspond dans notre étude à la cinétique du traceur dans le tissu tumoral en imagerie TEP). Ce signal moyen est défini comme étant la moyenne des valeurs des pixels de la région d intérêt (figure 25 et 26). En effet, le médecin trace sur l image TEP une région d intérêt autour de la région cible puis il calcule l activité que l on normalise en divisant par l activité injectée rapportée à la masse du patient [93]. T1 T2 T3 T4 Figure 25. Exemple de tracé d une région d intérêt [111] 61
65 Coupe T3 Coupe T4 t Figure 26. Valeur moyenne dans la région en fonction du temps [111] t Analyse compartimentale L analyse compartimentale vise à expliquer les variations temporelles de concentration ou de quantité d élément radioactif dans un volume de tissu à partir d'un modèle décrivant les échanges entre plusieurs compartiments considérés. Cette modélisation impose une description a priori de ce qui se passe dans un volume de tissu. Le choix du modèle et du nombre de paramètres à prendre en compte est lié à la nature des éléments radioactifs utilisés [20]. Dans ce contexte, nous pouvons citer le modèle de Mullani que nous avons détaillé dans la section précédente pour mieux comprendre la modélisation compartimentale. L analyse compartimentale se base sur une représentation simplifiée d un système biologique au moyen d un ensemble de compartiments présentant des interactions (Figure 27). Cette analyse utilise une formulation des échanges entre les compartiments au moyen d équations différentielles [80]. dc p K dt el. C Puis, elle procède à la résolution de ces systèmes d équations différentielles pour l estimation de paramètres ayant une interprétation biologique [80]. p. (4) C t p C exp( K 0 p el. y). (5) Figure 27. Représentation simplifiée d un système biologique [111] 62
66 Notion de compartiment Les compartiments représentent des volumes de distribution de l élément radioactif, ayant les mêmes propriétés dynamiques au sein de la région étudiée. Dans la pratique, ils ne représentent pas nécessairement un ensemble continu et homogène mais sont modélisés par des volumes continus et homogènes ayant globalement le même comportement. Les compartiments sont donc des volumes virtuels ou apparents. La répartition de l élément radioactif au sein de chaque compartiment à un temps donné est supposée homogène. A titre d exemple, le compartiment vasculaire représente l'ensemble de l'espace constitué par les micro-vaisseaux contenant le sang. Le compartiment interstitiel (ou interstitium) et le compartiment cellulaire sont distingués. Le compartiment interstitiel représente l'espace intercellulaire où s effectuent les échanges de molécules. Et le compartiment cellulaire représente l'ensemble des cellules du tissu [86]. Imagerie paramétrique L imagerie paramétrique est une technique permettant de résumer la séquence d images fonctionnelles en un ensemble d images paramétriques. Elle se base sur l approche pixel et utilise un modèle mathématique qui s applique à chaque décours temporel. Approche pixel Cette approche considère chaque pixel comme étant une région d'intérêt ayant un décours temporel Ck(t) qui représente la variation du signal en fonction du temps (figure 28). Le nombre k est égal à N² si l'échantillonnage spatial est N x N. Ceci conduit à N² fonctions Ck(t). Les méthodes d'imagerie paramétrique consistent à extraire de chacune de ces fonctions un ou plusieurs paramètres permettant d'établir une ou plusieurs images dites images paramétriques, pour résumer l'ensemble des k courbes. Temps Figure 28. Un décours temporel : évolution du signal dans un pixel 63
67 Le fait que ces paramètres puissent être considérés comme «fonctionnels» a amené à utiliser abusivement le vocable «d imagerie fonctionnelle» pour les images ainsi obtenues. Tous les domaines de l imagerie médicale permettent d obtenir des images telles que l IRM [20], [39] ou la tomodensitométrie dynamique [64], [39] et la médecine nucléaire comme la TEP [14], [39]. Le calcul des images paramétriques suppose que les pixels correspondant à la même distribution sous jacente fournissent les mêmes fonctions physiologiques estimées et donc les mêmes valeurs des paramètres, puisqu'à l'évidence il ne peut y avoir autant de fonctions que de pixels. Il existe un nombre important de cas où il est possible d'introduire des connaissances supplémentaires concernant le modèle sous jacent et, notamment de donner aux fonctions physiologiques cherchées une formulation mathématique qui ne concernera pas tous les pharmacocinéticiens. C est ce qu on appelle le modèle structural [22], [39]. Les images paramétriques sont généralement très bruitées. Le modèle utilisé est souvent restrictif [39]. À la différence de l'approche pixel, l approche AF analyse simultanément l ensemble des N courbes temporelles associées aux N pixels. Elle n impose pas un modèle cinétique a priori mais elle estime les images et les cinétiques représentatives, du contenu de la séquence d images à partir des données. Analyse de Fourier L analyse de Fourier est une transformation mathématique qui connaît des applications dans tous les domaines de l'imagerie médicale. Elle est largement développée en angiocardiographie nucléaire pour des études à l'équilibre et synchronisées à l'électrocardiogramme [10], [39]. Le principe de l analyse de Fourier est d ajuster chaque décours temporel par une fonction sinusoïdale caractérisée par deux paramètres : amplitude et phase (figure 29). Ceci revient à décomposer chaque courbe en une série de cosinus et de sinus. y t Ai, Φi x Aj, Φj Figure 29. Ajustement sinusoïdal des décours temporels 64
68 Les images paramétriques sont en fait, les représentations de l image d amplitude et l image de phase. L'image d amplitude traduit l'importance des variations de la fonction. L'image de phase est puissante pour la visualisation des anomalies de contraction au moyen d une échelle de couleur adaptée [39]. Figure 30. Exemple d analyse de phase en imagerie cardiaque [111] Comparons l analyse factorielle à l imagerie paramétrique, autre technique utilisée pour analyser des séquences d images dynamiques. En imagerie paramétrique, [39] suppose un modèle relativement précis sur les fonctions physiologiques. Nous procédons ensuite à l ajustement des données au modèle, pour déterminer la contribution des différents pixels aux différentes cinétiques décrites par le modèle. Cette approche est donc entièrement conditionnée par le modèle : si le modèle est erroné, les images seront biaisées. En analyse factorielle, nous utilisons également un modèle de superposition linéaire, mais celui-ci ne nécessite pas forcément d avoir des connaissances a priori fortes sur les cinétiques ou les compartiments sous-jacents au modèle. Le modèle sert à guider l analyse, mais sa résolution ne requiert pas d a priori aussi fort qu en imagerie paramétrique. En ce sens, l analyse factorielle reste une technique exploratoire, contrairement à l imagerie paramétrique. Comme l imagerie paramétrique, l analyse factorielle traite toute l image et non pas une région comme l approche par ROI. Comme en imagerie paramétrique, l approche AF permet d introduire des connaissances a priori sur les caractéristiques des courbes physiologiques ou des compartiments physiologiques recherchés. Ces a priori peuvent cependant être relativement flous, et ne 65
69 dictent pas totalement le résultat de l analyse factorielle, contrairement à l imagerie paramétrique où les a priori doivent être précis et conditionnent directement la fiabilité des résultats. L analyse factorielle fournit en outre des index caractérisant l adéquation des données au modèle, qui permettent d avoir des indications sur la qualité des résultats Travaux de recherche utilisant l analyse factorielle L analyse factorielle est, de nos jours, puissante et utile dans plusieurs applications et travaux de recherche. Quelques exemples d applications vont être présentés dans la suite, ainsi qu une liste de références bibliographiques relatives aux différentes applications. Exemples d études dynamiques La figure 31 montre un exemple d analyse factorielle en imagerie cardiaque dont le but est d analyser le mouvement de la paroi ventriculaire gauche et de détecter les régions présentant des défauts de mouvement. Ce type d analyse se réalise à partir d une séquence d images synchronisées à l électrocardiogramme et permet d obtenir l image des régions statiques et l image des régions en mouvement. Cette approche permet donc, d obtenir simultanément l image du métabolisme du glucose et l image paramétrique décrivant les régions en mouvement. L analyse produit, alors, une fusion des informations métaboliques et fonctionnelles [111]. Série d images originale Temps Cinétique dans une région statique Temps Cinétique dans une région en mouvement Métabolisme FDG diminué akinésie Région statique (Perfusion) Région en mouvement (fonction) Image perfusion / fonction Cinétique normale Métabolisme FDG normal Hypokinésie Figure 31. Examen cardiaque TEP-FDG synchronisé à l ECG (analyse factorielle pour l analyse de mouvement) [111] 66
70 La figure 32 illustre un exemple en oncologie scintigraphique, où l analyse factorielle a servi pour caractériser la réponse à une chimiothérapie. L idée était d étudier l évolution de la dynamique du radiotraceur après chimiothérapie. D où une fonction vasculaire, et une fonction décrivant la cinétique du traceur dans la tumeur ont été estimées. Dans cet exemple, il apparaît qu après chimiothérapie, l étendue du compartiment associé à la fonction décrivant la réponse tumorale a régressé. Cette régression correspond à une bonne réponse à la chimiothérapie [111]. Avant chimio Après chimio Facteur vasculaire Fixation non spécifique Série d images originale Facteur tumoral Figure 32. Etude Oncologique : ostéosarcome en imagerie planaire (analyse factorielle pour caractériser la réponse à une chimiothérapie) [111] Voici maintenant un exemple de scintigraphie planaire hépatique (figure 33), où l analyse factorielle met en évidence le dysfonctionnement d une partie du foie en estimant les cinétiques caractéristiques du passage du traceur dans le foie puis de son élimination. Série d images originales Figure 33. Examen hépatique en scintigraphie planaire (analyse factorielle pour détecter le disfonctionnement d un organe) [111] 67
71 Nous passons à une étude cardiaque en IRM (figure 34), avec un produit de contraste (Gd- DTPA-BMA). Cette analyse permet d estimer trois compartiments et leurs cinétiques associées : ventricule droit, ventricule gauche, et myocarde. F.Rrouin,U 494 INSERM,Paris, Dr.D.Revel et M.Janier,Lyon AF Ventricule droit Ventricule gauche myocarde Figure 34. Analyse factorielle d une séquence d images IRM cardiaque avec produit de contraste [111] Enfin, un dernier exemple concerne une analyse réalisée en IRM fonctionnelle pour les études d activation cérébrale (figure 35). Dans ce cas, l analyse factorielle sert à détecter les signaux d activation cérébrale liés à la réalisation d un certain paradigme et étudier le signal hémodynamique dans les différentes régions. Les études réalisées sont systématiquement 4D. Tout un volume de coupes cérébrales est alors, analysé simultanément. H.Benali, U494 INSERM, Paris AF Figure 35. Analyse factorielle appliquée à l imagerie de l IRM fonctionnelle [111] Logiciel «Pixies» pour l analyse factorielle Concernant la disponibilité de la méthode, c est seulement depuis quelques années que la méthode est accessible à tous, via un logiciel développé (figure 36) par une petite société, la société Apteryx, en collaboration avec l Unité 494 INSERM, et mis à disposition sur Internet. Ce logiciel, dans sa version gratuite, permet de tester l analyse factorielle sur ses propres données. Il existe également en versions payantes avec des fonctionnalités étendues. Il est 68
72 ergonomique, rapide, et tourne sur PC et Mac OS 10, ce qui permet à des non-spécialistes de mettre en œuvre la méthode [1]. Description de l interface Figure 36. Interface du logiciel Pixies [1] Outils de visualisation o Menu Analyse factorielle Le logiciel «Pixies» contient plusieurs outils de visualisation. Pour plus de détails, voir l annexe 1. Le principal outil de visualisation est le menu de l analyse factorielle qui permet d appliquer tout l algorithme de l analyse factorielle à la séquence d images. Le résultat est présenté sous la forme d'images factorielles et de courbes associées (figure 37). Les images factorielles sont représentées en niveaux de gris pour les valeurs positives, et en niveaux de bleu pour les valeurs négatives. Pour analyser de manière plus pratique les localisations spatiales des facteurs, le logiciel «Pixies» propose un mode multichrome, superposant les images factorielles et les courbes en différentes couleurs (figure 38). Chaque image factorielle en niveaux de gris est affectée d une couleur qui est également employée pour tracer la courbe factorielle associée. Il est à noter que seules les valeurs positives des images sont affichées dans ce mode. La superposition des images factorielles colorées permet alors d apprécier la répartition spatiale des facteurs les uns par rapport aux autres et la superposition des courbes permet de mieux apprécier leur position relative dans le temps. L échelle temporelle affichée par Pixies pour les courbes correspond aux indices des images. Les étapes de l approche de l analyse factorielle dans ce logiciel sont décrites dans l annexe 2. 69
73 Figure 37. Résultat de l application de l'af sur une séquence d images rénales Figure 38. Résultat de l application de l'af sur une séquence d images rénales (mode multichrome) o Menu Régions Si nous voulons afficher la courbe moyenne associée aux pixels d'une région d'intérêt (figure 39), nous sélectionnons "Dessiner" dans le menu "Régions". Et nous choisissons la forme de la région que nous souhaitons dessiner. Une fois que la région est dessinée, nous sélectionnons le curseur "Exploration" et nous cliquons dans la région. La courbe affichée est la courbe moyenne dans la région. En laissant appuyer le bouton et en déplaçant la souris, nous pouvons visualiser la courbe moyenne pour différentes positions de la région. 70
74 Figure 39. Résultat de l application d une région d intérêt sur une séquence d images rénales et visualisation de la courbe moyenne associée [1] Figure 40. Résultat de l application de l'analyse factorielle sur une région d intérêt: Affichage multi chrome [1] 2.2. Méthodologie d analyse des séquences d images dynamiques TEP basée sur la comparaison locale Objectif Il n existe pas actuellement de consensus sur la meilleure méthode de mesurer l activité tumorale, et sur la région d intérêt pour accomplir cette mesure particulièrement. L approche classique et la plus intuitive en routine clinique repose sur une segmentation manuelle des tumeurs [18]. Cette approche est longue et fastidieuse [74], [75]. 71
75 La segmentation d images est une étape incontournable dans tout processus d analyse d image. Elle constitue un premier pas vers son interprétation. Elle revient à partitionner l image en régions connexes et homogènes au sens d un critère d homogénéité. L objectif essentiel de la segmentation est la détermination précise de la forme et du volume d une lésion. Différentes méthodes automatiques ont été proposées pour déterminer un volume d intérêt en images fonctionnelles. Les méthodes semi-automatiques les plus utilisées sont basées sur des seuillages. D autres approches se basent sur la détection d objets d intérêt, comme les contours actifs, le fuzzy C-Mean ou les watersheds Approches de segmentation automatiques L'idée repose sur l'utilisation d'une forme (une courbe, une surface, un volume) a priori et initialisée suffisamment proche de la forme désirée, puis de la faire évoluer itérativement vers le résultat le plus proche possible de l'objet recherché dans l'image [48]. Les modèles déformables forment une famille de plusieurs méthodes plus ou moins complexes [37]. Nous pouvons citer le modèle des contours actifs «snakes» [31], [34], [62] ou les fronts de propagation «Level Set», une méthode plus évoluée [51], [26]. Cependant, l initialisation présente l inconvénient principal pour la méthode du contour actif [3]. En effet, l inconvénient principal de cette méthode est qu elle reste relativement sensible à leur initialisation pouvant provoquer des chutes dans des minima. De plus, leur convergence vers la forme finale peut être relativement lente. Un modèle plus évolué est le front de propagation «Level-set» [26]. Ce modèle de «levelset» se présente sous la forme d'une courbe lisse, continue et fermée [26] dont l'initialisation est située à la proximité extérieure du contour que nous voulons obtenir et dont l'évolution s'effectue selon un processus itératif de déformation contrôlé par un test de convergence. L'avantage de cette méthode est que les changements topologiques tels que la fusion et la scission du contour ou de la surface sont prises en compte implicitement. Ce modèle est largement utilisé en segmentation d'images TEP pour leur capacité à intégrer les processus de détection et de chaînage des contours en un seul processus de minimisation d'énergie. Cependant, la dépendance à la partie clinique pour l initiation du contour présente l inconvénient principal pour la méthode «Level set». En effet, les performances de ces algorithmes sont souvent sensibles aux variations de l intensité du bruit ou aux changements de contraste dans les images. Elles sont de plus généralement, dépendantes d initialisations et de pré- ou post-traitements gérés par l utilisateur, ainsi que d informations a priori supplémentaires [50]. 72
76 Certaines approches de la détection des changements dans l organisation spatiale entre deux images pour estimer les régions d intérêt afin de calculer l activité du traceur dans la tumeur sont présentées ici. Nous rappelons tout d abord la Différence Pixel à Pixel (DPP) et de l Indice de Similarité Structurelle (SSIM). La Différence Pixel à Pixel est une mesure classique et simple, avec des mesures locales bien définies. SSIM est un bon exemple d une mesure locale, construit à partir d une approche globale, localement limitée. Puis, une définition d une Carte des Dissimilarités Locales (CDL) sur des images en niveaux de gris est proposée. La CDL fournit des mesures locales bien définie et efficace Approches de comparaison locale Différence pixel par pixel Une comparaison locale très simple est donnée par les valeurs données par le calcul de la différence pixel à pixel (DPP). Pour deux images F et G, la DPP est donnée par : DPP F G ( p) G( p) F(, p ), (6) où p = (x, y) désigne la position d un pixel. Les valeurs locales ne sont calculées qu à partir des intensités des pixels, ce qui est une information pauvre. Mais cependant, les mesures sont localement bien définies. Une mesure globale peut être obtenue en sommant les valeurs de la DPP, fournissant l erreur moyenne absolue, l erreur quadratique moyenne ou le rapport signal sur bruit. Le principal inconvénient de la DPP est l absence de monotonie par rapport à la translation. La différence risque de donner des valeurs très importantes alors que l écart entre les deux images est faible (par exemple un décalage d un seul pixel). Approche SSIM L indice de similarité structurelle (SSIM) est une comparaison plus sophistiquée [105]. Il s agit d une mesure globale. Elle est basée sur l hypothèse que le système visuel humain est très adapté pour extraire les structures des objets dans une scène. La SSIM est donc basée sur la dégradation des informations structurelles. L'indice SSIM est une référence complètement métrique, elle a besoin d'une image de référence afin de mesurer la qualité d'image. La SSIM entre deux images F et G est donnée par : (2F G C1)(2 FG C2) SSIM( F, G) ( C )( C F G 1 F G 2, ) (7) 73
77 où µf (resp. µg) est l intensité moyenne de F (resp. de G), F (resp. G ) est l ecart type des intensités de F (resp. de G), et FG est la covariance entre les valeurs de F et G. C1 et C2 sont deux faibles constantes positives, nécessaires pour stabiliser la division. C1 = (k1d) 2 ;C2 = (k2d) 2, d étant la dynamique des valeurs de pixel, k1 =0:01 et k2 = 0:03 par défaut [105]. Ces quantités sont calculées avec la manière suivante: F m n mn r0 c0 F( r, c), (8) 2 F m n mn r0 c0 ( F( r, c) ) F 2, (9) FG mn m 1 n 1 1 r0 c0 ( F( r, c) )( G( r, c) ). F G (10) Comme pour d autres mesures globales, si une mesure locale est nécessaire, la SSIM peut être calculée dans une fenêtre locale glissante. Typiquement µf, F, et FG sont calculés dans une fenêtre glissante carrée de taille 8x8 (avec un lissage gaussien), qui se déplace pixel par pixel sur l image entière. Nous obtenons ainsi une carte SSIM, fournissant des informations locales sur la similarité structurelle entre les deux images. Une mesure globale peut être calculée à partir des valeurs moyennes de cette carte SSIM. Le choix du rayon de la fenêtre est décisif. F de petit rayon est limitée dans sa capacité à prendre en compte les grosses structures des images. F trop grande entraine un lissage des structures et ne permettra pas de prendre en compte les petites structures. Un autre aspect est la cohérence de la mesure locale. Avec un trop petit rayon, les statistiques locales peuvent être mal définies, conduisant à des valeurs de similarités non fiables. Ces deux inconvénients sont fréquemment observés quand une mesure globale est contrainte à être locale. Dissimilarités locales sur des images en niveaux de gris Dans des travaux antérieurs, certains chercheurs ont proposé de comparer localement des images binaires avec une mesure bien définie, obtenue à partir de la Distance de Hausdorff (DH) [8]. Le noyau principal de la CDL est de calculer la Distance de Hausdorff modifiée entre les images avec une fenêtre auto-adaptative. En pratique, la CDL est efficacement calculée grâce aux Transformées en Distance (TeD). 74
78 Pour des images binaires Les dissimilarités locales peuvent s interpréter comme des distances de Hausdorff [6], calculées dans des fenêtres de taille adaptative (voir [8] pour plus de détails). La taille des fenêtres est déterminée à partir du contenu local des deux images. La distance de Hausdorff définie entre deux ensembles (ici des images binaires), a plusieurs bonnes propriétés [59]. Localement, ces distances sont proportionnelles à la translation. Les principaux inconvénients de la DH est sa sensibilité aux points aberrants. Mais ces inconvénients sont réduits avec la CDL, puisque seules les fenêtres locales sont considérées. L'algorithme initial qui calcule la CDL est itératif et assez lent. La carte des dissimilarités locales, définie entre deux images binaires F et G, est introduite par [8]: CDL F, G ( p) F( p) G( p) max( d( p, F), d( p, G)), (11) où d(x, F) est la Transformée en distance (TeD) de F. Pour une position x = (x1, x2), d(x, F) représente la distance au pixel non-nul (i.e. de la forme) le plus proche. La TeD est bien connue dans la vision par ordinateur et la reconnaissance de formes. La CDL permet d obtenir une représentation locale et quantifiée des dissimilarités entre deux images [6]. Les valeurs de la CDL sont localement proportionnelles à la translation (cette propriété provenant de la DH). La CDL est de plus robuste aux petites déformations, contrairement à la différence pixel à pixel. Aucun paramètre n'est nécessaire. Elle a été utilisée avec succès dans plusieurs applications [8], [42], [65]. Nous proposons ainsi l extension d une carte des dissimilarités locales aux images en niveaux de gris. Une piste évidente consiste à étendre la Transformée en Distance dans l équation 11. En effet, une transformée en distance est un opérateur initialement appliqué aux images binaires [43]. Par définition, pour une image binaire G, soit F le fond (pixel de valeur 0) et M la forme (pixel de valeur 1) de G. Sous cette convention, TeD est définie par le calcul de la distance des points de M à G [72]. Définition 1 (TD) x I : TD( x) d( x, F), (12) où d(x, F) est une distance entre un pixel et un ensemble de points, définie par [72]: 75
79 Définition 2 (d(x, F)) d( x, F) min( d( x, y), y F). (13) Le calcul de la distance entre deux pixels d(x, y) peut se faire avec différentes distances spatiales : distance euclidienne, L, L1,. Remarque 1 Il faut noter que : x F, TD( x) 0. La transformée en distance d une image G est donc un tableau de distances TD(I) pouvant être visualisé comme une image en niveaux de gris où l on distingue l image d origine du fait que les valeurs de TD(I) aux points de M sont par définition non nulles et celles aux points de F sont elles nulles. Il faut noter que la transformée en distance est très sensible au bruit, en effet toute dégradation de l'image engendre la prise en compte des pixels de fond comme des pixels de forme et change totalement la transformée en distance [72]. Afin de pouvoir utiliser cet opérateur de transformée sur différents types d'images (en niveaux de gris, couleur), il a été généralisé dans un premier temps aux images en niveaux de gris [2], [63], [97], [98]. Pour des images en niveaux de gris Nous proposons ainsi l extension d une carte des dissimilarités locales, qui a fait ses preuves avec ces images binaires. La généralisation aux images en niveaux de gris est réalisée par l emploi de la généralisation de transformée en distance. L'une des difficultés de cette généralisation est l'impossibilité dans une image en niveaux de gris de distinguer aussi clairement que dans le cas binaire le fond et la forme [72]. Nous examinons la solution existante pour la définition des transformées de distance dans des images en niveaux de gris dans le chapitre suivant Travaux de recherche utilisant la mesure de dissimilarité locale La mesure de dissimilarité locale est, de nos jours, puissante et utile dans plusieurs applications et travaux de recherche. Quelques exemples d applications vont être présentés dans la suite, ainsi qu une liste de références bibliographiques relatives aux différentes applications. 76
80 Exemple 1 : Représentation synthétique La figure 41 illustre la notion de dissimilarité locale. Chaque image contient deux lettres. Les dissimilarités sont quantifiées : les fortes valeurs de mesure de dissimilarité sont représentées par un gris foncé, alors que celles qui sont faibles sont en gris clair. De plus, la carte donne accès à leur localisation spatiale : à partir de la CDL, nous pouvons voir que les plus fortes dissimilarités sont situées au niveau de la barre du "e" et du haut du "t", et effectivement, les dissimilarités correspondantes sont visuellement les plus importantes. Celles entre la partie gauche du "o" et le corps du "t" d une part, et entre les boucles du "e" et du "c" d autre part, sont en clair, et effectivement visuellement peu importantes [7]. Figure 41. Les lettres CO et ET et leur CDL, illustrant leurs dissimilarités locales [7] Exemple 2 : Application aux impressions anciennes La base de test est composée d impressions anciennes numérisées provenant d une collection particulière et de la médiathèque de Troyes. Elle a été constituée dans le cadre d une collaboration avec le laboratoire CReSTIC. La figure 42 donne des exemples d impressions originales provenant de la base. Ces images étant à l origine des impressions à l encre noire, elles sont fortement contrastées. Cela permet de les binariser pratiquement sans aucune perte d information. La base est composée de 68 images, parmi lesquelles il y a des groupes d impressions qui illustrent la même scène. La figure 43 présente une illustration d impressions anciennes et de leur CDL. Les figures 43(a) et 43(b) sont similaires, ainsi, les 77
81 plus hautes valeurs de leur CDL (figure 43(d)) sont regroupées (dans les parties représentant l herbe et les casques). Les figures 43(a) et 43(c) sont dissimilaires et la distribution spatiale des valeurs dans la CDL (figure 43(e)) sont réparties de manière plus aléatoire. Figure 42. Exemples d impressions anciennes originales de la base d application [7] 78
82 (a) Impression requête (b) Impression similaire (c) Impression dissimilaire (d) CDL entre 43(a) et 43(b) (e) CDL entre 43(a) et 43(c) Figure 43. Impressions anciennes (binarisées) et leur CDL [7] Conclusion Dans ce chapitre, nous avons détaillé l état de l art des méthodes d analyse des séquences d images fonctionnelles. Parmi ces méthodes, nous avons adopté la méthode de l analyse factorielle qui sera appliquée à des séquences d images dynamiques fonctionnelles à savoir la TEP. Nous avons aussi traité l estimation de la région d intérêt à travers les approches de comparaison locale. Parmi ces approches, nous avons adopté la mesure de dissimilarité locale. Son importance dans sa relation avec la méthode de l analyse factorielle dans le but de réaliser un outil de diagnostic automatique et précoce permettant l extraction et la 79
83 modélisation de la cinétique du traceur pour la caractérisation du cancer du sein sera l objet du chapitre suivant. 80
84 Chapitre III : Approche d analyse proposée pour l extraction et la modélisation de la cinétique du traceur en imagerie TEP pour la caractérisation des tissus tumoraux Introduction Description générale de l approche d analyse proposée Méthode d estimation de la région d intérêt Méthode d analyse des ROI basée sur l analyse factorielle Méthode d estimation de la cinétique du traceur Description détaillée de la méthodologie de l approche d analyse proposée pour l extraction et la modélisation de la cinétique du traceur en imagerie TEP pour la caractérisation du cancer du sein Méthodologie d analyse proposée basée sur l analyse factorielle Prétraitement des données Analyse orthogonale : estimation des données non bruitées Analyse oblique : estimation des fonctions physiologiques et des compartiments associés Méthodologie d analyse proposée basée sur la mesure de dissimilarité locale Transformée de distance à valeurs réelles (TDVR) : à travers la transformée Molchanov Carte des dissimilarités locales à valeurs réelles (CDLVR) Méthode originale pour l estimation de la région d intérêt Méthodologie de paramètrisation proposée pour l estimation de la cinétique du traceur au moyen des méthodes d analyse développées Proposition des modèles de paramètrisation Méthode originale d estimation de la cinétique du traceur : Quantification précoce du métabolisme glucidique en imagerie TEP à partir de la fixation du traceur dans le compartiment tumoral Conclusion
85 Introduction Les informations métaboliques sont accessibles par les médecins et peuvent être améliorées à l aide d une nouvelle approche pour l extraction et la modélisation de la cinétique du traceur caractérisant la tumeur. Dans ce chapitre, nous proposons une nouvelle approche pour la caractérisation du cancer du sein dans le but d une quantification automatique et précoce (après 11 minutes de l injection du traceur 18 F-FDG) du métabolisme glucidique du traceur 18 F-FDG. Cette approche est basée sur l analyse factorielle des séquences d'images médicales (AFSIM) pour déterminer un nouveau paramètre empirique KFPQ (KFPQ en anglais KFirst Pass Quantification) calculé à partir des deux compartiments obtenus dans la région d intérêt tumorale, au moyen d une extension d une mesure de dissimilarité locale proposée en niveaux de gris, et évalué durant le premier passage du traceur 18 F-FDG à partir des images TEP précoces. 1. Description générale de l approche d analyse proposée L examen TEP au 18 F-FDG est l'étalon in vivo pour l'évaluation du métabolisme glucidique dans la tumeur et largement utilisé en oncologie clinique. Plusieurs paramètres empiriques ont été proposés dans le but de caractériser quantitativement les résultats d un examen TEP au 18 F-FDG, particulièrement le calcul du flux sanguin BF (Blood Flow) et la valeur de fixation normalisée SUV (Standardized Uptake Value). Dans cette thèse, nous proposons une nouvelle approche pour l extraction et la modélisation de la cinétique du traceur en imagerie TEP en vue de la caractérisation des tissus tumoraux et en particulier le cancer du sein. Cette information peut être améliorée en utilisant des outils de traitement puissants développés tels que l analyse factorielle des séquences d'images médicales (AFSIM) et les approches de comparaison locales. Une étude précédente [119], [87] a montré que l'analyse des séquences d'images médicales (AFSIM) appliquée à une séquence d'images dynamiques TEP ne pouvait pas être discriminante pour évaluer l'évolution temporelle dynamique du traceur, afin de préciser les compartiments d'une tumeur. Les résultats de cette étude seront détaillés dans le chapitre suivant. Pour mieux comprendre l'importance de l'analyse factorielle (AFSIM), nous essayons d'analyser ses spécificités par rapport aux zones des régions d'intérêt. L estimation de la région d'intérêt (ROI) présente deux avantages: la première est de permettre une bonne séparation des compartiments physiologiques. La seconde est une quantification automatique 82
86 et précoce du métabolisme glucidique durant le premier passage du traceur 18 F-FDG, mesurée dans le tissu d intérêt des images dynamiques TEP afin de caractériser le cancer du sein. La figure 44 présente l organigramme de la méthodologie d analyse proposée pour la caractérisation quantitative des examens TEP au 18 F-FDG. Cette approche commence par une identification automatisée de la région d'intérêt (ROI en anglais pour Region Of Interest) tumorale à partir de la séquence des images dynamiques TEP. Ensuite, la méthode d analyse basée sur l analyse factorielle des séquences d'images médicales (AFSIM) est appliquée à la ROI obtenue au moyen d une extension de la carte des dissimilarités locales à valeurs réelles (CDLVR) proposée en niveaux de gris afin d estimer l'évolution temporelle de la concentration du traceur 18 F-FDG dans les deux compartiments physiologiques : purement tumoral et vasculaire. À partir du compartiment tumoral, nous pouvons alors évaluer la cinétique du traceur caractérisant la tumeur. Dans ce qui suit, nous allons donner une description détaillée de chaque étape. Séquence d images TEP Segmentation Région d intérêt (ROI) à travers la CDLVR Analyse Factorielle (AFSIM) Compartiments physiologiques Paramètrisation des compartiments physiologiques Figure 44. Approche d analyse proposée pour l extraction et la modélisation de la cinétique du traceur en imagerie TEP pour la caractérisation automatique et précoce du cancer du sein 1.1. Méthode d estimation de la région d intérêt L approche classique et la plus intuitive en routine clinique pour l estimation de la région d intérêt repose sur une segmentation manuelle des tumeurs [18]. Cette approche est longue et fastidieuse [74], [75]. Différentes méthodes automatiques ont été proposées pour déterminer un volume d intérêt en images fonctionnelles [50]. La dépendance à la partie clinique pour l initiation du contour présente un inconvénient principal pour les modèles déformables. En effet, les performances de ces algorithmes sont souvent sensibles aux variations de l intensité du bruit ou aux changements de contraste dans les images. Elles sont de plus généralement, dépendantes d initialisations et de pré- ou posttraitements gérés par l utilisateur, ainsi que d informations a priori supplémentaires [50]. L évolution spatio-temporelle du traceur est exploitée pour estimer automatiquement la région d intérêt tumorale. Certaines approches de comparaison locale pour la détection des 83
87 changements dans l organisation spatiale entre deux images TEP en vue d une estimation des régions d intérêt afin de mesurer l activité du traceur dans la tumeur sont présentées dans le chapitre précédent. Nous proposons ainsi l extension d une carte des dissimilarités locales à valeurs réelles (CDLVR), qui a fait ses preuves avec ces images binaires. La généralisation aux images en niveaux de gris est réalisée par l emploi de la généralisation de transformée en distance. La CDLVR fournit des mesures locales bien définies et efficaces Méthode d analyse des ROI basée sur l analyse factorielle La méthode d analyse AFSIM présente un intérêt particulier pour les études cliniques étant donné une méthode de séparation de sources pour estimer certaines fonctions physiologiques. Elle vise à estimer la variation de concentration d'un traceur dans différentes fonctions physiologiques. En effet, l analyse factorielle des séquences d'images médicales (AFSIM) est une méthode efficace pour la caractérisation automatisée du cancer du sein, à partir de l'analyse la région d intérêt tumorale des séquences d'images dynamiques temporelles. L analyse factorielle des séquences d images dynamiques est une méthode d analyse qui «résume» le contenu d une séquence d images indexées par le temps en un petit nombre d images et de courbes associées. Chaque image correspond à une composante, représentant un compartiment physiologique, dans lequel le signal change d une manière caractéristique au cours du temps. La courbe associée décrit la façon dont le signal évolue au cours du temps dans le compartiment. Dans notre cas, l approche de l analyse factorielle (AFSIM), appliquée à chaque zone tumorale, sert à séparer le compartiment vasculaire, ainsi que le compartiment purement tumoral et à évaluer leurs activités et leurs variations dans le temps caractérisant la tumeur Méthode d estimation de la cinétique du traceur Notre objectif principal est l extraction et la modélisation de la cinétique du traceur en imagerie TEP en vue de la caractérisation des tissus tumoraux et en particulier le cancer du sein. L idée est de proposer un nouveau modèle paramétrique qui permettra de corriger les limites du SUVmax [18]. Un paramètre clinique reflète une quantification automatique et précoce du métabolisme glucidique ; c'est-à-dire à partir d images précoces (après les 11 premières 84
88 minutes), contrairement au paramètre SUVmax qui est calculé à partir d images tardives (après 90 minutes de l injection du traceur 18 F-FDG). Ce nouveau modèle paramétrique doit être déterminé à partir de l évolution temporelle du traceur 18 F-FDG dans le compartiment purement tumoral, estimée à l aide de l approche de l analyse factorielle (AFSIM) appliquée à la région d intérêt tumorale, contrairement au paramètre SUVmax qui est souvent déterminé dans un mélange de compartiments vasculaire et tumoral. Plus spécifiquement, il s agit de déterminer un nouveau paramètre empirique KFPQ (KFPQ en anglais KFirst Pass Quantification) qui sera l objet de ce chapitre. Il est calculé à partir des deux compartiments obtenus dans la région d intérêt tumorale et évalué durant le premier passage du traceur 18 F-FDG, comme le cas du modèle du Mullani [28], dans les images TEP précoces. Les résultats obtenus dans le chapitre suivant montrent que ce nouveau paramètre proposé KFPQ est corrélé avec le paramètre SUVmax, l indice de la valeur maximale normalisée de la fixation du 18 F-FDG dans le tissu d intérêt. Le paramètre KFPQ peut être donc considéré comme une indication importante pour la prédiction précoce du métabolisme du glucose dans le tissu d intérêt. 2. Description détaillée de la méthodologie de l approche d analyse proposée pour l extraction et la modélisation de la cinétique du traceur en imagerie TEP pour la caractérisation du cancer du sein 2.1. Méthodologie d analyse proposée basée sur l analyse factorielle Le modèle sous-jacent à la méthode d analyse basée sur l AFSIM est le suivant [1], [119]: N xi ( t) a k 1 k ( i) f ( t) ε ( i), (14) où i désigne l'indice de pixel et k est le facteur d'index N représentant le nombre de compartiments physiologiques. Les coefficients fk sont les cinétiques fondamentales, également appelés «facteurs». "L'image factorielle" ak est "l'image factorielle" associée au k- ème compartiment physiologique. Le paramètre Ɛ(i) représente le bruit enregistré dans l i-ème pixel. Comme ce modèle linéaire est toujours une approximation de données réelles, par exemple à cause du bruit, il est un terme d'erreur du modèle. k 85
89 Dans ce modèle, les cinétiques xi(t) dans chaque pixel i sont connues, et les inconnues à estimer sont les images des compartiments physiologiques et les cinétiques fondamentales. Il faut, bien sûr, que le modèle de superposition linéaire soit justifié d un point de vue physiologique. En outre, le nombre de compartiments physiologiques à identifier doit être relativement faible, typiquement de deux à six. Il est important de savoir que plus ce nombre est élevé, moins l analyse est robuste [19]. Le bruit Ɛ(i) présent dans chaque pixel doit aussi être estimé. Pour estimer toutes ces inconnues, l analyse peut utiliser trois types de connaissances a priori : les propriétés du bruit permettant d estimer epsilon, des informations relatives aux allures des fonctions physiologiques et des informations relatives à la distribution spatiale des compartiments physiologiques. C est en exploitant toute ou une partie de ces connaissances que l analyse factorielle (AFSIM) conduit aux facteurs et aux images factorielles estimant les fonctions fondamentales et les compartiments physiologiques associés. La méthode de résolution du modèle de l AFSIM procède pour cela en deux étapes. La première estime le bruit présent dans chaque pixel en utilisant les propriétés du bruit lorsqu elles sont connues [11], [46], [19], [24], [4], [10]. Et la deuxième estime les fonctions physiologiques et les compartiments associés de façon à respecter les connaissances qui les concernent [90], [4], [10], [5], [23], [24]. Ces deux étapes sont précédées d'une étape de prétraitement de données effectuée sur les séquences d'images dynamiques en entrée. Dans ce qui suit, nous allons donner une description détaillée de chaque étape Prétraitement des données Cette étape a pour but d'améliorer la qualité des images TEP et d'augmenter le rapport signal sur bruit pour chaque cinétique. Nous proposons d'appliquer une moyenne spatiale des coupes qui ne contiennent que la région tumorale afin de réduire le bruit. Les séquences obtenues prétraitées des images TEP seront utilisées pour les prochaines étapes de l'analyse factorielle AFSIM Analyse orthogonale : estimation des données non bruitées Soit une séquence de P images fonctionnelles prises aux instants (t1, t2,, tp). Chacune des images est de taille (N x N). Nous désignons par X la matrice des données originales xi(t) (xi(t) est le décours temporel associé à un pixel i). X est alors, une matrice de (N x N) lignes et P colonnes. Elle est représentée comme suit (figure 45): 86
90 x 1 (t 1 ) x 1 (t 2 )... x 1 (t P ) x 2 (t 1 ) x 2 (t 2 )... x 2 (t P ) x 3 (t 1 ) x 3 (t 2 )... x 3 (t p ).. x (N^2-1). (t 1 ).. x (N^2-1). (t 2 ).... x (N^2-1). (t P ). x (N^2) (t 1 ) x (N^2) (t 2 ) x (N^2) (t p ) Figure 45. Matrice des données originales Les données originales xi(t) appartiennent alors, à un espace de dimension P. Et la partie non bruitée de ces données xi(t)- (t) ε i appartient à un espace S de dimension Q inférieure à P. Le but de l analyse orthogonale est d estimer cet espace S. Pour cela, (Buvat. I., 1998) utilise une décomposition en valeurs singulières des données (matrice X), qui consiste à diagonaliser la matrice de covariance de l ensemble des cinétiques correspondantes aux différents pixels, de sorte qu'elle permet de minimiser les différences quadratiques moyennes entre les données originales et la projection des données sur cet espace. Cette matrice fait intervenir des métriques W et M [22]. Matrice de covariance X t W X M. (15) Ceci revient à une pondération des données. En choisissant cette pondération en fonction des propriétés statistiques des données, nous pouvons réaliser une décomposition optimale du signal et du bruit. En effet, la décomposition en valeurs singulières des données permet d exprimer chaque cinétique comme une combinaison linéaire de P vecteurs u, où chaque vecteur u est associé à une valeur propre lambda q. L espace contenant la partie non bruitée des données est l espace engendré par les Q vecteurs propres associés aux Q plus grandes valeurs propres lambda q (figure 46). A ce stade, il est important de souligner que l analyse traite tous les pixels simultanément, via cette analyse de covariance. Ainsi, le bruit est estimé en analysant simultanément les caractéristiques de toutes les cinétiques (décours temporels). 87
91 Espace de dimension P contenant les données originales xi(t) Espace de dimension Q contenant les données non bruitées xi(t)- (t) ε i Figure 46. Estimation des données non bruitées (Site web 2) Analyse en Composantes Principales (ACP) La décomposition par l Analyse en Composantes Principales (ACP) des décours temporels de la séquence permet de concentrer l'information utile de la séquence sur les premières composantes, les dernières composantes étant essentiellement associées au bruit. Nous considérons une séquence d'images S (n, P) formée de P images à n pixels chacune. L'ACP peut s'appliquer sur la séquence d'images de manière simple, en considérant toutes les cinétiques xi(t) (i=1..n) comme différents individus (n individus) et leurs valeurs dans le temps comme autant de variables (P paramètres) caractérisant chaque individu (figure 47) [86]. P variables x 1 (t 1 ) x 1 (t 2 ). x 1 (t P ) x 2 (t 1 ) x 2 (t 2 ). x 2 (t P ) x 3 (t 1 ) x 3 (t 2 ). x 3 (t p ) x (n-1) (t 1 ) x (n-1) (t 2 ). x. (n-1) (t P )... x n (t 1 ) x n (t 2 ). x n (t p ) Figure 47. Matrice des données (individu-variable) Le but de cette méthode est d'extraire des n individus redondants (x1 xn), Q nouvelles variables non-redondantes par combinaison linéaire des variables (avec Q<<P). Cette étape permet de réduire l'information contenue dans les n individus en Q composantes orthogonales UQ(t). Le principe de l ACP peut être décrit à travers les étapes suivantes : Un vecteur moyen xmoy de dimension P est calculé à partir des n cinétiques (xi(t), i=1..n) : x moy n i1 ( t) xi ( t). n 88 (16)
92 Ce vecteur moyen est soustrait des vecteurs lignes de la matrice «individus-variables» (nous éliminons donc les ressemblances pour se concentrer sur les différences), ce qui génère la matrice des données centrées Xs (n, P) dont les lignes sont les vecteurs de différences φ i (t) associés à chacune des cinétiques : φ ( t) x ( t) x ( t). i i moy (17) La matrice de covariance R est construite ainsi : R X t s.xs. (18) La méthode consiste à exprimer la matrice R sous la forme : R U. Λ. U. P P t P (19) Ceci est en la décomposant en vecteurs propres UP (U1, U2,, UP) et valeurs propres Λ ) où est la matrice diagonale des valeurs propres. P (λ1,λ 2,...,λP La contribution relative de chaque vecteur propre est donnée par sa valeur propre associée. Les coordonnées VP de chaque individu dans la nouvelle base orthogonale se calculent simplement par projection : V X., s UP P (20) λ P et déterminent le poids de chaque composante UP(t) en chaque pixel. Les coordonnées VP(t) forment donc P images factorielles de n pixels, associées aux décours temporels UP(t). L ensemble des données centrées peut alors s exprimer comme suit : Xs V... (21) P ΛP U P Nous pouvons alors, exprimer l ensemble des cinétiques X sous la forme : X 1n. xmoy VP. ΛP. U P. (22) Et si nous ne retenons que les premières composantes principales significatives (pour Q <P), nous pouvons exprimer les décours temporels approchés. X 1n. xmoy VQ. ΛQ. UQ. (23) Le fait de ne retenir que les premiers vecteurs propres les plus significatifs permet de réduire la dimension du problème. Dans ce cas, nous estimons que l essentiel de l information est 89
93 représenté par les Q premiers vecteurs propres, le reste de l information non modélisée étant alors assimilé au bruit ou à l erreur du modèle [86]. Nous pouvons simplifier l écriture en posant en notation matricielle : X V.. U, (24) avec V V Q U x moy 1... U Q x moyp 1 Λ 0 0 Λ Q. (25) Soit, nous l écrivons en notation non matricielle : x ( t) x moy ( t) Analyse des Correspondances (AC) i Q q1 λ. v q q ( t). u q ( t). (26) Soit une séquence de P images fonctionnelles, à n pixels chacune. Elle se présente sous la forme d une matrice X (n, P). Les lignes de X sont les vecteurs xi (i=1..n) de P composantes xij (j=1..p). Soit yi l image de xi par la transformation g (yi=g (xi)). C est une normalisation optimale vue qu elle utilise les propriétés statistiques du signal et du bruit ([11]). L application de l analyse des correspondances (AC) est décrite à travers les étapes ci dessous : 1. Nous calculons les variables suivantes : P x i. x ij, j1 x.j x ij, i1 n n P x.. x ij. i1 j1 (27) (28) (29) 2. Nous définissons la matrice Y (n, P), l image de X par la transformation g. yi g( xi ) (1/xi.). xi. (30) 90
94 3. Nous calculons les variables : ω x i. / x.., i Γ diag( x. 1 / x..,..., x.j / x..,..., x.p / x.. ). (31) (32) 4. Le vecteur moyen y moy est définit par : moy 5. Les métriques W et M sont : y ( 1/ ωi ) ωi yi ( x. 1/ x..,..., x i1 i1 6. Nous calculons la matrice de covariance n N.j / x,..., x W diag( x 1. / x..,..., x i. / x..,..., x n. / x.. ), C ( Y 1.y )'. W.( Y 1.y ). M. n moy -1 M Γ. n moy...p / x.. ). (33) (34) (35) (36) 7. Nous calculons les Q vecteurs propres uq associés aux plus grandes valeurs propres de la matrice C et qui définissent le sous espace vectoriel contenant les données non bruitées. UQ est la matrice (Q, P) formée par les vecteurs propres uq. VQ est la matrice (n, Q) formée par les coordonnées vq(i) des yi dans la base {uq} q=1..q. est la matrice diagonale (Q, Q) dont les éléments sur la diagonale sont les racines carrées des valeurs propres. UQ et VQ doivent satisfaire les relations suivantes : V Q U Q '. M. U Id, Q ' V. DV. Id, Q ( Y 1.Y n Q moy ). M. U ' Q Λ Q.Λ. 1 Q q q (37) (38) (39) Les cinétiques non bruitées s écrivent alors sous la forme : y i y moy Q q1 λ v ( i) u. q q q (40) Et si nous retournons à la notation matricielle V V Q y moy 1... ymoyp 1 0 U UQ Λ, 0 Λ Q (41) 91
95 Y 1. Y V. Λ. U V. Λ. U. n moy Q Q Q (42) Les images résultant de l analyse orthogonale contiennent des valeurs négatives spécifiques. Les vecteurs propres ont des valeurs aussi positives et négatives. La combinaison linéaire de ces poids et des courbes est difficile à interpréter physiologiquement. Une analyse oblique permet l'introduction des contraintes de positivité Analyse oblique : estimation des fonctions physiologiques et des compartiments associés L espace S contenant les données non bruitées ayant été estimé, la seconde étape consiste à identifier les fonctions physiologiques et les compartiments associés dans cet espace résultant de l analyse orthogonale. Il s agit donc d effectuer un changement de base. Pour trouver la base qui aura la signification physiologique recherchée, les a priori relatifs aux fonctions et aux compartiments sont traduits sous forme de contraintes. En tenant compte de ces contraintes, le modèle est résolu à l aide d une approche itérative [46], [87]. Une fois les facteurs f identifiés, les f négatifs sont divisés par deux et normalisés afin de réduire le nombre des éléments négatifs de la matrice. Ce processus est répété d une manière itérative et doit être arrêté lorsque le nombre de facteurs négatifs f est considéré comme assez faible [38]. L analyse oblique est décrite à travers les étapes ci-dessous. Approche itérative : 1 er algorithme utilisant la matrice de transformation La décomposition orthogonale de la séquence ne permet pas d identifier des cinétiques et des images factorielles ayant un sens physiologique car les images obtenues contiennent des valeurs négatives. L'AFSIM fait alors l'hypothèse que les fonctions physiologiques recherchées sont présentes dans le sous-espace engendré par les premières composantes principales retenues. Le but de l algorithme est de trouver la transformation linéaire permettant d'exprimer des composantes ayant un sens physiologique. Pour trouver la bonne transformation, il faut se baser sur la contrainte de la positivité des fonctions physiologiques et des compartiments associés. La méthode va opérer une analyse oblique pour obtenir des décours temporels et des images associées aussi positifs que possible. Le modèle sous-jacent est donc toujours le même, à savoir que la séquence peut s'approximer par la combinaison linéaire de quelques images factorielles et décours temporels associés. 92
96 y ( t) i y moy ( t) Q q1 λ v ( i) u ( t). q q q (43) Le but est de modifier le repère défini par les composantes orthogonales en changeant le repère pour que la séquence se décompose en images factorielles ak(i) et décours temporels associés fk(t) : y ( t) a ( i) f ( t). i k Mais avec des contraintes de positivité sur les images et décours temporels : ak(i)>0 et fk(t)>0. Nous passons donc d'une représentation réduite à Q composantes k k (44) Y 1n. Ymoy VQ. ΛQ. UQ, (45) à une représentation toujours réduite mais en respectant certaines contraintes : Y A. F avec A 0 et F 0. (46) L algorithme cherche en pratique une matrice de transformation T qui résolve F T. U en respectant A 0 et F 0. T étant la transformation à appliquer aux coordonnées U et définie comme suit [11]: (47) T TQ. (48) Le calcul de cette modification oblique du repère sous contraintes est réalisé par un algorithme itératif optimisant à la fois les contraintes dans le domaine des décours temporels et dans le domaine des images. Les contraintes sont appliquées aux images, ensuite, les courbes associées sont déduites par projection, et ainsi de suite jusqu à convergence vers une solution stable [10]. Les étapes de l algorithme itératif sont les suivantes : 0. Initialisation de T 1. Calcul de A utilisant la relation : A V Λ -1 T. (49) 2. Modification des valeurs ak(i) en utilisant les contraintes de positivité et de normalisation. 3. Calcul de T en utilisant la relation : 93
97 4. Calcul de F selon T Λ ( V DV) -1 1 t 1 F TU. t V DA. (50) (51) 5. Modification des valeurs fk(t) en utilisant les contraintes de positivité et de normalisation. 6. Calcul de T en utilisant T F M U t ( UMU t ) 1. (52) 7. Nous testons la condition d arrêt suivant le nombre d itérations (nombre des éléments négatifs de la matrice). Si elle n est pas vérifiée on revient à l étape 0. Approche itérative : 2 éme algorithme (Buvat. I., 1998) propose une deuxième approche itérative de l analyse oblique. Etant donné une séquence de P images fonctionnelles, de n pixels chacune. Les cinétiques xi(t) subissent une normalisation générant les cinétiques yi tel que : yi(1) + yi(2) +...+yi(p)=1 xi ( t) yi ( t) P. (53) xi ( l) l1 Soit ymoy le vecteur moyen défini par : n yi ( t) i1 y (54) moy ( t). n Nous cherchons à obtenir un nombre des composantes physiologiques égal à q. Les cinétiques yi(t) non bruitées appartiennent à l espace S issu du calcul de l analyse orthogonale. Cet espace est d origine ymoy et engendré par les (q-1) vecteurs (W1, W2, W3, Wq-1) [38]. Ci est le point représentant la cinétique yi dans l espace S. Le point [Bj] représente la fonction physiologique fj dans l espace S. Nous avons la relation suivante :. 1 i )i B β β,..., β. j Ci γ, γ2i,..., γ(q- 1 1 j, 2 j (q-1 )j (55) (56) q C α B, α 0, i, j. i j1 ji j Cette relation montre que les points [Ci] sont les barycentres des points [Bj]. Ils sont aussi, localisés dans le polyèdre défini par les points [Bj]. (Figure 48) ji (57) 94
98 Les coordonnées des points [Ci] sont connues. Elles peuvent être déterminées par la projection des cinétiques originales dans la base (W1, W2, W3,, Wq-1). À partir des points [Ci], un algorithme itératif aura lieu pour déterminer les points [Bj]. (Figure 49) W 2 B 1 (f 1 ) C 1 (y 1 ) β 12 γ 12 C 2 (y 2 ) B 2 (f 2 ) β 11 γ 11 Y moy W 1 B 3 (f 3 ) Figure 48. Les points [Ci] sont les barycentres des points [Bj] dans l espace d origine ymoy et engendré par les vecteurs (W1, W2) (cas de trois fonctions physiologiques) [38] (N) B 1 ' B 1 Itération 2 C 2 C 4 B 1 Itération 1 C 1 Résultat final (N) B 2 ' B 2 B 2 C 3 B 3 ' B 3 (N) B 3 Figure 49. Durant l algorithme itératif, les points Ci sont, de plus en plus, inclus dans le triangle défini par les points Bj (cas de trois fonctions physiologiques) [38] Etapes de l algorithme itératif Soit les trois matrices suivantes : q β β1 B β β2... β(q- 1 ) 1... β(q- 1 q ) q, (58) 95
99 n γ γ1 C γ γ2... γ(q-1 ) 1... γ(q- 1 n ) n α α1 α α2 A α α3... αq α n n n qn,. (59) (60) Les étapes de l algorithme itératif sont les suivantes : 0. Nous estimons [B0] 1. Nous calculons [A0] selon l équation suivante :. A B 1. C (61) 2. Nous divisons par deux les éléments négatifs de la matrice [A0] puis nous les normalisons. Nous obtenons alors une nouvelle matrice [A1]. 3. Nous calculons [B1] à partir de l équation suivante : 1 1 t.[ A].[ C] n [ B] 4. Nous normalisons [B1] et nous obtenons alors, une nouvelle matrice [B2]. Nous testons la condition d arrêt (nombre des éléments négatifs de la matrice). Si elle n est pas vérifiée, nous revenons à l étape 0 [38].. (62) Calcul des images factorielles Soit [f ] la matrice des composantes physiologiques, [Φ] la matrice des images factorielles et [Y] la matrice des décours temporels [38]. Nous avons la relation suivante : Y f. φ. (63) 96
100 Nous calculons les images factorielles comme suit: t t 1 φ Y f ( f f ). (64) 2.2. Méthodologie d analyse proposée basée sur la mesure de dissimilarité locale Pour mieux comprendre l'importance de l'analyse factorielle (AFSIM), nous essayons d'analyser ses spécificités par rapport aux zones des régions d'intérêt afin d évaluer l'évolution temporelle dynamique de la cinétique du traceur caractérisant le cancer du sein. Dans cette section, nous cherchons à estimer la région d intérêt tumorale en exploitant l information spatio-temporelle des séquences d images dynamiques TEP de façon automatique. La localisation des tumeurs est réalisée par la détection robuste de changements entre deux images caractéristiques obtenues à partir de la séquence entière. La première image ne contient que l activité cardiaque et vasculaire alors que la seconde image contient en plus de l activité tumorale. Il est cependant nécessaire de disposer d une comparaison locale, fiable et bien définie, entre ces deux images. Une extension de la CDL, comme en niveaux de gris, qui a fait ses preuves avec ces images binaires est proposée dans notre travail de recherche. La Transformée en Distance à Valeurs Réelles (TDVR, en Anglais : Real-Valued Distance Transform - RVDT) introduite par Molchanov [66], est à l'origine de la définition de la Carte des Dissimilarités Locales à Valeurs Réelles (CDLVR, en Anglais : Real-Valued Local Dissimilarity Map RVLDM) [68], [69]. Une des contraintes est que pour une image vue en binaire puis en niveaux de gris, la transformée en distance calculée sur l'image binaire sera égale à la transformée en distance généralisée calculée sur l'image en niveaux de gris. Nous examinons ici la solution existante pour la définition des transformées de distance dans des images en niveaux de gris. Les transformées en distance généralisées aux images en niveaux de gris se basent sur des distances généralisées, elles aussi, aux images en niveaux de gris. C'est-à-dire que ces distances combinent la distance 2-D entre deux pixels x et y d'une image G et une «distance» sur les niveaux de gris des pixels séparant x et y [72]. L ensemble de solutions garde la même définition de la TeD: d(p, F) est la distance entre p = (x, y) au pixel non-nul (i.e. de la forme) le plus proche de F. Si une image se compose d'une région en niveaux de gris et un fond uniforme, la définition est applicable. Le seul travail est de définir une distance entre deux pixels en niveaux de gris, ce qui conduit à la Transformée 97
101 en Distance Pondérée par le niveau de Gris (TDPG, en Anglais : Gray-Weighted Distance Transform - GWDT) et la Transformée en Distance Pondérée sur Espace Courbe (TDPEC, en Anglais : Weighted Distance Transform On Curved Space - WDTOCS). Pour plus de détails, voir l annexe 3. Définition 3 (Distance de Wilson) La distance de Wilson est une distance sur X. Y donnée par : p ( x, y), p' ( x', y') D, dw( p, p') max( d( x, x'), y y' ), (65) où d(x, x ) définit, par exemple, la distance euclidienne entre les coordonnées spatiales. Définition 4 (TDW) Soit D l espace contenant, c'est-à-dire D=X.Y pour chaque point 3 p( x, y) D (rappelons que D ), la Transformée en Distance de Wilson (TDW, en Anglais : Wilson s Distance Transform - WDT) d'une image F qui définit la distance entre p et le sous-graphe de F: d( p, f ) inf d( p, p'). p' f (66) Malgré la facilité de l emploi de sa généralisation, cette solution combine encore les intensités et les coordonnées spatiales (avec l'opérateur max). Il souffre donc du même problème que la transformée TDPEC et a besoin d'une sorte de normalisation pour adapter la gamme des dimensions. L incorporation d'un signal dans un espace de dimension supérieure présente un autre inconvénient. Il rend la visualisation des distances difficiles. En effet, en considérant un signal à deux dimensions (une image), la transformée en distance utilisant l'approche de Wilson donne une carte en trois dimensions qui est mal affichée. Si l'interprétation de la distance est satisfaisante, la relation entre l'image et les distances est difficile. En particulier, la transformée TDW n'est pas directement utilisable dans la CDL de l'équation Transformée de distance à valeurs réelles (TDVR) : à travers la transformée Molchanov Une extension d un espace de dimension élevé a été proposée par Molchanov [66]. Dans son travail, il introduit une transformée de distance qui est basée sur des ensembles de niveau 98
102 supérieur et les résume avec un certain poids prédéfini [66]. Molchanov ne considère plus les coordonnées de luminance (sauf intrinsèque pour la définition des ensembles de niveau supérieur). Cela simplifie le choix d'un facteur de normalisation, par rapport à l'approche de Wilson. Définition 5 (ensemble de niveau supérieur) Étant donné un signal f, on définit un ensemble de niveau supérieur à Y donné par : X y ( f ) x X : f ( x) y. (67) Définition 6 (Transformée en Distance à Valeurs Réelles) Étant donné un signal de valeur réelle F défini sur un domaine distance à valeurs réelles (TDVR) est donnée par l équation suivante: TDVR[ f ]( p) d( p, X ( F)), yy y y X N, la transformée en (68) où d indique la transformée en distance connue d une image binaire ( ( F)) X y, Y y y dénote les facteurs de pondération. Le point intéressant de cette définition est qu'elle ne crée aucun artefact pour la visualisation en ajoutant une dimension au signal. En outre, elle a été bien développée dans un sens mathématique et permet d'inverser cette procédure (au moins pour les signaux finis discrets, ce qui est le cas pour les images), cela veut dire que l'on peut calculer une carte de transformée en distance à partir d'une image ou d'obtenir une image à partir d'une une carte de transformée en distance. Une autre bonne propriété : lorsque F est une image binaire, TDVR est la transformée en distance classique. Un objectif intuitif de la TDVR est de visualiser l'image en niveaux de gris comme une pile d'images binaires. Chaque image binaire est calculée à partir de seuils croissants. Une pile de transformées en distance est calculée et aplatie Carte des dissimilarités locales à valeurs réelles (CDLVR) Une solution pour étendre l équation 11 aux images en niveaux de gris est d étendre la notion de TeD [42], [65]. Parmi les diverses possibilités, la proposition de Molchanov est particulièrement attractive, mais, à notre connaissance, n a jamais été exploitée [66]. Dans sa version la plus simple, elle est définie sur une image dont les niveaux de gris appartiennent à [a, b], avec 0 a < b 255 : 99
103 b 1 d M ( x, F) d( x, X y ( F)), (69) 255 ya où d désigne la Transformée en Distance classique (TeD) et F) x X : F( x) y X y ( étant l image F seuillée au niveau y. Cette définition possède plusieurs propriétés intéressantes. La TeD obtenue reste ainsi à deux dimensions, contrairement aux solutions qui envisagent l image comme une fonction binaire dans un espace 3D (comme par exemple chez Wilson [109]). Elle reste entièrement valide pour des images binaires. Il s agit donc d une véritable généralisation de la notion de TeD. Et contrairement à d autres approches, les notions de fond et de forme [44] ne sont pas nécessaires. Enfin, les dimensions spatiales et de luminance ne sont pas combinées. Aucun facteur de normalisation n est donc nécessaire. En adoptant la TeD de Molchanov, l équation 11 reste valable. Pour des images en niveaux de gris, la CDLVR généralisée est donc: CDLVR ( x) G( x) F( x) max( d ( x, G), d ( x, F, G M M F (70) )) Méthode originale pour l estimation de la région d intérêt L'ensemble de la séquence d'images TEP est réduite à deux images clés construites à partir des moyennes généralisées données par l équation suivante : 1 ( N i1 p x i ) 1 p. Certaines diverses solutions de la détection des changements sont présentées ici. Nous rappelons d'abord la méthode MTVC (en Anglais : Method for Temporal Volumes Comparison). Ensuite, la méthode MAGMA (en Anglais : Method for Arithmetic and Geometric Means Analysis) est proposée [121]. La carte des dissimilarités locales est appliquée sur une séquence d images TEP afin de localiser des tumeurs du sein dans des séquences temporelles TEP et non pas les segmenter. Afin d obtenir des données plus facilement exploitables, les coupes qui correspondent à la zone tumorale sont sélectionnées et moyennées. À terme et pour un examen, onze images (I1 à I11) sont à exploiter. Le patient reste a priori stable au cours de ces acquisitions. Il peut avoir des mouvements de faible amplitude. Un recalage des images pourrait être envisagé. Cependant, en raison de la lourdeur des calculs nécessaires nous souhaitons éviter ce recalage, (71) 100
104 d où la nécessité de disposer d une méthode de comparaison robuste à de faibles écarts locaux. L évolution spatio-temporelle du traceur 18 F-FDG injecté dans le corps humain est utilisée pour estimer les tumeurs. À partir d une série temporelle de onze images où chaque image est normalisée, deux images clés sont calculées [121]. Quatre différentes méthodes sont proposées pour la construction des images clés. La première est la méthode MTVC qui est justifiée par une analyse physiologique. Selon les médecins [121], le traceur 18 F-FDG injecté dans le corps humain est encore essentiellement dans la circulation artérielle lors de la 1ére image TEP (le volume t1). Le plus souvent nous ne distinguons pas encore la tumeur (figure 50(a)), mais nous pouvons visualiser l aorte (bien que le pic d activité de l aorte survienne généralement à t2 voire t3). Par contre, le traceur s accumule dans la tumeur à la fin de l acquisition (figure 50(b)). (a) I1 (b) I2->11 Figure 50. Un exemple des images clés avec la méthode MTVC D où l idée de construire deux images TEP. La première image est obtenue à l instant t1. La seconde image est obtenue par moyenne temporelle pixel à pixel des images postérieures (de t2 à t11). La première image contient ainsi essentiellement l information de l activité cardiaque et artérielle. La seconde image contient en sus l information de l activité tumorale [121]. En second lieu, nous proposons trois autres méthodes de détection de changements : la première est la méthode MAGMA [121], la seconde méthode est GM-QM (Geometric Means Quadratic Means Analysis) et la troisième est la méthode M M (Minimum Means Maximum Means Analysis). L idée est de construire les deux images clés contenant le même type d informations qu avec MTVC, mais nous souhaitons disposer de deux images de bonne qualité. En effet avec MTVC, la première image clé est l image t1 alors que la seconde résulte du calcul d une moyenne. La première image est de moins bonne qualité que la seconde. Notre idée est d obtenir les deux images clés à l aide des moyennes généralisées. Nous nous 101
105 concentrons sur la moyenne géométrique, la moyenne arithmétique, la moyenne quadratique, la moyenne minimale et la moyenne maximale: la moyenne géométrique et la moyenne minimale contiennent principalement les faibles valeurs et les autres moyennes contiennent toutes les informations. GM ( p) N I ( p), I N i1 i (72) AM ( p) I 1 N N i1 I ( p), i (73) QM ( p) I 1 N N i1 I 2 i ( p), (74) M ( p) min I ( p), i1: N i (75) M ( p) max I ( p), i1: N i (76) où p=(x,y) représentant la position d un pixel. La méthode d estimation de la région d intérêt (ROI) tumorale que nous proposons s appuie sur la comparaison de ces deux images. La CDLVR est employée pour mettre en évidence les changements entre ces deux images, c est à dire l activité tumorale. La localisation de la tumeur est alors réalisée par détection des grandes valeurs de la CDLVR, par simple seuillage. Les principales étapes sont [121]: 1. Application d une moyenne spatiale des coupes qui correspondent à la région tumorale, pour obtenir une séquence d images TEP, 2. Application d'une normalisation pour les séquences d'images TEP prétraitées obtenues pour un niveau de gris entre 0 et 255. Pour chaque image TEP, nous soustrayons le minimum de l'image. Ensuite, nous divisons ce dernier terme par la différence entre le maximum et le minimum. Par la suite, nous multiplions tout par 255. Cette normalisation se fait pour deux raisons: la première est que la carte CDLVR est faite pour mettre en évidence les différentes structures de l'image et de les comparer. La normalisation permet d'avoir des images avec des niveaux de luminance globale constants. Donc les écarts seront principalement dûs aux structures des images. La 102
106 deuxième raison est de rendre la dynamique du terme F( p) G( p) à un ordre de grandeur comparable à celui du terme l environ de 255, max( d M ( p, F), d M ( p, G)) qui est égal à 3. Construction des images clés, soit avec la méthode MTVC, soit avec M M, GM- QM et la méthode MAGMA, 4. Calcul de la comparaison locale entre les images clés (DPP, SSIM ou CDLVR), 5. Construction d une image A a priori : cette image permet de mettre en relief le cancer du sein, qui est la pathologie sur laquelle nous avons été amenés à travailler. 6. Multiplication de l image résultant de la comparaison locale avec l image A a priori, 7. Seuillage global de la comparaison locale. Le seuil est calculé en fonction de la valeur maximale de la comparaison locale. Il est fixé à 90% du max de l image de comparaison, pour ne conserver que les zones qui ont le plus variés (au sens de la comparaison utilisée) entre les deux images clés. Notre approche proposée pour l estimation de la région d intérêt en imagerie TEP au moyen de dissimilarités locales à l aide des moyennes généralisées sera utilisée dans le chapitre suivant comme germe dans une segmentation de «Level-Set» [26]. Le modèle «Level-Set» est défini comme suit : t =. F (77) Où F est le terme qui décrit l évolution «Level-set». Rappelons que l'avantage de cette méthode est que les changements topologiques tels que la fusion et la scission du contour ou de la surface sont pris en compte implicitement. Ce modèle est largement utilisé en segmentation d'images TEP pour leur capacité à intégrer les processus de détection et de chaînage des contours en un seul processus de minimisation d'énergie. Pour ces raisons, la méthode «level-set» avait été choisi pour la segmentation de la ROI tumorale sur chaque image TEP [26]. Cette segmentation est effectuée pour chaque image de la séquence afin de construire une nouvelle séquence d images qui ne contient que les zones des régions d objets d intérêt. Rappelons que la région d'intérêt (ROI) segmentée présente deux avantages: la première est de permettre une bonne séparation des compartiments physiologiques. La seconde est une quantification automatique et précoce du métabolisme glucidique durant le premier passage du FDG, mesurée dans le tissu d intérêt des images dynamiques TEP afin de caractériser le cancer du sein. 103
107 2.3. Méthodologie de paramètrisation proposée pour l estimation de la cinétique du traceur au moyen des méthodes d analyse développées Proposition des modèles de paramètrisation Dans le but d effectuer une analyse plus approfondie de l évolution temporelle du traceur menu de l analyse factorielle AFSIM, nous pouvons supposer que le facteur qui augmente au cours du temps puis se stabilise serait plutôt lié au facteur tissulaire. Ceci est du principalement à l accumulation du radiotraceur dans ce compartiment à la fin de l acquisition. Cette propriété peut être exploitée pour proposer plusieurs modèles paramétriques appliqués à la modalité d imagerie TEP et qui permettront de corriger les limites des paramètres cliniques en TEP dans la littérature. L'exploitation d'un modèle permet alors de remonter à l'évolution temporelle de la cinétique du traceur et donc l évaluation du métabolisme du glucose dans le tissu d intérêt. Parmi ces modèles, nous pouvons citer ces paramètres tels que définis par les équations suivantes : Paramètre 1 proposé : K1 K 1 d ( p). ( f dt t tm 1 IT T t tt ( )). (78) Paramètre 2 proposé : K2 K t tm I ( p). f ( ). 2 T T t t t1 (79) Paramètre 3 proposé : K3 K ttm tt11 3 IT ( p). ft ( t) IT ( p). ft t tt tt 1 m1 ( ). (80) Avec p le pixel de l image, tm (pic du comptage du temps) le temps mesuré à la fin du premier passage, IT(p) et ft(t) sont respectivement les images factorielles et les facteurs associés au compartiment tumoral résultant de l analyse factorielle. Le premier modèle caractérise la pente (la dérivée de la fonction ft(t)) de l'évolution temporelle de la quasi-totalité du traceur jusqu à ce que la quantité du traceur soit retenue dans le compartiment tumoral. Le deuxième paramètre reflète la surface de l'évolution temporelle de la quasi-totalité du traceur jusqu à ce que le taux du comptage du traceur atteigne une valeur maximale. Et enfin, le troisième modèle proposé définit la différence entre 104
108 la surface de l'évolution temporelle de la quasi-totalité du traceur et la surface de ce traceur lorsqu'il quitte la tumeur. Dans l objectif de trouver une corrélation possible entre les modèles paramétriques empiriques proposés et les paramètres cliniques SUVmax, ki67, CD34, CD105 et BF, le coefficient de corrélation de Pearson a été calculé pour évaluer et analyser cette corrélation. Pour la population de patients, aucune corrélation significative entre les paramètres proposés et SUVmax (r = avec le paramètre K1, r = 0.5 avec le paramètre K2, r = avec le paramètre K3), ni pour ki67 score (r = avec le paramètre K1, r = avec le paramètre K2, r = avec le paramètre K3), ni pour CD34 score (r = avec le paramètre K1, r = avec le paramètre K2, r = 0.07 avec le paramètre K3) ni pour CD105 score (r = 0.37 avec le paramètre K1, r = 0.23 avec le paramètre K2, r = 0.01 avec le paramètre K3), ni pour BF score (r = avec le paramètre K1, r = avec le paramètre K2, r = avec le paramètre K3). Tel que discuté avec les cliniciens, ont confirmé la non signification physiologique de ces paramètres proposés et l'utilité des recherches plus poussées qui peuvent être envisagées pour l estimation de la cinétique du traceur caractérisant la tumeur Méthode originale d estimation de la cinétique du traceur : Quantification précoce du métabolisme glucidique en imagerie TEP à partir de la fixation du traceur dans le compartiment tumoral Chaque ROI de l'image TEP correspond à l'activité du traceur dans la tumeur. Elle correspond à la somme des activités d'un certain nombre de structures anatomiques et fonctionnelles. Ainsi, les courbes associées à la région d intérêt sont un mélange de courbes fondamentales, chacune ayant une interprétation physiologique. Dans notre cas, l approche de l analyse factorielle développée (AFSIM), appliquée à chaque zone tumorale, sert à séparer le compartiment vasculaire, ainsi que le compartiment purement tumoral et à évaluer leurs activités et leurs variations dans le temps. À partir des résultats de l approche AFSIM, la nouvelle séquence d'images qui ne contient que les zones des régions d intérêt est décomposée comme suit: X p ( t) 2 k 1 f ( t). I k k ( p). (81) Cette décomposition est réduite en deux facteurs : X p ( t) A ( t) T ( t) f ( t). I ( p) f ( t). I ( p), p p A A T T (82) 105
109 Étant donnée que Ap(t) est le compartiment vasculaire et Tp(t) est le compartiment purement tumoral. La mesure du taux de comptage d un traceur dans une région d intérêt et l utilisation des modèles dynamiques permettent de déterminer le métabolisme glucidique. L'exploitation d'un modèle permet alors de remonter à l'évolution temporelle du traceur et donc au métabolisme de la tumeur. L'objectif est de trouver une corrélation possible entre le paramètre physiologique SUVmax et le paramètre résultant du compartiment tumoral reflétant le métabolisme précoce du glucose de la tumeur. Le nombre de compartiments est une information a priori qui pourrait être fourni par les cliniciens. Si nous supposons l'existence de deux compartiments dans la ROI tumorale (compartiment tumorale et vasculaire), alors le paramètre k devrait être fixé à deux (voir l équation 14). L'analyse factorielle (AFSIM) fournit l évolution temporelle du traceur dans le compartiment vasculaire A(t), ainsi que dans le compartiment tumorale T(t). Dans le but d effectuer une analyse plus approfondie de l évolution temporelle du traceur, nous supposons les courbes synthétiques, reflétant les compartiments vasculaire A(t) et tumoral T(t), présentées à la figure 51. Nous pouvons supposer que le facteur qui s'accumule au début de l'acquisition serait lié au passage vasculaire du traceur. Tandis que, le facteur qui se stabilise à la fin de l'acquisition serait plutôt lié au facteur tissulaire. t m Figure 51. Courbes synthétiques reflétant les compartiments A(t) et tumoral T(t) Ce modèle postule pendant le premier passage du traceur à travers le tissu, le traceur est retenu pour une période de temps pendant laquelle la concentration du traceur dans la veine est très faible. Ce temps (td) [71] est plus long avec des traceurs fortement extractés tels que le 18 F-FDG. À l instant td [28] la quasi-totalité de la quantité du traceur est retenue dans la ROI et la sortie veineuse est proche de zéro. Lorsque t est inférieur à td, le taux du comptage atteint 106
110 un maximum lorsque l'entrée vasculaire à la ROI cesse; à la fois cette entrée et le drainage veineux sont à zéro [77]. Ce calcul est valable à tm (pic du comptage du temps) [28], le moment où la quantité du traceur dans la tumeur est la plus grande, c'est à dire à la fin du premier passage [71]. Afin d'évaluer le métabolisme du glucose pour une quantification précoce, nous proposons un nouveau paramètre empirique évalué par la dynamique du premier passage du 18 F-FDG pour le diagnostic précoce du cancer du sein. Le nouveau paramètre empirique KFPQ peut être adapté au pic du comptage du temps tm. Ce paramètre est défini par l'équation suivante: K FPQ tt m tt 1 I ( p). T d dt ( f T ( t)) tt 11 tt m1 I ( p). T d dt ( f T ( t)), (83) avec p est le pixel de l image, tm (pic du comptage du temps) est le temps mesuré à la fin du premier passage, IT(p) et ft(t) sont respectivement les images factorielles et les facteurs associés au compartiment tumoral résultant de l analyse factorielle (1FSIM) (voir l équation 82). Ce modèle caractérise la différence entre la pente (la dérivée de la fonction ft(t)) de l'évolution temporelle de la quasi-totalité du traceur lorsque la quantité du traceur est retenue dans le compartiment tumoral, (c'est à dire lorsque le taux du comptage du traceur atteint une valeur maximale) et la pente de ce traceur lorsqu'il quitte la tumeur. Conclusion Dans ce chapitre, nous avons développé un outil d aide au diagnostic assisté par ordinateur en imagerie TEP pour le diagnostic automatique et précoce du cancer du sein à l aide de l approche avancée AFSIM. L objectif a été d extraire un nouveau paramètre clinique, nommé KFPQ, qui est analogue au taux du métabolisme du 18 F-FDG accumulé dans la tumeur à la fin de l acquisition (quantification tardive). Ce nouveau paramètre permet de prédire une quantification précoce du métabolisme glucidique dans la ROI tumorale, au moyen d une extension d une carte des dissimilarités locales proposée en niveaux de gris, et évalué durant le premier passage du traceur 18 F-FDG dans les images TEP précoces (quantification précoce) avant la chimiothérapie. 107
111 Chapitre IV : Validation et Performances de l Approche Développée Dans les Applications Cliniques 1. Données pour l évaluation : Du synthétique vers des cas pathologiques Données synthétiques Exemple d une séquence d images TEP Description des cas pathologiques : bases de données Validation de la méthode d analyse proposée pour l estimation du tissu d intérêt Comparaison locale entre les images clés Exemples de résultats de la détection des changements Les images clés avec les méthodes MTVC ou M - M Les images clés avec les méthodes GM-QM ou MAGMA Injection d a priori et seuillage Résultats sur plusieurs patients Résultats sans injection d a priori et seuillage Résultats avec injection d a priori et seuillage Validation de la méthode d analyse proposée AFSIM Validation de la méthode d analyse proposée AFSIM sur des données synthétiques Validation des données synthétiques en se basant sur le critère de taille et la forme Validation des données synthétiques en tenant compte de l effet de volume partiel Validation des données synthétiques en se basant sur le critère de recouvrement et le bruit Validation de la méthode d analyse proposée AFSIM sur des données réelles : séquences d images dynamiques TEP Analyse orthogonale par l analyse des correspondances Analyse oblique Interprétation des résultats de la méthode d analyse proposée AFSIM Validation de la méthode de paramètrisation proposée pour l estimation de la cinétique du traceur en TEP au moyen des méthodes d analyse développées Résultat de l application de la méthode d analyse proposée AFSIM sur la région d intérêt tumorale Résultats de segmentation sur une image TEP Résultats de la méthode d analyse proposée AFSIM sur une ROI Evaluation du modèle du paramètre proposé pour l estimation de la cinétique du traceur
112 Introduction Durant ce chapitre, nous allons présenter et interpréter les résultats d expérimentation des différentes étapes de notre approche proposée pour l extraction et la modélisation de la cinétique du traceur en imagerie TEP en vue da la caractérisation de la tumeur, plus spécifiquement le cancer du sein. Nous commençons par présenter les résultats d expérimentation de la méthode pour l estimation de la région d intérêt au moyen d une extension de la carte des dissimilarités locales à valeurs réelles (CDLVR) proposée en niveaux de gris. À partir de la région d intérêt estimée, nous montrons les résultats d expérimentation de l application de la méthode d analyse proposée basée sur l analyse factorielle des séquences d images médicales (AFSIM) sur le tissu d intérêt pour estimer la variation de concentration du traceur 18 F-FDG dans différentes fonctions physiologiques. Nous devrons par la suite extraire un nouveau modèle paramètrique KFPQ permettant une quantification automatique et précoce du métabolisme glucidique en imagerie TEP qui permet de corriger les limites du SUV. Nous démarrons par valider les différentes méthodes en se basant sur une séquence d images synthétiques. Puis, nous passons à une séquence d images dynamiques TEP. 1. Données pour l évaluation : Du synthétique vers des cas pathologiques 1.1. Données synthétiques Avant de considérer les cas pathologiques réels, nous avons discuté avec l équipe clinique de quelques données synthétiques possibles qui peuvent impliquer et décrire des cas réels avec plusieurs variations logiques. Pour cela, nous avons particulièrement discuté de la forme possible de la tumeur qui peut réellement avoir lieu en se basant sur la forme aigue généralement détecté dans des cas des pathologies malignes et la forme courbée caractéristique de cas des tumeurs bénignes. Un autre critère qui a été également discuté est la taille de la tumeur. Lors de notre approche développée et en coopération avec l équipe clinique, il a suffit de distinguer une région de petite taille. Cela constitue un résultat très important. 109
113 La figure 52 montre un exemple de séquence d images synthétiques Xp(t) qui contient un bruit aigu. Cette séquence est obtenue selon la formule suivante : X p ( t) f ( t). I1( p) f2( t). I2( p) ( 1 p ). (84) Figure 52. Exemple d une séquence d images synthétiques 1.2. Exemple d une séquence d images TEP Nous avons reçu un examen TEP au 18 F-FDG du tissu tumoral du sein du Centre LECLERC de lutte contre le cancer à Dijon France. C est un ensemble de 540 fichiers DICOM qui représente 12 volumes de données de 45 coupes chacun de taille 144*144 (figure 53). Un volume est composé d une pile d images de coupes transversales du tronc. Il s agit de données dynamiques composées d une séquence d acquisitions, chacune dure 10 secondes. Onze volumes sont acquis pour un examen. Les acquisitions étant très courtes, les volumes TEP sont de très mauvaise qualité (variance du bruit «speckle» est de l ordre de 0.5). Volume de 45 coupes y z x t1 t2 t11 t12 t Figure 53. Un examen TEP au FDG : 12 Volumes de données de 45 coupes chacun 110
114 Une étape de prétraitement de données est effectuée sur les séquences d'images dynamiques en entrée. Cette étape a pour but d'améliorer la qualité des images TEP et d'augmenter le rapport signal sur bruit pour chaque cinétique. Nous proposons d'appliquer une moyenne spatiale des coupes qui ne contiennent que la région tumorale. Quelques images sont présentées dans la figure 54. Figure 54. Quelques coupes d une séquence d images TEP pour un patient 1.3. Description des cas pathologiques : bases de données Pendant la période de mars 2010 à août 2011, une vingtaine de patients (âge moyen : 46 ans, intervalle d âge : ans) ayant un cancer du sein invasif ont été recrutés pour une imagerie 18 F-FDG TEP avant tout traitement. Le critère considéré pour le choix des patients est un diagnostic récent du cancer du sein avec une tumeur primaire large de 2 cm de diamètre. Les patientes enceintes ou qui allaitent, les patients qui ne supportent pas la réalisation d une série d imagerie et les patients ayant des tumeurs inflammatoires sont exclus de cette liste. Le stade clinique déterminé selon la classification TNM des tumeurs malignes a été évalué par des examens cliniques, mammographie, ultrasongraphie, radiographie pulmonnaire, scintigraphie osseuse et les images TEP au 18 F-FDG. Ces patients ont été inclus dans des essais cliniques dans le principal objectif de déterminer la réponse pathologique à la chirurgie. Une étude complémentaire avec la 18 F-FDG PET a été planifiée et incluse dans le consentement informé. 111
115 2. Validation de la méthode d analyse proposée pour l estimation du tissu d intérêt A terme et pour un examen, onze images (I1 à I11) sont à exploiter. Chacune de ces images contient la zone tumorale qui est a priori localisée dans les seins, l activité cardiaque et vasculaire et d autres activités à l extrémité de l image. Ces composantes sont représentées dans la figure 55. Figure 55. Les composantes de chaque image TEP Dans l ensemble des résultats présentés ici, nous cherchons à estimer une tumeur éventuelle (ROI). À partir de la séquence temporelle, la méthode décrite précédemment dans le chapitre 3 permet d obtenir une image segmentée. Nous considérons avoir obtenu une bonne localisation lorsqu une seule composante connexe est présente et que cette composante est correctement positionnée. La validation est réalisée par un médecin Comparaison locale entre les images clés À partir d'une série temporelle de onze images où chaque image est normalisée, deux images clés sont calculées. La localisation est réalisée par la détection des changements robuste entre ces deux images clés. La première image est conçue pour contenir que l'activité cardiaque et vasculaire alors que, la seconde image contient en plus de l'activité tumorale. La validation des résultats de la construction des images clés est obtenue sur un ensemble de 27 cas réels. 112
116 Pour un exemple d un patient, nous présentons quelques résultats présentant la comparaison locale avec les différentes approches pour les différentes méthodes afin de construire les images clés telles que sont présentées dans la figure 56. (a) I1 (b) I2->11 (c) M (d) M (e) Moyenne Géométrique (f) Moyenne Quadratique (g) Moyenne Géométrique (h) Moyenne Arithmétique Figure 56. Diverses images clés : (a,b) la méthode MTVC, (c,d) la méthode méthode GM-QM et (g,h) la méthode MAGMA M - M, (e,f) la 113
117 La première méthode est la méthode MTVC. La première image clé, figure 56(a), est de qualité inférieure par rapport à la seconde image clé, figure. 56(b). Ceci est expliqué par le fait que la première image I1 clé est obtenue à partir d'une seule image de la séquence TEP, tandis que la seconde image est obtenue à partir de dix images I2->11. Nous obtenons une meilleure qualité d images clés avec les moyennes généralisées. La première image contient essentiellement une partie faible de l activité cardiaque et vasculaire, alors que la deuxième contient en plus l activité tumorale, une grande partie de l activité cardiaque et vasculaire que s ajoute et d autres activités à l extrémité. Entre ces deux images, le niveau d activité du traceur varie fortement dans la région tumorale. Mais la région cardiaque présente cependant des variations d intensités entre les deux images clés, ce qui risque de produire un faux positif dans la comparaison. La région tumorale est difficilement détectable par seuillage. La première observation est l infériorité des résultats avec la méthode M - M. Les interprétations sont similaires aux résultats obtenus à partir de la méthode MTVC. Nous remarquons l'image obtenue à partir de M, figure 56(c), ne contient que la valeur minimale alors que l'image obtenue à partir de M, figure 56(d), contient la valeur maximale correspondante à toutes les informations. La valeur minimale et la valeur maximale sont déterminées à partir de 11 valeurs pour un seul pixel. Par conséquent, il n y a pas l effet de moyennage qui améliore la qualité d'image. Entre ces deux images clés, le niveau de l activité du traceur varie fortement dans la région tumorale. Encore une fois, cela est dû à la qualité des images comparées. Ainsi, un exemple des résultats de deux méthodes différentes est proposé pour la construction des images clés : la méthode MAGMA et la méthode basée sur les moyennes Géométrique- Quadratique (GM-QM). Nous nous concentrons sur les moyennes géométrique, arithmétique et quadratique: la moyenne géométrique, comme indiquée dans figure 56(e) et figure 56(g), contient essentiellement la région tumorale en activité faible, l activité cardiaque et vasculaire et d autres activités à l extrémité, alors que la moyenne arithmétique et la moyenne quadratique, respectivement dans la figure 56(h) et la figure 56(f), contiennent en plus l activité tumorale. Nous remarquons que les deux images sont compatibles en termes de contenu. Ceci confirme que les deux méthodes MAGMA et GM-QM permettent d obtenir deux images clés qui contiennent des informations similaires à la méthode MTVC. Nous en déduisons que ces dernières sont utilisées pour mettre en évidence les changements entre les images clés, à savoir l'activité tumorale tout en améliorant la qualité des images TEP. 114
118 Seulement avec les méthodes MAGMA ou GM-QM, la région tumorale apparait clairement et est ainsi aisément détectable par seuillage Exemples de résultats de la détection des changements Pour un exemple d un même patient, nous présentons quelques résultats présentant la comparaison locale avec les différentes approches (DPP, SSIM et CDLVR) pour les différentes méthodes (MTVC, M - M, GM-QM et MAGMA). Les images clés proposées et leurs comparaisons locales correspondantes sont présentées dans la figure 57 pour une meilleure compréhension de l analyse que nous proposons. Nous considérons avoir obtenu une bonne localisation lorsqu une seule composante connexe est présente et que cette composante est correctement positionnée Les images clés avec les méthodes MTVC ou M - M La différence pixel à pixel (DPP) avec les méthodes MTVC et M - M, respectivement en figure 57(a) et en figure 57(d), est trop sensible aux variations de la région cardiaque. Les niveaux de gris de cette image rendent difficile la discrimination de la région tumorale de la région cardiaque. La mesure locale avec l approche SSIM avec les méthodes MTVC et M - M, telle qu elle apparaît respectivement dans la figure 57(b) et dans la figure 57(e), n est pas pertinente en raison du choix de la taille de la fenêtre. Le résultat de carte des dissimilarités locales à valeurs réelles (CDLVR) avec les méthodes MTVC et M - M, respectivement en figure 57(c) et en figure 57(f), est plus robuste aux faibles variations et plus sélective. La région tumorale est ainsi aisément détectable par seuillage. 115
119 (a) DPPI1, I2->11 (b) SSIMI1, I2->11 (c) CDLVRI1, I2->11 (d) DPP M - M (e) SSIM M - M (f) CDLVR M - M (g) DPPGM-QM (h) SSIMGM-QM (i) CDLVRGM-QM (j) DPPGM-AM (k) SSIMGM-AM (l) CDLVRGM-AM Figure 57. Un exemple de résultats des comparaisons locales pour différentes méthodes avec les mêmes images affichées dans figure 56. La première colonne contient les résultats des comparaisons locales avec l'approche DPP. La deuxième colonne contient les résultats des comparaisons locales avec l'approche SSIM et la dernière colonne contient les résultats des comparaisons locales avec l'approche CDLVR. La première ligne contient les résultats de la méthode MTVC pour les différentes approches. La deuxième ligne contient les résultats de la M - méthode M pour les différentes approches. La troisième ligne contient les résultats de la méthode GM-QM pour les différentes approches et la dernière ligne contient résultats de la méthode MAGMA pour les différentes approches. 116
120 Les images clés avec les méthodes GM-QM ou MAGMA Comme déjà mentionné dans la section précédente, les méthodes GM-QM et MAGMA ont le même comportement de point de vue l information dans la région tumorale. La différence pixel à pixel, avec les méthodes GM-QM et MAGMA, respectivement en figure 57(g) et en figure 57(j), est moins sensible aux faibles variations de la région cardiaque et vasculaire ainsi que à l extrémité que le résultat de la différence pixel à pixel obtenu avec la méthode MTVC et M - M M - M. La région tumorale apparait plus clairement (qu avec MTVC et ), mais il reste des résidus en région cardiaque. Les performances de la mesure locale avec l approche SSIM sont améliorées avec les méthodes GM-QM et MAGMA respectivement en figure 57(h) et en figure 57(k). Ces interprétations résident aux images comparées. La CDLVR, avec les méthodes GM-QM et MAGMA, telle que sont affichées dans la figure 57(i) et la figure 57(l), est plus sélective que la CDLVR obtenue avec les méthodes MTVC et M - M sur cet exemple, la région tumorale apparait clairement et est ainsi aisément détectable par seuillage. Nous confirmons qu avec seulement l'approche CDLVR, une meilleure localisation de la tumeur avec les méthodes GM-QM et MAGMA est obtenu Injection d a priori et seuillage Afin de renforcer l efficacité du seuillage, nous avons choisi d injecter les connaissances a priori disponibles sur la localisation de la tumeur. Etant donné que nous cherchons à détecter des tumeurs du sein, nous avons construit l image représentée en figure 58. Cette image code de façon simple la localisation potentielle des tumeurs. L injection de l a priori consiste à multiplier cette image avec la comparaison locale pour les différentes approches, comme présentée en figures 59, 60 et 61. Le seuil final est le seul paramètre des différentes méthodes. Sa valeur a été choisie empiriquement, mais est identique pour tous les examens. La deuxième colonne des figures 59, 60 et 61 contient un exemple d une image finale seuillée. Pour le même exemple d un patient, nous présentons ici les résultats d une localisation favorable d une tumeur présentant la comparaison locale avec les différentes approches (DPP, SSIM et CDLVR) pour les différentes méthodes (MTVC, M - M, GM-QM et MAGMA). Nous obtenons ainsi une bonne localisation lorsqu une seule composante connexe est présente et que cette composante est correctement positionnée. 117
121 Figure 58. Injection de l a priori de localisation (a) A.DPPI1, I2->I11 (b) Image finale seuillée (c) A.DPP M - M (d) Image finale seuillée (e) A.DPPGM-QM (f) Image finale seuillée (g) A.DPPGM-AM 118 (h) Image finale seuillée Figure 59. Un exemple de résultats d une localisation favorable pour l approche DPP avec les mêmes images affichées dans les figures 56 et 57. La première colonne contient l injection de l a priori de localisation avec l'approche DPP. La deuxième colonne contient le résultat de l image finale seuillée avec l approche DPP pour les différentes méthodes
122 (a) A.SSIMI1, I2->I11. (b) Image finale seuillée (c) A.SSIM M - M (d) Image finale seuillée (e) A.SSIMGM-QM (f) Image finale seuillée (g) A.SSIMGM-AM (h) Image finale seuillée Figure 60. Un exemple de résultats d une localisation favorable pour l approche SSIM avec les mêmes images affichées dans les figures 56 et 57. La première colonne contient l injection de l a priori de localisation avec l'approche SSIM. La deuxième colonne contient le résultat de l image finale seuillée avec l approche SSIM pour les différentes méthodes 119
123 (a) A.CDLVRI1, I2->I11 (b) Image finale seuillée (c) A.CDLVR M - M (d) Image finale seuillée (e) A.CDLVRGM-QM (f) Image finale seuillée (g) A.CDLVRGM-AM (h) Image finale seuillée Figure 61. Un exemple de résultats d une localisation favorable pour l approche CDLVR avec les mêmes images affichées dans les figures 56 et 57. La première colonne contient l injection de l a priori de localisation avec l'approche CDLVR. La deuxième colonne contient le résultat de l image finale seuillée avec l approche CDLVR pour les différentes méthodes 120
124 Pour l approche DPP, nous observons qu un simple seuillage ne permet pas toujours la localisation de la tumeur. Encore une fois, ceci est dû à la sensibilité de la l approche DPP aux variations de la région cardiaque. Un exemple patient d un résultat défavorable montre la difficulté pour l approche DPP de localiser la tumeur avec les différentes méthodes, tel qu il apparaît dans la figure 62. (a) I1 (b) I2->11 (c) A.DPPI1, I2->I11 (d) Image finale seuillée (e) M (f) M (g) A.DPP M - M (h) Image finale seuillée (i) Moyenne Géométrique (j) Moyenne Quadratique (k) A.DPPGM-QM (l) Image finale seuillée (m) Moyenne Géométrique (n) Moyenne Arithmétique (o) A.DPPGM-AM (p) Image finale seuillée Figure 62. Un exemple patient d un résultat défavorable des images clés présentant la comparaison locale avec l approche DPP dont la région tumorale n est pas détectable par seuillage avec les différentes méthodes 121
125 En outre, la mesure locale avec l approche SSIM n est pas pertinente en raison du choix de la taille de la fenêtre. Un exemple patient d un résultat défavorable montre la difficulté pour l approche SSIM de localiser la tumeur avec les différentes méthodes, tel qu il apparaît dans la figure 63. (a) I1 (b) I2->11 (c) A.SSIMI1, I2->I11 (d) Image finale seuillée (e) M (f) M (g) A.SSIM M - M (h) Image finale seuillée (i) Moyenne Géométrique (j) Moyenne Quadratique (k) A.SSIMGM-QM (l) Image finale seuillée (m) Moyenne Géométrique (n) Moyenne Arithmétique (o) A.SSIMGM-AM (p) Image finale seuillée Figure 63. Un exemple patient d un résultat défavorable des images clés présentant la comparaison locale avec l approche SSIM dont la région tumorale n est pas détectable par seuillage avec les différentes méthodes 122
126 Nous en déduisons que l approche CDLVR avec les deux méthodes GM-QM et MAGMA peut être efficacement utilisée pour mettre en évidence les différentes caractéristiques spatiales en améliorant la qualité de l image TEP. Nous remarquons que les méthodes GM- QM et MAGMA sont les plus robustes aux petites variations. Cependant, nous pouvons éviter le recalage des images puisque nous disposons d une méthode de comparaison robuste à de faibles écarts locaux. Ces deux derniers exemples montrent, dans la plupart des cas, la localisation défavorable de la tumeur. Il confirme que c'est seulement avec l approche CDLVR pour les deux méthodes GM-QM et MAGMA, un simple seuillage peut permettre une bonne localisation du cancer du sein Résultats sur plusieurs patients Résultats sans injection d a priori et seuillage Nous avons testé notre approche sur un panel de 27 examens issus de patients différents. Le seuil final est le seul paramètre de la méthode. Sa valeur a été choisie empiriquement, mais est identique pour tous les examens. Le tableau 2 contient le nombre de patients dont la tumeur est bien localisée sans l injection de l a priori pour les différentes méthodes. Tableau 2. Nombre de patients dont la tumeur est bien localisée sans l a priori de l injection sur un total de 27 examinés, analysés à la fois par les méthodes MTVC, MAGMA, GM-QM et présentant la comparaison efficace avec les approches DPP, SSIM et CDLVR. M - M Méthodes Approches DPP CDLVR SSIM MTVC MAGMA GM-QM M - M La première observation est l infériorité des résultats avec les méthodes MTVC et M - M. Nous remarquons aussi que le nombre de patients bien localisés avec la méthode GM-QM est comparable à celui de la méthode MAGMA. Ces deux dernières méthodes ont le même comportement de point de vue l information dans la localisation de la tumeur. 123
127 Dans tous les cas, les résultats de la localisation avec la CDLVR sont meilleurs (18 sur 27). La CDLVR est plus efficace que DPP et SSIM pour attraper les dissimilarités locales vu la bonne qualité des images comparées Résultats avec injection d a priori et seuillage Nous avons testé les mêmes approches avec injection d a priori sur un panel de 27 examens issus de patients différents. Le tableau 3 contient le nombre de patients dont la tumeur est bien localisée pour les différentes méthodes. Tableau 3. Nombre de patients dont la tumeur est bien localisée avec l a priori de l injection sur un total de 27 examinés, analysés à la fois par les méthodes MTVC, MAGMA, GM-QM et présentant la comparaison efficace avec les approches DPP, SSIM et CDLVR. M - M Méthodes Approches DPP CDLVR SSIM MTVC MAGMA GM-QM M - M La première observation est l infériorité des résultats avec l approche SSIM. Pas plus de 13 patients (sur 27) peuvent être bien localisés. Encore une fois, cela est dû à la difficulté rencontré avec SSIM pour attraper les dissimilarités locales. La seconde observation est l infériorité des résultats avec la méthode M - M. Ceci est du à la qualité des images clés comparées. Cette interprétation est similaire aux résultats résultant de la méthode MTVC. Mais nous gardons cette dernière méthode dans notre étude comparative car elle est justifiée d une manière physiologique. Nous remarquons aussi que le nombre de patients bien localisés avec la méthode GM-QM est comparable à celui de la méthode MAGMA. Les performances entre ces deux méthodes sont similaires. Ceci représente une étude comparative efficace. Ainsi, notre espace d étude comparative est encore limité aux résultats tels que affichés dans le tableau 4. Ce tableau contient le nombre de patients dont la tumeur est bien localisée : trois façons de calculer les images clés (MTVC, GM-QM et MAGMA) et deux approches pour la comparaison locale (DPP et CDLVR). Une meilleure localisation est obtenue avec les 124
128 méthodes GM-QM et MAGMA qu avec la méthode MTVC. Ceci est du à la bonne qualité des images clés comparées avec les méthodes GM-QM et MAGMA. Tableau 4. Nombre de patients bien localisés sur un total de 27 examinés, analysés à la fois par les méthodes MTVC, MAGMA et GM-QM présentant la comparaison efficace avec les approches DPP et CDLVR. L avant dernière ligne présente le nombre de patients analysés à la fois par les méthodes MTVC et MAGMA. La dernière ligne présente le nombre de patients analysés à la fois par les méthodes GM-QM et MAGMA. La dernière colonne présente le nombre d examens analysés à la fois par les approches DPP et CDLVR Méthodes Approches DPP CDLVR DPP CDLVR MTVC MAGMA GM-QM MTVC MAGMA GM-QM MAGMA Pour l approche DPP, une meilleure localisation est obtenue avec les images clés GM-QM et MAGMA. Lorsque les images appropriées sont prêtes (comme avec les méthodes GM-QM et MAGMA), la DPP peut être efficace que grâce à la bonne définition de la comparaison locale. Mais quand des images comparées sont de mauvaise qualité (comme le cas de la méthode MTVC), les résultats eux aussi sont mauvais. Dans tous les cas, les résultats de la localisation avec la CDLVR sont mieux (20 sur 27). Ces bonnes performances sont obtenues grâce à la bonne information locale fournie par la CDLVR. Afin de mieux comprendre les résultats, le tableau 4 comprend également le nombre de patients dont la tumeur est bien localisés à la fois par l approche DPP et l approche CDLVR, et avec les méthodes MTVC, GM-QM et MAGMA. MAGMA ou GM-QM améliore l information trouvée par la méthode MTVC, car quasiment tous les bons cas de la méthode MTVC sont inclus dans la méthode GM-QM ou MAGMA. La deuxième observation est que l approche CDLVR améliore la localisation trouvée par l approche DPP, car quasiment tous les bons cas de l approche DPP sont inclus dans l approche CDLVR. 125
129 La dernière ligne confirme que les deux méthodes (GM-QM et MAGMA) ont le même comportement de point de vue l information dans la localisation de la tumeur. Finalement, la CDLVR localise l activité tumorale plus efficacement que les approches DPP et SSIM. Sur les sept échecs, trois examens sont assez délicats à analyser, car les tumeurs sont de très petite taille. La CDLVR est instructive malgré la mauvaise qualité des images TEP. La CDLVR est plus efficace pour attraper les dissimilarités locales. Cette localisation sera utilisée comme germe dans une segmentation par Contour actif ou Level Set. L idée est de chercher à obtenir une segmentation automatique. 3. Validation de la méthode d analyse proposée AFSIM 3.1. Validation de la méthode d analyse proposée AFSIM sur des données synthétiques Validation des données synthétiques en se basant sur le critère de taille et la forme Le critère de taille a été également discuté. Il a suffit de distinguer une région de petite taille qui correspond à la taille de la tumeur du sein. Figure 64. Résultat de l analyse factorielle (AFSIM) Les résultats de l analyse factorielle montrent qu il existe trois compartiments. Deux compartiments sont représentés dans la figure 64 : le disque et le carré, le bruit n est pas représenté. Chaque compartiment est associé à une fonction physiologique. Ceci confirme que nous avons une bonne correspondance spatiale et temporelle entre les données originales et les résultats obtenus en utilisant l approche de l analyse factorielle (AFSIM). 126
130 Validation des données synthétiques en tenant compte de l effet de volume partiel Les effets de volume partiel résultant des résolutions spatiales médiocres des modalités d imagerie fonctionnelle constituent une des limites les plus importantes nuisant à l'utilisation quantitative de l'imagerie d émission. L effet de volume partiel (EVP) est la conséquence de la résolution spatiale limitée (l effet flou) et de l échantillonnage grossier choisi des images qui biaise les mesures réalisées sur les images ([91], [100]). Afin de prendre en compte l'effet de volume partiel (EVP) [120] dans notre étude d expérimentation, un filtre gaussien passe-bas est utilisé. En outre, nous avons appliqué le filtre gaussien M fois sur l'image originale de la séquence (M variant de 1 à 3) afin de faire varier le degré de l EVP. En effet, le filtre gaussien se rapporte à l effet de la faible résolution spatiale sur l'aspect visuel des frontières entre différentes régions de l'image surtout quand le nombre d itérations de filtrage augmente. Les figures 65, 66 et 67 montrent les résultats d expérimentation sur des images synthétiques en tenant compte de l EVP utilisant un filtre gaussien de taille 3 * 3 avec M = 1, 2 et 3 respectivement. Nous observons dans ces figures les deux effets : d'une part, le profil de la structure imagée est étalé et flou. D autre part, les frontières de l'objet sont rendues difficiles à discerner. I 1 I 2 Figure 65. Simulation de l'effet de volume partiel en utilisant un filtre gaussien de taille 3x3. I1 est le compartiment de disque et I2 est le compartiment carré. I 1 I 2 Figure 66. Simulation de l'effet de volume partiel en utilisant deux fois un filtre gaussien de taille 3x3. I1 est le compartiment de disque et I2 est le compartiment carré. 127
131 Figure 67. Simulation de l'effet de volume partiel en utilisant trois fois un filtre gaussien de taille 3x3. I1 est le compartiment de disque et I2 est le compartiment carré. Les résultats de l'analyse factorielle (AFSIM) montrent qu'il ya deux compartiments, comme affiché sur les figures 68, 69 et 70. Chaque compartiment est associé à une fonction physiologique. Cela confirme qu'une bonne correspondance spatiale et temporelle est obtenue entre les données initiales et les résultats obtenus en utilisant l'approche AFSIM avec l EVP. (a) (b) (c) (d) Figure 68. Résultats de AFSIM appliquée à la séquence des images synthétiques avec l EVP utilisant un filtre gaussien de taille 3x3: (a), (c) Image & Facteur du compartiment carré et (b), (d) l'image et facteur du compartiment de disque. (a) (b) (c) (d) Figure 69. Résultats de AFSIM appliquée à la séquence des images synthétiques avec l EVP utilisant deux fois un filtre gaussien de taille 3x3: (a), (c) Image & Facteur du compartiment carré et (b), (d) l'image et facteur du compartiment de disque. 128
132 (a) (b) (c) (d) Figure 70. Résultats de AFSIM appliquée à la séquence des images synthétiques avec l EVP utilisant trois fois un filtre gaussien de taille 3x3: (a), (c) Image & Facteur du compartiment carré et (b), (d) l'image et facteur du compartiment de disque Validation des données synthétiques en se basant sur le critère de recouvrement et le bruit Pour des évaluations quantitatives, nous avons utilisé deux métriques : l erreur absolue moyenne et l indice Cohen s Kappa (IK). L indice IK mesure le taux de recouvrement entre l image segmentée et la vérité terrain : 2VP IK, 2VP FN FP (85) où VP, FN et FP sont respectivement les nombres des vrais positifs, des faux négatifs et les faux positifs. La fiabilité du recouvrement de sources en absence de bruit est évaluée en maintenant une position fixe du disque et en translatant le carré de gauche à droite. Afin d'évaluer la robustesse de l'approche proposée, un bruit «speckle», l une des caractéristiques de l image TEP, est ajouté aux données avec trois différentes valeurs de variance : variance = 0,5, 1 et 1,5. Nous supposons que la plage de ces valeurs de variance correspond à une variance typique de variance des images TEP. En effet, pour une séquence des images TEP utilisée dans cette étude, nous évaluons la variance dans la région tumorale dont l'intensité est normalisée entre 0 et 1. Nous avons trouvé une valeur maximale de l ordre de dans ces ROI tumorales de chaque image de la séquence TEP pour une base de 20 patients. Par ailleurs, pour le choix des valeurs de variance du bruit «speckle», nous évaluons la variance dans la région bruitée des images synthétiques et nous avons trouvé une valeur 129
133 maximale de l ordre de , et pour une variance = 0,5, 1 et 1,5 respectivement. Figure 71. Validation métrique obtenue à partir des variations de niveau du bruit: un bruit de moyenne = 0 et de variance = 0,5 (trait rouge), un bruit de moyenne = 0 et de variance = 1 (trait bleue), un bruit de moyenne = 0 et de variance = 1,5 (trait pointillé bleu). À gauche: erreur absolue moyenne. A droite: indice Kappa Le recouvrement maximal correspond à la position 6 (figure 71). Nous pouvons remarquer que les meilleures performances sont atteintes quand le recouvrement décroit c est à dire quand l index kappa est élevé et vice versa pour l erreur absolue moyenne. Ceci confirme que notre approche est fiable dans le contexte de séparation de sources. Selon la figure 71, quand la variance du bruit augmente, la performance de la séparation des sources est la même. Ceci confirme l effet du débruitage après l application de l analyse factorielle. À partir de l indice de l erreur absolue moyenne (figure 71), nous pouvons observer une erreur moyenne maximale de l ordre de 0,11. Ceci correspond à 10% de l amplitude des données ce qui parait raisonnable. L erreur moyenne ne permet pas de donner une idée sur la distribution spatiale de l information par rapport à la vérité terrain. C est pourquoi nous avons recours à calculer l indice Kappa. Cet indice est égal à 0,74 correspondant au maximum de recouvrement (figure 71). Ceci confirme qu une bonne correspondance spatiale et temporelle est obtenue entre la forme originale et la forme obtenue après l application de l approche de l analyse factorielle (AFSIM) (IK>=0,7). Ces interprétations confirment la fiabilité de notre approche puisque il a été montré une meilleure robustesse à la variation de bruit (même effet du bruit) et au fort recouvrement. Ces critères sont adaptés aux images TEP. 130
134 3.2. Validation de la méthode d analyse proposée AFSIM sur des données réelles : séquences d images dynamiques TEP La résolution du modèle AFSIM procède en deux étapes. La première estime le bruit présent dans chaque pixel en utilisant les propriétés du bruit lorsqu elles sont connues. Nous avons démontré que les données TEP qui ont une distribution de Poisson, la décomposition orthogonale appropriée est l'analyse des correspondances [87]. Et la deuxième estime les fonctions physiologiques et les compartiments associés de façon à respecter les connaissances qui les concernent. Dans ce qui suit, nous allons donner une description détaillée des résultats de chaque étape Analyse orthogonale par l analyse des correspondances 6 x Figure 72. Affichage du vecteur moyen (première courbe en haut à gauche) et des vecteurs propres issus du calcul de l AC Figure 73. Affichage de l image moyenne (première image en haut à gauche) et des 12 images propres issues du calcul de l AC Comme le montrent les figures ci-dessus (figures 72 et 73), l analyse des correspondances a décomposé la séquence en images propres et cinétiques associées (composantes factorielles). 131
135 Ce mode de représentation a l avantage d être synthétique, car il résume l essentiel des dynamiques dans la séquence d images sur les premières composantes. En revanche, il ne nous permet pas d appréhender facilement la séquence d images. En effet, les images propres contiennent des valeurs négatives et les vecteurs propres présentent également des valeurs positives et négatives. La combinaison linéaire de ces poids et courbes est difficile à interpréter. L exploitation directe de l analyse des correspondances n est pas possible et nécessite l utilisation des contraintes de positivité pour permettre une interprétation physiologique des composantes extraites. Tableau 5. Mesures de variance associées à l analyse des correspondances Valeur propre Pourcentage de variance Nous estimons que l espace contenant les données non bruitées soit d origine le vecteur moyen et engendré par les deux premières composantes factorielles issues du calcul de l analyse des correspondances. Cet espace représente % (voir tableau 5) de la variance de données. La seconde étape consiste à identifier les fonctions physiologiques et les compartiments associés dans cet espace via une analyse oblique. Pourcentage de variance cumulée w x w x w x w x w1+w Analyse oblique Pour appliquer l analyse oblique, nous avons fixé le nombre de facteurs à trois. Les contraintes utilisées sont la positivité des compartiments et des fonctions associées. Un nombre d itérations égal à 100 était suffisant pour avoir la convergence de l algorithme Interprétation des résultats de la méthode d analyse proposée AFSIM L analyse factorielle montre qu il existe trois compartiments différents (voir Figure 74): -Le compartiment du ventricule droit. La courbe associée est décroissante en fonction du temps. En effet, le radiotraceur s accumule en premier temps dans le ventricule droit puis il migre vers la cavité gauche. -Le compartiment de la cavité gauche. Sa courbe physiologique est retardée et décroissante en fonction du temps. Ceci s explique par l arrivée du radiotraceur à la cavité gauche après un certain temps, son accumulation, puis sa migration vers le compartiment extra cardiaque. 132
136 -Le compartiment extra cardiaque. Sa courbe physiologique croît en fonction du temps puis se stabilise. Ceci est dû essentiellement, à l accumulation du radiotraceur dans ce compartiment Compartiment du Ventricule Droit 0.3 Compartiment de la Cavité Gauche 0.2 Compartiment Extra Cardiaque Figure 74. Résultat de l analyse factorielle basée sur l analyse des correspondances appliquée sur une séquence d images TEP au FDG Les pourcentages qui représentent les contributions relatives de chacune de ces trois structures fondamentales sont illustrés sur le tableau suivant : Tableau 6. Contribution relative de chacun des compartiments Cette étude ([119], [87]) a montré que l'analyse factorielle (AFSIM) appliquée à une séquence d'images dynamiques TEP ne pouvait pas être discriminante pour évaluer l'évolution temporelle dynamique du traceur, afin de préciser les compartiments d'une tumeur. Interprétations concernant la tumeur La figure correspondante au ventricule droit montre qu il existe deux parties de l image en hypo signal. La première partie est relative au ventricule gauche et la deuxième concerne la tumeur du sein. De ce fait, nous déduisons que la tumeur se comporte en partie comme le ventricule gauche. D autre part, dans la figure représentant l extra cardiaque, nous constatons que la tumeur est en hyper signal. Donc, nous pouvons déduire qu elle se comporte en partie comme l extra cardiaque. Nom du compartiment Contr(k) en % Ventricule Droit Cavité Gauche Extra Cardiaque
137 Pour mieux interpréter ces résultats, nous avons tracé manuellement, une région d intérêt autour de la tumeur du sein par le moyen du logiciel Image J. Via ce logiciel, nous avons extrait les différentes valeurs moyennes de la région d intérêt en fonction du temps. Et nous avons tracé la courbe moyenne relative à la tumeur. (Voir Figure 75) x 105 Courbe moyenne relative à la tumeur valeur moyenne dans la région temps Figure 75. Courbe moyenne relative à la tumeur La courbe relative à la tumeur est similaire à la fonction physiologique associée au compartiment extra cardiaque. Nous concluons que le comportement de la tumeur est plus proche de celui de l extra cardiaque que du ventricule gauche. 4. Validation de la méthode de paramètrisation proposée pour l estimation de la cinétique du traceur en TEP au moyen des méthodes d analyse développées Pour mieux comprendre l'importance de l'analyse factorielle, nous essayons d'analyser ses spécificités par rapport aux zones des régions d'intérêt. La région d'intérêt (ROI) segmentée présente deux avantages: la première est de permettre une bonne séparation des compartiments physiologiques. La seconde est une quantification automatique et précoce du métabolisme glucidique durant le premier passage du FDG, mesurée dans le tissu d intérêt des images dynamiques TEP afin de caractériser le cancer du sein. 134
138 4.1. Résultat de l application de la méthode d analyse proposée AFSIM sur la région d intérêt tumorale Résultats de segmentation sur une image TEP Chaque ROI de l'image TEP correspond à l'activité du traceur dans la tumeur. Elle correspond à la somme des activités d'un certain nombre de structures anatomiques et fonctionnelles. Ainsi, les courbes associées à la région d intérêt est un mélange de courbes fondamentales, chacune ayant une interprétation physiologique. Dans le but de déterminer la ROI tumorale, un objet de forme circulaire a été utilisé pour initialiser l ensemble des niveaux de la méthode de segmentation. Résultats de segmentation par «Contour actif» Dans toutes ces figures suivantes, le contour initial est placé avec la méthode manuelle et il évolue pour épouser la forme de la lésion malgré la présence du bruit «speckle» qui est un bruit très abondant. Nous gardons activées les améliorations apportées au contour actif (voir annexe 4). Nous remarquons d après les résultats obtenus que la forme du contour initial et son emplacement influent sur l algorithme du «snake». Cependant, l initialisation présente l inconvénient principal pour cette méthode. En effet, l inconvénient principal de cette méthode est qu elle reste relativement sensible à leur initialisation pouvant provoquer des chutes dans des minima. De plus, leur convergence vers la forme finale peut être relativement lente. Résultats de segmentation par «Level set» L'avantage de cette méthode est que les changements topologiques tels que la fusion et la scission du contour ou de la surface sont pris en compte implicitement. Ce modèle est largement utilisé en segmentation d'images TEP pour leur capacité à intégrer les processus de détection et de chaînage des contours en un seul processus de minimisation d'énergie. Pour ces raisons, la méthode «level-set» avait été choisi pour l'estimation de la ROI tumorale sur chaque image TEP. La figure 76 montre le résultat de segmentation de la ROI tumorale avec la méthode «Levelset». Nous pouvons observer qu à travers l algorithme itératif de segmentation (100 itérations sont suffisantes pour faire une bonne convergence), l évolution du niveau de l ensemble des fonctions «Level-set» localise efficacement la ROI tumorale. 135
139 Figure 76. Evolution de la méthode «Level set». A gauche : Initialisation de la courbe. A droite : résultat obtenu par la méthode «Level set» Résultats de la méthode d analyse proposée AFSIM sur une ROI La figure 77 représente les résultats de l analyse factorielle appliquée à la ROI tumorale. On peut observer que deux différents compartiments sont obtenus : le compartiment vasculaire A(t): les courbes physiologiques associées décroissent au cours du temps. le compartiment tumoral T(t): sa courbe physiologique augmente au cours du temps puis se stabilise. Ceci est du principalement à l accumulation du radiotraceur dans ce compartiment à la fin de l acquisition. Figure 77. Résultat de l analyse factorielle appliquée sur une ROI d une séquence d images TEP A Gauche : Les images et les facteurs du compartiment tumoral A Droite : Les images et les facteurs du compartiment vasculaire 136
140 4.2. Evaluation du modèle du paramètre proposé pour l estimation de la cinétique du traceur L étude proposée a été testée sur 25 patients. Seulement 20 cas pathologiques ont été retenus pour avoir un cancer du sein visible. L utilisation d une large base de données nous donne la possibilité d obtenir des informations et des diagnostics précis précoces pour le cancer du sein. Dans cette partie, nous allons évaluer le nouveau paramètre empirique proposé KFPQ basé sur les courbes du compartiment tumoral obtenu. La figure 78 montre des courbes typiques de l activité vasculaire mesurée au niveau de l aorte (tracé en pointillé) et l absorption du 18 F-FDG par la tumeur. Elle montre que l activité du premier passage a été délivrée au compartiment tumoral au pic du comptage du temps tm. Cette relation entre ce temps tm et la fonction d entrée vasculaire est utilisée pour vérifier que à tm, la concentration veineuse est presque nulle puisque Ap(tm) est très proche de zéro. Ces courbes sont utilisées pour mesurer le pic du comptage du temps tm. Le temps tm est fixé de façon empirique par la superposition des deux courbes précédentes (Figure 78). Le temps tm est le temps quand la sortie veineuse est proche de zéro et le taux de la quantité du traceur atteint une valeur maximale dans le compartiment tumoral. Dans les cas étudiés, ce temps est égal à 10 minutes. tm=10 Figure 78. Choix du temps du tm 137
141 Le tableau 7 donne les valeurs du paramètre empirique proposé KFPQ calculé selon l équation 83, et les paramètres SUVmax, Ki67, CD34, CD105 et BF pour les différents patients étudiés. Pour l indice SUVmax, il est calculé selon l équation suivante: SUV max C( t), injected_dose body_weight (86) où C(t) est la concentration sanguine du 18 F-FDG et les autres paramètres donnés par l équipe clinique avant la chimiothérapie néoadjuvante. Tableau 7. Etude des cas évaluant les différents paramètres médicaux empirqiues et le paramètre empirique proposé KFPQ chez les patients ayant un cancer du sein localement avancé Patients K FPQ SUV max Ki67 CD34 CD105 BF Patient Patient Patient Patient Patient5 Patient6 Patient7 Patient8 Patient9 Patient10 Patient11 Patient12 Patient13 Patient14 Patient15 Patient16 Patient17 Patient18 Patient19 Patient
142 Dans l objectif de trouver une corrélation entre le paramètre empirique KFPQ avant la chimiothérapie et les paramètres SUVmax, Ki67, CD34, CD105 et BF, le coefficient de corrélation de Pearson a été calculé pour évaluer et analyser la corrélation. Tous les tests étaient 2-coupes "2-sided et la valeur de P inférieure à 0,05 sont considérés significative. Les analyses ont été réalisées en utilisant le logiciel SPSS (version 13.0; SPSS Inc.). Pour la population de patients, nous avons trouvé une forte corrélation positive entre les paramètres SUVmax et KFPQ (r= avec la valeur test P=0.002). Par contre, aucune corrélation significative entre KFPQ et ki67 score, ni pour CD34 score ni pour CD105 score, ni pour BF score (r = 0.14, r =0.38, r =0.01 et r =0.17) respectivement, la valeur de P était statistiquement non significative). La figure 79 montre la corrélation entre les paramètres SUVmax et KFPQ où nous avons pu obtenir une corrélation linéaire. Nous n avons observé aucun intérêt à présenter les coefficients de corrélation pour les autres paramètres car aucune corrélation positive n a été obtenue. Figure 79. Validation du paramètre proposé KFPQ pour l'évaluation du SUVmax à l'aide d'un modèle du premier passage. Excellente corrélation linéaire est trouvée entre ces deux paramètres. Le nouveau paramètre empirique présenté dans notre étude est analogue au taux du métabolisme du 18 F-FDG accumulé dans la tumeur à la fin de l acquisition (quantification retardée). Ce nouveau paramètre permet de prédire le métabolisme glucidique dans la ROI tumorale à travers les images précoces (quantification précoce) avant la chimothérapie. Ceci peut être considéré comme une indication significative pour la quantification et l évaluation de la progression de la maladie durant le traitement. 139
143 Conclusion Ce chapitre est une concrétisation de notre étude qui a permis de bien évaluer notre approche proposée pour l extraction et la modélisation de la cinétique du traceur. Cette évaluation comporte essentiellement trois étapes : l estimation de la région d intérêt au moyen d une extension de la mesure de dissimilarité locale proposée en niveaux de gris, suivie de l application de la méthode d analyse proposée basée sur l analyse factorielle des séquences d images médicales (AFSIM) sur le tissu d intérêt pour estimer la variation de concentration du traceur 18 F-FDG dans différentes fonctions physiologiques. À partir du comportement purement tumoral, nous pouvons extraire un nouveau modèle paramètrique KFPQ permettant une quantification automatique et précoce du métabolisme glucidique en imagerie TEP caractérisant le cancer du sein. 140
144 Conclusion Générale 141
145 L imagerie médicale est un domaine de la médecine qui a connu des évolutions considérables. Elle a un rôle prééminent dans le diagnostic de multiples pathologies, dans leur suivi thérapeutique et même dans l'aide à la thérapie. L imagerie fonctionnelle, telle que la TEP, se considère comme la modalité technologique la plus évoluée. De telles modalités comportent des séquences d images qui suivent l'évolution au cours du temps d'un radiotraceur, donnant des informations fonctionnelles et quantitatives. Plusieurs outils et approches ont été proposés pour le traitement de ces diverses informations métaboliques pour plusieurs tâches d automatisation. En effet, parmi les tâches cliniques, celles qui sont manuelles consomment beaucoup de temps et ne sont pas efficaces pour un diagnostic précis. Ces tâches manuelles peuvent être effectuées efficacement de manière automatisée et peuvent être améliorées en utilisant des outils de traitements puissants développés tels que l analyse factorielle des séquences d'images médicales (AFSIM) et les approches de comparaison locales dans le but de l extraction et la modélisation de la cinétique du traceur en imagerie TEP caractérisant le cancer du sein. Nous avons pu de ce fait profiter d une formation sur le cancer du sein, ainsi qu en matière d informations sur les techniques d imagerie médicale et en particulier l image TEP, qui était notre cible dans ce sujet de recherche. Nous avons balayé de même les paramètres cliniques accessibles par la partie clinique en imagerie TEP comme le métabolisme glucidique et le flux sanguin ainsi que leurs performances et leurs limites. Nous avons exposé par la suite les méthodes d analyse de séquences d images fonctionnelles telles que l'analyse factorielle des séquences d'images médicales (AFSIM) et sa relation avec la méthode d estimation de la région d intérêt au moyen d une extension proposée de la carte de dissimilarité locale à valeurs réelles (CDLVR) des images en niveaux de gris. Nous avons montré que l approche d analyse proposée est efficace pour la caractérisation quantitative des examens TEP au 18 F-FDG. Cette approche commence par une identification automatisée de la région d'intérêt (ROI en anglais pour Region Of Interest) tumorale à partir de la séquence des images dynamiques TEP. Ensuite, la méthode d analyse basée sur l analyse factorielle des séquences d'images médicales (AFSIM) est appliquée à la ROI estimée afin d estimer l'évolution temporelle de la concentration du traceur 18 F-FDG dans les deux compartiments physiologiques: purement tumoral et vasculaire. A partir du compartiment tumoral, nous pouvons alors évaluer la cinétique du traceur caractérisant la tumeur. 142
146 Plus spécifiquement, il s agit de déterminer un nouveau paramètre empirique KFPQ (KFPQ en anglais KFirst Pass Quantification). Il est calculé à partir des deux compartiments obtenus dans la région d intérêt tumorale et tel que évalué durant le premier passage du traceur 18 F-FDG dans les images TEP précoces. Dans notre contexte, les résultats obtenus à partir de nos simulations ont été satisfaisants d après les métriques de validation. De plus, ils ont eu l accord et la validation de deux parties cliniques différentes. Comme perspective de ce travail de recherche, nous envisageons réaliser les taches suivantes : - Nous proposons d explorer d avantage notre travail en étudiant également le passage à la 3D, en travaillant sur les volumes TEP directement. - Nous étendrons d avantage la méthode d analyse factorielle des séquences d'images médicales avec des contraintes parcimonieuses pour estimer correctement les fonctions physiologiques recherchées. En effet, une solution satisfaisant les contraintes de positivité n est pas nécessairement la solution physiologique recherchée, et il peut être nécessaire d introduire des a priori plus précis (par exemple recherche d une fonction monotone croissante). - Nous explorons le résultat de la méthode proposée pour l estimation de la région d intérêt dans le but d atteindre une nouvelle approche de segmentation en imagerie TEP en combinant le modèle statistique et la mesure floue. 143
147 Liste des Annexes 144
148 Annexe 1 o Menu Fichier Pour charger le jeu de données correspondant à la simulation numérique, il suffit de sélectionner "Importer des données image" dans le menu fichier. Cette opération ouvre une fenêtre qui permet de se déplacer à travers des répertoires. Une fois nous avons ouvert le fichier de type interfile, ce jeu de données doit apparaître en bas de la fenêtre de travail sous la forme d'une icône. Pour visualiser les données, nous double-cliquons sur l'icône ou sur le petit carré et la série d'images apparaît. o Barre d outils Lorsqu'un jeu de données est sélectionné, la barre d'outils sous la barre de menu se remplit avec des icônes. Ces icônes donnent accès à de nombreuses commandes d'aide à la visualisation ou à l'exploration. Les icônes n'apparaissent que lorsqu'elles correspondent à une opération qui peut être appliquée au jeu de données sélectionné. Echelle de couleurs Nous pouvons modifier l'échelle de couleurs en cliquant sur l'icône "Echelle de couleurs". Mode cinéma L'icône représentant une pellicule photographique permet de visualiser la séquence en mode cinéma. En ce mode, nous pouvons augmenter ou diminuer la vitesse de défilement en cliquant sur les icônes correspondantes. Nous cliquons autant de fois que nous le souhaitons pour atteindre la vitesse de défilement voulue. Mode élément par élément Pour passer en mode élément par élément, nous cliquons sur l'icône correspondante, à gauche de l'icône cinéma. En ce mode, nous pouvons passer à l'élément suivant en cliquant sur les flèches droite ou gauche de la barre d'outils, ou faire défiler la série en utilisant le curseur coulissant, ou encore entrer directement un numéro d'image dans le champs approprié. A ce propos, nous pouvons à tout moment modifier la taille d'une fenêtre de visualisation et les proportions de l'image sont toujours conservées. Mode séquence éclatée Il est possible de retourner au mode séquence éclatée en cliquant sur l'icône représentant 4 images disposées en carré. Dans ce mode, nous pouvons sélectionner et désélectionner une image particulière en cliquant dessus. Un contour vert indique l'image sélectionnée. Nous pouvons saturer l'échelle de gris d'une image sélectionnée en déplaçant le curseur associé à 145
149 l'échelle de couleur horizontale figurant en haut de la fenêtre de travail de Pixies. Si nous "désélectionnons" une image (en cliquant dessus de nouveau), nous ne pouvons plus modifier l'échelle de gris. En effet, toutes les images ne partagent pas les mêmes minimum et maximum, ce qui rend cette opération impossible. Valeurs extrêmes partagées Pour visualiser toutes les images avec un minimum et un maximum commun, nous cliquons sur l'icône "Valeurs extrêmes partagées" (icône avec deux échelles de gris). Par défaut, le noir correspond à la valeur 0 et le blanc correspond à la valeur maximale dans les images. Les éventuelles valeurs négatives sont représentées en bleu. Ne pas aligner la valeur 0 avec le 0 de l'échelle de couleurs Si nous souhaitons que le noir corresponde à la valeur minimale dans les images, nous cliquons sur l'icône "Ne pas aligner la valeur 0 avec le 0 de l'échelle de couleurs" (icône comportant un zéro barré). Nous pouvons remarquer que les commandes telles que "Partage des valeurs extrêmes" et "Alignement de la valeur 0" ont deux états (partager ou ne pas partager, aligner ou ne pas aligner). Seul l'icône qui permet de changer d'état apparaît, c'est à dire l'icône montrant l'état qui n'est pas l'état courant. o Menu Générique Il existe un nombre d'outils génériques pour effectuer des opérations arithmétiques entre des séries d'images ou entre des images. Ces transformations sont géométriques, mathématiques ou des filtrages. La plupart de ces opérations figurent dans le menu "Générique". 146
150 Annexe 2 Curseur exploration Il permet d afficher le décours temporel associé à un pixel quelconque de la séquence originale. Agrégation Cette opération permet de modifier l échantillonnage spatial des images pour passer par exemple d images 256 x 256 à des images 64 x 64. Elle est utile lorsque le signal présent dans les images est très bruité puisqu elle permet d améliorer le rapport signal/bruit en regroupant des pixels. Elle permet aussi de réduire le volume total des données. Sélection de trixels Un trixel désigne le décours temporel d un pixel. Grace à la seléction de trixels, il est possible de sélectionner un sous ensemble de données sur lequel nous appliquons la suite du traitement. Pour choisir ce sous ensemble, il existe plusieurs façons de le faire : Soit nous utilisons une région d intérêt que nous traçons préalablement au moyen du menu région, soit nous indiquons de ne conserver que N ou X% des trixels (les N ou X% des trixels présentant la plus forte intensité de signal, où l'intensité du signal est définie comme étant l'aire sous la courbe temporelle). Une dernière option pour la sélection de trixels consiste à choisir un seuil, tel qu'uniquement les trixels dont l'intensité est supérieure à ce seuil seront conservés. Analyse orthogonale L'analyse orthogonale a pour vocation de séparer le signal du bruit dans les données analysées, et fournit également une représentation utile des données. Elle nécessite le choix d une métrique bien définie. En théorie, la métrique doit être choisie en fonction des propriétés statistiques du bruit affectant les données, pour effectuer une séparation optimale du bruit et du signal. En pratique, en scintigraphie planaire ou dans tous les cas où le bruit est un bruit de Poisson, la métrique doit être celle de l'analyse factorielle des correspondances (AFC). Pour toutes les autres modalités, ou en cas de doute, la métrique de l'analyse en composantes principales (ACP) doit être utilisée. De façon générale, l'examen des résultats de l'analyse orthogonale aide à déterminer le nombre de composantes physiologiques nécessaires pour résumer les informations sous-jacentes à la séquence d'images originale. Les images propres et les vecteurs propres associés à l analyse orthogonale n'ont pas d'interprétation physiologique immédiate. C'est la raison pour laquelle il est nécessaire d'effectuer ensuite une analyse oblique. 147
151 Analyse oblique Le principe de l'analyse oblique est d'identifier de nouvelles fonctions qui sont des combinaisons linéaires des vecteurs propres résultants de l'analyse orthogonale, et qui ont des interprétations physiologiques. Pour déterminer ces fonctions, il est nécessaire d'introduire des informations a priori. Ces informations sont le nombre de facteurs et un ensemble de contraintes. Dans l'édition Micro de Pixies, seules les deux contraintes fonctions et les deux contraintes compartiments les plus communes sont disponibles : - Fonctions et compartiments positifs. Dans de nombreuses applications, ces contraintes sont nécessaires car seul le signal positif a un sens. - Fonction constante, si nous savons a priori que la fonction que nous recherchons doit être constante. -Compartiment constant dans une région, si nous avons de bonnes raisons de croire qu'un compartiment doit être nul dans une région d'intérêt. Cette région doit être tracée au préalable à partir du menu "Régions". Projection Cette étape est nécessaire pour revenir à l'échantillonnage spatial original des données (échantillonnage modifié lors de l'étape d'"agrégation") et pour avoir une représentation des données exclues de l'analyse lors de l'étape "Sélection de Trixels". 148
152 Annexe 3 Définition 1 (TDPG) L idée d une transformée en distance pondérée par le niveau de gris a été introduite par D. Rutovitz en 1968 [94, 44]. Cette distance a été programmée de plusieurs manières par Vossepoel. A. M, Smeulders. A.W.M, et Van der Broek. K [104], Piper. J et Granum. E [83]... La transformée en distance pondérée par le niveau de gris entre deux pixels est définie dans [68, 112] comme la plus petite somme pondérée des valeurs de niveaux de gris le long du chemin discret entre ces deux points. Il correspond à l'estimation de l aire de la surface sous une courbe (chemin). Elle s'appuie sur le coût suivant entre deux pixels adjacents: w GWD 1 ( i) ( I( ti) I( ti 1)). ti ti 1, 2 (1) où t i t i1 est la distance spatiale entre les deux pixels et I(ti) est la valeur de niveaux de gris de I pour le pixel ti. Définition 2 (TDPEC) La transformée en distance TDPEC a été développé par Toivanen. P.J [105, 107]. TDPEC a pour chemin entre deux points défini comme le chemin de dimension n+1, une contrainte que se repose sur l hyper-surface définie par les valeurs de niveaux de gris. Il est exprimé comme étant la trajectoire géodésique minimale entre ces deux points. Elle s'appuie sur le coût suivant: w W DOCS ( i) ( I( t ) I( t i )) t t 2 i1 i i1 2. (2) Chacune de ces transformées en distance (GWDT, WDTOCS) peut être calculé d une manière rapide avec une bonne approximation par l algorithme «two-pass algorithm». Ces cartes des dissimilarités locales définies par la transformée GWDT et la transformée WDTOCS ont été comparées dans une application médicale [67]. La transformée WDTOCS fournit davantage d'informations que la transformée GWDT, mais le principal problème avec cette distance est l'inconstance des unités. En considérant les valeurs de niveaux de gris à n+1 dimensions de l'image, la méthode mêle les valeurs spatiales et de l'intensité. Pour faire face à ce problème, les valeurs des images peuvent être redimensionnées par un coefficient, masquant l'inconstance. Mais cela conduit à un réglage des paramètres. Généralement, les transformées 149
153 GWDT et WDTOCS comptent encore sur la présence d'un fond et une forme. Beaucoup d'images en niveaux de gris ne satisfont pas à cette hypothèse. Les transformées GWDT et WDTOCS ne sont donc pas une solution générale face à ce problème. Une solution intéressante peut être trouvée avec la transformée en distance continue [2]. Cette transformée en distance est basée sur un concept général du «pixel blanc» et «les pixels voisins blancs les plus proches trouvés». Le «pixel blanc» devient la «valeur lumineuse maximale» et le «pixel voisin blanc le plus proche trouvé» est remplacé par " une valeur lumineuse maximale accumulant sur le quartier». Cette dernière définition semble plus une réponse "ad-hoc" pour le problème abordé sans une interprétation consécutive. Un autre ensemble de solutions ne reposent pas sur la distinction entre un fond et une forme. L'idée principale consiste à intégrer un signal à N dimensions (N = 2 pour les images) dans un espace à N + 1 et à calculer des distances à partir de chaque point de cet espace pour le sousgraphe du signal [109]. Avec une telle représentation, une image de niveaux de gris est considérée comme une forme binaire dans un espace à trois dimensions. Dans [32], l'image est représentée en tant qu une surface, nous rappelons les principales définitions de Wilson [109]. Ces deux transformées se distinguent des autres car elles gèrent les niveaux de gris d'une manière différente (par soustraction plutôt que sommation) qui se rapproche de la notion de distance appliquée alors dans la troisième direction de l'espace [72]. GWDT utilise aussi bien les niveaux de gris des pixels traversés le long d'un chemin P que la distance spatiale entre les deux extrémités de P, tout comme WDTOCS avec une utilisation différente des niveaux de gris. WDTOCS utilise la différence des niveaux de gris des pixels traversés, ce qui correspond à la généralisation de la longueur. En effet cela revient à une distance spatiale dans R 2 associée à une différence de valeur de niveau de gris. Définition 3 (Sous-graphe du signal) Etant donné une image F définie dans 2 X dont les valeurs sont dans un ensemble Y donné (c est à dire F : X Y ), son sous-graphe F est défini comme suit: ( x, y) X. Y : y F( x). (3) F Dans cette définition, X désigne les coordonnées spatiales et Y l'intensité ou les valeurs d'éclairement. 150
154 Annexe 4 Variation du paramètre d élasticité Nous considérons les paramètres β= et γ=1 constants et nous effectuons une variation du paramètre α pour voir son influence sur l évolution du contour actif ainsi que l influence du contour initial. (a) (b) Figure A. 1. Variation du paramètre α sur une image TEP (a) Contour initial. (b) Image segmentée avec α =2. (a) (b) Figure A. 2. Variation du paramètre α sur une image TEP (a) Contour initial. (b) Image segmentée avec α =
155 (a) (b) Figure A. 3. Variation du paramètre α sur une image TEP (a) Contour initial. (b) Image segmentée avec α =6 Après différentes simulations, nous avons ajusté α à 2. Variation du paramètre de rigidité Nous considérons les paramètres α =2 et γ=1 constants et nous effectuons une variation du paramètre β pour voir son influence sur l évolution du contour actif. (a) (b) Figure A. 4. Variation du paramètre β sur une image TEP (a) Contour initial. (b) Image segmentée avec β =
156 (a) (b) Figure A. 5. Variation du paramètre β sur une image TEP (a) Contour initial. (b) Image segmentée avec β =1 (a) Figure A. 6. Variation du paramètre β sur une image TEP (a) Contour initial. (b) Image segmentée avec β =2 Après différentes simulations, nous avons ajusté β à 1. Variation du pas temporel Nous considérons les paramètres α =2 et β =1 constants et nous effectuons une variation du (b) paramètre γ pour voir son influence sur l évolution du contour actif. 153
157 (a) Figure A. 7. Variation du paramètre γ sur une image TEP (a) Contour initial. (b) Image segmentée avec γ =0.5 (b) (a) Figure A. 8. Variation du paramètre γ sur une image TEP (a) Contour initial. (b) Image segmentée avec γ =2 Après différentes simulations, nous avons ajusté γ à 2. Variation du contour initial Nous appliquons différents contours initiaux pour voir l influence d une telle initialisation tout en considérant les paramètres α =2, β =1 et γ =2. (b) 154
158 Nous imposons une forme aléatoire réalisée manuellement. (a) Figure A. 9. Variation du contour initial sur une image TEP (a) Contour initial. (b) Image segmentée (b) (a) (b) Figure A. 10. Variation du contour initial sur une image TEP (a) Contour initial. (b) Image segmentée 155
159 Bibliographie 156
160 [1] Pixies: image sequence processing software, version 1.11, [2] Arlandis. J., J.-C. Pérez., «The continuos distance transformation : A generalization of the distance transformation for continuos-valued images», Pattern Recognition & Applications, In I. Amsterdam, editor, [3] Aubert. G., M. Barlaud., O. Faugeras., S. Jehan-Besson., Image segmentation using active contours : calculus of variations or shape gradients?, SIAM, [4] Barber D C., The use of principal components in the quantitative analysis of gamma camera dynamic studies, Phys. Med. Biol, [5] Barber. D C., and Nijran. K S., Factor analysis of dynamic radionuclide studies Proc. 3rd World Congr. Of Nuclear Medicine and Biology, vol 1, ed C Raynaud (Paris: WFNMB), (1982) 314. [6] Baudrier. E, comparaison d images binaires reposant sur une mesure locale des dissimilarités Application à la classification, Thèse de doctorat, Université de Reims Champagne-Ardenne,, soutenue le 9 décembre [7] Baudrier. E., G. Millon., F. Nicolier., and S. Ruan., "Une méthode de comparaison d images binaires quantifiant les dissimilarités locales", Colloque Gretsi, Septembre 2007, Troyes. [8] Baudrier. E., F. Nicolier., G. Millon., and S. Ruan., "Binary-image comparaison with local-dissimilarity quantification", Pattern Recognition, vol.41, May 2008, p [9] Bazin. J P, Di Paola. R, B. Gibaud, P. Rougier and M. Tuhiana, Factor analysis of dynamic scintigraphic data as a modeling method. An application to the detection of the metastases Information Processing in Medical Imaging Di Paola and E Kahn (Paris: INSERM) (1980) [10] Benali. H., Foundations of Factor Analysis of Medical Image Sequences: A Unified Approach and Some Practical Implications, Image and vision computing, [11] Benali. H., A statistical model for the determination of the optimal metric in factor analysis image sequences (FAMIS), Phys. Med. Biol,
161 [12] Ben Abdallah M., Zehani S., Maalej M., Hsairi M., La tunisie Médicale, Vol 87 ( n 07 ) : , 2009 [13] A. Berriolo-Riedinger., C. Touzery., J.M. Riedinger., M. Toubeau., B. Coudert., L. Arnould., C. Boichot., A. Cochet., P. Fumoleau., F. Brunotte., [18F]FDG-PET predicts complete pathological response of breast cancer to neoadjuvant chemotherapy, Eur J Nucl Med Mol Imaging (2007), 34: [14] BRIANDET. Ph., «Les réseaux d images médicales», Revue de l ACOMEN, [15] Brownell. G.L., A history of positron imaging. Présentation faite à l'occasion des célébrations de la 50éme année de service de l'auteur auprès du Massachussetts General Hospital, october [16] Brownell. G.L., C.A. Burnham., S. Wilensky., S. Aranow., H. Kazemi., and D. Strieder., New developments in positron scintigraphy and the application of cyclotron-produced positron emitters. In Proceedings of the Symposium on Medical Radioisotope Scintigraphy, pages , [17] Bryant. T., Improved characterization of liver lesions with liver-phase uptake of liverspecific microbubbles: prospective multicenter study Radiology [18] Buvat. I., Les limites de SUV, Médecine nucléaire 31 (2007) [19] Buvat. I., Analyse factorielle de séquences d images dynamiques, U494 INSERM CHU Pitié-Salpêtrière, Paris. [20] I Buvat., Target apex-seeking in factor analysis of medical image sequences, Phy. Med. Bio, [21] Buvat. I., M. Rodriguez-Villafuerte., A. Todd-Pokropek., Benali. H., Di Paola. R., Comparative assessment of nine scatters correction methods based on spectral analysis using Monte Carlo simulations, J. Nucl. Med. 36 (1995), [22] Buvat. I., Statistical distribution of factors and factor images in factor analysis of medical image sequences. Phys. Med. Biol. 43, ,
162 [23] Buvat. I., S. Hapdey., H. Guillemet., Benali. H., and Di Paola. R., Generalized factor analysis of medical image series (famis) for accurate quantitation, U494 INSERM, Paris, France and Apteryx, Paris, France. [24] Buvat. I., S. Hapdey., Benali. H., A. Todd-Pokropek and Di Paola. R, Spectral Factor Analysis for Multi-isotope Imaging in Nuclear Medicine, IPMI'99, LNCS 1613, pp , [25] Calimero, «cours radiologie» [26] Caselles. V., R. Kimmel., G. Sapiro., Geodesic active contours., Int. J. Comput. Vis., vol. 22, no. 1 (Feb. 1997) pp [27] Charbel MERHEB. M., Optimisation de la reconstruction complète 3D en tomographie d'émission de positons du petit animal par modélisation monte-carlo de la matrice système, Thèse de doctorat, Université Paris XI, Faculté de médecine Paris sud, soutenue le 25 septembre [28] A. Cochet., S. Pigeonnat., B. Khoury., J.M. Vrigneaud., C. Touzery., A. Berriolo- Riedinger., I. Dygai-Cochet., M. Toubeau., O. Humbert., B. Coudert., P. Fumoleau., L. Arnould., F. Brunotte., Evaluation of Breast Tumor Blood Flow with Dynamic First-Pass 18F-FDG PET/CT: Comparison with Angiogenesis Markers and Prognostic Factors, J Nucl Med 2012 ; 53 : 1-9. [29] Comas. L., Modèles et algorithmes pour la scintigraphie cardiaque, thèse de doctorat, Université de Franche-Comté, [30] Compton. A., A quantum theory of the scattering of x-rays by light elements, Physical Review, 21(5) : , [31] Cohen L., On active contour models and balloons, Computer vision, graphics, and image processing: Image Understanding, 53, p , [32] Coquin. D., Bolon. P., "Application of Baddeley's distance to dissimilarity measurement between gray scale images", Pattern Recognition Letters, vol. 22, p , [33] Couturier. O., Jerusalem. G., J. N Guyen., and Hustinx. R., Sequential positron emission tomography using [18F] Fluorodeoxyglucose for monitoring response to 159
163 chemotherapy in metastatic breast cancer, Clinical Cancer Research, 12(21) : , [34] Davatzikos C., Prince J L., An active contour model for mapping the cortex, IEEE Trans. Med. Imag, 14 p.65 80, [35] David. S., Analyse d images pour les études de la réponse thérapeutique en Tomographie par Emission de Positrons, thèse de doctorat, Université Occidentale de Bretagne, [36] Defrise. M, Régine TREBOSSEN, Chapitre 10, La tomographie d émission de positons. [37] Delingette H., Hebert M., Ikeuchi K., Shape representation and image segmentation using deformable surfaces, IEEE Proceedings of Computer Vision and Pattern Recognition, p , [38] Di Paola. R., Handling of dynamic sequences in nuclear medicine, IEEE Transcations on Nuclear Science, [39] Di Paola. R., «Utilisation du traitement des séquences d images dans les études métaboliques», Informatique et Santé Collection, dirigée par P. Degoulet et M. Fieschi Paris, Springer-Verlag France Informatique et Médicaments, volume 2, [40] Dreuille. O., P Maszelin., H Foehrenbach., G Bonardel., JF Gaillard., «Principe et technique de la tomographie par émission de positons (TEP)», Encyclopédie Médico Chirurgicale, A-10:22p, [41] Dreuille. O., Mszelin. P., Foehrenbach. H., Bonardel. G., and Gaillard. J.F., «Principe et technique de la tomographie par émission de positons (tep)» Encyclopédie Médico- Chirurgicale, radiodiagnostic- Principes et techniques d'imagerie, A-10: 1-22, [42] Fedorov. A., Billet. E., Prastawa. M., Gerig. G., Radmanesh. A., Warfield. S. K., Kikinis. R., Chrisochoides. N., Evaluation of brain MRI alignment with the robust hausdorff distance measures, Advances in Visual Computing - Lecture Notes in Computer Science, 2008, 5358: [43] Fisher. B., S. Perkins., A. Walker., E. Wolfart., Hypermedia image processing reference, Department of Artificial Intelligence University of Edinburgh UK,
164 [44] Fouard. C., M. Gedda, An objective comparison between gray weighted distance transforms and distance transforms on curve spaces, 13 th International Conference on Discrete Geometry for Computer Imagery 2006 (DGCI2006), Pages , LNCS 4242, [45] Fox P., Mintun M., "A non-invasive approach to quantitative functional brain mapping with H2 15O and PET", J. Cereb. Blood Flow Metab., vol. 4, p , [46] Frouin F., FAMIS: a software package for functional feature extraction from biomedical multidimensional images, in Comput Med Imaging Graph p [47] Frouin. F., J.P. Bazin., M. Di-Paola., O. Jolivet., and Di Paola. R., FAMIS: a software package for functional feature extraction from biomedical multidimensional images, Comput Medical Imaging Graph, (1992) 16(2): [48] Fu KS., Mui JK., «A survey on image segmentation, Pattern Recognit 1981; 13:3 16. [49] Giammarile. F., «Tep et optimisation de la radiothérapie : comment? Quels traceurs? pourquoi faire? Médecine nucléaire», 31 : , [50] M.Hatt., C. Roux., Visvikis. D., Evaluation de méthodes de segmentation bayésiennes pour l'imagerie TEP en oncologie, Colloque GRETSI, [51] Mathieu.H., Détermination automatique des volumes fonctionnels en imagerie d'émission pour les applications en oncologie, thèse de doctorat, Université de Bretagne Occidentale- Telecom Bretagne, [52] Hermoye. L., Danse. E., Principes et techniques de l échographie, service de radiologie. [53] Hermoye. L., Principes, techniques et contrôle de qualité : Imagerie par Résonance magnétique, Unité de radiodiagnostic. [54] Hoffman EJ., Huang SC., Plummer D., Phelps ME., Quantitation in positron emission tomography: 6, Effet of nonuniform resolution. J Comput Assist Tomogr 1982 ; 6 : [55] Houston. A S., Will factor analysis ever become a universally accepted routine in nuclear medicine Nucl. Med. Commun. 11 (1990)
165 [56] Hume SP., Gunn RN., and Jones T., "Pharmacological constraints associated with positron emission tomographic scanning of small laboratory animals," Eur Jour Nucl Med, vol. 25, pp , [57] Hustinx. R., R. J. Dolin., F. Bénard., A. Bhatnagar., D. Chakraborty., R. J. Smith., S. Jang., and A. Alavi., Impact of attenuation correction on the accuracy of FDG-PET in patients with abdominal tumors : a free-response ROC analysis. European Journal of Nuclear Medicine, 27(9) : , [58] Hustinx. R., F. Bénard., and A. Alavi., Whole-body FDG-PET imaging in the management of patients with cancer. Seminars in Nuclear Medicine, 32(1):35 46, [59] Huttenlocher. D.P., G.A. Klanderman., "Comparing images using the Hausdorff distance", IEEE Transactions on Pattern Analysis and Machine Intelligence, vol. 15, 1993, p [60] Iyer M., Barrio J.R., Nmavari M., Bauer E., Satyamurthy N., Nguyen K., Toyokuni T., Phelps ME., Herschman HR., and Gambhir SS., "8-[F18]Fluoropenciclovir : An improved reporter probe for imaging HSV1-tk reporter gene expression in vivo using PET.," J Nucl Med, vol. 42, pp , [61] Jerusalem. G., N. Withofs., A. Rorive., and Hustinx. R., Positron emission tomography in oncology: an update. La Revue Du Praticien, 57(17): , [62] Kass. M., A. Witkin., D. Terzopoulos., Snakes: Active contour models, International Journal of Computer Vision, vol. 1, pp , [63] Levi. G., U. Montanari., A grey-weighted skeleton, Inform, Control 17, pages 62{91, [64] Mai Khuong N., Approche Bayes-Markov et restauration d'images scintigraphiques, Vannes, [65] Mitchell. H., Image similarity measures, 2010, Springer. [66] Molchanov. I., and P. Teran., "Distance transforms for real-valued functions", Journal of Mathematical Analysis and Applications, vol. 278, Feb. 2003, p
166 [67] Morain-Nicolier. F., J. Landr., S. Ruan., "Gray Level Local Dissimilarity Map and Global Dissimilarity Index for Quality of Medical Images", 7 th IFAC Symposium on Modelling and Control in Biomedical Systems, p , [68] Morain-Nicolier. F., J. Landr., S. Ruan., "Détection d objet par mesure de dissimilarities locales", In XXIIe Colloque GRETSI, 2009 Dijon. [69] Morain-Nicolier. F., J. Landr., S. Ruan., " shape matchingfrom a local dissimilarity measure", In International Conference on Image Processing Theory, Tools and Applications (IPTTA 2010), Paris, France. IEEE [70] Moretti. J.L., Tomodensitométrie CT TDM scanographie, Fac Diderot Univ Paris 7, Hop ST Louis. [71] Mullani. NA., RS. Herbst., RG. O Neil., KL. Gould., BJ. Barron., JL. Abbruzzese., Tumor blood flow measured by PET dynamic imaging of first-pass 18F-FDG uptake: a comparison with 15O-labeled water-measured blood flow, J Nucl Med, (2008) 49: [72] Nathalie. G., Développement d une méthode d évaluation de la qualité en image, Rapport de projet de recherche, Master 2 IMA, Université de La Rochelle, Juin [73] S. A. Nehmeh. S. A., Y. E. Erdi., T. Pan., A. Pevsner., K. E. Rosenzweig., E. Yorke., G. S. Mageras., H. Schoder., P. Vernon., O. Squire., H. Mostafavi., S. M. Larson., and J. L. Humm., Four dimensional (4D) PET/CT imaging of the thorax. Medical Physics, 31(12) : , Dec [74] Nestle U., Kremp S., Schaefer-Schuler A., Sebastian-Welsch C., Hellwig D., Rübe C., Comparison of different methods for delineation of 18F-FDG PET-positive tissue for target volume definition in radiotherapy of patients with non-small cell lung cancer, J Nucl Med 2005; 46:1342 8, [75] Nestle U., Schaefer-Schuler A., Kremp S., Groeschel A., Hellwig D., Rübe C., Target volume definition for 18F-FDG PET-positive lymph nodes in radiotherapy of patients with non-small cell lung cancer, Eur J Nucl Med Mol Imaging, 2007; 34: [76] Nijran. K S and Barber. D C, Faclor analysis of dynamic function studies using a priori physiological information. Phys. Med. Biol, (1986) 31:
167 [77] Nizar. A., Mullani. NA., K. Lance Gould., First-PassMeasurementsof RegionalBloodFlowwith ExternalDetectors, J Nucl Med 24: (1983) [78] Ouksili. Z., Compensation du mouvement respiratoire dans les images TEP/TDM thoraciques, thèse de doctorat, Université de Toulouse, [79] Pagani M., Stone-Elander S., Larsson SA,. Alternative positron emission tomography with non-conventional positron emitters: effets of their physical properties on image quality and potential clinical applications, Eur J Nucl Med 1997; 24: [80] Patlak, C. S., Blasberg, R. G., and Fenstermacher, J. D., (1983). "Graphical evaluation of blood-to-brain transfer constants from multiple-time uptake data", Journal of Cerebral Blood Flow and Metabolism, vol. 3, n 1, pp [81] Pauwels EKJ., Ribeiro MJ., Stoot JHMB., McCready VR., Bourguignon M., and Mazière B., "FDG accumulation and tumor biology", Nucl. Med. Bio., vol. 25, p , [82] Phelp. M.Es., E.J. Hoffman., NA Mullani., and MM Ter-Pogossian., "Application of annihilation coincidence detection to transaxial reconstruction tomography", J. Nucl. Med., vol. 16, p , [83] Piper. J., E. Granum., «Computing distance transformations in convex and non-convex domains, Pattern Recognition 20(6), pages , [84] Pitre. S., Développement d'un imageur gamma haute résolution pour la cancérologie : du traitement chirurgical du cancer à l'étude sur petits animaux, thèse de doctorat, Université Paris7-DENIS DIREROT. [85] Remy P., et Sanson Y., Clinical correlates of (18F) fluorodopa uptake in five grafted parkinsonian patients. Ann Neurol????= [86] Renault. G., Etude de la perfusion en échographie de contraste, thèse de doctorat, Université Paris-Sud XI, [87] Rekik. W., Ketata. I., L. Sallemi., K. Chtourou., M. Ben Slima., S. Ruan & A. Ben Hamida., towards factor analysis exploration applied to positron emission tomography functional imaging for breast cancer characterization, TSSD Transaction (2011), Vol.6, N3. 164
168 [88] Samal. M, M. Kamy, H. Surova, E. Marikova and Z. Dienstbier, Rotation to simple structure in factor analysis of dynamic radionuclide studies. Phys. Med. Biol, (1987) 32: [89] Shin JH., Chung JK., and Roh JK., "Monitoring of neural stem cell using sodium/iodide symporter gene", J Nucl Cardiol, vol. 43(suppl), pp. 238P, [90] Soret. M., Partial - volume effect in PET tumor imaging, Journal of Nuclear Medicine, [91] Soret M., Bacharach S. L., and Buvat I., (2007b), Partial-volume effect in PET tumor imaging, J Nucl Med, 48 : , 50, 147. [92] Sylvie. M., Contribution de l imagerie par résonance magnétique fonctionnelle à l étude de la mémoire chez l enfant, Epilepsies, [93] Talbot. J N., Yolande Petegnief., Virginie de Beco., Valérie Nataf., Maelia Balard., «Bases de la TEP et de la TEP/TDM: machines et médicaments radiopharmaceutiques pour le diagnostic médical», dossier thématique, service de médecine nucléaire et centre TEP, AP- HP Hôpital Tenon et Université Pierre et Marie Curie (Paris 6), (paris 75). [94] Tavitian B., Terrazzino S., Kühnast B., Marzabal S., Stettler O., Dollé F., Deverre J.R., Jobert A., Hinnen F., Bendriem B., Crouzel C. and Di Giamberardino L., "In vivo imaging of oligonucleotides with positron emission tomography", Nature Medicine 4( [95] Tazebay UH., Wapnir IL., Dohan O., Zuckier LS., Zhao QH., Deng HF., Amenta PS., Fineberg S., Pestell RG., and Carrasco N., "The mammary gland iodide transporter is expressed during lactation and in breast cancer", Nature, vol. 6, pp , [96] Ter-Pogossian M., Phelps M.E., Hoffman E.J. and Mullani N.A., "A positron emission transaxial tomograph for nuclear imaging (PETT)", Radiology, vol. 114, p , [97] Toivanen. P., New geodesic distance transforms for gray scale images, Pattern Recognition Letters 17, pages , [98] Toivanen. P., A. Kaarna., H. Kalviainen., «Distance transform in rgb color image compression. Proceedings of the NORSIG Nordic Signal Processing Symposium NORSIG 2000, Kolmarden, Sweden, pages ,
169 [99] Tomei Le Digarcher. S., Détection automatique de fixations radioactives dans les images TEP oncologiques, ingénieur CPE, Lyon, [100] Tylski. P., Caractérisation des tumeurs et de leur évolution en TEP/TDM au 18F-FDG, thèse de doctorat, Université Paris-Sud XI, [101] Vermeulen. PB., G. Gasparini., SB. Fox., Second international consensus on the methodology and criteria of evaluation of angiogenesis quantification in solid human tumours, Eur J Cancer; (2002) 38: [102] Visvikis. D., C. Cheze-Le Rest., and P. Jarritt., «PET technology: current trends and future developments». British Journal of Radiology, 77: , [103] Visvikis. D., C. Cheze Le Rest., and F. Lamare., «Le mouvement respiratoire en imagerie fonctionnelle du cancer : une revue des effets et des méthodes de correction», Traitement de l image et du signal, [104] Vossepoel. A., A. Smeulders., K. V. der Broek., Dioda : delineation and feature extraction of miscroscopical objects, Comp. Prog. Biomedicine 10, pages , [105] Wang. Z., A.C. Bovik., H.R. Sheikh., and E.P. Simoncelli., Image quality assessment : from error visibility to structural similarity, IEEE transactions on image processing, vol. 13, Apr. 2004, p [106] Warburg. O., Wind F., and Neglers E., (1930), On the metabolism of tumors in the body. London, Constable. [107] Warburg. O., On the origin of cancer cells. Science (New York, N.Y.), 123(3191): , [108] Weidner. N., J Pathol., Tumoural vascularity as a prognostic factor in cancer patients: the evidence continues to grow. (1998) 184: [109] Wilson. D.L., A.J. Baddeley., R.A. Owen., "A new metric for grey scale image comparison", International Journal of Computer Vision, vol. 24, p. 5-18, [110] (Site web 1) [111] (Site web 2) 166
170 [112] (Site web 3) [113] (Site web 4) [114] (Site web 5) [115] (Site web 6) [116] (Site web 7) [117] (Site web 8) [118] (Site web 9) Liste des publications [119] Ketata. I., Rekik. W., Morain-Nicolier. F., L. Sellami., K. Chtourou., S. Ruan., A. Ben Hamida., Exploration of the method of factor analysis applied to medical imaging functional, STA 2010, December 19-21(2010), Tunisia. [120] Ketata. I et al., Factor Analysis-based Approach for Early Uptake Automatic Quantification of Breast Cancer by 18F-FDG PET Images Sequence, Biomedical Signal Processing and Control 9(2014) [121] Ketata. I et al., Localisation de tumeurs dans des séquences TEP, par détection de changements au moyen de dissimilarités locales, Coresa
171 Résumé : Les travaux de recherche de cette thèse s inscrivent dans le cadre de la caractérisation du cancer du sein dans le but de réaliser une nouvelle approche pour l extraction et la modélisation de la cinétique du traceur en imagerie TEP. La mesure du taux de comptage d un traceur dans une région d intérêt (ROI) estimée au moyen d une extension d une Carte de Dissimilarité Locale à Valeurs Réelles (CDLVR) proposée en niveaux de gris et l utilisation des modèles dynamiques comme la méthode d Analyse Factorielle des Séquences d'images Médicales (AFSIM) appliquée sur la ROI permettent la quantification automatique et précoce du métabolisme glucidique. Plus spécifiquement, il s agit de déterminer un nouveau paramètre empirique KFPQ. Il est calculé à partir des deux compartiments obtenus dans la région d intérêt tumorale et tel que évalué durant le premier passage du traceur 18 F-FDG dans les images TEP précoces. Abstract: The research of this thesis proposes in the context of the breast cancer characterization in order to achieve a new approach for the extraction and modeling of the tracer kinetics in PET imaging. The measurement of the counting rate of a tracer in a region of interest (ROI) estimated using an extension of a Real Valued Local Dissimilarity Map (RVLDM) proposed grayscale and the use of dynamic models as the method of factor analysis of medical image sequences (FAMIS) applied on the ROI enable an automatic early quantification of glucose metabolism. More specifically, it is to determine a new KFPQ empirical parameter. It is calculated from the two compartments obtained in the region of interest and tumor as assessed during the first pass of the 18 F-FDG tracer in the early PET images. Mots clés: Cancer du sein, Images dynamiques TEP, Méthode d analyse CDLVR, Méthode MTVC, Méthode MAGAM, Méthode d analyse AFSIM, Quantification précoce du traceur KFPQ Key-words: Breast cancer, dynamic PET images, RVLDM Analysis method, MTVC Method, MAGMA Method, FAMIS Analysis method, First Pass Quantification KFPQ. USS- Université de Sfax - Route de l'aéroport km Sfax Tél URCA Ecoles Doctorales Campus Croix-Rouge Bâtiment Enseignement et Recherche - 57 rue Pierre Taittinger REIMS cedex - Tél fax Courriel : [email protected]
Tout ce que vous avez toujours voulu savoir sur la scintigraphie osseuse et le TEP-SCAN
 Tout ce que vous avez toujours voulu savoir sur la scintigraphie osseuse et le TEP-SCAN Docteur Antoine MONET Centre d Imagerie Fonctionnelle Clinique Saint Augustin Jeudi 25 Septembre 2008 Un peu d histoire
Tout ce que vous avez toujours voulu savoir sur la scintigraphie osseuse et le TEP-SCAN Docteur Antoine MONET Centre d Imagerie Fonctionnelle Clinique Saint Augustin Jeudi 25 Septembre 2008 Un peu d histoire
Les atouts et faiblesses des caméras TEP dédiées, TEP corps entier, TEP-CT, TEMP pour la quantification
 Les atouts et faiblesses des caméras TEP dédiées, TEP corps entier, TEP-CT, TEMP pour la quantification Irène Buvat U494 INSERM CHU Pitié-Salpêtrière, Paris [email protected] http://www.guillemet.org/irene
Les atouts et faiblesses des caméras TEP dédiées, TEP corps entier, TEP-CT, TEMP pour la quantification Irène Buvat U494 INSERM CHU Pitié-Salpêtrière, Paris [email protected] http://www.guillemet.org/irene
Document d information dans le cadre de l installation d un cyclotron. à Saint-Louis
 Document d information dans le cadre de l installation d un cyclotron à Saint-Louis Cancers & imagerie médicale Un progrès majeur pour une meilleure prise en charge des patients. Accroitre les possibilités
Document d information dans le cadre de l installation d un cyclotron à Saint-Louis Cancers & imagerie médicale Un progrès majeur pour une meilleure prise en charge des patients. Accroitre les possibilités
Bases physiques de l imagerie en
 Bases physiques de l imagerie en Médecine Nucléaire (MN) Pr. Malika ÇAOUI Service de Médecine Nucléaire CHU International Cheikh Zaid Faculté de Médecine et de Pharmacie - Rabat- 02/12/2010 Pr. Malika
Bases physiques de l imagerie en Médecine Nucléaire (MN) Pr. Malika ÇAOUI Service de Médecine Nucléaire CHU International Cheikh Zaid Faculté de Médecine et de Pharmacie - Rabat- 02/12/2010 Pr. Malika
Pierre OLIVIER - Médecine Nucléaire
 Diplôme Universitaire Corrélations anatomo-physio-pathologiques en imagerie thoracique 25 mai 2011 Imagerie TEP et pathologie tumorale bronchique Pierre OLIVIER - Médecine Nucléaire Détection en coincidence
Diplôme Universitaire Corrélations anatomo-physio-pathologiques en imagerie thoracique 25 mai 2011 Imagerie TEP et pathologie tumorale bronchique Pierre OLIVIER - Médecine Nucléaire Détection en coincidence
Intérêt de la TEP-FDG dans les cancers de l ovaire
 Intérêt de la TEP-FDG dans les cancers de l ovaire T. Mognetti et F. Giammarile Introduction La TEP-FDG (Tomographie par Émission de Positons après injection de 18 F- Fluoro-2-Déoxy-Glucose) est un des
Intérêt de la TEP-FDG dans les cancers de l ovaire T. Mognetti et F. Giammarile Introduction La TEP-FDG (Tomographie par Émission de Positons après injection de 18 F- Fluoro-2-Déoxy-Glucose) est un des
Sujets présentés par le Professeur Olivier CUSSENOT
 ANAMACaP Association Nationale des Malades du Cancer de la Prostate 17, bis Avenue Poincaré. 57400 SARREBOURG Sujets présentés par le Professeur Olivier CUSSENOT Place des nouvelles techniques d imagerie
ANAMACaP Association Nationale des Malades du Cancer de la Prostate 17, bis Avenue Poincaré. 57400 SARREBOURG Sujets présentés par le Professeur Olivier CUSSENOT Place des nouvelles techniques d imagerie
Simulation d'un examen anthropomorphique en imagerie TEMP à l iode 131 par simulation Monte Carlo GATE
 Simulation d'un examen anthropomorphique en imagerie TEMP à l iode 131 par simulation Monte Carlo GATE LAURENT Rémy [email protected] http://clrpcsv.in2p3.fr Journées des LARD Septembre 2007 M2R
Simulation d'un examen anthropomorphique en imagerie TEMP à l iode 131 par simulation Monte Carlo GATE LAURENT Rémy [email protected] http://clrpcsv.in2p3.fr Journées des LARD Septembre 2007 M2R
UE2 CANCEROLOGIE Place de la Médecine Nucléaire
 UE2 CANCEROLOGIE Place de la Médecine Nucléaire Imagerie Imagerie de Gamma Caméra Tomographie d émission monophotoniqueou TEMP: radiopharmaceutiqueémetteurs de rayonnement Gamma Imagerie de Caméra TEP
UE2 CANCEROLOGIE Place de la Médecine Nucléaire Imagerie Imagerie de Gamma Caméra Tomographie d émission monophotoniqueou TEMP: radiopharmaceutiqueémetteurs de rayonnement Gamma Imagerie de Caméra TEP
Quel apport de l imagerie dans les traitements anti-angiogéniques?
 Quel apport de l imagerie dans les traitements anti-angiogéniques? L Fournier, D Balvay, CA Cuénod Service de radiologie, Hôpital Européen Georges Pompidou Laboratoire de Recherche en Imagerie, Equipe
Quel apport de l imagerie dans les traitements anti-angiogéniques? L Fournier, D Balvay, CA Cuénod Service de radiologie, Hôpital Européen Georges Pompidou Laboratoire de Recherche en Imagerie, Equipe
Médecine Nucléaire : PET-scan et imagerie hybride
 Médecine Nucléaire : PET-scan et imagerie hybride Benjamin GEISSLER Centre d d Imagerie Nucléaire St-Etienne, Roanne, Le Puy en Velay 1967 2007 Principes Spécialit cialité médicale (1950) Radiologie Radiothérapie
Médecine Nucléaire : PET-scan et imagerie hybride Benjamin GEISSLER Centre d d Imagerie Nucléaire St-Etienne, Roanne, Le Puy en Velay 1967 2007 Principes Spécialit cialité médicale (1950) Radiologie Radiothérapie
PLACE DE L IRM DANS LE BILAN D EXTENSION DU CANCER DU RECTUM. Professeur Paul LEGMANN Radiologie A - Cochin Paris
 PLACE DE L IRM DANS LE BILAN D EXTENSION DU CANCER DU RECTUM Professeur Paul LEGMANN Radiologie A - Cochin Paris Cancer du rectum France : 15000 décès/an : 1ère cause. Pronostic souvent réservé Métastases
PLACE DE L IRM DANS LE BILAN D EXTENSION DU CANCER DU RECTUM Professeur Paul LEGMANN Radiologie A - Cochin Paris Cancer du rectum France : 15000 décès/an : 1ère cause. Pronostic souvent réservé Métastases
Qu est-ce qu un sarcome?
 Qu est-ce qu un sarcome? Qu est-ce qu une tumeur? Une tumeur est une prolifération anormale de cellules. Les tumeurs ne devraient donc pas automatiquement être associées à un cancer. Certaines tumeurs
Qu est-ce qu un sarcome? Qu est-ce qu une tumeur? Une tumeur est une prolifération anormale de cellules. Les tumeurs ne devraient donc pas automatiquement être associées à un cancer. Certaines tumeurs
Thierry DELZESCAUX. «biopicsel» group, URA CNRS-CEA 2210 Service MIRCen, I²BM, CEA Fontenay-aux-Roses, France. Thierry.Delzescaux@cea.
 Thierry DELZESCAUX «biopicsel» group, URA CNRS-CEA 2210 Service MIRCen, I²BM, CEA Fontenay-aux-Roses, France [email protected] Thierry DELZESCAUX Ingénieur chercheur CEA Experience Since 2008:
Thierry DELZESCAUX «biopicsel» group, URA CNRS-CEA 2210 Service MIRCen, I²BM, CEA Fontenay-aux-Roses, France [email protected] Thierry DELZESCAUX Ingénieur chercheur CEA Experience Since 2008:
Foscolo (1), J Felblinger (2), S Bracard (1) CHU Hôpital central, service de neuroradiologie, Nancy (1) CHU BRABOIS, Centre d investigation clinique
 S A l (1) G H (2) S S Aptel (1), G Hossu (2), S Foscolo (1), J Felblinger (2), S Bracard (1) CHU Hôpital central, service de neuroradiologie, Nancy (1) CHU BRABOIS, Centre d investigation clinique innovation
S A l (1) G H (2) S S Aptel (1), G Hossu (2), S Foscolo (1), J Felblinger (2), S Bracard (1) CHU Hôpital central, service de neuroradiologie, Nancy (1) CHU BRABOIS, Centre d investigation clinique innovation
Extraction de caractéristiques visuelles d'images médicales pour la recherche par similitude et l'aide au diagnostic
 Extraction de caractéristiques visuelles d'images médicales pour la recherche par similitude et l'aide au diagnostic Jérôme Palayret 1,2, Auréline Quatrehomme 1,2, Denis Hoa 1, William Puech 2 IMAIOS,
Extraction de caractéristiques visuelles d'images médicales pour la recherche par similitude et l'aide au diagnostic Jérôme Palayret 1,2, Auréline Quatrehomme 1,2, Denis Hoa 1, William Puech 2 IMAIOS,
LASER DOPPLER. Cependant elle n est pas encore utilisée en routine mais reste du domaine de la recherche et de l évaluation.
 LASER DOPPLER INTRODUCTION La technique qui utilise l effet Doppler à partir d un faisceau laser est l une des seules qui permette d enregistrer en continu le reflet de la perfusion superficielle de tissus
LASER DOPPLER INTRODUCTION La technique qui utilise l effet Doppler à partir d un faisceau laser est l une des seules qui permette d enregistrer en continu le reflet de la perfusion superficielle de tissus
- MANIP 2 - APPLICATION À LA MESURE DE LA VITESSE DE LA LUMIÈRE
 - MANIP 2 - - COÏNCIDENCES ET MESURES DE TEMPS - APPLICATION À LA MESURE DE LA VITESSE DE LA LUMIÈRE L objectif de cette manipulation est d effectuer une mesure de la vitesse de la lumière sur une «base
- MANIP 2 - - COÏNCIDENCES ET MESURES DE TEMPS - APPLICATION À LA MESURE DE LA VITESSE DE LA LUMIÈRE L objectif de cette manipulation est d effectuer une mesure de la vitesse de la lumière sur une «base
Chapitre 10 : Radioactivité et réactions nucléaires (chapitre 11 du livre)
 Chapitre 10 : Radioactivité et réactions nucléaires (chapitre 11 du livre) 1. A la découverte de la radioactivité. Un noyau père radioactif est un noyau INSTABLE. Il se transforme en un noyau fils STABLE
Chapitre 10 : Radioactivité et réactions nucléaires (chapitre 11 du livre) 1. A la découverte de la radioactivité. Un noyau père radioactif est un noyau INSTABLE. Il se transforme en un noyau fils STABLE
PLATE-FORME COMMUNE UNE SOLUTION LOGICIELLE UNIQUE POUR AMÉLIORER LA PRODUCTIVITÉ. Logiciel DIRECTVIEW V5 pour CR et DR
 Logiciel DIRECTVIEW V5 pour CR et DR UNE SOLUTION LOGICIELLE UNIQUE POUR AMÉLIORER LA PRODUCTIVITÉ Vous pouvez faire confiance aux systèmes CR et DR de Carestream pour leur qualité de prise d images. Maintenant
Logiciel DIRECTVIEW V5 pour CR et DR UNE SOLUTION LOGICIELLE UNIQUE POUR AMÉLIORER LA PRODUCTIVITÉ Vous pouvez faire confiance aux systèmes CR et DR de Carestream pour leur qualité de prise d images. Maintenant
Exemple PLS avec SAS
 Exemple PLS avec SAS This example, from Umetrics (1995), demonstrates different ways to examine a PLS model. The data come from the field of drug discovery. New drugs are developed from chemicals that
Exemple PLS avec SAS This example, from Umetrics (1995), demonstrates different ways to examine a PLS model. The data come from the field of drug discovery. New drugs are developed from chemicals that
Rad4Med.be, premier acteur global dans le nucléaire médical
 Bruxelles, 15 octobre 2013 Communiqué de presse Rad4Med.be, premier acteur global dans le nucléaire médical La radioactivité au service de la médecine, un savoir-faire belge qui s exporte dans le monde
Bruxelles, 15 octobre 2013 Communiqué de presse Rad4Med.be, premier acteur global dans le nucléaire médical La radioactivité au service de la médecine, un savoir-faire belge qui s exporte dans le monde
IRM du Cancer du Rectum
 IRM du Cancer du Rectum quels CHOIX TECHNIQUES pour quels OBJECTIFS THERAPEUTIQUES? Frank Boudghène, T. Andre, A. Stivalet, I. Frey, L. Paslaru, V. Ganthier, M. Tassart Hopital Tenon - Université Paris
IRM du Cancer du Rectum quels CHOIX TECHNIQUES pour quels OBJECTIFS THERAPEUTIQUES? Frank Boudghène, T. Andre, A. Stivalet, I. Frey, L. Paslaru, V. Ganthier, M. Tassart Hopital Tenon - Université Paris
Forthcoming Database
 DISS.ETH NO. 15802 Forthcoming Database A Framework Approach for Data Visualization Applications A dissertation submitted to the SWISS FEDERAL INSTITUTE OF TECHNOLOGY ZURICH for the degree of Doctor of
DISS.ETH NO. 15802 Forthcoming Database A Framework Approach for Data Visualization Applications A dissertation submitted to the SWISS FEDERAL INSTITUTE OF TECHNOLOGY ZURICH for the degree of Doctor of
Laboratoire d Informatique, de Traitement de l Information et des Systèmes EA 4108. 3 établissements T. Paquet D. Olivier T. Lecroq A.
 Laboratoire d Informatique, de Traitement de l Information et des Systèmes EA 4108 3 établissements T. Paquet D. Olivier T. Lecroq A. Benshrair 7 équipes Disciplines 27-61, 25-26-43-64 L. Heutte DocApp
Laboratoire d Informatique, de Traitement de l Information et des Systèmes EA 4108 3 établissements T. Paquet D. Olivier T. Lecroq A. Benshrair 7 équipes Disciplines 27-61, 25-26-43-64 L. Heutte DocApp
Nouvelles stratégies et nouveaux impacts de l imagerie des cancers
 03 CHATAL Page 26 Jeudi, 18. mars 2004 8:21 08 Le cancer : nouvelles données, nouvelles stratégies, nouveaux espoirs Cancer: recent evidence, innovative strategies, future promises 2004 Elsevier SAS. Tous
03 CHATAL Page 26 Jeudi, 18. mars 2004 8:21 08 Le cancer : nouvelles données, nouvelles stratégies, nouveaux espoirs Cancer: recent evidence, innovative strategies, future promises 2004 Elsevier SAS. Tous
Leçon n 1 : «Les grandes innovations scientifiques et technologiques»
 Leçon n 1 : «Les grandes innovations scientifiques et technologiques» Intro : Le XXè siècle fut un siècle de grands progrès scientifiques et techniques. Les évolutions connues par la médecine, les transports
Leçon n 1 : «Les grandes innovations scientifiques et technologiques» Intro : Le XXè siècle fut un siècle de grands progrès scientifiques et techniques. Les évolutions connues par la médecine, les transports
ENFIN, UN SYSTÈME POLYVALENT D'IMAGERIE ORL ET DENTAIRE
 CS 9300 ENFIN, UN SYSTÈME POLYVALENT D'IMAGERIE ORL ET DENTAIRE Conçu pour de multiples applications cliniques, le système CS 9300 fournit des images panoramiques de très grande qualité, ainsi que des
CS 9300 ENFIN, UN SYSTÈME POLYVALENT D'IMAGERIE ORL ET DENTAIRE Conçu pour de multiples applications cliniques, le système CS 9300 fournit des images panoramiques de très grande qualité, ainsi que des
Détection et suivi d'objets dans une séquence d'images par contours actifs
 Détection et suivi d'objets dans une séquence d'images par contours actifs A. Fekir (1), N. Benamrane (2) et A. Taleb-Ahmed (3) (1) Département d informatique, Université de Mustapha Stambouli, BP 763,
Détection et suivi d'objets dans une séquence d'images par contours actifs A. Fekir (1), N. Benamrane (2) et A. Taleb-Ahmed (3) (1) Département d informatique, Université de Mustapha Stambouli, BP 763,
Traitement bas-niveau
 Plan Introduction L approche contour (frontière) Introduction Objectifs Les traitements ont pour but d extraire l information utile et pertinente contenue dans l image en regard de l application considérée.
Plan Introduction L approche contour (frontière) Introduction Objectifs Les traitements ont pour but d extraire l information utile et pertinente contenue dans l image en regard de l application considérée.
Introduction de la journée
 Introduction de la journée David Cohen Université Pierre et Marie Curie, APHP, GH Pitié Salpêtrière, Paris, France Service de Psychiatrie de l Enfant et de l Adolescent Institut des Systèmes Intelligents
Introduction de la journée David Cohen Université Pierre et Marie Curie, APHP, GH Pitié Salpêtrière, Paris, France Service de Psychiatrie de l Enfant et de l Adolescent Institut des Systèmes Intelligents
Exposition de la population française aux rayonnements ionisants liée aux actes de diagnostic médical en 2012
 R A P P O R T Exposition de la population française aux rayonnements ionisants liée aux actes de Pôle Radioprotection, Environnement, Déchets et Crise RESUME Ce rapport met à jour, pour l année 2012, les
R A P P O R T Exposition de la population française aux rayonnements ionisants liée aux actes de Pôle Radioprotection, Environnement, Déchets et Crise RESUME Ce rapport met à jour, pour l année 2012, les
Peut-on reconnaître une tumeur de bas-grade en imagerie conventionnelle? S. Foscolo, L. Taillandier, E. Schmitt, A.S. Rivierre, S. Bracard, CHU NANCY
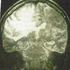 Peut-on reconnaître une tumeur de bas-grade en imagerie conventionnelle? S. Foscolo, L. Taillandier, E. Schmitt, A.S. Rivierre, S. Bracard, CHU NANCY A quoi sert l imagerie conventionnelle dans le diagnostic
Peut-on reconnaître une tumeur de bas-grade en imagerie conventionnelle? S. Foscolo, L. Taillandier, E. Schmitt, A.S. Rivierre, S. Bracard, CHU NANCY A quoi sert l imagerie conventionnelle dans le diagnostic
Traitements néoadjuvants des cancers du rectum. Pr. G. Portier CHU Purpan - Toulouse
 Traitements néoadjuvants des cancers du rectum Pr. G. Portier CHU Purpan - Toulouse Journées Francophones d Hépato-gastroentérologie et d Oncologie Digestive 2010 CONFLITS D INTÉRÊT Pas de conflit d intérêt
Traitements néoadjuvants des cancers du rectum Pr. G. Portier CHU Purpan - Toulouse Journées Francophones d Hépato-gastroentérologie et d Oncologie Digestive 2010 CONFLITS D INTÉRÊT Pas de conflit d intérêt
Once the installation is complete, you can delete the temporary Zip files..
 Sommaire Installation... 2 After the download... 2 From a CD... 2 Access codes... 2 DirectX Compatibility... 2 Using the program... 2 Structure... 4 Lier une structure à une autre... 4 Personnaliser une
Sommaire Installation... 2 After the download... 2 From a CD... 2 Access codes... 2 DirectX Compatibility... 2 Using the program... 2 Structure... 4 Lier une structure à une autre... 4 Personnaliser une
F-FLUORODÉOXYGLUCOSE EN ONCOLOGIE Expérience en Ile de France
 18F-fluorodéoxyglucose en oncologie. Expérience en Ile de France. 18 F-FLUORODÉOXYGLUCOSE EN ONCOLOGIE Expérience en Ile de France H. FOEHRENBACH 1, J. LUMBROSO 2 1 Service Médecine Nucléaire, Hôpital
18F-fluorodéoxyglucose en oncologie. Expérience en Ile de France. 18 F-FLUORODÉOXYGLUCOSE EN ONCOLOGIE Expérience en Ile de France H. FOEHRENBACH 1, J. LUMBROSO 2 1 Service Médecine Nucléaire, Hôpital
THÈSE. présentée à TÉLÉCOM PARISTECH. pour obtenir le grade de. DOCTEUR de TÉLÉCOM PARISTECH. Mention Informatique et Réseaux. par.
 École Doctorale d Informatique, Télécommunications et Électronique de Paris THÈSE présentée à TÉLÉCOM PARISTECH pour obtenir le grade de DOCTEUR de TÉLÉCOM PARISTECH Mention Informatique et Réseaux par
École Doctorale d Informatique, Télécommunications et Électronique de Paris THÈSE présentée à TÉLÉCOM PARISTECH pour obtenir le grade de DOCTEUR de TÉLÉCOM PARISTECH Mention Informatique et Réseaux par
Les renseignements suivants sont destinés uniquement aux personnes qui ont reçu un diagnostic de cancer
 Information importante pour les personnes atteintes d un cancer du poumon non à petites cellules de stade avancé Les renseignements suivants sont destinés uniquement aux personnes qui ont reçu un diagnostic
Information importante pour les personnes atteintes d un cancer du poumon non à petites cellules de stade avancé Les renseignements suivants sont destinés uniquement aux personnes qui ont reçu un diagnostic
Chapitre 02. La lumière des étoiles. Exercices :
 Chapitre 02 La lumière des étoiles. I- Lumière monochromatique et lumière polychromatique. )- Expérience de Newton (642 727). 2)- Expérience avec la lumière émise par un Laser. 3)- Radiation et longueur
Chapitre 02 La lumière des étoiles. I- Lumière monochromatique et lumière polychromatique. )- Expérience de Newton (642 727). 2)- Expérience avec la lumière émise par un Laser. 3)- Radiation et longueur
Bourses d excellence pour les masters orientés vers la recherche
 Masters de Mathématiques à l'université Lille 1 Mathématiques Ingénierie Mathématique Mathématiques et Finances Bourses d excellence pour les masters orientés vers la recherche Mathématiques appliquées
Masters de Mathématiques à l'université Lille 1 Mathématiques Ingénierie Mathématique Mathématiques et Finances Bourses d excellence pour les masters orientés vers la recherche Mathématiques appliquées
Ligne Dentaire. Système Dentaire Panoramique et 3D
 Ligne Dentaire Système Dentaire Panoramique et 3D La Société Villa Sistemi Medicali est fière de présenter son nouveau panoramique Rotograph Evo 3D, un système d'imagerie dentaire avec fonctionnalité 3-en-1:
Ligne Dentaire Système Dentaire Panoramique et 3D La Société Villa Sistemi Medicali est fière de présenter son nouveau panoramique Rotograph Evo 3D, un système d'imagerie dentaire avec fonctionnalité 3-en-1:
Etude d un cas industriel : Optimisation de la modélisation de paramètre de production
 Revue des Sciences et de la Technologie RST- Volume 4 N 1 /janvier 2013 Etude d un cas industriel : Optimisation de la modélisation de paramètre de production A.F. Bernate Lara 1, F. Entzmann 2, F. Yalaoui
Revue des Sciences et de la Technologie RST- Volume 4 N 1 /janvier 2013 Etude d un cas industriel : Optimisation de la modélisation de paramètre de production A.F. Bernate Lara 1, F. Entzmann 2, F. Yalaoui
Cancer du sein. Du CA15-3 à la tomographie à émission de positons.
 Cancer du sein. Du CA15-3 à la tomographie à émission de positons. Un taux de récidive de 30% dans les dix premières années chez des patientes en rémission complète après un traitement curatif, requiert
Cancer du sein. Du CA15-3 à la tomographie à émission de positons. Un taux de récidive de 30% dans les dix premières années chez des patientes en rémission complète après un traitement curatif, requiert
Sytème de Diagnostic d'imagerie Numérique simple et évolutif
 Sytème de Diagnostic d'imagerie Numérique simple et évolutif Un système simple et évolutif Scanner Ceph - Temps d'exposition : minimum 4 sec - Mode HD Fonction de prévisualisation Décidez ainsi immédiatement
Sytème de Diagnostic d'imagerie Numérique simple et évolutif Un système simple et évolutif Scanner Ceph - Temps d'exposition : minimum 4 sec - Mode HD Fonction de prévisualisation Décidez ainsi immédiatement
CORRELATION RADIO-ANATOMIQUE DANS LE CARCINOME HEPATOCELLULAIRE TRAITE PAR TRANSPLANTATION HEPATIQUE : IMPACT SUR LA RECIDIVE
 CORRELATION RADIO-ANATOMIQUE DANS LE CARCINOME HEPATOCELLULAIRE TRAITE PAR TRANSPLANTATION HEPATIQUE : IMPACT SUR LA RECIDIVE L. Lecoq, J. Gendre, N. Sturm, C. Letoublon, MN. Hilleret, JP. Zarski, V. Leroy
CORRELATION RADIO-ANATOMIQUE DANS LE CARCINOME HEPATOCELLULAIRE TRAITE PAR TRANSPLANTATION HEPATIQUE : IMPACT SUR LA RECIDIVE L. Lecoq, J. Gendre, N. Sturm, C. Letoublon, MN. Hilleret, JP. Zarski, V. Leroy
à Mulhouse un centre pionnier de recherche médicale
 à Mulhouse un centre pionnier de recherche médicale 25 ans de lutte contre les leucémies et l infarctus du myocarde Fondé en 1987 par le Professeur Philippe Hénon et localisé au sein de l Hôpital du Hasenrain
à Mulhouse un centre pionnier de recherche médicale 25 ans de lutte contre les leucémies et l infarctus du myocarde Fondé en 1987 par le Professeur Philippe Hénon et localisé au sein de l Hôpital du Hasenrain
La physique médicale au service du patient: le rôle de l agence internationale de l énergie atomique
 La physique médicale au service du patient: le rôle de l agence internationale de l énergie atomique Ahmed Meghzifene Chef de la Section Dosimétrie et Physique Médicale, Division de la Santé Humaine, Dept
La physique médicale au service du patient: le rôle de l agence internationale de l énergie atomique Ahmed Meghzifene Chef de la Section Dosimétrie et Physique Médicale, Division de la Santé Humaine, Dept
Hôpital performant et soins de qualité. La rencontre des extrêmes estelle
 Hôpital performant et soins de qualité. La rencontre des extrêmes estelle possible? 18 octobre 2012 Professeur Philippe KOLH CIO, Directeur du Service des Informations Médico-Economiques CHU de LIEGE Plan
Hôpital performant et soins de qualité. La rencontre des extrêmes estelle possible? 18 octobre 2012 Professeur Philippe KOLH CIO, Directeur du Service des Informations Médico-Economiques CHU de LIEGE Plan
Analyse de la vidéo. Chapitre 4.1 - La modélisation pour le suivi d objet. 10 mars 2015. Chapitre 4.1 - La modélisation d objet 1 / 57
 Analyse de la vidéo Chapitre 4.1 - La modélisation pour le suivi d objet 10 mars 2015 Chapitre 4.1 - La modélisation d objet 1 / 57 La représentation d objets Plan de la présentation 1 La représentation
Analyse de la vidéo Chapitre 4.1 - La modélisation pour le suivi d objet 10 mars 2015 Chapitre 4.1 - La modélisation d objet 1 / 57 La représentation d objets Plan de la présentation 1 La représentation
Photoactivatable Probes for Protein Labeling
 Photoactivatable Probes for Protein Labeling THÈSE N O 4660 (2010) PRÉSENTÉE LE 26 MARS 2010 À LA FACULTÉ SCIENCES DE BASE LABORATOIRE D'INGÉNIERIE DES PROTÉINES PROGRAMME DOCTORAL EN CHIMIE ET GÉNIE CHIMIQUE
Photoactivatable Probes for Protein Labeling THÈSE N O 4660 (2010) PRÉSENTÉE LE 26 MARS 2010 À LA FACULTÉ SCIENCES DE BASE LABORATOIRE D'INGÉNIERIE DES PROTÉINES PROGRAMME DOCTORAL EN CHIMIE ET GÉNIE CHIMIQUE
Test de terrain ou test de laboratoire pour la performance en endurance?
 Test de terrain ou test de laboratoire pour la performance en endurance? Ajaccio 12 mai 2012 F. Carré Université Rennes 1 Hopital Pontchaillou Inserm UMR 1099 Les «tests» chez le sportif Exploration performance
Test de terrain ou test de laboratoire pour la performance en endurance? Ajaccio 12 mai 2012 F. Carré Université Rennes 1 Hopital Pontchaillou Inserm UMR 1099 Les «tests» chez le sportif Exploration performance
Le Crédit-bail mobilier dans les procédures collectives
 Aimé Diaka Le Crédit-bail mobilier dans les procédures collectives Publibook Retrouvez notre catalogue sur le site des Éditions Publibook : http://www.publibook.com Ce texte publié par les Éditions Publibook
Aimé Diaka Le Crédit-bail mobilier dans les procédures collectives Publibook Retrouvez notre catalogue sur le site des Éditions Publibook : http://www.publibook.com Ce texte publié par les Éditions Publibook
Comparaison de Relevés 3D issus de plusieurs Systèmes de Numérisation
 Laboratoire Vision & Robotique Comparaison de Relevés 3D issus de plusieurs Systèmes de Numérisation Emilie KOENIG, Benjamin ALBOUY, Sylvie TREUILLET, Yves Lucas Contact : Sylvie Treuillet Polytech'Orléans
Laboratoire Vision & Robotique Comparaison de Relevés 3D issus de plusieurs Systèmes de Numérisation Emilie KOENIG, Benjamin ALBOUY, Sylvie TREUILLET, Yves Lucas Contact : Sylvie Treuillet Polytech'Orléans
Vision industrielle et télédétection - Détection d ellipses. Guillaume Martinez 17 décembre 2007
 Vision industrielle et télédétection - Détection d ellipses Guillaume Martinez 17 décembre 2007 1 Table des matières 1 Le projet 3 1.1 Objectif................................ 3 1.2 Les choix techniques.........................
Vision industrielle et télédétection - Détection d ellipses Guillaume Martinez 17 décembre 2007 1 Table des matières 1 Le projet 3 1.1 Objectif................................ 3 1.2 Les choix techniques.........................
Découvrez L INSTITUT UNIVERSITAIRE DU CANCER DE TOULOUSE
 Découvrez L INSTITUT UNIVERSITAIRE DU CANCER DE TOULOUSE 2014 L INSTITUT UNIVERSITAIRE DU CANCER DE TOULOUSE L Institut universitaire du cancer de Toulouse (IUCT) est un nouveau modèle français d organisation
Découvrez L INSTITUT UNIVERSITAIRE DU CANCER DE TOULOUSE 2014 L INSTITUT UNIVERSITAIRE DU CANCER DE TOULOUSE L Institut universitaire du cancer de Toulouse (IUCT) est un nouveau modèle français d organisation
FORMATION CONTINUE SUR L UTILISATION D EXCEL DANS L ENSEIGNEMENT Expérience de l E.N.S de Tétouan (Maroc)
 87 FORMATION CONTINUE SUR L UTILISATION D EXCEL DANS L ENSEIGNEMENT Expérience de l E.N.S de Tétouan (Maroc) Dans le cadre de la réforme pédagogique et de l intérêt que porte le Ministère de l Éducation
87 FORMATION CONTINUE SUR L UTILISATION D EXCEL DANS L ENSEIGNEMENT Expérience de l E.N.S de Tétouan (Maroc) Dans le cadre de la réforme pédagogique et de l intérêt que porte le Ministère de l Éducation
1985, 169, n 7, 1071-1075,séancedu 22 octobre1985. ALBARÈDE et Jean-Claude DARRAS
 Bull. Acad.NatleMéd., 1985, 169, n 7, 1071-1075,séancedu 22 octobre1985 Etude des méridiens d'acupuncture Par les traceurs radioactifs Pierre de VERNEJOUL *, Pierre ALBARÈDE et Jean-Claude DARRAS On sait
Bull. Acad.NatleMéd., 1985, 169, n 7, 1071-1075,séancedu 22 octobre1985 Etude des méridiens d'acupuncture Par les traceurs radioactifs Pierre de VERNEJOUL *, Pierre ALBARÈDE et Jean-Claude DARRAS On sait
1. Développement embarqué. André KPOZEHOUE DOMAINES DE COMPETENCES CONNAISSANCES TECHNIQUES
 André KPOZEHOUE 11 Rue Georges Teissier, 42000 Saint-Etienne. Téléphone : 06 34 95 30 57 / 09 53 11 29 77 e-mail : [email protected] Identifiant Skype : kpozehoue Mobilité géographique : France entière Disponibilité
André KPOZEHOUE 11 Rue Georges Teissier, 42000 Saint-Etienne. Téléphone : 06 34 95 30 57 / 09 53 11 29 77 e-mail : [email protected] Identifiant Skype : kpozehoue Mobilité géographique : France entière Disponibilité
Vue d ensemble : Office of Cellular, Tissue and Gene Therapies
 Vue d ensemble : Office of Cellular, Tissue and Gene Therapies DIAPOSITIVE 1 Cette présentation fournit une vue d ensemble de l Office of Cellular, Tissue, and Gene Therapies (bureau des thérapies cellulaires,
Vue d ensemble : Office of Cellular, Tissue and Gene Therapies DIAPOSITIVE 1 Cette présentation fournit une vue d ensemble de l Office of Cellular, Tissue, and Gene Therapies (bureau des thérapies cellulaires,
RAPID 3.34 - Prenez le contrôle sur vos données
 RAPID 3.34 - Prenez le contrôle sur vos données Parmi les fonctions les plus demandées par nos utilisateurs, la navigation au clavier et la possibilité de disposer de champs supplémentaires arrivent aux
RAPID 3.34 - Prenez le contrôle sur vos données Parmi les fonctions les plus demandées par nos utilisateurs, la navigation au clavier et la possibilité de disposer de champs supplémentaires arrivent aux
Filtrage stochastique non linéaire par la théorie de représentation des martingales
 Filtrage stochastique non linéaire par la théorie de représentation des martingales Adriana Climescu-Haulica Laboratoire de Modélisation et Calcul Institut d Informatique et Mathématiques Appliquées de
Filtrage stochastique non linéaire par la théorie de représentation des martingales Adriana Climescu-Haulica Laboratoire de Modélisation et Calcul Institut d Informatique et Mathématiques Appliquées de
Dr E. CHEVRET UE2.1 2013-2014. Aperçu général sur l architecture et les fonctions cellulaires
 Aperçu général sur l architecture et les fonctions cellulaires I. Introduction II. Les microscopes 1. Le microscope optique 2. Le microscope à fluorescence 3. Le microscope confocal 4. Le microscope électronique
Aperçu général sur l architecture et les fonctions cellulaires I. Introduction II. Les microscopes 1. Le microscope optique 2. Le microscope à fluorescence 3. Le microscope confocal 4. Le microscope électronique
PLATE-FORME DE MICROSCOPIE ÉLECTRONIQUE À TRANSMISSION
 PLATE-FORME DE MICROSCOPIE ÉLECTRONIQUE À TRANSMISSION Dr. Mohamed SENNOUR Responsable de la plate-forme JOURNÉE PLATES-FORMES EVRY, GÉNOCENTRE 25 juin 2013 Contexte et historique 2000 : constitution du
PLATE-FORME DE MICROSCOPIE ÉLECTRONIQUE À TRANSMISSION Dr. Mohamed SENNOUR Responsable de la plate-forme JOURNÉE PLATES-FORMES EVRY, GÉNOCENTRE 25 juin 2013 Contexte et historique 2000 : constitution du
La classification automatique de données quantitatives
 La classification automatique de données quantitatives 1 Introduction Parmi les méthodes de statistique exploratoire multidimensionnelle, dont l objectif est d extraire d une masse de données des informations
La classification automatique de données quantitatives 1 Introduction Parmi les méthodes de statistique exploratoire multidimensionnelle, dont l objectif est d extraire d une masse de données des informations
Direction générale de l offre de soin
 Apport de la télémédecine en matière de coopération territoriale 1. Une nouvelle organisation de l offre sanitaire pour mieux répondre aux besoins des populations 2. Comment organiser des activités de
Apport de la télémédecine en matière de coopération territoriale 1. Une nouvelle organisation de l offre sanitaire pour mieux répondre aux besoins des populations 2. Comment organiser des activités de
Nouvelles caméras CZT cardiaques: une seconde vie pour le thallium 201?
 Symposium Covidien, Nice, 10 mai 2010 Nouvelles caméras CZT cardiaques: une seconde vie pour le thallium 201? Bernard Songy Centre Cardiologique du Nord St-Denis Thallium 201: Le thallium 201 présente
Symposium Covidien, Nice, 10 mai 2010 Nouvelles caméras CZT cardiaques: une seconde vie pour le thallium 201? Bernard Songy Centre Cardiologique du Nord St-Denis Thallium 201: Le thallium 201 présente
Lymphome non hodgkinien
 Lymphome non hodgkinien Ce que vous devez savoir Le cancer : une lutte à finir 1 888 939-3333 www.cancer.ca LYMPHOME NON HODGKINIEN Ce que vous devez savoir Même si vous entendez parler du cancer presque
Lymphome non hodgkinien Ce que vous devez savoir Le cancer : une lutte à finir 1 888 939-3333 www.cancer.ca LYMPHOME NON HODGKINIEN Ce que vous devez savoir Même si vous entendez parler du cancer presque
Les sciences de l ingénieur appliquées à la prise en charge du
 Les sciences de l ingénieur appliquées à la prise en charge du cancer : enjeux et opportunités Début de cartographie des enjeux cliniques et technologiques gq Jean-François MENUDET, Cluster I-Care Cartographie
Les sciences de l ingénieur appliquées à la prise en charge du cancer : enjeux et opportunités Début de cartographie des enjeux cliniques et technologiques gq Jean-François MENUDET, Cluster I-Care Cartographie
G U I D E - A F F E C T I O N D E L O N G U E D U R É E. La prise en charge de votre mélanome cutané
 G U I D E - A F F E C T I O N D E L O N G U E D U R É E La prise en charge de votre mélanome cutané Mars 2010 Pourquoi ce guide? Votre médecin traitant vous a remis ce guide pour vous informer sur le mélanome
G U I D E - A F F E C T I O N D E L O N G U E D U R É E La prise en charge de votre mélanome cutané Mars 2010 Pourquoi ce guide? Votre médecin traitant vous a remis ce guide pour vous informer sur le mélanome
$SSOLFDWLRQGXNULJHDJHSRXUOD FDOLEUDWLRQPRWHXU
 $SSOLFDWLRQGXNULJHDJHSRXUOD FDOLEUDWLRQPRWHXU Fabien FIGUERES [email protected] 0RWVFOpV : Krigeage, plans d expériences space-filling, points de validations, calibration moteur. 5pVXPp Dans le
$SSOLFDWLRQGXNULJHDJHSRXUOD FDOLEUDWLRQPRWHXU Fabien FIGUERES [email protected] 0RWVFOpV : Krigeage, plans d expériences space-filling, points de validations, calibration moteur. 5pVXPp Dans le
Le GRAND CONSEIL de la République et canton de Genève décrète ce qui suit :
 Secrétariat du Grand Conseil PL 10267 Projet présenté par le Conseil d Etat Date de dépôt: 22 mai 2008 Projet de loi ouvrant un crédit au titre d'indemnité cantonale d'investissement de 3 000 000 F, pour
Secrétariat du Grand Conseil PL 10267 Projet présenté par le Conseil d Etat Date de dépôt: 22 mai 2008 Projet de loi ouvrant un crédit au titre d'indemnité cantonale d'investissement de 3 000 000 F, pour
J. Goupil (1), A. Fohlen (1), V. Le Pennec (1), O. Lepage (2), M. Hamon (2), M. Hamon-Kérautret (1)
 J. Goupil (1), A. Fohlen (1), V. Le Pennec (1), O. Lepage (2), M. Hamon (2), M. Hamon-Kérautret (1) (1) Pôle d Imagerie, service de Radiologie, CHU Caen (2) Pôle Cardio-thoracique, service de Chirurgie
J. Goupil (1), A. Fohlen (1), V. Le Pennec (1), O. Lepage (2), M. Hamon (2), M. Hamon-Kérautret (1) (1) Pôle d Imagerie, service de Radiologie, CHU Caen (2) Pôle Cardio-thoracique, service de Chirurgie
Parrainage par Monsieur Philippe PAREIGE de notre classe, presentation des nanotechnologies.
 LUDIVINE TASSERY 1ere S 5 Parrainage par Monsieur Philippe PAREIGE de notre classe, presentation des nanotechnologies. Lors de la seconde visite, Monsieur PAREIGE, nous a parlé des nanotechnologies et
LUDIVINE TASSERY 1ere S 5 Parrainage par Monsieur Philippe PAREIGE de notre classe, presentation des nanotechnologies. Lors de la seconde visite, Monsieur PAREIGE, nous a parlé des nanotechnologies et
INAUGURATION LABORATOIRE DE THERAPIE CELLULAIRE 16 FEVRIER 2012 DOSSIER DE PRESSE
 INAUGURATION LABORATOIRE DE THERAPIE CELLULAIRE 16 FEVRIER 2012 DOSSIER DE PRESSE Contact presse : Cathy Josse 03 22 66 87 83 / 06 86 30 46 57 [email protected] 1 COMMUNIQUE DE SYNTHESE Le 16 février
INAUGURATION LABORATOIRE DE THERAPIE CELLULAIRE 16 FEVRIER 2012 DOSSIER DE PRESSE Contact presse : Cathy Josse 03 22 66 87 83 / 06 86 30 46 57 [email protected] 1 COMMUNIQUE DE SYNTHESE Le 16 février
GUIDE MASTER 2. Radiothérapie-Oncologie
 GUIDE MASTER 2 Radiothérapie-Oncologie Master 2 (M2) : carte d identité -Niveau requis : Bac + 5 -Durée : Un an -S inscrit dans le cadre de la réforme dite LMD (Licence Master Doctorat) Remplace le DEA
GUIDE MASTER 2 Radiothérapie-Oncologie Master 2 (M2) : carte d identité -Niveau requis : Bac + 5 -Durée : Un an -S inscrit dans le cadre de la réforme dite LMD (Licence Master Doctorat) Remplace le DEA
Amélioration de la fiabilité d inspection en CND grâce à la fusion d information : applications en rayons X et ultrasons
 Amélioration de la fiabilité d inspection en CND grâce à la fusion d information : applications en rayons X et ultrasons Ahmad OSMAN 1a, Valérie KAFTANDJIAN b, Ulf HASSLER a a Fraunhofer Development Center
Amélioration de la fiabilité d inspection en CND grâce à la fusion d information : applications en rayons X et ultrasons Ahmad OSMAN 1a, Valérie KAFTANDJIAN b, Ulf HASSLER a a Fraunhofer Development Center
Maladie de Hodgkin ou lymphome de Hodgkin
 Maladie de Hodgkin ou lymphome de Hodgkin Ce que vous devez savoir Le cancer : une lutte à finir 1 888 939-3333 www.cancer.ca MALADIE DE HODGKIN Ce que vous devez savoir Même si vous entendez parler du
Maladie de Hodgkin ou lymphome de Hodgkin Ce que vous devez savoir Le cancer : une lutte à finir 1 888 939-3333 www.cancer.ca MALADIE DE HODGKIN Ce que vous devez savoir Même si vous entendez parler du
Les Data Sciences pour la santé: Qui, Quoi, Comment?
 Les Data Sciences pour la santé: Qui, Quoi, Comment? Pascal Staccini IRIS Department - School of Medicine of Nice Nice-Sophia Antipolis University UMR 912 - SESSTIM - INSERM et pour quoi faire? Les données
Les Data Sciences pour la santé: Qui, Quoi, Comment? Pascal Staccini IRIS Department - School of Medicine of Nice Nice-Sophia Antipolis University UMR 912 - SESSTIM - INSERM et pour quoi faire? Les données
23. Interprétation clinique des mesures de l effet traitement
 23. Interprétation clinique des mesures de l effet traitement 23.1. Critères de jugement binaires Plusieurs mesures (indices) sont utilisables pour quantifier l effet traitement lors de l utilisation d
23. Interprétation clinique des mesures de l effet traitement 23.1. Critères de jugement binaires Plusieurs mesures (indices) sont utilisables pour quantifier l effet traitement lors de l utilisation d
Compléments - Chapitre 5 Spectroscopie
 ompléments - hapitre 5 Spectroscopie Spectroscopie par résonance magnétique nucléaire (RMN 13 ) Tandis que la spectroscopie RMN 1 H fournit des données sur la disposition des atomes d'hydrogène dans une
ompléments - hapitre 5 Spectroscopie Spectroscopie par résonance magnétique nucléaire (RMN 13 ) Tandis que la spectroscopie RMN 1 H fournit des données sur la disposition des atomes d'hydrogène dans une
Opérations de base sur ImageJ
 Opérations de base sur ImageJ TPs d hydrodynamique de l ESPCI, J. Bico, M. Reyssat, M. Fermigier ImageJ est un logiciel libre, qui fonctionne aussi bien sous plate-forme Windows, Mac ou Linux. Initialement
Opérations de base sur ImageJ TPs d hydrodynamique de l ESPCI, J. Bico, M. Reyssat, M. Fermigier ImageJ est un logiciel libre, qui fonctionne aussi bien sous plate-forme Windows, Mac ou Linux. Initialement
Application Form/ Formulaire de demande
 Application Form/ Formulaire de demande Ecosystem Approaches to Health: Summer Workshop and Field school Approches écosystémiques de la santé: Atelier intensif et stage d été Please submit your application
Application Form/ Formulaire de demande Ecosystem Approaches to Health: Summer Workshop and Field school Approches écosystémiques de la santé: Atelier intensif et stage d été Please submit your application
Analyse d images. [email protected]. Edmond Boyer UFRIMA 1
 Analyse d images [email protected] Edmond Boyer UFRIMA 1 1 Généralités Analyse d images (Image Analysis) : utiliser un ordinateur pour interpréter le monde extérieur au travers d images. Images Objets
Analyse d images [email protected] Edmond Boyer UFRIMA 1 1 Généralités Analyse d images (Image Analysis) : utiliser un ordinateur pour interpréter le monde extérieur au travers d images. Images Objets
Mesure de l'impact de la marque de provenance Aliments du Québec sur la valeur des produits
 UNIVERSITE DE SHERBROOKE Faculté d'administration Mesure de l'impact de la marque de provenance Aliments du Québec sur la valeur des produits Francine Rodier Cette thèse a été évaluée par un jury composé
UNIVERSITE DE SHERBROOKE Faculté d'administration Mesure de l'impact de la marque de provenance Aliments du Québec sur la valeur des produits Francine Rodier Cette thèse a été évaluée par un jury composé
Introduction à l approche bootstrap
 Introduction à l approche bootstrap Irène Buvat U494 INSERM buvat@imedjussieufr 25 septembre 2000 Introduction à l approche bootstrap - Irène Buvat - 21/9/00-1 Plan du cours Qu est-ce que le bootstrap?
Introduction à l approche bootstrap Irène Buvat U494 INSERM buvat@imedjussieufr 25 septembre 2000 Introduction à l approche bootstrap - Irène Buvat - 21/9/00-1 Plan du cours Qu est-ce que le bootstrap?
Veraviewepocs 3De Le Panoramique dentaire qui répond à tous vos besoins en imagerie tridimensionnelle (3D)
 Veraviewepocs 3De Le Panoramique dentaire qui répond à tous vos besoins en imagerie tridimensionnelle (3D) Thinking ahead. Focused on life. Veraviewepocs 3De Le générateur à Rayons X pour tous vos besoins
Veraviewepocs 3De Le Panoramique dentaire qui répond à tous vos besoins en imagerie tridimensionnelle (3D) Thinking ahead. Focused on life. Veraviewepocs 3De Le générateur à Rayons X pour tous vos besoins
Lamia Oukid, Ounas Asfari, Fadila Bentayeb, Nadjia Benblidia, Omar Boussaid. 14 Juin 2013
 Cube de textes et opérateur d'agrégation basé sur un modèle vectoriel adapté Text Cube Model and aggregation operator based on an adapted vector space model Lamia Oukid, Ounas Asfari, Fadila Bentayeb,
Cube de textes et opérateur d'agrégation basé sur un modèle vectoriel adapté Text Cube Model and aggregation operator based on an adapted vector space model Lamia Oukid, Ounas Asfari, Fadila Bentayeb,
Approche par groupe de gènes pour les données longitudinales d expression génique avec une application dans un essai vaccinal contre le VIH
 Approche par groupe de gènes pour les données longitudinales d expression génique avec une application dans un essai vaccinal contre le VIH Boris Hejblum 1,2,3 & Rodolphe Thiébaut 1,2,3 1 Inserm, U897
Approche par groupe de gènes pour les données longitudinales d expression génique avec une application dans un essai vaccinal contre le VIH Boris Hejblum 1,2,3 & Rodolphe Thiébaut 1,2,3 1 Inserm, U897
physicien diplômé EPFZ originaire de France présentée acceptée sur proposition Thèse no. 7178
 Thèse no. 7178 PROBLEMES D'OPTIMISATION DANS LES SYSTEMES DE CHAUFFAGE A DISTANCE présentée à l'ecole POLYTECHNIQUE FEDERALE DE ZURICH pour l'obtention du titre de Docteur es sciences naturelles par Alain
Thèse no. 7178 PROBLEMES D'OPTIMISATION DANS LES SYSTEMES DE CHAUFFAGE A DISTANCE présentée à l'ecole POLYTECHNIQUE FEDERALE DE ZURICH pour l'obtention du titre de Docteur es sciences naturelles par Alain
Rapport final sur les priorités en matière de surveillance de la médecine
 Département fédéral de l'intérieur DF) Office fédéral de la santé publique OFSP Unité de direction Protection des consommateurs Rapport final sur les priorités en matière de surveillance de la médecine
Département fédéral de l'intérieur DF) Office fédéral de la santé publique OFSP Unité de direction Protection des consommateurs Rapport final sur les priorités en matière de surveillance de la médecine
Liège, le 29 juillet 2013. APPEL INTERNE et EXTERNE AUX CANDIDATURES N 2013-085
 Centre Hospitalier Universitaire de Liège Domaine Universitaire du Sart Tilman B35 4000 LIEGE 1 www.chuliege.be Département de Gestion des Ressources Humaines Service Recrutement Liège, le 29 juillet 2013
Centre Hospitalier Universitaire de Liège Domaine Universitaire du Sart Tilman B35 4000 LIEGE 1 www.chuliege.be Département de Gestion des Ressources Humaines Service Recrutement Liège, le 29 juillet 2013
Votre guide des définitions des maladies graves de l Assurance maladies graves express
 Votre guide des définitions des maladies graves de l Assurance maladies graves express Votre guide des définitions des maladies graves de l Assurance maladies graves express Ce guide des définitions des
Votre guide des définitions des maladies graves de l Assurance maladies graves express Votre guide des définitions des maladies graves de l Assurance maladies graves express Ce guide des définitions des
Intérêt diagnostic du dosage de la CRP et de la leucocyte-estérase dans le liquide articulaire d une prothèse de genou infectée
 Intérêt diagnostic du dosage de la CRP et de la leucocyte-estérase dans le liquide articulaire d une prothèse de genou infectée C. Rondé-Oustau, JY. Jenny,J.Sibilia, J. Gaudias, C. Boéri, M. Antoni Hôpitaux
Intérêt diagnostic du dosage de la CRP et de la leucocyte-estérase dans le liquide articulaire d une prothèse de genou infectée C. Rondé-Oustau, JY. Jenny,J.Sibilia, J. Gaudias, C. Boéri, M. Antoni Hôpitaux
Activité 38 : Découvrir comment certains déchets issus de fonctionnement des organes sont éliminés de l organisme
 Activité 38 : Découvrir comment certains déchets issus de fonctionnement des organes sont éliminés de l organisme 1. EXTRAITS REFERENTIELS DU BO Partie du programme : Fonctionnement de l organisme et besoin
Activité 38 : Découvrir comment certains déchets issus de fonctionnement des organes sont éliminés de l organisme 1. EXTRAITS REFERENTIELS DU BO Partie du programme : Fonctionnement de l organisme et besoin
Télé-expertise et surveillance médicale à domicile au service de la médecine générale :
 Télé-expertise et surveillance médicale à domicile au service de la médecine générale : Docteur DARY Patrick, Cardiologue, Praticien Hospitalier Centre Hospitalier de St YRIEIX - Haute Vienne 87500 Situé
Télé-expertise et surveillance médicale à domicile au service de la médecine générale : Docteur DARY Patrick, Cardiologue, Praticien Hospitalier Centre Hospitalier de St YRIEIX - Haute Vienne 87500 Situé
Ischémie myocardique silencieuse (IMS) et Diabète.
 Ischémie myocardique silencieuse (IMS) et Diabète. A propos d un cas clinique, sont rappelés: - les caractères cliniques et pronostiques de l IMS chez le diabétique, - la démarche de l identification de
Ischémie myocardique silencieuse (IMS) et Diabète. A propos d un cas clinique, sont rappelés: - les caractères cliniques et pronostiques de l IMS chez le diabétique, - la démarche de l identification de
BASE. Vous avez alors accès à un ensemble de fonctionnalités explicitées ci-dessous :
 BASE BioArray Software Environment (BASE) est une base de données permettant de gérer l importante quantité de données générées par des analyses de bio-puces. BASE gère les informations biologiques, les
BASE BioArray Software Environment (BASE) est une base de données permettant de gérer l importante quantité de données générées par des analyses de bio-puces. BASE gère les informations biologiques, les
PET/CT et Sarcoïdose. Daniel O Slosman
 PET/CT et Sarcoïdose Daniel O Slosman Objectifs (PET-FDG) Rappel technique (SPECT vs. PET) Rappel biologique (Radiotraceurs et FDG) Investigations scintigraphiques (Ga-67 vs autres) Utilité clinique du
PET/CT et Sarcoïdose Daniel O Slosman Objectifs (PET-FDG) Rappel technique (SPECT vs. PET) Rappel biologique (Radiotraceurs et FDG) Investigations scintigraphiques (Ga-67 vs autres) Utilité clinique du
