ISOLEMENT DU PEPSINOGENE EQUIN
|
|
|
- Mireille St-Gelais
- il y a 9 ans
- Total affichages :
Transcription
1 ÉCOLE NATIONALE VETERINAIRE D ALFORT Année 2006 ISOLEMENT DU PEPSINOGENE EQUIN THESE Pour le DOCTORAT VETERINAIRE Présentée et soutenue publiquement devant LA FACULTE DE MEDECINE DE CRETEIL Le par Elsa, Gisèle, Huguette BOCQUET Née le 3 janvier 1979 à Bully-les-Mines (Pas-de-Calais) JURY Président : M. Professeur à la Faculté de Médecine de CRETEIL Membres Directeur : Bianca Carstanjen Maître de conférences à l Ecole Nationale Vétérinaire d Alfort Assesseur : Stéphane Blot Maître de conférences à l Ecole Nationale Vétérinaire d Alfort Invité : Benoît Rémy Service de physiologie de la reproduction - Université de Liège (Belgique)
2 LISTE DES MEMBRES DU CORPS ENSEIGNANT Directeur : M. le Professeur COTARD Jean-Pierre Directeurs honoraires : MM. les Professeurs MORAILLON Robert, PARODI André-Laurent, PILET Charles Professeurs honoraires: MM. BORDET Roger, BUSSIERAS Jean, LE BARS Henri, MILHAUD Guy, ROZIER Jacques DEPARTEMENT DES SCIENCES BIOLOGIQUES ET PHARMACEUTIQUES (DSBP) Chef du département : M. BOULOUIS Henri-Jean, Professeur - Adjoint : M. DEGUEURCE Christophe, Professeur -UNITE D ANATOMIE DES ANIMAUX DOMESTIQUES - UNITE D HISTOLOGIE, ANATOMIE PATHOLOGIQUE Mme CREVIER-DENOIX Nathalie, Professeur M. CRESPEAU François, Professeur M. DEGUEURCE Christophe, Professeur* M. FONTAINE Jean-Jacques, Professeur * Mlle ROBERT Céline, Maître de conférences Mme BERNEX Florence, Maître de conférences M. CHATEAU Henri, Maître de conférences Mme CORDONNIER-LEFORT Nathalie, Maître de conférences -UNITE DE PATHOLOGIE GENERALE, MICROBIOLOGIE, IMMUNOLOGIE Mme QUINTIN-COLONNA Françoise, Professeur* M. BOULOUIS Henri-Jean, Professeur -UNITE DE PHYSIOLOGIE ET THERAPEUTIQUE M. BRUGERE Henri, Professeur Mme COMBRISSON Hélène, Professeur* M. TIRET Laurent, Maître de conférences -UNITE DE PHARMACIE ET TOXICOLOGIE Mme ENRIQUEZ Brigitte, Professeur * M. TISSIER Renaud, Maître de conférences M. PERROT Sébastien, Maître de conférences -DISCIPLINE : BIOCHIMIE M. MICHAUX Jean-Michel, Maître de conférences - UNITE DE VIROLOGIE M. ELOIT Marc, Professeur * Mme LE PODER Sophie, Maître de conférences -DISCIPLINE : PHYSIQUE ET CHIMIE BIOLOGIQUES ET MEDICALES M. MOUTHON Gilbert, Professeur -DISCIPLINE : GENETIQUE MEDICALE ET CLINIQUE Melle ABITBOL Marie, Maître de conférences -DISCIPLINE : ETHOLOGIE M. DEPUTTE Bertrand, Professeur -DISCIPLINE : ANGLAIS Mme CONAN Muriel, Ingénieur Professeur agrégé certifié DEPARTEMENT D ELEVAGE ET DE PATHOLOGIE DES EQUIDES ET DES CARNIVORES (DEPEC) Chef du département : M. FAYOLLE Pascal, Professeur - Adjoint : M. POUCHELON Jean-Louis, Professeur - UNITE DE PATHOLOGIE CHIRURGICALE - UNITE DE MEDECINE M. FAYOLLE Pascal, Professeur * M. POUCHELON Jean-Louis, Professeur* M. MAILHAC Jean-Marie, Maître de conférences Mme CHETBOUL Valérie, Professeur M. MOISSONNIER Pierre, Professeur M. BLOT Stéphane, Maître de conférences Mme VIATEAU-DUVAL Véronique, Maître de conférences M. ROSENBERG Charles, Maître de conférences Mlle RAVARY Bérangère, Maître de conférences (rattachée au DPASP) Mme MAUREY Christelle, Maître de conférences contractuel M. ZILBERSTEIN Luca, Maître de conférences contractuel M. HIDALGO Antoine, Maître de conférences contractuel - UNITE DE CLINIQUE EQUINE M. DENOIX Jean-Marie, Professeur M. AUDIGIE Fabrice, Maître de conférences* Mme CARSTANJEN Bianca, Maître de conférences contractuel Mme GIRAUDET Aude, Professeur contractuel Melle VIREVIALLE Hameline, Maître de conférences contractuel -UNITE DE REPRODUCTION ANIMALE Mme CHASTANT-MAILLARD Sylvie, Maître de conférences* (rattachée au DPASP) M. NUDELMANN Nicolas, Maître de conférences M. FONTBONNE Alain, Maître de conférences M. REMY Dominique, Maître de conférences (rattaché au DPASP) M. DESBOIS Christophe, Maître de conférences Melle CONSTANT Fabienne, AERC (rattachée au DPASP) Melle LEDOUX Dorothée, Maître de conférences Contractuel (rattachée au DPASP) - UNITE DE RADIOLOGIE Mme BEGON Dominique, Professeur* Mme STAMBOULI Fouzia, Maître de conférences contractuel -UNITE D OPHTALMOLOGIE M. CLERC Bernard, Professeur* Melle CHAHORY Sabine, Maître de conférences contractuel - UNITE DE PARASITOLOGIE ET MALADIES PARASITAIRES M. CHERMETTE René, Professeur M. POLACK Bruno, Maître de conférences* M. GUILLOT Jacques, Professeur Mme MARIGNAC Geneviève, Maître de conférences contractuel -UNITE DE NUTRITION-ALIMENTATION M. PARAGON Bernard, Professeur * M. GRANDJEAN Dominique, Professeur Mme BLANCHARD Géraldine, Professeur contractuel DEPARTEMENT DES PRODUCTIONS ANIMALES ET DE LA SANTE PUBLIQUE (DPASP) Chef du département : M.MAILLARD Renaud, Professeur - Adjoint : Mme DUFOUR Barbara, Maître de conférences -UNITE DES MALADIES CONTAGIEUSES M. BENET Jean-Jacques, Professeur* M. TOMA Bernard, Professeur Mme HADDAD/ H0ANG-XUAN Nadia, Maître de conférences Mme DUFOUR Barbara, Maître de conférences -UNITE D HYGIENE ET INDUSTRIE DES ALIMENTS D ORIGINE ANIMALE M. BOLNOT François, Maître de conférences * M. CARLIER Vincent, Professeur M. CERF Olivier, Professeur Mme COLMIN Catherine, Maître de conférences M. AUGUSTIN Jean-Christophe, Maître de conférences - UNITE DE ZOOTECHNIE, ECONOMIE RURALE M. COURREAU Jean-François, Professeur M. BOSSE Philippe, Professeur Mme GRIMARD-BALLIF Bénédicte, Professeur Mme LEROY Isabelle, Maître de conférences M. ARNE Pascal, Maître de conférences M. PONTER Andrew, Maître de conférences* - UNITE DE PATHOLOGIE MEDICALE DU BETAIL ET DES ANIMAUX DE BASSE-COUR M. MILLEMANN Yves, Maître de conférences* Mme BRUGERE-PICOUX Jeanne, Professeur M. MAILLARD Renaud, Maître de conférences M. ADJOU Karim, Maître de conférences - DISCIPLINE : BIOSTATISTIQUES M. SANAA Moez, Maître de conférences Mme CALAGUE, Professeur d Education Physique * Responsable de l Unité AERC : Assistant d Enseignement et de Recherche Contractuel
3 A Monsieur le Professeur Professeur à la faculté de médecine de Créteil, Qui nous a fait l honneur d accepter la présidence de notre jury de thèse. Hommages respectueux. A Madame le Docteur Bianca CARSTANJEN Maître de conférences à l Ecole Nationale Vétérinaire d Alfort, Qui m a fait l honneur de diriger et corriger ce travail. Qu elle trouve ici l expression de ma reconnaissance et de mon plus profond respect. A Monsieur le Docteur Stéphane BLOT Maître de conférences à l Ecole Nationale Vétérinaire d Alfort, Pour l attention qu il a portée à l examen de ce travail. Qu il trouve ici l expression de mes sincères remerciements.
4 Table des matières Table des illustrations....5 Introduction 7 1- Partie bibliographique L'estomac du cheval: généralités Anatomie Conformation extérieure Conformation intérieure Rapports Moyens de fixité Vaisseaux et nerfs Artères Veines Vaisseaux lymphatiques Nerfs Histologie Séreuse Musculeuse Sous-muqueuse Muqueuse Muqueuse proventriculaire Muqueuse fundique Muqueuse cardiale Muqueuse pylorique Physiologie Activité digestive microbienne intra-gastrique Sécrétion Cellules productrices Cellules pariétales Cellules principales Autres cellules Régulation de la sécrétion gastrique Régulation de la production d HCl Phases de sécrétion gastrique Inhibition de la sécrétion gastrique Motricité Principales affections de l'estomac du cheval Syndrome des ulcères gastriques équins Etiopathogénie Epidémiologie Signes cliniques Diagnostic Traitement Prophylaxie Parasitisme
5 Gastérophilose équine Spiruroses digestives ou habronémoses... gastriques des Equidés Trichostrongylose du cheval Impaction / dilatation de l estomac Impaction gastrique Dilatation gastrique aiguë Néoplasie gastrique Le pepsinogène Propriétés physiques et chimiques des pepsinogènes et pepsines Poids moléculaires Composition en acides aminés Propriétés physiques Groupements C- et N-terminaux Structures secondaire et tertiaire Autres propriétés chimiques Sécrétion du pepsinogène La cellule peptique Distribution des cellules principales et. du pepsinogène dans la muqueuse Embryologie Lésion et régénération Relation structure-fonction de la cellule peptique Synthèse et sécrétion Mécanismes Effets endocrines Sécrétion du pepsinogène Considérations générales Stimulus commun Stimulation d un système Stimuli simultanés Inhibition et stimulation simultanées Inhibition secondaire Les stimuli «dominant» et «dominé» Mécanismes cellulaires de. la stimulation de la sécrétion Sécrétion basale Stimulation de la sécrétion Mécanismes cholinergiques Effets de la dénervation Histamine Stimuli hormonaux Syndrome Zolinger-Ellison L antre pylorique comme source de sécrétagogue Phase intestinale de la sécrétion gastrique Autres stimuli Inhibition de la sécrétion de pepsinogène Influences endocrines sur la sécrétion gastrique Hypophyse antérieure
6 Cortex surrénalien Autres substances endocrines Etudes cliniques de la sécrétion de.. pepsinogène gastrique Stimulants Sexe et âge Variations normales Ulcère duodénal Ulcère gastrique Tumeur gastrique Gastrite Anémie pernicieuse Autres anémies Le pepsinogène dans le sang et l urine Activation du pepsinogène en pepsine Dosages du pepsinogène Méthodes protéolytiques Méthodes immunologiques Dosages radioimmunologiques Dosage par la méthode ELISA Diffusion sur gel d agarose Description des méthodes utilisées dans l étude Précipitation des protéines Généralités Précipitation aux sels Dialyse Séparation des protéines par adsorption Chromatographie échangeuse d ions Chromatographie par adsorption Dosages Dosage des protéines par la méthode de Lowry Dosage du pepsinogène par la méthode Dorny Electrophorèse Généralités Préparation et déroulement d une électrophorèse sur gel de polyacrylamide Partie travail personnel Matériel et méthodes Préparation de la muqueuse glandulaire Origine Préparation de la muqueuse Précipitation des protéines Chromatographie Résultats Préparation de la muqueuse glandulaire Précipitation des protéines Résultats des différentes chromatographies Chromatographie sur colonne DEAE Séphadex A Chromatographie sur colonne DEAE Céramic
7 Chromatographie sur colonne hydroxyapatite Electrophorèse Discussion Comparaison des différentes purifications du pepsinogène équin Intérêt du dosage du pepsinogène sanguin chez le cheval..80 Conclusion...84 Bibliographie
8 Table des illustrations Figures Figure 1 : Conformation extérieure de l estomac du cheval (d après Barone, 1984) Figure 2 : Conformation intérieure et répartition des différents types de muqueuse de l estomac du cheval (d après Barone, 1984) Figure 3 : Organes abdominaux de la région diaphragmatique du cheval, vue caudale après isolement en bloc par désinsertion du diaphragme (d après Barone, 1984) Figure 4 : Musculature gastrique du cheval (d après Barone, 1984) Figure 5 : coupe transversale schématique de la muqueuse fondique de cheval (d après Barone, 1984) Figure 6 : Différents intervenants de la stimulation de la sécrétion gastrique et leurs relations (d après Lefrançois et Tiret, 2000) Figure 7 : Différents intervenants de l inhibition de la sécrétion gastrique et leurs relations (d après Lefrançois et Tiret, 2000) Figure 8 : Différents intervenants de la stimulation de la motricité gastrique et leurs relations (d après Lefrançois et Tiret, 2000) Figure 9 : Différents intervenants de l inhibition de la motricité gastrique et leurs relations (d après Lefrançois et Tiret, 2000) Figure 10 : Relation entre les structures du pepsinogène, de la pepsine et des autres molécules formées au cours de la conversion du pepsinogène en pepsine (d après Herriott, 1962) Figure 11 : Principe de la dialyse (d après Stryer, 1992) Figure 12: Principe de la résine échangeuse d anions (d après Stryer, 1992) Figure 13: Appareillage et gel d électrophorèse (d après Stryer, 1992) Figure 14 : Profil d'élution de la DEAE Céramic I (d après Benoît Rémy, 2005) Figure 15 : Profil d'élution de la colonne hydroxyapatite (d après Benoît Rémy, 2005) Figure 16 : Electrophorèse monodimensionnelle SDS-PAGE du chargement et des différents pics obtenus après passage sur colonne DEAE céramic. La ligne STD montre les standards de masse moléculaire (d après Benoît Rémy, 2005) - 5 -
9 Figure 17 : Electrophorèse monodimensionnelle SDS-PAGE du chargement et des différents pics obtenus après passage sur colonne d'hydroxyapatite. La ligne STD montre les standards de masse moléculaire (d après Benoît Rémy, 2005) Photos Photo 1 : Images endoscopiques normales et pathologiques de l estomac du cheval (a : muqueuses squameuse (blanchâtre) et glandulaire (rose foncée) normales d un cheval adulte ; b : idem pour un poulain ; c : desquamation de la muqueuse gastrique chez un poulain de 14 jours ; d : ulcération extensive de la muqueuse squameuse chez un cheval adulte ; e : ulcères sanguinolents de la muqueuse squameuse chez un adulte ; f : ulcère chronique (C), aigu (A) de la muqueuse squameuse et ulcère de la muqueuse glandulaire (GU) ; g : sévère ulcération de la muqueuse non glandulaire chez un poulain de 4 mois) (d après Murray, 1997) Photo 2 : Larves L3 de Gasterophilus spp dans l estomac d un poulain observé au cours de l autopsie (d après Elsa Bocquet) Photo 3 : Image endoscopique de carcinome épidermoïde gastrique (flèches) chez un cheval (d après Vatistas et al., 1997) Tableaux Tableau 1 : Mesure des quantités de protéines et de protéases dans les différents précipités au sulfate d ammonium Tableau 2 : Résultats obtenus à partir des dosages des différentes fractions de la chromatographie sur la colonne DEAE Séphadex A25 Tableau 3 : Résultats obtenus à partir des dosages des différentes fractions de la chromatographie sur la colonne DEAE Céramic Tableau 4 : Résultats obtenus à partir des dosages des différentes fractions de la chromatographie sur la colonne hydroxyapatite Tableau 5 : Tableau comparatif des deux études sur l isolement du pepsinogène équin publiées dans la littérature avec la nôtre - 6 -
10 Introduction Le cheval peut être atteint de différentes affections gastriques de fréquence et de gravité variables. En premier lieu, le syndrome d ulcères gastriques équins est rencontré couramment chez les chevaux de tout âge mais touche plus particulièrement les jeunes chevaux de course et les poulains (Murray et al., 1990 ; Murray et al., 1996). Les signes cliniques accompagnant ce syndrome peuvent être absents dans les cas où la lésion est découverte par gastroduodénoscopie ou nécropsie dans un but prospectif, ou constituer un ensemble de symptômes non spécifiques caractérisé par de la faiblesse, de l amaigrissement, de l inconfort, un appétit variable et des coliques ou des diarrhées récurrentes ; dans les cas les plus graves, une perforation suivie d une péritonite peuvent survenir. Par ailleurs, l estomac peut être l objet d une contamination parasitaire par des larves du genre Gasterophilus spp le plus souvent, Habronema spp ou Trichostrongylus spp. Ces infestations s accompagnent d amaigrissement, de troubles digestifs (colique ou diarrhée) voire de péritonite dans les cas les plus sévères (Beugnet, 2003 ; Bussiéras et Chermette, 1995). Enfin il existe des néoplasies gastriques qui sont rares et le plus souvent incurables (Tamzali, 2003). Ces entités pathologiques gastriques se traduisent par une atteinte de l intégrité de la muqueuse et par conséquent par une libération de plusieurs composés cellulaires. En particulier le pepsinogène qui est le précurseur d une enzyme protéolytique, la pepsine, est activé en milieu acide gastrique après avoir été sécrété par les cellules principales. Cette substance fait l objet de tests spécifiques de type ELISA ou radio-immunologie, utilisés avec succès en médecine humaine pour le diagnostic d affections gastriques notamment des ulcères. En raison du manque d anticorps spécifiques d espèce, le dosage du pepsinogène n est pas rapporté comme étant une technique diagnostique fiable et clairement établie chez le cheval, la vache et le mouton. De fait, l examen endoscopique de l estomac représente la seule méthode valable pour le diagnostic des ulcères, des néoplasies et dans une moindre mesure du parasitisme. Cependant l équipement requis et la réalisation technique de l acte sont des limites non négligeables pour le praticien non spécialiste. L objectif de cette étude est d isoler et de purifier le (ou les) pepsinogène(s) du cheval avec pour but, dans un deuxième temps, la production d anticorps spécifiques mis en œuvre dans des tests diagnostiques d affections gastriques. Nous nous intéressons d abord aux données déjà acquises sur le pepsinogène ainsi qu à quelques données générales sur l estomac puis à l explication du principe des différentes techniques employées. Dans un deuxième temps, nous détaillons le protocole expérimental que nous avons mis en œuvre ainsi que les résultats obtenus. Enfin nous évoquons l interprétation des résultats, leur qualité et une comparaison avec ceux acquis dans les études précédentes
11 1- Partie bibliographique 1-1 L estomac du cheval : généralités Anatomie (Barone, 1984) Conformation extérieure La forme varie selon l état de vacuité ou de réplétion et en fonction des contractions de la musculeuse. Dans un état moyen, l estomac apparaît comme un sac allongé, légèrement aplati crânio-caudalement et replié sur lui-même de telle sorte que le cardia et le pylore sont proches l un de l autre. Il forme un croissant à convexité gauche puis ventrale. Cette disposition permet de reconnaître à l estomac : - deux faces : l une est antérieure ou «pariétale» ou «diaphragmatique» et l autre postérieure ou «viscérale», toutes deux sont lisses, convexes, tapissées par le péritoine viscéral et parcourues par des vaisseaux flexueux ; - deux bords ou courbures : la plus courte est nommée petite courbure et constitue le bord droit, concave de l organe. Elle commence ventralement au cardia et se termine en région dorsale du pylore. La jonction de la partie pylorique avec le reste de l organe s y marque par une angulation appelée incisure angulaire. Sur toute sa longueur, la petite courbure donne insertion au ligament hépato-gastrique, partie du petit omentum. La plus longue s appelle la grande courbure et forme le bord gauche, convexe et très extensible de l estomac. Elle débute dorsalement au cardia et se termine en partie ventrale du pylore. Elle donne attache sur toute sa longueur au grand omentum ou épiploon. Vers son milieu, on peut observer avec un état moyen de réplétion un léger étranglement correspondant à la limite entre ses parties proventriculaire et glandulaire. - deux extrémités : la plus volumineuse est le fundus gastrique, encore appelé grosse tubérosité ou saccus caecus, cette partie dorsale gauche de l estomac apparaît renflée et forme un cul-de-sac, très développé chez les Equidés. Il détermine avec l insertion de l œsophage une sorte de sillon très accentué : l incisure cardiale. L autre extrémité est la partie pylorique qui fait suite au corps de l estomac en se rétrécissant progressivement et en se portant vers la droite et vers le haut. Elle se termine par le pylore que marquent un léger rétrécissement annulaire et une consistance plus ferme. Un léger rétrécissement subdivise la partie pylorique en deux segments : le premier, le plus large, constitue l antre pylorique puis suit le deuxième segment, plus étroit, qui aboutit au pylore et s appelle canal pylorique. On nomme corps de l estomac la partie de l organe comprise entre le fundus et la partie pylorique. L estomac des Equidés est peu volumineux. Chez le cheval, sa capacité moyenne est de 10 à 15 litres, avec des variations de 6 à 25, voire 30 litres selon les individus et en fonction des repas. La surface de la muqueuse est de l ordre de cm² dont la moitié environ appartient au proventricule. Le poids de l organe entièrement vidé est voisin de 2 kilogrammes en moyenne. Chez l âne, le viscère est relativement plus capasse : il contient en moyenne 10 litres et son poids à l état de vacuité est de l ordre de 1,5 kilogramme
12 Figure 1 : Conformation extérieure de l estomac du cheval (d après Barone, 1984) - 9 -
13 Conformation intérieure Elle ressemble en négatif à la conformation extérieure avec les mêmes subdivisions. La paroi stomacale a une épaisseur uniforme sauf au niveau du pylore où elle présente un épaississement marqué chez le cheval. La muqueuse gastrique montre des modifications dans sa couleur suivant la région de l estomac considérée. La grosse tubérosité gauche est tapissée intérieurement d une muqueuse proventriculaire résistante, sèche, blanchâtre et lisse, comme celle de l œsophage qu elle continue. Elle s étend en outre sur la petite courbure et la partie adjacente des faces, jusqu au niveau de l incisure gastrique. Elle est séparée de la muqueuse fundique par une ligne de suture (margo plicatus) formant une crête saillante, irrégulière et sinueuse. La muqueuse glandulaire est limitée à la moitié droite de l organe, elle est discrètement plus épaisse que la muqueuse proventriculaire, molle et enduite de mucus. Elle forme des gros plis gastriques distensibles, orientés plus ou moins parallèlement en direction du pylore. Elle comprend une partie fundique qui est rougeâtre et une partie pylorique qui montre une couleur jaunâtre ou grise. Le cardia présente des spécificités importantes. L ostium cardial est très étroit et presque obturé par les plis de la muqueuse oesophagienne qui s étalent autour de lui avec une disposition radiaire assez régulière. Cet agencement, lié au développement de la partie correspondante de la musculeuse, rend toute régurgitation impossible à moins d une déchirure du cardia. Le pylore est pourvu d un sphincter épais. Sa muqueuse forme des plis longitudinaux qui commencent dans le canal pylorique et disparaissent très vite sur le versant duodénal, lequel correspond à une dilatation brusque du début de l intestin
14 Figure 2 : Conformation intérieure et répartition des différents types de muqueuse de l estomac du cheval (d après Barone, 1984)
15 Rapports L estomac est en contact avec d nombreux organes : foie, pancréas, rate, côlons ascendant, descendant et transverse, jéjunum et diaphragme. En raison de son faible volume et du grand développement du côlon, l estomac n a jamais, quel que soit son état de réplétion, de rapports avec la paroi abdominale ventrale. Figure 3 : Organes abdominaux de la région diaphragmatique du cheval, vue caudale après isolement en bloc par désinsertion du diaphragme (d après Barone, 1984) Moyens de fixité La continuité avec l œsophage et l intestin maintient l estomac en place, surtout pour l œsophage qui, bien inséré dans le diaphragme, constitue un élément de fixité important. La pression des viscères digestifs intervient de façon importante chez les Equidés. Le péritoine forme des ligaments et des replis, les omentums. Tous ces ligaments et replis sont en continuité les uns avec les autres : ils résultent de l accolement des feuillets péritonéaux de chaque face (diaphragmatique et viscérale) autour de l organe. Il existe donc un véritable cadre de ligaments et replis péritonéaux qui s insère sur les deux courbures de l estomac. Le petit omentum est une lame grossièrement quadrilatère, ployée sur elle-même, qui s insère d une part sur toute la petite courbure gastrique, se prolonge au début du duodénum jusqu au pancréas, d autre part sur la face viscérale (caudale) du foie. Cette disposition permet de le diviser en deux ligaments : l hépato-gastrique et l hépato-duodénal. L extrémité gauche du petit omentum est attachée à la terminaison de l œsophage, du diaphragme au cardia. Quant à l extrémité droite, elle est libre et ourlée par la veine
16 Le ligament gastro-phrénique s étend du fundus (cul-de-sac gauche) de l estomac aux piliers gauches du diaphragme. Son insertion stomacale va de l œsophage jusqu à la rate où il devient le grand omentum. Il est court mais très fort : c est un véritable ligament suspenseur de l estomac. Le grand omentum est une vaste membrane mince, cribliforme, souvent chargée de graisse et qui flotte librement dans la cavité abdominale. Il est chargé d un riche réseau de vaisseaux sanguins et lymphatiques qui lui communiquent de remarquables aptitudes réactionnelles. Il prend pour origine toute la grande courbure de l estomac, où se rejoignent les feuillets séreux qui ont tapissé chacune des faces de l organe, depuis le sommet du fundus jusqu à l origine du duodénum. Depuis ces attaches initiales, le grand omentum se porte très peu ventralement et caudalement en constituant une lame ou paroi superficielle. Le deuxième feuillet constitue la lame ou paroi profonde. Elle se sépare de la précédente aux abords de l estomac où elle remonte dorsalement, entre l estomac et les intestins, pour aller s insérer sur le côlon transverse et le pancréas. Les deux lames de l omentum n étant pas adhérentes l une à l autre, elles délimitent une cavité, la bourse omentale, qui est presque entièrement fermée ; elle ne communique avec le reste de la cavité abdominale que par un orifice : le foramen épiploïque Vaisseaux et nerfs Artères Toutes les artères des organes de la région post-diaphragmatique dont l estomac proviennent de l artère cœliaque qui naît de la face ventrale de l aorte abdominale au niveau de la dernière vertèbre thoracique. L artère cœliaque donne trois branches après avoir longé le bord crânial du pancréas. L artère gastrique gauche se distribue à la petite courbure et sur les deux faces du corps, ainsi qu au cardia et au revers correspondant du fundus. La plus volumineuse des trois, l artère splénique ou liénale irrigue le reste du fundus, la moitié gauche de la grande courbure, la partie adjacentes des faces et le pylore. L artère hépatique distribue le sang à la région pylorique, à une partie de la petite courbure et aux zones qui bordent la moitié droite de la grande courbure. Toutes les divisions de ces artères sont très flexueuses pour pouvoir se prêter aux variations de volume de l organe et cheminent quelque temps sous la séreuse avant d alimenter les divers réseaux artériels de la paroi Veines Elles commencent par un réseau de gros capillaires anastomosés autour des cryptes, sous la surface de la muqueuse, où ils reçoivent les capillaires périglandulaires. De ce réseau plongent en profondeur des veinules anastomosées qui se collectent progressivement à chaque couche de la paroi gastrique pour aboutir finalement aux racines des veines proprement dites de l estomac. Ces veines accompagnent exactement les branches de distribution des artères. Elles sont en général au nombre de deux pour chacune de celles-ci, qu elles encadrent. Mais au voisinage du point où elles quittent le viscère, elles s unifient et il n y a jamais qu une seule veine pour accompagner une artère de n importe quelle importance. Les grandes veines de l estomac répètent d abord la disposition des artères puis s en séparent et les veines gastriques, liénale et gastro-duodénale aboutissent à la veine porte, qui draine leur sang vers le foie Vaisseaux lymphatiques Ils naissent en cul-de-sac sous l épithélium superficiel de la muqueuse. Ils s anastomosent rapidement en un réseau muqueux. Ce système alimente un réseau sous-muqueux dont les
17 efférents perforent la musculeuse, drainent au passage le plexus musculaire et aboutissent à un plexus sous-séreux. Ce dernier est surtout dense sur les faces de l estomac. Ses efférents effectuent un trajet souvent long pour rejoindre les nœuds lymphatiques gastriques qui appartiennent au lymphocentre cœliaque. Chez le cheval, ces nœuds sont constants, petits, nombreux (15 à 35) et placés le long de la petite courbure ; un groupe accessoire de 10 à 20 nœuds lymphatiques omentaux est logé le long de la grande courbure de l estomac dans le grand omentum Nerfs Ils proviennent du parasympathique (qui augmente le tonus, la motricité et a sécrétion gastriques) par les nerfs vagues et du sympathique, dont le rôle est ici modérateur, par le plexus cœliaque. Le trajet des premiers est en principe distinct de celui des vaisseaux. Le tronc vagal ventral distribue ses branches à la face antérieure du corps, à la petite courbure et à la partie pylorique, tandis que le tronc vagal dorsal en donne au fundus et à la face postérieure. Les nerfs sympathiques, au contraire, accompagnent les divers vaisseaux et forment autour d eux des lacis plexiformes Histologie (Barone, 1984) Quatre tuniques constituent la paroi de l estomac. De l extérieur vers l intérieur, ce sont : la séreuse, la musculeuse, la sous-muqueuse et la muqueuse Séreuse Elle est constituée par le feuillet viscéral du péritoine, continu au niveau des courbures avec les mésos précédemment décrits. Elle se sépare en deux feuillets entre lesquels est logé le viscère. Chacun d eux adhère très intimement à la face correspondante. C est seulement sur le trajet des vaisseaux et nerfs superficiels qu on trouve les éléments d une véritable sousséreuse. Au niveau des courbures, à l insertion des omemtums, on trouve un conjonctif souspéritonéal plus abondant et la séreuse devient mobile sur le plan sous-jacent. Cette disposition, favorable à la distension de ces zones, contribue à faciliter les variations de volume de l organe. En regard de la petite courbure, la séreuse est en outre doublée par une petite quantité de tissu élastique qui semble avoir pour rôle de maintenir les deux extrémités de l organe rapprochées l une de l autre Musculeuse Comme celles de l œsophage et de l intestin, la musculature de l estomac présente deux plans de fibres fondamentaux, l un superficiel, longitudinal et l autre profond, circulaire. Cependant la morphologie particulière du viscère entraîne des remaniements, surtout marqués sur le fundus et dans la partie adjacente du corps. Selon les niveaux, on observe une dissociation, un renforcement ou encore un changement d orientation des plans musculaires, en rapport avec la conformation et la fonction propres à chaque région de l organe. Aux deux couches fondamentales s ajoutent ainsi dans le fundus et le corps de l estomac deux couches obliques, l une externe et l autre interne, la plus profonde. Immédiatement sous-séreuse, la couche longitudinale est réduite à une bande le long de chacune des deux courbures. Dans la partie pylorique, la couche longitudinale se renforce de fibres élastiques, devient complète et se poursuit par la couche longitudinale de l intestin. Les fibres obliques externes représentent une dépendance de la couche précédente et n existent qu au niveau du fundus et de la partie adjacente du corps. Elles sont particulièrement développées et forment un plan relativement épais, presque partout superficiel
18 La couche circulaire est absente au niveau du fundus et mince dans la partie adjacente du corps. Elle occupe une situation intermédiaire entre les plans précédents et les fibres obliques internes, qui la laissent toutefois en rapport direct avec la sous-muqueuse dans la partie pylorique. Elle est surtout nette au niveau de la petite courbure, où elle continue la couche circulaire de l œsophage, et ses faisceaux se perdent sur les faces du corps. Elle devient plus nette et complète dans la partie pylorique, surtout en regard du canal pylorique où elle se renforce et constitue le sphincter pylorique, remarquablement épais et susceptible par sa contraction de fermer complètement la communication avec l intestin. Les fibres obliques internes ne sont présentes que dans le fundus et le corps de l estomac. Elles constituent une couche épaisse, qui se met en continuité avec les fibres circulaires de la face gauche de l œsophage et dans laquelle on peut reconnaître deux parties continues l une avec l autre : - L anse cardiale embrasse le côté gauche du cardia et présente son maximum d épaisseur au fond de l incisure cardiale. Ses branches se portent de part et d autre de la petite courbure, en s étalant jusqu à l incisure gastrique de sorte que leurs faisceaux s irradient dans les faces de l organe ce qui délimite une gouttière dont le fond est constitué par les fibres circulaires de la petite courbure qui ferment à droite l encadrement musculaire du cardia. Le sommet de l anse cardiale est particulièrement épais ; il participe avec les fibres circulaires de la partie droite du cardia à la formation d un système sphinctériel puissant, qui bloque normalement l orifice de ce dernier. - Quand aux fibres obliques internes proprement dites, on peut les considérer comme une expansion de l anse cardiale sur l ensemble de la partie gauche de l estomac, en croisant la direction des fibres obliques externes
19 Figure 4 : Musculature gastrique du cheval (d après Barone, 1984)
20 Sous-muqueuse Cette tunique n est que faiblement unie à la face interne de la musculeuse, alors que sa face cavitaire adhère de la façon la plus intime à la muqueuse. Elle est constituée par un conjonctif lâche, surtout abondant dans la partie pylorique et épouse les moindres plis de la muqueuse qu elle supporte. Elle contient un très riche réseau vasculaire et un important plexus nerveux sous-muqueux mais elle est dépourvue de glandes Muqueuse Muqueuse proventriculaire Elle est sèche, blanchâtre et très comparable à la muqueuse oesophagienne. Sa musculaire muqueuse est relativement épaisse et présente deux plans de fibres irréguliers, souvent dissociés ; elle délègue de nombreux faisceaux dans la muqueuse propre qui est épaisse, fibreuse et résistante, riche en fibres élastiques. Il s en élève un grand nombre de petites papilles, toutes noyées dans l épithélium qui est épais, stratifié pavimenteux et non kératinisé. Les glandes font totalement défaut. L étude du développement a permis de mettre en évidence que la formation du proventricule correspond à une métaplasie de la muqueuse gastrique et non à une invasion de l estomac par l œsophage Muqueuse fundique Elle est considérée comme type de muqueuse gastrique proprement dite. Elle est refoulée entièrement dans le corps de l estomac et ne se trouve donc plus dans le fundus. Elle est épaisse, molle et rougeâtre. Son organisation générale est soulignée par l agencement de la musculaire-muqueuse. Celle-ci est forte, pourvue de deux plans de fibres dont l externe est longitudinal et l interne transversal. Ce dernier délègue entre les glandes de la muqueuse de nombreux faisceaux de fibres lisses qui forment des travées ou relèvements. Des relèvements majeurs isolent nettement des groupes glandulaires formant de véritables lobules qui se traduisent à la surface de la muqueuse par de minuscules champs surélevés : les aires gastriques séparées par d étroits sillons. Chaque lobule est à son tour subdivisé par des relèvements mineurs en petits groupes glandulaires dont les canaux excréteurs s ouvrent sur d étroites et profondes dépression : les cryptes gastriques percées sur les aires gastriques ou dans les sillons. La présence de ces multiples dépressions détermine sur les aires un réseau de faibles crêtes intermédiaires : les replis villeux. Le chorion conjonctif ou lamina propria est un tissu conjonctif qui entoure et soutient les structures épithéliales. Il est discret et riche en vaisseaux notamment sanguins mais également souvent infiltré de cellules lymphoïdes qui peuvent se regrouper en points lymphoïdes, surtout nombreux en zone pylorique. L épithélium est simple, formé d une seule rangée de cellules portée par une mince limitante et dont les caractères varient selon les points considérés. Il s enfonce en effet dans l épaisseur du chorion pour constituer une infinité de glandes en tubes, serrées presque au contact les unes des autres, qui occupent presque toute l épaisseur de la muqueuse. A la surface de celleci et dans la partie adjacente des cryptes, il est formé de cellules prismatiques, hautes et claires. Ces dernières deviennent plus basses et peu à peu cubiques vers le fond des cryptes et sur les orifices glandulaires. Les glandes fundiques ou fondiques ou gastriques propres sont tubuleuses, simples ou parfois bifurquées, presque rectilignes et perpendiculaires à la surface. Elles deviennent sinueuses ou légèrement contournées dans la profondeur. On reconnaît à chacune d elles un isthme ou col ou collet assez étroit et cylindrique, qui débouche dans la crypte ; un corps ou partie
21 principale, un peu plus large, cylindrique et bosselé, à peine flexueux et enfin un fond contourné et terminé en cul-de-sac. La lumière glandulaire est extrêmement étroite et souvent difficile à discerner. L épithélium comporte quatre types de cellules : - des cellules muqueuses ou mucocytes, cubiques et régulières, au cytoplasme basophile, localisées à l isthme dont elles forment seules le revêtement et sécrétant un mucus composé de glycosaminoglycanes acides ; de nombreuses figures de mitose peuvent également être observées, - dans le corps et le fond, des cellules principales ou glandulocytes principaux, clairs, de petite taille, polyédriques à noyau central ou basal, au cytoplasme basophile dans lequel s accumulent en région apicale des grains de sécrétion acidophile. Les caractéristiques observées sont celles d une cellule séreuse, c est-à-dire d une cellule à sécrétion exocrine protéique. Leur sécrétion est en effet constituée principalement d enzymes digestives, notamment du pepsinogène ainsi que de rénine. - des cellules bordantes ou glandulocytes pariétaux beaucoup moins nombreuses que les précédentes et surtout visibles au niveau du corps de la glande, plus rares dans le fond. Ce sont de volumineuses cellules piriformes qui déforment le contour glandulaire. En microscopie photonique, elles sont caractérisées par un noyau sphérique central et un cytoplasme acidophile comportant de nombreuses petites granulations acidophiles réfringentes correspondant aux mitochondries. En microscopie électronique, on remarque un réseau cananiculaire constituant un très important dispositif d amplification des surfaces membranaires ouvertes sur la lumière. Ces cellules interviennent dans la libération de l acide chlorhydrique. - des cellules argento-chromaffines, peu nombreuses, surtout présentes dans le fond des glandes. Elles sont de forme pyramidale et leur pôle apical, effilé, n a pas de contact direct avec la lumière. En microscopie photonique, elles sont caractérisées par leurs granulations qui s accumulent à leur pôle basal et sont colorables par les sels d argent et de chrome. En microscopie électronique, on observe un réticulum endoplasmique granuleux apical et un appareil de Golgi infranucléaire d où se détachent les grains de sécrétion, limités par une membrane, au contenu osmiophile. La polarité morphologique de ces cellules est donc orientée vers le pôle basal, contrairement aux autres cellules de la glande, ce qui caractérise une potentialité sécrétrice endocrine. Embryologiquement et fonctionnellement, ces cellules appartiennent au système APUD, système endocrine diffus de l organisme
22 Figure 5 : coupe transversale schématique de la muqueuse fondique de cheval (d après Barone, 1984) Muqueuse cardiale Elle s interpose entre la muqueuse oesophagienne du proventricule et la muqueuse fondique et ce raccordement est refoulé dans la partie moyenne de l organe où il n occupe qu une bande étroite de quelques millimètres entre la margo plicatus et la muqueuse fondique et disparaît même au voisinage de la petite courbure, où il se raccorde progressivement à la muqueuse pylorique. Son organisation est similaire à celle de la muqueuse fundique mais les glandes cardiales sont plus richement ramifiées et contournées qu en région fondique et sécrètent du mucus
23 Muqueuse pylorique Elle occupe toute la partie pylorique ainsi qu une zone variable du corps. Elle est plus mince et plus claire que la muqueuse fundique, un peu moins plissée aussi sauf au voisinage immédiat du pylore. Elle présente encore la même organisation générale mais les relèvements majeurs et mineurs de sa musculaire muqueuse sont beaucoup plus puissants, le groupement lobulaire des glandes particulièrement net et les cryptes beaucoup plus profondes et étroites. Ces dernières se rétrécissent de plus en plus vers le pylore en même temps que des tubes glandulaires plus nombreux s ouvrent isolément à la surface des aires gastriques. Par ailleurs, les glandes pyloriques sont fortement ramifiées et contournées sur elles-mêmes de façon à former sur les coupes histologiques des amas montrant de multiples petites surfaces de section. Ce sont des glandes muqueuses constituées majoritairement de cellules mucipares à pôle muqueux fermé, au noyau aplati et basal Physiologie (Lefrançois et Tiret, 2000) Activité digestive microbienne intragastrique Dans certaines conditions alimentaires, la fermentation intra-gastrique d hydrates de carbone ingérés peut être envisagée chez le cheval. Certaines bactéries intervenant dans la fermentation comme Lactobacillus acidophilus sont capables de survivre dans un environnement relativement acide. La substance majoritaire produite par fermentation par Lactobacillus est l acide lactique dont une grande quantité peut être générée dans un estomac de cheval s il y a une grande proportion d hydrates de carbone solubles dans la ration. D autre part, les bactéries qui convertissent ces hydrates de carbone en acides gras volatils sont plus sensibles à l acidité mais sont aussi présentes dans l estomac des chevaux. Il a été formulé l hypothèse selon laquelle ces bactéries colonisent l intérieur des ingesta fibreux les plus grossiers qui se collectent vers le sommet du contenu gastrique où le ph est plus à leur convenance parce que cette zone n est pas complètement pénétré par l acide gastrique. Ce ph plus élevé est encore augmenté par la salive parotidienne qui a été avalée et qui est produite à raison de 10 à 12 litres par jour chez un cheval adulte et possède une concentration en bicarbonates environ deux fois plus grande que celle du plasma. Cependant les acides gras volatils produits par l estomac du cheval ne sont pas absorbés vers le flux sanguin et par ailleurs la muqueuse non glandulaire est particulièrement résistante à la pénétration de ces substances Sécrétion Les sécrétions gastriques comprennent principalement de l acide chlorhydrique (HCl), du pepsinogène, le facteur intrinsèque et du mucus. L HCl permet de diminuer le ph du contenu gastrique et d activer le pepsinogène en pepsine intervenant dans la digestion des protéines. Le facteur intrinsèque est le facteur permettant l absorption de la vitamine B12 dans l iléon. Le mucus intervient en particulier dans la protection et la lubrification de la muqueuse Cellules productrices Les zones cardiale et du fundus comprennent essentiellement des cellules à mucus. Dans la zone pariétale ou fondique, on trouve des cellules pariétales (sécrétion d HCl), des cellules muqueuses et des cellules principales (sécrétion de pepsinogène). Dans la zone pylorique, les glandes sont plus profondes et contiennent des cellules G et des cellules muqueuses. Ces dernières peuvent avoir un rôle complémentaire de sécrétion de pepsinogène
24 Enfin on trouve dans la muqueuse gastrique des cellules enterrochromaffines-like qui sécrètent l histamine Cellules pariétales Le rôle majeur des cellules pariétales est de sécréter l HCl et d acidifier le contenu gastrique. Ces cellules possèdent l anhydrase carbonique qui catalyse la combinaison de CO 2 provenant du métabolisme cellulaire et de l H 2 O pour former H 2 CO 3. A la membrane apicale, des canaux H + /K + ATPase dépendant assurent activement la sécrétion de H +. Les ions Cl - suivent H + par diffusion à travers les canaux Cl -. A la membrane basolatérale HCO 3 - passe dans le sang grâce à un échangeur Cl - /HCO 3 -. Ces bicarbonates sont responsables d une alcalinisation du sang après un repas. Ils peuvent être sécrétés dans le tractus digestif par les sécrétions pancréatiques. La cellule pariétale produit aussi le facteur intrinsèque : une mucoprotéine indispensable à l absorption de la vitamine B Cellules principales Il s agit d une cellule sécrétrice spécialisée qui produit le pepsinogène qui est une proenzyme inactive permettant de protéger la cellule productrice. Il existerait plusieurs isoformes de pepsinogène équin mais la signification fonctionnelle de ces molécules concernant la protéolyse intra-gastrique n est pas connue. Quand le ph du suc gastrique est bas c est-à-dire inférieur à 4 (grâce à la production d HCl), le pepsinogène est converti en pepsine par coupure de la protéine et le peptide libéré qui est inhibiteur de l action de la pepsine est détruit. La pepsine commence la digestion des protéines en scindant les acides aminés tyrosine et phénylalanine après un carbone terminal. La cellule principale sécrète d autres enzymes gastriques dont la lipase, l amylase et la gélatinase. Concernant la lipase gastrique, elle possède un pic d activité pour un ph de 4 et elle est produite en quantité non négligeable par le cheval sans pour autant que son rôle dans la digestion des ingesta soit déterminé. Par ailleurs, le pancréas du cheval engendre beaucoup plus de lipase que n importe quelle autre enzyme digestive élaborée par cet organe, de plus une étude récente montre que les chevaux peuvent assimiler une quantité non négligeable de lipides. Les autres enzymes citées sont également générées par le pancréas en quantités plus conséquentes que l estomac et leur rôle n a pas été étudié Autres cellules Les cellules G, présentent dans la muqueuse pylorique, sont endocrines et élaborent la gastrine soluble grâce au motif répété d acide glutamique. La pentagastrine synthétique reproduit l activité de la gastrine. Les cellules D situées à la fois dans les muqueuses fondique et pylorique sécrètent de la somatostatine et ont une action plus paracrine qu endocrine. Ces cellules sont en effet très proches des cellules effectrices qui sont variées ce qui permet d avoir une action directe évitant ainsi le recours à la circulation sanguine pour la distribution. Cependant la somatostatine peut être relarguée dans le sang mais la majeure partie de ces actions concernant l estomac se fait par voie paracrine Régulation de la sécrétion gastrique Régulation de la production d HCl L acétylcholine, l histamine et la gastrine stimulent la sécrétion d HCl par la cellule pariétale. L acétylcholine se fixe sur les récepteurs muscariniques de cette cellule et induit par le second messager IP3 une augmentation de calcium intra-cellulaire conduisant à l activation des protéines kinases et à la sécrétion d H +. La gastrine agit de façon endocrine, se fixe sur son récepteur et induit une stimulation de cette sécrétion. Le syndrome de Zollinger-Ellison correspond à l apparition d une tumeur pancréatique associée à une surproduction de gastrine
25 qui induit une augmentation de la production d HCl par la cellule pariétale et qui a un effet trophique sur cette cellule. L histamine produite par les cellules enterrochromaffines-like agit de façon paracrine en se fixant sur son récepteur H2. Le second messager est l AMP C responsable de l activation des protéines kinases. Il existe un phénomène de potentialisation entre ces trois molécules. Chez le cheval, la sécrétion d HCl est moins marquée que pour les monogastriques carnivores et omnivores. Il en résulte une stérilisation moins poussée des ingesta ce qui est à l origine d une résistance partielle de la flore bactérienne responsable de l ensemencement des réservoirs postérieurs Phases de sécrétion gastrique La phase céphalique est une phase d anticipation. Les stimuli sont l odeur, le goût, les réflexes conditionnés, la mastication et la déglutition. Ces stimuli induisent une stimulation du nerf vague et la sécrétion d une part d acétylcholine provoquant la production d HCl, et d autre part de GRP favorisant la sécrétion de gastrine et par conséquent d HCl par les cellules G. La phase gastrique apporte environ 60% des sécrétions. La distension de l estomac, les produits de dégradation des protéines (acides aminés et peptides) sont les stimuli majoritaires. La distension induit une stimulation vagale et un réflexe local qui stimule principalement la production de gastrine. Les produits de dégradation des protéines ont un effet direct de stimulation de la production de gastrine. La stimulation vagale est également responsable d une augmentation de sécrétion de pepsinogène. Les ions H+ induisent un réflexe local stimulant la sécrétion de pepsinogène assurant une production quand le ph est suffisamment bas pour permettre l activation du pepsinogène. La phase intestinale est mise en œuvre par la présence de produits protéiques dans le duodénum et assure 10% des sécrétions gastriques. Pendant les périodes interdigestives, les sécrétions correspondent principalement à du mucus. Figure 6 : Différents intervenants de la stimulation de la sécrétion gastrique et leurs relations (d après Lefrançois et Tiret, 2000)
26 Inhibition de la sécrétion gastrique Plusieurs mécanismes participent à l inhibition des sécrétions gastriques. Une concentration élevée d H + provoquée par exemple par la vidange gastrique (à la fin de l effet tampon des aliments) inhibe la production de gastrine et donc d HCl. Le contenu duodénal joue aussi un rôle sur les sécrétions gastriques. Une concentration élevée d acides, de peptides ou une irritation provoque un réflexe d inhibition vagale. Les lipides, l acidité, l hyperosmolarité et l irritation induisent la synthèse par le duodénum de différentes molécules comme la CCK et la sécrétine qui vont inhiber les productions des cellules G, principales et pariétales. Figure 7 : Différents intervenants de l inhibition de la sécrétion gastrique et leurs relations (d après Lefrançois et Tiret, 2000) Motricité On distingue 3 composantes : la relaxation de la région orale associée au passage du bol alimentaire de l œsophage à l estomac, les contractions permettant la réduction de taille des aliments et le mélange des aliments avec les sécrétions, les contractions assurant la propulsion du chyme vers l intestin grêle. L estomac possède trois couches musculaires : longitudinale externe, circulaire et oblique interne spécifique de cette portion digestive. L épaisseur de cette paroi musculaire augmente de l estomac proximal à l estomac distal. L innervation extrinsèque provient du nerf vague et de l orthosympathique via le ganglion coeliaque. Basé sur des différences de motricité,
27 l estomac peut être divisé en deux régions : orale (fundus et partie proximale du corps) et caudale (partie caudale du corps et antrum). C est la contraction de cette portion qui mélange le bol alimentaire et le propulse dans le duodénum. La relaxation de la paroi gastrique est obligatoire quand l estomac reçoit des aliments sinon le volume ingéré est très limité et il existe des risques de rupture si on tente de le dépasser. Chez le cheval, elle est biphasique lors de l ingestion de repas solides. La première phase se produit au cours de l ingestion active et permet d augmenter fortement le volume de la portion orale de l estomac puis elle est suivie par la deuxième phase qui est la plus longue et qui correspond à une accommodation du volume. La durée de la première phase est directement reliée au temps mis pour ingérer le repas et est plus distincte lors de l ingestion de repas volumineux (elle est donc plus longue quand le cheval mange des fourrages que lorsqu il ingère des granulés), de même l accommodation est plus franche après de tels repas. La première phase fait intervenir le réflexe vago-vagal ce qui signifie que la distension de l estomac est détectée par des mécanorécepteurs, situés dans le pharynx et/ ou l œsophage, qui relayent cette information au système nerveux central via le nerf vague. Ce système envoie alors une information efférente aux muscles lisses de l estomac via le nerf vague induisant une relaxation par le peptide inhibiteur vaso-intestinal. On parle de relaxation réceptive. La deuxième phase est plus sous l influence d un rétrocontrôle exercé par des capteurs duodénaux qui sont stimulés par la nourriture provenant de l estomac. L estomac du cheval est donc tout à fait capable de s adapter à la taille des repas ingérés. La région caudale possède une paroi musculaire épaisse assurant l écrasement et le brassage des aliments. Les vagues de contractions péristaltiques commencent dans la région fundique et migrent aboralement. Ces fortes contractions augmentent encore vers le pylore et y propulsent une partie du chyme : cette action porte le nom de systole antrale. Pourtant cette vague de contraction ferme le pylore, ainsi la plus grande portion du contenu gastrique est propulsée de nouveau dans l estomac pour être encore mélangé et réduit. Ce processus est appelé rétropulsion. Le potentiel membranaire de repos du muscle lisse gastro-intestinal est d une ondulation permanente sans motilité significative associée : ce phénomène est nommé vagues lentes. La contraction se produit seulement quand un potentiel d action entraîne une dépolarisation complète du muscle. Etant donné qu un potentiel d action ne peut se produire qu en association avec la présence de vagues lentes, le taux maximum de contractions pour une région donnée est limité par la fréquence des vagues lentes dans cette région : elle est de 3 par minute pour l estomac. La stimulation parasympathique, la gastrine et la motiline augmentent la fréquence des potentiels d action et la force des contractions. A l inverse, la stimulation orthosympathique, la sécrétine et le peptide gastro-intestinal diminuent la fréquence et la force des contractions. Quand l animal est à jeun, des complexes myoélectriques migrant assurent la vidange complète de l estomac. Médiés par la motiline, ces complexes surviennent à intervalles réguliers (environ 90 minutes). La motiline est une hormone de 22 acides aminés sécrétée par le duodénum pendant les phases interprandiales. La vitesse de la vidange gastrique doit être régulée pour apporter un temps adéquat de neutralisation de l acidité et de l adsorption dans le duodénum. Pour entrer dans le duodénum, les particules doivent avoir une taille maximale, c est pourquoi les liquides sont plus rapidement vidangés : on estime par exemple que 90% de 8 litres de liquides mis en place dans l estomac l ont quitté dans les 15 minutes suivant l administration que le cheval ait ou non pratiqué un exercice, ceci s observe surtout le foal chez lequel on a remarqué que le lait est le liquide le plus lent à être vidangé. Les lipides passent plus vite. Les facteurs majeurs d inhibition de la vidange gastrique sont la présence d acides et de graisse dans le duodénum. La cholécystokinine est sécrétée quand les acides gras pénètrent dans le duodénum, et inhibe en retour la vidange, assurant un temps suffisant de digestion et d absorption dans le
28 duodénum. Des récepteurs de la muqueuse duodénale détectent les ions H +, et relayent l information aux muscles lisses gastriques via des interneurones du plexus myentérique. Ce mécanisme permet un apport lent d acide dans le duodénum et une neutralisation par les bicarbonates pancréatiques. Certaines substances thérapeutiques peuvent influencer le temps de vidange : par exemple, les α2-agonistes associés ou non au butorphanol, l érythromycine sous forme de lactobionate et le bétanéchol augmentent le temps de vidange. Figure 8 : Différents intervenants de la stimulation de la motricité gastrique et leurs relations (d après Lefrançois et Tiret, 2000) Figure 9 : Différents intervenants de l inhibition de la motricité gastrique et leurs relations (d après Lefrançois et Tiret, 2000)
29 cheval Principales affections de l estomac du Syndrome des ulcères gastriques équins (Tamzali, 2003) Etiopathogénie Les facteurs favorisant l apparition d ulcères sont les médicaments ralentissant la vidange gastrique (cathécolamines, xylazine, néostigmine, ), le parasitisme avec par exemple une infestation par les Gastérophiles provoquant une gastrite ulcérative chronique localisée aux points de fixation des larves et l alimentation puisque la sécrétion d acide augmente avec les repas et que la production d acides gras volatils pouvant désorganiser la couche cellulaire de la muqueuse non glandulaire peut se produire si la composition de l aliment favorise un ph acide et si les aliments sont fermentescibles comme les concentrés. Les facteurs déclenchants comprennent les anti-inflammatoires non stéroïdiens (AINS) qui inhibent la production de prostaglandines surtout au niveau de la muqueuse glandulaire qui est alors fragilisée par diminution du mucus et des bicarbonates. Par ailleurs la sécrétion d acide n est plus inhibée et une vasoconstriction de la muqueuse se produit ce qui provoque une lyse et une nécrose des vaisseaux. Parmi les autres facteurs déclenchants, on trouve le stress qui n est pathologique que s il est chronique (traumatismes, chocs endotoxiniques, contraintes environnementales, chirurgie, soins contraignants ). Les chevaux subissant un entraînement intensif (70-90% des chevaux de course à l entraînement) sont particulièrement touchés par cette affection. A grande vitesse, la pression intra-abdominale augmente provoquant un accroissement de la pression stomacale par effet mécanique ce qui ralentit la vidange et le contenu acide remonte jusqu à la muqueuse non glandulaire qui subit alors une corrosion acide Epidémiologie L activité du cheval a une forte influence sur la survenue des ulcères, en effet ils sont 3 fois plus élevés chez les chevaux de course (stress) que dans les autres disciplines. Le sexe ne joue pas de rôle. Les conditions de vie interviennent puisque l incidence des ulcères diminue quand elles sont proches des conditions naturelles, par exemple la mise au pâturage assure une alimentation à volonté et par conséquent une acidité gastrique moins élevée. Enfin la partie non glandulaire est 8 fois plus atteinte que la glandulaire, vraisemblablement en raison de défenses immunitaires inférieures Signes cliniques Chez les poulains de moins de 9 mois, on distingue une forme sub-clinique dans laquelle aucun signe extérieur n est observé. Les ulcères sont en général situés sur la muqueuse non glandulaire le long de la grande courbure ou près de la margo plicatus chez les poulains de moins de 4 mois. Les évènements pouvant être responsables de cette forme sont un stress majeur, une maladie intercurrente ou l administration d AINS et sont à l origine d ulcères en région glandulaire. La cicatrisation est possible sans traitement. Il existe une forme clinique qui peut faire suite à la précédente et se traduit par de la diarrhée, de la dysorexie voire un arrêt de la tétée, une baisse de la croissance, un poil piqué, du bruxisme, une hypersalivation, un «ventre en pot» et des coliques. Dans le cas des ulcères perforants, les signes cliniques sont absents jusqu à la rupture puis un état de choc accompagné de distension abdominale et de coliques se met en place. Ils sont peu fréquents mais souvent fatals en raison d une péritonite diffuse. Si une forte infestation par des gastérophiles se produit, une perforation est possible suite à un traitement anthelminthique. Les ulcères pyloriques et duodénaux sont rares
30 mais provoquent une striction et une obstruction à l écoulement gastrique. Ils surviennent chez les poulains âgés de 3 à 5 mois et qui vont manifester des coliques post-prandiales, une hypersalivation, du bruxisme et de la dyspnée. Chez les yearlings et les adultes, des lésions assez importantes sont fréquemment bien tolérées et le déclenchement des signes cliniques est provoqué par la mise à l entraînement, une maladie intercurrente ou à la suite d un traitement à base d AINS. On peut observer des coliques aiguës et récurrentes post-prandiales, des fécès en bouse de vache, un mauvais état corporel, une dysorexie, une baisse de performances et un changement de comportement Diagnostic Il peut être clinique, en gardant à l esprit qu il n existe aucune corrélation entre le nombre, la sévérité, la localisation des lésions et les répercutions cliniques. Le recueil des commémoratifs est souvent riche d informations notamment concernant l alimentation et l utilisation du cheval. Il convient également d évaluer la douleur, l état d hydratation et les bruits à l auscultation abdominale. Les techniques d imagerie utilisables regroupent la radiographie de contraste sur les poulains mais elle est rarement révélatrice ; l échographie qui permet de visualiser une tumeur ulcérée ainsi que l atteinte des structures avoisinantes ; la scintigraphie qui assure la visualisation des ulcères grâce au sucralfate marqué au technétium 99 qui s adsorbe à la surface des muqueuses ulcérées mais son utilisation est très rare pour cette indication et c est un examen très onéreux ; la laparotomie exploratrice est utilisée en dernier ressort mais le rapport bénéficerisque n est pas en sa faveur. Un diagnostic histologique sur les marges de l ulcère permet de vérifier leur nature et la présence d éventuelles lésions associées. En cours de recherche, un test sanguin pour mesurer le taux de pepsinogène dans le sang qui serait augmenté lors d ulcères est à l étude. L examen de choix demeure actuellement la gastroscopie qui nécessite la mise à jeun du cheval pendant 12 heures, la possession d un matériel coûteux et fragile et une connaissance du praticien de la manipulation d une part et des images normales et pathologiques d autre part. Chez l adulte, la muqueuse squameuse apparaît normalement blanche et luisante avec des stries longitudinales et la muqueuse glandulaire rose foncé avec entre les deux la margo plicatus. Quant au foal, la muqueuse squameuse est physiologiquement très fine et rose pâle à blanche et la muqueuse glandulaire rose foncé à rouge, brillante et lisse. Lorsqu ils ont mois d un mois, des plages desquamées dorsalement à la margo plicatus sont visibles chez le foal normal et la muqueuse glandulaire apparaît plus plissée. L opérateur peut attribuer des scores lésionnels allant de 0 quand il n y a pas d ulcère (épithélium intact, muqueuse ni hyperhémique ni hyperkératosique) à 4 lorsque les lésions sont étendues avec des zones d ulcération profonde. Souvent il est capable d estimer le nombre de lésions (moins pour la région glandulaire) mais il lui est difficile d en prédire la sévérité. La corrélation lésions symptômes n est pas toujours évidente, en effet on estime que 50% des poulains pur-sang ont des lésions gastriques sans signes cliniques. Chez les poulains les ulcères asymptomatiques sont localisés à la muqueuse squameuse le long de la grande courbure sur la margo plicatus. Quant aux poulains de 1 jour à 4mois, les ulcères peuvent être actifs mais cicatrisent sans traitement alors que pour les poulains plus âgés et les adultes, la cicatrisation est contrôlée afin d éviter l obstruction. Un examen de la muqueuse antrale et pylorique doit être systématiquement réalisé car la prévalence de cette zone est identique à celle de la muqueuse squameuse, probablement à cause d un reflux rétrograde. La répartition des lésions chez l adulte est telle que la majorité des ulcères est située dans une bande de 3 cm autour de la margo plicatus sur la zone squameuse alors que les ulcères de la muqueuse glandulaire sont possibles mais plus rares et souvent liés à l administration
31 d AINS. Chez le poulain âgé de moins de 2 mois, la majorité des lésions se retrouvent sur la grande courbure, quand l âge est inférieur à 1 mois, les ulcères sont en général précédés d une desquamation mais pas toujours : il s agit d un phénomène physiologique de protection de la muqueuse squameuse lorsque taux d acide pas encore stable. Les ulcères de la muqueuse glandulaire (proche de la margo plicatus sur la petite courbure ou du cardia) sont plus profonds que chez l adulte, avec des foyers hémorragiques et des troubles digestifs. Photo 1 : Images endoscopiques normales et pathologiques de l estomac du cheval (a : muqueuses squameuse (blanchâtre) et glandulaire (rose foncée) normales d un cheval adulte ; b : idem pour un poulain ; c : desquamation de la muqueuse gastrique chez un poulain de 14 jours ; d : ulcération extensive de la muqueuse squameuse chez un cheval adulte ; e : ulcères sanguinolents de la muqueuse squameuse chez un adulte ; f : ulcère chronique (C), aigu (A) de la muqueuse squameuse et ulcère de la muqueuse glandulaire (GU) ; g : sévère ulcération de la muqueuse non glandulaire chez un poulain de 4 mois) (d après Murray, 1997) a b c d e f g
32 Traitement Les objectifs sont d éliminer les signes cliniques, d induire la guérison des ulcères, de prévenir la récurrence et les complications et de réduire la durée et le coût du traitement. L utilisation d anti-acides permet de neutraliser l acidité dans la lumière stomacale (hydroxyde d aluminium, magnésium) mais leur action est de courte durée (15-30min) et limitée par la dose et la vidange gastrique. Les composés à base de bismuth sont doués d une petite capacité à neutraliser les acides et possèdent des actions cytoprotectrices par stimulation de la sécrétion de mucus et de bicarbonates et inhibition de l activité de la pepsine. Le sucralfate est un gel visqueux avec une part d hydroxyde d aluminium. Il stimule la formation des prostaglandines et la restitution cellulaire (cicatrisation). Il n est pas utilisable pour les ulcérations limitées à la muqueuse squameuse et se donne souvent en supplémentation d un traitement à base d antagonistes des récepteurs H2. Les antagonistes des récepteurs H2 à l histamine provoquent une inhibition dose dépendante de la sécrétion d acide par blocage de l interaction de l histamine avec ses récepteurs H2 (cimétidine (Tagamet ), ranitidine (Zantac )). Il est nécessaire de traiter au moins 10 à 20 jours même après disparition des signes cliniques. Les inhibiteurs des pompes à protons antagonisent spécifiquement la sécrétion d acide chlorhydrique en bloquant la pompe ATPase H+/K+ qui permet le transport des hydrogènes au sein des cellules pariétales. La liaison covalente à l ATPase est présente pendant toute la vie de la cellule et par conséquent une dose journalière est suffisante (oméprazole (Losec, GastroGard ND)). Les prostaglandines sont responsables de l inhibition de la sécrétion d acide gastrique, de la stimulation de la sécrétion de mucus et de bicarbonates et d une protection cellulaire (misoprostil (Cytotec )). A l heure actuelle les essais sont insuffisants et il existe des effets secondaires non négligeables (coliques). La durée du traitement est variable d un animal à l autre et dépend de la sévérité, du nombre et de l ancienneté des ulcères. En moyenne un traitement dure de 14 à 28 jours puis une vérification endoscopique pour ré-évaluer les lésions est appréciable Prophylaxie L apolectol est un complexe de pectine, lécithine et glycérol (Pronutrin TM) qui renforce et stabilise la production de mucus. Une gestion précise de l administration d AINS doit être observée. Enfin l amélioration des conditions de travail et de logement et l alimentation (respect des horaires de distribution, éviter la compétition entre chevaux et les diètes prolongées, donner des fibres) jouent un rôle prépondérant dans la prévention Parasitisme Gastérophilose équine (Beugnet, 2003 ; Bussiéras et Chermette, 1991) Il s agit d une myiase digestive des Equidés, due au développement dans la cavité buccale, l estomac, le duodénum ou le rectum, de larves parasites obligatoires du genre Gasterophilus. Plusieurs espèces de cette famille sont susceptibles de parasiter l estomac des Equidés : Gasterophilus equi (ou G. intestinalis), G. nasalis (ou G. veterinus ou G. duodenalis), G. haemorrhoidalis et G. pecorum. Les gastérophiles adultes ressemblent à des mouches (11 à 15 mm de long), au corps velu de couleur rouille avec un thorax brun jaunâtre leur donnant l aspect d un petit bourdon
33 Ce parasite est cosmopolite. Dans les pays d Europe et d Amérique du Nord, la prévalence est très élevée, de l ordre de 30 à 60% des Equidés sont infestés à chaque saison. En Europe, G. equi est l espèce la plus fréquemment rencontrée puisqu elle est détectée dans 90% des cas de gastérophiloses). Il s agit d une parasitose enzootique, sévissant surtout l hiver à la suite d infestations estivales. Les sources de parasites sont constituées par les Equidés hébergeant des larves et incorrectement vermifugés. En effet ces parasites sont obligatoires et spécifiques quasiuniquement vis-à-vis des Equidés. La contamination se fait par la ponte d œufs sur les chevaux ou par l ingestion d œufs déposés dans l environnement. Les causes favorisantes sont un climat chaud, un mode d élevage en plein air, un manque d hygiène par défaut de pansage et une couleur de robe foncée (cette dernière semble plus attirée les mouches). Aucun caractère de réceptivité (espèce, âge, race) n a été mis en évidence. L activité des mouches et leur ponte autour des chevaux peuvent entraîner des accès de frayeur et une excitation des animaux au pâturage. Les chevaux salivent, mâchent longuement et font des efforts de régurgitation plus particulièrement en fin d été lorsque les larves L1 et L2 sont localisées au niveau de la muqueuse buccale. Les larves L3 sont évaluées à 10 à 100 en moyenne mais ce nombre peut atteindre 700 voire 1000 dans l estomac et parfois le duodénum ce qui occasionne un appétit capricieux, des coliques chroniques d intensité modérée, une dysphagie ainsi qu une dyspepsie. Les symptômes souvent discrets en hiver, vont s intensifier dès le mois de février et peuvent rétrocéder en été après l élimination des larves. Le volume disponible dans l estomac peut se trouver réduit jusqu à 50% ce qui peut entraîner un certain retard de croissance chez les poulains ou une certaine baisse de forme. Photo 2 : Larves L3 de Gasterophilus spp dans l estomac d un poulain observé au cours de l autopsie (d après Elsa Bocquet) Les lésions observées dans l estomac notamment lors de contamination par G. equi et G. haemorrhoidalis sont souvent une atrophie de l organe qui est rétracté avec un volume qui peut être réduit de 50% et une gastrite scléreuse hypertrophique qui se distingue par un épaississement de plus de 10 fois et un aspect cartonné de la paroi gastrique. Sur la muqueuse gastrique en particulier du cul-de-sac gauche, de nombreuses larves sont fixées en bouquet. Quand elles se détachent, on peut voir des ulcérations de 2-4 mm au niveau des points de
34 fixation. Avec G. nasalis, les lésions duodénales et rectales rappellent celles de l estomac. Au stade final de l évolution, une péritonite chronique peut se compliquer d adhérences des anses intestinales. Des ulcères au niveau de la bouche et des lèvres peuvent être visibles au cours de l atteinte par les premiers stades larvaires. Les parasites exercent une action mécanique et irritative, une action spoliatrice assez marquée car elles sont hématophages et une action toxique. Il n existe pas de possibilité de diagnostic coprologique, bien que parfois des larves L3 sont observables aux marges de l anus ou dans les crottins à la fin du printemps, ce qui constitue souvent le seul signe vraiment caractéristique de l infestation. Aucun diagnostic de laboratoire comme une sérologie n est commercialisé. Une endoscopie digestive peut permettre de visualiser les larves fixées au niveau stomacal. La suspicion d infestation peut être posée sur la base des signes cliniques exprimés par le cheval ou lorsque les œufs de gastérophiles sont vus sur le pelage en été et en automne. Les organophosphorés (trichlorfon ou métrifonate, dichlorvos) sont actifs contre les larves L3 de gastérophiles. Le trichlorfon est contre-indiqué chez le poulain de moins de 4 mois d âge et la jument en fin de gestation, le dichlorvos ne doit pas être utilisé chez le poulain de moins de 100 kg et chez les sujets souffrant de troubles respiratoires chroniques. Les macrolides antiparasitaires tels que l ivermectine à 0,2 mg/kg (Eqvalan pâte, Furexel ) ou la moxidectine (Equest ) sont également actifs sur les gastrophiles. L ivermectine est active vis-à-vis de tous les stades larvaires des différentes espèces de gastérophiles et peut être administrée chez les poulains dès le plus jeune âge. Souvent le traitement est trop tardif s il est administré après l expulsion spontanée des larves. Il convient cependant de traiter les chevaux dont la contamination a été objectivée ainsi que tous les Equidés vivant avec ces derniers et soumis au même traitement anti-parasitaire. Les traitements prophylactiques sont à réaliser en fin d automne (novembre) de façon à stopper l évolution des larves L3 et d empêcher ainsi l apparition de nouvelles générations de gastérophiles l été suivant. Concernant les interventions sur l environnement, la destruction des mouches dans le milieu extérieur est illusoire ; on peut par contre limiter l infestation en effectuant des brossages quotidiens du pelage voire une tonte de ce dernier pour éliminer les œufs ou par des applications locales de lotions insecticides. Il faut également retirer les crottins dans lesquels des larves ont été aperçues Spiruroses digestives ou habronémoses gastriques des Equidés (Beugnet, 2003 ; Bussiéras et Chermette, 1995) Chez les Equidés, l habronémose est une helminthose dont la transmission est assurée par les mouches et qui est liée à la présence de vers dans l estomac et surtout dans les plaies cutanées. Les espèces affectées sont uniquement les Equidés : chevaux, poneys, ânes, mulets, zèbres. Le parasite est cosmopolite mais se rencontre plus souvent dans les pays chauds. Il s agit d un parasitisme beaucoup plus rare que la gastérophilose. La présence d Habronèmes adultes au niveau stomacal n est rencontrée que chez 4 à 5% des chevaux. Cependant du fait de la transmission par un insecte vecteur, cette affection parasitaire est liée à l abondance des mouches et des conditions hygiéniques de l élevage. Les lésions cutanées parasitées par les larves sont difficiles à traiter et ont tendance à s aggraver ou à se compliquer de surinfection. Cette affection peut atteindre tous les Equidés quel que soit leur âge. Elle se rencontre l été (de juin à septembre). On observe une certaine prédisposition à la ré-infestation sur des chevaux ayant déjà subi une première atteinte. Les sources de parasites sont les Equidés souffrant déjà d habronémose gastrique ainsi que les mouches contaminées. Lorsque les parasites sont situés dans l estomac, les signes cliniques sont en général discrets avec un appétit capricieux, parfois du pica, une polydypsie et de l amaigrissement. Des
35 troubles de la vidange gastrique se traduisant par des signes de colique sont également observables. Dans le cas où les nodules se rompent, une péritonite peut survenir et avoir une issue fatale. Les habronèmes peuvent avoir des localisations erratiques comme la peau, la conjonctive ou les poumons qui ne sont pas l objet de notre étude. Les lésions rencontrées sont celles d une gastrite chronique banale avec des zones inflammées, parfois ulcérées, recouvertes d un abondant mucus. Dans le cas de D. megastoma, on note la présence de volumineux nodules dans la sous-muqueuse de l estomac, saillants à l intérieur de l organe, d un diamètre de 1 à 10 cm avec un ou plusieurs pertuis et emplis de pus et de vers adultes. Le diagnostic clinique est pratiquement impossible. Les examens coproscopiques pour mettre en évidence des œufs ou des larves sont souvent négatifs dans la mesure où ces éléments sont très fragiles et émis de façon irrégulière. La réalisation d un xéno-diagnostic par élevage de larve de mouches dans les crottins suspects est envisageable. On peut mettre en évidence les larves par raclage des lésions cutanées et oculaires et ainsi suspecter une infestation parallèle de l estomac. L endoscopie gastrique permet le diagnostic de l habronémose imaginale. Au cours d un examen post-mortem, des parasites et les lésions qu ils ont occasionnées sont visibles en particulier dans le cas de D. megastoma. L ivermectine (Eqvalan pâte, Furexel ) et la milbémycine sont très actives sur les adultes. Quant à la lutte contre D. megastoma, il semble que seule l ivermectine puisse éliminer les adultes et les larves. Le traitement des autres localisations nécessite fréquemment le recours à la chirurgie ainsi que des applications locales de fenthion, trichlorfon ou anthelminthiques sur les plaies par exemple, il ne faut pas oublier le traitement par voie systémique afin de rompre le cycle. La prophylaxie permet uniquement des mesures offensives avec un dépistage associé au traitement des chevaux infestés, la destruction des larves L1 par stérilisation du fumier (méthode biothermique) et celle des hôtes intermédiaires (mouches et leurs larves) au moyen d insecticides, de repellents et de mesures concernant l environnement : entretien des fumiers, nettoyage fréquent des litières, ramassage des crottins dans les paddocks et prairies Il faut également veiller à la protection des plaies cutanées en été Trichostrongylose du cheval (Beugnet, 2003 ; Bussiéras et Chermette, 1995) Chez le cheval, la trichostrongylose est due à Trichostrongylus axei ou anguillule, un parasite de la famille des Trichostrongylidés qui est plus fréquemment rencontré chez les bovins, ovins et caprins. Il s agit d un petit ver filiforme, cosmopolite et localisé dans l estomac des Equidés et la caillette des Ruminants. Trichostrongylus axei est très souvent associé aux autres strongles. Son pouvoir pathogène passe souvent inaperçu sauf lors d infestation massive (10 à vers ou plus) où il provoque alors des diarrhées profuses particulièrement chez le jeune poulain. La trichostrongylose peut affecter tous les Equidés de tout âge, mais elle peut se montrer particulièrement sévère chez les jeunes poulains avant le sevrage. Cette parasitose s observe plus particulièrement chez les chevaux au pré mais aussi au box chez les poulains ingérant des crottins maternels contaminés. Les sources principales de parasites sont les Ruminants, les Equidés parasités et tout particulièrement les juments suitées pour les jeunes poulains. Les signes cliniques sont le plus souvent absents chez les chevaux adultes sauf lors de parasitisme massif sinon il est possible d avoir une baisse d appétit et une perte de poids. Dans ces cas et plus particulièrement chez les jeunes poulains, on observe une diarrhée aqueuse profuse, de couleur vert foncé et liée à une très forte congestion stomacale. Sur des animaux préalablement débilités ou carencés, cette diarrhée entraîne de la déshydratation, un
36 arrêt de la croissance et un mauvais état général. On peut également observer du pica, de la coprophagie, des oedèmes des régions déclives et l apparition d une gastrite chronique. Les lésions, au contraire, sont souvent marquées sur le cul-de-sac droit de l estomac : adénomes gastriques, qui parfois confluent en polyadénomes pouvant constituer des plaques épaisses, plissées de gastrite chronique, hyperplasique et ulcérative. Le diagnostic repose sur une coproculture qui seule permet d identifier les larves L3 ainsi qu une coproscopie mais les œufs de Trichostrongylus sont semblables à ceux d autres strongles, de plus les femelles émettent d assez faibles quantités d œufs. A l examen nécropsique, la mise en évidence des adultes n est pas aisée du fait de leur très petite taille. Il devient nécessaire d avoir recours à un examen histologique. La quasi-totalité des subtances antiparasitaires actives contre les strongles digestifs est efficace sur Trichostrongylus axei. En l occurrence on peut utiliser des benzimidazoles et analogues tels que le fenbendazole (Panacur Pâte ou 10% suspension), le fébantel (Rintal Pâte), le mébendazole (Telmin ), l oxybendazole (Equiminthe Pâte, Verméquine 20 ou 35), le thiabendazole (Némapan Liquide) ; des tétrahydropyrimidines comme le pamoate de pyrantel (Strongid Chevaux pâte orale) ; des macrolides antibiotiques à l instar de l ivermectine (Eqvalan pâte, Furexel ) et de la moxidectine (Equest ). Il est recommandé de traiter 4 fois par an dans la mesure du possible : à la mise à l herbe (marsavril), fin juin, fin septembre et à la rentrée au box fin novembre). Un déparasitage est nécessaire chez les juments gestantes dans les 15 jours suivant le poulinage pour éviter les contaminations du poulain. Les mesures sanitaires visant à réduire la contamination des herbages sont un complément indispensable à l emploi des anthelminthiques. La gestion sanitaire du cheptel exige la constitution de lots de chevaux par catégorie d âge (poulinières suitées, yearlings, adultes autres que poulinières suitées) ; tous les chevaux d un lot étant soumis aux mêmes mesures (pâturage commun, vermifugation par lot, rotation par lot). Le surpâturage doit être évité ; la densité maximale étant de un cheval par hectare. Les rotations de pâtures sont utiles car la quantité de larves infestantes dans l herbe croît avec la durée de séjour du troupeau sur la même parcelle. Un changement opéré tous les 15 jours sur des parcelles inoccupées pendant 1 à 3 mois entraîne une décontamination notable des prairies, surtout en été. Le fauchage, broyage ou hersage des surfaces par temps chaud et sec favorisent la destruction des larves en les exposant aux rayons solaires. Enfin, le ramassage hebdomadaire des crottins sur les parcelles est une méthode contraignante, rarement réalisée mais qui donne des résultats remarquables. Elle est très facilement applicable pour les paddocks herbeux, qui constituent une zone à fort risque : peu d herbe, forte concentration de chevaux, sur-contamination. Si des ruminants sont mis dans les mêmes pâtures que les chevaux, il faut veiller à vermifuger régulièrement les deux espèces Impaction / dilatation de l estomac (Mueller et al., 2001) Impaction gastrique L étiologie peut être une surcharge en grains, la présence d ingesta durs et desséchés ou un épithélioma spinocellulaire gastrique. Si la cause n est pas tumorale, les signes de douleur peuvent être de modérés à sévères. Le plus souvent, il n y a pas de signe de toxicité systémique sauf dans le cas de surcharge en grains au cours de laquelle on peut observer des symptômes de colique, une distension abdominale marquée, des signes de choc (tremblements, sudation, tachycardie, polypnée, muqueuses rouge brique à violettes), une absence de bruits digestifs et la présence de tympanisme, plus rarement de la diarrhée, un refus de se déplacer (fourbure), un reflux
37 gastrique lors de sondage et une distension du côlon à la palpation transrectale. Si des aliments sont accumulés dans l estomac, la douleur peut finir par être incontrôlable nécessitant une laparotomie exploratrice qui permet le diagnostic. Lors de surcharge en grains, un traitement agressif est mis en place le plus rapidement possible à base de fluidothérapie, de lutte contre les endotoxines (plasma hyper-immun, flunixine méglumine à quart de dose toutes les 6 heures, charbon ou sulfate de magnésium) et de pentoxiphylline pour inhiber les cytokines. Une sonde naso-gastrique peut être laissée ne place, le cheval doit être mis à jeun et des précautions sont prises pour limiter les risques de fourbure (litière épaisse, appui en fourchette, glace sur les pieds). Lors de distension sévère, une ponction de caecum peut être envisagée si le système cardio-vasculaire est stable et le diagnostic certain. Dans le cas d un contenu gastrique desséché, le traitement est chirurgical en prenant garde au couchage en raison du risque de rupture. Une administration de 2 à 3L d eau peut être réalisée au moyen d une aiguille placée à travers la paroi stomacale et dont l extrémité doit être réorientée afin d infiltrer différentes zones de la masse avant d effectuer un massage doux. Il est rarement possible de réaliser une exérèse de tumeur gastrique. Le pronostic est mauvais lors de signes cliniques marqués, très mauvais si la douleur abdominale est sévère et si une forte distension est présente (la mort survient en 24 à 48h) et il est très défavorable si une fourbure se déclare avant l atténuation des signes intestinaux Dilatation gastrique aiguë L étiologie peut être primaire lors de l ingestion d aliments hautement fermentescibles (herbe fraîche et/ou quantité excessive de céréales) ou secondaire quand une accumulation dans l estomac de liquides provenant des petits intestins suite à un iléus, une obstruction ou une inflammation sévère se produit. Les signes cliniques sont une tachycardie et une tachypnée en raison de la douleur et de la pression diaphragmatique. Si la dilatation est primaire, les muqueuses sont pâles et la rate est déplacée caudalement par l estomac. Si elle est secondaire, des signes de toxicité systémique peuvent apparaître, le liquide de paracentèse révèle une ischémie intra-abdominale avec une augmentation du taux protéique et de la numération leucocytaire, la palpation transrectale permet de mettre en évidence des anses d intestin grêle distendues. Dans certains cas, une régurgitation spontanée peut être observée avant la rupture stomacale le long de la grande courbure. Si cette dernière se produit, le liquide de paracentèse contient des matières alimentaires et la séreuse intestinale apparaît rugueuse à la palpation transrectale. Le traitement consiste avant tout en un sondage naso-gastrique pour décomprimer. Afin de faciliter le passage de la sonde, il est possible d instiller de la lidocaïne pour relâcher le cardia et de créer un effet de siphon pour éliminer tous les liquides en excès. Si l origine est primaire, il convient de laisser l animal tranquille une fois la pression éliminée. Dans les cas où la cause est secondaire, le soulagement procuré par le sondage n est que transitoire et il faut recourir à la chirurgie pour résoudre le problème initial. Lors de rupture stomacale, l amélioration est immédiate puis l état général se dégrade rapidement à la suite d un choc endotoxinique et cardio-vasculaire, l euthanasie est alors recommandée. Le pronostic est excellent si la cause est primaire et le soulagement de la pression gastrique rapide. Si l origine est secondaire, il dépend du problème sous-jacent et du temps passé avant instauration du traitement mais il reste moins bon que le précédent
38 Néoplasie gastrique (Tamzali, 2003) Les néoplasies gastro-intestinales primaires représentent 0,1% de la totalité des tumeurs chez le cheval. Le carcinome épidermoïde est le type de tumeur le plus fréquemment rencontré, on peut également observer les types suivants : adénocarcinome, leïomyome, lymphosarcome, papillome. Elles touchent surtout des chevaux âgés (>6ans) et en particulier les mâles (ils sont 4 fois plus atteints que les femelles). L étiologie est multifactorielle avec une hypothèse portée sur des irritations répétées de la muqueuse par des parasites ou le bol alimentaire. Il s agit le plus souvent d un phénomène chronique pouvant évoluer de façon asymptomatique pendant plusieurs mois avant une détérioration rapide sur 3-4 semaines avec l apparition de signes tels que : anorexie, dysphagie, dépression, amaigrissement, coliques chroniques souvent après un repas. Si une sténose du pylore se produit, du ptyalisme et un reflux oesophagien peuvent être observés. Dans le cas où l œsophage est partiellement obstrué, étant donné que l origine de ces néoplasies se situent fréquemment au niveau du cardia, l animal peut présenter de la dysphagie et un faciès inhabituel : il tend l encolure, tousse et lèche ses lèvres en permanence. Les métastases se localisent préférentiellement aux poumons, au foie, à la rate et au péritoine viscéral. Le diagnostic clinique est souvent difficile car les signes observés (âge, caractère chronique) sont peu spécifiques. L analyse hématologique d un cheval atteint de cette affection révèle un phénomène inflammatoire chronique. A l occasion d un sondage naso-gastrique, il est possible de sentir une résistance au passage de la sonde selon la localisation de la tumeur et d obtenir du reflux si le pylore est obstrué. Lorsque le tableau clinique l indique, une abdominocentèse et/ou une thoracocentèse peuvent révèler dans de tels cas la présence d un liquide inflammatoire avec un taux élevé de cellules nucléées (notamment des polynucléaires neutrophiles), de protéines et parfois de cellules néoplasiques. L examen échographique n est concluant que dans les stades avancés où une masse échogène peut être mise en évidence dans l estomac. Dans de rares cas, des métastases peuvent être palpées lors d un examen transrectal. Le diagnostic de certitude requiert un examen endoscopique ou nécropsique : la tumeur est alors visualisée avec une forme caractéristique en chou-fleur avec des zones d ulcération et de nécrose
39 Photo 3 : Image endoscopique de carcinome épidermoïde gastrique (flèches) chez un cheval (d après Vatistas et al., 1997) Le seul traitement envisageable consiste en l exérèse large mais l accès difficile et estomac de petite taille Quand les soins palliatifs ne sont plus suffisants, il faut alors envisager l euthanasie. Le pronostic est sombre en raison de la présence de métastases lors de l apparition des signes cliniques ou au moment du diagnostic. 1-2 Pepsinogène Propriétés physiques et chimiques des pepsinogènes et pepsines Poids moléculaires Le pepsinogène a un poids moléculaire d environ 40 kda (+/- 5), cette variation a plusieurs origines : les différentes isoformes au sein d une même espèce, l espèce en elle-même, la méthode de détermination du poids moléculaire (détermination par la composition en acides aminés, électrophorèse, mesure de la pression osmotique, ultracentrifugation, teneur en phosphate, diffusion lumineuse ) avec la précision inhérente à celle-ci (Herriott, 1962). La pepsine a un poids moléculaire de 35 à 38 kda avec les mêmes explications concernant les variations observées (Blumenfeld et Perlmann, 1959 ; Ryle et Porter, 1959) Composition en acides aminés Selon les isoformes, la composition est légèrement différente mais suffisamment constante pour conserver l activité. Il a été mis en évidence chez le porc 4 pepsinogènes nommés A, B, C, D qui se différencient par exemple par la présence ou l absence d un groupement phosphate ou un groupement N-terminal variable. Pendant la conversion du pepsinogène en pepsine, il y a perte de plusieurs acides aminés basiques (lysine, histidine, arginine) mais relativement moins de perte en acides aminés acides ou neutres. Cela explique que la pepsine migre plus rapidement vers l anode que le
40 pepsinogène. La forte teneur en acides aspartique et glutamique, conjointement avec le résidu phosphate, explique en partie pourquoi la pepsine (A) a un point isoélectrique bas (Tiselius et al., 1938). L absence de groupement phosphate, la teneur plus faible en aspartate et plus élevée en lysine et en arginine de la pepsine (C) explique pourquoi elle a un point isoélectrique plus élevé que la pepsine (A) (Ryle et Porter, 1959). L inhibiteur de la pepsine est relativement riche en lysine et inhibe aussi bien la pepsine (A) que (C) Propriétés physiques La constante de sédimentation du pepsinogène (B) est de 2,99*10-13 sec (Ryle, 1965) alors que celle de la pepsine est de 3,2*10-13 sec (Philpot et al., 1933). Le coefficient de diffusion du pepsinogène (B) est de 7,4*10-7 cm 2 /sec (Ryle, 1965) et il est de 9,0*10-7 cm 2 /sec pour la pepsine (A) (Philpot et al., 1933). Le point isoélectrique du pepsinogène (B) du chien est de 4,9 et de 4,0 à < 3,0 pour le pepsinogène (A) de cette même espèce (). Il est de 4,6 et 3,7 pour les bovins et l homme respectivement (Suchodolski et al., 2002). Ce paramètre est <3,0 pour les 8 isoformes de pepsinogène retrouvés chez le chat (Tress et al., 2004). La valeur de ce point pour la pepsine (A) est d environ 1,0 (Tiselius et al., 1938) Groupements C- et N-terminaux D après l analyse de la séquence des acides aminés du côté C-terminal, notamment chez le porc, la succession est la même pour le pepsinogène et le pepsine (alanine - leucine ou isoleucine - valine) ce qui suggère que cette dernière occupe probablement la position C- terminale du pepsinogène (Herriott, 1962 ; Van Vanukis et Herriott, 1959). Les groupements N-terminaux sont plus variables : au sein d une même espèce, les différences sont minimes entre les isoformes et entre différentes espèces les différences sont plus marquées mais on observe plus de 90% de similitudes entre les 25 premiers résidus de la portion N-terminale du chien, du chat, du bovin, du lapin et de l homme (Tress et al., 2004). Les séquences N-terminales du pepsinogène, de la pepsine et du peptide inhibiteur sont suffisamment différentes pour affirmer que ni la pepsine, ni le peptide inhibiteur ne se trouve en position N-terminale (Taylor, 1968) Structures secondaire et tertiaire La présence d une seule extrémité C- et N-terminale pour chaque pepsinogène et pepsine isolés qui ont été correctement caractérisés donne à penser que chaque molécule est constituée d une seule chaîne peptidique non ramifiée (Taylor, 1968). Le pepsinogène a une viscosité intrinsèque faible qui est peu modifiée par la réduction de l un de ces trois ponts dissulfures (Herriott, 1962). Le fait qu il y ait aussi une petite perte d activité suggère que ce pont est retiré d un site actif. La réduction d un deuxième pont dissulfure provoque une augmentation de la viscosité avec une certaine perte de l activité potentielle de l enzyme. Le troisième pont ne peut être brisé qu avec difficulté et perte totale de l activité enzymatique. Après la réduction des trois ponts, a pression osmotique est inchangée (Herriott, 1962) ce qui confirme que la molécule est formée d une seule chaîne et non de plusieurs chaînes liées entre elles par ces ponts. La faible viscosité indique que la chaîne est enroulée sur elle-même et les changements obtenus après la réduction montrent que cette forme est maintenue par deux ponts (Jirgensons, 1958)
41 Autres propriétés chimiques Le pepsinogène est converti en pepsine pour un ph inférieur à 5 mais est stable dans des solutions neutres ou faiblement basiques. Il est dénaturé de façon réversible pour un ph compris entre 8 et 10. Dans les cas où le ph est supérieur à 11,5, une perte de structure irréversible et dépendante du temps survient (Frattali et al., 1957) Sécrétion du pepsinogène La cellule peptique Cette cellule partage les caractéristiques des cellules sécrétrices de zymogènes telles que celles des glandes salivaires et pancréatiques. Toutes ont en commun leur origine embryologique (l endoderme), leur structure et ultrastructure cellulaires (Dalton, 1951). Ces dernières comprennent des granules de zymogènes et une architecture tubulaire caractéristique du réticulum endoplasmique qui est un moyen d isoler les enzymes nouvellement synthétisées du cytosol et de les transporter jusqu au site d encapsulation dans les granules. Ces cellules sont arrangées en systèmes tubulaires et passent par des cycles histologiques distincts corrélés à leur activité sécrétoire (Helander, 1964) Distribution des cellules principales et du pepsinogène dans la muqueuse Les cellules peptiques bordent les deux-tiers inférieurs des tubules gastriques et les cellules pariétales le tiers supérieur des tubules. La population de cellules peptiques est confinée au corps et au fundus de l estomac et absente de l antrum. La très faible quantité de pepsine sécrétée par l antrum peut être produite par les cellules muqueuses du collet qui sont aussi retrouvés dans le corps de l estomac et qui sont pressenties pour être les précurseurs des cellules peptiques (Bensley, 1928). Aucune granule de zymogène n est cependant retrouvée dans l antrum par microscopie électronique (Helander, 1962) Embryologie La période où apparaissent les premiers granules ou le pepsinogène mesurable dans l estomac du fœtus varie considérablement d une espèce à l autre. Le chien, le chat, le lapin et le porc n ont pas de pepsinogène jusqu à 1 à 2 semaines après la naissance alors que le rat naît avec une activité gastrique peptique. Le fœtus du mouton (mesurant 50 cm à terme) présente des cellules peptiques quand il a une taille de 14 cm et du pepsinogène mesurable par des méthodes chimiques à 19 cm. Quant à l embryon bovin, une activité peptique est décelable à partir du troisième mois de la vie fœtale et il sécrète activement du pepsinogène à la naissance (Hirschowitz, 1967) Lésion et régénération Il n y a que peu voire pas de mitoses de cellules principales aussi bien dans la vie foetale qu adulte (Bensley, 1928). De plus aucune preuve de perte de cellules peptiques par extrusion ou dégénération en l absence de lésion, n a pu être apportée (Hirschowitz, 1967). Les rayons X endommagent les cellules muqueuses du collet, les cellules épithéliales superficielles, les cellules principales et les cellules pariétales par ordre décroissant, de même que les vaisseaux sanguins et le tissu conjonctif (Dawson, 1925). A la lumière du microscope, les cellules principales sont lysées et relarguent leurs granules dans les tubules et le tissu interstitiel ce qui justifie probablement les taux de pepsinogène très élevés dans le plasma et
42 l urine. La sécrétion de pepsine gastrique chute après une irradiation de l estomac par les rayons X. Les changements sub-cellulaires précoces après irradiation létale par les rayons X comprennent une désorganisation d une grande partie du réticulum endoplasmique et des ruptures de la membrane nucléaire ; par ailleurs les granules de zymogène se rompent et deviennent moins denses. La synthèse de pepsinogène et la formation des granules semblent moins affectées par l irradiation. Au cours de la réparation consécutive aux dommages causés par les radiations, il ne se produit pas de phagocytose et on observe une discrète fibrose, la muqueuse régénérée étant réduite de moitié en épaisseur par rapport au lot de contrôle (Dawson, 1925). Les cellules principales réapparaissent plus tardivement que les cellules pariétales comme c est le cas lors de la régénération après une atteinte traumatique. Bien que les cellules muqueuses du collet régénèrent les cellules peptiques après une lésion, il n y a pas de preuve qu elles agissent de la même façon en l absence de lésion et aucune cellule de transition n a été mise en évidence (Bensley, 1928) Relation structure-fonction de la cellule peptique Les modifications morphologiques dans la cellule peptique sont peut-être mieux comprises quand elles sont étudiées en relation avec leur fonction en tant que cellule dans laquelle les protéines (enzymes hydrolytiques) sont synthétisées pour être sécrétées. Avant leur sécrétion, l enzyme est encapsulée dans des granules et donc séparée du reste de la cellule. La signification de cette encapsulation n est pas claire. Cela permet de protéger la cellule des enzymes habituellement inactives, mais plus vraisemblablement il s agit d un mécanisme qui a deux buts : le premier est de stocker l enzyme en quantité suffisante pour assurer un relargage rapide à la demande et le second de transporter l enzyme de façon méthodique vers la membrane sécrétrice de la cellule. La cellule peptique a été étudiée en microscopie optique et électronique pour ce qui est de sa morphologie générale (Bensley, 1928) et de l effet de diverses stimulations sur la formation des granules de zymogène, leur remplissage et leur vidange (Dawson, 1925). Bien que la cellule peptique fabrique principalement du pepsinogène, elle contient également d autres protéines protéolytiques qui sont étroitement liées au pepsinogène comme le facteur intrinsèque que la cellule synthétise probablement. Dans certaines espèces, comme l homme, ce facteur est produit par les cellules pariétales. La cellule peut cependant être déficiente en facteur intrinsèque alors que la sécrétion de pepsinogène est maintenue normalement comme dans un certains nombre de cas d anémie pernicieuse juvénile. Les études pour localiser le pepsinogène dans les cellules de la muqueuse gastrique par fractionnement et ultracentrifugation (Tang et al., 1959) ont donné des résultats variables et ont apporté peu d informations sur la compréhension des mécanismes subcellulaires ou de la structure chimique de la cellule peptique. Le cycle de sécrétion a été étudié par microscopie optique chez les souris, les rats, les lapins et les chats après soit distribution de nourriture, soit administration de pilocarpine. Chez les animaux à jeun, les cellules peptiques se remplissent de granules et la stimulation de ces dernières provoque le relargage de ces granules qui peuvent rester reconnaissables dans la lumière des tubules. Après une prise alimentaire, la plupart ou la totalité des granules disparaissent et ils recommencent à s accumuler 6 heures après ; le cycle complet s effectue en 16 à 24 heures chez le lapin et le rat. L inhibition de la sécrétion de pepsinogène par l atropine, l histamine chez le chien ou par des températures corporelles extrêmes ou par compression cérébrale (Fattah et al., 1961)aboutit à une accentuation de la phase de repos ; les cellules deviennent surchargées en granules et contiennent plus de pepsinogène mesurable par des méthodes chimiques. La sécrétion des granules après stimulation est suivie par une
43 fabrication accrue d ARN cytoplasmique qui est consommé pour la synthèse de nouvelles protéines. La microscopie électronique a permis de mettre en évidence un certain nombre de modifications subcellulaires de la cellule peptique en relation avec la synthèse, le stockage et la sécrétion du pepsinogène. Les granules sont formés à partir de l appareil de Golgi et migrent vers la bordure sécrétrice ou libre de la cellule (Dalton, 1951), qui comprend des microvillosités. Ces derniers sont éliminés à l endroit où les granules se vident. Après la vidange les granules deviennent plus petits et moins denses ce qui leur donne une apparence de vacuoles. Le nombre total des granules et des vacuoles ne diminue apparemment pas après la sécrétion (Helander, 1962) mais leur taille chez les souris diminue de moitié dans l heure qui suit le repas. La perte du contenu et la réduction de taille peuvent donner l impression d une cellule vide en microscopie optique, et ce bien que tous les granules ou toutes les cellules ne participent pas à la sécrétion en même temps. Dans la phase de réhabilitation qui suit la stimulation, des changements majeurs s opèrent dans le noyau, l appareil de Golgi et les ribosomes alors qu ils sont mineurs pour les mitochondries, les vacuoles, les microcorps denses et le cytoplasme (Helander, 1964) Synthèse et sécrétion Mécanismes Le pepsinogène est vraisemblablement synthétisé dans le système polysome - ARNm du réticulum endoplasmique puis transféré à travers la membrane dans le système tubulaire du réticulum pour le transport vers l appareil de Golgi où l enzyme est enfermée dans des granules. Ces derniers sont d abord argyrophiles et quand ils sont matures et ont migré vers la surface de sécrétion, ils deviennent argyrophobes et colorables par le violet clair. En dépit des preuves histologiques de déplétion de matériel qui fixe la coloration ou de densité électronique des granules après stimulation, l estomac peut continuer à sécréter de grandes quantités de pepsinogène pendant plusieurs heures (Bowie et Vineberg, 1935) - ces quantités sont supérieurs au contenu original. Le pepsinogène peut être synthétisé et sécrété continuellement sans subir la phase de coloration du stockage dans les granules ce qui suggère que le violet clair ne colore pas le pepsinogène mais un autre composé non identifié, présent dans les granules et qui est formé 6 à 18 heures après que le pepsinogène soit synthétisé et encapsulé. Dans les conditions classiques (à jeun ou non stimulé), le stockage du pepsinogène demeure pratiquement complet et constant (Hirschowitz, 1967) parce que la déplétion fractionnée est continuellement remplacée par la synthèse de nouvelles molécules de pepsinogène. Le taux de perte est tel que les granules nouvellement encapsulés ont le temps de devenir matures et colorables. Cependant, il est possible et sans doute probable que la sécrétion basale soit responsable du débordement de la synthèse continue. Ceci apparaît plus clairement lors de l inhibition partielle de la sécrétion de pepsinogène par l atropine quand le taux de sécrétion est diminué mais égal au taux de production (Hirschowitz, 1967). La réponse immédiate à un stimulus approprié est une décharge massive des granules mis en réserve ce qui se produit avant que la sécrétion d eau et d électrolytes soit complètement stimulée d où la présence d une forte concentration initiale de pepsine dans de faibles volumes de suc gastrique. Ce phénomène représente probablement l asynchronisme entre la réponse de l enzyme et de la sécrétion d eau électrolyte - dépendante à un stimulus commun. La perte de granules favorise alors la synthèse (rétrocontrôle positif) et, en fonction de la nature du stimulus, la cellule peut suivre une des deux voies. Si le stimulus est de courte durée d action (une injection de pilocarpine par exemple), la synthèse commence rapidement à restaurer les stocks de pepsinogène et la cellule entre alors dans un cycle de restauration de plusieurs heures. Cependant, si un fort stimulus à la sécrétion se poursuit, la synthèse
44 s effectue à un taux maximal pendant une période d environ 45 à 60 minutes jusqu à ce qu il égalise le taux de sécrétion et cela peut continuer de cette façon durant plusieurs heures sans signe d exhaustion (Bowie et Vineberg, 1935) et sans formation de granules matures et colorables. Lorsqu un tel stimulus se produit, la cellule entre dans un cycle restaurateur au cours duquel le taux de synthèse est supérieur à celui de la sécrétion et les granules deviennent plus grands et plus denses quand ils sont matures. Même lors de sécrétion active prolongée, une certaine quantité de pepsinogène résiduelle stockée est disponible pour la sécrétion si une stimulation supplémentaire se manifeste. Le taux maximum de sécrétion continue est limité par le taux maximal de synthèse mais peut être momentanément augmenté grâce au stock de pepsinogène préformé (Hirschowitz, 1967). Le taux de synthèse est soumis à un rétrocontrôle négatif partiel par le stock de pepsinogène, de sorte que quand la sécrétion est inhibée, le pepsinogène s accumule en excès dans la cellule et la synthèse est diminuée mais continue (Junquiera et al., 1958), ce qui résulte en une sécrétion excessive de concentration élevée. Chez les rats dont le pylore a été ligaturé et qui n ont pas reçu d atropine, il faut environ 10 heures pour sécréter et resynthétiser la quantité de pepsinogène égale à celle qui était présente à jeun alors que sous l influence de l atropine, il faut compter 16 heures Effets endocrines Ni les gonades ni la thyroïde ou les parathyroïdes n ont d effets significatifs sur la synthèse ou la sécrétion de pepsinogène ou la morphologie de la cellule peptique, alors qu une insuffisance surrénalienne ou pituitaire (Hirschowitz, 1967) est responsable d une diminution marquée mais non spécifique de la synthèse de pepsinogène, conformément à la baisse générale de synthèse protéique. Chez les rats surrénalectomisés, cette synthèse est affectée par la diminution du sodium, le manque de nourriture, le jeun ou des doses excessives de cortisone (75 mg/kg par jour) mais aucun de ces paramètres n affectent les rats sains. Les effets de la surrénalectomie peuvent être contrecarrés non spécifiquement par diverses hormones qui ont des activités gluco- et minéralocorticoïdes très variables. La diminution de synthèse s accompagne d une baisse proportionnelle de la sécrétion. Un effet contraire d une activité surrénalienne excessive n a pas prouvé mais une étude sur l augmentation de la sécrétion du pepsinogène gastrique chez les rats et les chats grâce à l hormone de croissance (Friedman et al., 1955), suggère que la glande pituitaire peut avoir une action directe sur la muqueuse gastrique. Il existe donc une régulation fine de la synthèse, du stockage et de la sécrétion de sorte que la cellule est capable de sécréter à la fois immédiatement et de façon continue et prolongée avec un changement coulant d un type de sécrétion à l autre Sécrétion du pepsinogène Considérations générales (Hirschowitz, 1967) Il est important d avoir à l esprit que dans la muqueuse gastrique la sécrétion de pepsinogène constitue un système complètement différent de la sécrétion d électrolytes et ces deux types de sécrétion sont différents de la musculature gastrique mais pour ces propres fonctions digestives, l estomac de l action étroitement intégrée de ces trois systèmes indépendants mais en corrélation. Dans l étude de ces fonctions, la corrélation quantitative entre les produits de chaque système, le commencement de l activité après stimulation et la fin de celle-ci avec des inhibiteurs et le comportement de chaque système sous diverses conditions sont utilisés. Etant donné que le type et l étendue de la réponse de chaque système est fondamentalement différente, aucune étude sur le contrôle de la sécrétion gastrique ne peut être complète à moins que la pepsine et les électrolytes ne soient mesurables et que le rendement maximal de chaque système sous
45 l effet du meilleur stimulus soit connu. Les mécanismes de contrôle du relargage des granules de zymogène et les facteurs qui contrôlent la sécrétion continue, secondés par la synthèse de nouvelles protéines, doivent être différents au niveau cellulaire de ceux qui commencent la sécrétion d H+ et le transport de Cl, Na et K et d eau et qui les maintiennent en sécrétion active. Les mécanismes régissant l intégration étroite entre la sécrétion de pepsine et d électrolytes mais aussi entre ces deux phénomènes et la motilité sont peu compris. Afin d être plus spécifiques et sans s intéresser à la motilité pour le moment, les sécrétions d électrolytes et de pepsinogène doivent pouvoir être stimulées indépendamment l une de l autre, ensemble par un stimulus commun et, s il existe un inhibiteur spécifique pour ce stimulus, inhibées ensemble par cette substance. Chacune doit pouvoir être stimulée par un stimulus différent agissant simultanément et enfin l une doit être stimulée quand l autre est inhibée, même par un agent identique. Certains effets secondaires de l inhibition de la sécrétion d électrolytes peuvent avoir des répercussions sur celle du pepsinogène. Par conséquent dans des conditions autres que le stimulus et l inhibiteur communs, il serait improbable ou au mieux fortuit de trouver une relation soit temporelle soit quantitative entre la sécrétion d acide et de pepsinogène Stimulus commun Le stimulus commun habituel et celui qui s applique probablement à la plupart des espèces est le nerf vague. La stimulation la mieux définie du nerf vague chez l animal intact peut être obtenue par hypoglycémie ou par le 2-désoxy-D-glucose (2DG) qui agit en stimulant l hypoglycémie (Hirschowitz, 1967). Chez l homme, le 2DG stimule à la fois la sécrétion d acide et de pepsine à un taux maximal alors que chez le chien, pour lequel l action maximale est de plus courte durée, les sécrétions d acide et de pepsinogène commencent, atteignent leur pic et déclinent en même temps et aux mêmes taux. Dans d autres expériences chez le chien, le déclenchement et la diminution de la motilité sont étroitement reliés à la sécrétion gastrique. Les mêmes résultats sont obtenus par stimulation électrique du nerf vague (Bowie et Vineberg, 1935). L atropine arrête immédiatement (<15s) les 3 effets du nerf vague ou peut les empêcher complètement chez le chien. D autres stimuli peuvent agir simultanément sur les deux systèmes : par exemple, l histamine chez l homme, la gastrine chez l homme et le chien et des doses appropriées de substances cholinergiques bien qu elles ne stimulent pas l un ou l autre système au maximum et donc laissent la place pour une synergie apparente avec d autres stimuli Stimulation d un système La stimulation d un système indépendamment de l autre a pu être réalisée : par exemple, chez le chien ou le chat, l histamine peut stimuler la sécrétion d électrolytes au niveau de sa capacité maximale et ne stimule pas la sécrétion de pepsinogène. Cette dernière peut être favorisée sans sécrétion acide par de fortes doses d acétylcholine (Hirschowitz, 1967) Stimuli simultanés Deux stimuli agissent en même temps, l un favorise la sécrétion d électrolytes et l autre celle du pepsinogène et chacun peut être inhibé séparément. En effet, si le 2DG ou une substance cholinergique est injecté(e) à un chien au cours d une stimulation continue par l histamine, une augmentation très rapide de la sécrétion de pepsinogène est observée sans modification concomitante de la sécrétion d acide qui est déjà maximale. Cette action peut être bloquée par l atropine sans affecter considérablement la sécrétion d électrolytes (Hirschowitz, 1967)
46 Inhibition et stimulation simultanées Enfin, un système peut être stimulé quand l autre est inhibé. En effet, si l insuline est injectée à des doses supérieures à 0,4 unités/kg durant une perfusion d histamine chez le chien, l hypoglycémie résultante les cellules peptiques alors que l insuline inhibe directement la sécrétion d électrolytes. Des faits similaires se produisent lors de la réponse sécrétrice de l estomac à l insuline sans intervention de l histamine, l insuline agissant directement sur la muqueuse sécrétrice en inhibant la sécrétion d électrolytes consécutive à l hypoglycémie. Cette inhibition est en relation avec les effets de l insuline sur le potassium dans les cellules sécrétrices d électrolytes. La situation converse, en l occurrence l inhibition de la sécrétion du pepsinogène par un agent stimulant la sécrétion d acide, est constatée avec l effet de l histamine durant la stimulation vagale de la sécrétion peptique qui est inhibée à hauteur de 25 à 50% (Hirschowitz, 1967) Inhibition secondaire Dans les expériences sur l insuline chez le chien, un effet secondaire de l inhibition de la sécrétion d électrolytes sur la sécrétion de pepsinogène peut se produire. Quand le volume relargué diminue à la suite de l inhibition de la sécrétion d électrolytes, la concentration de pepsine dans le suc gastrique augmente rapidement parce que le stimulus vagal agit encore sur la cellule peptique. Avec de très faibles volumes, l excrétion de pepsine décroît mais des concentrations remarquablement élevées de cette dernière sont mises en évidence. A la fois dans ce cas, dans celui de l atropine chez le rat et de la sécrétion dans de faibles volumes de pepsinogène très concentré après une administration d acétylcholine (Uvnäs, 1942), l eau est un facteur limitant de la sécrétion de pepsinogène. Quand le taux de sécrétion d eau est rapidement augmenté, soit par injection de KCl pendant une inhibition de l insuline, soit par injection d histamine pendant l action de l acétylcholine (Uvnäs, 1942), la sécrétion de pepsine est apparemment fortement stimulée pendant un moment. Cela peut représenter l excrétion de pepsinogène par la cellule peptique ou par les tubules où il s accumule pour la demande d eau qui le transporte à l extérieur de la cellule Les stimuli «dominant» et «dominé» Il est nécessaire de garder à l esprit que l action d un stimulus peut être submergée par un autre et que le stimulus dominant a l avantage. Pendant que l histamine est perfusée en quantité suffisante pour obtenir les taux maximaux de sécrétion d électrolytes, aucune autre augmentation de ce paramètre ne peut être attendue en ajoutant un autre stimulant qui a le même résultat final. Si le second stimulus, vagal par exemple, est capable par lui-même de produire la même quantité d acide, la seule preuve de son action sera l augmentation de la sécrétion de pepsinogène. Si le stimulus primaire est vagal et que la pepsine est sécrétée à des taux maximaux, l addition d une substance cholinergique par exemple, n augmente pas la sécrétion de pepsine. Par ce raisonnement, l action du relargage de gastrine sous l effet du nerf vague, peut entièrement être submergé par un effet vagal dominant direct (Hirschowitz, 1967) Mécanismes cellulaires de la stimulation de la sécrétion Il apparaît que les stimuli cholinergiques, la gastrine, dans certaines espèces l histamine et la caféine et chez l homme la réserpine et l hyperventilation sont capables de stimuler la sécrétion de pepsinogène mais seuls les stimuli cholinergiques et la gastrine sont sensibles à l atropine. Il semble par ailleurs improbable que l un de ceux-ci puisse être le médiateur final commun au niveau cellulaire, s il existe en effet seulement un tel médiateur. Le relargage de pepsinogène au niveau de la membrane luminale de la cellule est vraisemblablement dû à une
47 interaction entre la membrane cellulaire et celle des granules, qui peut être favorisée par n importe quel stimulus auquel la cellule peptique est sensible. La synthèse accrue résultant de la sécrétion est probablement un effet secondaire de la perte de granules de zymogène et dépend du système de feed-back inhérent à l association stockage-synthèse de la cellule peptique. En fonction de l espèce, du stimulus et des statistiques, la sécrétion de pepsinogène peut être corrélée positivement, négativement ou non à la sécrétion d H + et Cl - (Hirschowitz, 1967) Sécrétion basale Une certaine sécrétion de pepsinogène doit être présente dans tous les estomacs normaux puisque la synthèse, qui est normalement un processus indépendant et continu, remplit la cellule peptique de granules (Menzies, 1962) et que la sécrétion excessive se produit par décharge des granules afin de recevoir le pepsinogène nouvellement synthétisé. Ainsi, par exemple, le pepsinogène peut être récupéré d un estomac de chien apparemment non sécrétant par lavage (Schofield, 1959). Les seules exceptions sont constatées quand la synthèse est déprimée notamment lors d insuffisance pituitaire ou surrénalienne ou d hibernation et, évidemment, en l absence de cellules peptiques observée lors d atrophie gastrique complète. Cette sécrétion excessive due à la synthèse est la seule véritable sécrétion basale de pepsinogène et rien ne dénote plus que cela la stimulation soit par un stimulus endogène (nerveux ou hormonal), soit par un stimulus exogène. Les raisons de la présence d une telle stimulation endogène basale de pepsinogène et d électrolytes chez certaines espèces et de son absence dans d autres espèces sont encore obscures à l heure actuelle mais semblent reliées aux habitudes alimentaires. La sécrétion basale continue se manifeste chez l homme, les singes, le rat (Friedman, 1955), la souris, les herbivores (Hirschowitz, 1967). La sécrétion de pepsinogène non stimulée représente chez l homme avec ou sans affection du tractus gastrointestinal supérieur environ 28% de celle produite par une stimulation maximale avec l histamine (Ihre, 1938) et 20% de celle obtenue par une stimulation vagale maximale grâce au 2DG. Le suc gastrique et ainsi le pepsinogène sont produits à des taux très bas ou nuls dans des conditions basales chez le chien, le chat, les oiseaux et la grenouille bien qu il soit rapporté que 80% des grenouilles sécrètent spontanément au printemps et en été mais seulement 20% en hiver. Durant l hibernation ou à des températures très basses, la grenouille arrête de sécréter, le hérisson produit apparemment de l acide sans pepsine et possède des cellules peptiques vides ; cela suggère un défaut de synthèse. Le réchauffement climatique restaure rapidement la sécrétion de pepsinogène (Hirschowitz, 1967) Stimulation de la sécrétion (Hirschowitz, 1967) La plupart des stimuli de la sécrétion de pepsinogène favorisent également tous les composés de la sécrétion gastrique, bien que la force relative de la stimulation des cellules peptiques et principales par des stimuli différents diffère. Pour cette raison, une comparaison des stimuli chez n importe quel animal est mieux analysée en mettant en relation la quantité de pepsine et d acide (ou de chlore) que l estomac est capable de sécréter au maximum sous l effet d un stimulus approprié. Une autre procédure utile est de calculer le ratio de la concentration de pepsine sur celle de l acide ce qui permet une comparaison entre les stimuli sans tenir compte de la taille de la muqueuse sécrétrice ni de celle de l échantillon de suc gastrique. Dans la plupart des espèces, les mécanismes cholinergiques (vagaux) sont les stimuli les plus puissants et les plus clairs de la sécrétion de pepsinogène. Ils ne sont cependant pas les seuls stimuli et la sécrétion de pepsinogène ou son inhibition par l atropine n est en elle-même pas une indication absolue de l activité vagale ou cholinergique
48 Mécanismes cholinergiques A l exception éventuelle de la grenouille et de Necturus, la sécrétion de pepsinogène peut être stimulée par le nerf vague chez toutes les espèces étudiées, que ce soit par une stimulation électrique directe adéquate des troncs nerveux (Babkin, 1950) ou indirectement par une hypoglycémie (Ihre, 1938) induite par l insuline après administration de 2DG, par l alcool, par une prise alimentaire simulée, par des réflexes vago-vagaux induits par la distension de l estomac, par des stimuli psychiques et par dépression de la fonction cérébrale. Ces effets peuvent en général être bloqués par des doses adéquates d atropine (Babkin, 1950) et sont naturellement inefficaces après vagotomie. La simulation chimique de l effet vagal périphérique peut être obtenue par des esters de choline (acétylcholine, Mecholyl, carbachol et urécholine) ou par l inhibition de la cholinestérase par le diisopropyl-fluorophosphate (DFP) ou par la pilocarpine ou l ésérine in vivo (Babkin, 1950) ou in vitro. De grandes quantités de substances cholinergiques inhibent actuellement à la fois la sécrétion in vivo et in vitro (Villareal, 1953). Cependant, la réponse aux esters de choline ou aux inhibiteurs d acétylcholinestérase est considérablement plus faible qu elle ne peut l être à une stimulation vagale maximale et ainsi cela laisse la place à des actions potentielles par d autres stimuli plus puissants. L étude des facteurs contrôlant ou affectant le contrôle vagal de la sécrétion gastrique s effectue sur des chiens dressés, non anesthésiés et possédant une canule gastrique. Cette préparation est particulièrement adaptée à l étude de la réponse sécrétrice de l estomac aux stimuli vagaux parce que l histamine suscite une faible sécrétion de pepsine et il n y a pas de sécrétion basale chez un animal correctement dressé (Babkin, 1950). Du 2DG est injecté pendant une perfusion d histamine à dose maximale et provoque une augmentation rapide de la sécrétion de pepsine sans affecter le volume relargué ou la quantité d acide émise. Cette action est empêchée par l atropine donnée en même temps que le 2DG. L injection de ce dernier à des doses de 100 mg/kg produit des effets parallèles sur l émission de pepsine et d acide, la production maximale d acide égalant celle obtenue par action de l histamine et la production de pepsine dépassant celle obtenue sous l effet de l insuline. Parmi différents types de sucres, seul le prétraitement à base de glucose ou de mannose empêche l action du 2DG sur le nerf vague ; le galactose est sans effet et le fructose et le 3-0 méthylglucose augmentent la réponse au 2DG. L atropine administrée avant l injection de 2DG empêche complètement la sécrétion gastrique et lorsqu elle est donnée une heure après le 2DG, elle arrête la sécrétion (et la motilité) dans les 15 secondes ; cela indique que les sécrétions d acide et de pepsine ainsi que la motilité peuvent être stimulées par le même mécanisme (cholinergique). Les effets du 2DG ont été comparés à ceux de l histamine et de l insuline chez l homme : il a été montré qu il produit la même quantité d acide et une quantité de pepsine deux fois plus élevée que celles obtenues avec l histamine ou l insuline (Duke et al., 1965) mais il ne stimule pas un estomac vagotomisé. (Hirschowitz, 1967) L hypoglycémie induite par l insuline est à l origine d effets similaires à ceux évoqués précédemment, sauf en ce qui concerne l inhibition significative de la sécrétion d eau et d électrolytes par des doses d insuline supérieurs à 0,4 unités par kg grâce à une action directe sur la muqueuse gastrique et réversible par une injection intraveineuse de K + ou de Rb +. Pendant l action de l insuline, la production de pepsine est bien corrélée avec le logarithme de la concentration sanguine en sucre, mais l injection d un gramme de glucose par kg 30 à 90 minutes après l insuline n arrête pas la sécrétion gastrique et la relation entre la glucose et la pepsine n est plus vérifiée. L atropine injectée 90 minutes après l insuline stoppe toutes les sécrétions gastriques dans les 15 secondes mais l effet du prétraitement à l atropine qui a échoué dans le blocage de la sécrétion gastrique est anormal
49 A partir de ces études, il est possible de dire sur le système sécréteur (et moteur) vagal de l estomac : - il est particulièrement sensible au manque de glucose lors de son initiation, - de tous les sucres testés, seuls le mannose et le glucose sont des substrats adéquats pour les centres neuronaux en relevant alors que le fructose, le galactose et le 3-0 méthylglucose ne le sont pas et les deux derniers assurent actuellement l activation du système par une compétition potentielle avec le glucose pour entrer dans le cerveau, - une fois que le système est activé, il ne peut pas être arrêté en injectant de grandes quantités de glucose et donc n apparaît pas dépendant d la concentration de glucose dans le sang ou le cerveau pour maintenir de façon continue la stimulation de la sécrétion. La nature des mécanismes assurant une sécrétion continue n est pas connue, - il est dose-dépendant et ne fournit pas une réponse de type tout ou rien, que ce soit pour l ampleur de la réponse ou l arrêt de la stimulation, - il est vraisemblablement dépendant de la transmission cholinergique jusqu à un certain point puisque l atropine bloque la sécrétion stimulée et la motilité dans les 15 secondes et empêche complètement l effet du 2DG, - la réponse gastrique à une stimulation vagale est inhibée à hauteur de 80-90% par une anesthésie au Nembutal ce qui suggère une inhibition centrale par un mécanisme noncholinergique et cela rend incertain les résultats obtenus sur des animaux anesthésiés Effets de la dénervation Chez l homme, les résultats de vagotomie chirurgicale sur les ulcères sont variables puisqu aucun essai de vagotomie n est complet et que la collecte de suc gastrique est incertaine surtout dans les cas associés à une gastrectomie partielle. Dans un certain nombre de rapports, aucun effort n a été fait pour éliminer les cas avec une vagotomie incomplète, en conséquence il apparaît que la sécrétion de pepsine n est pas diminuée de manière significative. Quant aux cas où la vagotomie complète a pu être prouvée par l échec de la réponse à un stimulus vagal (Duke, 1965), la sécrétion basale d HCl est fortement déprimée voire absente et celle de la pepsine, bien que diminuée significativement, est toujours présente. En dépit du fait qu un estomac privé d innervation vagale puisse répondre à une stimulation par l histamine, la production maximale de pepsine est significativement moindre qu avant la dénervation (Duke, 1965) mais pas autant que la sécrétion d acide. L augmentation de la pepsine lors d hyperventilation n est pas affectée par la vagotomie (Hirschowitz, 1967). Des études variées ont été pratiquées sur des chiens chez lesquels l histamine ne stimulait pas la sécrétion de pepsine et aucune sécrétion basale ne se produisait ; les réponses obtenues diffèrent totalement de celles de l homme. De fait, les diverses préparations canines conviennent peut-être mieux à une étude sur l effet de la dénervation gastrique sur la sécrétion de pepsine. Des parties de la muqueuse gastrique fundique ont été dénervées par différentes méthodes ; par exemple, section des troncs vagaux après des observations de contrôle du sac fondique (Ferguson, 1963), préparation de sacs dénervés du type Heidenhain et enfin transplantation complète du sac avec une séparation totale de l apport nerveux et vasculaire (Ferguson, 1963). Une dénervation réversible de l estomac a été étudiée en injectant un anesthésique local dans les troncs vagaux. La dénervation vagale du sac fundique réduit la production de pepsine en réponse à l histamine et la pilocarpine de 50 à 70% et à l insuline de 80 à 95%, de même elle élimine la stimulation à une distension locale (vago-vagal) ou à une stimulation antrale (Ferguson, 1963). Cependant, le sac répond toujours à la pilocarpine, possiblement à cause de la persistance d une choline-acétylase locale. Des sacs transplantés sont presque complètement dépourvus de sécrétion de pepsine (moins de 1% des sacs innervés (Ferguson, 1963), bien que
50 un nettoyage minutieux du sac fournit toujours un peu de pepsine). Cependant la capacité de la muqueuse gastrique des Mammifères à sécréter in vitro indique qu elle peut fonctionner en l absence totale de sang ou d innervation et qu elle répond toujours à l histamine et à des stimuli cholinergiques (Villareal, 1953) Histamine La reconnaissance des différences spécifiques de l effet de l histamine sur la sécrétion de pepsinogène (Hirschowitz, 1967) a peut-être calmé une longue polémique. Les désaccords provenaient de méthodes de mesure de pepsine peu efficaces mais aussi de l habitude de mesurer la concentration et non la production. C est la raison pour laquelle l histamine à des doses variables et chez différentes espèces peut stimuler, inhiber ou n avoir aucun effet sur la sécrétion de pepsinogène. - Stimulation La stimulation de la sécrétion de pepsinogène et d acide chez l homme sous l effet de l histamine a été confirmé de nombreuses fois et cette réponse n est pas affectée par les antihistaminiques. Bien que la vagotomie réduise la réponse maximale, le ratio pepsine sur acide après stimulation par l histamine peut augmenter (Hirschowitz, 1967). L histamine stimule aussi la sécrétion de pepsinogène chez le singe, le cochon d Inde, le serpent, la tortue, la grenouille et la souris (Villareal, 1953). Ceux qui dénigrent la véritable stimulation du pepsinogène par l histamine, chez l homme en particulier, prétendent que la concentration initialement élevée et qui décline ultérieurement quand le volume augmente est une preuve du relargage de pepsine préformée ou présécrétée dans les tubules. Cependant, l observation de la production de pepsine pendant l administration intra-veineuse d histamine pendant 3 à 5 heures ou plus (Hirschowitz, 1967) révèle une croissance régulière de la production d un niveau basal à prolongé atteignant 3 à 4 fois les valeurs basales. Si une production prolongée définit une stimulation de la sécrétion, il s en suit que l histamine stimule la sécrétion de pepsinogène chez l homme, à la fois en causant le relargage initial des granules et en maintenant la sécrétion de pepsinogène nouvellement formé. - Manque de stimulation Le manque de stimulation de la sécrétion par l histamine a été décrit chez le chien, le chat (Linde, 1953), la marmotte, le pigeon, le poulet, la raie et cela peut provenir de l inhibition montrée par la suite. - Inhibition Avec des doses croissantes d histamine chez le chien et le chat, il y a une diminution progressive de la production de pepsine (Linde, 1953) alors que celle d acide augmente mais avec des doses trop élevées elle finit par décroître. Des doses excessives d histamine inhibe la sécrétion comme c est la cas avec un excèdent d esters de choline. Les doses les plus faibles stimulent apparemment de très petites quantités de pepsinogène. Avec une perfusion continue de 50 µg d histamine /kg/h, la plus faible dose pour obtenir une production d acide maximale chez des chiens conscients avec une fistule gastrique, la production de pepsine est un peu plus élevée dans la première heure que dans la deuxième ou la troisième, mais dans la quatrième heure, la concentration et la production doublent (Hirschowitz, 1967). Ces productions sont 15 à 30 fois plus élevées que celles résultant de la stimulation vagale mais peuvent être diminuées de plus de 50% par l administration d atropine pendant la perfusion. L administration d atropine avant de commencer la perfusion d histamine aboutit cependant à une sécrétion de pepsine 3 à 6 fois plus élevée qu avec l histamine sans atropine. Cela reste inexpliqué mais peut être analogue à la situation dans laquelle l histamine stimule la pepsine plus facilement d un sac fundique dénervé qu innervé. Une preuve plus directe de la suppression de la sécrétion de pepsine par l histamine chez le
51 chien vient de la diminution de cette sécrétion de 25 à 50% pour une dose donnée d insuline, de 2DG ou d urécholine fournie durant une perfusion d histamine plutôt qu administrée comme seul stimulus chez les mêmes chiens (Hirschowitz, 1967). L histamine ne semble pas inhiber la synthèse de pepsinogène puisque la cellule peptique contient progressivement de plus en plus de granules lors de longues perfusions d histamine (plus de 9 heures) (Bowie, 1935). Il n y a pas d explication correcte concernant l inhibition ou même le manque de stimulation de la sécrétion de pepsine par l histamine chez certaines espèces ; mais cela indique que l histamine est de façon peu probable le médiateur final commun pour la stimulation soit cholinergique soit par la gastrine de la sécrétion de pepsine puisque les deux stimulent fortement la sécrétion de pepsinogène et sont inhibées par l atropine. - Synergie avec les stimuli cholinergiques D après les données fournies précédemment, il est évident que deux stimuli différents de la sécrétion gastrique (l un agissant sur les électrolytes et l autre sur la pepsine, en l occurrence, l histamine et les substances cholinergiques respectivement) peuvent agir simultanément. L addition d une stimulation vagale puissante pendant une perfusion d histamine n augmente pas la sécrétion d eau et d électrolytes qui est déjà maximale, et le pepsinogène est ajouté au suc gastrique en quantités variables dépendantes de la force du stimulus vagal. Les stimuli cholinergiques chimiques sont généralement de plus faibles stimuli de la sécrétion gastrique que les stimuli vagaux ; par exemple, l acétylcholine en elle-même ne peut pas stimuler la sécrétion d acide chez le chat (Linde, 1953) mais en agissant avec l histamine il s agit d un stimulant puissant de la sécrétion de pepsinogène. C est aussi le cas du Mécholyl et de la pilocarpine chez l homme qui, à faibles doses, stimulent l émission de quantités relativement faibles de suc gastrique plutôt visqueux, pauvre en acide mais riche en pepsine et, à fortes doses, stimulent la production de mucus et de pepsine mais pas d acide. Au cours d une administration pendant une stimulation par l histamine, alors que la sécrétion d eau et d électrolytes est déjà active, il est aisé de voir comment la pepsine est plus facilement sécrétée et probablement en plus grande quantité qu il n est fabriqué dans la sécrétion visqueuse d une substance à activité cholinergique ou dans la sécrétion stimulée par l histamine ou encore de l association des deux (Linde, 1953). L affirmation de l existence d une synergie serait plus convaincante si la production de pepsine dans de telles conditions était supérieure à celle qui est maximale chez l animal qui subit un stimulus vagal puissant Stimuli hormonaux La grande puissance de la gastrine (<2µg/kg chez l homme pour une stimulation maximale de la production d acide) et les quantités relativement élevées d extrait de muqueuse pylorique requises pour produire les mêmes effets signifie qu une grande quantité de produits possiblement actifs et non identifiés doivent être injectés avec ces extraits. Les informations publiées disponibles sur la sécrétion de pepsinogène après stimulation par la gastrine ou par les polypeptides synthétisés sont incomplètes. Une étude (Hirschowitz, 1967) utilisant un pentapeptide chez des chiens conscients avec une canule gastrique indique qu une perfusion intra-veineuse au rythme d 1,5 µg/kg/h stimule la sécrétion d acide à hauteur de 80% de la production obtenue avec une dose maximale d histamine ( µg/kg/h) mais 10 à 20 plus de pepsine, ou environ la moitié de la réponse maximale à une stimulation vagale chez les mêmes chiens. La croissance de la sécrétion de pepsine est lente et le pic de production est retrouvé presqu une heure après celui obtenu par un stimulant vagal. A d autres égards, le pentapeptide a des effets sur Na, K et Cl similaires à ceux de l histamine, incluant la diminution du taux de sécrétion. Par contraste avec cet effet sur la sécrétion stimulée par l histamine, l atropine inhibe la réponse du facteur volume à l action du pentapeptide d environ 90% et cela réduit la concentration en acide de 30% et de pepsine de 75%. De fait la stimulation de l acide et de la pepsine par la gastrine et l inhibition de ces
52 deux produits par l atropine suggère que la gastrine est un «stimulus commun». L inhibition par l atropine (Gregory et Tracy, 1961) confirme les précédents rapports. Le sac fondique dénervé répond poins à la stimulation par la gastrine en ce qui concerne les sécrétions d acide et de pepsine (Gregory et Tracy, 1961) mais avec des doses supramaximales (pour l acide) d extraits de muqueuse pylorique, la pepsine augmente à l opposé de l effet inverse de l histamine. L anesthésie des troncs vagaux réduit la production d acide pendant la stimulation par la gastrine mais une telle expérience avec mesure de la sécrétion de pepsine n a pas été reportée Syndrome Zolinger-Ellison C est une affection humaine causée par une tumeur du pancréas qui sécrète de la gastrine et produit des taux permanents et élevés de sécrétion gastrique et de maladie ulcérative intraitable. Un sécrétagogue gastrique puissant a été isolé de telles tumeurs ; dans deux cas (Gregory et Tracy, 1961), l extrait stimule la sécrétion d acide avec un peu de pepsine alors que dans un autre cas (Hirschowitz, 1967), des extraits de tumeurs donnés à des chiens avec une fistule stimule la sécrétion d acide aussi puissamment que l histamine et la pepsine qu un stimulus vagal maximal. A la vue des effets du pentapeptide synthétique ayant le rôle de la gastrine, il semble que dans les cas précédents, les tumeurs manquent d activité stimulant la pepsine. Savoir si cela signifie qu il existe deux hormones ou s il s agit d un résultat anormal, n est pas déterminé L antre pylorique comme source de sécrétagogue La plupart des études, en faible nombre par ailleurs sur ce sujet, considère l antre pylorique comme le site de production d un agent humoral capable de stimuler la sécrétion de pepsinogène comme celle de l acide et à un niveau plus élevé. Langley a montré en 1881 (Hirschowitz, 1967) qu une éponge placée dans l antre d une grenouille est responsable d une sécrétion rapide de pepsinogène dans l œsophage alors qu une stimulation locale de ce dernier n a pas cet effet. Chez les chiens, la stimulation de cette zone par distension, par des extraits de foie ou de viande ou par transplantation vers le côlon, donne une augmentation de la sécrétion de pepsinogène en rapport avec l élévation de la sécrétion d acide. Des sacs fundiques transplantés, cependant, sécrètent très peu de pepsine avec n importe lequel de ces stimuli (Ferguson, 1963). La stimulation vagale de la sécrétion de pepsinogène pour l estomac innervé ne nécessite pas l antre ; la cocaïnisation, la dévascularisation ou le retrait de l antre (Linde, 1953) confirme ceci. Par contre, le nerf vague est vraisemblablement à l origine du relargage de gastrine par l antre (Uvnäs, 1942), bien que cette action soit facilement submergée au cours d une action directe et plus forte du nerf vague sur la muqueuse innervée. Il apparaît donc, à l exception de situations particulières comme le syndrome de Zollinger- Ellison que la gastrine antrale ne joue pas un rôle prédominant dans les mécanismes normaux contrôlant la sécrétion de pepsinogène Phase intestinale de la sécrétion gastrique La sécrétion de pepsinogène déclenchée par la nourriture ou l HCl présents dans l intestin est probablement soumise à l action d hormones (Babkin, 1950) et chez Necturus spp, cela semble être le seul stimulus connu de la sécrétion de pepsinogène. Un échantillon de sécrétine provenant de la muqueuse intestinale et mise en solution dans le butanol a été rapporté comme stimulant la sécrétion de pepsine. Les données suggèrent en effet un mécanisme hormonal mais comme avec la gastrine endogène, la phase intestinale est habituellement
53 négligeable et a tendance à être inefficace ou submergée par rapport à une stimulation directe plus forte par le nerf vague (Hirschowitz, 1967) Autres stimuli - Probablement vagaux Les réflexes vago-vagaux ont été impliqués dans la stimulation de la sécrétion lors de la distension du sac fundique innervé (Ferguson, 1963). Chez le chien, par exemple, de 10 à 20 fois plus de pepsine sont sécrétés par rapport à l acide grâce à la distension en comparaison de ce qui est produit avec l histamine (Grossman, 1963). Des réflexes similaires sont décrits pour les sécrétions pancréatiques. De tels réflexes jouent sans doute un rôle significatif dans les réponses normales après un repas et lors de sécrétion excessive de suc gastrique à la suite d une sténose pylorique. Les sacs dénervés ne répondent pas à la distension (Ferguson, 1963) mais le font correctement quand ils sont d abord stimulés par de faibles doses d histamine ou de gastrine (Grossman, 1963). L augmentation de la pression intra-crânienne (Fattah, 1961) et les lésions de la tête ou les chirurgies du crâne sont responsables d une stimulation de la sécrétion de pepsine, vraisemblablement par le nerf vague. Une réponse bimodale à la stimulation électrique de l hypothalamus postérieur a été mise en évidence dans laquelle le pepsinogène du suc gastrique ainsi que les catécholamines sanguines augmentent avec un pic à 30 et 120 minutes. Après sympathectomie, le premier pic disparaît mais pas le deuxième (Concha et al., 1960). L alcool stimule la sécrétion d acide et celle de pepsine, probablement par voie vagale et cet effet peut être bloqué par l atropine (Hirschowitz, 1967). - Non relayés par voie vagale L hyperventilation chez l homme accroît la sécrétion de pepsinogène jusqu à 100%, avec une production jusqu à 30% plus élevée qu avec l insuline. Ceci est accompagné par une discrète diminution de l sécrétion d acide. L hyperventilation est efficace à l état basal ou stimlué par l histamine et avec un délai minime mais sans diminution de la réponse, chez l homme vagotomisé ou atropiné de façon adéquate ; il est donc suspecté une action locale sur la cellule peptique (Hirschowitz, 1967). Une simple injection de réserpine à des doses thérapeutiques chez l homme augmente la sécrétion d acide et de pepsine (Levrat et Lambert, 1962) chez l homme pour 6 heures ou plus. Cette action n est pas bloquée par la vagotomie ou l atropine et donc une action directe sur la cellule peptique a été suggérée, de nouveau par un mécanisme non expliqué. En 1933, Komarov a extrait une substance du suc gastrique du chien qui stimule la sécrétion de pepsine pendant l administration d histamine. La stimulation du pepsinogène chez des chats anesthésiés et dénervés par un extrait de la muqueuse antrale a été rapportée. La nature de cette substance demeure inconnue et son action indéterminée (Hirschowitz, 1967). La caféine stimule la sécrétion gastrique chez le chat et l homme, particulièrement puissamment chez les patients atteints d ulcères duodénaux. Cette stimulation du pepsinogène est additive avec de petites doses d histamine (0,1-0,2 mg) et a le même effet sur la stimulation d acide et de pepsine que cette dose d histamine. Cependant chez le chien, la caféine seule est complètement inefficace pour stimuler la sécrétion d acide ou de pepsinogène, qu elle soit donnée par voie orale ou intra-veineuse. Si elle est injectée pendant un stimulus histaminique, aucune augmentation du pepsinogène n est observée. Les différences d espèce ne s expliquent pas mais l effet prolongé et puissant de la caféine sur la sécrétion gastrique de sujets atteints d ulcères duodénaux suggère l hypothèse qu elle peut être à l origine du relargage de gastrine chez l homme (Grossman, 1963)
54 Inhibition de la sécrétion de pepsinogène La sécrétion de pepsinogène est diminuée quand la synthèse de l enzyme est déprimée comme c est la cas au cour de l hibernation ou durant une insuffisance pituitaire ou surrénalienne (Schofield, 1952) qui déprécie également la sécrétion d acide à un niveau au moins égal ou plus élevé. Cela se produit également lors d atrophie pathologique de la muqueuse gastrique, de diminution de la vascularisation sanguine ou de vagotomie. L inhibition de la sécrétion de pepsine stimulée par un inhibiteur peut être due à un blocage d un stimulant spécifique, par exemple : inhibition par l atropine d une substance à action vagale et cholinergique ou stimulation de la gastrine au cours de laquelle les concentrations de pepsine et d électrolytes ainsi que leur production sont diminuées. Si le stimulus de la stimulation du pepsinogène agit simultanément avec un stimulus des électrolytes (insuline et histamine), l atropine bloque seulement le premier. L inhibition de la sécrétion de pepsinogène peut être secondaire à une diminution de la sécrétion d eau. Le tableau caractéristique dans une telle situation est une montée en flèche de la concentration de pepsinogène quand la production d eau décroît. Si le volume est suffisamment réduit, la production de pepsine diminue et l eau est excrétée à un taux limité à la sécrétion. De tels effets sont observés avec l insuline, le Diamox chez le chien, l atropine chez le rat, l entérogastrone et l huile dans l intestin (Hirschowitz, 1967). L histamine inhibe la production de pepsinogène chez le chien et le chat alors qu une sécrétion d acide fortement stimulée et de l atropine injectée pendant une perfusion d histamine chez des chiens réduit davantage la concentration et la production de pepsine. Mis à part ces effets chez le chien et le chat, il n y a pas d inhibiteurs spécifiques connus de la sécrétion de pepsinogène. La dépression modérée de la sécrétion de pepsinogène par l atropine dans certaines circonstances (pendant une stimulation par l histamine (Polland, 1931) ne peut être expliquée par une action anti-cholinergique pure. Cet effet et l inhibition par l atropine de la sécrétion d acide et de pepsine durant la stimulation gastrique ne peut être expliquée à cause du manque de connaissance des mécanismes cellulaires Influences endocrines sur la sécrétion gastrique Hypophyse antérieure L hypophysectomie chez le rat provoque une diminution de 80% de la sécrétion d acide et de pepsinogène qui commence après 3 à 7 jours avec une involution des cellules principales, et une décroissance du contenu de la muqueuse en pepsinogène (Hirschowitz, 1967). La cause de cette involution n est pas connue et aucune expérience visant au remplacement adéquat n a pas été tentée. Il faut se souvenir que les expériences d ablation aboutissent à une perte de poids sévère ce qui rend l interprétation de ces expériences moins faciles. La stimulation de la sécrétion d acide et de pepsine par les hormones de croissance chez le rat et le chat a été rapportée dans une étude (Friedman, 1955) mais ce travail n a pas été confirmé ou étendu. S il est confirmé, cela impliquerait un rôle plus direct de l hypophyse par rapport aux surrénales dans la sécrétion gastrique Cortex surrénalien Bien qu il existe de fortes controverses quant au rôle stimulant du cortex surrénalien (Crean, 1963), il y a unanimité sur le fait qu une insuffisance adréno-corticale cause une diminution modérée à marquée de la sécrétion gastrique chez l homme et le rat et peut être aggravée par un épuisement en sel ou un autre stress chez le rat (Hirschowitz, 1967). La réduction de la sécrétion de pepsinogène et à la fois d acide peut être renversée par un apport thérapeutique d extraits de cortex, de cortistérone, de désoxycorticostérone, de cortisone ou d hydrocortisone ce qui indique l effet relativement non spécifique de la surrénalectomie. La
55 métipirone qui supprime la sécrétion du cortex surrénalien, n affecte pas la sécrétion de pepsine chez le chien alors que celle d acide est réduite quelque peu après un traitement prolongé (Mc Intosh et al., 1960). Cependant, l effet de métipirone dans une telle expérience est d augmenter la sécrétion de minéralocorticoïdes et de laisser celle de glucocorticoïdes non affectée après les premiers jours et donc cela est peu significatif. L amphérone B, un inhibiteur de la fonction du cortex surrénalien, est responsable d une inhibition marquée de la production de volume de la sécrétion gastrique chez le rat ; le résultat est une diminution secondaire ou indirecte de la sécrétion de pepsinogène avec une augmentation de la concentration dans de faibles volumes. Les effets de l amphotérone B sont annulés par une administration concomitante de corticostéroïdes (Hirschowitz, 1967). Les preuves de stimulation rapide de la sécrétion gastrique par l ACTH ou n importe quel stéroïde cortico-surrénalien sont en général peu convaincantes (Bachrach, 1963) et toutes les augmentations rapportées sont trop faibles, par exemple, pour considérer un rôle direct du cortex surrénalien dans la réponse de l estomac à l insuline. Des perfusions de 8 heures d ACTH, de corticostérone ou d hydrocortisone chez un groupe de volontaires en bonne santé ne provoquent aucune stimulation de la sécrétion de pepsinogène (ou d acide) au cours de la perfusion ou dans les 5 heures suivantes, en dépit des signes d activité cortico-surrénalienne puissante (Hirschowitz, 1967). Une administration chronique ou à long terme d ACTH ou de stéroïdes cortico-surrénaliens peut entraîner une augmentation de la sécrétion gastrique basale de pepsine et d acide chez l homme à des taux mesurés lors d ulcères duodénaux mais de nouveau cela n a pas été confirmé par d autres même chez des sujets normaux chez lesquels les ulcères peptiques se développent après administration d ACTH. Chez le rat recevant de l ACTH pendant 1 à 3 semaines, aucune augmentation significative de la sécrétion de pepsinogène ou d acide n a été détectée. La plupart des controverses concernant le rôle stimulant du cortex surrénalien tombent si l effet direct des hormones cortico-surrénaliennes sur l augmentation de l excrétion du pepsinogène dans l urine est reconnu comme un phénomène qui ne signifie pas une stimulation de la sécrétion gastrique (Hirschowitz, 1967) Autres substances endocrines Avec des exceptions possibles mais douteuses, ni l épinéphrine ni la norépnéphrine n ont un effet stimulant direct sur la sécrétion de pepsinogène. La thyroïde (Abrams et Baker, 1954), les parathyroïdes (Blanshard et al., 1959) ou les gonades (Crean, 1963) n ont apparemment aucun effet direct sur la sécrétion gastrique de pepsinogène Etudes cliniques de la sécrétion de pepsinogène gastrique Ces études nécessitent l aspiration du contenu gastrique pendant au moins une heure au cours du jeun avant l application du stimulus et pendant 2 à 3 heures après. Le pepsinogène doit être mesuré par une méthode protéolytique standardisée valable et rapporté en unités acceptables avec, si possible, l activité d un pepsinogène sous forme cristalline disponible commercialement pour le test utilisé. Les mesures de pepsinogène sanguin ou urinaire ne sont acceptables pour l analyse du suc gastrique Stimulants L histamine est le stimulant de la sécrétion d acide et pepsine le plus utilisé en général chez l homme. La perfusion d histamine au taux de 0,01 mg/kg/h pendant 2-3 heures est un meilleur test qu une simple injection sous-cutanée (Duke, 1965). L utilisation de l hypoglycémie induite par l insuline (0,1-0,2 unité/kg) en tant que test de la sécrétion
56 gastrique de pepsinogène souffre d inconvénients comme la réponse aléatoire de la glycémie notamment chez les diabétiques et de la courte durée de stimulation (Duke, 1965). Le 2DG est considéré commun stimulant vagal avec une durée d action pongée chez l homme ainsi qu une stimulation maximale des sécrétions d acide et de pepsinogène (Hirschowitz, 1967), cependant son innocuité complète n a pas encore été prouvée par une utilisation à grande échelle Sexe et âge La concentration et la production de pepsine sont plus faibles chez les femelles (Rider et al., 1961) mais les jeunes des deux sexes ces paramètres rapportés au poids sont les mêmes que chez les adultes normaux (Hirschowitz, 1967) Variations normales Au stade basal, il y a une production de pepsine relativement stable pendant le jour et jour après jour. Lors d une stimulation maintenue, la variation d une période de 15 minutes à l autre est de moins de 20% et d une semaine à l autre, la réponse d un individu à un stimulus donné reste à peu près constant (+/- 20%) (Hirschowitz, 1967) Ulcère duodénal Sur la base d une large variété de tests, les patients atteints d ulcères duodénaux sécrètent environ 1,5 fois plus de pepsinogène (et d acide) que n en produisent le lot de contrôle (Rider et al., 1961). Cependant, la composition du suc gastrique chez les malades, surtout lors d une stimulation maximale, diffère peu de la composition normale. La principale différence concerne l augmentation du volume produit résultant d une élévation de la masse de la muqueuse gastrique. En général, les productions d acide et de pepsine augmentent de pair (Hirschowitz, 1967) et même dans les cas les plus extrêmes de maladie ulcérative du duodénum, le syndrome de Zollinger-Ellison, dans lequel la gastrine produite par des tumeurs pancréatiques oblige la muqueuse gastrique à sécréter continuellement à des taux maximaux ou proches de ce niveau, le pepsinogène gastrique est augmenté de façon proportionnelle à l acide. Il n est pas encore tout à fait établi que l état clinique observé lors d hypergastricisme soit le fait d une seule hormone mais il est presque certain que la gastrine seule produise le tableau de sécrétion observé dans ce syndrome. De plus, l hyperplasie de la muqueuse gastrique chez de nombreux patients avec un ulcère duodénal et l hyperplasie très marquée du syndrome précédemment cité, persistant même après vagotomie, suggère que la gastrine est une hormone gastrotropique ainsi qu un sécrétagogue gastrique Ulcère gastrique Lorsque ce type d ulcère est une complication d un ulcère duodénal, les types de sécrétion sont les mêmes que ceux des patients avec un ulcère duodénal alors que s il s agit d un ulcère gastrique primaire, les paramètre de sécrétion ressemblent à ceux des groupes de contrôle. Par contre dans le cas d ulcères de l antre pylorique, le profil de sécrétion est le même que lors d ulcère duodénal (Borg et Borgstrom, 1963) Tumeur gastrique Dans ce cas, la concentration moyenne de pepsine est la moitié de celle des sujets sains ou avec des ulcères gastriques bien que la production ne représente plus qu un quart de la normale ou moins (Rider et al., 1961). Le chevauchement des valeurs des paramètres concernant la pepsine entre les cas d ulcères et de tumeur est tel qu ils ne permettent pas de faire un diagnostic différentiel. En effet, des patients atteints d un adénocarcinome gastrique
57 ont des sécrétions d acide et de pepsine proches de celles observées dans les cas d ulcère duodénal (Hirschowitz, 1967) Gastrite Ce terme regroupe un ensemble d affections de la muqueuse gastrique dans lequel il y a un degré d inflammation plus ou moins élevé avec une atrophie de minime à totale. Sur la base d un examen gastroscopique, d une biopsie ou d alcoolisme récent, une étude a montré que la sécrétion de pepsinogène est moindre que dans le groupe contrôle, à la fois à jeun et après administration d histamine (Hirschowitz, 1967) Anémie pernicieuse La muqueuse fondique et du corps de l estomac dans cette affection sous sa forme habituelle chez l adulte est complètement atrophiée avec absence totale de cellule peptique ou pariétale ; les «sécrétions» obtenues contiennent 0 à 2% des valeurs de contrôle pour la pepsine et moins d 1% de facteur intrinsèque, aucune acidité n est détectée. La muqueuse de l antre pylorique n est pas toujours, ou encore habituellement, atrophique et dans de tels cas l absence de pepsinogène et de facteur intrinsèque va à l encontre du fait que la muqueuse antrale élabore davantage que n importe laquelle. Des extraits de foie ou de la vitamine B12 n apporte de régénération de la fonction. Lorsque la maladie touche les jeunes, la sécrétion d acide et de pepsine est possible. Les individus avec un stade intermédiaire d atrophie peuvent sécréter progressivement moins d H +, de pepsine et facteur intrinsèque. Ainsi dans un estomac dépourvu d acidité, la présence de quantités significatives de pepsine permet d exclure l anémie pernicieuse classique de l adulte (Poliner et Spiro, 1958) Autres anémies Lors d anémie par déficit en fer, la sécrétion d acide comme celle de pepsine est diminuée alors que la sécrétion de pepsine dans d autres types d anémies est généralement normale (Poliner et Spiro, 1958) Le pepsinogène dans le sang et l urine (Hirschowitz, 1967) A l instar d autres enzymes habituellement intracellulaires ou sécrétées dans la lumière du tractus digestif, le pepsinogène est retrouvé dans le sang en quantités faibles mais mesurables, qui sont relativement constantes chez un individu. Hirschowitz a calculé que la quantité de pepsinogène entrant dans le sang représente environ 1% de celle qui passe dans la lumière gastrique en 24 heures. L enzyme est présente sous forme de pepsinogène dans le sang à des concentrations d environ 10 à 20 µg / 100 ml de plasma chez des personnes en bonne santé, disparaît après une gastrectomie complète et augmente fortement lors d insuffisance rénale puisqu alors son élimination du sang n est plus assurée. Sa présence à des concentrations élevées dans le sang veineux gastrique suggère qu il atteint directement la circulation sanguine. Comme pour d autres enzymes, les mécanismes de fuite cellulaires vers le sang sont inconnus mais l augmentation rapide du pepsinogène sanguin après atteinte de la muqueuse gastrique par les rayons X, une chirurgie gastrique, des doses destructrices d histamine, d alcool ou de cinchophène donne à penser qu il dérive normalement de cellules détruites. L alimentation et les stimulants gastriques habituels qui augmentent la sécrétion de pepsinogène n ont pas d effet sur le pepsinogène sanguin. En temps normal, le pepsinogène quitte les cellules peptiques vers le fluide interstitiel et dans des conditions dégénératives, il s échappe de cellules détruites
58 La concentration de pepsinogène dans le plasma est en général reliée de façon grossière à la masse de cellules peptiques et ainsi augmente de 1,5 à 2 fois au-dessus des valeurs de contrôle chez les individus atteints d ulcère duodénal, sans différence appréciable due au sexe, à l âge ou à la durée de la maladie, avec traitement ou avec la présence ou l absence de cratères ulcéreux. De la même façon que pour la sécrétion gastrique, le pepsinogène plasmatique est normal dans les ulcères gastriques primaires mais élevé dans les cas d ulcères duodénaux. Quant aux tumeurs gastriques, la valeur du pepsinogène plasmatique est en-dessous de la normale et lors d anémie pernicieuse, très bas ou absent. L intérêt de cette valeur en tant qu outil d évaluation de la sécrétion gastrique est très limité. Le pepsinogène présent dans l urine ou uropepsine dérive du pepsinogène plasmatique et en fin de compte des cellules peptiques de l estomac. Il est facilement excrété par un rein sain à un taux qui est relativement constant pour un individu donné, pendant la journée et jour après jour (+/- 10%). Il est probablement filtré et réabsorbé dans le tubule, son excrétion étant augmentée par une élévation du taux de filtration glomérulaire et les atteintes tubulaires. De fortes augmentations de l excrétion du pepsinogène sont dues à l ACTH ou aux glucocorticoïdes, reliées en partie à l accroissement du TFG mais ils sont aussi responsables de l élévation de l enzyme dans la circulation veineuse gastrique. Cependant, le taux dans le sang veineux périphérique n est pas augmenté. La quantité excrétée par des individus jeunes par unité de surface corporelle est la même que chez des adultes normaux (comme le sont les sécrétions gastriques d acide et de pepsine par rapport au poids corporel). Il n y a pas de bonne corrélation entre la sécrétion de pepsine gastrique, excepté dans une grande population dans laquelle tous les extrêmes sont présents, c est-à-dire de l absence de sécrétion à une sécrétion et une excrétion élevées (cas des ulcères duodénaux). En particulier il n y a pas d augmentation du pepsinogène urinaire lors de stimulation de la sécrétion du pepsinogène gastrique et l inverse est vrai avec l ACTH. Le manque de corrélation empêche toute quantification directe de la sécrétion gastrique à partir des mesures de pepsinogène plasmatique ou urinaire Activation du pepsinogène en pepsine (Cheret et Bonfils, 1970) La pepsine est présente dans la muqueuse gastrique sous forme d un précurseur inactif : le pepsinogène qui s en distingue par un poids moléculaire plus élevé et une plus grande stabilité en milieu neutre ou légèrement alcalin. Cette conversion se produit spontanément en solution de ph inférieur à 6, et s observe avec facilité à ph égal ou inférieur à 5. Elle comporte une ou plusieurs réactions et résulte en la perte de près de 20% de la molécule et en la formation de la pepsine, d un polypeptide inhibiteur à prédominance basique et de peptides variés. La pepsine catalyse la conversion ; il faut donc qu au moins une liaison peptidique soit rompue pour que se produise cette activation mais des études plus précises ont montré qu en fait 7 à 8 liaisons peptidiques sont hydrolysées (Figure 10)
59 Figure 10 : Relation entre les structures du pepsinogène, de la pepsine et des autres molécules formées au cours de la conversion du pepsinogène en pepsine (d après Herriott, 1962) Le schéma est finalement le suivant : Pepsine Pepsinogène Complexe pepsine + inhibiteur + peptide X ph<6 ph>5,4 ph<5,5 Pepsine + inhibiteur Pepsine (ph<1,5) Pepsine (ph 3,5-4,0) Peptides Z Peptides Y Donc la pepsine, en solution acide, catalyse la conversion du pepsinogène en un composé «pepsine + inhibiteur» accompagné de la formation de peptides X. En solution de ph inférieur à 5,4, ce composé se dissocie en pepsine libre et inhibiteur, ce dernier étant dégradé catalytiquement par la pepsine pendant un temps prolongé, avec un vitesse maximum pour un ph de 3,5-4 et donne les peptides Y. La combinaison entre la pepsine et l inhibiteur est une réaction réversible, le résultat final de la réaction dépendant du ph. A ph 2, l activation est très rapide, de l ordre d une minute ou deux. A ph plus élevé, la réaction est plus lente et si à ph 3 elle est complète au bout de 10 minutes, à ph voisin de 4,5, elle est faible et semble alors proportionnelle au temps. Comparant la cinétique de la réaction à ph 2 et ph 4, Ryle a obtenu des résultats différents : selon cet auteur, il y aurait un processus autocatalytique intriqué à un deuxième processus hypothétique qui suivrait des cinétiques différentes. En plus du ph, divers facteurs peuvent intervenir sur la vitesse d activation, en particulier la concentration en zymogène et en sels
60 Dans la pratique, l activation s effectue à ph 2 maintenu pendant 5 à 30 minutes, soit à 37 C, soit à la température du laboratoire ou même à température plus basse encore. L arrêt de la réaction d activation est obtenu à un ph voisin de 5 à l aide d un tampon approprié. La vitesse de l activation est évaluée enzymatiquement après un temps déterminé, soit par dosage de l activité protéolytique potentielle (ph 2) du pepsinogène restant après dénaturation alcaline (ph 8) de la pepsine formée ; soit par mesure du pouvoir coagulant sur le lait (ou gélifiant sur la gélatine) de la pepsine libérée à ph 5-6 alors que le pepsinogène inactif est pratiquement stable à ce ph. Une représentation imagée de la conversion du pepsinogène en pepsine peut être donnée par caractérisation électrophorétique. L activation séparée des fractions protéasiques résultant de l électrophorèse d extraits de muqueuse gastrique montre qu à chacune de ces fractions correspond une ou plusieurs bandes spécifiques dont la mobilité est constamment supérieure à celle du zymogène correspondant. Lorsque l activation est incomplète, des bandes électrophorétiques transitoires ont pu être observées. De même un zymogène isolé par chromatographie peut donner après activation un ou deux pics actifs. Il est généralement admis qu à chaque enzyme correspond un précurseur spécifique : cependant, les résultats obtenus par Tang sur les variations du rapport des quantités respectives de pepsine et gastricsine, formées selon le ph auquel se produit la conversion, l ont amené à penser que le zymogène responsable est un précurseur commun. Le pepsinogène d une espèce peut être activé en sa pepsine correspondante par la pepsine d une autre espèce. Les études effectuées sur les groupements terminaux et les liaisons disulfures indiquent que le pepsinogène est une chaîne peptidique unique dont la pepsine occupe l extrémité du C- terminal. Par contre, les séquences N-terminales de la pepsine et de l inhibiteur différent l une de l autre et également de celle du pepsinogène. Ce sont donc sans doute des peptides inertes qui constituent cette partie N-terminale de la chaîne. L inhibiteur a été isolé par activation à ph 1-2 pendant un temps très court suivi d une rapide inactivation alcaline de la pepsine et d une précipitation par l acide trichloracétique : dans ces conditions l inhibiteur reste dissout. Ce dernier est détruit par la pepsine entre ph 3 et 5 avec une vitesse maximum au voisinage de ph Dosages du pepsinogène Méthodes protéolytiques (Banga-Mboko et al., 2003 ; Kerboeuf et al., 2002) L estimation des concentrations sériques ou plasmatiques du pepsinogène est conventionnellement basée sur l utilisation des méthodes protéolytiques. Plusieurs méthodes ont été proposées mais celle qui a obtenu une grande audience est basée sur l estimation des peptides libérés pendant l incubation du sérum avec une protéine de référence (albumine, hémoglobine, ) à ph acide. La méthode protéolytique est une méthode indirecte de la mesure de la concentration du pepsinogène. Le pepsinogène contenu dans l échantillon dont on désire connaître la concentration, est transformé en pepsine par un acide fort (acide chlorhydrique en général) et par la chaleur. La pepsine va provoquer la lyse d un substrat protéique riche en acides aminés aromatiques qui sont la cible privilégiée de cette enzyme. L albumine sérique bovine, l hémoglobine de cheval ou de bovin (cette dernière aurait une plus grande sensibilité que d autres substrats protéiques) sont couramment utilisées. Le substrat doit être sensible à l activité de la pepsine, facile à préparer, de conservation asse bonne et bon marché. Il existe des substrats synthétiques qui sont plutôt destinés à l analyse de l activité d enzymes
61 purifiées, ils ne sont pas adaptés au dosage à partir du sérum puisque ce dernier contient, chez les Mammifères, plusieurs isoenzymes ayant des spécificités biochimiques propres. Les protéines non attaquées par la pepsine sont précipitées par l acide trichloracétique. Ce précipité est éliminé par filtration ou centrifugation. Le liquide filtré ou le surnageant, contenant les acides aminés aromatiques, est recueilli et coloré par un réactif spécifique de la tyrosine comme le réactif de Folin-Ciocalteus. La densité optique de ce mélange est déterminée au spectrophotomètre sur une longueur d onde correspondant à l absorption maximale du mélange, 680 nanomètres pour l exemple précédent. Les données obtenues sont comparées à celles d une gamme étalon de tyrosine qui sert de référence d acide aminé aromatique. Les résultats sont exprimés en Unités (U) ou milliunités (mu) tyrosine par litre de sérum / 24 heures, en mg de tyrosine/mole ou encore en µmole/litre de sérum. La chaleur et l acidité du milieu au début du protocole conduisent aussi à une coupure non spécifique des liaisons impliquant des acides aminés aromatiques. Ceux-ci peuvent soit être dosés séparément puis retranchés des valeurs trouvées pour les tubes contenant le pepsinogène, soit être pris en compte lors de l étalonnage du spectrophotomètre à partir du contenu d un tube rempli uniquement par le substrat et qui a subi le même traitement que les tubes avec les échantillons. Afin d augmenter la précision du dosage, toutes les dilutions de l échantillon ainsi que les standards sont faits en double et une moyenne des résultats est réalisée par la suite. Le principal reproche de cette méthode est qu elle mesurait non seulement l activité protéolytique des pepsines mais aussi celles de toutes les autres protéases gastriques aspartiques présentes dans le sérum, d où une surestimation des résultats. Ainsi dans certaines études, la concentration de pepsinogène chez les patients souffrant d une gastrectomie ou d une anémie pernicieuse avait des valeurs plus élevées que chez des sujets normaux. Les confusions et les contradictions entre laboratoires ont poussé la plupart des laboratoires en médecine humaine à abandonner cette méthode en faveur d autres techniques plus spécifiques (immunologiques). Ces dernières sont en cours de développement en médecine vétérinaire Méthodes immunologiques Les dosages immunologiques sont basés sur la capacité d un antisérum à se lier spécifiquement à l antigène et à un traceur (ou un marqueur approprié) permettant la mise en évidence de cette réaction. Le traceur est souvent un isotope radioactif (le plus fréquemment l iode 125) et le résultat est donné par la mesure de la radioactivité : c est le dosage radioimmunologique, radioimmunoassay en anglais (RIA). Le traceur peut être aussi une enzyme qui, mise en présence de son substrat, généralement un chromogène, libère une substance colorée, facile à mettre en évidence par mesure de la densité optique ou enzyme linked immuno-sorbent assay (ELISA) Dosages radioimmunologiques (Banga- Mboko et al., 2003) C est une technique qui se doit d être sensible, spécifique et précise pour doser des quantités infimes de substances biologiques comme le pepsinogène dans les liquides biologiques. Elle a été mise au point dans les années cinquante par les américains Yalow et Bergson. Son principe est basé sur la compétition entre l antigène marqué par un isotope (Ag*) et l antigène non marqué (Ag) pour les anticorps spécifiques (Ac). Ag* / Ag + Ac Ac-Ag* + Ac-Ag Les concentrations en Ag* et en Ac étant constantes, toute augmentation de la concentration en Ag entraîne une augmentation de la concentration en complexe Ag-Ac au détriment de la formation du complexe Ag*-Ac et par conséquent une augmentation de la quantité d Ag*
62 libre dans le milieu d incubation. Au terme de la réaction, les Ag* libres et liés sont séparés. Grâce au signal émis par le marqueur, on peut mesurer la concentration en complexe Ag*-Ac pour chaque concentration en Ag. Dans la pratique, pour réaliser un dosage, on établit une courbe standard ou d étalonnage avec des concentrations connues en pepsinogène grâce à laquelle on détermine la concentration en antigène de solutions inconnues (sérum ou plasma). La figure Fig. RIA montre la décroissance du pourcentage du pepsinogène marqué qui se fixe à l anticorps en fonction de quantités progressivement croissantes du pepsinogène non marqué. Le pepsinogène marqué déterminé dans des conditions identiques sur un échantillon inconnu (sérum ou plasma) permettra d obtenir la concentration en pepsinogène dans l échantillon. Les avantages de la méthode RIA sont les suivants: - une excellente spécificité (capacité de mesurer un antigène particulier aux anticorps) ; la spécificité de la réaction immunologique est en rapport avec la pureté du pepsinogène marqué et la spécificité de l antisérum, - une excellente sensibilité ou «limite de détection» (possibilité de détecter les plus petites quantités de pepsinogène capable d entraîner une décroissance dans la fixation du pepsinogène marqué) qui varie avec le titre de l antisérum utilisé. Par sa sensibilité, le RIA à déterminer des concentrations en nanogramme/ml ou picogramme/ voire femtogramme/ml. - une bonne précision déterminée par l erreur point de la courbe et par l erreur dosée sur un même échantillon analysé à plusieurs reprises pour une même manipulation, - des possibilités d application en grandes séries, les échantillons n ont pas besoin de subir un protocole particulier. Le dosage radioimmunologique nécessite le matériel suivant : - une préparation pure de pepsinogène débarrassée de toute contamination ce qui est primordial pour assurer le succès du dosage ; il existe des préparations commerciales de pepsinogène A disponibles sur le marché et qui donnent des résultats satisfaisants, - la même préparation marquée par un isotope radioactif selon la technique de Greenwood et collaborateurs (1963). Le marqueur radioactif le plus utilisé actuellement en immuno-analyse est l iode 125 dont les caractéristiques physiques de période (60 jours) et de rayonnement (gamma de 35 kev) en l isotope de choix : utilisation des trousses pendant 4 à 8 semaines seln la vitesse de la radiolyse du traceur (c est-à-dire la rupture de la liaison entre l anticorps ou l antigène et l iode 125), rayonnement gamma donc détectable dans des compteurs à scintillation mais d énergie trop faible pour entraîner une irradiation externe du personnel. L obtention d une molécule pepsinogène marquée pure, non dégradée et de haute activité spécifique, est indispensable pour la réalisation d une RIA sensible, reproductible et spécifique. - un antisérum spécifique : les anticorps font partie du système immunitaire de l organisme et ils servent à éliminer les substance étrangères à celui-ci ; grâce à leurs remarquables propriétés d affinité et de spécificité ils permettent aux dosages immunologiques de mesurer de très faibles concentration d analytes. Le dosage par RIA fait intervenir deux anticorps. Les premiers sont obtenus après immunisation du pepsinogène pur chez les lapins par l intermédiaire de plusieurs injections sous-cutanées ou intramusculaires du pepsinogène de l espèce concernée à intervalles réguliers. Le second anticorps est un anti-gammaglobuline produit chez un animal d espèce différente de celle utilisée pour fabriquer le premier. Il permet la séparation de l Ag* lié et Ag* libre, par précipitation du complexe Ac-Ag, en se liant au fragment Fc du premier anticorps (ainsi est-il spécifique aux IgG). En médecine vétérinaire, la mise au point de cette technique en est encore à ses prémices notamment chez le porc ; chez les ruminants par contre, l instabilité de la molécule du pepsinogène (entre autres facteurs) constituerait un obstacle majeur au développement d une RIA chez les bovins. En médecine humaine, les nouvelles techniques de chromatographie
63 ayant conduit à la séparation des pepsinogènes A et C, le RIA a supplanté les autres techniques dans le diagnostic des maladies gastro-intestinales et cancéreuses grâce à sa spécificité qui permet de distinguer les deux groupes de pepsinogène et à sa sensibilité Dosage par la méthode ELISA Il s agit d un test immunologique destiné à détecter et/ou doser une protéine dans un liquide biologique ou une préparation de laboratoire. Dans la technique dite en «sandwich», les puits d une microplaque ou des tubes en polypropylène sont tapissés avec un anticorps de capture capable de lier spécifiquement l antigène recherché, en l occurrence ici le pepsinogène. Lors de cette opération appelée coating, l anticorps de capture se fixe au plastique du support par interaction électrostatique. L anticorps de capture assure la spécificité du test. La solution à tester est ensuite déposée dans les puits ou les tubes et l antigène va se lier spécifiquement à l anticorps de capture. Un deuxième anticorps, l anticorps traceur, capable de se lier à l antigène capturé est alors ajouté au mélange précédent et les anticorps traceurs non fixés sont éliminés par rinçage. L anticorps traceur est couplé à une enzyme catalysant la formation d un produit coloré. La réaction peut être quantifiée par colorimétrie à partir d une courbe d étalonnage réalisée avec des concentrations connues d antigène puisque le nombre de molécules d anticorps traceur fixées dépend du nombre de molécules d antigène immobilisées par l anticorps de capture. Cette technique offre l avantage de ne pas utiliser de produits radioactifs, d être très spécifique, sensible et rapide surtout par rapport aux méthodes protéolytiques qui nécessitent plusieurs heures d incubation en général. En médecine humaine, des méthodes ELISA de pepsinogène ont été développées et présentent une excellente corrélation avec les résultats de RIA et en médecine vétérinaire, de tels tests commencent à voir le jour, notamment chez les ruminants avec de très bons résultats en particulier chez le mouton (Turner et Shanks, 1982) Diffusion sur gel d agarose (Scott et al., 1995) Cette méthode utilise les propriétés de diffusion du pepsinogène à travers un gel acide et opaque composé de 1% d agarose avec 0,25% de caséine de lait de bovin dans un tampon tris (ph 8,2). Le gel en question est préparé et après solidification il est immergé dans une solution tampon de glycine contenant du chlorure de baryum jusqu à ce que le gel devienne uniformément opaque. Son épaisseur est de 5 mm et des orifices de 8,5 mm de diamètre sont réalisés dans le gel et 0,5 ml de plasma ou de pepsinogène standard y sont déposés. La diffusion radiale autour du puits s effectue en 24h à 37 C. La taille des zones éclaircies est évaluée et celle des échantillons de concentration inconnue est comparée aux solutions pepsinogène porcin mises en place à différentes concentrations (0,15-0,3-0,6-1,2 ng/ml) ce qui permet de déterminer les concentrations recherchées
64 1-3 Description des méthodes utilisées dans l étude Précipitation des protéines (Tessier et al., 1992) Généralités Son but est de séparer différents types de protéines en fonction de leur degré de solubilité, le précipité protéique obtenu pouvant ensuite être séparé de la fraction soluble par divers moyens comme la filtration ou la centrifugation par exemple. Cette deuxième solution a eu notre préférence pour cette purification en raison du meilleur rendement en protéine qu elle apporte et de sa rapidité de réalisation. Le précipité protéique résulte de la formation d un réseau ou agrégat entre différentes protéines dont les propriétés de solubilité ont été modifiées. En effet, la solubilité des protéines est fonction de la nature des interactions établies entre la surface de la molécule montrant des groupements polaires et hydrophiles et le solvant environnant. Les résidus non polaires de la protéine, en créant des zones hydrophobes, interagissent également avec le solvant en ordonnant les molécules d eau en structures appelées clathrates. La précipitation résulte d une modification de la couche d hydratation par changement des caractéristiques du solvant ou de la surface protéique. Trois types de précipitations peuvent être définis selon les possibilités de remise en solution du précipité : résolubilisation totale, partielle ou nulle. Dans ce premier cas de figure, la précipitation est dite réversible, lorsque l agent précipitant ne modifie pas la structure propre de la protéine et conserve sa fonction biologique intacte. L élimination de cet agent permet la reformation de la couche d hydratation et donc la solubilisation du précipité. C est ce type de technique que nous avons employée puisqu il nous importait de conserver le pepsinogène intact et que les autres types ne permettent pas à la protéine de retrouver sa structure initiale voire dénaturent cette dernière. L intérêt porté aux techniques de précipitation est justifié par leur facilité d utilisation par rapport à d autres méthodes de purification. Elles ont comme principal avantage de concentrer l extrait protéique, tout en éliminant de façon plus ou moins sélective certains contaminants et ce en atteignant des coefficients de purification analogues aux autres méthodes Précipitation aux sels La précipitation des protéines par adjonction de sels, encore appelée précipitation par saltingout, est la méthode de fractionnement protéique la plus largement utilisée. Une force ionique élevée, obtenue par l addition de sels, peut avoir deux effets sur la solubilité : neutraliser certaines charges ioniques requises en surface pour le maintien de la solubilité et compétitionner avec les protéines pour les molécules d eau disponibles en solution. Quand la concentration en sel est assez élevée pour priver une protéine des molécules d eau qui l hydratent, celle-ci sort de solution et précipite. Comme chaque protéine est plus ou moins stable en solution selon sa composition et donc son caractère plus ou moins hydrophobe, on peut en séparer plusieurs en fonction de leur tendance à précipiter plus ou moins vite quand on change la force ionique de la solution qui les contient. Le phénomène de salting-out a donc été assimilé à une modification de tension de surface. D un point de vue théorique, la solubilité de protéines pures (S) en milieu aqueux peut être exprimée en fonction de la concentration en sels (m) selon l équation : log S = β - K s m où K s est une constante dépendant du caractère hydrophobe de la surface protéique et du moment dipolaire de la protéine, ainsi que de la nature du sel employé. β est la constante de Debye, qui varie en fonction de la
65 charge nette de la protéine, du sel employé, de la température et du ph. Ces quatre paramètres doivent être pris en compte lors de la précipitation. Pour effectuer une précipitation par cette méthode, le choix du sel doit répondre à plusieurs exigences : la teneur en impuretés doit être réduite et la dissolution du sel ne doit pas être trop exothermique afin d éviter toute dénaturation des protéines. Enfin, la différence de densité entre la solution de sel et le précipité doit être maximale pour faciliter par la suite la séparation par centrifugation. Le rendement de la précipitation est dépendant de la nature des sels utilisés. Les plus efficaces sont des anions multivalents tels qu les sulfates ou les phosphates. Une hiérarchie selon la série d Hofmeister peut ainsi être établie avec le pouvoir de salting-out croissant : _ Anions: PO 4 3- > SO 4 2- > CH 3 COO - > Cl - > Br - > NO 3 - > ClO 4- > I - > SCN -, _ Cations: NH 4 + > Rb + > K + > Na + > Cs + > Li + > Mg 2+. En pratique, les sels de potassium ne sont pas utilisés en raison de leur faible degré de solubilité. Le sulfate de sodium, peu soluble aux basses températures, ne peut être utilisé qu à des températures voisines de 30 C. Les citrates ne peuvent être employés à un ph inférieur à 7 en raison de leur fort pouvoir tampon. De même, le pouvoir tampon des ions ammonium empêche l utilisation de ces sels à un ph supérieur à 8. Cependant, les précipitations par salting-out étant le plus souvent réalisées à un ph inférieur à 8, le sulfate d ammonium reste le sel le plus communément pour la précipitation des protéines. Le degré de pureté de ce sel, fourni commercialement, est généralement satisfaisant, par ailleurs sa solubilisation n entraîne pas de réaction exothermique, il ne dénature pas les protéines et ne coûte pas cher. La quantité de sulfate d ammonium (en gramme) à ajouter à un litre de solution protéique pour atteindre le degré de saturation souhaité (S2), en fonction de la concentration initiale (S1) en sulfate d ammonium, peut être lue directement sur une table ou calculée à l aide de la formule suivante, qui tient compte de la solubilité du sulfate d ammonium à 20 C (533g/l) : Q = [533*(S2-S1)]/[100-(0,3*S2)], Q étant la quantité de sulfate d ammonium (en g) à additionner pour passer d une solution de concentration initiale S1 (en % m/v) à la concentration S2 (en % m/v). Pour toute précipitation, le ph est un paramètre majeur. Lorsqu on travaille à des valeurs de ph proches du phi de la protéine à purifier, la charge nette de celle-ci s annule et les forces de répulsion électrostatiques deviennent négligeables ce qui favorise la précipitation. Il est donc conseillé, pour optimiser les procédés de précipitation, d ajuster le ph de la solution à la valeur du phi de la protéine à précipiter. Il faut noter que pour la précipitation au sulfate d ammonium, le ph doit être contrôlé pour compenser l acidification due à l adjonction du sel, ce qui s effectue au moyen de soude (NaOH) dont la quantité est ajustée grâce à un phmètre trempant dans la solution qui a reçu le sulfate d ammonium. Les interactions hydrophobes étant favorisées par une augmentation de la température, une précipitation à température ambiante peut être préférée à une précipitation à 4 C. Cependant, il faut tenir compte d une dégradation protéolytique potentielle et/ou d une dénaturation thermique des protéines. Enfin, on considère que 30 minutes d agitation lente, une fois le degré de saturation atteint, suffisent pour compenser pour précipiter les protéines. Le choix de la concentration en sulfate d ammonium doit répondre à un compromis entre le rendement de purification et le degré de pureté de la protéine désirée. La méthode de fractionnement classique, encore appelée précipitation fractionnée, consiste à effectuer des précipitations successives par augmentation de la concentration en sel afin de localiser la fraction contenant la protéine d intérêt. Si la concentration en protéine est inférieure à 1mg/ml, la sensibilité aux sels est insuffisante et une étape de concentration par diafiltration ou ultrafiltration s avère nécessaire avant la précipitation. Dans la plupart des cas, le précipité est récupéré par centrifugation. Le culot est ensuite dissous dans un volume de tampon équivalent à au moins deux fois le volume de précipité. Les protéines ou les agrégats qui ne
66 resolubilisent pas sont éliminés par centrifugation. Quant la différence de densité entre le précipité formé et la solution de sel est trop faible, la filtration se révèle nécessaire. A titre indicatif, une solution saturée en sulfate d ammonium possède une densité de 1,23g/ml à 20 C alors que la densité moyenne des protéines est de 1,29g/ml. Si l on souhaite conserver les protéines agrégées, le sulfate d ammonium présente l avantage de les stabiliser, à l abri des contaminations bactériennes et d actions protéolytiques. Cependant, la présence de ce sel peut être préjudiciable pour la suite des protocoles expérimentaux, justifiant parfois des étapes de dessalage, en particulier avant toute étape de chromatographie échangeuse d ions. Le dessalage est réalisé généralement par dialyse, ultrafiltration ou simple dilution Dialyse (Figure 11) Dans une dialyse, les protéines dans une concentration de sels donnée sont séparées d une solution à la concentration en sels différente par une membrane poreuse. Les sels ont tendance à équilibrer leur concentration de part et d autre de la membrane. La vitesse de dialyse dépend beaucoup de la quantité de matériel à dialyser et de la viscosité des solutions. Afin d accélérer la procédure, on peut fractionner le volume de solution protéique et placer les différents éléments obtenus dans un grand volume de tampon de dialyse ou mieux changer fréquemment ce tampon face auquel on équilibre la solution protéique. Figure 11 : Principe de la dialyse (d après Stryer, 1992) Séparation des protéines par adsorption (Stryer, 1992) Chromatographie échangeuse d ions La chromatographie est une technique d analyse destinée à séparer les constituants d un mélange. Les molécules à séparer sont entraînées par un fluide (un liquide dans notre cas) que l on appelle la phase mobile, elles interagissent ou au contraire n interagissent pas avec un support (ou matrice) fixe que l on appelle la phase stationnaire ; il y a donc distribution ou partition des composants entre ces deux phases. Le flux du vecteur étant continu, c est la rétention plus ou moins longue des différentes molécules sur le support fixe, qui va les séparer les unes des autres. Une résine (polymère d oses) échangeuse d ions est une matrice insoluble comportant des groupements chargés liés de façon covalente. Des échangeurs d ions chargés positivement ou négativement sont disponibles commercialement. Un échangeur chargé positivement, comme
67 celui que nous utilisons, est capable d établir des interactions électrostatiques avec des anions : s il fixe un type d anion et qu un autre type d anion se présente, ce dernier peut soit prendre la place du premier, soit le déplacer avec lui, c est pour quoi cette résine est nommée résine échangeuse d anions (Figure 12). Figure 12: Principe de la résine échangeuse d anions (Stryer, 1992) Dans une telle résine, la nature de la fonction ionisable peut être une base forte comme un ammonium quaternaire (ex : triméthylammonium ---N(CH 3 ) 3 + ) ou une base faible telle qu une forme protonée d une amine primaire, secondaire ou tertiaire (ex : diéthylaminoéthylammonium C 2 H 4 N H + C 2 H 5 C 2 H 5 ) Inversement avec une échangeur chargé négativement, on trouve soit un acide fort à l instar du sulfonate (---SO 3 - ), soit un acide faible tel le carboxyméthyl (--O--CH 2 --CO 2 - ). Dans un premier temps, la résine est équilibrée dans un tampon dont le ph est tel que le groupement porté par l échangeur d ions soit ionisé : dans notre cas, en l occurrence celui d une base (échangeuse d anions), le ph doit être inférieur au pk a du groupe ionisable ce qui signifie par exemple que le ph doit se situer en dessous de 9,5 pour le DEAE-ammonium. C est l inverse dans le cas des acides où le ph doit dépasser la valeur du pk a de la fonction ionisable c est-à-dire que le ph doit être supérieur à 4 pour le carboxyméthyl. Les protéines à séparer sont dans le même tampon (donc au même ph) et en fonction de leur point isoélectrique (pi), elles portent une charge positive, négative ou nulle. Le fractionnement des protéines par chromatographie échangeuse d ions dépend des différences de charges présentées par ces molécules entre elles. La charge dépend en effet du nombre et du type des acides aminés périphériques ionisables. Les résidus lysine, par exemple, ont un groupement périphérique chargé positivement une fois ionisés, alors que les résidus acide glutamique sont chargés négativement quand ils sont ionisés. Chaque groupe périphérique ionisable a un pka distinct et comme, par définition, chaque protéine a une séquence propre d acides aminés, des protéines différentes ont à un ph donné des charges globales distinctes et peuvent donc être séparées sur cette base
68 Pour n importe quelle protéine, il y a une valeur de ph à laquelle l ensemble des charges négatives équivaut à celui des charges positives et donc la charge de la protéine est nulle. Il s agit du point isoélecrique (pi) ou plus précisément le point isoionique. A ce ph, la protéine ne peut se lier à aucune résine échangeuse d ions. En dessous de ce ph, la protéine a une charge globale positive et peut donc se lier à un échangeur de cations, alors qu au dessus de ce ph, elle a une charge globale négative et a la capacité de se fixer à un échangeur d anions. Les protéines sont généralement stables (et fonctionnellement actives) dans un éventail assez étroit de ph de sorte que le choix de l échangeur d ions est souvent dicté par la stabilité en fonction du ph de la protéine désirée. Si la protéine est plus stable à des valeurs de ph inférieures au pi, un échangeur de cations doit être utilisé et inversement si la protéine est plus stable à un ph supérieur au pi, le choix se tourne alors vers un échangeur d anions. Par contre, si la protéine est stable sur une large gamme de ph, l un ou l autre des changeurs peut être utilisé et celui qui fournit le meilleur fractionnement est sélectionné. A l achat, les résines échangeuses d ions possèdent des ions liés aux groupes chargés de ces dernières et nommés contre-ions. Pour la résine CM-cellulose, le contre-ion est habituellement Na + alors qu il s agit de Cl - en ce qui concerne la résine DEAE-cellulose. Après avoir choisi la résine adéquate, il faut la mélanger à une solution tampon afin d obtenir une mixture pâteuse qui est versée dans une colonne de chromatographie adaptée. Le ph de ce tampon de départ est crucial puisqu il détermine la charge des protéines à séparer. Il doit être au moins une unité ph au dessus ou en dessous du pi des protéines d intérêt de façon à s assurer d une liaison correcte. Cependant, les résines CM- et DEAE-cellulose sont des échangeuses d ions faibles et par conséquent sont ionisées sur une gamme réduite de ph. La résine DEAE-cellulose commence à perdre sa charge au dessus d un ph de 9 ; c est pour un ph inférieur à 5 que se produit le même phénomène pour la résine CM-cellulose. Le terme «faible» ne se rapporte pas à la force des liaisons des ions avec la résine, ni à la force physique de la résine elle-même. L intervalle effectif de ph de départ, que l on utilise l une ou l autres de ces deux résines, est compris entre 5 et 9. De plus, afin de parfaire le choix du ph de départ, il faut veiller à ce que sa force ionique soit raisonnablement faible puis que l affinité des protéines pour les résines échangeuses d ions diminue lorsque la force ionique augmente. Une fois introduit dans la colonne, le lit de la résine échangeuse d ions est lavé abondamment avec le tampon de départ puis la solution de protéines est appliquée. Les protéines qui ont une charge opposée à celle de la résine au ph de départ, vont se lier à elle et donc déplacer les contre-ions. Inversement les protéines qui ont une charge nulle ou identique à celle de la résine ne se lient pas et suivent le flux à travers la colonne. Parmi toutes les protéines qui se lient à la colonne, il y a la protéine d intérêt or les protéines ont des affinités différentes pour l échangeur d ions en raison des différences de leur charge nette. Ces affinités peuvent être altérées en faisant varier soit le ph soit la force ionique du tampon de la colonne. Si on considère un ensemble de protéines liées à un échangeur d anions, DEAE-cellulose, quand le ph diminue (à l inverse augmente dans le cas d un échangeur de cations), les groupements - COO - de la protéine commencent à se protoner et donc à perdre leur charge. La charge globale négative de la protéine va diminuer ainsi que son affinité pour la résine. Des protéines distinctes sont éluées de la résine à différentes valeurs de ph en même temps que leurs charges négatives diminuent jusqu à une valeur critique. Il est dès lors possible de séparer les protéines liées à la colonne en diminuant progressivement le ph en utilisant un gradient de ph tampon et en collectant les fractions contenues dans de petites cuvettes recueillant un volume pré-déterminé (de l ordre de quelques millilitres) de l éluat, en ce qui concerne l appareil que nous utilisons. L absorption de chaque fraction est mesurée au fur et à mesure, une fois le volume désiré atteint, cela permet de définir autant de pics d absorption que de composants
69 présents. Il suffit de réunir l ensemble des cuvettes correspondant à un pic pour recueillir une solution concentrée en une protéine qu il faut alors caractériser. Au lieu de modifier le ph pour éluer les protéines liées à un échangeur d ions, il est envisageable d augmenter la force ionique du tampon de la colonne. Pour une force faible, la compétition entre les ions du tampon et les protéines envers les groupements chargés de l échangeur d ions, est minimale et les protéines sont fortement attachées. Cependant, une fois les protéines fixées, l augmentation de la force ionique accroît la compétition et réduit l interaction entre l échangeur d ions et les protéines d où l élution de ces dernières. Ce type d élution peut être mis en œuvre que l on utilise un échangeur d anions ou de cations. Cela est généralement accompli en incorporant un gradient linéaire de la concentration en NaCl dans la solution tampon de la colonne tout en gardant le ph constant Chromatographie par adsorption Cette chromatographie est basée sur la répartition des solutés entre l adsorbant qui constitue la phase stationnaire et la phase liquide mobile. Cette phase stationnaire est un solide non ionique et très divisé (adsorbant pulvérulant) afin d augmenter la surface et donc de favoriser les interactions. Les différents adsorbants se distinguent par leur capacité d adsorption et leur polarité électrique. La fixation des molécules dissoutes à cette phase solide est due à l établissement de liaisons secondaires de surface de type électrostatique entre groupements polaires : liaison dipôle-ion ou dipôle-dipôle ou liaison de Van der Waals. Chacun des solutés est soumis à une force de rétention par adsorption et, lors du passage de la phase mobile, à une force d entraînement. L équilibre qui en résulte aboutit à une migration différentielle des solutés de l échantillon à analyser ce qui permet leur séparation. Il est régi par la loi de Freundlich ou de Langmuir : C 2 =KC 1 n (n 1) où C 2 est la concentration du composant C dans la phase stationnaire, C 1 la concentration du composant C dans la phase mobile et K le coefficient de partage entre les deux phases qui dépend de la température. Le solvant déplace le soluté en ayant une affinité plus forte pour l adsorbant que ce soluté : cela peut provenir de la taille du solvant qui est plus petite que celle du soluté par conséquent les molécules du solvant peuvent être plus proches de celles de l adsorbant et comme la force de Van der Waals est proportionnelle à l inverse du carré de la distance entre les groupes polaires, elle est plus forte pour les molécules de l adsorbant qui prennent la place du solvant ; par ailleurs la polarité du solvant doit être supérieure à celle du soluté pour assurer ce déplacement. Nous utilisons dans cette purification l hydroxyapatite qui est constituée de phosphate de calcium comme on en trouve dans nos dents. Cette substance retient les protéines de deux façons : le calcium interagit avec les groupements acides des protéines alors que son phosphate interagit avec les groupements aminés. L éluant employé est un gradient de phosphate destiné à compétionner ces interactions (on peut également utiliser un gradient de potassium) Dosages Dosage des protéines par la méthode de Lowry (Lowry et al., 1951) Le but est de déterminer la concentration en protéines de l échantillon en se basant sur une solution standard dont les différentes dilutions ont des concentrations en protéines connues. Les protéines sont mises en évidence par une réaction colorée et la coloration est d autant plus intense que la concentration en protéines est importante. On mesure alors la densité optique de différentes dilutions de la solution standard et de l échantillon en ayant pour référence le milieu sans protéines c est-à-dire uniquement de l eau. Par extrapolation par rapport à la droite obtenue avec les dilutions de la solution standard et après correction du facteur de
70 dilution, on obtient plusieurs estimations de la concentration de l échantillon dont la moyenne donne une valeur définitive de cette concentration. Les solutions utilisées sont : - une solution de carbonate de sodium (Na 2 CO 3 ) 2% dans la soude NaOH 0,1M qui correspond à la solution 1, - une solution de tartrate de Na 1%, appelée solution 2, qui est préparée avec 1g de cette substance par 100 ml d eau et qui est à conserver à 4 C, - une solution de sulfate de cuivre (CuSO 4 ), dénommée solution 3, constituée de 50mg de CuSO4 dans 100 ml de la solution 2 et fabriquée extemporanément, - une solution finale pour le dosage dite solution 4 composée de 50 ml de la solution 1 avec 1 ml de la solution 3, - le réactif de Folin Ciocolteur du phénol de Merck n 9001, - des solutions standards d albumine sérique de bœuf (Bovine Serum Albumin ou BSA) qui s obtiennent en mélangeant 10 mg de BSA à 10 ml d eau puis en pratiquant une dilution de cette solution de 2 en 2 en 4 points : 1mg/ml, 0,5mg/ml, 0,25mg/ml et 0,125 mg/ml. La réalisation du dosage comporte les étapes suivantes : - Pour chaque point de dilution de la solution standard de BSA, 200µl de cette solution sont mélangés à 200µl d H 2 O puis le tout est vortexé. Chaque point est doublé pour augmenter la précision des mesures. - L échantillon subit également plusieurs dilutions qui sont choisies en fonction de la concentration en protéines attendue ou en adaptant après un premier essai avec des dilutions prises au hasard. De façon identique à la solution standard, 200µl de chaque point de dilution sont mélangés à un même volume d H 2 O et vortexés. L ensemble des points est réalisé en double exemplaire. Afin de calibrer le spectrophotomètre, 2 tubes dits «blancs» contenant uniquement le milieu sans aucune protéine, sont conçus avec 400µl d H 2 O. Pour l ensemble des tubes, 2 ml de la solution 4 sont ajoutés puis ils sont homogénéisés. - Après 10 minutes d attente, 200µl de réactif de Folin sont additionnés à chaque tube qui est vortexé. - Après 30 minutes, la densité optique de chacun des tubes est lue au spectrophotomètre à une longueur d onde de 500nm soit en lumière visible, dans des cuvettes en verre Dosage du pepsinogène par la méthode Dorny (Dorny et Vercruysse, 1998) Les réactifs nécessaires à la réalisation de ce dosage sont : - un tampon glycine-nacl-hcl (0,1M) nécessitant deux solutions. La première est appelée stock A et fabriquée avec 7,507g de glycine, 5,844g de NaCl pour un volume de 1L d H 2 O qsq. La seconde, nommée stock B, requiert 26,6g de HCl pour un volume de 1L d H 2 O qsq soit 0,27M d HCl. - une solution d acide trichloro-acétique (TCA) 4% résultant de la dilution 4g de TCA dans un volume de 100 ml d H 2 O qsq. - une solution de soude NaOH (0,25M) constituée par la dilution 10g de NaOH dans un volume de 1L d H 2 O qsq. - une solution de stock tyrosine pour laquelle 1,812g de L-tyrosine sont dilués dans 1L d HCl 0,1M (soit 9,85g d HCl pour 1L d H 2 O). Certaines solutions sont à préparer juste avant leur utilisation : - les solutions standards tyrosine qui sont au nombre de trois correspondant aux concentrations de 0,1, 0,2 et 0,3 mmol/l et qui sont obtenues en mélangeant respectivement 100, 200 et 300 µl de la solution de stock tyrosine avec 10 ml d HCl 0,1M. - le substrat qui est conçu au maximum une heure avant utilisation en additionnant deux volumes du stock A pour un volume du stock B afin d obtenir la solution C. Les volumes sont
71 adaptés en fonction de la quantité de solution C nécessaire. Ensuite 2g d albumine bovine sont dissous dans 98 ml de la solution C puis mélangés lentement pendant 30 minutes à 4 C. - le réactif de Folin-Ciocalteus Phenol est utilisé après une dilution au tiers du réactif initial ce qui correspond à l adjonction de 2 volumes d H 2 O pour un volume de réactif pur. La réalisation du dosage comprend les étapes suivantes : - Afin de réaliser la mesure de densité optique du milieu, un substrat blanc est réalisé avec 100 µl d H 2 O avec 500 µl du substrat, l ensemble est mis en place dans un tube fermé et vortexé. La préparation de l échantillon nécessite le mélange de 100 µl de ce dernier à 500 µl de substrat puis l ensemble est vortexé et le tube est fermé. Pour chaque standard tyrosine (0,1-0,2-0,3 mmol/l), 1000 µl sont placés dans un tube fermé. - Tous les tubes sont incubés au bain-marie à 37 C pendant 24 heures. - Après l incubation, la réaction est stoppée en ajoutant 1000 µl de TCA 4% dans chaque tube sauf dans les standards tyrosine. Tous les tubes sont vortexés et après 10 minutes, ils sont centrifugés à 3000 G pendant 20 minutes. - La lecture spectrophotométrique nécessite de placer dans des tubes de 4 ml, 200 µl de surnageant de chaque dilution, de même pour le substrat blanc et les standards puis chacun des tubes reçoit ensuite 2000 µl de la solution NaOH (0,25M) puis 300 µl du réactif Folin- Ciocalteus (33%). L ensemble des tubes est homogénéisé grâce au vortex et une incubation à température ambiante est effectuée pendant 30 minutes. - Une fois ce temps écoulé, la densité optique de chacun des tubes est lue au spectrophotomètre à une longueur d onde de 680 nm soit en lumière visible, dans des cuvettes en plastique ou en verre Electrophorèse (Stryer, 1992) Généralités Les protéines ont une charge nette positive ou négative reflétant le mélange d acides aminés dont elles sont formées, or une molécule chargée se déplace dans un champ électrique, c es ce que l on appelle l électrophorèse. Ce phénomène offre un moyen puissant de séparation des protéines. La vitesse de migration (v) d une protéine (ou d une molécule quelconque) dans un champ électrique est fonction de l intensité de ce champ (E), de la charge globale de la protéine (z) et du coefficient de frottement (f) : v = Ez/f. La force électrique Ez qui attire la molécule chargée vers l électrode de charge contraire s oppose à la résistance de la viscosité fv résultant du frottement entre la molécule en mouvement et le milieu. Le coefficient de frottement dépend à la fois de la masse et de la forme de la molécule en cours de migration et de la viscosité du milieu. Les séparations électrophorétiques sont presque toujours réalisées dans des gels et non pas dans des solutions libres, pour deux raisons. Tout d abord, les gels suppriment les courants de convexion produits par de faibles gradients de température, ce qui est nécessaire pour une séparation efficace. En second lieu, les gels servent de tamis moléculaires qui améliorent la séparation. Les molécules dont les dimensions sont faibles si on les compare à celles des pores du gel, se déplacent aisément dans le gel, tandis que les molécules dont les dimensions sont plus grandes que celles des pores sont presque immobiles. Les molécules d une taille intermédiaire migrent à travers le gel plus ou moins facilement. Les gels de polyacrylamide sont des supports de choix pour l électrophorèse parce qu ils sont chimiquement inertes et peuvent être aisément formés par polymérisation de l acrylamide. De plus, le diamètre de leurs pores peut être contrôlé par le choix de différentes concentrations d acrylamide et de méthylènebisacrylamide (réactif permettant la formation de liaisons croisées) lors de la polymérisation
72 Les protéines peuvent être séparées en grande partie sur la base de leur masse par électrophorèse sur gel de polyacrylamide dans des conditions dénaturantes. Le mélange de protéines est tout d abord dissous dans une solution de sodium dodécyl sulfate (SDS), détergent anionique qui rompt presque toutes les interactions non covalentes présentes dans les molécules natives. Du fait que le détergent se lie aux groupements hydrophobes de la molécule protéique, provoquant leur déroulement en chaînes polypeptidiques allongées, les molécules protéiques sont libérées de leur association avec d autres molécules protéiques ou lipidiques, et rendues aisément solubles dans la solution de détergent. Le mercaptoéthanol ou le dithiothréitol est également ajouté pour réduire les liaisons disulfures. Les anions du SDS se lient aux chaînes principales dans le rapport d environ une molécule de SDS pour deux résidus acides aminés, ce qui donne à un complexe de SDS avec une protéine dénaturée une charge négative élevée qui est approximativement proportionnelle à la masse de la protéine. La charge négative acquise par la fixation du SDS est habituellement beaucoup plus grande que la charge de la protéine native ; cette charge native est ainsi rendue négligeable. Les complexes SDS-protéines dénaturées sont ensuite soumis à une électrophorèse dans un gel de polyacrylamide, généralement sous la forme d une fine plaque verticale présentant un pôle négatif en haut et positif en bas. La charge globale des protéines étant négative, cela provoque leur migration vers l électrode positive lorsqu on applique une tension d environ 200 volts. Typiquement, plusieurs échantillons sont analysés dans une même électrophorèse et sont déposés dans des puits moulés dans le gel lors de sa formation grâce à une seringue de quelques microlitres. Il est classique de réserver un puits à une solution comportant des protéines de poids moléculaire connus afin de déterminer cette valeur pour les différentes protéines séparées. Une fois l électrophorèse achevée, les protéines peuvent être visualisées dans le gel par une coloration à l argent ou au bleu de Coomassie qui révèle une série de bandes (Figure 13). Figure 13: Appareillage et gel d électrophorèse Figure 13: appareillage et gel d électrophorèse Les protéines de petit poids moléculaire se déplacement rapidement à travers le gel, tandis que celles de haut poids moléculaire restent à l extrémité supérieure près de la zone de déposition
73 La mobilité de la plupart des chaînes polypeptidiques est, dans ces conditions, linéairement proportionnelle au logarithme de leur masse. Cette relation empirique n est pas vérifiée pour certaines protéines. Par exemple, quelques protéines riches en glucides ainsi que les protéines membranaires migrent de façon anormale. Pour des molécules de même taille, une distinction peut être faite si elles diffèrent par leur nombre de groupements hydrophobes. La protéine qui en est la plus riche fixe plus de détergent et a donc une charge négative plus élevée, elle est par conséquent soumise à de plus grandes forces électriques, subit une accélération accrue et migre plus loin. L électrophorèse sur gel de polyacrylamide en présence de SDS est rapide, sensible et d un haut degré de résolution. L électrophorèse et la coloration prennent environ un jour. Une quantité de protéines aussi faible que 0,1 µg (environ 2 pmol) donne une bande distincte lorsqu elle est colorée par le bleu de Coomassie, et des quantités moindres (environ 0,02 µg) peuvent même être détectées par une coloration à l argent. Les protéines dont les masses diffèrent d environ 2% (par exemple 40 et 41 kda), ce qui représente une différence d à peu près 10 résidus, peuvent habituellement être distinguées Préparation et déroulement d une électrophorèse sur gel de polyacrylamide Les solutions de stock et les tampons sont : - l acrylamide / bis (30% T ; 2,67% C) qui est composé de 29,2g d acrylamide et de 0,8g de N N -bis-méthylène-acrylamide pour 100 ml d H 2 O qsq et dont la conservation se fait à +4 C dans le noir et au maximum pour 30 jours. - le SDS 10% qui correspond à la dilution de 10g de sodium-dodécyl-sulfate dans 100 ml d H 2 O qsq avec une conservation qui se fait à 20 C. - le tris-hcl 1,5M, ph 6,8 qui s obtient par la dilution de 18,15g de Tris base dans 100 ml d H 2 O qsq en ajustant le ph à 6,8 avec une solution d HCl 6N puis en conservant à +4 C. - le tampon de migration (concentré 10 fois) est un mélange de 15,15g de Tris base avec 72g de glycine et 5g de SDS dans 500 ml d H 2 O qsq, sa conservation s effectue à +4 C. Il faut diluer 50 ml de tampon concentré 10 fois dans 450 ml d eau distillée avant utilisation. - le tampon des échantillons est constitué de 3,55 ml d eau distillée, 1,25 ml de Tris-HCl 0,5M ph 6,8, de 2,5 ml de glycérol, de 2,0 ml de SDS 10% (W/V) et de 0,2 ml de bleu de bromophénol 0,5% (W/V). Cette solution est à conserver à température ambiante. Il faut ajouter, juste avant utilisation, 50 µl de mercapto-éthanol pour 950 µl de tampon puis diluer les échantillons au moyen de ce tampon au moins à 1 : 2 et chauffer le mélange à 95 C pendant 4 minutes. - l APS 10% est réalisé en dissolvant 100 mg d ammonium persulfate dans 1 ml d eau distillée le jour même de l utilisation. - les standards pharmacia sont à diluer dans 200 µl de tampon et 5 µl de ce mélange sont chargés dans chaque puits. La formulation des gels est donnée pour un volume de 10 ml de gel et les proportions dépendent du pourcentage du gel qui peut varier de 4 à 15% selon la taille de pores que l on souhaite obtenir. Il faut adapter leur diamètre à la taille des protéines que l on peut estimer. Nous utilisons un pourcentage de gel de 10% soit un mélange de 4,1 ml d H 2 O, 3,3 ml d acrylamide/bis et 2,5 ml de tampon du gel c est-à-dire du Tris-HCl 1,5M, ph 6,8 pour le gel de séparation et le même tampon mais à la concentration de 0,5M pour le gel de concentration. Ce mélange est dégazé avant l ajout de 0,1 ml de SDS 10% puis de 50 µl d APS 10% et de 10 µl de Temed. Le gel de séparation est coulé entre les deux plaques puis 200 µl d amyl-alcool sont déposés. Une fois la polymérisation complète accomplie, nous coulons le gel de concentration
74 La migration est mise en œuvre au moyen d une tension de 200 volts (+/- 100 ma) qui est appliquée à l appareil d électrophorèse pour une durée de 35 minutes et pour deux gels. Lorsque la migration est achevée, la coloration du gel extrait de son étau se fait en plaçant ce dernier dans une solution composée de 400 ml de méthanol, 100 ml d acide acétique, 1,0 g de bleu de Coomassie et 500 ml d eau pendant 30 minutes à une heure. Cette opération est suivie par l étape de décoloration au cours de laquelle le gel est transféré dans le bain constitué d un mélange de 400 ml de méthanol, 100 ml d acide acétique pour 500 ml d eau pendant 2 à 3 heures
75 2- Partie travail personnel 2-1 Matériel et méthodes Préparation de la muqueuse glandulaire Origine Les estomacs et une petite partie du duodénum (2-4 cm de long) de deux chevaux en bonne santé, tués à l abattoir de Meaux pour la consommation humaine sont prélevés immédiatement après leur abattage, vidés de leur contenu et nettoyés à l eau. L un des deux chevaux est un hongre d origine inconnue âgé de 2 ans et l autre un hongre Oldenbourg de 8 ans. Les organes entiers sont placés dans la glace à l intérieur d une glacière pour être transportés jusqu au laboratoire. Les muqueuses glandulaires sont disséquées au scalpel du reste de l estomac et du duodénum puis pesées Préparation de la muqueuse La muqueuse est broyée à l aide d un mixeur et mise en solution dans un volume de tampon phosphate, 0,1M (5,2g NaH 2 PO ,0g Na 2 HPO 4 ), ph 7,4 tel que l on obtienne environ 2mL de tampon par gramme de tissu. Cette solution est homogénéisée grâce à un agitateur magnétique pendant 45 minutes à 4 C. Par la suite, une centrifugation de la solution homogénéisée est effectuée à 4 C à la vitesse de 9000 tours/min (soit g) pendant 60 minutes (Sorvall RC5B, rotor GS3). Le surnageant que l on dénomme extrait I est conservé alors que le culot est jeté Précipitation des protéines La première étape de la précipitation est l obtention d une saturation à 35% de sulfate d ammonium de l extrait I. Afin d accéder à cette valeur, 353g de sulfate d ammonium soit 208g/L d extrait sont ajoutés à l extrait I. L ensemble est alors agité jusqu à dissolution totale du sulfate d ammonium puis laissé au repos pendant 2 heures à 4 C. Cette opération assure la précipitation des lipoprotéines. La solution obtenue est ensuite centrifugée à 9000 tours par minute pendant 60 minutes à 4 C. Le culot est mis en suspension et dialysé dans 20L de tampon phosphate 0,02M (10,5g NaH 2 PO ,0g Na 2 HPO 4 ), ph 7,4 pendant 15 heures à 4 C. Cette fraction est appelée précipité 35 %. Le surnageant obtenu subit à nouveau une précipitation avec 556 g de sulfate d ammonium soit 316 g/l pendant 15 heures, la saturation obtenue est alors de 80% et elle permet de précipiter le pepsinogène. La solution obtenue est nommée précipité 80 %. La solution est centrifugée de la même façon que précédemment. Le surnageant est jeté tandis que le culot est dialysé contre 4 bains de tampon phosphate 0,02M (10,5 g NaH 2 PO ,0 g Na 2 HPO 4 ), ph 7,4 pendant 24 heures à 4 C. A la fin de la dialyse, les précipités 35 et 80 % sont centrifugés à 4 C à la vitesse de tours/min (soit g) pendant 10 minutes
76 2-1-3 Chromatographie Afin de séparer les différentes protéines du précipité 80 % dialysé, nous réalisons trois chromatographies successives entrecoupées de dosages des protéines et du pepsinogène pour les différents pics d absorption mis en évidence. Pour chaque nouvelle chromatographie, nous employons le pic le plus riche en pepsinogène de la chromatographie précédente. La première étape consiste à réaliser une évaluation par dosage de la quantité de protéines contenues dans la solution à traiter afin d adapter le volume de gel qui va fixer les protéines. En effet, chaque gel a une capacité bien précise de macromolécules qu il peut lier et si cette capacité est dépassée, il y a alors perte de protéines et donc diminution du rendement. Il faut ensuite préparer la chromatographie utilisant une résine échangeuse d anions de type DEAE Séphadex A25 (Amersham) qui comporte une matrice polyosidique assurant la séparation de macromolécules ionisées. Cette résine a une capacité de chargement de 10 mg/ml et d après le dosage des protéines, nous déduisons qu un volume de 1,43 L de gel au minimum est nécessaire. Un litre et demi de cette résine est lavé au moyen de trois litres de tampon phosphate 200mM, ph 7,4 pendant 15 heures puis il est mis en place dans la colonne de chromatographie dans laquelle passent dix litres de tampon phosphate 20mM, ph 7,4. Les 432 ml obtenus après dialyse du précipité 80 % sont chargés sur la colonne. Celle-ci est ensuite éluée avec puis cinq litres de tampon phosphate 20mM, ph 7,4. Le liquide recueilli constitue la fraction non adsorbée. Les protéines fixées à la colonne sont ensuite éluées avec du tampon phosphate 20 mm, ph 7,4 contenant des concentrations croissantes de NaCl (100 mm, 200 mm, 500 mm et 1 M). Le volume d'élution de chaque fraction correspond à cinq fois le volume de la colonne. Les fractions intéressantes, soit celles qui correspondent aux concentrations de 500 mm et 1000 mm de NaCl, sont concentrées sur une cassette de concentration Millipore et nommées respectivement S500 et S1000. La concentration en protéines et en pepsinogène est déterminée pour la solution «non adsorbée» ainsi que pour chaque concentration de NaCl par, respectivement la méthode de Lowry et de Dorny. Les solutions S500 et S1000 sont dialysées dans un tampon phosphate 20mM, ph 7,4 pendant 15 heures. La solution S500 subit une chromatographie FPLC (Waters 650/600E) échangeuse d ions mais de type DEAE céramique (Biosepra) (1,6 x 11 cm). Cette opération est réalisée en deux fois avec une premier chargement avec un volume de 179 ml et un deuxième avec le volume restant soit 252,4 ml ce qui correspond à un chargement de 179 mg et 252 mg de protéines. Un spectrophotomètre (Waters 486) permet de mesurer la densité optique de l'éluat. Le débit appliqué à la colonne est de 6 ml/min. Les protéines sont éluées au moyen d une solution comportant une concentration croissante de NaCl dont la valeur est programmée pour une certaines durée. Nous obtenons différents pics qui parfois dépassent la feuille de graphique où est rapportée la mesure de densité optique de chaque tube, nous effectuons une mesure de la densité optique de chaque tube concerné après avoir dilué l'échantillon 20 fois. Une évaluation de la concentration en protéines et en pepsinogène de chaque pic des deux chargements est réalisée avec les méthodes citées précédemment. Les pics des deux chargements sont dialysés contre du tampon phosphate 20 mm, ph 7,4 à 4 C (4 bains pour une durée totale de 24 heures). Le pic le plus riche en pepsinogène du premier chargement est soumis à une chromatographie FPLC (Waters 650/600E) par adsorption sur une colonne d hydroxyapatite (Hydroxyapatite Bio-gel HT Gel, BioRAD) (1,6 x 20 cm) équilibrée en tampon phosphate de sodium 20 mm, ph 7,4. Un débit de 1 ml/min est appliqué. Les protéines sont éluées par un gradient de tampon phosphate allant de 20 mm à 200 mm. Sur l ensemble des pics obtenus, nous évaluons la concentration en protéines et en pepsinogène comme décrit précédemment
77 2-2 Résultats Préparation de la muqueuse glandulaire Après dissection des estomacs des deux chevaux, on obtient 475 g de muqueuse glandulaire pour le premier et 491 g pour le second soit un total de 966 g de tissu. Le tissu est broyé et du tampon est ajouté pour atteindre un volume de 1692 ml. Après agitation, le mélange est centrifugé. Le culot est écarté tandis que le surnagent est conservé pour la suite de la purification Précipitation des protéines Après la précipitation au sulfate d ammonium, les précipités 35 % et 80 % sont remis en suspension et largement dialysés. Après dialyse, les volumes de ces deux fractions sont respectivement de 156 ml et 432 ml. Les dosages de protéines et de protéases sont réalisés sur les deux précipités et repris dans le tableau 1. Tableau 1 : Mesure des quantités de protéines et de protéases dans les différents précipités au sulfate d ammonium Fraction Qté totale de protéines (mg) Activité enzymatique totale (Utyr) Act. Enz / Prot Précipité 0-35% ,154 Précipité 35-80% ,262 Total Ces résultats prouvent que la majorité des protéases et en particulier du pepsinogène se trouve dans le précipité 35-80% Résultats des différentes chromatographies Chromatographie sur colonne DEAE Séphadex A25 Les résultats sont repris dans le tableau Tableau 2. Tableau 2 : Résultats obtenus à partir des dosages des différentes fractions de la chromatographie sur la colonne DEAE Séphadex A25 DEAE Sép. A25 Qté de prot (mg) Act. Enz (Utyr) Act. Enz. / Prot. Rendement en Utyr Facteur de purification Non adsorbé ,01 0, mm ,01 0, mm ,08 12,13 5, mm ,381 3,608 1 M ,661 16,482 Total
78 Ce tableau met en évidence un bon rendement pour les protéines mais un rendement très faible pour le pepsinogène. L hypothèse envisageable serait une dégradation du pepsinogène au cours de cette étape Chromatographie sur colonne DEAE Céramic Etant donné la quantité importante de protéines obtenue dans la fraction S500, la colonne DEAE céramic a dû être chargée en deux fois. Les profils d'élution sont repris dans la figure suivante (Figure 14). Figure 14 : Profil d'élution de la DEAE Céramic I (d après Benoît Rémy, 2005) 6 1 Do à 280 nm Molarité de NaCl (M) Fractions de 2 ml La quantité de protéines ainsi que l'activité enzymatique de chaque fraction sont reprises dans le tableau 3. Tableau 3 : Résultats obtenus à partir des dosages des différentes fractions de la chromatographie sur la colonne DEAE Céramic DEAE céramic Qté de prot (mg) Act. Enz. (Utyr) Act. Enz. / Prot Rendement en Utyr Facteur de purification Chargement 348 Pic ,039 0,246 Pic ,067 0,679 Pic ,43 132,8 3,208 Pic ,736 5,691 Pic ,333 0,187 Total ,59 Les rendements de cette colonne sont excellents. Cette étape a permis de purifier trois fois le pepsinogène
79 Chromatographie sur colonne hydroxyapatite La colonne d hydroxyapatite chargée avec le pic le plus riche en pepsinogène du premier chargement de la colonne précédente donne le profil d élution suivant (Figure 15). Figure 15 : Profil d'élution de la colonne hydroxyapatite (d après Benoît Rémy, 2005) Do à 280 nm II III IV I Fractions de 2 ml La quantité de protéines ainsi que l'activité enzymatique de chaque fraction sont reprises dans le tableau 4. Tableau 4 : Résultats obtenus à partir des dosages des différentes fractions de la chromatographie sur la colonne hydroxyapatite Hydroxyapatite Qté de prot (mg) Act. Enz (Utyr) Act. Enz. / Prot. Rendement en Utyr Facteur de purification Chargement 128 Pic I 0, ,1 8,30 13,8 Pic II ,160 0,423 0,835 Pic III ,70 5,22 0,575 Pic IV ,546 16,6 Total ,6 Les rendements de cette colonne sont moyens. Le pepsinogène est le plus pur dans le pic I mais la quantité obtenue est très très faible, par ailleurs la valeur de densité optique mesurée pour ce pic est en dehors de la courbe standard donc très imprécise. Le pepsinogène est le plus abondant dans le pic IV mais il est moins pur que dans le pic I Molarité de tampon phosphate (M)
80 2-2-4 Electrophorèse Le résultat de l électrophorèse réalisée sur le chargement de la colonne DEAE céramique ainsi que sur les différents pics obtenus après la chromatographie est reporté dans la figure 16. Figure 16 : Electrophorèse monodimensionnelle SDS-PAGE du chargement et des différents pics obtenus après passage sur colonne DEAE céramic. La ligne STD montre les standards de masse moléculaire (d après Benoît Rémy, 2005) STD chgt pic 1 pic 2 pic 3 pic 4 pic 5 STD - 97 kda - 66 kda - 45 kda - 30 kda Le résultat de l électrophorèse réalisée sur le chargement de la colonne hydroxyapatite ainsi que sur les différents pics obtenus après la chromatographie est reporté dans la figure
81 Figure 17 : Electrophorèse monodimensionnelle SDS-PAGE du chargement et des différents pics obtenus après passage sur colonne d'hydroxyapatite. La ligne STD montre les standards de masse moléculaire (d après Benoît Rémy, 2005) STD chgt pic 1 pic 2 pic 3 pic 4 STD - 97 kda - 66 kda - 45 kda - 30 kda - 20,1 kda L électrophorèse met en évidence l absence de protéine en quantité détectable dans le premier pic et la présence dans les autres pics de plusieurs protéines différentes puisque l on peut observer plusieurs bandes distinctes. Les poids moléculaires de ces protéines ont été estimés à : - 45,0 et 53,7 kda pour le pic 2, - 45,0 et 51,3 kda pour le pic 3, - 42,6, 47,8 et 56,2 kda pour le pic
82 2-3 Discussion Le pepsinogène est le précurseur inactif de la pepsine, une protéase active en milieu acide dans l estomac. Il est synthétisé et stocké sous la forme d une chaîne polypeptidique à l intérieur de granules zymogènes des cellules principales de la muqueuse glandulaire gastrique. Le contenu de ces granules est sécrété en réponse à des stimuli neurologiques, hormonaux et gastriques appropriés. Le pepsinogène a déjà été purifié et caractérisé dans plusieurs espèces : homme, porc, bœuf, chien, lapin, chat, chameau, singe, cobaye, poulet, souris, rat, ours, grenouille taureau et poisson Comparaison des différentes purifications du pepsinogène équin (Tableau 5) Nous nous basons sur la comparaison de deux études sur la purification du pepsinogène équin décrites dans la littérature (Sayegh et al., 1995 et Khittoo et al., 1991) avec notre purification. L origine et le traitement des estomacs dont est extrait le pepsinogène sont similaires dans les trois études, mis à part le fait que dans notre étude et celle de Sayegh (Sayegh et al., 1995), tout ou partie de cet organe a subi une étape de congélation-décongélation avant dissection de la muqueuse fondique. Ces changements d état peuvent être à l origine de discrètes altérations des protéines ; elles sont cependant moindres qu avec une conservation sans refroidissement, la solution idéale étant d'extraire la muqueuse immédiatement après la mort du cheval. Il est aussi important de considérer si une partie du duodénum a été prélevée en même temps que l estomac puisqu il existe des différences de sécrétion de pepsinogène entre les diverses régions gastro-duodénales. Ceci n a pas encore été prouvé chez le cheval. Le tampon phosphate utilisé au cours de toute la purification a été choisi parce que le pka du couple acido-basique qui intervient ici (H 2 PO 4 - / HPO 4 2- ) est de 7,2 et donc voisin du ph auquel on désire travailler. En effet, on recherche un ph proche du ph biologique (7,4) afin de maintenir l activité potentielle et la stabilité du pepsinogène. Nous avons pratiqué une précipitation des protéines par l intermédiaire du sulfate d ammonium à des taux proches de ceux utilisés dans l étude de Khittoo et Vermette (Khittoo et al., 1991), par contre cette technique n a pas été mise en œuvre dans celle de Sayegh (Sayegh et al., 1995). Elle permet d éliminer une partie des protéines qui ne présentent pas d intérêt pour notre purification comme les lipoprotéines et de diminuer le volume de l'extrait. Cette étape nécessite la mise en œuvre d une dialyse afin de débarrasser la solution des sels trop abondants ce qui peut perturber la suite de la procédure. Les pourcentages que nous avons choisis pour les différentes étapes de la saturation sont basés sur les travaux déjà effectués sur le pepsinogène d autres espèces qui laissent présager des éventuelles propriétés du pepsinogène équin vis-à-vis des sels d ammonium. Chacune des trois études a utilisé des colonnes de chromatographie pour séparer les protéines mais le choix de ces dernières a été propre à chaque équipe. Un minimum de deux colonnes aux propriétés différentes est requis afin de séparer les protéines sur des caractéristiques physico-chimiques distinctes et ainsi d avoir un produit final le plus pur possible. Les électrophorèses destinées entre autres à déterminer la pureté et la masse moléculaire des substances isolées ont été pratiquées suivant la même technique établie par Laemmli, sauf dans l étude de Khittoo et Vermette (Khittoo et al., 1991) où le pepsinogène isolé est activé en milieu acide avant de subir l électrophorèse, cette activation n a pas été rapportée dans la purification de Sayegh (Sayegh et al., 1995). Elle pourrait être à l origine de modifications dans la structure du pepsinogène qui expliqueraient le plus faible poids moléculaire du pepsinogène observé dans ces travaux
83 A la fin de la procédure, nous obtenons plusieurs enzymes protéolytiques gastriques de poids moléculaire pouvant varier entre 42,6 et 56,2 kda. La confirmation de la nature de ces protéines nécessite un séquençage des acides aminés qui les composent. Etant donné que le pepsinogène bovin a une masse moléculaire de 40 kda par spectrométrie de masse qui est la technique la plus précise pour mesurer cette valeur et que par analyse électrophorétique cette masse moléculaire est de 45 kda, nous pouvons avancer l hypothèse que la bande correspondant à la masse moléculaire de 45 kda pourrait être le pepsinogène équin par analogie avec les bovins. Cette bande se retrouve dans les pics 2 et 3 mais la protéine semble être plus pure dans le pic 3. En conséquence la masse moléculaire du pepsinogène dans notre étude serait de 45 kda ce qui le situe entre les valeurs de deux autres études, à savoir 40 kda pour Khittoo (Khittoo et al., 1991) et 73 à 78 kda pour Sayegh (Sayegh et al., 1995). Ces différences peuvent être dues à l utilisation de procédures distinctes, notamment à la mise en œuvre de colonnes de chromatographie de plusieurs types, au manque de précision des méthodes de dosage et d évaluation de la masse moléculaire par électrophorèse, à l existence d éventuels groupes de pepsinogène comme dans d autres espèces Au terme de notre étude, l analyse électrophorétique révèle que dans les différents pics, plusieurs protéines sont mises en évidence. Les poids moléculaires calculés sont trop éloignés les uns des autres pour qu ils s agissent des isoformes d un même groupe de pepsinogène mais il peut s agir de pepsinogène appartenant à des groupes distincts. En effet nous avons pris une partie de la muqueuse duodénale en plus de la muqueuse gastrique pour matière première et par conséquent les protéases isolées peuvent être différentes entre les deux types de muqueuse. Il n a pas été précisé dans les autres études si une partie du duodénum avait été intégrée à la muqueuse glandulaire gastrique. Une dégradation du pepsinogène a également pu se produire au cours de l isolement. Différentes équipes ont été montré l'existence de plusieurs types de pespsinogène (pespinogène A et C chez l'homme, les porcins et les bovins, F chez le lapin). Le degré de purification ainsi que son rendement n ont pas été évalué dans les études de Khittoo (Khittoo et al., 1991) et de Sayegh (Sayegh et al., 1995). Quant à notre purification, ces paramètres nous permettent de préciser que nous obtenons d une part une très faible quantité de pepsinogène très pur et d autre part une quantité plus élevée de pepsinogène qui n est totalement purifié Intérêt du dosage du pepsinogène sanguin chez le cheval Les publications concernant l étude du pepsinogène équin et ses applications sont peu nombreuses malgré l importance clinique et économique des affections gastriques touchant cette espèce. Pourtant les études menées sur des individus adultes parasités par Trichostrongylus axei (Waddell et Mc Cosker, 1969) ou jeunes atteints d ulcères gastriques ou duodénaux (Wilson et Pearson, 1986) sont plutôt prometteuses. En effet dans le premier cas, il a été mis en évidence une augmentation significative de la concentration sérique en pepsinogène chez les animaux infestés par rapport à ceux qui étaient sains : le taux est de 16,5 µg tyrosine / ml de sérum / heure d incubation chez les parasités et de 8,8 chez les animaux sains dans l étude de Waddell et McCosker (Waddell et Mc Cosker, 1969), cette même constatation a été faite sur des poneys pâturant en alternance avec des moutons et qui s étaient contaminés à partir de la source constituée par les petits ruminants. Cependant une parasitose due aux larves de Gasterophilus intestinalis ne semble pas provoquer d augmentation du pepsinogène sanguin. L origine probable de cette différence est que ces larves de Gasterophilus se développent plutôt dans la région proventriculaire alors que celles de Trichostrongylus touchent plus particulièrement la région fondique. Le dosage
84 du pepsinogène sanguin peut donc se révéler utile pour aider au diagnostic de certaines parasitoses puisqu il apparaît que seules les larves se fixant sur la muqueuse fondique ou pylorique (Habronema spp, Trichostrongylus axei, Gasterophilus nasalis et haemorrhoidalis) soient responsables de lésions à l origine d une hausse de ce paramètre. Ceci est d autant plus intéressant que le diagnostic coproscopique est difficile en raison de la fragilité des éléments recherchés voire impossible. Les ulcères gastriques et duodénaux sont une pathologie fréquente chez le cheval : plus de 50% des poulains de moins de 3 mois montrent des signes d ulcères gastro-duodénaux quel que soit leur historique médical (Murray et al., 1990), plus de 90% des pur-sang à l entraînement en course sont touchés par cette affection (Murray et al., 1996). La mesure du pepsinogène sérique ne semble pas dépourvue d intérêt étant donné la rupture de l intégrité de la muqueuse gastrique et/ou duodénale. Elle a été évaluée au cours d une étude réalisée par Wilson et Pearson (Wilson et Pearson, 1986) sur des poulains normaux et atteints d ulcères suspectés ou confirmés. Les résultats montrent une hausse significative de ce paramètre chez les poulains malades par rapport aux sains, cependant il faut tenir compte du fait que cette différence n est valable qu après l âge de deux semaines. En dessous de cet âge, les valeurs de la concentration de pepsinogène sanguin sont élevées quel que soit l état de santé du foal. Cet élément aurait pour origine une accumulation de ce précurseur dans le liquide amniotique durant la vie fœtale, l immaturité du rein qui engendrerait un défaut d élimination du pepsinogène et le stress de la parturition accompagnée d une élévation des stéroïdes endogènes et donc d une augmentation de la concentration en pepsinogène et en acide. Il est primordial de connaître cette information afin d interpréter correctement le résultat du dosage. Cela permet de poser d autres questions sur les paramètres pouvant influencer ce taux sanguin dans le but d améliorer la fiabilité du test. Par exemple, il a été prouvé que la concentration sérique du pepsinogène A augmente substantiellement après une prise alimentaire chez le chien sain (Suchodolski et al., 2003), cette donnée n a pas encore été étudiée chez le cheval tout comme l existence ou non d un rythme circadien, l influence du type d alimentation, des traitements éventuels... Dans les différentes études qui ont été amenées à évaluer la «pepsinogénémie», un chevauchement est fréquemment observé entre les valeurs normales et anormales ; une forte augmentation de ce paramètre est en faveur d une ulcération gastro-duodénale, par contre une valeur normale ne permet pas d exclure cette pathologie. C est pour cette raison que ce dosage ne peut être utilisé pour poser un diagnostic définitif. Il est nécessaire d y associer le tableau clinique présenté par le poulain afin d orienter les suspicions vers une affection ulcérative et ainsi d éviter les examens invasifs tels que la gastroscopie ou le test de perméabilité au sucrose (nécessitant un sondage urinaire) (O Connor et al., 2003), ce qui est un des objectifs de cette méthode. Pour améliorer la précision du dosage et le rendre plus sensible, le développement de méthodes radio-immunologiques est un pas à franchir. Chez l homme, comme pour de nombreuses espèces, différents types de pepsinogènes ont été identifiés. Les pepsinogènes A et C sont synthétisés dans la région gastrique et le pepsinogène C est en plus fabriqué dans la région pylorique et le duodénum. Ces différences de localisation cellulaire font que leurs variations respectives peuvent faciliter le diagnostic différentiel en orientant sur la région gastro-duodénale atteinte. Aucune recherche sur les différents groupes de pepsinogène n a été entreprise chez le cheval jusqu à maintenant. Le taux de pepsinogène sanguin chez des animaux sains a été évalué pour différents herbivores. Ce taux est relativement élevé chez des espèces comme le lapin ou le singe car on estime qu une grande quantité de ce précurseur est nécessaire pour digérer les protéines présentes dans les végétaux. A l inverse chez les ruminants le taux observé est plus bas : mu (mu : milli-unité de tyrosine avec une unité tyrosine qui correspond au nombre de micromoles de tyrosine libérées par litre de sérum par minute) pour les bovins, mu
85 pour les ovins (Kerboeuf et al., 2002). L origine de cette valeur semble due à la double fonctionnalité de l abomasum qui, en plus du pepsinogène, synthétise une grande quantité de lysozyme pour digérer les micro-organismes du rumen. Quant au cheval, le taux est également bas : il est généralement inférieur à 250 mu. Ceci peut s expliquer par la fonction digestive minime de l estomac dans cette espèce, l essentiel de la digestion s effectuant dans les segments suivants où il existe également une flore intestinale particulière comme les ruminants. Enfin si l intérêt du dosage du pepsinogène chez le cheval se confirme notamment pour le diagnostic des ulcères gastro-duodénaux, du parasitisme ou des néoplasies, cela permettra d avoir une méthode plus rapide et moins invasive que la gastroscopie par exemple afin de détecter une affection gastrique. La gastroscopie nécessite en effet un jeun d au moins 12 heures pour réaliser une exploration correcte de l estomac, par ailleurs elle n est pas accessible à tous les vétérinaires étant donné le coût du matériel et en conséquence l acte en lui-même est assez onéreux (de l ordre de 80 à 100 ). L évaluation de la pepsinogénémie ainsi que la distinction des différentes formes de pepsinogène permettant d affiner le diagnostic pourraient être considérées comme une nouvelle technique de «biopsie gastrique sérologique» (Korsantje et al., 2002). Ce test constitue la première étape de l élaboration de ce test puisqu il est nécessaire, selon la méthode de dosage choisie, de fabriquer un antisérum du pepsinogène équin par exemple afin d obtenir un résultat le plus spécifique possible. En effet, il existe une grande homologie entre le pepsinogène équin et celui d autres espèces ce qui a permis la réalisation des études de Waddell et McCosker en 1969 et de Wilson et Pearson en 1986, précédemment citées, grâce à l utilisation d anti-sérums provenant d autres espèces (herbivores notamment, la proximité entre les pepsinogènes de deux espèces étant d autant plus grande que celles-ci sont phylogénétiquement proches). Les parties codant pour le site d action enzymatique sont en général assez bien conservées d une espèce à l autre car le mode d action est sensiblement le même, le reste de l enzyme est beaucoup plus variable. Cependant une similitude non négligeable est observée entre le pepsinogène et d autres protéines comme la chymosine, la PAG (pregnancy associated glycoprotein) ou la cathepsine avec plus de 80% d homologie. Pour cette raison, il est primordial d avoir un anti-sérum du pepsinogène équin de façon à ce que le test soit le fiable possible en permettant de suivre les variations du taux de cette protéine et uniquement de celle-ci. Par ailleurs, la mise au point de ces dosages utilisant des anti-sérums ou des marqueurs radioactifs requiert la quantification des réactions non spécifiques, étant donné que ces derniers se lient toujours en faible quantité à d autres molécules que celles dont ils sont sensés être spécifiques ce qui rend les réactions faussement positives, même si cela est consécutif à des variations de faible ampleur. Par exemple, pour mesurer cette part de «non spécifique», il faut réaliser des dosages avec des sérums artificiellement dépourvus de pepsinogène, après un passage sur une colonne d affinité comme un gel d agarose comprenant des anticorps anti-pepsinogènes (Benoît Rémy, communication personnelle non publiée)
86 Tableau 5 : Tableau comparatif des deux études sur l isolement du pepsinogène équin publiées dans la littérature avec la nôtre (Tampon P : tampon phosphate 0,1M, ph 7,4) Purification Dosage Résultats Matière première Mise en solution Précipitation, dialyse et centrifugation Séparation des protéines Electrophorèse Etude Khittoo, Vermette estomac cheval euthanasié, lavé à l eau distillée puis dissection de la muqueuse glandulaire Muqueuse mise en suspension dans tampon P et homogénéisée par un malaxeur Précipitation au sulfate d ammonium à 36% de saturation. Mélange 1 h, repos 16 h, centrifugation 13700g 30 min. Précipitation du surnageant à 75% de sat. Puis même centrifugation 1 chromatographie par échange d anions puis 1 autre par filtration sur gel SDS-PAGE Méthode protéolytique (hémoglobine) 1 protéase de 40 kda Etude Sayegh, Anderson estomacs de chevaux sains, euthanasiés, rincés à l eau, mis en solution dans tampon P puis congelés. Muqueuse glandulaire disséquée après décongélation. Muqueuse mise en solution dans tampon P (2ml/g), homogénéisée 25 min par agitateur puis filtrée sur laine de verre Filtrat centrifugé à 10000g 45 min. Dialyse du surnageant 3h contre tampon P puis centrifugation. 2 chromatographies par échanges d anions différentes SDS-PAGE Méthode protéolytique (hémoglobine) 2 protéases de 73 et 78 kda Notre étude 2 estomacs de chevaux sains, tués à l abattoir, rincés à l eau, conservés en glacière puis dissection de la muqueuse glandulaire Muqueuse broyée, mise en solution dans tampon P (2ml/g), homogénéisée 45 min par agitateur. Centrifugation g 60 min. Précipitation du surnageant au sulfate d ammonium à 35% de sat puis même centrifugation. Précipitation du surnageant à 80%, même centrifugation, dialyse et centrifugation 48000g 10 min 2 chromatographies par échanges d anions différentes puis 1 chromatographie par adsorption. SDS-PAGE Méthode protéolytique (albumine) 1protéase principale de 45 kda
87 Conclusion A partir de la muqueuse glandulaire de deux chevaux sains, nous avons isolé plusieurs protéases gastriques par des méthodes classiques de purification de protéines (mise en solution de la muqueuse, extraction, centrifugation, précipitation, dialyse, chromatographies, dosages des protéines et du pepsinogène à chaque étape, électrophorèse). Afin de confirmer qu une ou plusieurs de ces protéases sont du pepsinogène alors présent sous une ou plusieurs formes, un séquençage des acides aminés de l extrémité N-terminale de chacune de ces protéines est nécessaire. Parmi les poids moléculaires mesurés sur l ensemble des protéines isolées et d après les données obtenues à partir d autres espèces, le poids moléculaire le plus probable dans notre étude est de 45 kda. Cette donnée est proche (aux erreurs et à la précision de la mesure près) de celle notée dans l étude de Khittoo et Vermette (1991) dont l évaluation du poids moléculaire du pepsinogène s élève à 40 kda mais elle est éloignée de la valeur de 73 à 78 kda fournie par Sayegh en La finalité de ce travail est l élaboration d un test sanguin permettant de mesurer la pepsinogénémie dont la valeur serait le reflet de l intégrité de la muqueuse gastrique, comme cela a été montré dans d autres espèces mais qui reste encore à prouver chez le cheval. Cette méthode de diagnostic a l avantage d éviter des examens invasifs et coûteux tels que la gastroscopie et en particulier pour la mise en évidence des ulcères. Il convient alors d étudier les facteurs de variation au sein de l espèce équine : âge, sexe, race, état de réplétion de l estomac, interaction médicamenteuse puis, une fois l effet de ces facteurs quantifié, l attention pourra se porter sur l influence des différentes pathologies (ulcères gastroduodénaux, tumeur, parasitisme dans une moindre mesure). La différentiation des éventuelles formes de pepsinogène puis l étude de leur production pourrait apparaître profitable pour distinguer différentes atteintes gastriques, à l exemple de ce qui a été prouvé chez l homme (Korstanje et al., 2002)
88 Bibliographie ABRAMS G.D., BAKER B.L. The cytology and secretory activity of gastric zymogenic cells after ablation of ductless glands. Gastroenterology, 1954, 27, 462 (abstract). BABKIN B.P. Secretory mechanism of the digestive glands. 2 nd ed. New-York: Hoeber, BACHRACH W.H. On the question of a pituitary-adrenal component in the gastric secretory response to insulin hypoglycemia. Gastroenterology, 1963, 44, 178 (abstract). BARONE R. Estomac. In: Anatomie comparée des Mammifères domestiques. Tome 3 ème : splachnologie I : appareil digestif, appareil respiratoire. 2 nd ed., Paris : Editions Vigot, 1984, BEUGNET F. Le parasitisme interne des Equidés. Polycopié. Ecoles Nationales Vétérinaires de Nantes, de Toulouse et de Maisons-Alfort. 3 ème cycle professionnel court, dominante «pathologie équine», 2003, 62p. BENSLEY R.R. The gastric glands. In: COWDRY E.V., editor. Special cytology, Volume I, New-York: Hoeber, 1928, BLANSHARD G., ARABEHETY J.T., GRAY S.J. Gastric secretion and parathyroid function in rats. Am. J. Physiol., 1959, 196, BLUMENFELD O.O., PERLMANN G.E. The amino-acid composition of crystalline pepsin. J. Gen. Physiol., 1959, 42, BORG I., BORGSTROM S.G. Pepsin secretion and peptic ulcer. Acta Chir. Scand., 1963, 125, BOWIE D.J., VINEBERG A.M. The selective action of histamine and the effect of prolonged vagal stimulation on the cells of the gastric glands in the dog. Quart. J. Exptl. Physiol., 1935, 25, BUSSIERAS J., CHERMETTE R. Abrégé de parasitologie vétérinaire. Entomologie vétérinaire. (Tome IV). Polycopié. Ecole Nationale vétérinaire d Alfort, Unité pédagogique de parasitologie p. BUSSIERAS J., CHERMETTE R. Abrégé de parasitologie vétérinaire. Helminthologie vétérinaire. 2 ème édition (Tome III). Polycopié. Ecole Nationale vétérinaire d Alfort, Unité pédagogique de parasitologie p. BANGA-MBOKO H., GODEAU J.M., DRION P.V., SIDIKOU I.D., REMY B., BECKERS J.F. Evaluation de l utilisation du pepsinogène sanguin comme biomarqueur de l intégrité de la muqueuse gastrique chez le porc. 2. Méthodes de dosage et intérêt en pathologie porcine. Ann Méd. Vét., 2003, 147,
89 CHERET A.M., BONFILS S. Pepsine et pepsinogène. Origine, propriétés, préparation. Path. Biol., 1970, 18(5-6), CONCHA J., GUERRERO-FIGUEROA R., BRAVO I. Gastric pepsinogen secretion and blood catecholamines after posterior hypothalamic stimulation. Rev. Can. Biol., 1960, 19, CREAN G.P. The endocrine system and the stomach. Vitamine Hormone, 1963, 21, DALTON A. J. Electron micrography of epithelial cells of the gastrointestinal tract and pancreas. Am. J. Anat., 1951, 89, DAWSON A.B. Histological changes in the gastric mucosa (Pawlow Pouch) of the dog following irradiation. Am. J. Roentgenol., 1925, 13, DORNY P., VERCRUYSSE J. Evaluation of a micro-method for the routine determination of serum pepsinogen in cattle. Res. Vet. Sci., 1998, 65, DUKE W.W., HIRSCHOWITZ B.I., SACHS G. Vagal stimulation of gastric secretion in man by 2-desoxy-D-glucose. Lancet, 1965, 2, EYSKER M., JANSEN J., MIRCK M.H. Control of strongylosis in horses by alternate grazing of horses and sheep and some other aspects of the epidemiology of Strongylidae infections. Vet.Parasitol., 1986, 19, EYSKER M., JANSEN J., WEMMENHOVE R., MIRCK M.H. Alternate grazing of horses and sheep as control for gastro-intestinal helminthiasis in horses. Vet.Parasitol., 1983, 13, FATTAH F., GRIFFEN W.O., NICOLOFF D.M., CASTENEDA A., WANGENSTEEN O.H. Factors which effect release of pepsinogen granules from gastric tubules. Surgery, 1961, 49, FERGUSON D.J. The antral phase of gastric secretion before and after vagotomy. Experients on gastric pouch dogs. Surgery, 1963, 33, FRATTALI V., STEINER R.F., EDELHCH H. Native and unfolded states of pepsinogen. J. Biol. Chem., 1965, 240, FRIEDMAN M.H.F., MAGEE J.T., TELFER N., SANDWEISS D.J. Influence of growth hormone on gastric secretion. Am. J. Physiol., 1955, 183, 617 (abstract). GREGORY R.A., TRACY H.J. The preparation and properties of gastrin. J. Physiol., 1961, 156, GROSSMAN M.I. Integration of neurol acid hormonal control of gastric secretion. Physiologist, 1963, 6, HELANDER H.F. Ultrastructure of fundus glands of the mouse gastric mucosa. J. Ultrastruc. Res. Suppl, 1962, 4,
90 HELANDER H.F. Ultrastructure of gastric fundus glands of refed mice. J. Ultrastruc. Res., 1964, 10, HERRIOTT R.M. Pepsinogen and pepsin. J. Gen. Physiol., 1962, 45, HIRSCHOWITZ B.I. Secretion of pepsinogen. In: CODE C.F. editor. Handbook of physiology: a critical, comprehensive presentation of physiological knowledge and concepts. Section 6: alimentary canal. Volume II: secretion, Baltimore: Williams and Wilkins, 1967, IHRE B. J. Human gastric secretion. Acta Med. Scand. Suppl., 1938, 95, 1 (abstract). JIRGENSONS B. Optical rotation and viscosity of native and denatured proteins. Arch. Biochem. Biophys., 1958, 74, JUNQUIERA L.C.U., ROTHSCHIELD H.A., VUGMAN I. The action of atropine on pancreatic secretion. Brit. J. Pharmacol., 1958, 13, KERBOEUF D., KOCH C., LE DREAN E., LACOURT A. Méthode simplifiée de mesure de la concentration en pepsinogène dans le sérum. Revue Méd. Vét., 2002, 153, KHITOO G., VERMETTE L., NAPPERT G., LARIVIERE N. Isolation of a major form of pepsinogen from gastric mucosa of horses. Am. J. Vet. Res., 1991, 52(5), KORSTANJE A., DEN HARTOG G., BIEMOND I., LAMERS C.B.H.W. The serological gastric biopsy: a non-endoscopical diagnostic approach in management of the dyspeptic patient. Significance for primary care based on a survey of the literature. Scand. J. Gastroenterol., 2002, 37 (suppl 236), LEFRANCOIS T.,TIRET L. Physiologie de la digestion.2 nd éd. Polycopié. Ecole Nationale vétérinaire d Alfort, Unité pédagogique de physiologie p. LEVRAT M., LAMBERT R. Action de la réserpine sur la sécrétion gastrique chlorhydrique et peptique chez l homme. Arch. Maladies App. Digest., 1962, 51, LINDE S. The secretion of pepsin during the gastric phase of gastric secretion. Acta Physio. Scand., 1953, 28, LOWRY O.H., ROSEBROUGH N.J., FARR A.L., RANDALL R.J. Protein measurement with the folin phenol reagent. J. Biol. Chem., 1951, 193, Mc INTOSH I.W., DUTHIE H.L., FORREST P.M. The effect of an adrenal inhibitor (SU 4885) on gastric secretion in dogs. Gut, 1960, 1, MENZIES G. The effects of starvation and of feeding following starvation on the pepsinogen granules of the rat s stomach. J. Pathol. Bacteriol., 1962, 83,
91 MUELLER E., MOORE J.N., DIVERS T.J. Affections de l estomac. In : ORSINIJ.A., DIVERS T.J., editors. Urgences en médicine équine - Traitements et procédures, Paris: Editions Maloine, 2001, MURRAY M.J. Chapter 12 : Foal stomach and duodenum. In : TRAUB-DARGATZ J.L., BROWN C.M., editors. Equine endoscopy 2 nd ed., St Louis: Mosby-Year Book, 1997, MURRAY M.J., MURRAY C.M., SWEENEY H.J. et al. The prevalence of gastric ulcers in foals in Ireland and England: an endoscopic survey. Equine Vet. J. 1990, 22, 6-9. MURRAY M.J., SCHUSSER G.F., PIPERS F.S. et al. Factors associated with gastric lesions in thoroughbred race horse. Equine Vet. J. 1996, 28, O CONNOR M.S., STEINER J.M., ROUSSEL A.J. et al. Sucrose permeability testing as an indicator of gastric ulceration in horses. AAEP proceedings, 2003, 49, PHILPOT J. St. L., ERICKSSON-QUENSEL I.B. An ultracentrifugal study of crystalline pepsin. Nature, 1933, 132, POLINER J.J., SPIRO H.M. The independent secretion of acid, pepsin and intrinsic factor by the human stomach. Gastroenterology, 1958, 34, 196 (abstract). POLLAND W.S. The effect of atropine upon gastric secretion after histamine stimulation. J. Clin. Invest., 1931, 9, RIDER J.A., MOELLER H.C., ENGLAND M. Studies on gastric pepsin. Gastroenterology, 1961, 40, 690 (abstract). RYLE A.P. Pepsinogen B: the zymogen of pepsin B. Biochem. J., 1965, 96, RYLE A.P., PORTER R.R. Parapepsins; two proteolytic enzymes associated with porcine pepsin. Biochem. J., 1959, 73, SAYEGH A. I., ANDERSON N. V., HARDING J. W., CERPOVICZ P., DeBOWES R. M., RITTER R. C. et al. Purification of two equine pepsinogens by use of high-performance liquid chromatography. Am. J. Vet. Res., 1999, 60(1), SCHOFIELD B. The inhibition of pepsin output in separated gastric pouches in dogs following feeding, and its correlation with motility changes. Gastroenterology, 1959, 37, SCOTT I., STEAR M.J., McKELLAR Q.A. Comparison of four methods for the determination of plasma pepsinogen concentration. Res. Vet. Sc., 1995, 59, STRYER L. Exploration des protéines. In : La biochimie de Lubert Stryer. 3 ème éd., Paris : Flammarion médecine sciences, 1992,
92 SUCHODOLSKI J. S., STEINER J. M., RUAUX C.G., BOARI A., WILLIAMS D. A. Purification and partial characterisation of canine pepsinogen A and B. Am. J. Vet. Res., 2002, 63(11), SUCHODOLSKI J. S., STEINER J. M., RUAUX C.G., WILLIAMS D. A. Serum concentrations of pepsinogène A in healthy dogs after food deprivation and after feeding. Am. J. Vet. Res., 2003, 64(9), SUZUKI M., NARITA Y., ODA S., MORIYAMA A. et al. Purification and characterization of goat pepsinogens and pepsins. Comp. Biochem. Physiol., 1999, 122, TAMZALI Y. Les ulcères gastriques. Polycopié. Ecoles Nationales Vétérinaires de Nantes, de Toulouse et de Maisons-Alfort. 3 ème cycle professionnel court, dominante «pathologie équine», 2003, 20p. TANG J., WOLF S., CAPUTTO R., TRUCCO. Isolation and crystallization of gastricsin from human gastric juice. J. Biol. Chem., 1959, 234, TAYLOR W.H. Biochemistry of pepsins. In: CODE C.F. editor. Handbook of physiology: a critical, comprehensive presentation of physiological knowledge and concepts. Section 6: alimentary canal. Volume V: bile, digestion, ruminal physiology, Baltimore: Williams and Wilkins, 1968, TESSIER M., VIOLLET B., EGLY J.M. La précipitation des protéines. Le technoscope du futur, 1992, 54, TISELIUS A., HENSCHEN G.E., SVENSSON H. Electrophoresis of pepsin. Biochem. J., 1938, 32, TRESS U., STEINER J.M., RUAUX C.G., SUCHODOLSKI J.S., WILLIAMS D.A. Purification and partial characterisation of feline pepsinogène. Am. J. Vet. Res., 2004, 65(9), TURNER J.C., SHANKS V. An enzyme-linked immunoassay for pepsinogen in sheep plasma. Vet. Parasitol., 1982, 10, UVNÄS B. The part played by the pyloric region in the cephalic phase of gastric secretion. Acta Physiol. Scand., 1942, 13, VAN VANUKIS H., HERRIOTT R.M. Structural changes associated with the conversion of pepsinogen to pepsin. I. The N-terminal amino-acid residues of pepsin and pepsinogen. Biochim. Biophys. Acta, 1959, 23, VATISTAS N., SNYDER J.R., JOHNSON B. Chapter 13: Adult stomach and duodenum. In : TRAUB-DARGATZ J.L., BROWN C.M., editors. Equine endoscopy 2 nd ed., St Louis: Mosby-Year Book, 1997, VILLAEAL R. Pepsin secretion and synthesis in vitro. Proc. Soc. Exptl. Biol. Med., 1953, 83,
93 WADDELL A. H., Mc COSKER P. J. Serum pepsinogen concentrations in horses naturally infected with Trichostrongylus Axei. Aus. Vet. J., 1969, 45, WILSON J.H., PEARSON M.M. Serum pepsinogen levels in foals with gastric or duodenal ulcers. Equine Pract., 1986, 51,
Os Hyoïde. Cartilage thyroïde. Cartilage Cricoïde. Cartilage Trachéal. S ouvre à la déglutition et à l expiration
 MUSCULEUSE OESOPHAGIENNE : 1/3 supérieur : Musculeuse striée longitudinale (Paroi) + S.S.O 1/3 moyen : Musculeuse striée externe longitudinale + circulaire lisse interne 1/3 inférieur : Musculeuse circulaire
MUSCULEUSE OESOPHAGIENNE : 1/3 supérieur : Musculeuse striée longitudinale (Paroi) + S.S.O 1/3 moyen : Musculeuse striée externe longitudinale + circulaire lisse interne 1/3 inférieur : Musculeuse circulaire
TUTORAT UE 5 2012-2013 Anatomie Correction Séance n 6 Semaine du 11/03/2013
 TUTORAT UE 5 2012-2013 Anatomie Correction Séance n 6 Semaine du 11/03/2013 Appareil respiratoire-organogénèse de l appareil digestif Cours du Pr. PRUDHOMME Séance préparée par Anissa BARAKAT, Caroline
TUTORAT UE 5 2012-2013 Anatomie Correction Séance n 6 Semaine du 11/03/2013 Appareil respiratoire-organogénèse de l appareil digestif Cours du Pr. PRUDHOMME Séance préparée par Anissa BARAKAT, Caroline
Le reflux gastro-oesophagien (280) Professeur Jacques FOURNET Avril 2003
 Pré-Requis : Corpus Médical Faculté de Médecine de Grenoble Le reflux gastro-oesophagien (280) Professeur Jacques FOURNET Avril 2003 Sécrétion acide et peptique de l estomac Motricité œsophagienne et gastrique
Pré-Requis : Corpus Médical Faculté de Médecine de Grenoble Le reflux gastro-oesophagien (280) Professeur Jacques FOURNET Avril 2003 Sécrétion acide et peptique de l estomac Motricité œsophagienne et gastrique
LE LARYNX VUE ANTERIEURE DU LARYNX : Décembre 2007 Sources Étudiantes. Faculté de Médecine Montpellier-Nîmes
 LE LARYNX Le larynx est un conduit aérien qui joue un rôle essentiel dans la phonation mais aussi dans la respiration. Suite au larynx, se trouve la glotte, une zone rétrécie qui délimite les voies aériennes
LE LARYNX Le larynx est un conduit aérien qui joue un rôle essentiel dans la phonation mais aussi dans la respiration. Suite au larynx, se trouve la glotte, une zone rétrécie qui délimite les voies aériennes
L eau dans le corps. Fig. 6 L eau dans le corps. Cerveau 85 % Dents 10 % Cœur 77 % Poumons 80 % Foie 73 % Reins 80 % Peau 71 % Muscles 73 %
 24 L eau est le principal constituant du corps humain. La quantité moyenne d eau contenue dans un organisme adulte est de 65 %, ce qui correspond à environ 45 litres d eau pour une personne de 70 kilogrammes.
24 L eau est le principal constituant du corps humain. La quantité moyenne d eau contenue dans un organisme adulte est de 65 %, ce qui correspond à environ 45 litres d eau pour une personne de 70 kilogrammes.
ETUDE BIBLIOGRAPHIQUE DU BIEN-ÊTRE CHEZ LE CHEVAL
 ECOLE NATIONALE VETERINAIRE D ALFORT ANNEE 2003 ETUDE BIBLIOGRAPHIQUE DU BIEN-ÊTRE CHEZ LE CHEVAL THESE pour le DOCTORAT VETERINAIRE présentée et soutenue publiquement devant LA FACULTE DE MEDECINE DE
ECOLE NATIONALE VETERINAIRE D ALFORT ANNEE 2003 ETUDE BIBLIOGRAPHIQUE DU BIEN-ÊTRE CHEZ LE CHEVAL THESE pour le DOCTORAT VETERINAIRE présentée et soutenue publiquement devant LA FACULTE DE MEDECINE DE
Cavité buccale et système dentaire
 Cavité buccale et système dentaire I. Introduction La cavité buccale forme la 1 ère cavité du tube digestif. Les dents ont un rôle : Fonctionnel : mastication, déglutition, phonation Esthétique : expression
Cavité buccale et système dentaire I. Introduction La cavité buccale forme la 1 ère cavité du tube digestif. Les dents ont un rôle : Fonctionnel : mastication, déglutition, phonation Esthétique : expression
Anti-Inflammatoires Non stéroïdiens
 Pharmacologie Clinique des Anti-Inflammatoires Non stéroïdiens Effets indésirables Aude FERRAN Plan Toxicité digestive Ulcères» Physiopathologie : effets locaux et systémiques» Cas du cheval Augmentation
Pharmacologie Clinique des Anti-Inflammatoires Non stéroïdiens Effets indésirables Aude FERRAN Plan Toxicité digestive Ulcères» Physiopathologie : effets locaux et systémiques» Cas du cheval Augmentation
Infestation par Dipylidium caninum,
 Fiche technique n 24 Infestation par Dipylidium caninum, le téniasis félin à Dipylidium Parmi tous les vers qui peuvent infester le chat, Dipylidium caninum est un parasite fréquemment rencontré dans le
Fiche technique n 24 Infestation par Dipylidium caninum, le téniasis félin à Dipylidium Parmi tous les vers qui peuvent infester le chat, Dipylidium caninum est un parasite fréquemment rencontré dans le
Le cliché thoracique
 Le cliché thoracique Date de création du document 2008-2009 Table des matières * Introduction... 1 1 Nomenclature radiologique... 1 2 Le cliché thoracique de face... 2 2. 1 Qualité du cliché... 1 2. 2
Le cliché thoracique Date de création du document 2008-2009 Table des matières * Introduction... 1 1 Nomenclature radiologique... 1 2 Le cliché thoracique de face... 2 2. 1 Qualité du cliché... 1 2. 2
Dr E. CHEVRET UE2.1 2013-2014. Aperçu général sur l architecture et les fonctions cellulaires
 Aperçu général sur l architecture et les fonctions cellulaires I. Introduction II. Les microscopes 1. Le microscope optique 2. Le microscope à fluorescence 3. Le microscope confocal 4. Le microscope électronique
Aperçu général sur l architecture et les fonctions cellulaires I. Introduction II. Les microscopes 1. Le microscope optique 2. Le microscope à fluorescence 3. Le microscope confocal 4. Le microscope électronique
Chapitre II La régulation de la glycémie
 Chapitre II La régulation de la glycémie Glycémie : concentration de glucose dans le sang valeur proche de 1g/L Hypoglycémie : perte de connaissance, troubles de la vue, voire coma. Hyperglycémie chronique
Chapitre II La régulation de la glycémie Glycémie : concentration de glucose dans le sang valeur proche de 1g/L Hypoglycémie : perte de connaissance, troubles de la vue, voire coma. Hyperglycémie chronique
1- Parmi les affirmations suivantes, quelles sont les réponses vraies :
 1- Parmi les affirmations suivantes, quelles sont les réponses vraies : a. Les troubles fonctionnels digestifs sont définis par les critères de Paris b. En France, le syndrome de l intestin irritable touche
1- Parmi les affirmations suivantes, quelles sont les réponses vraies : a. Les troubles fonctionnels digestifs sont définis par les critères de Paris b. En France, le syndrome de l intestin irritable touche
Manuel d hygiène bucco-dentaire Destiné à la formation de prophylaxistes
 Manuel d hygiène bucco-dentaire Destiné à la formation de prophylaxistes élaboré pour le SDI par Graziella Secci hygiéniste dentaire [email protected] SDI 2006 / 2007; Ed. n 1 La cavité buccale - Anatomie
Manuel d hygiène bucco-dentaire Destiné à la formation de prophylaxistes élaboré pour le SDI par Graziella Secci hygiéniste dentaire [email protected] SDI 2006 / 2007; Ed. n 1 La cavité buccale - Anatomie
Le trajet des aliments dans l appareil digestif.
 La digestion. La digestion, c est la transformation des aliments en nutriments assimilables par l organisme. Dans le tube digestif, les aliments subissent une série de dégradations mécaniques et chimiques
La digestion. La digestion, c est la transformation des aliments en nutriments assimilables par l organisme. Dans le tube digestif, les aliments subissent une série de dégradations mécaniques et chimiques
La filtration glomérulaire et sa régulation
 UE3-2 - Physiologie rénale Chapitre 4 : La filtration glomérulaire et sa régulation Professeur Diane GODIN-RIBUOT Année universitaire 2010/2011 Université Joseph Fourier de Grenoble - Tous droits réservés.
UE3-2 - Physiologie rénale Chapitre 4 : La filtration glomérulaire et sa régulation Professeur Diane GODIN-RIBUOT Année universitaire 2010/2011 Université Joseph Fourier de Grenoble - Tous droits réservés.
Module digestif. II. Prévention du reflux gastro-œsophagien :
 Module digestif Pathologie œsophagique I. Rappel anatomique : Etendu de 15 à 40 cm des arcades dentaires. D environ 25 cm de long. Constitué de 2 types de muscles. Recouvert par une muqueuse malpighienne
Module digestif Pathologie œsophagique I. Rappel anatomique : Etendu de 15 à 40 cm des arcades dentaires. D environ 25 cm de long. Constitué de 2 types de muscles. Recouvert par une muqueuse malpighienne
La langue, constituant la majeure partie de la partie inférieure de la cavité orale,
 LES «ANNEXES» DE LA CAVITE ORALE La Langue La langue, constituant la majeure partie de la partie inférieure de la cavité orale, occupe l espace dans cette cavité orale, dans la concavité de l arche mandibulaire,
LES «ANNEXES» DE LA CAVITE ORALE La Langue La langue, constituant la majeure partie de la partie inférieure de la cavité orale, occupe l espace dans cette cavité orale, dans la concavité de l arche mandibulaire,
Chapitre 1 Œsophage. Embryologie
 Chapitre 1 Œsophage 1. Embryologie 2. Anatomie 3. Radioanatomie 4. Histologie 5. Physiologie œsophagienne 6. Sémiologie œsophagienne 7. Reflux gastro-œsophagien 8. Examen clinique d un patient consultant
Chapitre 1 Œsophage 1. Embryologie 2. Anatomie 3. Radioanatomie 4. Histologie 5. Physiologie œsophagienne 6. Sémiologie œsophagienne 7. Reflux gastro-œsophagien 8. Examen clinique d un patient consultant
SUPPLÉMENT AU DIPLÔME D ETUDES FONDAMENTALES VETERINAIRES Supplément n 2012-01 Délivré par l INP-Ecole Nationale Vétérinaire de Toulouse
 SUPPLÉMENT AU DIPLÔME D ETUDES FONDAMENTALES VETERINAIRES Supplément n 2012-01 Délivré par l INP-Ecole Nationale Vétérinaire de Toulouse Le présent supplément au diplôme suit le modèle élaboré par la Commission
SUPPLÉMENT AU DIPLÔME D ETUDES FONDAMENTALES VETERINAIRES Supplément n 2012-01 Délivré par l INP-Ecole Nationale Vétérinaire de Toulouse Le présent supplément au diplôme suit le modèle élaboré par la Commission
LASER DOPPLER. Cependant elle n est pas encore utilisée en routine mais reste du domaine de la recherche et de l évaluation.
 LASER DOPPLER INTRODUCTION La technique qui utilise l effet Doppler à partir d un faisceau laser est l une des seules qui permette d enregistrer en continu le reflet de la perfusion superficielle de tissus
LASER DOPPLER INTRODUCTION La technique qui utilise l effet Doppler à partir d un faisceau laser est l une des seules qui permette d enregistrer en continu le reflet de la perfusion superficielle de tissus
1ST2S Biophysiopathologie : Motricité et système nerveux. 2012-2013. La physiologie neuro-musculaire :
 La physiologie neuro-musculaire : Introduction : Le neurone possède 3 propriétés indispensables pour assurer sa fonction au sein de l organisme : -l excitabilité : capacité à répondre à un stimulus -la
La physiologie neuro-musculaire : Introduction : Le neurone possède 3 propriétés indispensables pour assurer sa fonction au sein de l organisme : -l excitabilité : capacité à répondre à un stimulus -la
PARTIE II : RISQUE INFECTIEUX ET PROTECTION DE L ORGANISME. Chapitre 1 : L Homme confronté aux microbes de son environnement
 PARTIE II : RISQUE INFECTIEUX ET PROTECTION DE L ORGANISME Chapitre 1 : L Homme confronté aux microbes de son environnement I- Les microbes dans notre environnement Qu est-ce qu un microbe? Où se trouvent-ils?
PARTIE II : RISQUE INFECTIEUX ET PROTECTION DE L ORGANISME Chapitre 1 : L Homme confronté aux microbes de son environnement I- Les microbes dans notre environnement Qu est-ce qu un microbe? Où se trouvent-ils?
La fonction respiratoire
 La fonction respiratoire Introduction Fonction vitale : Au-delà de 3 min = atteintes graves Après 5 min = très altérés On parle de 3 phénomènes : Ventilation : respiration visible, échanges aériens intérieur
La fonction respiratoire Introduction Fonction vitale : Au-delà de 3 min = atteintes graves Après 5 min = très altérés On parle de 3 phénomènes : Ventilation : respiration visible, échanges aériens intérieur
Mieux informé sur la maladie de reflux
 Information destinée aux patients Mieux informé sur la maladie de reflux Les médicaments à l arc-en-ciel Mise à jour de l'information: septembre 2013 «Maladie de reflux» Maladie de reflux La maladie de
Information destinée aux patients Mieux informé sur la maladie de reflux Les médicaments à l arc-en-ciel Mise à jour de l'information: septembre 2013 «Maladie de reflux» Maladie de reflux La maladie de
ANTICORPS POLYCLONAUX ANTI IMMUNOGLOBULINES
 L OUTIL IDEAL POUR TOUTES LES DETECTIONS IMMUNOCHIMIQUES pour toutes les techniques immunodosages (EIA/ELISA) dot/ westernblot immunohistochimie immunocytochimie cytométrie en flux quel que soit le système
L OUTIL IDEAL POUR TOUTES LES DETECTIONS IMMUNOCHIMIQUES pour toutes les techniques immunodosages (EIA/ELISA) dot/ westernblot immunohistochimie immunocytochimie cytométrie en flux quel que soit le système
Transport des gaz dans le sang
 UE3-2 - Physiologie Physiologie Respiratoire Chapitre 9 : Transport des gaz dans le sang Docteur Sandrine LAUNOIS-ROLLINAT Année universitaire 2010/2011 Université Joseph Fourier de Grenoble - Tous droits
UE3-2 - Physiologie Physiologie Respiratoire Chapitre 9 : Transport des gaz dans le sang Docteur Sandrine LAUNOIS-ROLLINAT Année universitaire 2010/2011 Université Joseph Fourier de Grenoble - Tous droits
Les Animaux habitent presque toutes les parties de la biosphère. La structure et la fonction chez les Animaux : principes fondamentaux.
 40 La structure et la fonction chez les Animaux : principes fondamentaux Concepts clés- 40.1 Les lois de la physique et le milieu régissent la taille et la forme des Animaux 40.2 Il y a une corrélation
40 La structure et la fonction chez les Animaux : principes fondamentaux Concepts clés- 40.1 Les lois de la physique et le milieu régissent la taille et la forme des Animaux 40.2 Il y a une corrélation
AMINES BIOGENIQUES. Dopamine/Noradrénaline/Adrénaline (CATECHOLAMINES) Sérotonine/Histamine/Dopamine
 AMINES BIOGENIQUES Dopamine/Noradrénaline/Adrénaline (CATECHOLAMINES) Sérotonine/Histamine/Dopamine Effets physiologiques des bioamines via le systeme nerveux autonome Cardiovasculaire: Augmentation du
AMINES BIOGENIQUES Dopamine/Noradrénaline/Adrénaline (CATECHOLAMINES) Sérotonine/Histamine/Dopamine Effets physiologiques des bioamines via le systeme nerveux autonome Cardiovasculaire: Augmentation du
LA QUESTION DE LA PRISE DE POIDS CHEZ LE FUMEUR EN SEVRAGE TABAGIQUE
 Jean-Paul BLANC Diététicien-Nutritionniste Neuilly sur Seine www.cabinet-de-nutrition-et-dietetique.eu LA QUESTION DE LA PRISE DE POIDS CHEZ LE FUMEUR EN SEVRAGE TABAGIQUE Au cours de la dernière décennie
Jean-Paul BLANC Diététicien-Nutritionniste Neuilly sur Seine www.cabinet-de-nutrition-et-dietetique.eu LA QUESTION DE LA PRISE DE POIDS CHEZ LE FUMEUR EN SEVRAGE TABAGIQUE Au cours de la dernière décennie
Conduite à tenir devant une morsure de chien (213b) Professeur Jacques LEBEAU Novembre 2003 (Mise à jour mars 2005)
 Conduite à tenir devant une morsure de chien (213b) Professeur Jacques LEBEAU Novembre 2003 (Mise à jour mars 2005) Pré-Requis : Anatomie faciale Principes de traitement des plaies Principes d'antibiothérapie
Conduite à tenir devant une morsure de chien (213b) Professeur Jacques LEBEAU Novembre 2003 (Mise à jour mars 2005) Pré-Requis : Anatomie faciale Principes de traitement des plaies Principes d'antibiothérapie
schémas du by-pass gastrique pour obésité morbide
 Femme de 58 ans, opérée d un by-pass gastrique 2 ans auparavant. Depuis 10jours, nausées et vomissements. Quels sont les éléments sémiologiques significatifs à retenir sur ls images scanographiques après
Femme de 58 ans, opérée d un by-pass gastrique 2 ans auparavant. Depuis 10jours, nausées et vomissements. Quels sont les éléments sémiologiques significatifs à retenir sur ls images scanographiques après
Informations sur le cancer de l intestin
 Informations sur le cancer de l intestin Le cancer de l intestin fait partie des affections malignes les plus fréquentes et représente la deuxième cause de mortalité par cancer en Suisse. Cette maladie
Informations sur le cancer de l intestin Le cancer de l intestin fait partie des affections malignes les plus fréquentes et représente la deuxième cause de mortalité par cancer en Suisse. Cette maladie
Liste des matières enseignées
 Liste des matières enseignées Domaine : Sciences de la Nature et de la Vie Filière : Biologie Parcours : Tronc Commun Semestre1 VHG Coefficient Cours TD/TP Crédits/s. unité crédits U.E fondamental : 13
Liste des matières enseignées Domaine : Sciences de la Nature et de la Vie Filière : Biologie Parcours : Tronc Commun Semestre1 VHG Coefficient Cours TD/TP Crédits/s. unité crédits U.E fondamental : 13
DOSSIER D'INSCRIPTION
 CENTRE HOSPITALIER UNIVERSITAIRE DE NICE ECOLE D' INFIRMIERS ANESTHESISTES CONCOURS D ENTREE DOSSIER D'INSCRIPTION DATE LIMITE DE DEPOT LE DERNIER JOUR OUVRABLE DU MOIS DE MARS ANNEE N ECOLE INFIRMIERS
CENTRE HOSPITALIER UNIVERSITAIRE DE NICE ECOLE D' INFIRMIERS ANESTHESISTES CONCOURS D ENTREE DOSSIER D'INSCRIPTION DATE LIMITE DE DEPOT LE DERNIER JOUR OUVRABLE DU MOIS DE MARS ANNEE N ECOLE INFIRMIERS
IRM du Cancer du Rectum
 IRM du Cancer du Rectum quels CHOIX TECHNIQUES pour quels OBJECTIFS THERAPEUTIQUES? Frank Boudghène, T. Andre, A. Stivalet, I. Frey, L. Paslaru, V. Ganthier, M. Tassart Hopital Tenon - Université Paris
IRM du Cancer du Rectum quels CHOIX TECHNIQUES pour quels OBJECTIFS THERAPEUTIQUES? Frank Boudghène, T. Andre, A. Stivalet, I. Frey, L. Paslaru, V. Ganthier, M. Tassart Hopital Tenon - Université Paris
Transport des gaz dans le sang
 UE3-2 - Physiologie Physiologie Respiratoire Chapitre 9 : Transport des gaz dans le sang Docteur Sandrine LAUNOIS-ROLLINAT Année universitaire 2011/2012 Université Joseph Fourier de Grenoble - Tous droits
UE3-2 - Physiologie Physiologie Respiratoire Chapitre 9 : Transport des gaz dans le sang Docteur Sandrine LAUNOIS-ROLLINAT Année universitaire 2011/2012 Université Joseph Fourier de Grenoble - Tous droits
Troubles d ingestion, de digestion, d absorption et d élimination
 Chapter.indd 250 4/10/11 5:46 PM PARTIE 10 Troubles d ingestion, de digestion, d absorption et d élimination CHAPITRE Évaluation clinique Système gastro-intestinal......... 252 CHAPITRE 54 Interventions
Chapter.indd 250 4/10/11 5:46 PM PARTIE 10 Troubles d ingestion, de digestion, d absorption et d élimination CHAPITRE Évaluation clinique Système gastro-intestinal......... 252 CHAPITRE 54 Interventions
Tuberculose bovine. Situation actuelle
 Tuberculose bovine Situation actuelle 21 mai 2013 Dr G. Peduto Vétérinaire cantonal Service de la consommation et des affaires vétérinaires 1 Tuberculose bovine La Suisse est indemne depuis 1959 Dernier
Tuberculose bovine Situation actuelle 21 mai 2013 Dr G. Peduto Vétérinaire cantonal Service de la consommation et des affaires vétérinaires 1 Tuberculose bovine La Suisse est indemne depuis 1959 Dernier
Utilisation des substrats énergétiques
 Utilisation des substrats énergétiques Collège des Enseignants de Nutrition Date de création du document 2010-2011 Table des matières I Les organes et les substrats... 3 I.1 Les substrats énergétiques...
Utilisation des substrats énergétiques Collège des Enseignants de Nutrition Date de création du document 2010-2011 Table des matières I Les organes et les substrats... 3 I.1 Les substrats énergétiques...
Articulations du coude et de l avant-bras
 Articulations du coude et de l avant-bras 1 Articulation du coude 1.1 Définition Le coude est l articulation intermédiaire du membre supérieur. Elle comprend trois articulations distinctes entre l humérus,
Articulations du coude et de l avant-bras 1 Articulation du coude 1.1 Définition Le coude est l articulation intermédiaire du membre supérieur. Elle comprend trois articulations distinctes entre l humérus,
GUIDE D INFORMATIONS A LA PREVENTION DE L INSUFFISANCE RENALE
 GUIDE D INFORMATIONS A LA PREVENTION DE L INSUFFISANCE RENALE SOURCES : ligues reins et santé A LA BASE, TOUT PART DES REINS Organes majeurs de l appareil urinaire, les reins permettent d extraire les
GUIDE D INFORMATIONS A LA PREVENTION DE L INSUFFISANCE RENALE SOURCES : ligues reins et santé A LA BASE, TOUT PART DES REINS Organes majeurs de l appareil urinaire, les reins permettent d extraire les
Sciences de la vie et de la Terre
 Sciences de la vie et de la Terre Thème 2 B Enjeux planétaires contemporains - La plante domestiquée Table des matières 1 : La plante cultivée : le Maïs...Erreur! Signet non défini. 2 : Les variétés de
Sciences de la vie et de la Terre Thème 2 B Enjeux planétaires contemporains - La plante domestiquée Table des matières 1 : La plante cultivée : le Maïs...Erreur! Signet non défini. 2 : Les variétés de
Information génétique
 chapitre 3 Information génétique et division cellulaire L étude de la division cellulaire est abordée pour découvrir comment est transmise et conservée l information génétique portée par les chromosomes.
chapitre 3 Information génétique et division cellulaire L étude de la division cellulaire est abordée pour découvrir comment est transmise et conservée l information génétique portée par les chromosomes.
La Dysplasie Ventriculaire Droite Arythmogène
 1 La Dysplasie Ventriculaire Droite Arythmogène Document rédigé par l équipe pluridisciplinaire du centre de référence pour les maladies cardiaques héréditaires (Paris), en collaboration avec des patients
1 La Dysplasie Ventriculaire Droite Arythmogène Document rédigé par l équipe pluridisciplinaire du centre de référence pour les maladies cardiaques héréditaires (Paris), en collaboration avec des patients
Les vers de nos compagnons
 Les vers de nos compagnons Il se peut que votre animal de compagnie soit contaminé par des vers sans que vous ne vous en rendiez compte. Près d'un animal de compagnie sur deux (chat et chien) est porteur
Les vers de nos compagnons Il se peut que votre animal de compagnie soit contaminé par des vers sans que vous ne vous en rendiez compte. Près d'un animal de compagnie sur deux (chat et chien) est porteur
Les différentes maladies du coeur
 Auteur : Dr Pascal AMEDRO Les différentes maladies du coeur 1. Le cœur normal L oxygène capté dans l air va dans les poumons, où le sang «bleu» est alors oxygéné et devient «rouge». Il est conduit par
Auteur : Dr Pascal AMEDRO Les différentes maladies du coeur 1. Le cœur normal L oxygène capté dans l air va dans les poumons, où le sang «bleu» est alors oxygéné et devient «rouge». Il est conduit par
Les grands syndromes. Endoscopie trachéo-bronchique. Professeur D. ANTHOINE CHU de NANCY
 Les grands syndromes Endoscopie trachéo-bronchique Professeur D. ANTHOINE CHU de NANCY 1 Endoscopie souple avec pince et brosse (fibroscopie) 2 Endoscopie Arbre bronchique normal Bifurcation trachéobronchique
Les grands syndromes Endoscopie trachéo-bronchique Professeur D. ANTHOINE CHU de NANCY 1 Endoscopie souple avec pince et brosse (fibroscopie) 2 Endoscopie Arbre bronchique normal Bifurcation trachéobronchique
Chapitre 2 : Respiration, santé et environnement.
 Chapitre 2 : Respiration, santé et environnement. Rappels : L air qui nous entoure contient 3 gaz principaux: 71% d azote, 21% d oxygène, 0,03 % de CO2 et quelques gaz rares. L eau de chaux se trouble
Chapitre 2 : Respiration, santé et environnement. Rappels : L air qui nous entoure contient 3 gaz principaux: 71% d azote, 21% d oxygène, 0,03 % de CO2 et quelques gaz rares. L eau de chaux se trouble
«Peut-on jeûner sans risque pour la santé?»
 Le FIGARO du 21/10/2013, page 13 : Cet article est un document culturel qui témoigne à quel degré l establishment médical français ignore le jeûne. À mettre au frigo, pour le ressortir le jour où l'essai
Le FIGARO du 21/10/2013, page 13 : Cet article est un document culturel qui témoigne à quel degré l establishment médical français ignore le jeûne. À mettre au frigo, pour le ressortir le jour où l'essai
Biochimie I. Extraction et quantification de l hexokinase dans Saccharomyces cerevisiae 1. Assistants : Tatjana Schwabe Marcy Taylor Gisèle Dewhurst
 Biochimie I Extraction et quantification de l hexokinase dans Saccharomyces cerevisiae 1 Daniel Abegg Sarah Bayat Alexandra Belfanti Assistants : Tatjana Schwabe Marcy Taylor Gisèle Dewhurst Laboratoire
Biochimie I Extraction et quantification de l hexokinase dans Saccharomyces cerevisiae 1 Daniel Abegg Sarah Bayat Alexandra Belfanti Assistants : Tatjana Schwabe Marcy Taylor Gisèle Dewhurst Laboratoire
IMMUNOLOGIE. La spécificité des immunoglobulines et des récepteurs T. Informations scientifiques
 IMMUNOLOGIE La spécificité des immunoglobulines et des récepteurs T Informations scientifiques L infection par le VIH entraîne des réactions immunitaires de l organisme qui se traduisent par la production
IMMUNOLOGIE La spécificité des immunoglobulines et des récepteurs T Informations scientifiques L infection par le VIH entraîne des réactions immunitaires de l organisme qui se traduisent par la production
Séquence 1. Glycémie et diabète. Sommaire
 Séquence 1 Glycémie et diabète Sommaire 1. Prérequis 2. La régulation de la glycémie 3. Le diabète 4. Synthè se 5. Glossaire 6. Exercices Exercices d apprentissage du chapitre 2 Exercices d apprentissage
Séquence 1 Glycémie et diabète Sommaire 1. Prérequis 2. La régulation de la glycémie 3. Le diabète 4. Synthè se 5. Glossaire 6. Exercices Exercices d apprentissage du chapitre 2 Exercices d apprentissage
Cellules procaryotes Service histologie Pr.k.mebarek
 Cellules procaryotes Service histologie Pr.k.mebarek I) Les cellules procaryotes II) Les cellules eucaryotes o 1) Caractéristiques générales des cellules eucaryotes o 2) Organisation des cellules eucaryotes
Cellules procaryotes Service histologie Pr.k.mebarek I) Les cellules procaryotes II) Les cellules eucaryotes o 1) Caractéristiques générales des cellules eucaryotes o 2) Organisation des cellules eucaryotes
Prolapsus génital et incontinence urinaire chez la femme Professeur Pierre BERNARD Septembre 2002
 Prolapsus génital et incontinence urinaire chez la femme Professeur Pierre BERNARD Septembre 2002 Pré-Requis : Connaissance de bases : Anatomie du pelvis Classification des troubles de la statique génitale
Prolapsus génital et incontinence urinaire chez la femme Professeur Pierre BERNARD Septembre 2002 Pré-Requis : Connaissance de bases : Anatomie du pelvis Classification des troubles de la statique génitale
dos La qualité au service de votre santé Avenue Vinet 30 1004 Lausanne - Suisse p r e n d r e s o i n d e s o n
 dos p r e n d r e s o i n d e s o n Avenue Vinet 30 1004 Lausanne - Suisse La qualité au service de votre santé Cette information, éditée par l Institut de physiothérapie de la Clinique de La Source, vous
dos p r e n d r e s o i n d e s o n Avenue Vinet 30 1004 Lausanne - Suisse La qualité au service de votre santé Cette information, éditée par l Institut de physiothérapie de la Clinique de La Source, vous
Dracunculose Association Française des Enseignants de Parasitologie et Mycologie (ANOFEL)
 Dracunculose Association Française des Enseignants de Parasitologie et Mycologie (ANOFEL) 2014 1 Table des matières Introduction... 3 1. Historique et actualité... 3 2. Agent pathogène et cycle... 4 3.
Dracunculose Association Française des Enseignants de Parasitologie et Mycologie (ANOFEL) 2014 1 Table des matières Introduction... 3 1. Historique et actualité... 3 2. Agent pathogène et cycle... 4 3.
Conseils aux patients* Lutter activement. *pour les patients ayant subi une opération de remplacement de la hanche ou du genou
 Conseils aux patients* Lutter activement contre la thrombose *pour les patients ayant subi une opération de remplacement de la hanche ou du genou 2 Mentions légales Directeur de la publication : Bayer
Conseils aux patients* Lutter activement contre la thrombose *pour les patients ayant subi une opération de remplacement de la hanche ou du genou 2 Mentions légales Directeur de la publication : Bayer
Les tests génétiques à des fins médicales
 Les tests génétiques à des fins médicales Les tests génétiques à des fins médicales Nous avons tous hérité d une combinaison unique de gènes de la part de nos parents. Cette constitution originale et l
Les tests génétiques à des fins médicales Les tests génétiques à des fins médicales Nous avons tous hérité d une combinaison unique de gènes de la part de nos parents. Cette constitution originale et l
ATELIER SANTE PREVENTION N 2 : L ALIMENTATION
 ATELIER SANTE PREVENTION N 2 : L ALIMENTATION Mardi 24 janvier 2012 au Centre de Formation Multimétiers de REIGNAC L objectif de cet atelier sur la santé est de guider chacun vers une alimentation plus
ATELIER SANTE PREVENTION N 2 : L ALIMENTATION Mardi 24 janvier 2012 au Centre de Formation Multimétiers de REIGNAC L objectif de cet atelier sur la santé est de guider chacun vers une alimentation plus
des banques pour la recherche
 ADN, cellules, tissus... des banques pour la recherche FÉVRIER 2009 Les banques d échantillons de matériel biologique (tissus, cellules, ADN ), appelées biobanques, mettent à disposition des chercheurs
ADN, cellules, tissus... des banques pour la recherche FÉVRIER 2009 Les banques d échantillons de matériel biologique (tissus, cellules, ADN ), appelées biobanques, mettent à disposition des chercheurs
SKW. Les enzymes dans la technologie des détergents. Schweizerischer Kosmetikund Waschmittelverband
 SKW Schweizerischer Kosmetikund Waschmittelverband Association suisse des cosmétiques et des détergents The Swiss Cosmetic and Detergent Association Les enzymes dans la technologie des détergents Les enzymes
SKW Schweizerischer Kosmetikund Waschmittelverband Association suisse des cosmétiques et des détergents The Swiss Cosmetic and Detergent Association Les enzymes dans la technologie des détergents Les enzymes
Cancer de l'œsophage. Comprendre le diagnostic. Le cancer : une lutte à finir 1 888 939-3333 www.cancer.ca
 Cancer de l'œsophage Comprendre le diagnostic Le cancer : une lutte à finir 1 888 939-3333 www.cancer.ca Cancer de l'œsophage Comprendre le diagnostic Vous venez d apprendre que vous avez un cancer Une
Cancer de l'œsophage Comprendre le diagnostic Le cancer : une lutte à finir 1 888 939-3333 www.cancer.ca Cancer de l'œsophage Comprendre le diagnostic Vous venez d apprendre que vous avez un cancer Une
TECHNIQUES: Principes de la chromatographie
 TECHNIQUES: Principes de la chromatographie 1 Définition La chromatographie est une méthode physique de séparation basée sur les différentes affinités d un ou plusieurs composés à l égard de deux phases
TECHNIQUES: Principes de la chromatographie 1 Définition La chromatographie est une méthode physique de séparation basée sur les différentes affinités d un ou plusieurs composés à l égard de deux phases
LA CHOLÉCYSTECTOMIE PAR LAPAROSCOPIE
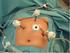 LA CHOLÉCYSTECTOMIE PAR LAPAROSCOPIE Une technique chirurgicale Pour vous, pour la vie Qu est-ce que la cholécystectomie? C est l intervention chirurgicale pratiquée pour enlever la vésicule biliaire.
LA CHOLÉCYSTECTOMIE PAR LAPAROSCOPIE Une technique chirurgicale Pour vous, pour la vie Qu est-ce que la cholécystectomie? C est l intervention chirurgicale pratiquée pour enlever la vésicule biliaire.
MAB Solut. vos projets. MABLife Génopole Campus 1 5 rue Henri Desbruères 91030 Evry Cedex. www.mabsolut.com. intervient à chaque étape de
 Mabsolut-DEF-HI:Mise en page 1 17/11/11 17:45 Page1 le département prestataire de services de MABLife de la conception à la validation MAB Solut intervient à chaque étape de vos projets Création d anticorps
Mabsolut-DEF-HI:Mise en page 1 17/11/11 17:45 Page1 le département prestataire de services de MABLife de la conception à la validation MAB Solut intervient à chaque étape de vos projets Création d anticorps
Qu est-ce que la PACES?
 Qu est-ce que la PACES? Depuis la rentrée 2010, et selon l arrêté du 28 octobre 2009 publié au journal offi ciel du 17 novembre 2009, les premières années de médecine et de pharmacie, ainsi que celles
Qu est-ce que la PACES? Depuis la rentrée 2010, et selon l arrêté du 28 octobre 2009 publié au journal offi ciel du 17 novembre 2009, les premières années de médecine et de pharmacie, ainsi que celles
Correction TP 7 : L organisation de la plante et ses relations avec le milieu
 Correction TP 7 : L organisation de la plante et ses relations avec le milieu (TP multiposte : groupes de 4 élèves qui se répartissent sur les 4 postes une fois chaque poste travaillé, un bilan sera établi
Correction TP 7 : L organisation de la plante et ses relations avec le milieu (TP multiposte : groupes de 4 élèves qui se répartissent sur les 4 postes une fois chaque poste travaillé, un bilan sera établi
LES ASPECTS MEDICAUX DE L ALIMENTATION CHEZ LA PERSONNE POLYHANDICAPEE
 31 août au 2 septembre 2009 6ème Congrès suisse de pédagogie spécialisée à l'uni Tobler, Berne Ouvrir l horizon Standardisation et différenciation en pédagogie spécialisée LES ASPECTS MEDICAUX DE L ALIMENTATION
31 août au 2 septembre 2009 6ème Congrès suisse de pédagogie spécialisée à l'uni Tobler, Berne Ouvrir l horizon Standardisation et différenciation en pédagogie spécialisée LES ASPECTS MEDICAUX DE L ALIMENTATION
L univers vivant De la cellule à l être humain
 L univers vivant De la cellule à l être humain La cellule humaine Voir : http://www.biologieenflash.net/sommaire.html Voir : http://fr.wikipedia.org/ La cellule humaine Unité de base de tous les êtres
L univers vivant De la cellule à l être humain La cellule humaine Voir : http://www.biologieenflash.net/sommaire.html Voir : http://fr.wikipedia.org/ La cellule humaine Unité de base de tous les êtres
Table des matières. Remerciements...v. Préface... vii. Avant-propos... xi. Mode d utilisation du manuel et du DVD... xv
 Remerciements...v Préface... vii Avant-propos... xi Mode d utilisation du manuel et du DVD... xv Nomenclature française traditionnelle et terminologie anatomique officielle...xvii Table des matières...
Remerciements...v Préface... vii Avant-propos... xi Mode d utilisation du manuel et du DVD... xv Nomenclature française traditionnelle et terminologie anatomique officielle...xvii Table des matières...
STRUCTURE ET FONCTION DES PLURICELLULAIRES
 Plan de cours STRUCTURE ET FONCTION DES PLURICELLULAIRES 101-FYA-PT Pondération 3-1-2 Gilles Bourbonnais (C360) [email protected] Sciences de la Nature / PASC@L http://ici.cegep-ste-foy.qc.ca/profs/gbourbonnais/
Plan de cours STRUCTURE ET FONCTION DES PLURICELLULAIRES 101-FYA-PT Pondération 3-1-2 Gilles Bourbonnais (C360) [email protected] Sciences de la Nature / PASC@L http://ici.cegep-ste-foy.qc.ca/profs/gbourbonnais/
Exercices pour renforcer les muscles abdominaux après l accouchement
 Exercices pour renforcer les muscles abdominaux après l accouchement Pendant la grossesse, les muscles du ventre, appelés abdominaux, s étirent beaucoup et perdent souvent de la force. Il est important
Exercices pour renforcer les muscles abdominaux après l accouchement Pendant la grossesse, les muscles du ventre, appelés abdominaux, s étirent beaucoup et perdent souvent de la force. Il est important
2015-2016. Médecine Pharmacie Dentaire Sage-femme ANNÉE UNIVERSIT AIRE
 Médecine Pharmacie Dentaire Sage-femme ANNÉE UNIVERSIT AIRE 2015-2016 SudMédical Montpellier-Nîmes Établissement d Enseignement Supérieur Privé Espace Saint-Charles - 300, rue Auguste Broussonnet - 34090
Médecine Pharmacie Dentaire Sage-femme ANNÉE UNIVERSIT AIRE 2015-2016 SudMédical Montpellier-Nîmes Établissement d Enseignement Supérieur Privé Espace Saint-Charles - 300, rue Auguste Broussonnet - 34090
L ALCOOL ET LE CORPS HUMAIN
 L ALCOOL ET LE CORPS HUMAIN TABLE DES MATIÈRES Présentation 1 L alcool, différent des autres aliments 2 Différent au moment de l absorption 3 Différent au moment de l élimination 4 Différent dans les conséquences
L ALCOOL ET LE CORPS HUMAIN TABLE DES MATIÈRES Présentation 1 L alcool, différent des autres aliments 2 Différent au moment de l absorption 3 Différent au moment de l élimination 4 Différent dans les conséquences
Médecine ostéopathique. L oesophage et l estomac. Luc Peeters & Grégoire Lason
 Médecine ostéopathique L oesophage et l estomac Luc Peeters & Grégoire Lason L oesophage et l estomac Luc Peeters & Grégoire Lason Copyright par Osteo 2000 sprl 2015. Aucun élément de cette édition ne
Médecine ostéopathique L oesophage et l estomac Luc Peeters & Grégoire Lason L oesophage et l estomac Luc Peeters & Grégoire Lason Copyright par Osteo 2000 sprl 2015. Aucun élément de cette édition ne
Chapitre 7: Dynamique des fluides
 Chapitre 7: Dynamique des fluides But du chapitre: comprendre les principes qui permettent de décrire la circulation sanguine. Ceci revient à étudier la manière dont les fluides circulent dans les tuyaux.
Chapitre 7: Dynamique des fluides But du chapitre: comprendre les principes qui permettent de décrire la circulation sanguine. Ceci revient à étudier la manière dont les fluides circulent dans les tuyaux.
Domaine : Sciences, Technologies et Santé Mention : Nutrition, Sciences des aliments, Agroalimentaire
 Contexte Domaine : Sciences, Technologies et Santé Mention : Nutrition, Sciences des aliments, Agroalimentaire Fédération des spécialités de Master des 5 pôles universitaires partenaires de la région Nord-Pas-de-Calais
Contexte Domaine : Sciences, Technologies et Santé Mention : Nutrition, Sciences des aliments, Agroalimentaire Fédération des spécialités de Master des 5 pôles universitaires partenaires de la région Nord-Pas-de-Calais
Pseudotumor cerebri. Anatomie Le cerveau et la moelle épinière baignent dans un liquide clair, appelé le liquide céphalo-rachidien (LCR).
 Hypertension intracrânienne idiopathique Pseudotumor cerebri Votre médecin pense que vous pouvez souffrir d hypertension intracrânienne idiopathique connue aussi sous le nom de «pseudotumeur cérébrale».
Hypertension intracrânienne idiopathique Pseudotumor cerebri Votre médecin pense que vous pouvez souffrir d hypertension intracrânienne idiopathique connue aussi sous le nom de «pseudotumeur cérébrale».
Conférence technique internationale de la FAO
 Décembre 2009 ABDC-10/7.2 F Conférence technique internationale de la FAO Biotechnologies agricoles dans les pays en développement: choix et perspectives pour les cultures, les forêts, l élevage, les pêches
Décembre 2009 ABDC-10/7.2 F Conférence technique internationale de la FAO Biotechnologies agricoles dans les pays en développement: choix et perspectives pour les cultures, les forêts, l élevage, les pêches
Comprendre l efflorescence
 Février 2006 Bulletin technique 4 BULLETIN TECHNIQUE Le Conseil Canadien des Systèmes d Isolation et de Finition Extérieure (SIFE) / (416) 499-4000 Comprendre l efflorescence Nous avons tous déjà observé
Février 2006 Bulletin technique 4 BULLETIN TECHNIQUE Le Conseil Canadien des Systèmes d Isolation et de Finition Extérieure (SIFE) / (416) 499-4000 Comprendre l efflorescence Nous avons tous déjà observé
Faculté des Sciences d ORSAY
 Université Paris-Sud 11 Faculté des Sciences d ORSAY Personnes ressources des disciplines représentées : Département de Biologie Vice-Président : Hervé DANIEL Secrétaire : Malika DERRAS Université Paris-Sud
Université Paris-Sud 11 Faculté des Sciences d ORSAY Personnes ressources des disciplines représentées : Département de Biologie Vice-Président : Hervé DANIEL Secrétaire : Malika DERRAS Université Paris-Sud
Tableau récapitulatif : composition nutritionnelle de la spiruline
 Tableau récapitulatif : composition nutritionnelle de la spiruline (Valeur énergétique : 38 kcal/10 g) Composition nutritionnelle Composition pour 10 g Rôle Protéines (végétales) 55 à 70 % Construction
Tableau récapitulatif : composition nutritionnelle de la spiruline (Valeur énergétique : 38 kcal/10 g) Composition nutritionnelle Composition pour 10 g Rôle Protéines (végétales) 55 à 70 % Construction
Artéfact en queue de comète à l échographie hépatique: un signe de maladie des voies biliaires intra-hépatiques
 Artéfact en queue de comète à l échographie hépatique: un signe de maladie des voies biliaires intra-hépatiques T Smayra, L Menassa-Moussa, S Slaba, M Ghossain, N Aoun Hôtel-Dieu de France, Université
Artéfact en queue de comète à l échographie hépatique: un signe de maladie des voies biliaires intra-hépatiques T Smayra, L Menassa-Moussa, S Slaba, M Ghossain, N Aoun Hôtel-Dieu de France, Université
ULBI 101 Biologie Cellulaire L1. Le Système Membranaire Interne
 ULBI 101 Biologie Cellulaire L1 Le Système Membranaire Interne De la nécessité d un SMI Le volume augmente comme le cube de la dimension linéaire, alors que la surface n'est augmentée que du carré Une
ULBI 101 Biologie Cellulaire L1 Le Système Membranaire Interne De la nécessité d un SMI Le volume augmente comme le cube de la dimension linéaire, alors que la surface n'est augmentée que du carré Une
Niveau CEl CE2. Le grand dauphin ou dauphin souffleur Tursiops truncatus
 Niveau CEl CE2 Le grand dauphin ou dauphin souffleur Tursiops truncatus INTRODUCTION: non un poisson. Le dauphin souffleur ou grand dauphin est un mammifère marin, et Comme tous les mammifères il suivantes
Niveau CEl CE2 Le grand dauphin ou dauphin souffleur Tursiops truncatus INTRODUCTION: non un poisson. Le dauphin souffleur ou grand dauphin est un mammifère marin, et Comme tous les mammifères il suivantes
Maîtrise des phases critiques en élevage porcin : Comment améliorer la santé digestive du porcelet?
 1. Introduction : Maîtrise des phases critiques en élevage porcin : Comment améliorer la santé digestive du porcelet? P. Rondia* et J. Wavreille** Centre wallon de recherches agronomiques *Unité Nutrition
1. Introduction : Maîtrise des phases critiques en élevage porcin : Comment améliorer la santé digestive du porcelet? P. Rondia* et J. Wavreille** Centre wallon de recherches agronomiques *Unité Nutrition
CRITERES DE REMPLACEMENT
 ANATOMIE ET CYTOLOGIE PATHOLOGIQUES - 7 semestres dans des services agréés pour le DES d anatomie et cytologie pathologiques, dont au moins 5 doivent être accomplis dans des services hospitalouniversitaires
ANATOMIE ET CYTOLOGIE PATHOLOGIQUES - 7 semestres dans des services agréés pour le DES d anatomie et cytologie pathologiques, dont au moins 5 doivent être accomplis dans des services hospitalouniversitaires
Sport et alpha ANNEXES
 Sport et alpha ANNEXES Edition 2013 TABLE DES MATIERES Table des matières 1 Alimentation 2 Boire, Boire, Boire... 2 Et à l approche des «20 km de Bruxelles»? 3 Et pendant l épreuve? 3 Stretching 4 Avant
Sport et alpha ANNEXES Edition 2013 TABLE DES MATIERES Table des matières 1 Alimentation 2 Boire, Boire, Boire... 2 Et à l approche des «20 km de Bruxelles»? 3 Et pendant l épreuve? 3 Stretching 4 Avant
Activité 38 : Découvrir comment certains déchets issus de fonctionnement des organes sont éliminés de l organisme
 Activité 38 : Découvrir comment certains déchets issus de fonctionnement des organes sont éliminés de l organisme 1. EXTRAITS REFERENTIELS DU BO Partie du programme : Fonctionnement de l organisme et besoin
Activité 38 : Découvrir comment certains déchets issus de fonctionnement des organes sont éliminés de l organisme 1. EXTRAITS REFERENTIELS DU BO Partie du programme : Fonctionnement de l organisme et besoin
UNIVERSITE MONTPELLIER I UFR de PHARMACIE
 UNIVERSITE MONTPELLIER I UFR de PHARMACIE DOPAGE «DE L ANALYSE A LA PREVENTION» EN PARTENARIAT AVEC DOPAGE : de l analyse à la prévention PORTEURS DU PROJET RESPONSABLES S Michel AUDRAN Professeur de pharmacie
UNIVERSITE MONTPELLIER I UFR de PHARMACIE DOPAGE «DE L ANALYSE A LA PREVENTION» EN PARTENARIAT AVEC DOPAGE : de l analyse à la prévention PORTEURS DU PROJET RESPONSABLES S Michel AUDRAN Professeur de pharmacie
 Oui, les noix sont grasses, mais elles sont aussi bourrées de vitamines, de minéraux, de fibres et de protéines! Quant à son gras, principalement monoinsaturé, il est bon pour le coeur. Et, combiné à l'action
Oui, les noix sont grasses, mais elles sont aussi bourrées de vitamines, de minéraux, de fibres et de protéines! Quant à son gras, principalement monoinsaturé, il est bon pour le coeur. Et, combiné à l'action
Université Saint-Joseph
 Université Saint-Joseph Faculté de pharmacie Actuellement, le métier de pharmacien est un métier polyvalent, ouvert à plusieurs activités dans le domaine de la santé individuelle et publique. Mis à part
Université Saint-Joseph Faculté de pharmacie Actuellement, le métier de pharmacien est un métier polyvalent, ouvert à plusieurs activités dans le domaine de la santé individuelle et publique. Mis à part
Chapitre 7 : Structure de la cellule Le noyau cellulaire
 UE2 : Structure générale de la cellule Chapitre 7 : Structure de la cellule Le noyau cellulaire Professeur Michel SEVE Année universitaire 2010/2011 Université Joseph Fourier de Grenoble - Tous droits
UE2 : Structure générale de la cellule Chapitre 7 : Structure de la cellule Le noyau cellulaire Professeur Michel SEVE Année universitaire 2010/2011 Université Joseph Fourier de Grenoble - Tous droits
Titre : «CYCLISME ET DIABETE DE TYPE 1» Auteur(s) : Docteur Karim BELAID. Catégorie : Médecine du Sport - Diaporama, 20 vues.
 Titre : «CYCLISME ET DIABETE DE TYPE 1» Auteur(s) : Docteur Karim BELAID Catégorie : Médecine du Sport - Diaporama, 20 vues. Date de présentation : 2014 Lieu : Roubaix. Mis à disponibilité sur le site
Titre : «CYCLISME ET DIABETE DE TYPE 1» Auteur(s) : Docteur Karim BELAID Catégorie : Médecine du Sport - Diaporama, 20 vues. Date de présentation : 2014 Lieu : Roubaix. Mis à disponibilité sur le site
A B C Eau Eau savonneuse Eau + détergent
 1L : Physique et chimie dans la cuisine Chapitre.3 : Chimie et lavage I. Les savons et les détergents synthétiques 1. Propriétés détergentes des savons Le savon est un détergent naturel, les détergents
1L : Physique et chimie dans la cuisine Chapitre.3 : Chimie et lavage I. Les savons et les détergents synthétiques 1. Propriétés détergentes des savons Le savon est un détergent naturel, les détergents
Pourquoi je ne vois pas mes abdos?
 Un e dossier élaboré par Peter Blanken Introduction : La réponse courte est la suivante: parce que les muscles sont cachés par une couche de graisse La réponse détaillée à cette question se trouve dans
Un e dossier élaboré par Peter Blanken Introduction : La réponse courte est la suivante: parce que les muscles sont cachés par une couche de graisse La réponse détaillée à cette question se trouve dans
