COMMISSION NATIONALE D EVALUATION DES DISPOSITIFS MEDICAUX ET DES TECHNOLOGIES DE SANTE AVIS DE LA COMMISSION. 20 mars 2012
|
|
|
- Isabelle Goulet
- il y a 7 ans
- Total affichages :
Transcription
1 COMMISSION NATIONALE D EVALUATION DES DISPOSITIFS MEDICAUX ET DES TECHNOLOGIES DE SANTE AVIS DE LA COMMISSION 20 mars 2012 Nom : Modèles et références retenus : Fabricant : Demandeur : CONCLUSIONS AFX, endoprothèse aortique abdominale Ceux proposés par le demandeur (cf. page 4) Endologix Inc. Endologix International BV Aucune étude clinique spécifique de l endoprothèse aortique abdominale AFX n est fournie. Seul un rapport réalisé par la société Endologix, publié en 2011, rapportait les évènements de matériovigilance de l endoprothèse AFX entre aout 2011 et le 31 décembre Les données non spécifiques fournies étaient Données disponibles : Service Attendu (SA) Le rapport d évaluation technologique publié par le National Institute for Health and Clinical Excellence (NICE) en février Les résultats des études EVAR 1, DREAM et EVAR 2 à long terme publiés en Il est à noter que l étude EVAR 2 incluaient des patients à haut risque chirurgical. Le rapport HAS sur l évaluation des endoprotheses aortiques abdominales utilisées pour le traitement des anévrismes de l aorte abdominale sous-rénale juillet 2009 Deux études spécifiques de POWERLINK : o L étude Carpenter et al. essai pivot, prospectif, multicentrique, en ouvert, contrôlé, mené dans 15 sites aux USA, dont l objectif était d évaluer les résultats, en termes d efficacité et de sécurité, obtenus par le système POWERLINK en comparaison à la chirurgie. o L étude Qu et al ; prospective, monocentrique (Nuremberg, Allemagne), non randomisée menée de février 1999 à septembre 2006 dont l objectif principal était d évaluer les résultats à 7 ans du traitement de l anévrisme aortique abdominal par l endoprothèse aortique abdominale POWERLINK. Suffisant, en raison de : - l intérêt thérapeutique du produit et sa place dans la stratégie thérapeutique, - l intérêt de santé publique au vu de la gravité de la pathologie
2 Indications : Eléments conditionnant le SA : Spécifications techniques : Modalités de prescription et d utilisation : Amélioration du SA : Patient ayant un anévrisme de l aorte abdominale (AAA) sous-rénale mesurant au moins 5 cm de grand diamètre ou ayant augmenté d au moins 1 cm au cours de la dernière année et respectant les critères anatomiques suivants : collet sans thrombus circonférentiel ni calcifications majeures, collet proximal à bords parallèles : 15 mm, angle du collet proximal : - < 40, - ou compris entre 40 et 60, à la condition de bénéficier d une longueur de collet supérieure à 20 mm. Le diamètre du collet proximal, l état du collet distal (point(s) d ancrage iliaque), les accès iliofémoraux doivent être compatibles avec le système de pose et l endoprothèse utilisés. À noter que la mise en place d une endoprothèse aortique abdominale ne doit pas entraîner l exclusion volontaire d artère(s) viscérale(s) fonctionnelle(s) y compris artère hypogastrique, en dehors de l artère mésentérique inférieure. Aucune exigence supplémentaire par rapport aux spécifications techniques proposées par le fabricant. L implantation des endoprothèses AFX doit être réalisée conformément aux recommandations émises par la HAS/l AFSSaPS incluant, entre autres : - La nécessité d informer les patients des avantages et des inconvénients des deux techniques et des incertitudes à long terme, et l évolutivité possible de l AAA. Pour permettre un choix éclairé impliquant le patient, une notice d information au patient a été validée, destinée à être mise à la disposition des praticiens. - L environnement opératoire : la pose d une endoprothèse aortique abdominale ne doit être envisagée que dans un centre pluridisciplinaire regroupant des activités chirurgicales et radiologiques. Ce centre doit avoir une pratique régulière de la chirurgie vasculaire, des thérapeutiques endovasculaires et des explorations radiologiques à visée vasculaire. La collaboration radiochirurgicale est éminemment souhaitable. La salle où se déroule la pose doit répondre à des critères de qualité chirurgicale permettant une intervention majeure et radiologique (traitement numérisé de l image avec un mode soustraction, matériel et salle de cathétérisme conforme à un bloc opératoire en termes d asepsie, injecteur de produit de contraste, respect des contraintes de radioprotection du personnel). Il est important de rappeler les conditions dans lesquelles devront être pratiquées ces interventions afin d assurer une sécurité optimale au patient. Pour les centres débutants, l assistance d un médecin tuteur est recommandée pour la mensuration et la pose des 6 premiers implants. - La surveillance du patient est obligatoire à long terme. En son absence le traitement ne peut pas être considéré comme complet. Cette surveillance est sous la responsabilité de l implanteur selon un calendrier précis dont le patient aura été informé. Ces examens se dérouleront conformément aux recommandations du «Guide du bon usage des examens d imagerie médicale». Absence d amélioration du service attendu (ASA V) de l endoprothèse aortique AFX par rapport aux endoprothèses aortiques abdominales POWERLINK - 2 -
3 Type d inscription : Durée d inscription : Nom de marque Jusqu à la fin de prise en charge actuelle de l endoprothèse aortique abdominale POWERLINK (1 er mars 2014) Conditions du renouvellement : Population cible : Environ La CNEDiMTS subordonne le renouvellement d inscription de chaque endoprothèse à la présentation des résultats d'une étude de suivi spécifique mise en place sur une cohorte de patients représentative de la population traitée en conditions réelles d utilisation. L objectif de chaque étude est d évaluer l intérêt de la technique en documentant, la mortalité globale, les complications (endofuite, migration), le taux de conversion chirurgicale, l évolution et la rupture de l anévrisme à long terme, c'est-à-dire au delà de 5 ans. Cette étude de cohorte prospective devra concerner au moins 150 patients implantés après inscription sur la LPPR. Les résultats de l étude de suivi devront être communiqués pour examen à la CNEDiMTS une fois par an. L évaluation de ce suivi pourra aboutir à la recommandation par la CNEDiMTS du maintien ou à la suppression de la prise en charge de l endoprothèse aortique abdominale concernée. Dans ces conditions AFX devra faire l objet du même protocole que celui mis en place pour POWERLINK
4 ARGUMENTAIRE Nature de la demande Demande d inscription sur la liste des produits et prestations mentionnés à l article L du code de la Sécurité Sociale. Modèles et références Références Endoprothèse aortique, monocorps bifurqué aortobifémoral Endoprothèse aortique bifurquée avec jambages intégrés côté homolatéral et controlatéral Extension aortique. Extension de jambage (iliaque) BA22-60/I13-40, BA22-80/I13-40, BA22-100/I13-40, BA22-70/I16-30, BA22-60/I16-40, BA22-90/I16-30, BA22-80/I16-40, BA22-100/I16-40, BA25-60/I13-40, BA25-80/I13-40, BA25-100/I13-40, BA25-70/I16-30, BA25-60/I16-40, BA25-90/I16-30, BA25-80/I16-40, BA25-80/I16-55, BA25-100/I16-40, BA25-100/I16-55, BA28-60/I13-40, BA28-80/I13-40, BA28-100/I13-40, BA28-70/I16-30, BA28-60/I16-40, BA28-90/I16-30, BA28-80/I16-40, BA28-80/I16-55, BA28-100/I16-40, BA28-100/I16-55 A25-25/C55, A25-25/C75, A25-25/C55-O20, A25-25/C95, A25-25/C75-O20, A25-25/C95-O20, A28-28/C55, A28-28/C75, A28-28/C55-O20, A28-28/C95, A28-28/C75-O20, A28-28/C95-O20, A34-34/C80, A34-34/C100, A34-34/C80-O20, A34-34/C100-O20 I16-16/C55, I16-16/C55F, I16-16/C88, I20-13/C70F, I20-13/C88F, I20-20/C55, I20-20/C55F, IS20-25/C55, IF20-25/C65, IS20-25/C65 Conditionnement : unitaire Applications La demande d inscription concerne les indications suivantes : Patient ayant un anévrisme de l aorte abdominale sous-rénale mesurant au moins 5 cm de grand diamètre ou ayant augmenté d au moins 1 cm au cours de la dernière année et respectant les critères anatomiques suivants : collet sans thrombus circonférentiel ni calcifications majeures collet proximal à bords parallèles > 15 mm angle du collet proximal : - < 40 - ou compris entre 40 et 60, à la condition de bé néficier d une longueur de collet supérieure à 20 mm Le diamètre du collet proximal, l état du collet distal (point(s) d ancrage iliaque), les accès iliofémoraux doivent être compatibles avec le système de pose et l endoprothèse utilisé. A noter que la mise en place d une endoprothèse aortique abdominale ne doit pas entraîner l exclusion volontaire d artère(s) viscérale(s) fonctionnelle(s), y compris artère hypogastrique, en dehors de l artère mésentérique inférieure. Il s agit d une première demande d inscription Historique du remboursement - 4 -
5 Caractéristiques du produit et de la prestation associée Marquage CE Classe III, notification par le NSAI (n 0050), Irla nde. Description Le système endovasculaire AFX comprend 2 composants : - une endoprothèse implantable constituée d une cage en alliage de cobalt chrome autoexpansible, recouverte d un greffon à paroi fine en PTFE expansé de faible porosité, fixé par une suture en polypropylène en position proximale et distale par rapport à la cage. - un cathéter de largage jetable : Il existe des systèmes de largage spécifiques pour les différents modèles d endoprothèses AFX (monocorps et extensions de jambage) en fonction de leurs dimensions L endoprothèse préchargée est insérée à l aide de la gaine d introduction AFX par voie endoluminale via l artère fémorale ou iliaque sur un guide. Le système comprend une endoprothèse monobloc bifurquée, une endoprothèse d extension proximale et des endoprothèses d extension de jambage iliaque. L endoprothèse monobloc bifurquée est composé d un tronc principal (dont dont le diamètre est compris entre 22 mm et 28 mm et de longueur comprise entre 60 et 100 mm), sur lequel sont fixés 2 jambages iliaques (dont le diamètre est compris entre 13 mm et 16 mm et de longueur comprise entre 30 et 55 mm). Chaque composant est introduit séparément dans le système vasculaire du patient. AFX est une extension de la gamme POWERLINK. Les endoprothèses AFX sont le résultat de modifications apportées aux endoprothèses aortiques POWERLINK en ce qui concerne leur structure et leur système d introduction : - L utilisation d une membrane de PTFE plus fine (diminution de 0,0040,, à 0,0020,, ) - Une modification du diamètre du cathéter de largage ainsi qu une modification de sa couleur Fonctions assurées L implantation d une endoprothèse aortique permet : d exclure la poche anévrismale du flux circulant et de la pression artérielle, de renforcer la paroi artérielle. A terme, le but est de prévenir la croissance et la rupture de l anévrisme. Acte ou prestation associée Les actes concernant la pose d une endoprothèse aortique abdominale sont référencés à la Classification Commune des Actes Médicaux (CCAM version 23, ) notamment sous le chapitre «Pose d endoprothèse couverte dans l aorte abdominale et l artère iliaque»
6 1. Intérêt du produit ou de la prestation Service Attendu 1.1 Analyse des données : évaluation de l effet thérapeutique / effets indésirables liés à l utilisation Aucune donnée clinique spécifique de l endoprothèse aortique abdominale AFX na été fournie. Les études décrites dans le dossier sont les suivantes : Le rapport d évaluation technologique publié par le National Institute for Health and Clinical Excellence (NICE) en février Les résultats des études EVAR 1, DREAM et EVAR 2 à long terme publiés en Il est à noter que l étude EVAR 2 incluaient des patients à haut risque chirurgical. Le rapport HAS sur l évaluation des endoprotheses aortiques abdominales utilisées pour le traitement des anévrismes de l aorte abdominale sous-rénale juillet 2009 Deux études spécifiques de POWERLINK : o L étude Carpenter et al. 1,2 essai pivot, prospectif, multicentrique, en ouvert, contrôlé, mené dans 15 sites aux USA, dont l objectif était d évaluer les résultats, en termes d efficacité et de sécurité, obtenus par le système POWERLINK en comparaison à la chirurgie. o L étude Qu et al. 3 ;prospective, monocentrique (Nuremberg, Allemagne), non randomisée menée de février 1999 à septembre 2006 dont l objectif principal était d évaluer les résultats à 7 ans du traitement de l anévrisme aortique abdominal par l endoprothèse aortique abdominale POWERLINK. Matériovigilance AFX est commercialisée aux Etats-Unis et en Amérique latine depuis Aout Au 31 décembre 2011, endoprothèse AFX ont été implantées. Un rapport réalisé par la société Endologix, publié en 2011, consacre un chapitre aux événements indésirables enregistrés dans le monde depuis la commercialisation des endoprothèses POWERLINK et AFX. Au total, dispositifs POWERLINK et AFX ont été implantés à travers le monde ( endoprothèses bifurquées extensions). La mortalité, les ruptures et les conversions chirurgicales recensées depuis la mise à disposition du dispositif sont résumées dans le Tableau 1. Tableau 1 - Mortalité, ruptures et conversions chirurgicales signalées (Octobre 2011) Etats-Unis Autres pays AFX POWERLINK AFX POWERLINK Mortalité per opératoire Mortalité post opératoire * Rupture d anévrisme post procédure 0 8 _ 9 Conversion per opératoire **,$ _ 33 Conversion post opératoire $ 1 41 _ 9 * Après l'implantation, mais dans les 30 jours. Les décès comprennent ceux signalés comme étant liés aux comorbidités pré-existantes. ** Certains événements sont survenus après l insertion mais avant le déploiement du dispositif. $ Certaines conversions (34 per-opératoires, 1 post-opératoire) sont également incluses dans la catégorie «mortalité». Deux ruptures d'anévrismes post-opératoires sont également incluses dans la catégorie «conversion post opératoire». 1 Carpenter J. The POWERLINK bifurcated system for endovascular aortic aneurysm repair: four-year results of the US multicenter trial. J Cardiovasc Surg (Torino) Jun;47 : Wang GJ, Carpenter JP; Endologix Investigators.. The POWERLINK system for endovascular abdominal aortic aneurysm repair: Sixyear results. J Vasc Surg 2008; 48: Qu L, Hetzel G, Raithel D.. Seven years single center experience of Powelink unibody bifurcated endograft for endovascular aortic aneurysm repair. J Cardiovasc Surg 2007;
7 Les 2 décès observés dans le groupe AFX ont été attribués pour l un à des complications gastrointestinales et pour l autre il reste d origine inconnue. Une conversion était liée à une endofuite de type III non résolue. Les événements relatifs à l intégrité du dispositif ainsi que les endofuites rapportées à travers le monde sont résumés dans le Tableau 2. Tableau 2 Intégrité du dispositif (Octobre 2011) Evénements Etats-Unis Autres pays AFX POWERLINK AFX POWERLINK Plicature, compression ou rupture de l endoprothèse 0 8 (dont 5 tardives) - 3 dont 2 tardives Autre Occlusion du jambage 0 21 _ 2 Types d endofuites Une endofuite de type IA périopératoire et 1 endofuite de type IA survenue entre 30 jours et 1 an a été rapportée. Toutes ont été résolues. 3 endofuites de type III ont été rapportées avec AFX. Six notifications ont rapportées une difficulté de retrait du système de largage AFX. 2 échecs ou difficultés de déploiement ont été rapportés. 52 évènements mineurs impliquant AFX ont été rapportés. La Commission souligne l absence de données cliniques spécifiques à l endoprothèse aortique abdominale AFX. Cependant la Commission estime que les données cliniques disponibles confirmant la sécurité des endoprothèses aortiques abdominales POWERLINK sont extrapolables à l endoprothèse aortique abdominale AFX. La Commission estime que le rapport effet thérapeutique / effets indésirables, des endoprothèses aortiques abdominales AFX est favorable à leur utilisation dans le traitement des anévrismes de l aorte abdominale. 1.2 Place dans la stratégie thérapeutique Le traitement de référence des AAA sous-rénale est la mise à plat-greffe avec ouverture du sac anévrismal et implantation d une prothèse synthétique. Cette technique a l avantage d être efficace, fiable et d avoir un recul de plus de 20 ans. La mortalité periopératoire est inférieure à 5 % dans la majorité des séries d AAA non rompus, mais elle augmente de façon importante, jusqu à 15 %, chez les malades à risque chirurgical élevé. L implantation d une endoprothèse aortique abdominale est une technique plus récente qui représente une alternative au traitement conventionnel, notamment chez les patients à risque chirurgical élevé. Le traitement endovasculaire des anévrismes de l aorte abdominale sous-rénale est une alternative au traitement chirurgical de mise à plat-greffe
8 Les endoprothèses aortiques abdominales ont un intérêt, de part leur effet thérapeutique, dans le traitement des patients ayant un anévrisme de l aorte abdominale sous-rénale mesurant au moins 5 cm de grand diamètre ou ayant augmenté d au moins 1 cm au cours de la dernière année et respectant les critères anatomiques suivants : - collet sans thrombus circonférentiel ni calcifications majeures - collet proximal à bords parallèles > 15 mm - angle du collet proximal : - < 40 - ou compris entre 40 et 60, à la condition de bénéficier d une longueur de collet supérieure à 20 mm Au vu des données fournies, cet intérêt est confirmé pour les endoprothèses aortiques abdominales AFX. 2. Intérêt de santé publique 2.1 Gravité de la pathologie L anévrisme de l aorte abdominale (AAA) est une dilatation permanente de l aorte. La croissance progressive d un AAA est inéluctable et à terme, tout anévrisme est menacé de rupture. Ce risque est d autant plus élevé que le diamètre de l anévrisme est large. Lorsque le diamètre de l anévrisme est de plus de 5 cm, le risque de rupture d un AAA est très variable d une série à l autre. En revanche, il est très faible pour des diamètres inférieurs à 5 cm. D autre part, la dilatation anévrismale de l aorte entraîne la formation progressive d un thrombus sur la paroi interne du sac anévrismal et les risques associés sont des accidents emboliques périphériques ainsi que la thrombose de l aorte elle-même. Enfin, la gangue inflammatoire qui se développe autour de l'anévrisme peut être à l origine d une altération des tissus voisins. L AAA est une pathologie évolutive le plus souvent asymptomatique et découverte à l occasion d un examen abdominal systématique. Grâce aux méthodes de diagnostic et de suivi, la chirurgie est programmée de plus en plus précocement 4,5. Ceci permet d éviter la rupture qui est une cause fréquente de décès des patients atteints d anévrisme de l aorte abdominale. La mortalité en cas de rupture de l anévrisme est majeure (65 à 90 %) 6. Les risques de rupture évoluent en fonction de la taille de l anévrisme (tableau ci-dessous). Diamètre de l AAA 7,8 Risque de rupture à 5 ans Au-dessous de 4 cm 10 % Entre 4 et 7 cm 25 % 7 et 10 cm 45 % Au-dessus de 10 cm 60 % Les complications de l anévrisme de l aorte abdominale sont à l origine d un handicap et d une dégradation marquée de la qualité de vie. Elles engagent le pronostic vital. 4 Drott C, Arfvidsson B, Ortenwall P, Lundholm K. Age-standardized incidence of ruptured aortic aneurysm in a defined Swedish population between 1952 and 1988 : mortality rate and operative results. Br J Surg 1992 ; 79(2) : Thomas PR, Stewart RD. Abdominal aortic aneurysm. Br J Surg 1988 ; 75(8) : Becker F, Baud JM, pour le groupe de travail ad hoc : Dépistage des anévrysmes de l aorte abdominale et surveillance des petits anévrysmes de l aorte abdominale : argumentaire et recommandations de la société française de médecine vasculaire. Journal des Maladies Vasculaires 2006 ; 31 (5) : Nevitt MP, Ballard DJ, Hallett JW. Prognosis of abdominal aortic aneurysms. A populationbased study. N Engl J Med 1989 ; 321(15) : Katz DA, Littenberg B, Cronenwett JL. Management of small abdominal aortic aneurysms. Early surgery vs watchful waiting. JAMA 1992 ; 268(19) :
9 2.2 Epidémiologie de la pathologie La prévalence des AAA est mieux connue depuis la mise en place de campagnes de dépistage échographique 9,10. Elle varie en fonction du diamètre de l anévrisme pris en compte et de la population étudiée (âge, sexe, facteurs de risque vasculaire). Elle augmente chez l homme et avec l âge. On estime que 2 à 6 % de la population de plus de 65 ans sont atteints d AAA 11. La prévalence des AAA de plus de 5 cm serait chez les plus de 60 ans de 0,6 % chez l homme et de 0,2 % chez la femme 6. Selon les données de l Agence Technique de l Information sur l Hospitalisation (ATIH), sur la période , le nombre de séjours dans un établissement de soins pour un diagnostic principal d AAA était de dont pour anévrisme non rompu. Les interventions concernaient dans 92 % des hommes (9 759 hommes et 768 femmes) et 88 % des patients avaient plus de 60 ans. Dans 73 % des cas, le traitement choisi était la chirurgie ouverte et dans 21 % des cas une endoprothèse. La mortalité péri-opératoire était de 3 % (346/10 527) tout anévrisme confondu. 2.3 Impact Les données cliniques disponibles à ce jour montrent que les endoprothèses aortiques abdominales réduisent la mortalité toute cause péri-opératoire par rapport à la chirurgie ouverte mais que ce bénéfice disparaît au bout de deux ans. La mortalité liée à l anévrisme est plus faible avec les endoprothèses mais les données existantes à long terme (8 ans) montrent une disparition de ce bénéfice après 6 ans. Le taux de complications liées à l intervention et le taux de réinterventions sont plus élevés pour les patients traités par voie endovasculaire que par chirurgie. Les principales complications des endoprothèses sont les endofuites, c est-à-dire une exposition du sac anévrismal à la pression artérielle, nécessitant une reprise des patients. L utilisation des endoprothèses a un impact sur le système de santé. La pose d endoprothèse nécessite en effet un plateau technique et une expertise spécifique des chirurgiens. Les endoprothèses ont l avantage de réduire la durée de l intervention, le temps de séjour en unité de soins intensifs, la durée du séjour hospitalier et d éviter les pertes sanguines. En revanche elles nécessitent l utilisation de produit de contraste au cours de l intervention et un suivi post-opératoire annuel des patients par examens tomodensitométrique ou par ultrasons pour vérifier l absence d endofuites. De plus, le nombre de complications et de ré-interventions entraîneraient un nombre de ré-hospitalisations plus important par rapport aux patients traités par chirurgie. Il n existe cependant pas de données comparant les durées totales d hospitalisation entre les deux traitements. L endoprothèse AFX répond à un besoin déjà couvert. Les endoprothèses aortiques abdominales, dont AFX ont un intérêt pour la santé publique, compte tenu du caractère de gravité des anévrismes de l aorte abdominale sous-rénale En conclusion, la Commission Nationale d'evaluation des Dispositifs Médicaux et des Technologies de Santé estime que le service attendu est suffisant pour l inscription de l endoprothèse aortique abdominale AFX sur la liste des Produits et Prestations prévue à l'article L du code de la sécurité sociale, dans les indications suivantes : 9 Wilmink AB, Forshaw M, Quick CRG, Hubbard CS, Day NE. Accuracy of serial screening for abdominal aortic aneurysms by ultrasound. J Med Screen 2002 ; 9(3) : Agence nationale d accréditation et d évaluation en santé. Prothèses endoaortiques : évaluation clinique et économique. Paris : ANAES ; Scott RA, Tisi PV, Ashton HA, Allen DR. Abdominal aortic aneurysm rupture rates : a 7- year follow-up of the entire abdominal aortic aneurysm population detected by screening. J Vasc Surg 1998 ; 28(1) :
10 Patients ayant un anévrisme de l aorte abdominale sous-rénale mesurant au moins 5 cm de grand diamètre ou ayant augmenté d au moins 1 cm au cours de la dernière année et respectant les critères anatomiques suivants : - collet sans thrombus circonférentiel ni calcifications majeures - collet proximal à bords parallèles > 15 mm - angle du collet proximal : - < 40 - ou compris entre 40 et 60, à la condition de bénéficier d une longueur de collet supérieure à 20 mm Le diamètre du collet proximal, l état du collet distal (point(s) d ancrage iliaque), les accès iliofémoraux doivent être compatibles avec le système de pose et l endoprothèse utilisés. À noter que la mise en place d une endoprothèse aortique abdominale chez un patient ne doit pas entraîner l exclusion volontaire d artère(s) viscérale(s) fonctionnelle(s) y compris artère hypogastrique, en dehors de l artère mésentérique inférieure. Eléments conditionnant le Service Attendu Spécifications techniques minimales Sans objet Modalités d utilisation et de prescription L implantation de l endoprothèse aortique abdominale AFX doit être réalisée conformément aux recommandations émises par la HAS/l Afssaps incluant, entre autres : - La nécessité d informer les patients des avantages et des inconvénients des deux techniques et des incertitudes à long terme, et l évolutivité possible de l AAA. Pour permettre un choix éclairé impliquant le patient, une notice d information au patient a été validée, destinée à être mise à la disposition des praticiens. - L environnement opératoire : la pose d une endoprothèse aortique abdominale ne doit être envisagée que dans un centre pluridisciplinaire regroupant des activités chirurgicales et radiologiques. Ce centre doit avoir une pratique régulière de la chirurgie vasculaire, des thérapeutiques endovasculaires et des explorations radiologiques à visée vasculaire. La collaboration radio-chirurgicale est éminemment souhaitable. La salle où se déroule la pose doit répondre à des critères de qualité chirurgicale permettant une intervention majeure et radiologique (traitement numérisé de l image avec un mode soustraction, matériel et salle de cathétérisme conforme à un bloc opératoire en termes d asepsie, injecteur de produit de contraste, respect des contraintes de radioprotection du personnel). Il est important de rappeler les conditions dans lesquelles devront être pratiquées ces interventions afin d assurer une sécurité optimale au patient. Pour les centres débutants, l assistance d un médecin tuteur est recommandée pour la mensuration et la pose des 6 premiers implants. - La surveillance du patient est obligatoire à long terme. En son absence le traitement ne peut pas être considéré comme complet. Cette surveillance est sous la responsabilité de l implanteur selon un calendrier précis dont le patient aura été informé. Ces examens se dérouleront conformément aux recommandations du «Guide du bon usage des examens d imagerie médicale». Amélioration du Service Attendu Au vue de l absence de données cliniques spécifiques de l endoprothèse aortique abdominale AFX, la Commission Nationale d'evaluation des Dispositifs Médicaux et des Technologies de Santé s est prononcée pour une absence d amélioration du service attendu (ASA V) des endoprothèses AFX par rapport aux endoprothèses aortiques abdominales POWERLINK dont elles sont une évolution
11 Conditions de renouvellement et durée d inscription Conditions de renouvellement : La CNEDiMTS maintient les recommandations formulées dans l avis du 28 septembre 2010 et subordonne le renouvellement d inscription de chaque endoprothèse à la présentation des résultats d'une étude de suivi spécifique, mise en place sur une cohorte de patients représentative de la population traitée en conditions réelles d utilisation. L objectif de chaque étude est d évaluer l intérêt de la technique en documentant, la mortalité globale, les complications (endofuite, migration), le taux de conversion chirurgicale, l évolution et la rupture de l anévrisme à long terme, c'est-à-dire au delà de 5 ans. Cette étude de cohorte prospective devra concerner au moins 150 patients implantés après inscription sur la LPPR. Les résultats de l étude de suivi devront être communiqués pour examen à la CNEDiMTS une fois par an. L évaluation de ce suivi pourra aboutir à la recommandation par la CNEDiMTS du maintien ou à la suppression de la prise en charge de l endoprothèse aortique abdominale concernée. Dans ces conditions AFX devra faire l objet du même protocole que celui mis en place pour POWERLINK. Durée d inscription proposée : Jusqu à la fin de prise en charge actuelle de l endoprothèse aortique abdominale POWERLINK (1 er mars 2014) Population cible Une approximation de la population cible est faite en prenant en compte la population de patients atteints d un AAA de plus de 5 cm. Selon les données INED 12, au 1 er janvier 2009, le nombre d adultes de plus de 60 ans en France métropolitaine est estimé à hommes et femmes. En appliquant à ces chiffres, les taux de prévalence évalués par Becker et al. 6, le nombre de personnes ayant un AAA de plus de 5 cm serait de au total dont hommes et femmes. Compte tenu du caractère asymptomatique des AAA, il est difficile d évaluer le nombre d AAA susceptibles d être diagnostiqués et donc pris en charge chaque année. A défaut de données épidémiologiques françaises, la population cible des endoprothèses aortiques peut être estimée à partir du nombre de patients hospitalisés pour un AAA chaque année. En 2009, d après les données du Programme de médicalisation des systèmes d information (PMSI), le nombre de séjours dans un établissement de soins pour un diagnostic principal d AAA non rompu était de Selon les experts, on peut considérer qu environ 60 % des anévrismes de l aorte abdominale sousrénale répondent aux conditions anatomiques permettant de poser une endoprothèse, soit environ patients qui se répartissent de la façon suivante : patients à haut risque chirurgical, patients sans risque chirurgical particulier. La Commission évalue la population cible concernée par ces demandes à environ patients par an. 12 Données INED. < [Consulté le ]
iliaque ZENITH abdomina aortique ale) 244 février 2015 : COOK France Demandeur Les modèles Indications retenues : Service Attendu (SA) :
 COMMISSION NATIONALE D EVALUATION DES DISPOSITIFS MEDICAUX ET DES TECHNOLOGIES DEE SANTE AVIS DE LA CNEDiMTS 244 février 2015 CONCLUSIONS ZENITH ALPHA SPIRAL Z, jambage abdomina ale) Demandeur : COOK France
COMMISSION NATIONALE D EVALUATION DES DISPOSITIFS MEDICAUX ET DES TECHNOLOGIES DEE SANTE AVIS DE LA CNEDiMTS 244 février 2015 CONCLUSIONS ZENITH ALPHA SPIRAL Z, jambage abdomina ale) Demandeur : COOK France
COMMISSION NATIONALE D EVALUATION DES DISPOSITIFS MEDICAUX ET DES TECHNOLOGIES DE SANTE. AVIS DE LA COMMISSION 08 février 2011 CONCLUSIONS
 COMMISSION NATIONALE D EVALUATION DES DISPOSITIFS MEDICAUX ET DES TECHNOLOGIES DE SANTE AVIS DE LA COMMISSION 08 février 2011 Nom : Modèles et références retenus : Fabricant : Demandeur : Données disponibles
COMMISSION NATIONALE D EVALUATION DES DISPOSITIFS MEDICAUX ET DES TECHNOLOGIES DE SANTE AVIS DE LA COMMISSION 08 février 2011 Nom : Modèles et références retenus : Fabricant : Demandeur : Données disponibles
Surveillance de l opéré vasculaire. DIU d échographie. L examen pré et postinterventionnel. Surveillance du geste de revascularisation
 DIU d échographie module vasculaire DESC de médecine vasculaire L examen pré et postinterventionnel Gudrun Böge Médecin Vasculaire CHU de Montpellier-Nîmes Surveillance de l opéré vasculaire Surveillance
DIU d échographie module vasculaire DESC de médecine vasculaire L examen pré et postinterventionnel Gudrun Böge Médecin Vasculaire CHU de Montpellier-Nîmes Surveillance de l opéré vasculaire Surveillance
Revue de la littérature
 Résultats à long terme des anévrysmes traités Revue de la littérature Cours de DES de neurochirurgie Inter-région Rhône-Alpes / Auvergne Vendredi 22/04/11 Méthode (1): sélection bibliographique en fonction
Résultats à long terme des anévrysmes traités Revue de la littérature Cours de DES de neurochirurgie Inter-région Rhône-Alpes / Auvergne Vendredi 22/04/11 Méthode (1): sélection bibliographique en fonction
CSMA 2013 11e Colloque National en Calcul des Structures 13-17 Mai 2013
 CSMA 2013 11e Colloque National en Calcul des Structures 13-17 Mai 2013 Simulation du déploiement d endoprothèses dans des anévrismes iliaques tortueux Nicolas DEMANGET 1, Pierre BADEL 1 *, Stéphane AVRIL
CSMA 2013 11e Colloque National en Calcul des Structures 13-17 Mai 2013 Simulation du déploiement d endoprothèses dans des anévrismes iliaques tortueux Nicolas DEMANGET 1, Pierre BADEL 1 *, Stéphane AVRIL
Révision des descriptions génériques Comment monter un dossier?
 DISPOSITIFS MEDICAUX Révision des descriptions génériques Comment monter un dossier? Guide pour le dossier déposé par les fabricants/distributeurs Adopté en séance de la CEPP* le 13 juillet 2005 *CEPP
DISPOSITIFS MEDICAUX Révision des descriptions génériques Comment monter un dossier? Guide pour le dossier déposé par les fabricants/distributeurs Adopté en séance de la CEPP* le 13 juillet 2005 *CEPP
REPOUSSER LES LIMITES DE LA CHIRURGIE BARIATRIQUE DANS LES OBESITES MASSIVES AVEC COMORBIDITES
 Première Journée du Centre Intégré Nord Francilien de prise en charge de l obésité de l adulte et de l enfant REPOUSSER LES LIMITES DE LA CHIRURGIE BARIATRIQUE DANS LES OBESITES MASSIVES AVEC COMORBIDITES
Première Journée du Centre Intégré Nord Francilien de prise en charge de l obésité de l adulte et de l enfant REPOUSSER LES LIMITES DE LA CHIRURGIE BARIATRIQUE DANS LES OBESITES MASSIVES AVEC COMORBIDITES
Gelsoft Plus LA SEULE PROTHESE VASCULAIRE AU MONDE EN POLYESTER A STRUCTURE TRICOTEE KOPER IMPREGNEE DE GELATINE, RESISTANT A LA DILATATION
 Gelsoft Plus LA SEULE PROTHESE VASCULAIRE AU MONDE EN POLYESTER A STRUCTURE TRICOTEE KOPER IMPREGNEE DE GELATINE, RESISTANT A LA DILATATION Structure tricotée Köper exclusive offrant: - une dilatation
Gelsoft Plus LA SEULE PROTHESE VASCULAIRE AU MONDE EN POLYESTER A STRUCTURE TRICOTEE KOPER IMPREGNEE DE GELATINE, RESISTANT A LA DILATATION Structure tricotée Köper exclusive offrant: - une dilatation
B06 - CAT devant une ischémie aiguë des membres inférieurs
 B06-1 B06 - CAT devant une ischémie aiguë des membres inférieurs L ischémie aiguë est une interruption brutale du flux artériel au niveau d un membre entraînant une ischémie tissulaire. Elle constitue
B06-1 B06 - CAT devant une ischémie aiguë des membres inférieurs L ischémie aiguë est une interruption brutale du flux artériel au niveau d un membre entraînant une ischémie tissulaire. Elle constitue
Service évaluation des actes professionnels
 TRAITEMENT DES AGÉNÉSIES DENTAIRES MULTIPLES LIÉES AUX DYSPLASIES ECTODERMIQUES OU À D'AUTRES MALADIES RARES, CHEZ L ENFANT ATTEINT D OLIGODONTIE, AVEC POSE DE 2 IMPLANTS (VOIRE 4 MAXIMUM) UNIQUEMENT DANS
TRAITEMENT DES AGÉNÉSIES DENTAIRES MULTIPLES LIÉES AUX DYSPLASIES ECTODERMIQUES OU À D'AUTRES MALADIES RARES, CHEZ L ENFANT ATTEINT D OLIGODONTIE, AVEC POSE DE 2 IMPLANTS (VOIRE 4 MAXIMUM) UNIQUEMENT DANS
Qui et quand opérer. au cours du traitement de l EI?
 Qui et quand opérer au cours du traitement de l EI? Gilbert Habib Département de Cardiologie - Timone Marseille 7es JNI Bordeaux, 8 juin 2006 Université de la Méditerranée Faculté de Médecine de Marseille
Qui et quand opérer au cours du traitement de l EI? Gilbert Habib Département de Cardiologie - Timone Marseille 7es JNI Bordeaux, 8 juin 2006 Université de la Méditerranée Faculté de Médecine de Marseille
Artéfact en queue de comète à l échographie hépatique: un signe de maladie des voies biliaires intra-hépatiques
 Artéfact en queue de comète à l échographie hépatique: un signe de maladie des voies biliaires intra-hépatiques T Smayra, L Menassa-Moussa, S Slaba, M Ghossain, N Aoun Hôtel-Dieu de France, Université
Artéfact en queue de comète à l échographie hépatique: un signe de maladie des voies biliaires intra-hépatiques T Smayra, L Menassa-Moussa, S Slaba, M Ghossain, N Aoun Hôtel-Dieu de France, Université
IMMED Monitoring vidéo porté
 IMMED Monitoring vidéo porté L indexation vidéo au service du soin des personnes Projet financé par PEPS S2TI CNRS et des bourses BQR de l Université Bordeaux 1 1 Contexte Maladies et dépendances liées
IMMED Monitoring vidéo porté L indexation vidéo au service du soin des personnes Projet financé par PEPS S2TI CNRS et des bourses BQR de l Université Bordeaux 1 1 Contexte Maladies et dépendances liées
Dr Pierre-François Lesault Hôpital Privé de l Estuaire Le Havre
 Dr Pierre-François Lesault Hôpital Privé de l Estuaire Le Havre «Il faut toujours prendre le maximum de risques avec le maximum de précautions» R. Kipling??? Geste d angioplastie en 2014 plus de limites
Dr Pierre-François Lesault Hôpital Privé de l Estuaire Le Havre «Il faut toujours prendre le maximum de risques avec le maximum de précautions» R. Kipling??? Geste d angioplastie en 2014 plus de limites
Les différentes maladies du coeur
 Auteur : Dr Pascal AMEDRO Les différentes maladies du coeur 1. Le cœur normal L oxygène capté dans l air va dans les poumons, où le sang «bleu» est alors oxygéné et devient «rouge». Il est conduit par
Auteur : Dr Pascal AMEDRO Les différentes maladies du coeur 1. Le cœur normal L oxygène capté dans l air va dans les poumons, où le sang «bleu» est alors oxygéné et devient «rouge». Il est conduit par
Résultat du traitement de la varicocèle chez l'adolescent par l'association coils-sclérosants.
 Résultat du traitement de la varicocèle chez l'adolescent par l'association coils-sclérosants. P. Fajadet, L. Carfagna, O. Loustau, J. Vial, J. Moscovici, J.J. Railhac, N. Sans. Radiologie Interventionnelle
Résultat du traitement de la varicocèle chez l'adolescent par l'association coils-sclérosants. P. Fajadet, L. Carfagna, O. Loustau, J. Vial, J. Moscovici, J.J. Railhac, N. Sans. Radiologie Interventionnelle
LES NOUVEAUX ANTICOAGULANTS
 LES NOUVEAUX ANTICOAGULANTS Pr. Alessandra Bura-Rivière, Service de Médecine Vasculaire Hôpital Rangueil, 1 avenue Jean Poulhès, 31059 Toulouse cedex 9 INTRODUCTION Depuis plus de cinquante ans, les héparines
LES NOUVEAUX ANTICOAGULANTS Pr. Alessandra Bura-Rivière, Service de Médecine Vasculaire Hôpital Rangueil, 1 avenue Jean Poulhès, 31059 Toulouse cedex 9 INTRODUCTION Depuis plus de cinquante ans, les héparines
Votre guide des définitions des maladies graves de l Assurance maladies graves express
 Votre guide des définitions des maladies graves de l Assurance maladies graves express Votre guide des définitions des maladies graves de l Assurance maladies graves express Ce guide des définitions des
Votre guide des définitions des maladies graves de l Assurance maladies graves express Votre guide des définitions des maladies graves de l Assurance maladies graves express Ce guide des définitions des
La recherche clinique au cœur du progrès thérapeutique
 2 èmes Assises de l Innovation Thérapeutique Paris, 05-11-2014 La recherche clinique au cœur du progrès thérapeutique Pr. Jean-François DHAINAUT Président du Groupement Inter-régional de la Recherche Clinique
2 èmes Assises de l Innovation Thérapeutique Paris, 05-11-2014 La recherche clinique au cœur du progrès thérapeutique Pr. Jean-François DHAINAUT Président du Groupement Inter-régional de la Recherche Clinique
Livret d accueil des stagiaires
 Livret d accueil des stagiaires SOMMAIRE : I/ Présentation du service II/Le métier de manipulateur III/ Modalités d encadrement IV/ Votre stage V/ Bilan global de votre stage I/ Présentation du service
Livret d accueil des stagiaires SOMMAIRE : I/ Présentation du service II/Le métier de manipulateur III/ Modalités d encadrement IV/ Votre stage V/ Bilan global de votre stage I/ Présentation du service
Modules optionnels. Passer à l acte en implantologie
 Passer à l acte en implantologie Modules optionnels est un cycle de formation basé sur des travaux pratiques de chirurgie implantaire, permettant de confirmer les acquis théoriques. À l issue du cursus,
Passer à l acte en implantologie Modules optionnels est un cycle de formation basé sur des travaux pratiques de chirurgie implantaire, permettant de confirmer les acquis théoriques. À l issue du cursus,
Ministère des affaires sociales, de la santé et des droits des femmes
 Ministère des affaires sociales, de la santé et des droits des femmes Direction générale de l offre de soins Sous-direction du pilotage de la performance des acteurs de l offre de soins Bureau Innovation
Ministère des affaires sociales, de la santé et des droits des femmes Direction générale de l offre de soins Sous-direction du pilotage de la performance des acteurs de l offre de soins Bureau Innovation
INFORMATION À DESTINATION DES PROFESSIONNELS DE SANTÉ LE DON DU VIVANT
 INFORMATION À DESTINATION DES PROFESSIONNELS DE SANTÉ LE DON DU VIVANT Les étapes du don de rein DONNER UN REIN DE SON VIVANT PEUT concerner CHACUN le don du vivant 3 /////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////
INFORMATION À DESTINATION DES PROFESSIONNELS DE SANTÉ LE DON DU VIVANT Les étapes du don de rein DONNER UN REIN DE SON VIVANT PEUT concerner CHACUN le don du vivant 3 /////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////
TVP fémorale. Systématisation. La TVP : écho-doppler JP Laroche Unité de Médecine Vasculaire CHU Montpellier. Thrombus mobile
 Systématisation VCI Fémorale Superf. 3/4 Iliaque Poplitée La TVP : écho-doppler JP Laroche Unité de Médecine Vasculaire CHU Montpellier Mars 2015 Fémorale Sural Difficultés et Pièges: écho-doppler Veineux
Systématisation VCI Fémorale Superf. 3/4 Iliaque Poplitée La TVP : écho-doppler JP Laroche Unité de Médecine Vasculaire CHU Montpellier Mars 2015 Fémorale Sural Difficultés et Pièges: écho-doppler Veineux
ALTO : des outils d information sur les pathologies thromboemboliques veineuses ou artérielles et leur traitement
 Communiqué de presse Bayer HealthCare S.A.S. Parc Eurasanté 220, avenue de la Recherche 59120 LOOS France Tel.+333 28 16 34 00 www.bayerhealthcare.fr Favoriser l observance avec ALTO : l engagement de
Communiqué de presse Bayer HealthCare S.A.S. Parc Eurasanté 220, avenue de la Recherche 59120 LOOS France Tel.+333 28 16 34 00 www.bayerhealthcare.fr Favoriser l observance avec ALTO : l engagement de
Format de l avis d efficience
 AVIS D EFFICIENCE Format de l avis d efficience Juillet 2013 Commission évaluation économique et de santé publique Ce document est téléchargeable sur www.has-sante.fr Haute Autorité de santé Service documentation
AVIS D EFFICIENCE Format de l avis d efficience Juillet 2013 Commission évaluation économique et de santé publique Ce document est téléchargeable sur www.has-sante.fr Haute Autorité de santé Service documentation
fréquence - Stimulateur chambre ventriculaire Indications retenues : est normale Service Attendu (SA) : Comparateu retenu : Amélioration Nom de marque
 COMMISSION NATIONALE D EVALUATION DES DISPOSITIFS MEDICAUX ET DES TECHNOLOGIES DEE SANTE AVIS DE LA CNEDiMTS 01 juillet 2014 CONCLUSIONS ELUNA 8 SR-T, stimulateur cardiaque implantable simple s chambre
COMMISSION NATIONALE D EVALUATION DES DISPOSITIFS MEDICAUX ET DES TECHNOLOGIES DEE SANTE AVIS DE LA CNEDiMTS 01 juillet 2014 CONCLUSIONS ELUNA 8 SR-T, stimulateur cardiaque implantable simple s chambre
Assurance Maladie. Le développement de la Chirurgie ambulatoire par la MSAP et les incitations tarifaires
 Assurance Maladie Le développement de la Chirurgie ambulatoire par la MSAP et les incitations tarifaires 1. LA MSAP Principe Les textes Les gestes retenus Bilan MSAP 2011 2. LES MESURES TARIFAIRES INCITATIVES
Assurance Maladie Le développement de la Chirurgie ambulatoire par la MSAP et les incitations tarifaires 1. LA MSAP Principe Les textes Les gestes retenus Bilan MSAP 2011 2. LES MESURES TARIFAIRES INCITATIVES
Chirurgie assistée par robot et laparoscopie en 3D à l avantage des patients?
 HigHligHts 2012: CHiRURgiE Chirurgie assistée par robot et laparoscopie en 3D à l avantage des patients? Lukasz Filip Grochola a, Hubert John b, Thomas Hess c, Stefan Breitenstein d a Clinique de chirurgie
HigHligHts 2012: CHiRURgiE Chirurgie assistée par robot et laparoscopie en 3D à l avantage des patients? Lukasz Filip Grochola a, Hubert John b, Thomas Hess c, Stefan Breitenstein d a Clinique de chirurgie
COMMISSION DE LA TRANSPARENCE. Avis. 10 mars 2010
 COMMISSION DE LA TRANSPARENCE Avis 10 mars 2010 ARIXTRA 1,5 mg/0,3 ml, solution injectable en seringue pré-remplie - Boîte de 2 (CIP : 363 500-6) - Boîte de 7 (CIP : 363 501-2) - Boîte de 10 (CIP : 564
COMMISSION DE LA TRANSPARENCE Avis 10 mars 2010 ARIXTRA 1,5 mg/0,3 ml, solution injectable en seringue pré-remplie - Boîte de 2 (CIP : 363 500-6) - Boîte de 7 (CIP : 363 501-2) - Boîte de 10 (CIP : 564
Réparation de la communication interauriculaire (CIA) Informations destinées aux patients
 Réparation de la communication interauriculaire (CIA) Informations destinées aux patients Schéma du cœur avec CIA Aorte Artère pulmonaire Oreillette gauche CIA Appendice auriculaire gauche Oreillette droite
Réparation de la communication interauriculaire (CIA) Informations destinées aux patients Schéma du cœur avec CIA Aorte Artère pulmonaire Oreillette gauche CIA Appendice auriculaire gauche Oreillette droite
Positionnement de l implant
 HORS SÉRIE Hors série - 2009 Positionnement de l implant Déterminants biologiques et précision NobelActive NobelGuide Chirurgie à minima et esthétique ESTHÉTIQUE ET CHIRURGIE GUIDÉE AVEC NOBELACTIVE PAR
HORS SÉRIE Hors série - 2009 Positionnement de l implant Déterminants biologiques et précision NobelActive NobelGuide Chirurgie à minima et esthétique ESTHÉTIQUE ET CHIRURGIE GUIDÉE AVEC NOBELACTIVE PAR
dossier de presse nouvelle activité au CHU de Tours p a r t e n a r i a t T o u r s - P o i t i e r s - O r l é a n s
 dossier de presse nouvelle activité au CHU de Tours lat ransplantation hépatique p a r t e n a r i a t T o u r s - P o i t i e r s - O r l é a n s Contact presse Anne-Karen Nancey - Direction de la communication
dossier de presse nouvelle activité au CHU de Tours lat ransplantation hépatique p a r t e n a r i a t T o u r s - P o i t i e r s - O r l é a n s Contact presse Anne-Karen Nancey - Direction de la communication
S o m m a i r e 1. Sémiologie 2. Thérapeutique
 Sommaire 1. Sémiologie... 1 Auscultation cardiaque... 1 Foyers d auscultation cardiaque... 1 Bruits du cœur... 1 Souffles fonctionnels... 2 Souffles organiques... 2 Souffle cardiaque chez l enfant... 3
Sommaire 1. Sémiologie... 1 Auscultation cardiaque... 1 Foyers d auscultation cardiaque... 1 Bruits du cœur... 1 Souffles fonctionnels... 2 Souffles organiques... 2 Souffle cardiaque chez l enfant... 3
LIGNES DIRECTRICES CLINIQUES TOUT AU LONG DU CONTINUUM DE SOINS : Objectif de ce chapitre. 6.1 Introduction 86
 LIGNES DIRECTRICES CLINIQUES TOUT AU LONG DU CONTINUUM DE SOINS : ÉTABLISSEMENT DE LIENS ENTRE LES PERSONNES CHEZ QUI UN DIAGNOSTIC D INFECTION À VIH A ÉTÉ POSÉ ET LES SERVICES DE SOINS ET DE TRAITEMENT
LIGNES DIRECTRICES CLINIQUES TOUT AU LONG DU CONTINUUM DE SOINS : ÉTABLISSEMENT DE LIENS ENTRE LES PERSONNES CHEZ QUI UN DIAGNOSTIC D INFECTION À VIH A ÉTÉ POSÉ ET LES SERVICES DE SOINS ET DE TRAITEMENT
Traitement des plaies par pression négative (TPN) : des utilisations spécifiques et limitées
 BON USAGE DES TECHNOLOGIES DE SANTÉ Traitement des plaies par pression négative (TPN) : des utilisations spécifiques et limitées Les systèmes de traitement des plaies par pression négative (TPN) sont des
BON USAGE DES TECHNOLOGIES DE SANTÉ Traitement des plaies par pression négative (TPN) : des utilisations spécifiques et limitées Les systèmes de traitement des plaies par pression négative (TPN) sont des
CEPHALEES POST-BRECHE DURALE. Post Dural Puncture Headache (PDPH)
 CEPHALEES POST-BRECHE DURALE Post Dural Puncture Headache (PDPH) G. Buzançais Dr E. Morau 6 Mars 2013 Plan Introduction Physiopathologie Traitements Conclusion Définitions Brèche durale Ponction de dure-mère
CEPHALEES POST-BRECHE DURALE Post Dural Puncture Headache (PDPH) G. Buzançais Dr E. Morau 6 Mars 2013 Plan Introduction Physiopathologie Traitements Conclusion Définitions Brèche durale Ponction de dure-mère
PRINTEMPS MEDICAL DE BOURGOGNE ASSOCIATIONS ANTIAGREGANTS ET ANTICOAGULANTS : INDICATIONS ET CONTRE INDICATIONS
 PRINTEMPS MEDICAL DE BOURGOGNE ASSOCIATIONS ANTIAGREGANTS ET ANTICOAGULANTS : INDICATIONS ET CONTRE INDICATIONS Dr Mourot cardiologue Hôpital d Auxerre le 31 mars 2012 PLAN DE LA PRESENTATION ASSOCIATION
PRINTEMPS MEDICAL DE BOURGOGNE ASSOCIATIONS ANTIAGREGANTS ET ANTICOAGULANTS : INDICATIONS ET CONTRE INDICATIONS Dr Mourot cardiologue Hôpital d Auxerre le 31 mars 2012 PLAN DE LA PRESENTATION ASSOCIATION
da Vinci Pontage gastrique
 da Vinci Pontage gastrique Une nouvelle approche de la chirurgie bariatrique Êtes-vous intéressé par la dernière option de traitement de l'obésité? Votre docteur peut vous proposer une nouvelle procédure
da Vinci Pontage gastrique Une nouvelle approche de la chirurgie bariatrique Êtes-vous intéressé par la dernière option de traitement de l'obésité? Votre docteur peut vous proposer une nouvelle procédure
Les défibrillateurs cardiaques implantables
 Les défibrillateurs cardiaques implantables Etudes d'évaluation économique Etudes d'évaluation technologique Avant-propos Cette étude a été réalisée, à la demande de la Caisse Nationale de l'assurance
Les défibrillateurs cardiaques implantables Etudes d'évaluation économique Etudes d'évaluation technologique Avant-propos Cette étude a été réalisée, à la demande de la Caisse Nationale de l'assurance
ROBOT ET CHIRURGIE AORTIQUE:
 ROBOT ET CHIRURGIE AORTIQUE: FAISABILITÉ ET PERSPECTIVES FUTURES Fabien THAVEAU, Nabil CHAKFE, Jean-Georges KRETZ Service de Chirurgie Vasculaire, Strasbourg INTRODUCTION CHIRURGIE MINI-INVASIVE: but:
ROBOT ET CHIRURGIE AORTIQUE: FAISABILITÉ ET PERSPECTIVES FUTURES Fabien THAVEAU, Nabil CHAKFE, Jean-Georges KRETZ Service de Chirurgie Vasculaire, Strasbourg INTRODUCTION CHIRURGIE MINI-INVASIVE: but:
Essais cliniques de phase 0 : état de la littérature 2006-2009
 17 èmes Journées des Statisticiens des Centres de Lutte contre le Cancer 4 ème Conférence Francophone d Epidémiologie Clinique Essais cliniques de phase 0 : état de la littérature 2006-2009 Q Picat, N
17 èmes Journées des Statisticiens des Centres de Lutte contre le Cancer 4 ème Conférence Francophone d Epidémiologie Clinique Essais cliniques de phase 0 : état de la littérature 2006-2009 Q Picat, N
GUIDE POUR LA MISE SUR LE MARCHÉ DE DISPOSITIFS MÉDICAUX SUR MESURE APPLIQUE AU SECTEUR DENTAIRE
 Actualisation Mai 2012 Direction de l'evaluation des Dispositifs Médicaux Département Surveillance du Marché GUIDE POUR LA MISE SUR LE MARCHÉ DE DISPOSITIFS MÉDICAUX SUR MESURE APPLIQUE AU SECTEUR DENTAIRE
Actualisation Mai 2012 Direction de l'evaluation des Dispositifs Médicaux Département Surveillance du Marché GUIDE POUR LA MISE SUR LE MARCHÉ DE DISPOSITIFS MÉDICAUX SUR MESURE APPLIQUE AU SECTEUR DENTAIRE
Traitement des Pseudarthroses des Os Longs par Greffe Percutanée de Moelle Osseuse Autologue Concentrée
 Traitement des Pseudarthroses des Os Longs par Greffe Percutanée de Moelle Osseuse Autologue Concentrée Etude rétrospective de 45 cas Didier MAINARD, Jérôme DILIGENT Service de Chirurgie Orthopédique,
Traitement des Pseudarthroses des Os Longs par Greffe Percutanée de Moelle Osseuse Autologue Concentrée Etude rétrospective de 45 cas Didier MAINARD, Jérôme DILIGENT Service de Chirurgie Orthopédique,
Nouveaux rôles infirmiers : une nécessité pour la santé publique et la sécurité des soins, un avenir pour la profession
 Position adoptée par Conseil national de l Ordre des infirmiers le 14 septembre 2010 Nouveaux rôles infirmiers : une nécessité pour la santé publique et la sécurité des soins, un avenir pour la profession
Position adoptée par Conseil national de l Ordre des infirmiers le 14 septembre 2010 Nouveaux rôles infirmiers : une nécessité pour la santé publique et la sécurité des soins, un avenir pour la profession
Transplantation pulmonaire et mucoviscidose. Optimiser la prise en charge médicale
 Transplantation pulmonaire et mucoviscidose Optimiser la prise en charge médicale Dr Isabelle Danner-Boucher CRCM adulte de Nantes Unité de Transplantation Thoracique 11èmes Journées Scientifiques de la
Transplantation pulmonaire et mucoviscidose Optimiser la prise en charge médicale Dr Isabelle Danner-Boucher CRCM adulte de Nantes Unité de Transplantation Thoracique 11èmes Journées Scientifiques de la
Leucémies de l enfant et de l adolescent
 Janvier 2014 Fiche tumeur Prise en charge des adolescents et jeunes adultes Leucémies de l enfant et de l adolescent GENERALITES COMMENT DIAGNOSTIQUE-T-ON UNE LEUCEMIE AIGUË? COMMENT TRAITE-T-ON UNE LEUCEMIE
Janvier 2014 Fiche tumeur Prise en charge des adolescents et jeunes adultes Leucémies de l enfant et de l adolescent GENERALITES COMMENT DIAGNOSTIQUE-T-ON UNE LEUCEMIE AIGUË? COMMENT TRAITE-T-ON UNE LEUCEMIE
Collection Soins infirmiers
 Collection Soins infirmiers Une production du Université de Caen Basse-Normandie Traumatologie : traitements des fractures Dr. J-P de ROSA CH. AVRANCHES-GRANVILLE Fractures diagnostic 2 Fractures-diagnostic
Collection Soins infirmiers Une production du Université de Caen Basse-Normandie Traumatologie : traitements des fractures Dr. J-P de ROSA CH. AVRANCHES-GRANVILLE Fractures diagnostic 2 Fractures-diagnostic
La mesure de la réserve coronaire
 Revues Générales Qu est-ce que la FFR? Comment l utiliser? réalités Cardiologiques # 291_Janvier/Février 2013 Résumé : La mesure de la réserve coronaire (FFR : Fractional Flow Reserve) s est imposée depuis
Revues Générales Qu est-ce que la FFR? Comment l utiliser? réalités Cardiologiques # 291_Janvier/Février 2013 Résumé : La mesure de la réserve coronaire (FFR : Fractional Flow Reserve) s est imposée depuis
La solution santé et prévoyance modulable de Generali.
 La solution santé et prévoyance modulable de Generali. 2 Pour faire face aux aléas de la vie La Prévoyance Entreprise 6-20 de Generali est un contrat de prévoyance/santé qui vous permet d apporter à vos
La solution santé et prévoyance modulable de Generali. 2 Pour faire face aux aléas de la vie La Prévoyance Entreprise 6-20 de Generali est un contrat de prévoyance/santé qui vous permet d apporter à vos
Règlement concernant l obtention du «CERTIFICAT SSO DE FORMATION POSTGRADE (CFP SSO) EN IMPLANTOLOGIE ORALE»
 Règlement concernant l obtention du «CERTIFICAT SSO DE FORMATION POSTGRADE (CFP SSO) EN IMPLANTOLOGIE ORALE» INDEX: 1. Bases 2. Objectifs de formation postgrade 3. Candidature en vue de l obtention du
Règlement concernant l obtention du «CERTIFICAT SSO DE FORMATION POSTGRADE (CFP SSO) EN IMPLANTOLOGIE ORALE» INDEX: 1. Bases 2. Objectifs de formation postgrade 3. Candidature en vue de l obtention du
Télé-expertise et surveillance médicale à domicile au service de la médecine générale :
 Télé-expertise et surveillance médicale à domicile au service de la médecine générale : Docteur DARY Patrick, Cardiologue, Praticien Hospitalier Centre Hospitalier de St YRIEIX - Haute Vienne 87500 Situé
Télé-expertise et surveillance médicale à domicile au service de la médecine générale : Docteur DARY Patrick, Cardiologue, Praticien Hospitalier Centre Hospitalier de St YRIEIX - Haute Vienne 87500 Situé
Nos expertises au service des salariés et des entreprises. Entreprises de. la restauration rapide, votre formule santé
 Nos expertises au service des salariés et des entreprises Entreprises de la restauration rapide, votre formule santé Votre régime frais de santé Entreprise, salariés : une solution Gagnant - Gagnant La
Nos expertises au service des salariés et des entreprises Entreprises de la restauration rapide, votre formule santé Votre régime frais de santé Entreprise, salariés : une solution Gagnant - Gagnant La
Don d organes et mort cérébrale. Drs JL Frances & F Hervé Praticiens hospitaliers en réanimation polyvalente Hôpital Laennec, Quimper
 Don d organes et mort cérébrale Drs JL Frances & F Hervé Praticiens hospitaliers en réanimation polyvalente Hôpital Laennec, Quimper La mort cérébrale Cessation irréversible de toute fonction cérébrale
Don d organes et mort cérébrale Drs JL Frances & F Hervé Praticiens hospitaliers en réanimation polyvalente Hôpital Laennec, Quimper La mort cérébrale Cessation irréversible de toute fonction cérébrale
PLACE DE L IRM DANS LE BILAN D EXTENSION DU CANCER DU RECTUM. Professeur Paul LEGMANN Radiologie A - Cochin Paris
 PLACE DE L IRM DANS LE BILAN D EXTENSION DU CANCER DU RECTUM Professeur Paul LEGMANN Radiologie A - Cochin Paris Cancer du rectum France : 15000 décès/an : 1ère cause. Pronostic souvent réservé Métastases
PLACE DE L IRM DANS LE BILAN D EXTENSION DU CANCER DU RECTUM Professeur Paul LEGMANN Radiologie A - Cochin Paris Cancer du rectum France : 15000 décès/an : 1ère cause. Pronostic souvent réservé Métastases
Avis 23 avril 2014. BARITEKAL 20 mg/ml, solution injectable Boîte de 10 ampoules de 5 ml (CIP : 34009 585 896 3 8) Laboratoire NORDIC PHARMA
 COMMISSION DE LA TRANSPARENCE Avis 23 avril 2014 BARITEKAL 20 mg/ml, solution injectable Boîte de 10 ampoules de 5 ml (CIP : 34009 585 896 3 8) Laboratoire NORDIC PHARMA DCI Code ATC (2012) Motif de l
COMMISSION DE LA TRANSPARENCE Avis 23 avril 2014 BARITEKAL 20 mg/ml, solution injectable Boîte de 10 ampoules de 5 ml (CIP : 34009 585 896 3 8) Laboratoire NORDIC PHARMA DCI Code ATC (2012) Motif de l
La Dysplasie Ventriculaire Droite Arythmogène
 1 La Dysplasie Ventriculaire Droite Arythmogène Document rédigé par l équipe pluridisciplinaire du centre de référence pour les maladies cardiaques héréditaires (Paris), en collaboration avec des patients
1 La Dysplasie Ventriculaire Droite Arythmogène Document rédigé par l équipe pluridisciplinaire du centre de référence pour les maladies cardiaques héréditaires (Paris), en collaboration avec des patients
Ordelys santé. senior. Ordelys. santé senior. Demande d adhesion immédiate, Adhésion à partir de 55 ans
 Demande d adhesion immédiate, Sans questionnaire de santé, ni délai d attente san Ordelys santé Complémentaire santé senior Ordelys santé senior Adhésion à partir de 55 ans Vos garanties /// ORDELYS SANTE
Demande d adhesion immédiate, Sans questionnaire de santé, ni délai d attente san Ordelys santé Complémentaire santé senior Ordelys santé senior Adhésion à partir de 55 ans Vos garanties /// ORDELYS SANTE
Le traitement conservateur des tumeurs malignes des membres a largement remplacé les amputations
 FACE A FACE Péroné vascularisé / Péroné non vascularisé Reconstruction après résection tumorale Dr NOURI / Dr BEN MAITIGUE SOTCOT Juin 2012 Le traitement conservateur des tumeurs malignes des membres a
FACE A FACE Péroné vascularisé / Péroné non vascularisé Reconstruction après résection tumorale Dr NOURI / Dr BEN MAITIGUE SOTCOT Juin 2012 Le traitement conservateur des tumeurs malignes des membres a
Item 169 : Évaluation thérapeutique et niveau de preuve
 Item 169 : Évaluation thérapeutique et niveau de preuve COFER, Collège Français des Enseignants en Rhumatologie Date de création du document 2010-2011 Table des matières ENC :...3 SPECIFIQUE :...3 I Différentes
Item 169 : Évaluation thérapeutique et niveau de preuve COFER, Collège Français des Enseignants en Rhumatologie Date de création du document 2010-2011 Table des matières ENC :...3 SPECIFIQUE :...3 I Différentes
MODULE D EXERCICE PROFESSIONNEL NOTION MÉDICO-ÉCONOMIQUE DES DE RADIOLOGIE ET IMAGERIE MÉDICALE. Dr F Lefèvre (1-2), Pr M Claudon (2)
 MODULE D EXERCICE PROFESSIONNEL NOTION MÉDICO-ÉCONOMIQUE DES DE RADIOLOGIE ET IMAGERIE MÉDICALE Dr F Lefèvre (1-2), Pr M Claudon (2) 1 - SCP Radiolor 2 - CHU de Nancy MODE D EXERCICE DU PRATICIEN Choix
MODULE D EXERCICE PROFESSIONNEL NOTION MÉDICO-ÉCONOMIQUE DES DE RADIOLOGIE ET IMAGERIE MÉDICALE Dr F Lefèvre (1-2), Pr M Claudon (2) 1 - SCP Radiolor 2 - CHU de Nancy MODE D EXERCICE DU PRATICIEN Choix
ORGANISATION D UN SECTEUR DE RADIOLOGIE INTERVENTIONNELLE
 ORGANISATION D UN SECTEUR DE RADIOLOGIE INTERVENTIONNELLE F. JOFFRE La radiologie interventionnelle est une activité spécifique qui implique des moyens humains et matériels ainsi que des structures spécifiques.
ORGANISATION D UN SECTEUR DE RADIOLOGIE INTERVENTIONNELLE F. JOFFRE La radiologie interventionnelle est une activité spécifique qui implique des moyens humains et matériels ainsi que des structures spécifiques.
L axe 5 du Cancéropole Nord Ouest
 L axe 5 du Cancéropole Nord Ouest Cancers, Individu id & Société L état des lieux d un pari Le Rapport Cordier 1 Biomarqueurs prédictifs 2 L axe 5 du Cancéropole Nord Ouest Cancers, Individu & Société
L axe 5 du Cancéropole Nord Ouest Cancers, Individu id & Société L état des lieux d un pari Le Rapport Cordier 1 Biomarqueurs prédictifs 2 L axe 5 du Cancéropole Nord Ouest Cancers, Individu & Société
Traitements néoadjuvants des cancers du rectum. Pr. G. Portier CHU Purpan - Toulouse
 Traitements néoadjuvants des cancers du rectum Pr. G. Portier CHU Purpan - Toulouse Journées Francophones d Hépato-gastroentérologie et d Oncologie Digestive 2010 CONFLITS D INTÉRÊT Pas de conflit d intérêt
Traitements néoadjuvants des cancers du rectum Pr. G. Portier CHU Purpan - Toulouse Journées Francophones d Hépato-gastroentérologie et d Oncologie Digestive 2010 CONFLITS D INTÉRÊT Pas de conflit d intérêt
Échographie normale et pathologique du grand pectoral
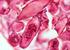 Échographie normale et pathologique du grand pectoral JL Brasseur, N Gault, B Mendes, D Zeitoun-Eiss, J Renoux, P Grenier G H Pitié-Salpêtrière Introduction La pathologie du grand pectoral est relativement
Échographie normale et pathologique du grand pectoral JL Brasseur, N Gault, B Mendes, D Zeitoun-Eiss, J Renoux, P Grenier G H Pitié-Salpêtrière Introduction La pathologie du grand pectoral est relativement
«La Mutualité Française ouvre de nouveaux chantiers innovants.»
 39 e Congrès de la Mutualité Française Résolution générale «La Mutualité Française ouvre de nouveaux chantiers innovants.» La crise financière, économique, sociale et écologique frappe durement notre pays,
39 e Congrès de la Mutualité Française Résolution générale «La Mutualité Française ouvre de nouveaux chantiers innovants.» La crise financière, économique, sociale et écologique frappe durement notre pays,
Chambres à cathéter implantables
 Chambres à cathéter implantables Pas de conflits d intérêt avec le sujet traité APHAL Formation PPH Jeudi 19 mars 2015 Sébastien GEORGET Pharmacie Centre Psychothérapique de Nancy Définition (1) Définition
Chambres à cathéter implantables Pas de conflits d intérêt avec le sujet traité APHAL Formation PPH Jeudi 19 mars 2015 Sébastien GEORGET Pharmacie Centre Psychothérapique de Nancy Définition (1) Définition
SYNOPSIS INFORMATIONS GÉNÉRALES
 Evaluation de l utilisation d un anticoagulant anti-xa direct oral, Apixaban, dans la prévention de la maladie thromboembolique veineuse chez les patients traités par IMiDs au cours du myélome : étude
Evaluation de l utilisation d un anticoagulant anti-xa direct oral, Apixaban, dans la prévention de la maladie thromboembolique veineuse chez les patients traités par IMiDs au cours du myélome : étude
Juillet 2015. Découvrez votre régime frais de santé. Entreprises des articles de sports et équipements de loisirs. Assuré par
 Juillet 2015 Découvrez votre régime frais de santé Entreprises des articles de sports et équipements de loisirs Assuré par Votre régime frais de santé UN RÉGIME FRAIS DE SANTÉ LABELLISÉ PAR VOTRE PROFESSION
Juillet 2015 Découvrez votre régime frais de santé Entreprises des articles de sports et équipements de loisirs Assuré par Votre régime frais de santé UN RÉGIME FRAIS DE SANTÉ LABELLISÉ PAR VOTRE PROFESSION
Nouveau plan greffe : Axes stratégiques pour l avenir
 Extrait Communiqué de presse Saint-Denis, le 12 avril 2012 Nouveau plan greffe : Axes stratégiques pour l avenir La dynamique du plan greffe 2000-2003 a généré un essor sans précédent de près de 50 % de
Extrait Communiqué de presse Saint-Denis, le 12 avril 2012 Nouveau plan greffe : Axes stratégiques pour l avenir La dynamique du plan greffe 2000-2003 a généré un essor sans précédent de près de 50 % de
Télémédecine, télésanté, esanté. Pr. François KOHLER kohler@medecine.uhp-nancy.fr
 Télémédecine, télésanté, esanté Pr. François KOHLER kohler@medecine.uhp-nancy.fr Télémédecine : Définition et domaines «Exercice de la médecine à distance» => Implique un médecin En France : Décret n 2010-1229
Télémédecine, télésanté, esanté Pr. François KOHLER kohler@medecine.uhp-nancy.fr Télémédecine : Définition et domaines «Exercice de la médecine à distance» => Implique un médecin En France : Décret n 2010-1229
La prise en charge de l AVC ischémique à l urgence
 La prise en charge de l AVC ischémique à l urgence Nathalie Bourdages, inf., B. Sc., conseillère en soins infirmiers, Direction des soins infirmiers et des regroupement clientèles, Centre hospitalier de
La prise en charge de l AVC ischémique à l urgence Nathalie Bourdages, inf., B. Sc., conseillère en soins infirmiers, Direction des soins infirmiers et des regroupement clientèles, Centre hospitalier de
POLITIQUE DE SECURITE DE L EFS ou la nécessité de construire un système sûr, durable, évolutif et raisonné
 POLITIQUE DE SECURITE DE L EFS ou la nécessité de construire un système sûr, durable, évolutif et raisonné Congrès SFSP, Jeudi 3 novembre 2011 Contexte et objectifs Sécurité transfusionnelle = Préoccupation
POLITIQUE DE SECURITE DE L EFS ou la nécessité de construire un système sûr, durable, évolutif et raisonné Congrès SFSP, Jeudi 3 novembre 2011 Contexte et objectifs Sécurité transfusionnelle = Préoccupation
Synthes ProPlan CMF. Service de planification et produits spécifiques de patient pour la chirurgie craniomaxillo-faciale.
 Synthes ProPlan CMF. Service de planification et produits spécifiques de patient pour la chirurgie craniomaxillo-faciale. Exécution en bloc opératoire de procédures planifiées en préopératoire Réduction
Synthes ProPlan CMF. Service de planification et produits spécifiques de patient pour la chirurgie craniomaxillo-faciale. Exécution en bloc opératoire de procédures planifiées en préopératoire Réduction
J. Goupil (1), A. Fohlen (1), V. Le Pennec (1), O. Lepage (2), M. Hamon (2), M. Hamon-Kérautret (1)
 J. Goupil (1), A. Fohlen (1), V. Le Pennec (1), O. Lepage (2), M. Hamon (2), M. Hamon-Kérautret (1) (1) Pôle d Imagerie, service de Radiologie, CHU Caen (2) Pôle Cardio-thoracique, service de Chirurgie
J. Goupil (1), A. Fohlen (1), V. Le Pennec (1), O. Lepage (2), M. Hamon (2), M. Hamon-Kérautret (1) (1) Pôle d Imagerie, service de Radiologie, CHU Caen (2) Pôle Cardio-thoracique, service de Chirurgie
Transplantation hépatique à donneur vivant apparenté. Olivier Scatton, Olivier Soubrane, Service de chirurgie Cochin
 Transplantation hépatique à donneur vivant apparenté Olivier Scatton, Olivier Soubrane, Service de chirurgie Cochin Introduction Le prélèvement d une partie du foie chez une personne «vivante» et apparentée
Transplantation hépatique à donneur vivant apparenté Olivier Scatton, Olivier Soubrane, Service de chirurgie Cochin Introduction Le prélèvement d une partie du foie chez une personne «vivante» et apparentée
Grossesse et HTA. J Potin. Service de Gynécologie-Obstétrique B Centre Olympe de Gouges CHU de Tours
 Grossesse et HTA J Potin Service de Gynécologie-Obstétrique B Centre Olympe de Gouges CHU de Tours HTA et grossesse Pathologie fréquente : 2 à 5 % des grossesses (2 à 3 % des multipares, 4 à 8 % des primipares)
Grossesse et HTA J Potin Service de Gynécologie-Obstétrique B Centre Olympe de Gouges CHU de Tours HTA et grossesse Pathologie fréquente : 2 à 5 % des grossesses (2 à 3 % des multipares, 4 à 8 % des primipares)
Cette intervention aura donc été décidée par votre chirurgien pour une indication bien précise.
 Qu est-ce qu une arthroscopie? Il s agit d une intervention chirurgicale mini-invasive dont le but est d explorer l articulation du genou et de traiter la lésion observée dans le même temps. Comment se
Qu est-ce qu une arthroscopie? Il s agit d une intervention chirurgicale mini-invasive dont le but est d explorer l articulation du genou et de traiter la lésion observée dans le même temps. Comment se
Dr Marie-Pierre CRESTA. Agence de la biomédecine SRA Sud-Est/Océan Indien. Juin 2014
 Dr Marie-Pierre CRESTA Agence de la biomédecine SRA Sud-Est/Océan Indien Juin 2014 Que savoir en tant que citoyen? Les LBE La greffe, ça marche Que savoir en tant que professionnel? Pénurie, contexte épidémiologique
Dr Marie-Pierre CRESTA Agence de la biomédecine SRA Sud-Est/Océan Indien Juin 2014 Que savoir en tant que citoyen? Les LBE La greffe, ça marche Que savoir en tant que professionnel? Pénurie, contexte épidémiologique
SAntium sa. Santium santé. senior. Santium. santé senior. Demande d adhesion immédiate, Adhésion de 50 à 89 ans
 Demande d adhesion immédiate, Sans questionnaire de santé, ni délai d attente SAntium sa Santium santé Complémentaire santé senior Santium santé senior Adhésion de 50 à 89 ans Vos garanties /// SANTIUM
Demande d adhesion immédiate, Sans questionnaire de santé, ni délai d attente SAntium sa Santium santé Complémentaire santé senior Santium santé senior Adhésion de 50 à 89 ans Vos garanties /// SANTIUM
Votre complémentaire santé collective avec Mutex - l alliance mutualiste
 Convention collective nationale des industries chimiques Votre complémentaire santé collective avec Mutex - l alliance mutualiste Offre labellisée par les Industries chimiques Une complémentaire santé
Convention collective nationale des industries chimiques Votre complémentaire santé collective avec Mutex - l alliance mutualiste Offre labellisée par les Industries chimiques Une complémentaire santé
LA COMPLEMENTAIRE SANTE OBLIGATOIRE : QUESTIONS/REPONSES
 LA COMPLEMENTAIRE SANTE OBLIGATOIRE : QUESTIONS/REPONSES UFT 68, rue CARDINET 75017 PARIS Tel : 01.47.66.49.68. SOMMAIRE I. Les obligations à l égard des entreprises... 2 À partir de quand les entreprises
LA COMPLEMENTAIRE SANTE OBLIGATOIRE : QUESTIONS/REPONSES UFT 68, rue CARDINET 75017 PARIS Tel : 01.47.66.49.68. SOMMAIRE I. Les obligations à l égard des entreprises... 2 À partir de quand les entreprises
Une infirmière re clinicienne en et soins de. Stomathérapie. fonction? L infirmière. re «clinicienne?» Rôle de l infirmil. ressource?
 Une stomathérapie et soins de plaies : intérêt d une d telle fonction? Marie Magdeleine lefort ULB Erasme re «clinicienne?» re praticienne «nurse practitioner» Prise en charge de pathologies spécifiques
Une stomathérapie et soins de plaies : intérêt d une d telle fonction? Marie Magdeleine lefort ULB Erasme re «clinicienne?» re praticienne «nurse practitioner» Prise en charge de pathologies spécifiques
PLAQUETTE D INFORMATION
 Mutuelle du personnel du groupe Société Générale PLAQUETTE D INFORMATION Registre National des Mutuelles N 784 410 805 Juillet 2010 Comment calculer un taux de remboursement de Mutuelle? Les remboursements
Mutuelle du personnel du groupe Société Générale PLAQUETTE D INFORMATION Registre National des Mutuelles N 784 410 805 Juillet 2010 Comment calculer un taux de remboursement de Mutuelle? Les remboursements
Diatélic DP : télémédecine pour la prévention des aggravations de santé des dialysés à domicile
 DP : télémédecine pour la prévention des aggravations de santé des dialysés à domicile Jacques CHANLIAU, François CHARPILLET, Pierre-Yves DURAND, Robert HERVY, Jean-Pierre THOMESSE, Luis VEGA Résumé. DP
DP : télémédecine pour la prévention des aggravations de santé des dialysés à domicile Jacques CHANLIAU, François CHARPILLET, Pierre-Yves DURAND, Robert HERVY, Jean-Pierre THOMESSE, Luis VEGA Résumé. DP
Quel apport de l imagerie dans les traitements anti-angiogéniques?
 Quel apport de l imagerie dans les traitements anti-angiogéniques? L Fournier, D Balvay, CA Cuénod Service de radiologie, Hôpital Européen Georges Pompidou Laboratoire de Recherche en Imagerie, Equipe
Quel apport de l imagerie dans les traitements anti-angiogéniques? L Fournier, D Balvay, CA Cuénod Service de radiologie, Hôpital Européen Georges Pompidou Laboratoire de Recherche en Imagerie, Equipe
Comment évaluer. la fonction contractile?
 Comment évaluer la fonction contractile? Pr Xavier MONNET Service de réanimation médicale Hôpital de Bicêtre Assistance publique Hôpitaux de Paris Conflit d intérêt Pulsion Medical Systems CAP PiCCO Echocardiographie
Comment évaluer la fonction contractile? Pr Xavier MONNET Service de réanimation médicale Hôpital de Bicêtre Assistance publique Hôpitaux de Paris Conflit d intérêt Pulsion Medical Systems CAP PiCCO Echocardiographie
AUDIT ISO SUR CESARIENNE CH MACON
 AUDIT ISO SUR CESARIENNE CH MACON JOURNEE DU «RESEAU MATER» Jeudi 18 novembre 2010 C. Brunet M.P. Veuillet Sage-femme cadre I.D.E. hygiéniste PRESENTATION DU SERVICE MATERNITE CH MACON niveau 2B PERSONNELS
AUDIT ISO SUR CESARIENNE CH MACON JOURNEE DU «RESEAU MATER» Jeudi 18 novembre 2010 C. Brunet M.P. Veuillet Sage-femme cadre I.D.E. hygiéniste PRESENTATION DU SERVICE MATERNITE CH MACON niveau 2B PERSONNELS
«Quelle information aux patients en recherche biomédicale? Quels enseignements en retirer pour la pratique quotidienne?»
 «Quelle information aux patients en recherche biomédicale? Quels enseignements en retirer pour la pratique quotidienne?» Dr Adeline Paris Unité de Pharmacologie Clinique Centre d Investigation Clinique
«Quelle information aux patients en recherche biomédicale? Quels enseignements en retirer pour la pratique quotidienne?» Dr Adeline Paris Unité de Pharmacologie Clinique Centre d Investigation Clinique
La Liste de Vérification Chirurgicale
 La Liste de Vérification Chirurgicale Dre Shannon Fraser Professeure Assistant, Université McGill Chef de la division de chirurgie générale M Bobby Paré Coordonnateur en Soins Infirmiers bloc opératoire
La Liste de Vérification Chirurgicale Dre Shannon Fraser Professeure Assistant, Université McGill Chef de la division de chirurgie générale M Bobby Paré Coordonnateur en Soins Infirmiers bloc opératoire
e-santé du transplanté rénal : la télémédecine au service du greffé
 e-santé du transplanté rénal : la télémédecine au service du greffé Professeur Michèle Kessler CHU de Nancy et réseau Néphrolor L une des applications de la télémédecine est la télésurveillance à domicile,
e-santé du transplanté rénal : la télémédecine au service du greffé Professeur Michèle Kessler CHU de Nancy et réseau Néphrolor L une des applications de la télémédecine est la télésurveillance à domicile,
des banques pour la recherche
 ADN, cellules, tissus... des banques pour la recherche FÉVRIER 2009 Les banques d échantillons de matériel biologique (tissus, cellules, ADN ), appelées biobanques, mettent à disposition des chercheurs
ADN, cellules, tissus... des banques pour la recherche FÉVRIER 2009 Les banques d échantillons de matériel biologique (tissus, cellules, ADN ), appelées biobanques, mettent à disposition des chercheurs
Ischémie myocardique silencieuse (IMS) et Diabète.
 Ischémie myocardique silencieuse (IMS) et Diabète. A propos d un cas clinique, sont rappelés: - les caractères cliniques et pronostiques de l IMS chez le diabétique, - la démarche de l identification de
Ischémie myocardique silencieuse (IMS) et Diabète. A propos d un cas clinique, sont rappelés: - les caractères cliniques et pronostiques de l IMS chez le diabétique, - la démarche de l identification de
cursus d implantologie orale Les clés du succès par le compagnonnage
 cursus d implantologie orale Les clés du succès par le compagnonnage Validé par un certificat - Crédit de 200 points Accrédité par le Conseil National de la Formation Continue en Odontologie Numéro d accréditation
cursus d implantologie orale Les clés du succès par le compagnonnage Validé par un certificat - Crédit de 200 points Accrédité par le Conseil National de la Formation Continue en Odontologie Numéro d accréditation
Guide Pratique Frais de santé
 Version janvier 2013 Guide Pratique Frais de santé Anciens salariés Site internet : www.cgam.fr E-mail : individuel@cgam.fr Adresse postale : CGAM 41207 ROMORANTIN Cedex Par téléphone au 02 54 88 38 14
Version janvier 2013 Guide Pratique Frais de santé Anciens salariés Site internet : www.cgam.fr E-mail : individuel@cgam.fr Adresse postale : CGAM 41207 ROMORANTIN Cedex Par téléphone au 02 54 88 38 14
Nos expertises au service des salariés et des entreprises. Septembre 2013. Entreprises de. la restauration rapide, votre formule santé
 Nos expertises au service des salariés et des entreprises Septembre 2013 Entreprises de la restauration rapide, votre formule santé Votre régime frais de santé Entreprise, salariés : une solution Gagnant
Nos expertises au service des salariés et des entreprises Septembre 2013 Entreprises de la restauration rapide, votre formule santé Votre régime frais de santé Entreprise, salariés : une solution Gagnant
METHODOLOGIE GENERALE DE LA RECHERCHE EPIDEMIOLOGIQUE : LES ENQUETES EPIDEMIOLOGIQUES
 Enseignement du Deuxième Cycle des Etudes Médicales Faculté de Médecine de Toulouse Purpan et Toulouse Rangueil Module I «Apprentissage de l exercice médical» Coordonnateurs Pr Alain Grand Pr Daniel Rougé
Enseignement du Deuxième Cycle des Etudes Médicales Faculté de Médecine de Toulouse Purpan et Toulouse Rangueil Module I «Apprentissage de l exercice médical» Coordonnateurs Pr Alain Grand Pr Daniel Rougé
L ACCÈS VEINEUX DE COURTE DURÉE CHEZ L ENFANT ET LE NOUVEAU-NÉ
 L ACCÈS VEINEUX DE COURTE DURÉE CHEZ L ENFANT ET LE NOUVEAU-NÉ Plan de la présentation Introduction L enfant Le cathéter court La voie veineuse centrale La voie intra-osseuse Plan de la présentation Le
L ACCÈS VEINEUX DE COURTE DURÉE CHEZ L ENFANT ET LE NOUVEAU-NÉ Plan de la présentation Introduction L enfant Le cathéter court La voie veineuse centrale La voie intra-osseuse Plan de la présentation Le
CARCEPT ÉVOLUTION SANTÉ PRÉSERVEZ VOTRE CAPITAL SANTÉ MUTUELLE CARCEPT PREV COMPLÉMENTAIRE SANTÉ
 CARCEPT ÉVOLUTION SANTÉ PRÉSERVEZ VOTRE CAPITAL SANTÉ MUTUELLE CARCEPT PREV COMPLÉMENTAIRE SANTÉ * Département 79 2 À partir de 46,93 / mois* pour un assuré de 60 ans en formule ECO Au fil du temps, les
CARCEPT ÉVOLUTION SANTÉ PRÉSERVEZ VOTRE CAPITAL SANTÉ MUTUELLE CARCEPT PREV COMPLÉMENTAIRE SANTÉ * Département 79 2 À partir de 46,93 / mois* pour un assuré de 60 ans en formule ECO Au fil du temps, les
