Innovation. Research. Care. Excellence
|
|
|
- Valérie Lapierre
- il y a 10 ans
- Total affichages :
Transcription
1 n e w s l e t t e r 6 - j u i n Innovation Research Care Excellence Dans ce numéro Spécial Cancer colorectal le groupe fête ses 10 ans La chirurgie pour cancer colorectal en 2008 Progrès dans le traitement des métastases Le diagnostic du cancer colorectal héréditaire Cliniques universitaires Saint-Luc Av Hippocrate, Bruxelles Belgique Tel: 02/ Fax: 02/
2 Guide des consultations - examens médico-techniques CANCERS DU SYSTEME DIGESTIF Pathologies Etage Local Rendez-vous ou accueil Clinique des pathologies tumorales du colon et du rectum Chirurgie et transplantation abdominale Pr R. DETRY Pr A. KARTHEUSER Dr C. REMUE Gastro-entérologie Dr K. AZZOUZI Dr O. DEWIT Dr H. PIESSEVAUX Génétique Pr K. DAHAN Oncologie médicale Pr Y. HUMBLET Dr M. MANO Radiothérapie oncologique Pr P. SCALLIET Coordonateur de soins oncologiques M. F. MADDALENA Coordonatrice de recherche clinique médicale Mme M DE COOMAN Clin-1 C9 Clin-1 C9 Clin-1 C9 Clin-2 Q7 Clin-2 Q7 Clin-2 Q7 Franklin 0 Clin-1 C9 Clin-1 C9 Clin-1 C9 US 42 US 42 Groupe Pluridisciplinaire d Oncologie hépato-bilio-pancréatique Chirurgie et transplantation abdominale Dr O. CICCARELLI Pr J.-F. GIGOT Dr C. HUBERT Pr J. LERUT Gastro-entérologie Dr I. BORBATH Pr P. DEPREZ Pr A. GEUBEL Pr Y. HORSMANS Médecine nucléaire Pr S. PAUWELS Oncologie médicale Pr Y. HUMBLET Dr M. MANO Radiothérapie oncologique Pr P. SCALLIET Coordonateur de soins oncologiques & Coordonateur de recherche clinique médicale M. A. CERATTI Tumeurs de l oesophage et de l estomac Chirurgie et transplantation abdominale Pr J.-M. COLLARD Gastro-entérologie Pr P. DEPREZ Pr H. PIESSEVAUX Oncologie médicale Pr Y. HUMBLET Dr M. MANO Radiothérapie oncologique Pr P. SCALLIET Coordonateurs de soins oncologiques M. F. MADDALENA M. A. CERATTI Clin-1 C9 Clin-1 C9 Clin-1 C9 Clin-1 C9 Clin-2 Q7 Clin-2 Q7 Clin-2 Q7 Clin-2 Q7 Clin-2 V7 Clin-1 C9 Clin-1 C9 Clin-1 C9 US 42 Clin-1 C9 Clin-2 Q7 Clin-2 Q7 Clin-1 C9 Clin-1 C9 Clin-1 C9 US 42 US Résultats
3 edito Dix bougies pour la clinique des pathologies tumorales du côlon et du rectum au Centre du Cancer! Quel fier anniversaire et que de chemin parcouru depuis 1998 Il y a dix ans, l organisation de la Clinique des Pathologies Tumorales du Côlon et du Rectum se justifiait principalement par deux raisons. La première, l importance épidémiologique des cancers du côlon et du rectum, les plus fréquents du tube digestif et parmi les trois tumeurs malignes les plus fréquentes en Europe occidentale dans les deux sexes. A titre d exemple, en 2004, 7582 nouveaux cas de cancers colorectaux ont été diagnostiqués en Belgique ( La seconde motivation était le constat évident que les meilleurs résultats thérapeutiques procédaient d une prise en charge pluridisciplinaire à même d évaluer au mieux la stratégie globale et optimale du plan thérapeutique adapté à chaque cas. Michel SYMANN, rédacteur en chef et Alex Kartheuser et Christine Sempoux, rédacteurs invités. Le généraliste joue un rôle essentiel dans le diagnostic des cancers. A lui de promouvoir judicieusement le dépistage, car certains cancers coliques sont longtemps muets, et de choisir le maître achat pour le diagnostic quand douleurs abdominales, modifications du transit, sang rouge dans les selles ou selles noires ou encore anémie ferriprive lui font évoquer cette tumeur. Ces aspects (techniques de dépistage, colonoscopie virtuelle, examen diagnostic de choix) seront abordés dans une prochaine livraison de la newsletter du Centre du Cancer. Certes, la prise en charge du cancer du côlon est un exercice pluridisciplinaire, mais la chirurgie est la pierre angulaire de l édifice, car le traitement du cancer colorectal est dominé par son ablation chirurgicale. L excitation que provoque le développement de l imagerie médicale, du diagnostic moléculaire et des thérapies ciblées ne doit pas occulter les progrès exceptionnels accomplis par la chirurgie en général et plus particulièrement dans le cancer colorectal. Soucis d exérèse maximale sur le plan carcinologique et diminution simultanée de la morbidité et de la mortalité, ces objectifs apparaissent antinomiques! Et pourtant, les résultats sont là, grâce à l ingéniosité déployée par exemple dans l approche laparoscopique et dans la réhabilitation rapide postopératoire. L adénocarcinome du rectum, qui pose le difficile problème du risque de récidive locorégionale et celui de la conservation sphinctérienne est une autre illustration remarquable de ces progrès où se combinent avancées chirurgicales (article de D. Léonard) et progrès de la radiothérapie (article de P. Scalliet et E. Danse) et de la chimiothérapie. En effet,la radiochimiothérapie néoadjuvante suivie par une excision mésorectale est devenue l approche standard des stades II et III du cancer rectal. chirurgie pour cancer colorectal en 2008 A. Kartheuser, R. Detry, Ch. Remue... 4 Microchirurgie endoscopique transanale ou technique de Buess D. Léonard, A. Jouret, A. Kartheuser Cancer du rectum et radiothérapie P. Scalliet, E. Danse sommairela Chimiothérapie du Cancer Colorectal M. Mano, F. Duhoux, Y. Humblet Le point sur le traitement chirurgical des métastases hépatiques colorectales JF. Gigot Chimio-hyperthermie intra-péritonéale Ch. Remue, F. Lois, X. Wittebole Le diagnostic du cancer colorectal héréditaire C. Sempoux, K. Dahan News...38 L article de M. Mano nous apprend que pour les stades III du cancer du côlon, la chimiothérapie adjuvante à base d Oxaliplatine est devenue la règle. Pour ce qui est du cancer colorectal métastatique, l utilisation d agents cytotoxiques conventionnels comme l Oxaliplatine et de l Irinotécan et l usage du Bévacizumab et des anticorps antirécepteurs du facteur de croissance épidermique humain offrent un espoir de survie de plus de deux ans à la majorité des malades, c est-à-dire plus du double de ce que l on observait il y a 5 à 10 ans. Même les patients en stade IV ont encore une chance d être guéris si leur métastase est susceptible d être extirpée par une ablation chirurgicale complète comme nous l illustre, dans une ode enthousiaste à la pluridisciplinarité, l article de JF. Gigot dans le chef des métastases hépatiques. Et le progrès ne se ralentit pas! En témoigne l introduction toute récente aux Cliniques universitaires Saint-Luc de la chimio-hyperthermie intrapéritonéale (CHIP) dans certains cas de carcinoses péritonéales. (voir l article de Ch.Remue et al). Finalement, pour terminer sur une note de biologie moléculaire, des mutations géniques spécifiques ont été identifiées dans les cancers colorectaux familiaux et sporadiques. Estimations du risque et recherches d interventions préventives font partie d un nouveau champ de découvertes en pleine expansion comme le démontre bien l article de C. Sempoux et K. Dahan. Un souhait, unanime, que le rythme de ces extraordinaires progrès ne se ralentisse pas! Editeur responsable: Marc Hamoir, Président du Centre du Cancer. Cliniques universitaires Saint-Luc, 10, av. Hippocrate 1200 Bruxelles Rédacteur en chef: Michel Symann Secrétariat: Myriam Goosse, [email protected], 02/ Photos: CAV des Cliniques / Hugues Depasse, D. R.
4 La chirurgie pour cancer colorectal en 2008: oncologiquement plus «agressive» mais plus respectueuse de l intégrité corporelle Prof. A. Kartheuser 1, R. Detry 1, Ch. Remue 1, D. Léonard 1, F. Lois 2, A. Jouret 3, Ch. Sempoux 3. Centre du Cancer, Clinique des Pathologies Tumorales du Colon et du Rectum (CPTCR), Service de Chirurgie et Transplantation Abdominale, Unité de Chirurgie Colorectale (UCCR) (1), Services d Anesthésiologie (2) et d Anatomie Pathologique (3) Cliniques universitaires Saint-Luc. [email protected] Figure 1: Laparoscopie. L approche laparoscopique nécessite la mise en place de plusieurs trocarts, dont un pour la caméra et les autres pour les instruments chirurgicaux. Le trait jaune suprapubien indique l emplacement de la petite incision nécessaire pour extraire le côlon disséqué. (CAV M. Lemaire) Introduction En 2008, la pierre angulaire du traitement du cancer colorectal reste l exérèse chirurgicale, mais cet élément central du traitement ne peut plus se concevoir en dehors d une approche pluridisciplinaire, ou mieux interdisciplinaire, qui per se augmente les chances de guérison des patients. Ce fut le primum movens de la création dès le 16 janvier 1998 de la Clinique des Pathologies Tumorales du Côlon et du Rectum (CPTCR) au sein des Cliniques Universitaires St-Luc. Au cours des dix dernières années, les progrès techniques de la chirurgie de ce cancer très fréquent - plus de 7000 nouveaux cas par an en Belgique - 2 e cancer chez la femme - 3 e cancer chez l homme - ont été à la fois remarquables et paradoxaux: la chirurgie du cancer rectal est devenue à la fois plus agressive (exérèse totale systématique du rectum et du mésorectum, interventions lourdes pour récidives, cytoréduction extensive pour carcinose péritonéale suivie de chimio-hyperthermie intrapéritonéale, etc.) et plus respectueuse de l intégrité corporelle (appro che laparoscopique, Fast-Track, exérèse locale par les voies naturelles, conservation poussée à l extrême de l appareil sphinctérien, préservation des nerfs pelviens autonomes, reconstruction périnéale totale en cas d amputation, etc.). Approche laparoscopique L approche laparoscopique a été introduite dans notre unité de chirurgie colorectale pour le cancer du côlon et pour le cancer du rectum dès Sur le plan technique, toute la dissection, très minutieuse, se fait à ventre fermé (Figure 1) sous contrôle vidéo-endoscopique ainsi que le rétablissement de la continuité colorectale. Seule l exérèse du segment colique porteur de la tumeur se fait par une courte incision sus-pubienne (± 5 cm) peu délabrante et peu inesthétique. Pour le cancer du côlon, la validité carcinologique de l approche laparoscopique est actuellement démontrée par de nombreuses études prospectives randomisées, plusieurs revues et méta-analyses. Les avantages immédiats de la laparoscopie ont été bien documentés: moins de complications majeures, moins de douleur, reprise plus rapide du transit, hospitalisations plus courtes avec des résultats oncologiques au moins équivalents à ceux de la chirurgie par laparotomie. La survie à 3 ans et à 5 ans est la même qu après chirurgie ouverte classique (respectivement, de 82,2% et de 76,4%). Pour le cancer du rectum, si la faisabilité et les avantages de la laparoscopie ont été aussi démontrés, il persiste un doute quant au contrôle de la qualité de l exérèse du mésorectum, comme l ont montré D. Léonard et F. Penninckx dans l étude PROCARE (voir encart p.17). Enfin, concernant le devenir oncologique après laparoscopie pour cancer du rectum, une seule méta-analyse a été publiée à ce jour, reprenant 25 publications dont peu d études randomisées. Cette méta-analyse a montré que les résultats étaient superposables à ceux de la chirurgie conventionnelle pour la qualité du curage ganglionnaire, les marges de sécurité distales et latérales, ainsi que pour le taux de récidives locales et à distance et enfin pour la survie. D autres études devront encore confirmer ces résultats très prometteurs. FAST-TRACK ou Réhabilitation rapide après Chirurgie Colorectale Dans le contexte du respect de l intégrité corporelle par l approche laparoscopique, nous avons introduit depuis un an le concept de réhabilitation rapide après chirurgie colorectale - en particulier pour cancer du 4
5 La chirurgie pour cancer colorectal en 2008: oncologiquement plus «agressive» mais plus respectueuse de l intégrité corporelle Figure 2 Fast-Track: hospitalisation breve. Voici votre ticket de bus! Quand vous vous réveillerez, vous pourrez prendre le bus devant l hôpital! côlon - décrit par H. KEHLET au Danemark et encore appelé «FAST-TRACK» ou «ERAS» pour Enhanced Recovery after Surgery. Il s agit d un ensemble de mesures péri- et peropératoires (pas de jeûne, pas de préparation colique, pas de sonde gastrique, pas de drains, pas de sonde urinaire, pas de morphiniques, péridurale thoracique, mobilisation rapide, réalimentation immédiate, hospitalisation brève (Figure 2) ) qui vise à affecter le moins possible l équilibre physiologique du patient. Il s agit d une véritable approche interdisciplinaire et intermétiers qui permet au patient de récupérer rapidement et de quitter l hôpital dès le troisième jour postopératoire (photo 1). A l avenir, cette approche pourrait permettre au patient d aborder la chimiothérapie adjuvante de manière plus précoce et dans de meilleures conditions avec peut-être un impact sur la survie à démontrer dans les prochaines années! Total Mesorectal Excision (TME) ou technique de Heald L association d une exérèse chirurgicale oncologiquement plus agressive, plus complète, et d une radiochimiothérapie préopératoire pour les tumeurs plus évoluées, a permis de réduire drastiquement le taux de récidives locales du cancer du rectum. Ce risque de récidive locale qui pouvait atteindre jusqu à 40-50% à 5 ans a été réduit à 4-12% selon les équipes. Cette technique chirurgicale, décrite par R.J. Heald et utilisée dans notre unité depuis 1998 associe une résection systématique de la totalité du rectum et de son «mésorectum» (TME ou «Total Mesorectal Excision»), quelle que soit la localisation de la tumeur, en respectant un plan anatomique, embryologique, encore appelé le «Holy Plane» (Figure 3, Photos 2-5 page suivante) et un respect accru des nerfs pelviens sympathiques et parasympathiques. Après une telle exérèse le rectum est remplacé par un réservoir colique en J et la continuité digestive est restaurée par une anastomose mécanique colo-anale intrapelvienne (Figure 4). Photo 1 Groupe multi-disciplinaire Fast-Track. 5
6 La chirurgie pour cancer colorectal en 2008: oncologiquement plus «agressive» mais plus respectueuse de l intégrité corporelle Figure 3: Holy Plane ou plan sacré de Heald. Le plan sacré de Heald est le plan anatomique des accolements embryologiques que doit suivre le chirurgien pour toute exérèse du rectum et de son méso. Grâce à la cette conservation des nerfs autonomes les risques de troubles urinaires ou sexuels postopératoires, tels que l anéjaculation ou l éjaculation rétrograde, est considérée comme complète (R0) et carcinologiquement curative (Photo 6) si cette marge de sécurité entre le bord latéral de la tumeur et le plan de résection ou «holy Photo 2 TME Heald: Face antérieure du rectum. Vue antérieure d une pièce de proctectomie avec exérèse totale du «mésorectum» selon la technique de Heald. Photo 3 TME Heald: Face postérieure du rectum. Photo 4 TME Heald: Face antérieure du rectum. Le plan de dissection chirurgical souspéritonéal antérieur a été badigeonné à l encre de Chine selon la technique de Quirke. Photo 5 TME Heald: Face postérieure du rectum: Encre de chine selon la technique de Quirke. Figure 4 Anastomose colorectale méchanique intra-pelvienne par double agrafage (CAV M. Lemaire). Photo 6: Marge de sécurité latérale ou circonférentielle. La pièce chirurgicale est coupée en tranches horizontales de 0,5-1 cm pour examen macroscopique de l extension latérale de la tumeur. La distance de sécurité carcinologique entre le plan de dissection chirurgical et la tumeur doit être d au moins 2 mm. l impuissance et les troubles de la vidange vésicale, qui pouvaient toucher jusqu à 90% des patients, ne sont actuellement plus que de l ordre de 15%. C est pourquoi cette technique entre bien dans la philosophie d un plus grand respect de l intégrité corporelle du patient. Enfin, la technique de la «TME de Heald» a introduit, en plus de la notion conventionnelle de marge de sécurité distale, c.-à-d. la distance entre le pôle inférieur de la tumeur et la tranche de section chirurgicale distale, le concept aussi capital, en terme de récidive locale et de survie du patient, de marge circonférentielle ou latérale (CRM ou Circumferential Resection Margin) qui doit désormais figurer sur tout rapport anatomopathologique. La résection chirurgicale plane» est égale ou supérieure à 2 mm. Conservation de l appareil sphinctérien anal et anastomose coloanale (ACA) Une meilleure connaissance des voies d extension et de dissémination des tumeurs rectales a autorisé les chirurgiens à reculer sans cesse les limites de la conservation sphinctérienne anale, sans obérer le résultat oncologique, et ce, pour éviter la mutilation d une amputation abdomino-périnéale (AAP) du rectum avec colostomie définitive (Figure 5). Le taux d AAP qui, récemment encore au niveau national, était de l ordre de 50% est actuellement ramené à moins de 20%. Ce paramètre est d ailleurs considéré comme un indicateur de qualité pour une unité spécialisée de chirurgie colorectale. a. Mucosectomie endoanale, réservoir colique et anastomose coloanale (ACA) Lorsque le pôle inférieur de la tumeur se situe à 2 cm, voire même plus récemment à 1cm de l appareil sphinctérien, celui-ci peut être conservé intégralement (Figure 6). Moyennant la construction d un réservoir colique en J et une mucosectomie endoanale, la continuité coloanale (ACA) est assurée par une anastomose manuelle réalisée par voie périnéale au niveau de la ligne pectinée (Figure 7). 6
7 La chirurgie pour cancer colorectal en 2008: oncologiquement plus «agressive» mais plus respectueuse de l intégrité corporelle Dans notre unité, pour ces exérèses locales, nous avons adopté la technique de microchirurgie endoscopique transanale (TEM) ou technique de Buess, dont les indib. Dissection intersphinctérienne partielle (DIS), réservoir colique et ACA Pour les tumeurs moins infiltrantes (ut1, ut2), qui affleurent l appareil sphinctérien, mais qui se situent au moins à 1cm de la ligne pectinée, une conservation avec ACA est toujours possible, moyennant cette fois le sacrifice de la moitié supérieure du sphincter interne réalisée par une dissection intersphinctérienne partielle (DIS) (Figure 8). c. Dissection intersphinctérienne totale (DIT), réservoir colique et ACA. Enfin, frontière ultime de la conservation sphinctérienne, réservée surtout aux sujets jeunes, le plus souvent de sexe masculin, avec une bonne musculature sphinctérienne, en présence de petites tumeurs de stade ut1 ou ut2, c.-à-d. ne franchissant pas la musculeuse rectale, affleurant cette fois la ligne pectinée elle-même, mais à une distance de 1cm de la marge anale, l intervention peut-être réalisée moyennant une dissection intersphinctérienne totale (DIT) emportant la totalité du sphincter interne (Figure 9). Chez ces patients, les résultats fonctionnels et en particulier la continence reposent entièrement sur le seul sphincter externe. Les travaux de E. Rullier ont montré que les résultats fonctionnels de cette chirurgie extrême sont satisfaisants dans 55 à 75% des cas et que le taux de récidives locales reste inférieur à 5%. Reconstruction périnéale totale (RPT) après amputation abdomino-périnéale (AAP) du rectum Dans les cas devenus heureusement beaucoup plus rares (moins de 20%), où l amputation abdomino-périnéale (AAP) de rectum est inévitable en raison de la localisation ou de la taille de la tumeur (ut3-ut4), il existe actuellement des alternatives à la colostomie définitive. Chez des patients jeunes qui refusent la colostomie une réparation périnéale totale (RPT) peut être proposée après une AAP carcinologique moyennant: 1. Un rétablissement de la continuité digestive par une anastomose colocutanée périnéale (Figure 10) 2. Une restauration de la continence par double graciloplastie (transposition des deux muscles droit interne des deux cuisses) électrostimulée (stimulateur Medtronic ) (Figure 11) 3. Une appendicostomie ombilicale de Malone, à peine visible sur le plan esthétique, permettant une vidange colique efficace et régulière par des lavements antérogrades instillés par une petite sonde introduite par l orifice de Malone au fond de l ombilic. Dans notre unité de chirurgie colorectale, dix patients ont bénéficié de cette technique relativement lourde. Pour huit d entre eux, les résultats fonctionnels et la qualité de vie sont satisfaisants et stables dans le temps. Résection locale par voie transanale: Technique de Buess Toujours dans la même philosophie de respect de l intégrité corporelle, en particulier, la sauvegarde de l appareil sphinctérien anal, des techniques de résection locale par voie transanale ont été développées pour les petits cancers du rectum de stade ut1. Figure 5 Amputation abdomino-périnéale du rectum. L amputation abdomino-périnéale du rectum est une intervention mutilante qui emporte la totalité de l appareil sphinctérien. (CAV M. Lemaire) Figure 6 Conservation intégrale de l appareil sphinctérien avec mucosectomie endoanale. La marge de sécurité carcinologique pour la conservation de l appareil sphinctérien se mesure entre le pôle inférieur de la tumeur et le bord supérieur du canal anal. Idéalement, elle doit être supérieure ou égale à 1 cm. (CAV M. Lemaire) Figure 7 Anastomose colo-anale avec réservoir colique en J. (CAV M. Lemaire) Figure 8 Dissection intersphinctérienne partielle. (CAV M. Lemaire) Figure 9 Dissection intersphinctérienne totale. (CAV M. Lemaire) Figure 10 Anastomose colo-cutanée périnéale après amputation abdomino-périnéale du rectum. Figure 11 Double graciloplastie électrostimulée. Une double transposition des muscles droit interne ou gracilis autour du nouvel anus avec électrostimulation continue permet à nouveau d assurer la continence. 7
8 La chirurgie pour cancer colorectal en 2008: oncologiquement plus «agressive» mais plus respectueuse de l intégrité corporelle Figure 12 Endoprothèse auto-expansible pour occlusion colique. Grâce à la radiochimiothérapie préopératoire et à la réalisation systématique de l exérèse totale du rectum et de son mésorectum selon la technique de Heald, la surcations et les modalités techniques sont développées dans un autre article de cette même revue. Occlusion colique gauche Les patients qui étaient admis en urgence en occlusion colique gauche étaient traités le plus souvent par une simple colostomie de proche amont ou par une résection avec colostomie selon Hartman. Deux alternatives sont actuellement possibles: a. Endoprothèse auto-expansible avant chirurgie définitive Cette approche a été développée récemment par l équipe de M. Morino de Turin et consiste à mettre en place sous contrôle radiologique ou par voie endoscopique une endoprothèse auto-expansible à travers la tumeur colique gauche ou sigmoïdienne occlusive de manière à pouvoir préparer le patient à une chirurgie curative, par voie laparoscopique, quelques jours plus tard (Figure 12). Cette stratégie permet d éviter les risques inhérents à la chirurgie d urgence chez des patients non préparés souvent dénutris, déshydratés et dont le bilan carcinologique n a pas pu être réalisé. b. Préparation colique peropératoire suivie de résection-anastomose immédiate Lorsque l état général du patient et les conditions locales du colon d amont (absence de dilacérations caecales ou de zones de nécrose) le permettent, une préparation colique sur table, antérograde, par une sonde introduite dans le caecum via l appendice est aisément réalisée sans aucun risque de contamination fécale et permet de faire une résection tumorale avec curage ganglionnaire adéquat et un rétablissement immédiat de la continuité digestive par anastomose colorectale. Une iléostomie de protection peut être réalisée si nécessaire. L iléostomie est refermée après quelques mois par voie locale. Cette stratégie thérapeutique a l avantage de traiter d emblée la lésion néoplasique en respectant les règles carcinologiques et en évitant d imposer au patient une nouvelle laparotomie ultérieure, souvent difficile, pour rétablissement de la continuité colorectale. La morbi-mortalité est faible, en particulier en ce qui concerne les fistules anastomotiques. Exentération pelvienne antérieure ou postérieure Une meilleure connaissance de l anatomie chirurgicale pelvienne, une meilleure maîtrise des techniques chirurgicales et les progrès majeurs de la réanimation postopératoire autorisent actuellement à envisager des interventions lourdes de type exentération pelvienne antérieure (rectum, mésorectum, vagin, utérus, vessie, prostate) ou postérieure (rectum, mésorectum, sacrum) pour des tumeurs très évoluées de type ut4, envahissant les organes de voisinage. En raison de son caractère mutilant, cette chirurgie est plutôt réservée aux patients jeunes. Cette approche chirurgicale relativement lourde permet d espérer un taux de survie à cinq ans de 50 à 60% avec une mortalité quasi nulle et au prix d une morbidité acceptable. Chirurgie pour récidive pelvienne 8
9 La chirurgie pour cancer colorectal en 2008: oncologiquement plus «agressive» mais plus respectueuse de l intégrité corporelle venue d une récidive locale pelvienne est devenue plus rare: 4 à 12% à 5 ans. Moyennant un suivi postopératoire très régulier (tous les 4 à 6 mois au cours des cinq premières années), les récidives peuvent être détectées à un stade précoce et encore opérable, avec une survie à 5 ans allant de 15 à 35% selon les centres. Chimio-Hyperthermie Intra-Péritonéale (CHIP) pour carcinose péritonéale Arrivés au stade de carcinose péritonéale, la plupart des patients étaient, jusqu il y a peu encore, récusés pour la chirurgie d exérèse à visée curative. La persévérance de pionniers comme P. Sugarbaker aux USA, F. Gilly et O.Glehen à Lyon et D. Elias à Paris, a permis de montrer qu une cytoréduction complète de la totalité du tissu tumoral intraabdominal suivie d une chimio-hyperthermie intrapéritonéale (CHIP), à ventre fermé ou à ventre ouvert, avec Mitomycine C ou Oxaliplatine à une température de 42 à 43 C pendant 30, 60 ou 90 minutes, dans le même temps opératoire, permettait d espérer des taux de survie de l ordre de 64% à 2 ans et de 54% à 5 ans. Ces résultats sont comparables à ceux obtenus et largement acceptés après résection hépatique pour métastases d origine colorectale. Cette procédure thérapeutique est cependant lourde et complexe. Elle expose le patient à un risque de mortalité et de morbidité post-opératoire élevé (respectivement de 0 à 18% et de 16 à 65%). Ce type de traitement ne peut donc s adresser qu à des patients soigneusement sélectionnés au sein de centres ayant une expertise suffisante. Dans notre centre, nous avons opté pour une technique de CHIP à ventre fermé, à base d Oxaliplatine à 43 C (voir article dans cette même revue). Chirurgie palliative Une fois encore, la chirurgie colorectale a fait des progrès très importants pour venir en aide aux patients, arrivés en phase terminale d un cancer colorectal et jugés inopérables mais qui présentent une symptomatologie très invalidante de type obstruction, hémorragie ou ténesme chronique. Outre les traitements médicaux modernes, multimodaux, qui en unité de soins palliatifs sont utilisés en première intention et permettent de soulager la plupart des patients en occlusion terminale sans recours à la chirurgie ni même à la décompression par sonde gastrique, il existe actuellement deux alternatives interventionnelles par les voies naturelles: a. Résection endoscopique par résecteur à prostate modifié pour le rectum Un résecteur endoscopique à prostate a été adapté à la chirurgie rectale - anse diathermique plus large et obturateur anal (Photos 7, 8) - pour traiter les symptômes liés à une tumeur rectale par ailleurs inopérable. Plusieurs patients ont bénéficié de cette technique réalisée en collaboration avec nos confrères urologues (Dr A. Feyaerts et Prof P. Van Cangh). Comme pour la prostate, la résection se fait sous un courant liquidien continu, ce qui permet une excellente vision intrarectale et une hémostase très Photo 7 Résecteur endoscopique à prostate (haut) adapté pour le rectum (bas). Photo 8 Résection endoscopique d une tumeur rectale. 9
10 La chirurgie pour cancer colorectal en 2008: oncologiquement plus «agressive» mais plus respectueuse de l intégrité corporelle Photo 9 Endoprothèse auto-expansible pour tumeur occlusive du rectum. L examen radiologique après la mise en place de la prothèse rectale montre une bonne restauration de la filière rectale. précise de la moindre hémorragie. Une très grande quantité de tissu tumoral peut être réséquée en une seule séance, sous anesthésie générale ou même sous anesthésie locorégionale. Selon une série importante de Hamy, 87% des patients sont immédiatement soulagés de leur symptomatologie. Cette technique peut être répétée si nécessaire. b. Endoprothèse auto-expansible Cette option thérapeutique palliative est plutôt réservée aux lésions obstructives du haut rectum, de la jonction rectosigmoïdienne et du sigmoïde (Photo 9). La mise en place d une telle endoprothèse auto-expansible est relativement simple et peut se faire sous contrôle endoscopique ou radiologique. Les risques potentiels sont la migration de la prothèse, la perforation, l hémorragie, l impaction de selles ou la ré-obstruction par du tissu tumoral. Malgré ces risques, le taux de succès est supérieur à 90%. Toutes ces techniques permettent d éviter une laparotomie exploratrice avec confection d une iléo- ou colostomie chez ces patients fragiles et en fin de vie. Conclusions L approche chirurgicale du cancer colorectal a fortement évolué au cours de ces dernières années. Les techniques nouvelles tendent toutes vers une exérèse plus carcinologique, plus systématisée et plus complète du cancer colorectal tout en respectant davantage l intégrité corporelle et la qualité de vie du patient. Chacune de ces techniques, choisies de manière appropriée en fonction du patient et des caractéristiques individuelles de sa tumeur, ne peut s inscrire que dans le cadre d une stratégie thérapeutique globale décidée en commun en réunion pluridisciplinaire préopératoire. Références Abbès Orabi N., Mauel E., Van Wymersch Th., Crispin B., Ykman O., Detry R., Kartheuser A. Late results of systematic Malone appendicostomy adjunction to double graciloplasty in the Total Perineal Reconstruction after abdomino-perineal resction for rectal cancer. Dis Colon Rectum 2007 ; 50: Anderson C, Uman G, Pigazzi A. Oncologic outcomes of laparoscopic surgery for rectal cancer: A systematic review and meta-analysis of the literature. Eur J Surg Oncol In Press. Birbeck KF, Macklin CP, Tiffin NJ, Parsons W, Dixon MF, Mapstone NP, Abbott CR, Scott N, Finan PJ, Johnston D, Quirke P. Rates of circumferential resection margin involvement vary between surgeons and predict outcomes in rectal cancer surgery. Ann Surg ;235: Bonjer HJ, Hop WC, Nelson H, Sargent DJ, Lacy AM, Castells A, Guillou PJ, Thorpe H, Brown J, Delgado S, Kuhrij E, Haglind E, Påhlman L; Transatlantic Laparoscopically Assisted vs Open Colectomy Trials Study Group. Laparoscopically assisted vs open colectomy for colon cancer: a meta-analysis. Arch Surg. 2007;142: Buess G, Hutterer F, Theiss J, Böbel M, Isselhard W, Pichlmaier H. A system for a transanal endoscopic rectum operation. Chirurg. 1984;55: Elias D, Pocard M, Goere D. HIPEC with oxaliplatin in the treatment of peritoneal carcinomatosis of colorectal origin. Cancer Treat Res. 2007;134: Fleshman J, Sargent DJ, Green E, Anvari M, Stryker SJ, Beart RW Jr, Hellinger M, Flanagan R Jr, Peters W, Nelson H; for The Clinical Outcomes of Surgical Therapy Study Group. Laparoscopic colectomy for cancer is not inferior to open surgery based on 5-year data from the COST Study Group trial. Ann Surg. 2007;246: Heald RJ, Moran BJ, Ryall RD, Sexton R, MacFarlane JK. Rectal cancer: the Basingstoke experience of total mesorectal excision, Arch Surg. 1998;133: Kapiteijn E, Marijnen CA, Nagtegaal ID, Putter H, Steup WH, Wiggers T, Rutten HJ, Pahlman L, Glimelius B, van Krieken JH, Leer JW, van de Velde CJ; Dutch Colorectal Cancer Group.Preoperative radiotherapy combined with total mesorectal excision for resectable rectal cancer. N Engl J Med. 2001;345: Kehlet H.Fast-track colorectal surgery. Lancet. 2008;371: Khot UP, Lang AW, Murali K, Parker MC. Systematic review of the efficacy and safety of colorectal stents. Br J Surg. 2002;89: Kremer Y., Remue C., Detry R., De Kock M., Kartheuser A. Fast track en chirurgie colorectale ou la réhabilitation rapide des patients. Louvain Médical ;124:S199-S205. Léonard D., Penninckx F. On behalf of the PROCARE steering group, the GI Pathology Club and the Belgian Section of Colorectal Surgery. Candidate TME instructurs: Preliminary results of the PROCARE project. Colorectal Disease, 2007, 9: 13 Léonard D., Sempoux C., Colin J.F., Remue C., Detry R., Kartheuser A. Transanal Endoscopic Microsurgery: Results of 15-year experience. Ann. Oncology 2007 ; 18: 82. Macdermid E, Hooton G, Macdonald M, McKay G, Grose D, Mohammed N, Porteous C. Patient Survival With The Colorectal Cancer Multi- Disciplinary Team.Colorectal Dis In Press. Murray JJ, Schoetz DJ Jr, Coller JA, Roberts PL, Veidenheimer MC. Intraoperative colonic lavage and primary anastomosis in nonelective colon resection. Dis Colon Rectum. 1991;34: Noel JK, Fahrbach K, Estok R, Cella C, Frame D, Linz H, Cima RR, Dozois EJ, Senagore AJ. Minimally invasive colorectal resection outcomes: short-term comparison with open procedures. J Am Coll Surg. 2007;204: VRullier E, Zerbib F, Laurent C, Bonnel C, Caudry M, Saric J, Parneix M. Intersphincteric resection with excision of internal anal sphincter for conservative treatment of very low rectal cancer. Dis Colon Rectum. 1999;42: Sutton CD, Marshall LJ, White SA, Flint N, Berry DP, Kelly MJ. Ten-year experience of endoscopic transanal resection. Ann Surg. 2002;235: Tjandra JJ, Kilkenny JW, Buie WD, Hyman N, Simmang C, Anthony T, Orsay C, Church J, Otchy D, Cohen J, Place R, Denstman F, Rakinic J, Moore R, Whiteford M; The Standards Practice Task Force; The American Society of Colon and Rectal Surgeons. Practice parameters for the management of rectal cancer (revised). Dis Colon Rectum. 2005;48: Yamada K, Ishizawa T, Niwa K, Chuman Y, Aikou T. Pelvic exenteration and sacral resection for locally advanced primary and recurrent rectal cancer. Dis Colon Rectum. 2002;45:
11 La Clinique des Pathologies Tumorales du Colon et du Rectum (CPTCR) au Centre du Cancer Responsable: Prof. Christine Sempoux, anatomo-pathologiste Pour tout renseignement: Frédéric Maddalena, coordinateur de soins en oncologie (02/ ). La Clinique des Pathologies Tumorales du Colon et du Rectum (CPTCR) prend en charge en moyenne chaque année près de 200 nouveaux patients. L équipe des spécialistes concernés se réunit lors d un staff pluridisciplinaire hebdomadaire afin de déterminer pour chaque patient un plan de traitement spécifique, combinant, selon les indications, la chirurgie, la chimiothérapie et la radiothérapie. Chaque année, de nouveaux protocoles d études cliniques sont proposés afin de permettre aux patients de participer aux progrès les plus récents de la recherche scientifique. Après l intervention chirurgicale sur la pièce d exérèse ou sur le matériel prélevé lors de la colonoscopie, une analyse peut être effectuée pour déterminer le caractère éventuellement héréditaire du cancer et si nécessaire les patients sont ensuite reçus en consultation de conseil génétique. Deux doctorants travaillent au sein du groupe, l un sur les mécanismes fondamentaux responsables du développement du cancer colorectal et l autre, sur les facteurs de risque de récidive de ce cancer, en étroite collaboration avec le registre belge du cancer, dans le cadre du projet national Procare dans lequel tous les spécialistes du CPTCR sont largement impliqués. Une partie de l équipe multidisciplinaire. 11
12 Résection locale des petites tumeurs du rectum: Microchirurgie endoscopique transanale ou Technique de Buess Dr. D. Léonard 1, A. Jouret 2, A. Kartheuser 1, J.F. Colin³, R. Detry 1,Ch. Remue 1,Ch. Sempoux 2 Centre du Cancer, Clinique des Pathologies Tumorales du Colon et du Rectum (CPTCR), Service de Chirurgie et Transplantation Abdominale, Unité de Chirurgie Colorectale (UCCR) (1), Services d Anatomie Pathologique (2) et de Gastroentérologie (3) Cliniques universitaires Saint-Luc. [email protected] Depuis son développement par l équipe allemande, de nombreuses publications sont venues étayer la faisabilité, la faible morbidité et la mortalité quasi virtuelle, ainsi que les résultats oncologiques de cette technique. Figure 1 Vue d ensemble de l appareillage de Buess installé en salle d opération. Figure 2 Schéma d une mucosectomie dans le plan de la sous-muqueuse (trait plein). Figure 3 Schéma d une résection en paroi rectale totale dans le plan de la graisse périrectale (trait plein). Depuis de nombreuses années, pour les petites tumeurs du rectum, les chirurgiens utilisent des voies transanale, trans-sphinctérienne ou périnéale. Leur développement a été largement motivé par la volonté de trouver un compromis entre résection complète de la tumeur, conservation du rectum et de l appareil sphinctérien tout en limitant le caractère invasif de la procédure. La voie transanale classique fait toujours partie de l arsenal thérapeutique pour des tumeurs ou polypes rectaux, mais, pour des raisons d accessibilité, ses indications se limitent aux lésions du bas rectum. La technique de résection transanale endoscopique microchirurgicale (TEM) a été introduite par le Prof G. Buess en 1984, pour permettre la résection, par les voies naturelles, de tumeurs rectales, soit trop éloignées de la marge anale pour une exérèse chirurgicale transanale classique, soit trop étendues pour une résection endoscopique conventionnelle. Technique En pratique, l exérèse est réalisée via un endoscope mis en place sous contrôle de la vue et fixé à la table d opération afin d obtenir un champ opératoire parfaitement stable et centré sur la lésion tout en libérant les deux mains du chirurgien (Figure 1). Une pompe permet la création d un pneumorectum et sert concomitamment de système de succion et d irrigation. L optique binoculaire magnifie l image six fois et donne une vision en 3D qui permet une dissection très précise. La résection est réalisée soit dans le plan de la sous muqueuse (mucosectomie) pour les lésions bénignes (Figure 2) ou de la graisse périrectale (paroi rectale totale) pour les lésions malignes (Figure 3). Une marge latérale de 0,5 à 1 cm est respectée scrupuleusement (Figure 4). La brèche pariétale peut faire ou ne pas faire l objet d une suture (Figure 5). Pour les lésions villeuses qui peuvent recouvrir une très grande surface de paroi rectale, une infiltration sous-muqueuse préalable facilite la mucosectomie qui peut être étendue et qui le plus souvent ne pourra pas être suturée. La pièce est immédiatement épinglée sur du liège en salle d opération puis est envoyée au laboratoire d Anatomie-Pathologique où, après encrage de la partie profonde, elle est fixée pendant 24 h dans le formol à 4%. La pièce est ensuite analysée en totalité par des coupes pratiquées tous les 2 à 3 mm Figure 4 L intervention débute par un marquage précis de la limite de résection respectant une marge de sécurité de 0,5 cm à 1 cm tout autour de la tumeur. Figure 5 Suture transversale de la brèche pariétale rectale. 12
13 Résection locale des petites tumeurs du rectum: Microchirurgie endoscopique transanale ou Technique de Buess afin de déterminer le degré d infiltration du processus tumoral malin de même que le caractère complet ou incomplet de la résection. Le rapport anatomopathologique précise le type de prélèvement, la nature de la lésion, son caractère bénin ou malin. En cas de malignité, le degré d infiltration de la tumeur est mentionné de même que le caractère complet ou incomplet de la résection (marges latérales et profondes saines ou non). Le degré d infiltration se grade en cancer intramuqueux (ptis) ou sous-muqueux. Cette infiltration sous-muqueuse se divise à son tour en degrés de profondeur sm1, (infiltration sous-muqueuse 1/3 superficiel), sm2 (1/3 médian) ou sm3 (1/3 profond). Indications a) Lésions bénignes Développée initialement pour l exérèse de tumeurs bénignes, principalement des adénomes non résécables endoscopiquement, la TEM a fait ses preuves en terme d efficacité thérapeutique pour ces indications. La littérature est quasi unanime pour confirmer le haut taux de guérison et en corollaire, des taux de récidive faibles. Ce taux est de l ordre de 5% pour les tumeurs bénignes. Il faut souligner, à côté des résultats très satisfaisants dans ces indications, la très faible morbidité de la technique de même que sa mortalité quasi nulle. Dans notre unité, plus de 100 patients ont bénéficié de cette technique qui a cependant été réservée essentiellement aux lésions bénignes du rectum. Initialement, l exérèse de ces polypes bénins était surtout réalisée en mucosectomie. C est encore le cas actuellement pour les lésions villeuses en nappe qui peuvent être très étendues. Pour les polypes adénomateux mieux circonscrits, mais plus volumineux, qui en leur sein peuvent cacher un foyer malin inaccessible aux biopsies de surface, nous avons opté pour la résection en paroi rectale totale systématique. Celle-ci permet une stadification anatomopathologique précise de la tumeur (Photos 1-4). En cas de découverte fortuite de dégénérescence carcinomateuse, l analyse méticuleuse de l infiltration pariétale et les autres facteurs de risque (différenciation, perméations lymphatique ou veineuse ) dictera la stratégie thérapeutique. Seules des tumeurs ptis et pt1, sans facteurs de risque, et après approbation en discussion multidisciplinaire de la CPTCR, pourront bénéficier d un simple suivi. Dans le cas contraire, une chirurgie d exérèse radicale de type TME de Heald (Total Mesorectal Excision), est proposée dans les jours qui suivent. En cas de résection endoscopique de polype dégénéré, mais pour lequel il persiste un doute sur la marge de sécurité carcinologique par rapport à la ligne de résection sousmuqueuse, une résection en paroi rectale totale de la cicatrice de polypectomie est également une option proposée dans notre unité. L absence de facteurs de mauvais pronostic et l absence de tissu néoplasique résiduel sur cette «macrobiopsie» réalisée par Buess permettent de proposer une simple surveillance. b) Lésions malignes Les résultats encourageants sur le plan de l efficacité et de la sécurité dans les indications pour lésions bénignes, ont permis d envisager la technique de Buess pour certains petits cancers ut1 dont les indications très précises doivent être discutées en réunion pluridisciplinaire d oncologie. Cependant, au-delà de la faisabilité aujourd hui bien démontrée, la controverse persiste quant à la légitimité de proposer une résection locale par TEM pour un cancer Photo 1 Vue endoscopique (rectoscopie) d un petit cancer (diamètre 1cm) et de stade ut1. Photo 2 La pièce de résection est immédiatement épinglée en salle d opération. Photo 3 Section de la pièce après fixation de 24 h dans le formol à 4%. Photo 4 Examen histologique d un adénocarcinome rectal stadifié pt1sm3. 13
14 Résection locale des petites tumeurs du rectum: Microchirurgie endoscopique transanale ou Technique de Buess du rectum: le taux de récidive locale ou à distance est-il comparable avec les résultats offerts par la chirurgie radicale d exérèse du rectum et de son méso? En cas de récidive locale, une chirurgie de rattrapage a-t-elle les mêmes chances de succès? Plusieurs séries contrôlées et deux études randomisées ont confronté la chirurgie par voie conventionnelle et la résection locale pour des patients sélectionnés. Les résultats semblent comparables pour le sousgroupe des cancers classés pt1 de bas risque, c est-à-dire situés dans le haut ou moyen rectum, sm1 ou sm2, bien différenciés et ne présentant pas d infiltration vasculaire ou lymphatique. Les taux de récidive pour ces patients sont de l ordre de 6%, ce qui est comparable à la chirurgie classique. Mais la prudence s impose dans l interprétation des résultats de séries souvent de faible envergure et au suivi limité. Quoi qu il en soit, les auteurs qui défendent la résection locale de petits cancers rectaux plaident pour une surveillance étroite et une chirurgie de rattrapage en cas de récidive. Les séries publiées de chirurgie de rattrapage tendent malheureusement à démontrer des résultats en terme de survie spécifique qui paraissent inacceptables eu égard au stade favorable de la lésion primaire. Ainsi pour une lésion pt1 dont la survie à 5 ans peut atteindre 90% à 100% après chirurgie radicale classique, cette même procédure réalisée pour récidive locale de la lésion n atteint plus que 50% à 60% de survie à 5 ans. Perspective d avenir Les dernières évolutions en matière d excision locale de cancers du rectum plus avancés (ut2, ut3) après radiochimiothérapie vont probablement étendre le champ d action de la technique de Buess. Cette attitude nouvelle se base sur la fonte tumorale après radiochimiothérapie avec des réponses qui peuvent même être complètes dans près de 20% des cas. Plusieurs séries ont été récemment publiées et les résultats semblent prometteurs, mais encore largement à confirmer. Dans ce contexte, notre Clinique des Pathologies Tumorales du Colon et du Rectum (CPTCR) participe à un essai clinique prospectif, multicentrique et randomisé, l essai français GRECCAR 2. Il s agit d un essai clinique comparant deux stratégies chirurgicales: tumorectomie par voie transanale classique ou TEM selon Buess versus exérèse rectale radicale chez les bons répondeurs après radiochimiothérapie pour cancer du bas rectum. Conclusion Actuellement, la supériorité de la microchirurgie endoscopique transanale ou technique de Buess, par rapport à la chirurgie conventionnelle, a bien été démontrée pour les lésions bénignes du rectum, en particulier les nappes villeuses étendues. Dans le cadre d une concertation multidisciplinaire, il existe une place bien définie pour la technique de Buess pour les polypes à foyer malin voire même les petits cancers invasifs de découverte fortuite. Par contre, pour les cancers du rectum dont le diagnostic est bien établi, la technique de Buess ne peut se concevoir que dans le cadre d études cliniques. Références Buess G, Hutterer F, Theiss J, Bobel M, Isselhard W, Pichlmaier H. A system for a transanal endoscopic rectum operation. Chirurg 1984; 55: Hahnloser D, Wolff BG, Larson DW, Ping J, Nivatvongs S. Immediate radical resection after local excision of rectal cancer: an oncologic compromise? Dis Colon Rectum 2005; 48: Léonard D, Sempoux Ch, Colin JF, Remue C, Detry R, Kartheuser A. Transanal endoscopic microsurgery: results of a 15-year experience. Ann Oncol 2007; 18:7. Lezoche E, Guerrieri M, Paganini AM, Baldarelli M, De Sanctis A, Lezoche G. Long-term results in patients with T2-3N0 distal rectal cancer undergoing radiotherapy before transanal endoscopic microsurgery. Br J Surg 2005; 92: Lezoche E, Guerrieri M, Paganini AM, D Ambrosio G, Baldarelli M, Lezoche G, Feliciotti F, De Sanctis A. Transanal endoscopic versus total mesorectal laparoscopic resections of T2-N0 low rectal cancers after neoadjuvant treatment: a prospective randomized trial with a 3-years minimum follow-up period. Surg Endosc 2005; 19: Madbouly KM, Remzi FH, Erkek BA, Senagore AJ, Baeslach CM, Khandwala F, Fazio VW, Lavery IC. Recurrence after transanal excision of T1 rectal cancer: should we be concerned? Dis Colon Rectum 2005; 48: Maslekar S, Beral DL, White TJ, Pillinger SH, Monson JR. Transanal endoscopic microsurgery: where are we now? Dig Surg 2006; 23: Middleton PF, Sutherland LM, Maddern GJ. Transanal endoscopic microsurgery: a systematic review. Dis Colon Rectum 2005; 48: Nascimbeni R, Burgart LJ, Nivatvongs S, Larson DR. Risk of lymph node metastasis in T1 carcinoma of the colon and rectum. Dis Colon Rectum 2002; 45: Paty PB, Nash GM, Baron P, Zakowski M, Minsky BD, Blumberg D, Nathanson DR, Guillem JG, Enker WE, Cohen AM, Wong WD. Long-term results of local excision for rectal cancer. Ann Surg 2002; 236: Winde G, Nottberg H, Keller R, Schmid KW, Bunte H. Surgical cure for early rectal carcinomas (T1). Transanal endoscopic microsurgery vs. anterior resection. Dis Colon Rectum 1996; 39:
15 Euromut, la SSMG et le Centre du Cancer vous invite, à une SESSION D INFORMATION SUR LA PREVENTION ET LE DEPISTAGE DU CANCER Des experts exposeront dans un langage clair tout ce qu il y a à savoir sur la prévention et le dépistage des cancers du sein, de la prostate, du côlon, du col de l utérus. Après ces exposés, le public aura l opportunité d interroger chaque médecin, rencontrer des associations de patients et se documenter sur les examens de dépistage. Cette session est ouverte à tous, n hésitez pas à en avertir vos patients! Informations pratiques : Vendredi 19 septembre 2008 de 14h à 17h Auditoire Joseph Maisin, Auditoires Centraux, 51, av. E. Mounier, 1200 Bruxelles Avec le support de la Fondation contre le cancer, les associations de patients Vivre comme avant asbl et Stoma Ilco Bruxelles-Wallonie asbl. Agenda des staffs multidisciplinaires * Lundi Mardi Mercredi Jeudi Vendredi 08h45-11h15 12h00-14h00 08h00-09h00 08h00-09h00 Staff neuro-onco Staff mélanome Staff uro-onco Staff hémato et et mélanome oculaire tumeurs pédiatriques 17h00-18h00 16h30-17h00 17h00-18h30 13h00-14h30 14h00-15h30 Staff thyroïde Staff oeso-gastro Clinique du sein Staff hémato adulte Staff pneumo et staff tumeurs 17h00-18h00 pelviennes 17h00-20h00 17h00-19h30 Staff hépatobiliaire Staff sarcome Staff cervicomaxillo-facial 18h00-19h00 Staff colorectal Lieu: salle de réunion d Anatomopathologie, niveau 1, Tour Rosalind Franklin, entrée F av. Mounier Bruxelles. Lieu Pédiatrie: salle de réunion de radiologie pédiatrique, niveau -2 Q1, 10 avenue Hippocrate Bruxelles. *Renseignements sur la fréquence de ces réunions auprès de Madame Goosse - [email protected], 02/
16 Cancer du rectum et radiothérapie Prof. Pierre Scalliet, radiothérapeute - Prof. Etienne Danse, radiologue Centre du Cancer, Clinique des pathologies tumorales du colon et du rectum, Services de radiothérapie oncologique et de radiologie. Cliniques universitaires Saint-Luc. [email protected] Figure 1 Exemple de cancer du rectum au stade T3 sur un examen IRM. La tumeur apparaît comme une zone blanchâtre marquée de deux flèches. Cette tumeur part de la paroi du rectum et progresse vers l extérieur, dans la gaine rectale (ou mésorectum). A côté des prodigieux progrès de la chirurgie, la radiothérapie a connu un essor important dans le domaine du cancer du rectum, au point de devenir un standard thérapeutique. Quelles étaient les questions? Autrefois, près de la moitié des patients chez lesquels un cancer du rectum était découvert étaient opérés de manière «radicale», et portaient une poche de colostomie pour le reste de leurs jours. Malgré ce geste mutilant, presque la moitié de ces patients souffraient d une récidive du cancer dans les 2 à 3 ans. Elle pouvait être traitée par une irradiation associée avec de la chimiothérapie, au prix d une importante toxicité, avec des résultats aléatoires. En modifiant radicalement leur technique, les chirurgiens sont parvenus à réduire à la fois le nombre de colostomies définitives et la fréquence des récidives locales. Il est possible de conserver l anus chez plus des deux tiers des patients, avec un danger de récidive autour de 10%. Ce taux de récidive est encore trop élevé. Comment faire mieux? Deux études de grande envergure, l une en Suède et l autre aux Pays-Bas, ont démontré qu une irradiation du pelvis précédant l intervention chirurgicale réduisait encore le risque de récidive de moitié. Ce risque aujourd hui ne dépasse plus 5%. C est le standard en Tous les patients ne bénéficient pas de ce traitement préopératoire. Pour environ un tiers d entre eux, le cancer est localisé, et limité en extension (stades T1T2 N0). Dans ces cas, le geste chirurgical est suffisant pour contrôler durablement la maladie. Lorsque la lésion est plus invasive (T3) ou lorsque des ganglions anormaux ont été repérés au cours des examens de stadification, soit au contact du rectum, soit dans le pelvis, une irradiation préopératoire est indiquée. Un exemple de lésion T3 est illustré sur la figure 1. Deux modalités existent. Celle utilisée le plus fréquemment consiste en une irradiation de 5 semaines, centrée sur le rectum et sa gaine (le mésorectum), ainsi que sur les voies lymphatiques de drainage le long des vaisseaux iliaques internes. L association de cette irradiation à une chimiothérapie concomitante offre des résultats supérieurs. C est le standard recommandé au Centre du Cancer des Cliniques universitaires Saint-Luc, ainsi d ailleurs que dans les autres institutions du pays (recommandations PROCARE). Chez une minorité de patients, la situation est plus urgente (présence de métastases hépatiques ou pulmonaires), et la chimiothérapie doit être commencée le plus vite possible après l intervention. Dans ces cas, une irradiation plus courte est proposée (5 jours), suivie immédiatement par la chirurgie. Ce schéma est aussi utilisé chez des personnes fragiles, notamment les personnes très âgées avec un profil gériatrique, afin de limiter la durée des soins. Le choix entre ces deux protocoles se fait au moment de la réunion pluridisciplinaire du mardi soir. 16
17 La technique d irradiation est tridimensionnelle, basée sur une étude complète sur CT scan de la région pelvienne, complétée par les informations apportées par l IRM du pelvis. Cette étude complète de la localisation et de l extension se fait en équipe, entre les radiothérapeutes et les radiologues, avant de déterminer la technique d irradiation proprement dite. Cinq faisceaux sont utilisés, avec une attention particulière à la protection de l intestin grêle (prévention de lésions chroniques d iléite) et de l appareil sphinctérien anal (conservation d une continence satisfaisante). Un exemple de distribution de dose est illustré sur la figure 2. Figure 2 Distribution de dose autour de la tumeur rectale et de la gaine du rectum sur une coupe de CT scan à hauteur des hanches chez un homme. La dose est «concentrée» sur le rectum. Un ganglion satellite est visible à gauche de la lésion (entourée en vert). Le Projet PROCARE Le remplacement de la dissection pelvienne traditionnelle par la TME de Heald (Total Mesorectal Excision) dans les plans embryologiques du fascia rectii ou «Holy Plane» avec la conservation des plexus autonomes a entraîné une amélioration quantitative et qualitative des résultats après traitement du cancer rectal. Cette amélioration a bien été montrée par les études randomisées hollandaise et suédoise qui ont eu également le mérite de démontrer la faisabilité d audits nationaux précédés par l implémentation de guidelines et d un entraînement spécifique. Le projet PROCARE (PRoject On Cancer of the REctum) est un projet national qui vise à améliorer la prise en charge du cancer du rectum en Belgique en réduisant la variabilité thérapeutique. La première étape, en 2005, a été la rédaction et la diffusion de guidelines de PROCARE rédigées par toutes les sociétés scientifiques impliquées dans la prise en charge du cancer colorectal en Belgique. Dans le cadre d une étude assignée par le KCE à PROCARE et liée à l identification de la qualité des indicateurs de soin, les guidelines ont été améliorées en accord avec l EBM la plus récente. La deuxième étape a été l organisation de deux workshops aux Cliniques Universitaires Saint-Luc avec la participation du tandem «chirurgico-pathologique» anglais qui a développé la technique de TME et son évaluation, les professeurs R.J. Heald et Ph. Quircke. Au moins un chirurgien et un anatomopathologiste de chaque institution hospitalière belge ont participé à ces workshops de formation en «live». La troisième étape a été la création d une base de données spécifique à l enregistrement des cas de cancer du rectum. Les enregistrements ont commencé dès octobre 2005 au Registre belge du Cancer. L évaluation préliminaire des 525 premiers patients enregistrés a été présentée en septembre 2007 au Congrès de la Société Européenne de Colo-proctologie (ESCP) (D. Léonard, F. Penninckx. Colorectal Disease, 2007 ; 9: 13). La quatrième étape, qui constitue la véritable pierre angulaire du projet PROCARE, consiste en un entraînement décentralisé à la technique de l excision totale du mésorectum (TME) par des chirurgiens qualifiés. La sélection de ces «chirurgiens-entraîneurs» s appuie essentiellement sur la qualité du spécimen de TME revu anonymement par un panel d experts anatomopathologistes. A ce jour plus de 1200 patients ont été introduits au registre et 12 chirurgiens belges ont déjà été validés comme «chirurgiensentraîneurs». Notre Centre des Pathologies Tumorales du Colon et du Rectum (CPTCR) s implique activement dans ce projet: introduction de tous les cas de cancers du rectum opérés (A. Kartheuser, Ch. Remue, R. Detry), candidatures pour la qualification de «chirurgien-entraîneur», participation à l élaboration et rédaction des guidelines EBM avec le KCE (E. Danse, D. Léonard), participation à la révision de tous les cas par un panel d experts d anatomopathologistes (Ch. Sempoux, A. Jouret), participation au comité directeur du Procare (E. Danse, A. Jouret, Y. Humblet, A. Kartheuser, P. Scaillet, Ch. Sempoux).
18 Chimiothérapie du Cancer Colorectal Dr. Max Mano et François Duhoux, Prof. Yves Humblet Centre du cancer. Clinique des Pathologies Tumorales du Colon et du Rectum, Unité d Oncologie médicale. Cliniques universitaires Saint-Luc. [email protected] Le traitement adjuvant du cancer colorectal Introduction Le cancer colorectal est un problème de santé publique au niveau mondial. Malgré les progrès obtenus grâce à l introduction de nouveaux médicaments cytostatiques, les taux de rechute pour les patients atteints de stade II/III réséqués restent supérieurs à 20% malgré les traitements adjuvants les meilleurs [1]. C est la raison pour laquelle des moyens importants ont été investis dans les outils de diagnostic précoce et de prévention, mais aussi dans l efficacité des traitements adjuvants. Chez les patients ayant bénéficié d une résection potentiellement curative, l administration de chimiothérapie adjuvante est souvent considérée. Chez les patients atteints de cancer colique de stade III, une chimiothérapie à base de 5-fluorouracile (5-FU) pendant 6 mois améliore la survie de 5 à 10% en termes absolus [2] et était considérée comme le traitement standard depuis le milieu des années Entre-temps, il a été démontré qu il n y a aucune raison à étendre la durée de la chimiothérapie contenant du 5-FU pendant plus de 6 mois, et que les traitements par 5-FU en infusion continue ou en bolus ont une efficacité similaire, mais un profil de toxicité différent. Ce sont les infusions continues qui offrent le meilleur index thérapeutique et qui sont utilisées en Europe. Nouveaux agents De récents essais cliniques randomisés se sont intéressés à de nouveaux cytotoxiques comme l irinotécan et l oxaliplatine. L addition d oxaliplatine au 5-FU/leucovorin (LV) a amélioré la survie sans progression dans deux essais cliniques randomisés indépendants [1, 3]. Dans les deux études, les bénéfices escomptés étaient supérieurs chez les patients avec une atteinte ganglionnaire, mais cela au prix d une toxicité accrue et potentiellement invalidante, comme une neuropathie sensitive. Les patients à faible risque (par exemple, sans atteinte ganglionnaire) devraient être informés en toute objectivité du pour et du contre du traitement adjuvant. Trois essais cliniques randomisés ont évalué le rôle de la chimiothérapie à base d irinotécan dans le cancer colique précoce, avec des résultats décevants. A l heure actuelle, un traitement adjuvant à base d irinotécan ne peut pas être recommandé en dehors du contexte d un essai clinique. Les fluoropyrimidines orales jouent un rôle croissant dans la prise en charge du cancer colorectal et peuvent dès à présent être considérées comme une alternative au 5-fluorouracil. L équivalence entre 6 mois de traitement adjuvant par 5-FU/LV et les molécules orales capecitabine et UFT a été démontrée par deux essais cliniques randomisés [4, 5]. De nombreux essais cliniques randomisés s intéressent au rôle des agents biologiques dans le contexte adjuvant, en particulier le bevacizumab et le cetuximab. D autres agents ont fait preuve d activité dans le contexte métastatique et pourraient éventuellement être employés à l avenir en situation adjuvante: l anticorps monoclonal anti-egfr entièrement humanisé panitumumab, le composé oral anti-angiogénique PTK/ZK qui inhibe tous les récepteurs du VEGF, des composés oraux anti-angiogéniques comme le sunitinib et l AMG 706, de petits inhibiteurs de la tyrosine kinase comme le gefitinib et l erlotinib, l inhibiteur de protéasome bortezomib, la nouvelle fluoropyrimidine orale S-1, entre autres. En résumé, un nombre croissant de patients bénéficie de chimiothérapie à base d oxaliplatine. Celle-ci est maintenant considérée comme le traitement standard dans le traitement adjuvant du cancer colique à ganglions positifs, mais il subsiste des controverses en ce qui concerne l indica- 18
19 Chimiothérapie du Cancer Colorectal tion et le type de traitement adjuvant chez les patients avec ganglions négatifs. Les patients devraient être encouragés à participer à des essais cliniques, en particulier ceux qui évaluent le rôle de nouveaux agents biologiques dans le contexte adjuvant. Un essai avec l anti-egfr cétuximab combiné à la chimiothérapie est actuellement en cours aux CUSL. Cas particulier des patients âgés De nombreux articles ont montré que les patients âgés bénéficient autant de la chimiothérapie que les plus jeunes. Toutefois, dans ces études, la notion de patient âgé s applique parfois à des patients de plus de 65 ou 70 ans. De plus, la démonstration du bénéfice chez ces patients est souvent basée sur des analyses de sousgroupes ou sur des données poolées impliquant un nombre relativement restreint de patients. Le véritable challenge concerne plutôt les patients octogénaires et nonagénaires, qui sont de plus en plus nombreux dans nos hôpitaux, et qui font face à de nombreuses difficultés durant le traitement. Il est primordial pour les oncologues d identifier les patients âgés qui souffrent de problèmes gériatriques comme un déclin fonctionnel ou cognitif, un isolement social ou un statut socio-économique défavorable. Des outils décisionnels sont disponibles pour faciliter la prise de décision, mais ils ne sont pas toujours suffisamment pragmatiques que pour être utilisés en routine clinique. Idéalement, les patients âgés devraient bénéficier d une évaluation gériatrique complète avant et pendant le traitement. Sur la base de données d efficacité et de sécurité rassurantes, la capecitabine s est révélée être un traitement adjuvant d intérêt pour les patients âgés. Chez les patients à risque élevé de rechute, des schémas adaptés à base d oxaliplatine peuvent être proposés (réduction des doses et/ou de la durée du traitement, en fonction de la tolérance). Conclusion et perspectives Pour conclure, la chimiothérapie cytotoxique a atteint un niveau élevé de prévention des rechutes dans le cancer colique précoce. Une meilleure sélection des patients par des critères biologiques et/ou génétiques pourra peut-être définir des sous-populations qui bénéficient particulièrement ou ne bénéficient pas du tout d agents potentiellement toxiques et coûteux comme l oxaliplatine et l irinotécan. Il est aussi possible que les schémas de chimiothérapie actuels puissent être améliorés en termes d efficacité et de tolérance. Il est impossible de prédire ce qu apportera l introduction de nouveaux agents dans le contexte adjuvant, comme les molécules ciblées qui ont démontré un impact à un stade plus avancé de la maladie. Les recherches actuelles se concentrent plutôt sur leur utilisation en combinaison avec la chimiothérapie classique. Dans l avenir, nous pourrons probablement également mieux sélectionner les patients soi-disant à «faible risque» (par exemple, sans atteinte ganglionnaire) qui pourraient quand même retirer un bénéfice substantiel de la chimiothérapie. Le cancer colorectal avancé Un nombre non négligeable de patients atteints d un cancer colorectal (CCR) se présente avec - ou développe après un traitement chirurgical optimal - des métastases à distance. Dans le CCR, ces dernières sont définies comme des adénopathies en dehors des aires de drainage lymphatique régional, des métastases hépatiques ou dans d autres organes, ou une carcinomatose péritonéale. Contrairement à d autres tumeurs solides, la présence de métastases à distance dans le CCR n est pas toujours synonyme Références 1. de Gramont A., Boni C., Navarro M., et al. Oxaliplatin/5FU/LV in adjuvant colon cancer: Updated efficacy results of the MOSAIC trial, including survival, with a median follow-up of six years. Journal of Clinical Oncology, 2007 ASCO Annual Meeting Proceedings Part I. Vol 25, No. 18S (June 20 Supplement), 2007: Efficacy of adjuvant fluorouracil and folinic acid in colon cancer. International Multicentre Pooled Analysis of Colon Cancer Trials (IMPACT) investigators. Lancet 345 (8955): , Kuebler JP, Wieand HS, O Connell MJ, et al. Oxaliplatin combined with weekly bolus fluorouracil and leucovorin as surgical adjuvant chemotherapy for stage II and III colon cancer: results from NSABP C-07. J Clin Oncol Jun 1;25(16): Twelves C, Wong A, Nowacki MP, et al. Capecitabine as adjuvant treatment for stage III colon cancer. N Engl J Med Jun 30;352(26): Lembersky BC, Wieand HS, Petrelli NJ, et al. Oral uracil and tegafur plus leucovorin compared with intravenous fluorouracil and leucovorin in stage II and III carcinoma of the colon: results from National Surgical Adjuvant Breast and Bowel Project Protocol C-06. J Clin Oncol May 1;24(13):
20 Chimiothérapie du Cancer Colorectal sélectionnés sont associés à des taux de survie à 5 ans de 20-40%, avec un nombre non négligeable de patients menés à la guérison. Toutes ces techniques sont actuellement disponibles aux CUSL et certaines d entre elles sont discutées plus en détail dans ce numéro. Pour les patients sans indication immédiate d un traitement chirurgical, un traitement systémique est initialement proposé. Et, ceci n exclut pas la possibilité qu après une bonne réponse, une telle décision devra être reconsidérée. Figure 1 Résection des métastases hépatiques: l accumulation de facteurs de mauvais pronostic réduit le bénéfice potentiel pour un patient individuel. d une maladie incurable: certains patients sont potentiellement «rattrapables», par exemple, au moyen d une résection chirurgicale et/ou d une destruction par d autres techniques de pointe, comme l ablation par radiofréquence (ARF). Le traitement des métastases hépatiques (par résection chirurgicale et/ou ARF), de loin la situation la plus courante, est disponible depuis plusieurs années pour des patients présentant des métastases hépatiques limitées. Il n existe pas actuellement de critères absolus de «résécabilité» et/ou «opérabilité»: avec le progrès des techniques et l augmentation de l expérience, de plus en plus de patients deviennent potentiellement opérables. Or, il est important de préciser que l accumulation de facteurs de mauvais pronostic réduit le bénéfice potentiel pour un patient individuel (figure 1). Les progrès dans ce domaine ont été considérables, de sorte que d autres approches «radicales» sont parfois utilisées, comme la résection de métastases ganglionnaires isolées intra abdominales, la résection et/ou ARF de métastases pulmonaires, ou la péritonectomie avec chimiothérapie intra péritonéale hyperthermique (CHIP) pour la carcinomatose péritonéale limitée. Ces traitements utilisés dans des cas bien Actuellement, le traitement systémique standard du CCR métastatique est la chimiothérapie. L introduction de nouvelles molécules actives, comme l oxaliplatine et l irinotecan, a mené la survie médiane des patients à 20 mois, voire plus [1]. Plus récemment, l introduction de nouvelles molécules «ciblées», comme l inhibiteur de l angiogenèse bevacizumab, a encore amélioré l efficacité da la chimiothérapie systémique de sorte que la survie médiane semble actuellement dépasser les 24 mois [2]. Bien que cette molécule ne soit pas actuellement remboursée par la sécurité sociale belge, il est souvent possible d y avoir accès (ou à d autres molécules apparentées) par la participation à des essais cliniques en cours aux Cliniques universitaires Saint-Luc. L apparition de molécules orales modifie aussi progressivement la pratique des oncologues. Par exemple, la capecitabine et l UFT peuvent parfois remplacer le 5-flourouracil actuellement administré en ambulatoire via une pompe pour infusion intraveineuse. Il est donc actuellement possible, dans certains cas, soit de gérer la totalité du traitement en ambulatoire, soit (quand des molécules per os sont utilisées en combinaison avec l oxaliplatine ou l irinotecan) de réduire le nombre de visites en hôpital de jour. Par conséquent, il devient aussi possible d éviter le placement d un cathéter veineux central. Pour des raisons de confort et de convenance, cette option est 20
21 Chimiothérapie du Cancer Colorectal particulièrement appréciée par les patients âgés, bien qu il ne puisse pas être certifié que ces traitements oraux sont toujours mieux tolérés qu un traitement intraveineux classique. Une attention particulière est nécessaire pour les cas des patients à «résécabilité limite» ou «incertaine», c est-à-dire, ceux potentiellement candidats à une approche radicale en cas de bonne réponse au traitement systémique, d où l importance de réaliser, dans presque tous les cas, un bilan d extension initial assez complet et précis. D une manière générale, ces patients sont candidats à des traitements plus agressifs, soit associant des molécules ciblées diverses à la chimiothérapie (fréquemment dans le cadre d un essai clinique), soit par l utilisation de schémas de chimiothérapie combinant les 3 drogues actives (5-fluorouracil, irinotecan et oxaliplatine). Un résumé simplifié de l arbre décisionnel est montré dans la figure 2. Un problème fréquemment rencontré dans la pratique clinique, pour des patients se présentant déjà en situation métastatique, est la nécessité d un traitement de la tumeur colique/rectale primitive (chirurgie, prothèse ) avant l administration d un traitement systémique. En règle générale, ce dernier doit avoir la priorité, surtout en cas de maladie systémique étendue et menaçante, mais ces décisions ne peuvent être prises qu en discussion pluridisciplinaire, et en tenant compte aussi de la présence et de la sévérité des symptômes associés à la tumeur primitive. Après échec de la chimiothérapie standard, des traitements à base de molécules nouvelles (comme les anticorps monoclonaux cétuximab et panitumumab) peuvent être envisagés, associés ou non à la chimiothérapie. Cette décision doit tenir compte de l état général du malade et, parfois, du résultat de certains tests de laboratoire comme l expression du récepteur de l EGF ou la présence d une mutation du gène KRAS dans les cellules tumorales. Pour les patients présentant une maladie en progression après ou pendant cétuximab, un traitement expérimental avec un nouvel anticorps monoclonal 100% humanisé (zalutumumab) est actuellement disponible aux Cliniques universitaires Saint-Luc. Figure 2 Arbre décisionnel (simplifié) de la prise en charge du cancer colorectal métastatique. Références 1. Tournigand C, Andre T, Achille E, et al. FOLFIRI followed by FOLFOX6 or the reverse sequence in advanced colorectal cancer: a randomized GERCOR study. J Clin Oncol Jan 15;22(2): Sugrue M. M., Kozloff M., Hainsworth J, et al. Safety and effectiveness of bevacizumab plus chemotherapy in elderly patients with mcrc: Results from the BRiTE registry Gastrointestinal Cancers Symposium (abs 345) 21
22 Le point sur le traitement chirurgical des métastases hépatiques colorectales: l approche pluridisciplinaire du Centre du Cancer Prof. Jean-François GIGOT (1), Catherine HUBERT (1), Christine SEMPOUX (3), Yves HUMBLET (4), Max MANO (4), Bernard VAN BEERS (5), Laurence Pierre DEPREZ (6), Ivan BORBATH (6), Pierre SCALLIET (7), Renaud LHOMMEL (8), Alex KARTHEUSER (2), Roger DETRY (2), Christophe REMUE (2), Daniel Centre du Cancer. Groupe Pluridisciplinaire d Oncologie hépato-biliopancréatique et Clinique des pathologies tumorales du Colon et du Rectum. Services et Unités: Chirurgie et Transplantation Abdominale, Chirurgie Hépato-Bilio-Pancréatique (1) et Chirurgie Colorectale (2) ; Anatomo-Pathologie (3) ;Oncologie médicale (4) ; Imagerie Médicale (5) ; Gastro-entérologie (6) ; Radiothérapie oncologique (7) et Médecine Nucléaire (8). Cliniques Universitaires Saint-Luc. [email protected] Le groupe pluridisciplinaire d oncologie hépato-bilio-pancréatique Les dossiers de chaque patient admis aux Cliniques universitaires Saint-Luc et porteur de tumeurs malignes du foie, des voies biliaires et du pancréas sont discutés de façon hebdomadaire en concertation pluridisciplinaire, incluant toutes les spécialités potentiellement impliquées (chirurgiens, gastro-entérologues, oncologues médicaux, anatomopathologistes, radiologues, radiothérapeutes, médecins nucléaristes,.). Le Groupe Pluridisciplinaire d Oncologie hépato-bilio-pancréatique (HBP) formule une stratégie diagnostique et thérapeutique consensuelle basée sur des «guidelines» préétablis par le groupe en se référant aux données les plus récentes de la littérature scientifique. Les dossiers des patients porteurs de métastases hépatiques d origine colorectale sont discutés en concertation avec les membres de la Clinique des pathologies tumorales du Colon et du Rectum (CPTCR) dont la réunion hebdomadaire suit immédiatement celle du groupe HBP. Plusieurs protocoles de recherche clinique sont en cours au sein du groupe. Enfin, les réunions hebdomadaires de présentation de dossiers cliniques sont ouvertes aux médecins généralistes et spécialistes extérieurs aux Cliniques. Pour tout renseignement: Antonino Ceratti, coordonateur de soins oncologiques et coordonateur de recherche clinique (02/ ). Mots clés: métastases hépatiques colorectales, hépatectomies, chimiothérapie, survie. Introduction Le cancer du côlon représente le 3 e cancer par ordre de fréquence en Belgique. Près de la moitié des patients porteurs d un cancer colorectal vont développer des métastases hépatiques synchrones (au moment du diagnostic du cancer colorectal primitif) ou métachrones (après l exérèse du cancer primitif). En l absence de traitement chirurgical, la survie à 5 ans reste exceptionnelle en cas de métastase malgré l administration de schémas de plus en plus efficaces de chimiothérapie. La chirurgie d exérèse est donc actuellement considérée comme le traitement de choix chez les patients porteurs de métastases hépatiques colorectales (MHCR) résécables, leur permettant d atteindre des taux de survie à 5 ans de l ordre de 50%, bien meilleurs que par le passé. Ces bons résultats sont obtenus grâce à une meilleure sélection et préparation des patients, à une meilleure évaluation de l étendue de la maladie, à une chirurgie plus agressive et plus sûre, mais surtout à une concertation médico-chirurgicale pluridisciplinaire continue centrée sur le patient. Une meilleure sélection et préparation des patients La prédiction de l opérabilité du patient repose non pas sur l âge en tant que tel, mais surtout sur l évaluation de la comorbidité générale, en tenant compte de l étendue planifiée de l hépatectomie. Aux Cliniques universitaire Saint-Luc, ce risque opératoire est évalué en concertation avec nos collègues anesthésistes en consultation d EPI (évaluation préintervention). En cas d hépatectomie majeure (plus de 3 segments hépatiques réséqués), le futur foie restant après hépatectomie doit également être évalué tant sur le plan de son volume que de sa fonction. En effet, un volume hépatique résiduel insuffisant expose le patient à un risque significatif d insuffisance hépatique postopératoire, pouvant entraîner le décès. En cas d hépatopathie associée ou 22
23 Le point sur le traitement chirurgical des métastases hépatiques colorectales: l approche pluridisciplinaire du Centre du Cancer ANNET (5), Pierre GOFFETTE (5), LEONARD (2), Antonino CERATTI d hépatotoxicité sur chimiothérapie, il est prudent d exiger que le volume du futur foie résiduel soit plus important. Lorsque le volume hépatique résiduel est jugé insuffisant en préopératoire pour permettre la réalisation d une hépatectomie majeure, on peut recourir à une embolisation portale radiologique afin d obtenir une hypertrophie compensatoire du foie controlatéral à l exérèse, la chirurgie hépatique d exérèse étant alors réalisée 6 à 8 semaines plus tard. Aux Cliniques universitaires Saint-Luc, ce geste délicat de radiologie interventionnelle est assuré par le Prof. GOFFETTE, du Département d Imagerie médicale. Dans l intervalle, la maladie néoplasique doit être contrôlée par une chimiothérapie intercurrente qui est administrée par nos collègues oncologues médicaux. Une meilleure évaluation de l étendue de la maladie La détermination de la résécabilité tumorale relève de l expertise de nos collègues radiologues et va dépendre de l extension de la maladie oncologique en intrahépatique et en extrahépatique. Le nombre, la distribution parenchymateuse hépatique segmentaire et les rapports avec les gros troncs vasculobiliaires des MHCR sont cruciaux pour juger de leur résécabilité. Le scanner spiralé et la résonance magnétique nucléaire avec contraste sont les examens de référence pour la détection des MHCR. La tomodensitométrie par émission de positrons au fluorodeoxyglucose (Pet- FDG) est l innovation technologique la plus performante pour détecter une localisation métastatique extrahépatique, permettant une meilleure sélection des patients en évitant de sous-estimer l extension de la maladie métastatique. C est également une modalité efficace pour le monitoring de la réponse thérapeutique des métastases et de leur éventuel échappement à la chimiothérapie. Enfin, l échographie peropératoire au moment de l intervention colique en cas de MHCR synchrones a un rôle crucial dans la détection lésionnelle et l élaboration de la stratégie chirurgicale. Une chirurgie plus agressive et plus sûre Les critères de résécabilité actuels ne reposent plus seulement sur le nombre, le caractère bilobaire des MHCR ou sur l existence de métastases extrahépatiques, mais sur la possibilité de réaliser une exérèse complète de toutes les lésions métastatiques (appelée exérèse R0), intra- et extrahépatiques, en une ou plusieurs opérations, en laissant un foie résiduel de volume suffisant et avec une vascularisation et un drainage biliaire adéquat, le tout avec une mortalité opératoire acceptable. Dans les centres spécialisés, la mortalité opératoire après résection des MHCR est de l ordre de 1%. La présence de métastases hépatiques multiples ou bilobaires et de métastases extrahépatiques ne constitue pas une contre-indication à la chirurgie, à condition que ces métastases soient résécables de manière radicale également. L objectif de la chirurgie carcinologique est donc d assurer une exérèse complète des MHCR avec une marge de sécurité chirurgicale saine en parenchyme hépatique non tumoral. Le concept est d adapter l exérèse aux métastases, en réalisant de principe des résections économiques, préservant la possibilité technique de résections itératives. Outre l embolisation portale, plusieurs stratégies permettent d augmenter la résécabilité chirurgicale, par exemple en pratiquant des hépatectomies en deux temps dans les métastases bilobaires (par exemple, «nettoyage» tumoral du foie gauche lors d une première intervention chirurgicale, suivie d une embolisation portale droite, puis 6 à 8 semaines plus tard d une hépatectomie droite), des hépatectomies itératives en cas de récidive, des résections chirurgicales combinées de métastases extra-hépatiques ou en associant au geste d hépatectomie des techniques de destruction locale comme la thermoablation par radiofréquence. Ces techniques de destruction locale ne constituent cependant pas une alternative à la chirurgie de résection qui reste actuellement le traitement de référence, avec de Figure 1 Volumineuse métastase hépatique du foie droit. Les calculs de volumétrie hépatique montrent que le foie gauche est de volume suffisant. 23
24 Le point sur le traitement chirurgical des métastases hépatiques colorectales: l approche pluridisciplinaire du Centre du Cancer Figure 2 Vues peropératoires de la ligne de transsection hépatique. Figure 3 Vue peropératoire en cours de transsection hépatique. meilleurs résultats en termes de récidive locale. La radiofréquence doit donc être réservée aux patients âgés, à haut risque opératoire qui ne pourraient pas supporter une hépatectomie majeure ou encore aux patients ayant des métastases hépatiques colorectales bilobaires où la radiofréquence est alors associée à une résection hépatique homolatérale pour augmenter la radicalité oncologique. Elle peut également être utilisée chez des patients présentant une récidive de MHCR, qui ont déjà été opérés à plusieurs reprises et chez qui le volume hépatique restant est insuffisant pour subir une x ième hépatectomie. Les critères d inclusion pour la radiofréquence sont stricts et doivent être respectés: métastases < 3-4 cm de diamètre, à distance des gros troncs biliaires (pour éviter une nécrose thermique) et des gros vaisseaux intrahépatiques (pour éviter un taux de récidive locale accru par «cooling effect», un phénomène de refroidissement relatif par le flux sanguin du vaisseau juxta-tumoral qui emporte la chaleur de la radiofréquence). Une concertation pluridisciplinaire continue centrée sur le patient L heure n est plus à opposer l efficacité des traitements existants, mais à s interroger sur leur association optimale afin de guérir ces patients porteurs de MHCR. Une concertation pluridisciplinaire continue centrée sur le patient, à tout moment de son histoire oncologique, doit donc être la règle afin d offrir à celui-ci toutes les chances de guérison issues de l efficacité combinée de chacun des traitements disponibles. C est sans conteste le facteur le plus important dans l amélioration actuelle de la survie des patients porteurs de MHCR. En cas de MHCR jugées irrésécables après concertation avec un chirurgien hépatique spécialisé, la chimiothérapie permet en effet, grâce à son efficacité, de rendre secondairement résécables près de 15 à 20% de ces patients. De ce fait, même en cas de MHCR jugées irrésécables, la chirurgie de la tumeur primitive colorectale se doit d être toujours carcinologiquement radicale, sous peine de récidive locale colorectale alors que les MHCR peuvent être devenues ultérieurement résécables sous chimiothérapie. La réponse tumorale à la chimiothérapie est prédictive de la résécabilité et en cas de chirurgie d exérèse «de sauvetage» pour des MHCR qui ne répondent pas à la chimiothérapie, la survie est mauvaise. Cependant, en cas de chimiothérapie de longue durée, une attention particulière sera apportée à la détection d une hépatotoxicité et au problème de la disparition radiologique des métastases, considérée souvent à tort comme un succès thérapeutique et exposant le patient à un risque de traitement chirurgical incomplet ou à la nécessité de chirurgie itérative. En effet, la disparition morphologique lésionnelle ne correspond que rarement à une guérison définitive, puisqu une persistance ou une récidive a été rapportée dans plus de 80% des cas. Le rôle de la chimiothérapie néoadjuvante en cas de MHCR résécables est en cours d évaluation. L intérêt de la chimiothérapie adjuvante au décours d une résection hépatique pour MHCR a été souligné par une amélioration de la survie sans récidive. En conclusion, la chirurgie d exérèse des MHCR en combinaison avec la chimiothérapie est la seule stratégie thérapeutique potentiellement curative actuellement. La 24
25 Le point sur le traitement chirurgical des métastases hépatiques colorectales: l approche pluridisciplinaire du Centre du Cancer Figure 4 Examen de la pièce d exérèse avec une marge de sécurité centimétrique. chirurgie doit être proposée à tout patient qui présente des métastases qui peuvent être réséquées en totalité avec des marges saines. On assiste à une meilleure sélection des malades, à une évaluation plus performante de l étendue de la maladie grâce aux progrès de l imagerie, à une extension progressive des indications (métastases extrahépatiques, récidives après hépatectomie, ) et au développement de stratégies chirurgicales et chimiothérapiques visant à augmenter la résécabilité. Une approche médico-chirurgicale concertée permet d améliorer la survie à long terme de ces patients. Cette approche pluridisciplinaire est un élément qualitatif primordial dans leur prise en charge thérapeutique. Tous les membres du Groupe d Oncologie HBP en sont de fervents partisans. TIME IS A GIFT In KIT+ GIST, the Promise Continues Glivec (imatinib) is indicated for the treatment of adult patients with KIT (CD 117)-positive unresectable and/or metastatic malignant gastrointestinal stromal tumours (GIST). Dénomination : GLIVEC 100 mg gélules. GLIVEC 400 mg comprimés pellicullés. Composition : Chaque gélule contient 100 mg d'imatinib (sous forme de mésilate) Chaque comprimé contient 400 mg d'imatinib (sous forme de mésilate). Indications : Glivec est indiqué dans le traitement : des patients adultes et enfants atteints de leucémie myéloïde chronique (LMC) chromosome Philadelphie (bcr-abl) positive (Ph+) nouvellement diagnostiquée lorsque la greffe de moelle osseuse ne peut être envisagée comme un traitement de première intention. des patients adultes et enfants atteints de LMC Ph+ en phase chronique après échec du traitement par l'interféron alpha, ou en phase accélérée ou en crise blastique. des patients adultes atteints de leucémie aiguë lymphoïde chromosome Philadelphie positive (LAL Ph+) nouvellement diagnostiquée en association avec la chimiothérapie. des patients adultes atteints de LAL Ph+ réfractaire ou en rechute en monothérapie. des patients adultes atteints de syndromes myélodysplasiques/myéloprolifératifs (SMD/SMP) associés à des réarrangements du gène du PDGFR (platelet-derived growth factor receptor). des patients adultes atteints d'un syndrome hyperéosinophilique (SHE) à un stade avancé et/ou d'une leucémie chronique à éosinophiles (LCE) associés à un réarrangement du FIP1L1-PDGFR. L'effet de Glivec sur l'issue d'une greffe de moelle osseuse n'a pas été évalué. Glivec est également indiqué dans le traitement o des patients adultes atteints de tumeurs stromales gastro-intestinales (GIST - gastrointestinal stromal tumours) malignes Kit (CD 117) positives non résécables et/ou métastatiques. des patients adultes atteints de dermatofibrosarcome protuberans (DFSP ou maladie de Darier-Ferrand) non résécable et patients adultes atteints de DFSP en rechute et/ou métastatique ne relevant pas d'un traitement chirurgical. Chez l'adulte et les patients pédiatriques, l'efficacité de Glivec est basée sur les taux de réponses hématologiques et cytogénétiques globales et la survie sans progression dans la LMC, sur les taux de réponses hématologique et cytogénétique des LAL Ph+, des SMD/SMP, sur les taux de réponses hématologiques des SHE/LCE et sur les taux de réponses objectives des patients adultes dans les GIST et les DFSP. L'expérience avec Glivec chez les patients atteints de SMD/SMP associés à des réarrangements du gène du PDGFR est très limitée. A l'exception de la LMC en phase chronique nouvellement diagnostiquée, il n'existe pas d'étude clinique contrôlée démontrant un bénéfice clinique ou une prolongation de la durée de vie, pour ces maladies. Posologie : Le traitement doit être instauré par un médecin ayant l'expérience du traitement des hémopathies malignes ou des sarcomes. La dose prescrite doit être administrée par voie orale, avec un grand verre d'eau, au cours d'un repas pour réduire le risque d'irritations gastrointestinales. Les doses de 400 mg ou 600 mg devront être administrées en une prise par jour, tandis que la dose journalière de 800 mg devra être répartie en deux prises de 400 mg par jour, matin et soir. Pour les patients (enfants) incapables d'avaler les gélules, leur contenu peut être dilué dans un verre d'eau plate ou de jus de pomme. Dans la mesure où les études menées chez l'animal ont montré des effets toxiques sur la reproduction et que le risque potentiel chez le fœtus humain est inconnu, il est recommandé aux femmes en âge de procréer qui ouvrent les gélules d'en manipuler le contenu avec précaution et d'éviter tout contact avec la peau ou les yeux, ainsi que toute inhalation. Il convient de se laver les mains immédiatement après avoir manipulé les gélules ouvertes. Posologie dans la LMC chez l'adulte. Patients en phase chronique de LMC : La posologie recommandée est de 400 mg/j. La phase chronique est définie par l'ensemble des critères suivants : blastes < 15 % dans le sang et la moelle osseuse, basophiles dans le sang < 20 %, plaquettes > 100 x 10 9 /l. Patients en phase accélérée : La posologie recommandée est de 600 mg/j chez. La phase accélérée est définie par la présence d'un des critères suivants : blastes 15 % mais < 30 % dans le sang ou la moelle osseuse, blastes plus promyélocytes 30 % dans le sang ou la moelle osseuse (à condition que blastes < 30 %), basophiles dans le sang 20 %, plaquettes < 100 x 10 9 /l indépendamment du traitement. Patients en crise blastique : La posologie recommandée est de 600 mg/j. La crise blastique est définie par la présence de blastes 30 % dans le sang ou la moelle osseuse ou un envahissement extramédullaire autre qu'une hépatosplénomégalie. Durée du traitement : dans les études cliniques, le traitement est poursuivi jusqu'à progression de la maladie. L'effet de l'arrêt du traitement après l'obtention d'une réponse cytogénétique complète n'a pas été étudié. En l'absence d'effets indésirables sévères et de neutropénie ou de thrombopénie sévères non imputables à la leucémie, une augmentation de la dose peut être envisagée, de 400 mg à 600 mg ou 800 mg, chez les patients en phase chronique, ou de 600 mg à un maximum de 800 mg (en deux prises de 400 mg par jour) chez les patients en phase accélérée ou en crise blastique, dans les circonstances suivantes : évolution de la maladie (à tout moment), absence de réponse hématologique satisfaisante après un minimum de 3 mois de traitement, absence de réponse cytogénétique après 12 mois de traitement, ou perte de la réponse hématologique et/ou cytogénétique obtenue auparavant. Les patients devront être surveillés étroitement après augmentation de la dose étant donnée la possibilité d'une incidence accrue des effets indésirables à plus fortes doses. Posologie dans la LMC chez l'enfant. Chez l'enfant, la posologie devra être établie en fonction de la surface corporelle (mg/m2). La dose journalière recommandée chez l'enfant est de 340 mg/m2 dans la LMC en phase chronique et dans la LMC en phase avancée (ne doit pas dépasser une dose totale de 800 mg). Le traitement peut être administré en une prise quotidienne ou bien être divisé en deux prises (une le matin et une le soir). Ces recommandations posologiques reposent actuellement sur un faible nombre d'enfants. On ne dispose d'aucune donnée chez l'enfant de moins de 2 ans. L'augmentation de doses de 340 mg/m2 jusqu'à 570 mg/m2 par jour (sans dépasser la dose totale de 800 mg) peut être envisagée chez l'enfant en l'absence d'effets indésirables graves et de neutropénie ou thrombopénie sévères non liées à la leucémie dans les circonstances suivantes : progression de la maladie (à n'importe quel moment) ; absence de réponse hématologique satisfaisante après au moins 3 mois de traitement ; absence de réponse cytogénétique après 12 mois de traitement; ou perte d'une réponse hématologique et/ou cytogénétique antérieure. Les patients devront être surveillés attentivement au cours des escalades de doses compte tenu du risque accru d'effets indésirables à des doses plus élevées. Posologie dans les LAL Ph+. La posologie recommandée de Glivec est de 600 mg/jour chez les patients atteints de LAL Ph+. Le traitement devrait être supervisé par des hématologues experts dans la prise en charge de cette maladie pour toutes les phases de traitement. Schéma thérapeutique : Sur la base des données existantes, Glivec s'est montré efficace et sûre lorsqu'il est administré à 600 mg/j en association à une chimiothérapie d'induction, de consolidation et d'entretien utilisée des LAL Ph+ nouvellement diagnostiquées de l'adulte. La durée de traitement par Glivec peut varier en fonction du traitement appliqué, mais généralement les traitements prolongés de Glivec ont fourni de meilleurs résultats. Chez les patients adultes atteints de LAL Ph+ en rechute ou réfractaire, une montérapie par Glivec à la dose de 600 mg/j est sure, efficace et peut être poursuivie jusqu'à la progression de la maladie. Posologie dans les SMD/SMP. La posologie recommandée de Glivec est de 400 mg/jour chez les patients atteints de SMD/SMP. La durée de traitement : dans l'unique étude clinique menée à ce jour, le traitement par Glivec a été poursuivi jusqu'à la progression de la maladie. A la date de l'analyse, la durée médiane de traitement était de 47 mois (24 jours à 60 mois). Posologie dans les SHE/LCE. La dose recommandée de Glivec est de 100 mg/jour chez les patients atteints de SHE/LCE. Une augmentation de dose de 100 mg à 400 mg chez ces patients peut être envisagée si la réponse au traitement est insuffisante et en l'absence d'effets indésirables. Posologie dans les GIST. Patients atteints de GIST malignes non résécables et/ou métastatiques : la posologie recommandée est de 400 mg/j. Les données concernant l'effet de l'augmentation des doses de 400 mg à 600 mg ou 800 mg chez des patients en progression lorsqu'ils sont traités à la plus faible dose sont limitées. Il n'y a pas actuellement de données disponibles permettant de recommander une dose spécifique en fonction de la résection gastro-intestinale antérieure chez des patients atteints de GIST. La majorité des patients (98%) inclus dans l'étude clinique avaient eu une résection auparavant. Pour tous les patients de l'étude, la première administration de Glivec a eu lieu au moins deux semaines après la résection ; toutefois on ne peut pas faire d'autre recommandation supplémentaire sur la base de cette étude. Durée du traitement : dans les études cliniques menées chez des patients atteints de GIST, le traitement par Glivec a été poursuivi jusqu'à la progression de la maladie. A la date de l'analyse, la durée médiane de traitement était de 7 mois (7 jours à 13 mois). L'effet de l'arrêt du traitement après l'obtention d'une réponse n'a pas été étudié. Posologie dans le DSFP. La posologie recommandée de Glivec est de 800 mg/jour chez les patients atteints de DFSP. Ajustement de la posologie en cas d'effets indésirables. Effets indésirables extra-hématologiques : En cas de survenue d'un effet indésirable extra-hématologique sévère, le traitement par Glivec doit être interrompu jusqu'à résolution de l'événement. Le traitement peut ensuite être repris de manière appropriée en fonction de la sévérité initiale de l'événement. En cas d'élévation de la bilirubine > 3 x la limite supérieure de la normale (LSN) fournie par le laboratoire d'analyses ou des transaminases > 5 x la LSN, Glivec doit être interrompu jusqu'à un retour de la bilirubine à un taux < 1.5 x la LSN et des transaminases à un taux < 2.5 x la LSN. Le traitement peut alors être repris à dose réduite chez l'adulte, la dose sera diminuée de 400 à 300 mg ou de 600 à 400 mg ou de 800 à 600 mg, et chez l'enfant la dose sera diminuée de 340 à 260 mg/m 2 /jour. Effets indésirables hématologiques : En cas de neutropénie ou thrombopénie sévères, il est recommandé de diminuer la dose ou d'interrompre le traitement conformément aux instructions reprises dans la notice complète. Enfant : Il n'y a pas d'expérience chez l'enfant de moins de 2 ans. L'utilisation chez l'enfant atteint de LAL Ph+ est limitée, et l'utilisation chez l'enfant atteint de SMD/SMP et de DFSP est très limitée. Il n'y a pas d'expérience chez l'enfant et l'adolescent atteints de GIST et de SHE/LCE.. Insuffisance hépatique : L'imatinib est principalement métabolisé par le foie. Les patients présentant une altération de la fonction hépatique, légère, modérée ou importante devraient être traités à la dose mimimale recommandée de 400 mg. La dose peut être réduite si elle est mal tolérée. Insuffisance rénale : L'imatinib n'étant pas excrété par le rein de façon significative, une diminution de la clairance de l'imatinib libre n'est pas attendue chez les patients ayant une insuffisance rénale. Chez les patients présentant une altération de la fonction rénale légère à modérée (clairance de la créatinine = ml/min) la dose initiale de traitement de 400 mg par jour est recommandée. Bien que l'information disponible soit très limitée chez les patients présentant une altération de la fonction rénale sévère (clairance de la créatinine = < 20 ml/min) et chez les patients dialysés, le traitement pourra aussi être initié à la même dose de 400 mg. Toutefois, la prudence est recommandée chez ces patients. La dose peut être réduite si elle est mal tolérée ou augmentée en l'absence d'efficacité. Patients âgés : la pharmacocinétique de l'imatinib n'a pas été spécifiquement étudiée chez le sujet âgé. Aucune différence significative de pharmacocinétique n'a été observée en fonction de l'âge chez les patients adultes inclus dans les études cliniques dont plus de 20 % étaient âgés de 65 ans et plus. Par conséquent, aucune recommandation particulière sur la posologie n'est requise pour ces patients. Contre-indications : Hypersensibilité à la substance active ou à l'un des excipients. Effets indésirables : Les patients atteints de pathologies malignes à un stade avancé peuvent présenter des affections intercurrentes. Ces affections peuvent rendre difficile l'évaluation du lien entre l'administration de Glivec et la survenue d'événements indésirables en raison de la variété des symptômes liés à la maladie sous-jacente, à sa progression ou à la co-administration de nombreux médicaments. Au cours des études cliniques menées dans la LMC, un arrêt du traitement motivé par des effets indésirables imputables au médicament a été observé chez 2,4% des patients nouvellement diagnostiqués, 4% des patients en phase chronique tardive après échec du traitement par l'interféron, 4% des patients en phase accélérée après échec du traitement par l'interféron et 5% des patients en crise blastique après échec du traitement par l'interféron. Dans les GIST, le produit étudié a été arrêté en raison d'effets indésirables imputables au médicament chez 4% des patients. Les effets indésirables ont été comparables dans toutes les indications, à deux exceptions près. Il y a eu plus de myélosuppressions observées chez les patients atteints de LMC que chez ceux atteints de GIST, ce qui est probablement dû à la maladie sous-jacente. Dans l'étude clinique GIST, 7 (5%) patients ont présenté des saignements de grade 3/4 selon la classification CTC (Common Toxicity Criteria) : saignements gastrointestinaux (3 patients), saignements intra-tumoraux (3 patients), les deux types (1 patient). La localisation de la tumeur gastrointestinale peut avoir été à l'origine des saignements gastro-intestinaux. Les saignements gastro-intestinaux et intra-tumoraux peuvent être sérieux et dans certains cas fatals. Les effets indésirables les plus fréquemment rapportés ( 10 %) pouvant être imputables au traitement par Glivec dans les deux indications ont été des nausées modérées, vomissements, diarrhée, douleur abdominale, fatigue, myalgies, crampes musculaires et rash. Des œdèmes superficiels ont été très fréquemment observés dans toutes les études cliniques et décrits principalement comme des œdèmes périorbitaux ou des membres inférieurs. Toutefois, ces œdèmes ont été rarement sévères et ont pu être contrôlés par des diurétiques, d'autres mesures symptomatiques ou en réduisant la dose de Glivec. Lorsque l'imatinib était associé à des doses élevées de chimiothérapie chez des patients atteints de LAL Ph+, une toxicité hépatique transitoire se traduisant par une élévation des transaminases et une hyperbilirubinémie a été observée. Divers effets indésirables tels qu'épanchement pleural, ascite, œdème pulmonaire, prise de poids rapide avec ou sans œdème superficiel ont été décrits dans le cadre de rétention hydrique. Ces effets peuvent habituellement être contrôlés par l'interruption temporaire du Glivec et par l'utilisation de diurétiques et d'autres traitements symptomatiques appropriés. Cependant, certains de ces effets peuvent être graves voire mettre en jeu le pronostic vital : plusieurs patients en crise blastique sont décédés, avec un tableau clinique complexe associant un épanchement pleural, une insuffisance cardiaque congestive et une insuffisance rénale. Les études cliniques menées chez l'enfant n'ont pas révélé de données de tolérance particulière à cette population. Les effets indésirables, en dehors des cas isolés, sont repris ci-dessous : ils sont classés par organe et par ordre de fréquence en utilisant la convention suivante : très fréquent (> 1/10), fréquent (> 1/100, 1/10), peu fréquent (> 1/1000, 1/100), rare 1/1000, fréquence indéterminée (ne peut être estimée sur la base des données disponibles). Au sein de chaque fréquence de groupe, les effets indésirables doivent être présentés suivant un ordre décroissant de fréquence, le plus fréquent en premier. Les effets indésirables et leurs fréquences présentés ci-après sont issus des principales études d'enregistrement. Investigations : Très fréquent : Prise de poids. Fréquent : Perte de poids. Peu fréquent : Augmentation de la créatininémie, augmentation de la créatine phosphokinase, augmentation de la lacticodeshydrogénase, augmentation des phosphatases alcalines. Rare : Augmentation de l'amylasémie. Affections cardiaques : Peu fréquent : Palpitations, tachycardie, insuffisance cardiaque congestive, oedème. Rare: Arythmie, fibrillation auriculaire, arrêt cardiaque, infarctus du myocarde, angine de poitrine, épanchement péricardique. Affections hématologiques et du système lymphatique : Très fréquent : neutropénie, thrombopénie, anémie. Fréquent : Pancytopénie, neutropénie fébrile. Peu fréquent : Thrombocythémie, lymphopénie, aplasie médullaire, eosinophilie, lymphadénopathie. Rare : Anémie hémolytique. Affections du système nerveux : Très fréquent : Céphalées. Fréquent : Sensations vertigineuses, paresthésies, troubles du goût, hypoesthésie. Peu fréquent : Migraine, somnolence, syncope, neuropathie périphérique, troubles de la mémoire, sciatique, syndrome des jambes sans repos, tremblement, hémorragie cérébrale. Rare : Hypertension intracrânienne, convulsions, névrite optique. Affections oculaires : Fréquent : Oedème des paupières, secretions lacrymales augmentées, hémorrhagie conjonctivale, conjonctivite, yeux secs, vision trouble. Peu fréquent : Irritation oculaire, douleur oculaire, œdème orbitaire, hémorrhagie sclérale, hémorrhagie rétinienne, blépharite, œdème maculaire. Rare : Cataracte, glaucome, œdème papillaire. Affections de l'oreille et du labyrinthe: Peu fréquent : Vertiges, acouphènes, perte auditive. Affections respiratoires, thoraciques et médiastinales : Fréquent : Dyspnée, epistaxis, toux. Peu fréquent : Epanchement pleural, douleur pharyngolaryngée. Rare: Douleur pleurale, fibrose pulmonaire, hypertension pulmonaire, hémorrhagie pulmonaire. Affections gastro-intestinales : Très fréquent : Nausées, diarrhée, vomissements, dyspepsie, douleur abdominale. Fréquent : Flatulences, ballonnements, reflux gastro-oesophagien, constipation, sécheresse de la bouche, gastrite. Peu fréquent : Stomatite, mucite, hémorrhagie gastro-intestinale, eructation, méléna, oesophagite, ascite, ulcère gastrique, hématémèse, chéilite, dysphagie, pancréatite. Rare : Colite, ileus, affection abdominale inflammatoire. Affections du rein et des voies urinaires : Peu fréquent : Douleur rénale, hématurie, insuffisance rénale aiguë, pollakurie. Affections de la peau et du tissu sous-cutané : Très fréquent : Œdème périorbitaire, dermatite/eczéma/rash. Fréquent : Prurit, œdème de la face, peau sèche, erythème, alopécie, sueurs nocturnes, réaction de photosensibilité. Peu fréquent : Rash pustuleux, contusion, hypersudation, urticaire, ecchymose, tendance augmentée aux ecchymoses, hypotrichose, hypopigmentation cutanée, dermatite exfoliative, ongles cassants, folliculite, pétéchies, psoriasis, purpura, hyperpigmentation cutanée, eruption bulleuse. Rare : Dermatose aiguë fébrile neutrophilique (syndrome de Sweet), décoloration des ongles, œdème de Quincke, rash vésiculaire, érythème polymorphe, vascularite leucocyclasique, syndrome de Stevens-Johnson. Affections musculo-squelettiques et systémiques : Très fréquent : Crampes et spasmes musculaires, douleurs musculosquelettiques incluant les myalgies, arthralgies, douleurs osseuses. Fréquent : Gonflement des articulations. Peu fréquent : Raideur articulaire et musculaire. Rare: Faiblesse musculaire, arthrite. Troubles du métabolisme et de la nutrition : Fréquent : Anorexie. Peu fréquent : Hypokaliémie, augmentation de l'appétit, hypophosphatémie, diminution de l'appétit, déshydratation, goutte, hyperuricémie, hypercalcémie, hyperglycémie, hyponatrémie. Rare : Hyperkaliémie, hypomagnésémie. Infections et infestations : Peu fréquent : Zona, herpès simplex, inflammation nasopharyngée, pneumonie, sinusite, cellulites, infection des voies respiratoires hautes, influenza, infection des voies urinaires, gastroenterite, septicémie. Rare : Infection fongique. Affections vasculaires : Fréquent : Bouffées vasomotrices, hémorragie. Peu fréquent : Hypertension, hématome, extrémités froides, hypotension, syndrome de Raynaud. Troubles généraux et anomalies au site d'administration : Très fréquent : Rétention hydrique et œdème, fatigue. Fréquent : Faiblesse, pyrexie, anasarque, frissons, rigidité. Peu fréquent : Douleur thoracique, malaise. Affections hépatobiliaires : Fréquent : Elévation des enzymes hépatiques. Peu fréquent : Hyperbilirubinémie, hepatite, ictère. Rare : Insuffisance hépatique, nécrose hépatique. Affections des organes de reproduction et du sein : Peu fréquent : Gynécomastie, dysfonctionnement érectile, ménorragie, menstruation irregulière, troubles sexuels, douleur des mammelons, gonflement des seins, œdème du scrotum. Affections psychiatriques : Peu fréquent : Insomnie. Peu fréquent : Dépression, diminution de libido, anxiété. Rare: Confusion. Les types de réactions suivantes ont principalement été observées au cours de la commercialisation de Glivec. Cela comprend les rapports spontanés de cas individuels ainsi que les effets indésirables graves des études cliniques en cours, des programmes d'accès élargi et des études de pharmacologie clinique et des études exploratoires menées dans le cadre d'indications thérapeutiques non enregistrées. Comme ces effets sont issus d'une population dont la taille n'est pas déterminée, il n'est pas toujours possible d'estimer de manière fiable leur fréquence ou d'établir la relation de causalité avec l'exposition à l'imatinib. Tumeurs bénignes, malignes et non précisées (comprenant kystes et polypes) : Indéterminée: Hémorragie tumorale, nécrose tumorale. Affections du système immunitaire : Indéterminée: Choc anaphylactique. Affections cardiaques : Indéterminée: Péricardite, tamponnade. Affections du système nerveux : Indéterminée: Oedème cérébral. Affections oculaires : Indéterminée: Hémorragie du corps vitré. Affections respiratoires, thoraciques, et médiastinales : Indéterminée: Insuffisance respiratoire aiguë, maladie pulmonaire interstitielle. Affections gastro-intestinales : Indéterminée: Ileus/obstruction intestinale, perforation gastro-intestinale, diverticulite. Affections de la peau et du tissu sous-cutané : Indéterminée: Kératose lichenoïde, lichen plan. Nécrolyse épidermique toxique. Affections musculosqelettiques et systémiques : Indéterminée: Nécrose avasculaire/nécrose de la hanche. Affections vasculaires : Indéterminée: Thrombose/embolie. Anomalies biologiques : voir notice complète. Titulaire et numéro de l'autorisation de miser sur le marché : Novartis Europharm Limited - Wimblehurst Road - Horsham - West Sussex, RH12 5AB - Royaume Uni - EU/1/01/198/005 et EU/1/01/198/010. Délivrance : sur prescription médicale. Date de la dernière mise à jour du texte
26 Le Fonds Joseph Maisin Vous invitent à la conférence du Lauréat du Prix INBEV-BAILLET LATOUR de la SANTE 2008 Le Professeur Robert A. Weinberg Whitehead Institute for Biomedical Research, Cambridge, USA The Development of Malignant Growth Le vendredi 03 octobre 2008 à 17 heures Une réception sera offerte à l issue de la conférence UCL-LEW, auditoire J. Maisin, av. E. Mounier 51, 1200 Bruxelles (Station de métro «Alma»)
27 Le professeur Robert Weinberg est membre du Whitehead Institute for Biomedical Research, Cambridge, USA, où il poursuit ses recherches sur le cancer depuis Il est Professeur dans le Département de Biologie du MIT (Massachusetts Institute of Technology) où il a commencé sa carrière d enseignant en 1972 après des stages postdoctoraux chez E. Winocour au Weizmann Institute et chez R. Dulbecco au Salk Institute. Un jury international a désigné le docteur R. Weinberg comme lauréat du Prix INBEV- BAILLET LATOUR DE LA SANTE 2008, qui lui sera remis par la Princesse Mathilde le 3 octobre prochain. Cette distinction prestigieuse couronne des découvertes qui ont fait de R. Weinberg un pionnier des mécanismes moléculaires et génétiques de la cancérogenèse. Il a notamment identifié les premiers oncogènes dans des tumeurs humaines non induites par un virus et a montré que ces oncogènes sont des formes mutées de gènes normaux, les proto-oncogènes. Il a démontré comment plusieurs oncogènes collaborent pour induire une tumeur et fut le premier à rendre ainsi cancéreuse in vitro une cellule humaine normale. Il a découvert le premier gène suppresseur de tumeur (celui dont l inactivation conduit au rétinoblastome) ainsi que le gène humain de la télomérase, laquelle contrôle le vieillissement cellulaire. Tout récemment, il a identifié trois facteurs qui favorisent l invasion métastatique et montré que celleci peut être stimulée par des cellules souches mésenchymateuses provenant de la moelle osseuse. Plusieurs des molécules ainsi caractérisées par le Professeur Weinberg sont des cibles thérapeutiques en oncologie. Titulaire de nombreuses distinctions scientifiques, il est auteur de plus de 350 articles de recherche et du remarquable traité «The Biology of Cancer» publié en par Guy Rousseau, 20 mai 2008
28 Chimio-hyperthermie intra-péritonéale ou chip pour carcinose péritonéale en chirurgie colorectale DR. Ch. Remue 1, F. Lois 2, X. Wittebole 3, D. Léonard 1, A. Kartheuser 1 Photo 1 Système de drains, capteurs de pression et de température en place pour la CHIP à ventre fermé. Centre du Cancer, Clinique des Pathologies Tumorales du Colon et du Rectum (CPTCR), Service de Chirurgie et Transplantation Abdominale, Unité de Chirurgie Colorectale (UCCR) (1), Services d Anesthésie (2) et des Soins Intensifs Médico-Chirurgicaux (3) Cliniques universitaires Saint-Luc. [email protected] a) Introduction Lors du diagnostic initial de cancer colorectal, une atteinte péritonéale est déjà présente chez 10 à 15% des patients. Lorsque la carcinose apparaît plus tard, elle est encore confinée au péritoine dans 10 à 35% des cas. Le pronostic des patients souffrant de carcinose d origine colorectale est extrêmement péjoratif avec une survie atteignant rarement 6 mois. Il n existe pas de traitement standard pour ces patients dont la qualité de vie est souvent affectée par la présence d ascite ou l apparition de syndrome subocclusif ou occlusif. La chirurgie seule peut pallier cette symptomatologie, mais n est jamais curative. Il en va de même de la chimiothérapie systémique seule qui peut améliorer la survie (médiane de 7-24 mois), mais n offre aucune solution curative à long terme. L exérèse chirurgicale d une carcinose ne peut, par principe, être considérée comme complète, en raison de résidus tumoraux microscopiques (résection de type R1). C est pour traiter cette maladie résiduelle que, dans les années 80, P. Sugarbaker aux Etats Unis et F. Gilly à Lyon ont proposé une thérapeutique originale associant une chirurgie de cytoréduction à une chimiohyperthermie intrapéritonéale (CHIP). b) Principes a. Cytoréduction Pour être efficace, la chimio-hyperthermie intrapéritonéale peropératoire doit être précédée d une chirurgie de réduction tumorale maximale car la diffusion tissulaire des molécules de chimiothérapie ne dépasse pas 2,5 mm de profondeur. Le principe est de réséquer ou d électrocoaguler tous les implants tumoraux supramillimétriques. Cette cytoréduction peut conduire à des résections étendues du péritoine pariétal et à des résections multiples d organes intra-abdominaux. La limite principale de cette approche est le risque de complications postopératoires liées à l agressivité du geste lui-même et le risque de séquelles ultérieures découlant directement de l étendue des résections intestinales (stomies, grêle court, ). b. Hyperthermie L hyperthermie est connue pour avoir un effet cytotoxique. Une température de 42 à 45 maintenue pendant 10 à 60 minutes entraîne une mort cellulaire par destruction membranaire et dénaturation protéique. Par ailleurs, il a été montré que l hyperthermie potentialise l effet de certains agents cytotoxiques, soit en augmentant leur pénétration dans les tissus tumoraux, soit en augmentant leur cytotoxicité. c. Chimiothérapie En raison de l existence d un gradient péritonéo-plasmatique, l avantage d une instillation intrapéritonéale directe est de pouvoir soumettre les tissus tumoraux à des concentrations de drogues plus importantes que par voie systémique. Pour les CP d origine colorectale, la chimiothérapie la plus utilisée est la Mitomycine C. Actuellement, sur base des bons résultats par voie systémique, l Oxaliplatine est de plus en plus utilisée et fait l objet d essais cliniques de CHIP notamment en France et en Belgique (Belgian multicenter prospective phase II clinical study: Evaluation of the treatment of peritoneal carcinomatosis of colorectal origin through complete resection and HIPEC with Oxaliplatin). 28
29 Chimio-hyperthermie intra-péritonéale ou chip pour carcinose péritonéale en chirurgie colorectale Plus récemment, l Irinotecan (CPT-11) a également été utilisé. En ce qui concerne les pseudomyxomes, la molécule la plus utilisée est la Mitomycine C. Pour les mésothéliomes on utilise souvent une combinaison de Cisplatine et Doxorubicine, de l Oxaliplatine ou de l Irinotecan. d. Hyperpression Deux techniques principales de CHIP ont été décrites: celle à «ventre ouvert» ou technique du «Colisée» et celle à «ventre fermé». La technique à ventre ouvert permet de maintenir une bonne homogénéisation de l hyperthermie et des cytotoxiques au sein de l abdomen, mais pose comme problème l exposition du personnel soignant. Par rapport à la technique ouverte, la technique à ventre fermé (Photo 1) permet de bénéficier de la pression intraabdominale induite pour améliorer la pénétration tissulaire des molécules de chimiothérapie. En outre, la technique à ventre fermé assure une plus grande sécurité pour le personnel soignant quelle que soit la molécule utilisée. Figure 1 Peritoneal Cancer Index (PCI): index permettant la quantification de la carcinose péritonéale de 0 à 3 pour chacune des 13 zones abdominales. c) Technique a. Cytoréduction Avant d entreprendre la cytoréduction, une exploration minutieuse et systématisée de la cavité abdominale selon des critères standardisés permet d établir l étendue de la CP. Un index de mesure, le PCI (Peritoneal Cancer Index) a été mis au point par Sugarbaker. Cet index quantifie la CP de 0 à 3 pour 13 zones abdominales définies avec un maximum de 39 points (Figure 1). La cytoréduction n est entreprise que pour les patients dont le PCI est inférieur à 25. Par ailleurs, un envahissement des organes rétropéritonéaux comme la veine cave ou l aorte doit faire renoncer à la cytoréduction et à la CHIP. Si l indication de la cytoréduction avec CHIP est retenue, seul le péritoine macroscopiquement tumoral est réséqué ou détruit par électrocoagulation. En revanche, le péritoine macroscopiquement normal est préservé et va être traité par la CHIP. Le grand épiploon est réséqué systématiquement même s il semble normal, en raison de la fréquence de son atteinte microscopique. Les zones de carcinose péritonéale (CP) qui infiltrent en profondeur un organe digestif creux requièrent l exérèse partielle ou totale de ce viscère. Les zones de CP superficielles, en particulier celle du mésentère grêle et de la séreuse intestinale, peuvent être détruites par électrocoagulation très fugace. Les métastases hépatiques font l objet d une exérèse réglée dans le même temps opératoire. L exérèse de la vésicule biliaire, qu elle soit atteinte ou non, est quasi systématique pour éviter une cholé- Figure 2 Principe général du fonctionnement de la chimio-hyperthermie intrapéritonéale (CHIP). 29
30 Chimio-hyperthermie intra-péritonéale ou chip pour carcinose péritonéale en chirurgie colorectale Photo 2 La circulation du liquide de chimiothérapie, le maintien de la température à 43 C, et le monitoring de la pression intraabdominal sont assurés par un appareil intégré, le Cavitherm (EFS, France). cystite post-chip. La splénectomie n est pratiquée qu en fonction de son atteinte néoplasique. Les organes pelviens (utérus, annexes, rectum ) atteints sont réséqués en bloc avec le péritoine. La cytoréduction nécessite une stratégie de résection dans un ordre précis de manière à ce qu aucune lésion n échappe au traitement. b. CHIP Le traitement se fait en circuit fermé stérile pour éviter toute contamination septique (Figure 2). Des drains tubulaires placés dans les différents quadrants abdominaux permettent d instiller et de recueillir le liquide chauffé contenant les molécules de chimiothérapie à débit constant de 500ml/ min. Des capteurs thermiques sont aussi disposés dans l abdomen pour monitorer la température intrapéritonéale réelle qui doit idéalement se situer entre 42 et 43 C. Le débit, la pression et la température sont contrôlés grâce à un système intégré, le Cavitherm (Photo 2). La quantité de liquide utilisée est adaptée à la surface corporelle des patients: 2 l/m2 en perfusion continue. d) Indications L indication originelle de ce type de traitement est le pseudomyxome péritonéal. Secondairement, les indications ont été étendues à la carcinose d origine colorectale et appendiculaire ainsi que le mésothéliome péritonéal. La CHIP est en cours d évaluation pour les cancers de l ovaire, les cancers gastriques et des carcinoses rares (endocrines, etc.) e) implémentation aux Cliniques universitaires Saint-Luc L implémentation de la procédure CHIP à Saint-Luc est le fruit d une très longue préparation qui a débuté en janvier 2006 avec de multiples réunions, exposés, séminaires, visites et formations dans différents centres (Amsterdam, Lyon-Sud et Paris). C est aussi le résultat d un véritable travail intermétier avec l implication de trente-deux personnes appartenant à une vingtaine de métiers différents. (Tableau 1) Dans notre unité de chirurgie colorectale, nous avons opté pour la chimio-hyperthermie intrapéritonéale à ventre fermé notamment en raison de l avantage potentiel conféré par l hyperpression intraabdominale et en raison de la sécurité de la procédure pour les soignants. L originalité de la CHIP dans notre centre est d associer l Oxaliplatine à la technique à ventre fermé. f) Résultats Plusieurs études prospectives et rétrospectives ont souligné l intérêt de l association d une chirurgie de cytoréduction optimale avec une chimiothérapie intrapéritonéale périopératoire dans le traitement des CP colorectales en rapportant des médianes de survie nettement supérieure à la survie spontanée, atteignant 32 à 38 mois dans les séries les plus récentes. Une survie à 2 ans de 64% et à 5 ans de 54% a été observée au sein d études où la chirurgie de cytoréduction complète était de 85 à 100%. Une étude randomisée de phase III a comparé l association chirurgie de cytoréduction et CHIP à la Mitomycine C au traitement standard (chirurgie palliative + chimiothérapie systémique palliative) pour le traitement de la CP colorectale. L étude a été arrêtée après 2 ans d inclusion du fait d un bénéfice significatif en terme de survie (médiane de survie de 22,4 vs 12,6 mois) en faveur de l association chirurgie de cytoréduction et CHIP. La conception de cette étude ne permettait pas de déterminer si ce bénéfice était lié à la 30
31 Chimio-hyperthermie intra-péritonéale ou chip pour carcinose péritonéale en chirurgie colorectale Tableau 1: Interdisciplinarité de la CHIP Anatomopathologie: Ch. Sempoux, A. Jouret Anesthésie: F. Lois, P. Forget,Y. Kremer Assistante sociale: C. Detrogh Chirurgie colorectale: A. Kartheuser, C. Remue, D. Léonard, R. Detry Chirurgie hépatobiliopancréatique: JF. Gigot, C. Hubert Clinique des Pathologies Tumorales du Colon et du Rectum (CPTCR): F. Maddelena Consultation: S. Van der Does Gastroentérologie: I. Borbath Infirmière hospitalisation: V. Agnoli Infirmières salle d opération: Cl. Mahieux, I. Duyck, D. Patris, L. Talbi, V. Vankaekenbergh Infirmier soins intensifs: G. Tirone Kinésithérapie: B. Fosseprez Nutrition: B. Bertand Oncologie médicale: Y. Humblet, M. Mano Perfusionniste: D. Thiry Pharmacie: B. Sneyers, G. Leclercq, D. Wouters Planification des séjours hospitaliers: S. De Cuyper Réanimateur: X. Wittebole Stomathérapie: B. Crispin, V. Decroës Technicien salle d opération: O. Vanderhaegen résection des lésions ou à la CHIP ou encore à la combinaison des deux traitements. Elle rapporte toutefois un bénéfice indiscutable de l association chirurgie de cytoréduction et CHIP par rapport à une prise en charge palliative (chimiothérapie de type leucovorine-5-fu, chimiothérapie de référence du cancer colorectal métastatique au moment de l élaboration de l étude). Une large étude multicentrique et rétrospective portant sur 506 patients atteints de CP colorectale tous traités par l association d une chirurgie de cytoréduction et d une chimiothérapie intrapéritonéale périopératoire (CHIP, CIPPI ou leur association) rapporte pour des patients traités par chirurgie de cytoréduction complète une survie de 32 mois, qui rejoint les résultats obtenus par la chirurgie dans le traitement des métastases hépatiques. Cette étude a permis sur une large population d identifier plusieurs facteurs pronostiques permettant de mieux sélectionner ce type de procédure. En analyse multivariée plusieurs facteurs pronostiques indépendants de meilleure survie ont été identifiés: la cytoréduction complète des lésions, l extension limitée de la carcinose, l âge inférieur à 65 ans, la possibilité de réintervenir pour une seconde cytoréduction, la réalisation d une chimiothérapie systémique adjuvante. Plusieurs de ces facteurs pronostiques ont été retrouvés dans d autres études prospectives. Il n y a cependant aucune étude à ce jour comparant la cytoréduction complète des lésions de carcinose suivie, soit d une chimiothérapie systémique soit d une chimiothérapie intrapéritonéale per ou postopératoire immédiate. L association d une chirurgie de cytoréduction et d une chimiothérapie intrapéritonéale périopératoire est une procédure thérapeutique lourde et complexe. Elle expose le patient à un risque de mortalité et de morbidité postopératoire élevé (respective- 31
32 Chimio-hyperthermie intra-péritonéale ou chip pour carcinose péritonéale en chirurgie colorectale ment de 0 à 18% et de 16 à 65%). Ces taux sont en nette régression avec l expérience croissante des équipes spécialisées dans la prise en charge des CP. Au sein d études ayant inclus plus de 200 patients et ayant spécifiquement analysé la toxicité des procédures, les taux de mortalité n excèdent pas 3% et les taux de morbidité 24%. Ce type de traitement ne peut donc s adresser qu à des patients soigneusement sélectionnés pour une prise en charge dans les centres experts dans le traitement des carcinoses péritonéales. En ce qui concerne les pseudomyxomes et mésothéliomes péritonéaux, les résultats sont difficiles à interpréter, car la prise en charge thérapeutique n a pas toujours été uniforme. Les principaux facteurs pronostiques du pseudomyxome péritonéal sont le grade histologique, la qualité de la chirurgie de cytoréduction, et l importance du passé chirurgical abdominal. En cas de chirurgie de cytoréduction complète avec chimiohyperthermie intrapéritonéale pour les pseudomyxomes de grade histologique 1 (adénomucinose péritonéale), la survie à 5 ans est supérieure à 80% et de 30% pour les cas de grade 2-3. La mortalité de la cytoréduction complète avec CHIP est comprise entre 3 et 8%. La morbidité postopératoire est de 33% si on ne prend en compte que les complications nécessitant un traitement invasif spécifique. Le mésothéliome péritonéal n a pas le même pronostic que le pseudomyxome, mais l association d une chirurgie de cytoréduction à une CHIP permet d obtenir des médianes de survie supérieures à 100 mois et 63% de survie à 5 ans. L une de ses particularités est son meilleur pronostic chez la femme. g) Développements futurs a. «Second look» pour cancer colorectal à risque Le pronostic de la CP est amélioré par la CHIP après cytoréduction complète mais pourrait être encore meilleur si cette thérapeutique pouvait intervenir plus précocement dans la maladie. Elias et al. ont rapporté qu une ré-exploration chirurgicale de principe 1 an après l intervention initiale, chez des patients à risque de développer une CP d origine colorectale (occlusion, perforation, etc.), permettait la découverte et le traitement précoce d une CP dans 55% des cas. b. Traitement palliatif de l ascite La CHIP est également un traitement adéquat pour la palliation des ascites malignes. L ascite est l une des principales causes d hospitalisation durant les six derniers mois d évolution de la maladie. Le pronostic d un patient avec une ascite réfractaire est sombre. Le traitement à ce stade est palliatif avec pour but de préserver la qualité de vie et de faire régresser ou contrôler l ascite. Dans une série récente de 19 cas, Sugarbaker a rapporté que la CHIP seule par voie laparoscopique peut définitivement résoudre le problème d ascite récidivante dans la majorité des cas (17/19). A l avenir, la CHIP prendra peut-être une place de plus en plus importante dans le traitement de confort de ces patients en fin de vie. h) Conclusions La CHIP, associée à une chirurgie de cytoréduction optimale, permet aujourd hui de bouleverser la prise en charge et le pronostic de patients atteints d une évolution métastatique péjorative qui les condamnait autrefois à très court terme. Les progrès de la technique, des données pharmacocinétiques et de la sélection des indications permettent une amélioration croissante des résultats. Il s agit toutefois d une procédure lourde ne pouvant être mise en place qu au sein de centres spécialisés du fait des spécificités de prise en charge pré, per et postopératoire. Il faut aujourd hui avoir impérativement le réflexe de penser à une telle indication 32
33 Chimio-hyperthermie intra-péritonéale ou chip pour carcinose péritonéale en chirurgie colorectale pour des patients présentant une carcinose péritonéale primitive (mésothéliomes, carcinome séreux primitif de péritoine) ou secondaire (colorectale, pseudomyxome péritonéal). La CHIP est devenue un standard thérapeutique pour des patients sélectionnés. Références Deraco M., Peritonectomy and intraperitoneal hyperthermic perfusion (IPHP): a strategy that has confirmed its efficacy in patients with pseudomyxoma peritonei. Ann Surg Oncol 2004; 11: Elias D., Malignant Peritoneal Mesothelioma: Treatment with maximal cytoreductive surgery plus intraperitoneal chemotherapy. Gastroentérol Clin Biol Elias D., Results of systematic second-look surgery in patients at high risk of developing colorectal peritoneal carcinomatosis. Ann Surg Mar;247(3): Glehen O., Gilly FN., Cytoreductive surgery combined with perioperative intraperitoneal chemotherapy for the management of peritoneal carcinomatosis from colorectal cancer: a multi-institutional study. J. Clin Oncol 2004; 22: Glehen O., Intraperitoneal chemohyperthermia using a closed abdominal procedure and cytoreductive surgery for the treatment of peritoneal carcinomatosis: morbidity and mortality analysis of 216 consecutive procedures.ann Surg Oncol Oct;10(8): Sugarbaker PH., Results of tratment of 385 patients with peritoneal surface spread of appendiceal malignancy. Ann Surg Oncol 1999; 6: Verwaal VJ., Zoetmulder FA., Randomized trial of cytoreduction and hyperthermic intraperitoneal chemotherpy versus systemic chemotherapy and palliative surgery in patients with peritoneal carcinomatosis of colorectal cancer. J. Clin Oncol 2003; 21: Verwaal VJ., Zoetmulder FA. Predicting the survival of patients with peritoneal carcinomatosis of colorectal origin treated by aggressive cytoreduction and hyperthermic intraperitoneal chemotherapy. Br J Surg Jun;91(6): Now Reimbursed TM BESP-K0002 9/07
34 Le diagnostic du cancer colorectal héréditaire Le diagnostic du cancer colorectal héréditaire Prof. C. Sempoux et K. Dahan Centre du Cancer, Clinique des Pathologies Tumorales du Côlon et du Rectum Service d Anatomie pathologique et Centre de Génétique Humaine, Cliniques universitaires Saint-Luc. [email protected] Recherche du syndrome de Lynch au Centre du Cancer des Cliniques universitaires Saint-Luc Dès l identification de l anomalie génétique responsable du syndrome de Lynch, celle-ci a été recherchée systématiquement chez tous les patients opérés d un cancer colorectal aux cliniques universitaires Saint-Luc. De plus, la recherche est aussi effectuée sur du matériel biopsique prélevé en endoscopie s il existe une suspicion clinique et sur du matériel rétrospectif si le fils ou la fille d un ou d une patiente ou son médecin en fait la demande. Le principe est d analyser d abord le tissu tumoral en combinant la recherche par PCR d une éventuelle instabilité des microsatellites d une part et l expression immunohistochimique des enzymes de réparation de l ADN d autre part. Nous détectons aussi l expression de la protéine p53 qui dans les cancers avec instabilité des microsatellites présente un pattern d expression particulier que nous avons observé et décrit récemment. L analyse par PCR peut se faire soit sur du matériel congelé, soit sur du matériel fixé au formol et enrobé en paraffine. Le pathologiste prépare alors des lames qui seront macrodisséquées par le généticien pour en extraire l ADN. Dans un deuxième temps, en cas d identification d une instabilité des microsatellites, le gène indiqué par l analyse immunohistochimique fait l objet d un séquençage complet pour rechercher la mutation causale qui permettra ensuite le dépistage et le conseil génétique pour toute la famille en consultation. Pour toute information : Professeur Karin Dahan, Centre de Génétique Humaine (02/ ; Professeur Christine Sempoux, Service d Anatomie Pathologique (02/ ). Introduction Une histoire familiale peut être mise en évidence chez environ 30 % des patients nouvellement diagnostiqués pour un cancer colorectal (CCR), mais en définitive chez moins de 5 % d entre eux le cancer sera démontré comme étant lié à une catégorie définie de CCR héréditaire causée par une mutation germinale dans un gène spécifique. La forme la plus fréquente de CCR héréditaire est le syndrome de Lynch. Plus rares sont les syndromes de polypose adénomateuse familiale et les syndromes d adénomes multiples ainsi que les divers syndromes de polyposes hamartomateuses. Le diagnostic de ces formes héréditaires de CCR implique une série de spécificités dans la prise en charge du patient et de sa famille et, par conséquent, ce diagnostic doit être fiable. Des caractéristiques cliniques et histopathologiques peuvent fournir des indices sur la nature héréditaire du processus néoplasique, mais celle-ci doit ensuite être affirmée par la mise en évidence de l anomalie génétique spécifique. De plus, en raison de la nature germinale des mutations dans ces syndromes, diverses manifestations extracoliques peuvent être le premier signe de la maladie et leur connaissance peut grandement améliorer la qualité des soins. Syndrome de Lynch La forme la plus courante de CCR héréditaire est le syndrome de Lynch également connu sous le nom de syndrome de cancer colorectal héréditaire sans polypose ou HNPCC mais ce terme est amené à être abandonné, car il ne souligne pas suffisamment la complexité de la présentation clinique, l existence de multiples polypes du côlon et la présence d une anomalie génétique spécifique. Ce syndrome se caractérise par le développement de tumeurs principalement situées au niveau du colon droit, souvent mucineuses, à cellules en bague à chaton ou peu différenciées dites «médullaires» ou encore infiltrées de lymphocytes. Les patients atteints de syndrome de Lynch peuvent aussi présenter des tumeurs malignes en dehors du colon comme des carcinomes de l intestin grêle, des tumeurs cutanées et chez les femmes des adénocarcinomes de l endomètre. Le pathologiste peut être le premier à soupçonner la nature héréditaire du cancer du côlon, par sa localisation droite et son aspect histologique particulier ou en reconnaissant l association avec des tumeurs extracoliques. Le syndrome de Lynch, de transmission autosomique dominante, résulte d une mutation germinale dans un des gènes de réparation des mésappariements de l ADN (gènes MMR). Les mutations dans les gènes MLH1 et MSH2 rendent compte de plus de 90 % des cas de syndrome de Lynch, tandis que 5 à 10 % supplémentaires sont liés aux gènes MSH6 et plus rarement PMS2. 34
35 Le diagnostic du cancer colorectal héréditaire Ces mutations peuvent conduire à une inactivation du système de réparation de l ADN à chaque réplication cellulaire et au développement de tumeurs caractérisées par des niveaux élevés d instabilité des courtes séquences répétitives de l ADN appelées microsatellites. Les cancers sont dits MSI-H (microsatellite instability-high) et peuvent adopter de multiples localisations en association avec le syndrome. Le statut d instabilité élevée des microsatellites (MSI-H) détecté par PCR au niveau de la tumeur (Figure 1) est un excellent marqueur du syndrome de Lynch. A cette analyse moléculaire est couplée une étude immunohistochimique de l expression des protéines codées par les gènes du MMR. La perte d expression immunohistochimique, témoin de l inactivation tumorale d un des gènes MMR, est un test fiable pour autant que des règles strictes soient respectées : utilisation des anticorps anti-hmlh1, hmsh2, hmsh6 et PMS2, évaluation de l expression au niveau des noyaux des cellules tumorales et vérification de l existence d une positivité du contrôle interne (Figure 2). Cette analyse dirige le généticien dans sa recherche du gène muté dont l identification fournira en fin de compte la base pour le dépistage génétique. Les mutations qui sous-tendent le syndrome de Lynch sont multiples et variées. Alors que la plupart d entre elles entraînent la perte totale de l expression de la protéine, certains types de mutations se traduiront par une perte de fonction de la protéine qui sera encore exprimée et détectable par immunohistochimie (environ 10% des cas). C est la raison pour laquelle l immunohistochimie constitue un bon test de dépistage général du syndrome de Lynch mais qu en cas de suspicion clinique, il est indispensable de réaliser une recherche d instabilité des microsatellites. Ni les caractéristiques morphologiques décrites ci-dessus ni le statut MSI-H ne permettent de faire la différence entre les CCR attribués à un syndrome de Lynch et certains CCR sporadiques liés à l inactivation acquise et non héréditaire du gène MLH1. Dans ce dernier cas il y a aussi une perte d expression de hmlh1 et par conséquent, l immunohistochimie ne peut pas non plus à elle seule faire la Tableau 1: Critères révisés de Bethesda Quand rechercher une instabilité des microsatellites? 1. en cas de CCR diagnostiqué chez un patient de moins de 50 ans 2. en cas de développement d un CCR synchrone ou métachrone ou d autres cancers associés au syndrome de Lynch (endomètre, estomac, ovaires, pancréas, rein et uretère, voies biliaires, intestin grêle, cerveau, et adénomes des glandes sébacées et kératoacanthomes), indépendamment de l âge 3. en cas de CCR avec histologie typique de MSI-H (tumeur avec infiltration de lymphocytes ou réaction lymphocytaire de type Crohn, tumeur mucineuse ou à cellules en bague à chaton ou médullaire) diagnostiqué chez un patient de moins de 60 ans 4. en cas de CCR diagnostiqué chez un ou plusieurs apparentés au premier degré avec un des cancers diagnostiqué avant l âge de 50 ans 5. en cas de CCR diagnostiqué chez deux ou plusieurs apparentés au premier ou au second degré quel que soit leur âge discrimination entre CCR sporadique et syndrome de Lynch. Toutefois, dans la majorité des CCR sporadiques avec MSI-H, il existe une mutation caractéristique du gène BRAF (V600E) que le généticien recherche pour faire le diagnostic différentiel. Les critères cliniques et pathologiques pour l identification des patients à risque de syndrome de Lynch (guidelines révisés de Bethesda) sont repris dans le tableau 1. Les personnes suspectées de syndrome de Lynch ou identifiées comme atteintes doivent faire l objet d une coloscopie de dépistage tous les 1 à 2 ans à partir de l âge de ans ou à partir de 10 ans avant le plus jeune cas de cancer du côlon dans la famille. Les détails pratiques pour la recherche de syndrome de Lynch aux Cliniques universitaires Saint-Luc sont repris dans l encart. Polypose adénomateuse familiale La polypose adénomateuse familiale (PAF) est caractérisée par la présence de plusieurs centaines de polypes adénomateux colorectaux. En général, moins de 1 % de tous les nouveaux CCR diagnostiqués rentrent dans le cadre de la PAF, soit une incidence estimée Figure 1 Electrophérogrammes représentatifs de la migration des produits d amplification PCR correspondant aux 6 séquences cibles étudiées ou microsatellites (BAT25, BAT26, D3S1497, TP53, AC10 et D2S123). N indique l amplification de l ADN extrait du tissu colique sain et CRC, l ADN tumoral. L instabilité ou MSI s observe pour les 6 séquences étudiées dans chaque piste correspondant à l ADN tumoral. A B C Figure 2 Adénocarcinome peu différencié du colon droit (A) exprimant normalement la protéine hmsh2 en immunohistochimie (B) mais ne montrant pas d expression de la protéine hmlh1 dans le noyau des cellules tumorales alors que le contrôle interne représenté par des cellules inflammatoires et fibroblastiques est bien positif (C). 35
36 Le diagnostic du cancer colorectal héréditaire Figure 3A Aspect macroscopique caractéristique d une polypose adénomateuse familiale. Figure 3B Représentation schématique d un arbre généalogique: les carrés illustrent les hommes, les ronds les femmes, la couleur noire le statut clinique de polypose adénomateuse familiale. Le génotype correspondant à la mutation germinale du gène APC, dont les électrophérogrammes accompagnent la généalogie, est représenté par le sigle - : l allèle normale du gène APC étant associé au caractère +. à 1/ naissances. L âge moyen du premier adénome est de 16 ans dans sa forme classique pour un âge moyen de 39 ans de CCR chez les patients non traités. La maladie se transmet sur un mode autosomique dominant et est causée par une mutation germinale dans le gène APC. Dans les cas classiques, la muqueuse du côlon est tapissée par des centaines de polypes, pour la plupart sessiles uniformément distribués sur tout le gros intestin (Figure 3A). Microscopiquement, ce sont des adénomes tubulaires identiques à leurs homologues sporadiques. Dans l intestin grêle, les polypes se développent de préférence dans la région péri-ampullaire du duodénum et les adénocarcinomes du duodénum sont la principale cause de décès chez les patients qui ont subi une colectomie prophylactique. Dans l estomac, les polypes glandulo-kystiques fundiques se développent dans près de 90 % des adultes porteurs de PAF. Dès 1993, un registre a été développé pour la PAF en Belgique (cfr encart FAPA). Des cas de CCR familiaux avec moins de 100 polypes ont été décrits par Lynch en Chez ces sujets, le CCR apparaît environ 15 ans plus tard que dans la PAF classique. Les polypes de l estomac et du duodénum sont fréquents. Les recherches initiales avaient montré que certains de ces patients étaient porteurs de mutations dans le premier ou le dernier tiers du gène APC et le terme «polypose familiale atténuée» ou «polypose colorectale atténuée» a été proposé par comparaison avec les patients présentant des mutations dans la région centrale du gène APC qui développent un plus grand nombre de polypes. Toutefois, il a été montré qu un certain nombre de ces patients ainsi que certains cas de PAF sans mutation classique du gène APC présentaient une mutation germinale dans le gène MYH et qu il s agissait d une affection héréditaire récessive. Il est important de signaler qu environ 30 % des mutations du gène APC surviennent de novo (sans histoire familiale connue), résultant d une mutation acquise lors de la gamétogenèse chez l un des parents. Cette caractéristique moléculaire et l existence de deux modes de transmission rendent impossible toute évaluation du risque de PAF chez les apparentés directs en absence de tests génétiques. L accessibilité des gènes APC et MYH à l analyse moléculaire a ainsi modifié la prise en charge des patients FAP en améliorant leur diagnostic (Figure 3B), en influençant le geste chirurgical et en augmentant de façon significative la survie chez les sujets jeunes et porteurs asymptomatiques d une altération génétique. Syndromes de polyposes hamartomateuses Les syndromes de polyposes hamartomateuses comprennent principalement le syndrome de Peutz-Jeghers et le syndrome de la polypose juvénile. Ces syndromes sont caractérisés par le développement de polypes hamartomateux et par un risque accru de cancers gastrointestinaux et extradigestifs. Dans le syndrome de Peutz-Jeghers, on observe une pigmentation cutanéo-muqueuse et des hamartomes dans tout le tube digestif, de l estomac à l anus. Il se transmet sur un mode autosomique dominant sans prédilection de sexe avec une incidence de 1: Un polype typique est un hamartome développé aux dépens de la musculaire muqueuse. Les polypes surviennent principalement dans l intestin grêle, le plus souvent en groupes. Les mutations germinales responsables sont retrouvées dans le gène STK11/LKB1 dans environ la moitié des familles touchées. La polypose juvénile est héritée sur un mode autosomique dominant au moins dans 30 % des patients et l incidence est de 1 : Les patients développent de nombreux poly- 36
37 Le diagnostic du cancer colorectal héréditaire pes hamartomateux colorectaux qui se caractérisent par une importante dilatation des cryptes glandulaires. Le nombre de polypes est plus faible que dans les PAF. Les polypes peuvent aussi survenir dans l intestin grêle et l estomac. Une dysplasie adénomateuse peut se développer dans un polype juvénile et il y a un risque accru de malignité, en particulier de CCR à un jeune âge et aussi un risque accru de cancers pancréatiques, gastriques et duodénaux. Le diagnostic de syndrome de polypose juvénile est posé lorsque 3 à 10 polypes juvéniles typiques sont retrouvés dans le tube digestif. En revanche, les polypes juvéniles sporadiques chez les enfants ne sont pas associés au développement de tumeurs malignes et leur diagnostic est un diagnostic d exclusion reposant sur une évaluation clinique qui doit exclure un syndrome de polypose. Enfin, il existe un syndrome dit de polypose héréditaire mixte caractérisé par des polypes du côlon de divers types histologiques, bien que la lésion caractéristique soit un polype juvénile atypique et un syndrome dit de polypose adénomateuse festonnée caractérisé par la présence d un grand nombre d adénomes sessiles festonnés sans polypes juvéniles. Conclusions Identifier les individus à risque élevé de CCR est un nouvel aspect de la pratique médicale visant à personnaliser la prise en charge et le suivi des familles touchées par un syndrome de prédisposition héréditaire au cancer. Combiner les critères cliniques et les données histopathologiques permet de diagnostiquer ou tout au moins de suspecter une origine héréditaire. Le diagnostic définitif repose sur la détection par le généticien de la mutation germinale spécifique qui servira de base au dépistage dans la famille. Références 1) Burt RW. Colon cancer screening. Gastroenterology. 2000;119(3): ) de la Chapelle A. Genetic predisposition to colorectal cancer. Nat Rev Cancer. 2004; 4(10): ) Jass JR. Classification of colorectal cancer based on correlation of clinical, morphological and molecular features. Histopathology. 2007; 50(1): FAPA et le futur registre du syndrome de Lynch La F.A.P.A. (Familial Adenomatous Polyposis Association) est une A.S.B.L. qui a été créée le 25 mai 1993 à l initiative de trois médecins de l UCL, le Dr Jean-Pierre Coppens du Service de Gastroentérologie, le Dr Christine Verellen-Dumoulin du Centre de Génétique Humaine et le Dr Alex Kartheuser du Service de Chirurgie de l Appareil Digestif. Les membres fondateurs, issus des 7 centres universitaires du pays, représentent toutes les disciplines médicales directement concernées par la polypose adénomateuse familiale (PAF). Le Président actuel de la FAPA est le Professeur Eric Van Cutsem (KUL, Leuven) et le Professeur Alex Kartheuser en est le Secrétaire Général. L A.S.B.L. a été créée spécifiquement pour permettre de dépister tous les patients porteurs de PAF et de les informer ainsi que leurs familles sur les risques, les possibilités de dépistage et les traitements à leur disposition. L association gère le registre national belge de la PAF. Ce registre permet d aider les cliniciens, les épidémiologistes et les scientifiques à travailler pour mieux comprendre l affection, pour mieux prévenir et pour mieux traiter les patients porteurs de polypose et leurs familles. Une revue récente du registre permettait de comptabiliser 238 patients enregistrés, dont 217 ont subi une colectomie prophylactique, seul traitement capable de mettre les patients à l abri d un inéluctable cancer colorectal. Sur les 20 dernières années, le type de procédure prophylactique a évolué de l anastomose iléorectale (AIR 39%, AIA 58% de 1986 à 1996) vers l anastomose iléoanale (AIR 18%, AIA 74% de 1996 à 2006). Très prochainement, la FAPA va élargir son champ d intérêt puisqu un second registre destiné à colliger les informations de patients atteints de syndrome de Lynch (cancer colorectal héréditaire non polyposique ou HNPCC) va voir le jour. FAPA, A.S.B.L. Mme E. Claes, coordinatrice : Tél. : [email protected] 37
38 news Le Docteur Christophe Remue a rejoint définitivement l Unité de Chirurgie Colorectale, Service de Chirurgie et Transplantation Abdominale, le 1 er octobre Ses principaux centres d intérêt sont la Laparoscopie, le Fast-Track et la Chimio-Hyperthermie Intra-Péritonéale (CHIP). news Le Docteur Anne Jouret-Mourin a rejoint l équipe des anatomo-pathologistes des Cliniques universitaires Saint-Luc depuis octobre 2007 comme chef de clinique. Elle est orientée en pathologie digestive et prend une part active en cancérologie, notamment en pathologie colorectale, dans le cadre de la Clinique des Pathologies Tumorales du Colon et du Rectum présentée dans cette newsletter. news Dès 1985, Sylvie Ahn a, comme assistante du Prof. M. Rousseau, joué un rôle essentiel dans le développement de la recherche cardiologique clinique, particulièrement au niveau international (Adm. Study Coord. for the NHLBI, Bethesda, USA), ainsi que dans la gestion de l Unité de Cathétérisme Cardiaque, contribuant de plus, comme co-fondatrice, à la création du Belgian Working Group on Interventional Cardiology. Ce 1 er mai 2008 elle a rejoint le Centre du Cancer avec pour but de développer, valoriser et coordonner la recherche clinique au sein de toutes les équipes impliquées dans le domaine du cancer. Elle s attachera également à faire connaître au niveau belge et international le potentiel clinique et scientifique du Centre du Cancer. news news Licencié en Sciences psychologiques et fort d une expérience en soins palliatifs, Guillaume Gascard a été engagé en décembre 2007 pour venir renforcer l équipe de psychologues du Centre du Cancer. Les patients peuvent être rencontrés en consultation extra-hospitalière mais également dans l unité de soin d oncologie, l hôpital de jour et le service de radiothérapie. Comme le reste de l équipe, G. Gascard est aussi intégré à l unité de psychiatrie de liaison afin de favoriser la collaboration Psychologues/ Psychiatres. Contact: (Secretariat de la Psychiatrie de liaison): (02/764.) Infirmier gradué spécialisé en Soins Palliatifs, Frédéric Maddaléna a exercé sa profession pendant 9 ans en oncologie. Il occupe depuis le mois d octobre 2007 le poste de Coordinateur de Soins/ Coordinateur en Recherche clinique pour la Clinique des Pathologies Tumorales du Colon et du Rectum, présentée dans ce numéro. news Le Docteur Daniel Léonard vient d être nommé Résident dans l Unité de Chirurgie Colorectale, Service de Chirurgie et Transplantation Abdominale. Il prendra ses fonctions le 1 er octobre 2009 après avoir passé une année de formation supplémentaire à l Hôpital St-Antoine à Paris. Son centre d intérêt principal est le cancer colorectal. 38
39 Because we care
40 Résumé des caractéristiques du produit. Dénomination du médicament: CAMPTO 20 mg/ml, solution à diluer pour perfusion. Composition qualitative et quantitative: la solution à diluer contient 20 mg/ml de chlorhydrate d irinotécan trihydraté (équivalent à 17,33 mg/ml d irinotécan). Les flacons de CAMPTO contiennent 40 mg, 100 mg ou 300 mg de chlorhydrate d'irinotécan trihydraté. Forme pharmaceutique: solution à diluer pour perfusion. Indications thérapeutiques: CAMPTO est indiqué dans le traitement des patients avec cancer colorectal avancé: en association avec le 5-fluorouracile et l'acide folinique chez les patients n'ayant pas reçu de chimiothérapie antérieure pour le stade avancé de leur maladie; en monothérapie après échec d'un traitement ayant comporté du 5-FU. CAMPTO en association avec le cétuximab est indiqué dans le traitement des patients présentant un cancer colorectal métastatique exprimant le récepteur du facteur de croissance épidermique (EGFR), après l échec d un traitement cytotoxique incluant l irinotécan. CAMPTO en association avec le 5-fluorouracile, l'acide folinique et le bévacizumab est indiqué en traitement de première ligne des patients atteints d'un carcinome métastatique du côlon ou du rectum. Posologie et mode d'administration: réservé à l'adulte. La solution pour perfusion CAMPTO doit être perfusée dans une veine périphérique ou centrale. Posologie recommandée: en monothérapie (chez les patients prétraités): la posologie recommandée de CAMPTO est de 350 mg/m 2 administrés en perfusion intraveineuse de 30 à 90 minutes toutes les 3 semaines. En association (chez les patients non prétraités): l'efficacité et la tolérance de CAMPTO en association avec le 5-fluorouracile (5-FU) et l'acide folinique (AF) ont été évaluées selon le schéma suivant: Campto et 5-FU/AF : schéma toutes les 2 semaines. La dose recommandée de CAMPTO est de 180 mg/m 2 en perfusion intraveineuse de 30 à 90 minutes toutes les 2 semaines, suivie d'une perfusion d'acide folinique et de 5 fluorouracile. Pour la posologie et le mode d administration concomitante du cétuximab, se référer au Résumé des Caractéristiques du Produit de ce médicament. La dose d irinotécan utilisée est généralement la même que celle administrée au cours des derniers cycles du régime précédent contenant del irinotécan. L irinotécan doit être administré au moins une heure après la fin de la perfusion du cétuximab. Concernant la posologie et le mode d'administration du bévacizumab, se référer au Résumé des Caractéristiques du Produit de ce médicament. Ajustements posologiques: CAMPTO doit être administré après récupération convenable de tous les événements indésirables, c'est-à-dire jusqu au grade 0 ou 1 selon les critères NCI-CTC (National Cancer Institute Common Toxicity Criteria) et après disparition complète d'une diarrhée liée au traitement. Avant chaque administration ultérieure du traitement, les doses de CAMPTO, et de 5-FU lorsque d application, devront être réduites en tenant compte des événements indésirables du plus haut grade observés au cours de l'administration précédente. Le traitement doit être retardé d'une ou deux semaines afin de permettre une récupération des événements indésirables liés au traitement. La posologie de CAMPTO et/ou de 5-FU lorsque d application, devra être réduite de 15 à 20% en cas de survenue des événements indésirables suivants: toxicité hématologique: neutropénie grade 4, neutropénie fébrile (neutropénie grade 3-4 et fièvre grade 2-4), thrombopénie et leucopénie (grade 4); toxicité non hématologique (grade 3-4). Les recommandations visant à modifier la dose du cétuximab lorsqu il est administré en association avec l irinotécan, doivent être suivies conformément au Résumé des Caractéristiques du Produit de ce médicament. Se référer au Résumé des Caractéristiques du Produit du bévacizumab pour les modifications de la dose du bévacizumab lorsqu'il est administré en association avec CAMPTO/5-FU/AF. Durée de traitement: le traitement par CAMPTO doit être poursuivi jusqu à progression objective de la maladie ou apparition d une toxicité inacceptable. Populations à risque: patients présentant une insuffisance hépatique: en monothérapie: le taux sanguin de bilirubine (jusqu à 3 fois la limite supérieure de la normale (LSN)) chez des patients ayant un indice de performance 2 déterminera la dose initiale de CAMPTO. Chez les patients ayant une hyperbilirubinémie et un temps de prothrombine supérieur à 50 %, la clairance de l irinotécan est diminuée et par conséquent le risque d hémotoxicité est accru. Aussi, une surveillance hebdomadaire de l hémogramme complet devra être réalisée pour ces patients. Chez les patients ayant un taux de bilirubine allant jusqu à 1,5 fois la limite supérieure de la normale (LSN), la dose recommandée de CAMPTO est de 350 mg/m 2. Chez les patients ayant un taux de bilirubine allant de 1,5 à 3 fois la LSN, la dose recommandée de CAMPTO est de 200 mg/m 2. Les patients ayant un taux de bilirubine supérieur à 3 fois la LSN ne doivent pas être traités avec CAMPTO. Chez les patients présentant une insuffisance hépatique traités par CAMPTO en association, aucune donnée n est disponible. Patients présentant une insuffisance rénale: aucune étude spécifique n'ayant été réalisée chez les insuffisants rénaux, CAMPTO n'est pas recommandé chez cette population. Sujets âgés: aucune étude pharmacocinétique spécifique n'a été réalisée chez le sujet âgé. Toutefois, la dose doit être choisie avec prudence dans cette population en raison de la fréquence plus importante d'altération des fonctions biologiques. Cette population demande une surveillance plus étroite. Contre-indications: maladie inflammatoire chronique de l'intestin et/ou occlusion intestinale. Antécédents d'hypersensibilité sévère au chlorhydrate d'irinotécan trihydraté ou à l'un des excipients de CAMPTO. Grossesse et allaitement. Bilirubinémie supérieure à 3 fois la limite supérieure de la normale. Insuffisance médullaire sévère. Indice de performance de grade OMS > 2. Administration concomitante de millepertuis. Pour les contre-indications additionnelles du cétuximab ou du bévacizumab, se référer au Résumé des Caractéristiques du Produit de ces médicaments. Effets indésirables: les effets indésirables détaillés dans cette rubrique se rapportent à l irinotécan. Il n existe aucun élément permettant de suggérer une influence du cétuximab sur le profil de tolérance de l irinotécan ou vice versa. En association avec le cétuximab, les effets indésirables additionnels rapportés sont ceux attendus pour le cétuximab (tels que 88 % d éruptions acnéiformes). En conséquence, se référer également au Résumé des Caractéristiques du Produit du cétuximab. Pour obtenir des informations relatives aux effets indésirables en association avec le bévacizumab, se référer au Résumé des Caractéristiques du Produit du bévacizumab. Les effets indésirables suivants possiblement ou probablement liés à l'administration de CAMPTO ont été rapportés sur une population de 765 patients à la dose recommandée de 350 mg/m 2 en monothérapie, et de 145 patients traités par CAMPTO en association avec 5-FU/AF toutes les 2 semaines à la dose recommandée de 180 mg/m 2. Affections gastro-intestinales: diarrhée tardive: la diarrhée (survenant plus de 24 heures après l'administration de CAMPTO) constitue une toxicité dose-limitante de CAMPTO. En monothérapie: une diarrhée sévère est observée chez 20 % des patients qui ont suivi les recommandations de prise en charge de la diarrhée. Une diarrhée sévère est retrouvée dans 14 % des cycles évaluables. Le délai médian d'apparition de la première selle liquide est de 5 jours après la perfusion de CAMPTO. En association: une diarrhée sévère est observée chez 13,1 % des patients qui ont suivi les recommandations de prise en charge de la diarrhée. Une diarrhée sévère est retrouvée dans 3,9 % des cycles évaluables. Des cas peu fréquents de colite pseudomembraneuse ont été rapportés dont un cas avec une documentation bactériologique (Clostridium difficile). Nausées et vomissements: en monothérapie: des nausées et vomissements sévères sont observés chez environ 10 % des patients ayant reçu un traitement antiémétique. En association: une incidence moindre des nausées et vomissements sévères a été observée (respectivement 2,1 % et 2,8 % des patients). Déshydratation: des épisodes de déshydratation, généralement associés à une diarrhée et/ou des vomissements, ont été rapportés. Des cas peu fréquents d insuffisance rénale, d hypotension ou de collapsus cardio-vasculaire ont été rapportés chez des patients ayant eu des périodes de déshydratation associées à une diarrhée et/ou des vomissements. Autres affections gastro-intestinales: une constipation relative à CAMPTO et/ ou au lopéramide a été observée: en monothérapie: chez moins de 10 % des patients ; en association: chez 3,4 % des patients. Des cas peu fréquents d'occlusion intestinale, d'iléus ou d hémorragie gastro-intestinale et de rares cas de colites, parmi lesquels des typhlites, des colites ischémiques et ulcéreuses, ont été rapportés. De rares cas de perforations STANDARD OF CARE IN FIRST-LINE METASTATIC COLORECTAL CANCER* intestinales ont été rapportés. D'autres effets peu sévères incluant anorexie, douleurs abdominales et mucosite ont été également observés. De rares cas de pancréatite symptomatique ou asymptomatique ont été observés lors d'un traitement par irinotécan. Affections hématologiques: la neutropénie constitue une toxicité dose-limitante. La neutropénie était réversible et non cumulative ; le délai médian d'apparition du nadir était de 8 jours que ce soit en monothérapie ou en association. En monothérapie: la neutropénie a été observée chez 78,7 % des patients et était sévère (nombre de neutrophiles < 500/mm 3 ) dans 22,6 % des cas. Parmi les cycles évaluables, 18 % avaient un nombre de neutrophiles < 1000/mm 3 dont 7,6 % avec un nombre de neutrophiles < 500/mm 3. La récupération totale était en général atteinte le 22ème jour. Une fièvre accompagnée d'une neutropénie sévère a été rapportée chez 6,2 % des patients et dans 1,7 % des cycles. Des épisodes infectieux sont survenus chez environ 10,3 % des patients (2,5 % des cycles) et ont été associés à une neutropénie sévère chez environ 5,3 % des patients (1,1 % des cycles), et ont entraîné 2 décès. Une anémie a été rapportée chez environ 58,7 % des patients (8 % avec une hémoglobine < 8 g/dl et 0,9 % avec une hémoglobine < 6,5 g/dl). Une thrombocytopénie (< /mm 3 ) a été observée chez 7,4 % des patients et 1,8 % des cycles dont 0,9 % des patients avec des plaquettes /mm 3 et 0,2 % des cycles. Presque tous les patients avaient normalisé leur numération plaquettaire le 22ème jour. En association: une neutropénie a été observée chez 82,5 % des patients et était sévère (nombre de neutrophiles < 500/mm 3 ) dans 9,8 % des cas. Parmi les cycles évaluables, 67,3 % avaient un nombre de neutrophiles < 1000/mm 3 dont 2,7 % avec un nombre de neutrophiles < 500/mm 3. La récupération totale était en général atteinte dans les 7 à 8 jours. Une fièvre accompagnée d'une neutropénie sévère a été rapportée chez 3,4 % des patients et dans 0,9 % des cycles. Des épisodes infectieux sont survenus chez environ 2 % des patients (0,5 % des cycles) et ont été associés à une neutropénie sévère chez environ 2,1 % des patients (0,5 % des cycles), et ont entraîné 1 décès. Une anémie a été rapportée chez environ 97,2 % des patients (2,1 % avec une hémoglobine < 8 g/dl). Une thrombocytopénie (< /mm 3 ) a été observée chez 32,6 % des patients et 21,8 % des cycles. Aucune thrombocytopénie sévère (< mm 3 ) n'a été observée. Un cas de thrombocytopénie périphérique avec anticorps antiplaquettes est rapporté dans l'expérience clinique obtenue après la mise sur le marché. Infections et infestations: des cas peu fréquents d insuffisance rénale, d hypotension ou de collapsus cardio-vasculaire ont été observés chez des patients ayant présenté une septicémie. Troubles généraux et anomalies au site de perfusion: syndrome cholinergique aigu: un syndrome de type cholinergique aigu, transitoire et sévère a été observé chez 9 % des patients traités par monothérapie et chez 1,4 % des patients traités par association. Les principaux symptômes étaient définis par une diarrhée précoce et un ensemble d autres symptômes tels que douleurs abdominales, conjonctivite, rhinite, hypotension, vasodilatation, hypersudation, frissons, malaise, vertige, troubles visuels, myosis, larmoiements et hypersalivation survenant pendant ou dans les 24 heures suivant la perfusion de CAMPTO. Ces symptômes disparaissent à l administration d atropine. L'asthénie sévère était observée chez moins de 10 % des patients traités par monothérapie et chez 6,2 % des patients traités par association. L'imputabilité à CAMPTO n'est pas clairement établie. Une fièvre isolée non accompagnée d'infection ou de neutropénie sévère est survenue chez 12 % des patients traités par monothérapie et chez 6,2 % des patients traités par association. Des réactions modérées au site d injection sont peu fréquemment rapportées. Affections cardiaques: des rares cas d hypertension pendant ou après la perfusion ont été rapportés. Affections respiratoires: la maladie pulmonaire interstitielle qui se traduit par des infiltrats pulmonaires est peu fréquente lors du traitement sous irinotécan. Des effets précoces tels que dyspnée ont été rapportés. Affections de la peau et du tissu sous-cutané: l'alopécie est très fréquente et réversible. Des réactions cutanées modérées sont peu fréquemment rapportées. Affections du système immunitaire: des réactions allergiques modérées sont peu fréquemment rapportées. Des réactions anaphylactiques/anaphylactoïdes ont été rarement rapportées. Affections musculo-squelettiques: des effets précoces tels que contraction musculaire ou crampes et paresthésie ont été rapportés. Examens biologiques: en monothérapie, une augmentation transitoire mineure à modérée des taux sériques, soit des transaminases, soit des phosphatases alcalines, soit de la bilirubine a été observée respectivement chez 9,2 %, 8,1 % et 1,8 % des patients, en l'absence de progression des métastases hépatiques. Une augmentation transitoire mineure à modérée des taux sériques de créatinine est observée chez 7,3 % des patients. En association, une élévation sérique transitoire (grade 1 et 2) des ALAT, ASAT, des phosphatases alcalines ou de la bilirubine a été observée chez 15 %, 11 %, 11 % et 10 % des patients respectivement, en l'absence de progression des métastases hépatiques. Des grades 3 transitoires ont été observés chez 0 %, 0 %, 0 % et 1 % des patients respectivement. Aucun grade 4 n'a été observé. Des augmentations de l amylase et/ou de la lipase ont été très rarement rapportées. Des cas rares d hypokaliémie et d hyponatrémie principalement liées à la diarrhée et aux vomissements, ont été rapportés. Affections du système nerveux: de très rares cas de troubles transitoires du langage ont été rapportés dans des rapports post-marketing avec des perfusions d irinotécan. Titulaire de l autorisation de mise sur le marché: Pfizer S.A., Boulevard de la Plaine 17, 1050 Bruxelles. Numéros d autorisation de mise sur le marché: 40 mg/2 ml : 241 T7 F12 ; 100 mg/5 ml : 241 T8 F12; 300 mg/15 ml : 241 T9 F12. Statut légal de délivrance: sur prescription médicale. Date de mise à jour du texte: janvier Date d approbation: 02/2008. *Köhne CH. EJC Supplements 2004; 2(7): /2008
PLACE DE L IRM DANS LE BILAN D EXTENSION DU CANCER DU RECTUM. Professeur Paul LEGMANN Radiologie A - Cochin Paris
 PLACE DE L IRM DANS LE BILAN D EXTENSION DU CANCER DU RECTUM Professeur Paul LEGMANN Radiologie A - Cochin Paris Cancer du rectum France : 15000 décès/an : 1ère cause. Pronostic souvent réservé Métastases
PLACE DE L IRM DANS LE BILAN D EXTENSION DU CANCER DU RECTUM Professeur Paul LEGMANN Radiologie A - Cochin Paris Cancer du rectum France : 15000 décès/an : 1ère cause. Pronostic souvent réservé Métastases
Traitements néoadjuvants des cancers du rectum. Pr. G. Portier CHU Purpan - Toulouse
 Traitements néoadjuvants des cancers du rectum Pr. G. Portier CHU Purpan - Toulouse Journées Francophones d Hépato-gastroentérologie et d Oncologie Digestive 2010 CONFLITS D INTÉRÊT Pas de conflit d intérêt
Traitements néoadjuvants des cancers du rectum Pr. G. Portier CHU Purpan - Toulouse Journées Francophones d Hépato-gastroentérologie et d Oncologie Digestive 2010 CONFLITS D INTÉRÊT Pas de conflit d intérêt
IRM du Cancer du Rectum
 IRM du Cancer du Rectum quels CHOIX TECHNIQUES pour quels OBJECTIFS THERAPEUTIQUES? Frank Boudghène, T. Andre, A. Stivalet, I. Frey, L. Paslaru, V. Ganthier, M. Tassart Hopital Tenon - Université Paris
IRM du Cancer du Rectum quels CHOIX TECHNIQUES pour quels OBJECTIFS THERAPEUTIQUES? Frank Boudghène, T. Andre, A. Stivalet, I. Frey, L. Paslaru, V. Ganthier, M. Tassart Hopital Tenon - Université Paris
Chirurgie assistée par robot et laparoscopie en 3D à l avantage des patients?
 HigHligHts 2012: CHiRURgiE Chirurgie assistée par robot et laparoscopie en 3D à l avantage des patients? Lukasz Filip Grochola a, Hubert John b, Thomas Hess c, Stefan Breitenstein d a Clinique de chirurgie
HigHligHts 2012: CHiRURgiE Chirurgie assistée par robot et laparoscopie en 3D à l avantage des patients? Lukasz Filip Grochola a, Hubert John b, Thomas Hess c, Stefan Breitenstein d a Clinique de chirurgie
Qu est-ce qu un sarcome?
 Qu est-ce qu un sarcome? Qu est-ce qu une tumeur? Une tumeur est une prolifération anormale de cellules. Les tumeurs ne devraient donc pas automatiquement être associées à un cancer. Certaines tumeurs
Qu est-ce qu un sarcome? Qu est-ce qu une tumeur? Une tumeur est une prolifération anormale de cellules. Les tumeurs ne devraient donc pas automatiquement être associées à un cancer. Certaines tumeurs
Tumeurs rectales Bilan initial et Imagerie
 Tumeurs rectales Bilan initial et Imagerie Ou en est on plus de 10 ans après? Valérie LAURENT(1) François JAUSSET (1) Laurence CHONE(2) Laurent BRESLER(3) Adeline GERMAIN (3) Thibaut FOUQUET(3) Didier
Tumeurs rectales Bilan initial et Imagerie Ou en est on plus de 10 ans après? Valérie LAURENT(1) François JAUSSET (1) Laurence CHONE(2) Laurent BRESLER(3) Adeline GERMAIN (3) Thibaut FOUQUET(3) Didier
Apport de l IRM dans le bilan préthérapeutique du cancer du rectum
 Apport de l IRM dans le bilan préthérapeutique du cancer du rectum Y MORMECHE, S SEHILI, J MORMECHE, CH CHAMMEKHI, S KHELIFI, A BACCAR, MH DAGHFOUS, A CHERIF TUNIS - TUNISIE PLAN Introduction Matériel
Apport de l IRM dans le bilan préthérapeutique du cancer du rectum Y MORMECHE, S SEHILI, J MORMECHE, CH CHAMMEKHI, S KHELIFI, A BACCAR, MH DAGHFOUS, A CHERIF TUNIS - TUNISIE PLAN Introduction Matériel
Apport de l IRM dans la
 Apport de l IRM dans la caractérisation tissulaire préopératoire des tumeurs rectales Y MORMECHE, S SEHILI, J MORMECHE, CH CHAMMEKHI, S KHELIFI, A BACCAR, MH DAGHFOUS, A CHERIF TUNIS - TUNISIE PLAN Introduction
Apport de l IRM dans la caractérisation tissulaire préopératoire des tumeurs rectales Y MORMECHE, S SEHILI, J MORMECHE, CH CHAMMEKHI, S KHELIFI, A BACCAR, MH DAGHFOUS, A CHERIF TUNIS - TUNISIE PLAN Introduction
Recommandations régionales Prise en charge des carcinomes cutanés
 Recommandations régionales Prise en charge des carcinomes cutanés - décembre 2009 - CARCINOMES BASOCELLULAIRES La chirurgie : traitement de référence et de 1 ère intention Classification clinique et histologique
Recommandations régionales Prise en charge des carcinomes cutanés - décembre 2009 - CARCINOMES BASOCELLULAIRES La chirurgie : traitement de référence et de 1 ère intention Classification clinique et histologique
Essai Inter-groupe : FFCD UNICANCER FRENCH - GERCOR
 CLIMAT - PRODIGE 30 Etude de phase III randomisée évaluant l Intérêt de la colectomie première chez les patients porteurs d un cancer colique asymptomatique avec métastases hépatiques synchrones non résécables
CLIMAT - PRODIGE 30 Etude de phase III randomisée évaluant l Intérêt de la colectomie première chez les patients porteurs d un cancer colique asymptomatique avec métastases hépatiques synchrones non résécables
QUE SAVOIR SUR LA CHIRURGIE de FISTULE ANALE A LA CLINIQUE SAINT-PIERRE?
 QUE SAVOIR SUR LA CHIRURGIE de FISTULE ANALE A LA CLINIQUE SAINT-PIERRE? Vous allez être opéré(e) à la clinique Saint-pierre d une fistule anale par l équipe chirurgicale des docteurs Bardou, Ben brahem
QUE SAVOIR SUR LA CHIRURGIE de FISTULE ANALE A LA CLINIQUE SAINT-PIERRE? Vous allez être opéré(e) à la clinique Saint-pierre d une fistule anale par l équipe chirurgicale des docteurs Bardou, Ben brahem
Cancer du sein in situ
 traitements et soins octobre 2009 recommandations professionnelles Cancer du sein COLLECTION recommandations & référentiels Recommandations de prise en charge spécialisée Carcinome canalaire et carcinome
traitements et soins octobre 2009 recommandations professionnelles Cancer du sein COLLECTION recommandations & référentiels Recommandations de prise en charge spécialisée Carcinome canalaire et carcinome
Cancers de l hypopharynx
 Cancers de l hypopharynx A- GENERALITES 1) Epidémiologie Cancer fréquent et de pronostic grave du fait de son évolution insidieuse et de son caractère lymphophile. C est quasiment toujours un carcinome
Cancers de l hypopharynx A- GENERALITES 1) Epidémiologie Cancer fréquent et de pronostic grave du fait de son évolution insidieuse et de son caractère lymphophile. C est quasiment toujours un carcinome
INTERFERON Traitement adjuvant du mélanome à haut risque de récidive. Dr Ingrid KUPFER-BESSAGUET Dermatologue CH de quimper
 INTERFERON Traitement adjuvant du mélanome à haut risque de récidive Dr Ingrid KUPFER-BESSAGUET Dermatologue CH de quimper Pourquoi proposer un TTT adjuvant? Probabilité de survie à 10 ans en fonction
INTERFERON Traitement adjuvant du mélanome à haut risque de récidive Dr Ingrid KUPFER-BESSAGUET Dermatologue CH de quimper Pourquoi proposer un TTT adjuvant? Probabilité de survie à 10 ans en fonction
Informations sur le cancer de l intestin
 Informations sur le cancer de l intestin Le cancer de l intestin fait partie des affections malignes les plus fréquentes et représente la deuxième cause de mortalité par cancer en Suisse. Cette maladie
Informations sur le cancer de l intestin Le cancer de l intestin fait partie des affections malignes les plus fréquentes et représente la deuxième cause de mortalité par cancer en Suisse. Cette maladie
A l Assistance Publique - Hôpitaux de Marseille, Octobre Rose est l occasion de mettre en valeur la filière de soins dédiée au cancer du sein.
 OCTOBRE ROSE 2013 La campagne Octobre Rose a pour but d inciter les femmes de 50 à 74 ans à participer au dépistage organisé du cancer du sein. Une femme sur trois ne se fait pas dépister ou pas de manière
OCTOBRE ROSE 2013 La campagne Octobre Rose a pour but d inciter les femmes de 50 à 74 ans à participer au dépistage organisé du cancer du sein. Une femme sur trois ne se fait pas dépister ou pas de manière
DOSSIER DE PRÉSENTATION
 DOSSIER DE PRÉSENTATION GUSTAVE ROUSSY ET LE CANCER DU SEIN OCTOBRE 2013 Gustave Roussy et le cancer du sein octobre 2013 page 1 DOSSIER DE PRÉSENTATION Gustave Roussy et le cancer du sein GUSTAVE ROUSSY,
DOSSIER DE PRÉSENTATION GUSTAVE ROUSSY ET LE CANCER DU SEIN OCTOBRE 2013 Gustave Roussy et le cancer du sein octobre 2013 page 1 DOSSIER DE PRÉSENTATION Gustave Roussy et le cancer du sein GUSTAVE ROUSSY,
Incontinence anale du post-partum
 Incontinence anale du post-partum Laurent Abramowitz Unité de proctologie médico-chirurgicale de l hôpital Bichat, Paris Et cabinet libéral Prévalence Inc anale France (1) : 11% > 45 ans Damon et al (2):Pop
Incontinence anale du post-partum Laurent Abramowitz Unité de proctologie médico-chirurgicale de l hôpital Bichat, Paris Et cabinet libéral Prévalence Inc anale France (1) : 11% > 45 ans Damon et al (2):Pop
Découvrez L INSTITUT UNIVERSITAIRE DU CANCER DE TOULOUSE
 Découvrez L INSTITUT UNIVERSITAIRE DU CANCER DE TOULOUSE 2014 L INSTITUT UNIVERSITAIRE DU CANCER DE TOULOUSE L Institut universitaire du cancer de Toulouse (IUCT) est un nouveau modèle français d organisation
Découvrez L INSTITUT UNIVERSITAIRE DU CANCER DE TOULOUSE 2014 L INSTITUT UNIVERSITAIRE DU CANCER DE TOULOUSE L Institut universitaire du cancer de Toulouse (IUCT) est un nouveau modèle français d organisation
Recommandations 2005. Prise en charge des patients adultes atteints d un mélanome cutané MO
 Recommandations 2005 Prise en charge des patients adultes atteints d un mélanome cutané MO Recommandations pour la Pratique Clinique : Standards, Options et Recommandations 2005 pour la prise en charge
Recommandations 2005 Prise en charge des patients adultes atteints d un mélanome cutané MO Recommandations pour la Pratique Clinique : Standards, Options et Recommandations 2005 pour la prise en charge
Le dépistage du cancer de la prostate. une décision qui VOUS appartient!
 Le dépistage du cancer de la prostate une décision qui VOUS appartient! Il existe un test de dépistage du cancer de la prostate depuis plusieurs années. Ce test, appelé dosage de l antigène prostatique
Le dépistage du cancer de la prostate une décision qui VOUS appartient! Il existe un test de dépistage du cancer de la prostate depuis plusieurs années. Ce test, appelé dosage de l antigène prostatique
Les traitements du cancer invasif du col de l utérus
 JUIN 2011 Les traitements du cancer invasif du col de l utérus Nom du chapitre COLLECTION GUIDES PATIENTS LE COL DE L UTÉRUS LE CHOIX DES TRAITEMENTS LA CHIRURGIE LA RADIOTHÉRAPIE LA CHIMIOTHÉRAPIE LES
JUIN 2011 Les traitements du cancer invasif du col de l utérus Nom du chapitre COLLECTION GUIDES PATIENTS LE COL DE L UTÉRUS LE CHOIX DES TRAITEMENTS LA CHIRURGIE LA RADIOTHÉRAPIE LA CHIMIOTHÉRAPIE LES
Actualités s cancérologiques : pneumologie
 Actualités s cancérologiques : pneumologie PLAN Incidence / facteurs de risque Anatomie Symptômes Types de tumeurs Diagnostic / extension Classification Traitement Pronostic Pneumologie : incidence Belgique
Actualités s cancérologiques : pneumologie PLAN Incidence / facteurs de risque Anatomie Symptômes Types de tumeurs Diagnostic / extension Classification Traitement Pronostic Pneumologie : incidence Belgique
Le traitement conservateur des tumeurs malignes des membres a largement remplacé les amputations
 FACE A FACE Péroné vascularisé / Péroné non vascularisé Reconstruction après résection tumorale Dr NOURI / Dr BEN MAITIGUE SOTCOT Juin 2012 Le traitement conservateur des tumeurs malignes des membres a
FACE A FACE Péroné vascularisé / Péroné non vascularisé Reconstruction après résection tumorale Dr NOURI / Dr BEN MAITIGUE SOTCOT Juin 2012 Le traitement conservateur des tumeurs malignes des membres a
TUMEURS DU BAS APPAREIL URINAIRE
 1 Plan de cours I - TUMEURS PRIMITIVES DE LA VESSIE c1 - Tumeurs papillaires non infiltrantes c2 - Tumeurs papillaires infiltrantes c3 - Carcinome in-situ en muqueuse plane D - Pronostic : II - TUMEURS
1 Plan de cours I - TUMEURS PRIMITIVES DE LA VESSIE c1 - Tumeurs papillaires non infiltrantes c2 - Tumeurs papillaires infiltrantes c3 - Carcinome in-situ en muqueuse plane D - Pronostic : II - TUMEURS
INFORMATION & PRÉVENTION. Le cancer de la vessie
 INFORMATION & PRÉVENTION Le cancer de la vessie G R A N D P U B L I C Ce à quoi sert la vessie La vessie est une poche qui reçoit l urine produite par les reins, via les uretères*. Elle est constituée
INFORMATION & PRÉVENTION Le cancer de la vessie G R A N D P U B L I C Ce à quoi sert la vessie La vessie est une poche qui reçoit l urine produite par les reins, via les uretères*. Elle est constituée
LA RADIOTHÉRAPIE DANS LE CANCER DU RECTUM : quand, comment et pourquoi?
 LA RADIOTHÉRAPIE DANS LE CANCER DU RECTUM : quand, comment et pourquoi? P. Martinive (1), D. Vandaele (2), E. Lennerts (3), M. Polus (2), C. Coimbra (4), L. Kohnen (4), J. Vanderick (1), J. Collignon (5),
LA RADIOTHÉRAPIE DANS LE CANCER DU RECTUM : quand, comment et pourquoi? P. Martinive (1), D. Vandaele (2), E. Lennerts (3), M. Polus (2), C. Coimbra (4), L. Kohnen (4), J. Vanderick (1), J. Collignon (5),
Les renseignements suivants sont destinés uniquement aux personnes qui ont reçu un diagnostic de cancer
 Information importante pour les personnes atteintes d un cancer du poumon non à petites cellules de stade avancé Les renseignements suivants sont destinés uniquement aux personnes qui ont reçu un diagnostic
Information importante pour les personnes atteintes d un cancer du poumon non à petites cellules de stade avancé Les renseignements suivants sont destinés uniquement aux personnes qui ont reçu un diagnostic
Dépistage du cancer colorectal :
 Dépistage du cancer colorectal : Quels enjeux? Robert Benamouzig Gastro-entérologie Hôpital Avicenne Bobigny Le cancer colorectal dans le monde 3ème cause de cancer Augmentation 1975 : 500 000 cas 1990
Dépistage du cancer colorectal : Quels enjeux? Robert Benamouzig Gastro-entérologie Hôpital Avicenne Bobigny Le cancer colorectal dans le monde 3ème cause de cancer Augmentation 1975 : 500 000 cas 1990
L ATROPHIE DU SPHINCTER ANAL EXTERNE en ENDOSONOGRAPHIE TRIDIMENSIONNELLE. Vincent de PARADES PARIS
 L ATROPHIE DU SPHINCTER ANAL EXTERNE en ENDOSONOGRAPHIE TRIDIMENSIONNELLE Vincent de PARADES PARIS INTRODUCTION L incontinence anale du post-partum partum relève de deux mécanismes : la déchirure de l
L ATROPHIE DU SPHINCTER ANAL EXTERNE en ENDOSONOGRAPHIE TRIDIMENSIONNELLE Vincent de PARADES PARIS INTRODUCTION L incontinence anale du post-partum partum relève de deux mécanismes : la déchirure de l
Revue de la littérature
 Résultats à long terme des anévrysmes traités Revue de la littérature Cours de DES de neurochirurgie Inter-région Rhône-Alpes / Auvergne Vendredi 22/04/11 Méthode (1): sélection bibliographique en fonction
Résultats à long terme des anévrysmes traités Revue de la littérature Cours de DES de neurochirurgie Inter-région Rhône-Alpes / Auvergne Vendredi 22/04/11 Méthode (1): sélection bibliographique en fonction
INFORMATION À DESTINATION DES PROFESSIONNELS DE SANTÉ LE DON DU VIVANT
 INFORMATION À DESTINATION DES PROFESSIONNELS DE SANTÉ LE DON DU VIVANT QUELS RÉSULTATS POUR LE RECEVEUR? QUELS RISQUES POUR LE DONNEUR? DONNER UN REIN DE SON VIVANT PEUT CONCERNER CHACUN /////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////
INFORMATION À DESTINATION DES PROFESSIONNELS DE SANTÉ LE DON DU VIVANT QUELS RÉSULTATS POUR LE RECEVEUR? QUELS RISQUES POUR LE DONNEUR? DONNER UN REIN DE SON VIVANT PEUT CONCERNER CHACUN /////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////////
Transplantation hépatique à donneur vivant apparenté. Olivier Scatton, Olivier Soubrane, Service de chirurgie Cochin
 Transplantation hépatique à donneur vivant apparenté Olivier Scatton, Olivier Soubrane, Service de chirurgie Cochin Introduction Le prélèvement d une partie du foie chez une personne «vivante» et apparentée
Transplantation hépatique à donneur vivant apparenté Olivier Scatton, Olivier Soubrane, Service de chirurgie Cochin Introduction Le prélèvement d une partie du foie chez une personne «vivante» et apparentée
APPORT DE L'IRM DANS LE BILAN D'EXTENSION LOCOREGIONALE DES TUMEURS RECTALE
 ROYAUME DU MAROC UNIVERSITE SIDI MOHAMMED BENABDELLAH FACULTE DE MEDECINE ET DE PHARMACIE FES UNIVERSITESIDI MOHAMMED BEN ABDELLAH FES APPORT DE L'IRM DANS LE BILAN D'EXTENSION LOCOREGIONALE DES TUMEURS
ROYAUME DU MAROC UNIVERSITE SIDI MOHAMMED BENABDELLAH FACULTE DE MEDECINE ET DE PHARMACIE FES UNIVERSITESIDI MOHAMMED BEN ABDELLAH FES APPORT DE L'IRM DANS LE BILAN D'EXTENSION LOCOREGIONALE DES TUMEURS
Sujets présentés par le Professeur Olivier CUSSENOT
 ANAMACaP Association Nationale des Malades du Cancer de la Prostate 17, bis Avenue Poincaré. 57400 SARREBOURG Sujets présentés par le Professeur Olivier CUSSENOT Place des nouvelles techniques d imagerie
ANAMACaP Association Nationale des Malades du Cancer de la Prostate 17, bis Avenue Poincaré. 57400 SARREBOURG Sujets présentés par le Professeur Olivier CUSSENOT Place des nouvelles techniques d imagerie
De la chirurgie du nodule aux ganglions
 De la chirurgie du nodule aux ganglions Docteur Xavier CARRAT Institut Bergonié Clinique Saint Augustin Chirurgie des lésions bénignes de la thyroïde problématique opératoire «simple» avec indication portée
De la chirurgie du nodule aux ganglions Docteur Xavier CARRAT Institut Bergonié Clinique Saint Augustin Chirurgie des lésions bénignes de la thyroïde problématique opératoire «simple» avec indication portée
G U I D E - A F F E C T I O N D E L O N G U E D U R É E. La prise en charge de votre mélanome cutané
 G U I D E - A F F E C T I O N D E L O N G U E D U R É E La prise en charge de votre mélanome cutané Mars 2010 Pourquoi ce guide? Votre médecin traitant vous a remis ce guide pour vous informer sur le mélanome
G U I D E - A F F E C T I O N D E L O N G U E D U R É E La prise en charge de votre mélanome cutané Mars 2010 Pourquoi ce guide? Votre médecin traitant vous a remis ce guide pour vous informer sur le mélanome
Traitement des plaies par pression négative (TPN) : des utilisations spécifiques et limitées
 BON USAGE DES TECHNOLOGIES DE SANTÉ Traitement des plaies par pression négative (TPN) : des utilisations spécifiques et limitées Les systèmes de traitement des plaies par pression négative (TPN) sont des
BON USAGE DES TECHNOLOGIES DE SANTÉ Traitement des plaies par pression négative (TPN) : des utilisations spécifiques et limitées Les systèmes de traitement des plaies par pression négative (TPN) sont des
Cette intervention aura donc été décidée par votre chirurgien pour une indication bien précise.
 Qu est-ce qu une arthroscopie? Il s agit d une intervention chirurgicale mini-invasive dont le but est d explorer l articulation du genou et de traiter la lésion observée dans le même temps. Comment se
Qu est-ce qu une arthroscopie? Il s agit d une intervention chirurgicale mini-invasive dont le but est d explorer l articulation du genou et de traiter la lésion observée dans le même temps. Comment se
LA CHOLÉCYSTECTOMIE PAR LAPAROSCOPIE
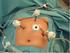 LA CHOLÉCYSTECTOMIE PAR LAPAROSCOPIE Une technique chirurgicale Pour vous, pour la vie Qu est-ce que la cholécystectomie? C est l intervention chirurgicale pratiquée pour enlever la vésicule biliaire.
LA CHOLÉCYSTECTOMIE PAR LAPAROSCOPIE Une technique chirurgicale Pour vous, pour la vie Qu est-ce que la cholécystectomie? C est l intervention chirurgicale pratiquée pour enlever la vésicule biliaire.
Peut-on ne pas reprendre des marges «insuffisantes» en cas de Carcinome canalaire infiltrant
 Peut-on ne pas reprendre des marges «insuffisantes» en cas de Carcinome canalaire infiltrant Institut Cancérologie de l Ouest CHIRURGIE Dr. Isabelle Jaffré CAS CLINIQUE 1 36 ans 90B sans CI radiothérapie
Peut-on ne pas reprendre des marges «insuffisantes» en cas de Carcinome canalaire infiltrant Institut Cancérologie de l Ouest CHIRURGIE Dr. Isabelle Jaffré CAS CLINIQUE 1 36 ans 90B sans CI radiothérapie
Ordonnance du DFI sur les prestations dans l assurance obligatoire des soins en cas de maladie
 Ordonnance du DFI sur les prestations dans l assurance obligatoire des soins en cas de maladie (Ordonnance sur les prestations de l assurance des soins, OPAS) Modification du 14 juin 2010 Le Département
Ordonnance du DFI sur les prestations dans l assurance obligatoire des soins en cas de maladie (Ordonnance sur les prestations de l assurance des soins, OPAS) Modification du 14 juin 2010 Le Département
Maladie de Hodgkin ou lymphome de Hodgkin
 Maladie de Hodgkin ou lymphome de Hodgkin Ce que vous devez savoir Le cancer : une lutte à finir 1 888 939-3333 www.cancer.ca MALADIE DE HODGKIN Ce que vous devez savoir Même si vous entendez parler du
Maladie de Hodgkin ou lymphome de Hodgkin Ce que vous devez savoir Le cancer : une lutte à finir 1 888 939-3333 www.cancer.ca MALADIE DE HODGKIN Ce que vous devez savoir Même si vous entendez parler du
Validation clinique des marqueurs prédictifs le point de vue du méthodologiste. Michel Cucherat UMR CNRS 5558 - Lyon
 Validation clinique des marqueurs prédictifs le point de vue du méthodologiste Michel Cucherat UMR CNRS 5558 - Lyon Marqueur prédictif - Définition Un marqueur prédictif est un marqueur qui prédit le bénéfice
Validation clinique des marqueurs prédictifs le point de vue du méthodologiste Michel Cucherat UMR CNRS 5558 - Lyon Marqueur prédictif - Définition Un marqueur prédictif est un marqueur qui prédit le bénéfice
Prise en charge des déchirures périnéales obstétricales sévères. Courjon M, Ramanah R, Eckman A, Toubin C, Riethmuller D.
 Prise en charge des déchirures périnéales obstétricales sévères Courjon M, Ramanah R, Eckman A, Toubin C, Riethmuller D. Introduction Incidence : 0,5 à 3 % Importance de la reconnaissance et d un traitement
Prise en charge des déchirures périnéales obstétricales sévères Courjon M, Ramanah R, Eckman A, Toubin C, Riethmuller D. Introduction Incidence : 0,5 à 3 % Importance de la reconnaissance et d un traitement
Votre guide des définitions des maladies graves de l Assurance maladies graves express
 Votre guide des définitions des maladies graves de l Assurance maladies graves express Votre guide des définitions des maladies graves de l Assurance maladies graves express Ce guide des définitions des
Votre guide des définitions des maladies graves de l Assurance maladies graves express Votre guide des définitions des maladies graves de l Assurance maladies graves express Ce guide des définitions des
Incontinence urinaire : trop souvent taboue
 Incontinence urinaire : trop souvent taboue Tous concernés! De quoi s agit-il? C est une perte accidentelle ou involontaire des urines, qu il s agisse de quelques gouttes à une fuite plus conséquente :
Incontinence urinaire : trop souvent taboue Tous concernés! De quoi s agit-il? C est une perte accidentelle ou involontaire des urines, qu il s agisse de quelques gouttes à une fuite plus conséquente :
Les sciences de l ingénieur appliquées à la prise en charge du
 Les sciences de l ingénieur appliquées à la prise en charge du cancer : enjeux et opportunités Début de cartographie des enjeux cliniques et technologiques gq Jean-François MENUDET, Cluster I-Care Cartographie
Les sciences de l ingénieur appliquées à la prise en charge du cancer : enjeux et opportunités Début de cartographie des enjeux cliniques et technologiques gq Jean-François MENUDET, Cluster I-Care Cartographie
Cancers du larynx : diagnostic, principes de traitement (145a) Professeur Emile REYT Novembre 2003 (Mise à jour Mars 2005)
 Cancers du larynx : diagnostic, principes de traitement (145a) Professeur Emile REYT Novembre 2003 (Mise à jour Mars 2005) Pré-Requis : Anatomie du larynx Physiologie de la phonation et de la déglutition
Cancers du larynx : diagnostic, principes de traitement (145a) Professeur Emile REYT Novembre 2003 (Mise à jour Mars 2005) Pré-Requis : Anatomie du larynx Physiologie de la phonation et de la déglutition
Prolapsus génital et incontinence urinaire chez la femme Professeur Pierre BERNARD Septembre 2002
 Prolapsus génital et incontinence urinaire chez la femme Professeur Pierre BERNARD Septembre 2002 Pré-Requis : Connaissance de bases : Anatomie du pelvis Classification des troubles de la statique génitale
Prolapsus génital et incontinence urinaire chez la femme Professeur Pierre BERNARD Septembre 2002 Pré-Requis : Connaissance de bases : Anatomie du pelvis Classification des troubles de la statique génitale
Artéfact en queue de comète à l échographie hépatique: un signe de maladie des voies biliaires intra-hépatiques
 Artéfact en queue de comète à l échographie hépatique: un signe de maladie des voies biliaires intra-hépatiques T Smayra, L Menassa-Moussa, S Slaba, M Ghossain, N Aoun Hôtel-Dieu de France, Université
Artéfact en queue de comète à l échographie hépatique: un signe de maladie des voies biliaires intra-hépatiques T Smayra, L Menassa-Moussa, S Slaba, M Ghossain, N Aoun Hôtel-Dieu de France, Université
LIGNES DIRECTRICES CLINIQUES TOUT AU LONG DU CONTINUUM DE SOINS : Objectif de ce chapitre. 6.1 Introduction 86
 LIGNES DIRECTRICES CLINIQUES TOUT AU LONG DU CONTINUUM DE SOINS : ÉTABLISSEMENT DE LIENS ENTRE LES PERSONNES CHEZ QUI UN DIAGNOSTIC D INFECTION À VIH A ÉTÉ POSÉ ET LES SERVICES DE SOINS ET DE TRAITEMENT
LIGNES DIRECTRICES CLINIQUES TOUT AU LONG DU CONTINUUM DE SOINS : ÉTABLISSEMENT DE LIENS ENTRE LES PERSONNES CHEZ QUI UN DIAGNOSTIC D INFECTION À VIH A ÉTÉ POSÉ ET LES SERVICES DE SOINS ET DE TRAITEMENT
Charte régionale des Réunions de Concertation Pluridisciplinaire de PACA, Corse et Monaco
 Réseau Régional de Cancérologie ONCOPACA-Corse Charte régionale des Réunions de Concertation Pluridisciplinaire de PACA, Corse et Monaco 1. CONTEXTE ET OBJECTIF Contexte : Cette présente charte a été définie
Réseau Régional de Cancérologie ONCOPACA-Corse Charte régionale des Réunions de Concertation Pluridisciplinaire de PACA, Corse et Monaco 1. CONTEXTE ET OBJECTIF Contexte : Cette présente charte a été définie
Principales causes de décès selon le groupe d âge. 0 24 25 44 45 64 65 84 85 et plus
 Module 2 Exercice 1: Cellules souches hématopoïétiques 1. Causes de décès en Suisse (2010) La figure suivante montre les causes de décès les plus fréquentes en Suisse en 2010, telles qu elles ont été relevées
Module 2 Exercice 1: Cellules souches hématopoïétiques 1. Causes de décès en Suisse (2010) La figure suivante montre les causes de décès les plus fréquentes en Suisse en 2010, telles qu elles ont été relevées
Leucémies de l enfant et de l adolescent
 Janvier 2014 Fiche tumeur Prise en charge des adolescents et jeunes adultes Leucémies de l enfant et de l adolescent GENERALITES COMMENT DIAGNOSTIQUE-T-ON UNE LEUCEMIE AIGUË? COMMENT TRAITE-T-ON UNE LEUCEMIE
Janvier 2014 Fiche tumeur Prise en charge des adolescents et jeunes adultes Leucémies de l enfant et de l adolescent GENERALITES COMMENT DIAGNOSTIQUE-T-ON UNE LEUCEMIE AIGUË? COMMENT TRAITE-T-ON UNE LEUCEMIE
Hospices cantonaux Centre Hospitalier Universitaire Vaudois DOSSIER DE PRESSE. Création du Centre romand hospitalo-universitaire de neurochirurgie
 Hospices cantonaux Centre Hospitalier Universitaire Vaudois DOSSIER DE PRESSE Création du Centre romand hospitalo-universitaire de neurochirurgie 1. Le Centre romand hospitalo-universitaire de neurochirurgie
Hospices cantonaux Centre Hospitalier Universitaire Vaudois DOSSIER DE PRESSE Création du Centre romand hospitalo-universitaire de neurochirurgie 1. Le Centre romand hospitalo-universitaire de neurochirurgie
Prise en charge des dysplasies et carcinomes in situ de la surface oculaire au CHT de Nouvelle-Calédonie
 Prise en charge des dysplasies et carcinomes in situ de la surface oculaire au CHT de Nouvelle-Calédonie Congrès de la SFO Mai 2011 M. Le Loir (Brest), E. Mancel (Nouméa), L.W. Hirst (Brisbane) Dysplasie
Prise en charge des dysplasies et carcinomes in situ de la surface oculaire au CHT de Nouvelle-Calédonie Congrès de la SFO Mai 2011 M. Le Loir (Brest), E. Mancel (Nouméa), L.W. Hirst (Brisbane) Dysplasie
Mise au point sur l IRM l troubles de la statique pelvienne chez la femme
 Mise au point sur l IRM l et les troubles de la statique pelvienne chez la femme V.FAUTH P.MESTDAGH M.COSSON J.P.LUCOT E.PONCELET Service d imagerie d médicalem Hôpital Jeanne de Flandres - CHRU Lille
Mise au point sur l IRM l et les troubles de la statique pelvienne chez la femme V.FAUTH P.MESTDAGH M.COSSON J.P.LUCOT E.PONCELET Service d imagerie d médicalem Hôpital Jeanne de Flandres - CHRU Lille
UNE INTERVENTION CHIRURGICALE AU NIVEAU DU SEIN
 UNE INTERVENTION CHIRURGICALE AU NIVEAU DU SEIN Informations générales Pour vous, pour la vie Cette brochure vise à vous fournir des informations générales concernant l intervention chirurgicale que vous
UNE INTERVENTION CHIRURGICALE AU NIVEAU DU SEIN Informations générales Pour vous, pour la vie Cette brochure vise à vous fournir des informations générales concernant l intervention chirurgicale que vous
Pierre OLIVIER - Médecine Nucléaire
 Diplôme Universitaire Corrélations anatomo-physio-pathologiques en imagerie thoracique 25 mai 2011 Imagerie TEP et pathologie tumorale bronchique Pierre OLIVIER - Médecine Nucléaire Détection en coincidence
Diplôme Universitaire Corrélations anatomo-physio-pathologiques en imagerie thoracique 25 mai 2011 Imagerie TEP et pathologie tumorale bronchique Pierre OLIVIER - Médecine Nucléaire Détection en coincidence
GUIDE - AFFECTION LONGUE DURÉE. Tumeur maligne, affection maligne du tissu lymphatique ou hématopoïétique. Cancer colorectal
 GUIDE - AFFECTION LONGUE DURÉE Tumeur maligne, affection maligne du tissu lymphatique ou hématopoïétique Cancer colorectal Février 2008 Ce document s inscrit dans un double dispositif : La mise en œuvre
GUIDE - AFFECTION LONGUE DURÉE Tumeur maligne, affection maligne du tissu lymphatique ou hématopoïétique Cancer colorectal Février 2008 Ce document s inscrit dans un double dispositif : La mise en œuvre
F-FLUORODÉOXYGLUCOSE EN ONCOLOGIE Expérience en Ile de France
 18F-fluorodéoxyglucose en oncologie. Expérience en Ile de France. 18 F-FLUORODÉOXYGLUCOSE EN ONCOLOGIE Expérience en Ile de France H. FOEHRENBACH 1, J. LUMBROSO 2 1 Service Médecine Nucléaire, Hôpital
18F-fluorodéoxyglucose en oncologie. Expérience en Ile de France. 18 F-FLUORODÉOXYGLUCOSE EN ONCOLOGIE Expérience en Ile de France H. FOEHRENBACH 1, J. LUMBROSO 2 1 Service Médecine Nucléaire, Hôpital
À PROPOS DU. cancer colorectal. Les choix de traitement du cancer colorectal : guide du patient
 À PROPOS DU cancer colorectal Les choix de traitement du cancer colorectal : guide du patient Table des matières Qu est-ce que le cancer colorectal?... 1 Les stades du cancer colorectal... 2 Quels sont
À PROPOS DU cancer colorectal Les choix de traitement du cancer colorectal : guide du patient Table des matières Qu est-ce que le cancer colorectal?... 1 Les stades du cancer colorectal... 2 Quels sont
Cancer du sein. Du CA15-3 à la tomographie à émission de positons.
 Cancer du sein. Du CA15-3 à la tomographie à émission de positons. Un taux de récidive de 30% dans les dix premières années chez des patientes en rémission complète après un traitement curatif, requiert
Cancer du sein. Du CA15-3 à la tomographie à émission de positons. Un taux de récidive de 30% dans les dix premières années chez des patientes en rémission complète après un traitement curatif, requiert
Faut-il encore modifier nos pratiques en 2013?
 Anti-agrégants, anticoagulants et Endoscopie digestive Faut-il encore modifier nos pratiques en 2013? Christian Boustière, Marseille ANGIOPAS Essai de phase II randomisé multicentrique évaluant l efficacité
Anti-agrégants, anticoagulants et Endoscopie digestive Faut-il encore modifier nos pratiques en 2013? Christian Boustière, Marseille ANGIOPAS Essai de phase II randomisé multicentrique évaluant l efficacité
Qu est-ce que le cancer du pancréas?
 Cancer du pancréas Qu est-ce que le cancer du pancréas? Laissez-nous vous expliquer. www.fondsanticancer.org www.esmo.org ESMO/FAC Patient Guide Series basés sur les recommandations de pratique clinique
Cancer du pancréas Qu est-ce que le cancer du pancréas? Laissez-nous vous expliquer. www.fondsanticancer.org www.esmo.org ESMO/FAC Patient Guide Series basés sur les recommandations de pratique clinique
CORRELATION RADIO-ANATOMIQUE DANS LE CARCINOME HEPATOCELLULAIRE TRAITE PAR TRANSPLANTATION HEPATIQUE : IMPACT SUR LA RECIDIVE
 CORRELATION RADIO-ANATOMIQUE DANS LE CARCINOME HEPATOCELLULAIRE TRAITE PAR TRANSPLANTATION HEPATIQUE : IMPACT SUR LA RECIDIVE L. Lecoq, J. Gendre, N. Sturm, C. Letoublon, MN. Hilleret, JP. Zarski, V. Leroy
CORRELATION RADIO-ANATOMIQUE DANS LE CARCINOME HEPATOCELLULAIRE TRAITE PAR TRANSPLANTATION HEPATIQUE : IMPACT SUR LA RECIDIVE L. Lecoq, J. Gendre, N. Sturm, C. Letoublon, MN. Hilleret, JP. Zarski, V. Leroy
PRISE EN CHARGE DES LESIONS SPINCTERIENNES ANALES DU POST-PARTUM : DU CURATIF AU PREVENTIF
 PRISE EN CHARGE DES LESIONS SPINCTERIENNES ANALES DU POST-PARTUM : DU CURATIF AU PREVENTIF Laurent ABRAMOWITZ Unité de proctologie médico-chirurgicale Hôpital Bichat Claude Bernard 95, Rue de Passy 75016
PRISE EN CHARGE DES LESIONS SPINCTERIENNES ANALES DU POST-PARTUM : DU CURATIF AU PREVENTIF Laurent ABRAMOWITZ Unité de proctologie médico-chirurgicale Hôpital Bichat Claude Bernard 95, Rue de Passy 75016
Qui et quand opérer. au cours du traitement de l EI?
 Qui et quand opérer au cours du traitement de l EI? Gilbert Habib Département de Cardiologie - Timone Marseille 7es JNI Bordeaux, 8 juin 2006 Université de la Méditerranée Faculté de Médecine de Marseille
Qui et quand opérer au cours du traitement de l EI? Gilbert Habib Département de Cardiologie - Timone Marseille 7es JNI Bordeaux, 8 juin 2006 Université de la Méditerranée Faculté de Médecine de Marseille
UE2 CANCEROLOGIE Place de la Médecine Nucléaire
 UE2 CANCEROLOGIE Place de la Médecine Nucléaire Imagerie Imagerie de Gamma Caméra Tomographie d émission monophotoniqueou TEMP: radiopharmaceutiqueémetteurs de rayonnement Gamma Imagerie de Caméra TEP
UE2 CANCEROLOGIE Place de la Médecine Nucléaire Imagerie Imagerie de Gamma Caméra Tomographie d émission monophotoniqueou TEMP: radiopharmaceutiqueémetteurs de rayonnement Gamma Imagerie de Caméra TEP
Greffe de moelle osseuse: Guérir ou se soigner?
 Greffe de moelle osseuse: Guérir ou se soigner? Malika Benkerrou Site de référence pédiatrique national sur la drépanocytose Hôpital Robert Debré, Paris 3èmes Journées de la Drépanocytose en Martinique
Greffe de moelle osseuse: Guérir ou se soigner? Malika Benkerrou Site de référence pédiatrique national sur la drépanocytose Hôpital Robert Debré, Paris 3èmes Journées de la Drépanocytose en Martinique
G U I D E P A T I E N T - A F F E C T I O N D E L O N G U E D U R É E. La prise en charge du cancer du foie
 G U I D E P A T I E N T - A F F E C T I O N D E L O N G U E D U R É E La prise en charge du cancer du foie Décembre 2010 Pourquoi ce guide? Votre médecin traitant vous a remis ce guide pour vous informer
G U I D E P A T I E N T - A F F E C T I O N D E L O N G U E D U R É E La prise en charge du cancer du foie Décembre 2010 Pourquoi ce guide? Votre médecin traitant vous a remis ce guide pour vous informer
INFORMATIONS AU PATIENT SUR LA COLOSCOPIE
 INFORMATIONS AU PATIENT SUR LA COLOSCOPIE Votre médecin vous a prescrit une coloscopie. Afin que vous soyez parfaitement informé(e) sur l examen, ses indications, sa préparation indispensable, etc., nous
INFORMATIONS AU PATIENT SUR LA COLOSCOPIE Votre médecin vous a prescrit une coloscopie. Afin que vous soyez parfaitement informé(e) sur l examen, ses indications, sa préparation indispensable, etc., nous
COMMISSION DE LA TRANSPARENCE. Avis. 23 mai 2007
 COMMISSION DE LA TRANSPARENCE Avis 23 mai 2007 SUTENT 12,5 mg, gélule Flacon de 30 (CIP: 376 265-0) SUTENT 25 mg, gélule Flacon de 30 (CIP: 376 266-7) SUTENT 50 mg, gélule Flacon de 30 (CIP: 376 267-3)
COMMISSION DE LA TRANSPARENCE Avis 23 mai 2007 SUTENT 12,5 mg, gélule Flacon de 30 (CIP: 376 265-0) SUTENT 25 mg, gélule Flacon de 30 (CIP: 376 266-7) SUTENT 50 mg, gélule Flacon de 30 (CIP: 376 267-3)
Le dépistage des cancers
 Le dépistage des cancers G R A N D P U B L I C Octobre 2009 Le dépistage des cancers Détecter tôt certains cancers permet de les traiter mieux, c'est-à-dire de proposer des traitements moins lourds, et
Le dépistage des cancers G R A N D P U B L I C Octobre 2009 Le dépistage des cancers Détecter tôt certains cancers permet de les traiter mieux, c'est-à-dire de proposer des traitements moins lourds, et
Quel apport de l imagerie dans les traitements anti-angiogéniques?
 Quel apport de l imagerie dans les traitements anti-angiogéniques? L Fournier, D Balvay, CA Cuénod Service de radiologie, Hôpital Européen Georges Pompidou Laboratoire de Recherche en Imagerie, Equipe
Quel apport de l imagerie dans les traitements anti-angiogéniques? L Fournier, D Balvay, CA Cuénod Service de radiologie, Hôpital Européen Georges Pompidou Laboratoire de Recherche en Imagerie, Equipe
HERNIE DISCALE LOMBAIRE
 Service de Chirurgie orthopédique et Traumatologique Hôpital Beaujon 100, boulevard du général Leclerc 92110 CLICHY Accueil : 01 40 87 52 53 Consultation : 01 40 87 59 22 Feuillet d information complémentaire
Service de Chirurgie orthopédique et Traumatologique Hôpital Beaujon 100, boulevard du général Leclerc 92110 CLICHY Accueil : 01 40 87 52 53 Consultation : 01 40 87 59 22 Feuillet d information complémentaire
Session plénière: 1 / 4 Sessions scientifiques et poster discussions: Poster présentations: 87/1438
 CANCERS DIGESTIFS Session plénière: 1 / 4 Sessions scientifiques et poster discussions: 38/435 Poster présentations: 87/1438 The TME Trial after a Median Follow-up of 11 Years C. A. Marijnen et Al, Leiden,
CANCERS DIGESTIFS Session plénière: 1 / 4 Sessions scientifiques et poster discussions: 38/435 Poster présentations: 87/1438 The TME Trial after a Median Follow-up of 11 Years C. A. Marijnen et Al, Leiden,
Radiologie Interven/onnelle sur les nodules pulmonaires. J. Palussière, X. Buy Département imagerie
 Radiologie Interven/onnelle sur les nodules pulmonaires J. Palussière, X. Buy Département imagerie Radiofréquence Interac*on courant électro- magné*que ma*ère agita*on ionique chaleur Coagula*on Nécrose
Radiologie Interven/onnelle sur les nodules pulmonaires J. Palussière, X. Buy Département imagerie Radiofréquence Interac*on courant électro- magné*que ma*ère agita*on ionique chaleur Coagula*on Nécrose
Un avantage décisif pour la résection des polypes et des myomes. Système
 Un avantage décisif pour la résection des polypes et des myomes Système Nouvelle norme en résection hystéroscopique Truclear apporte une précision, une clarté et une efficacité sans précédents pour réséquer
Un avantage décisif pour la résection des polypes et des myomes Système Nouvelle norme en résection hystéroscopique Truclear apporte une précision, une clarté et une efficacité sans précédents pour réséquer
SOINS DE PRATIQUE COURANTE. Prélèvement aseptique cutané ou de sécrétions muqueuses, prélèvement de selles
 NOMENCLATURE GENERALE DES ACTES PROFESSIONNELS INFIRMIERS (Arrêté du 25 mars 1993) (Arrêté du 21 avril 1994) (Arrêté du 1er mars 1999) (Arrêté du 8 Décembre 1999) (Arrêté du 12 Octobre 2000) (Arrêté du
NOMENCLATURE GENERALE DES ACTES PROFESSIONNELS INFIRMIERS (Arrêté du 25 mars 1993) (Arrêté du 21 avril 1994) (Arrêté du 1er mars 1999) (Arrêté du 8 Décembre 1999) (Arrêté du 12 Octobre 2000) (Arrêté du
Intérêt de la TEP-FDG dans les cancers de l ovaire
 Intérêt de la TEP-FDG dans les cancers de l ovaire T. Mognetti et F. Giammarile Introduction La TEP-FDG (Tomographie par Émission de Positons après injection de 18 F- Fluoro-2-Déoxy-Glucose) est un des
Intérêt de la TEP-FDG dans les cancers de l ovaire T. Mognetti et F. Giammarile Introduction La TEP-FDG (Tomographie par Émission de Positons après injection de 18 F- Fluoro-2-Déoxy-Glucose) est un des
GUIDE PATIENT - AFFECTION DE LONGUE DURÉE. La prise en charge du cancer du rein
 GUIDE PATIENT - AFFECTION DE LONGUE DURÉE La prise en charge du cancer du rein Novembre 2010 Pourquoi ce guide? Votre médecin traitant vous a remis ce guide pour vous informer sur le cancer du rein, son
GUIDE PATIENT - AFFECTION DE LONGUE DURÉE La prise en charge du cancer du rein Novembre 2010 Pourquoi ce guide? Votre médecin traitant vous a remis ce guide pour vous informer sur le cancer du rein, son
Les cancers de la prostate
 Vous cherchez de l aide ou d autres informations? Vous avez besoin de parler? Vous cherchez des informations sur un type de cancer ou ses possibilités de traitement? Vous voulez savoir comment faire appel
Vous cherchez de l aide ou d autres informations? Vous avez besoin de parler? Vous cherchez des informations sur un type de cancer ou ses possibilités de traitement? Vous voulez savoir comment faire appel
Réflexions sur les possibilités de réponse aux demandes des chirurgiens orthopédistes avant arthroplastie
 Bull. Acad. Natle Chir. Dent., 2007, 50 113 Commission de l exercice professionnel et Groupe de réflexion Réflexions sur les possibilités de réponse aux demandes des chirurgiens orthopédistes avant arthroplastie
Bull. Acad. Natle Chir. Dent., 2007, 50 113 Commission de l exercice professionnel et Groupe de réflexion Réflexions sur les possibilités de réponse aux demandes des chirurgiens orthopédistes avant arthroplastie
TRAITEMENT DE L INCONTINENCE URINAIRE. Dr B Pogu Urologue FMC Sud Marne
 TRAITEMENT DE L INCONTINENCE URINAIRE Dr B Pogu Urologue FMC Sud Marne DEFINITION! Incontinence urinaire (IU) : perte involontaire des urines par l urètre, survenant en dehors de la miction et pouvant
TRAITEMENT DE L INCONTINENCE URINAIRE Dr B Pogu Urologue FMC Sud Marne DEFINITION! Incontinence urinaire (IU) : perte involontaire des urines par l urètre, survenant en dehors de la miction et pouvant
HEL-01298-de-0513-0001-21494. Des maladies dépistées grâce aux examens préventifs
 HEL-01298-de-0513-0001-21494 Des maladies dépistées grâce aux examens préventifs Sommaire 1. Pourquoi des examens préventifs? 3 2. Examens préventifs pour le dépistage des facteurs de risque/maladies du
HEL-01298-de-0513-0001-21494 Des maladies dépistées grâce aux examens préventifs Sommaire 1. Pourquoi des examens préventifs? 3 2. Examens préventifs pour le dépistage des facteurs de risque/maladies du
CANCERS ET RAYONNEMENTS IONISANTS Fortes doses: seconds cancers après radiothérapie
 CANCERS ET RAYONNEMENTS IONISANTS Fortes doses: seconds cancers après radiothérapie Rencontres Nucléaire et Santé 08/02/2013 Pierre BEY Professeur émérite de Cancérologie;Radiothérapie Université de Lorraine
CANCERS ET RAYONNEMENTS IONISANTS Fortes doses: seconds cancers après radiothérapie Rencontres Nucléaire et Santé 08/02/2013 Pierre BEY Professeur émérite de Cancérologie;Radiothérapie Université de Lorraine
Rééducation de la rééducation de l Incontinence Urinaire de l homme : Résultats. Guy Valancogne
 Rééducation de la rééducation de l Incontinence Urinaire de l homme : Résultats Guy Valancogne Depuis la fin des années 90 : études pour le cas spécifique de l incontinence masculine, - certaines d entre
Rééducation de la rééducation de l Incontinence Urinaire de l homme : Résultats Guy Valancogne Depuis la fin des années 90 : études pour le cas spécifique de l incontinence masculine, - certaines d entre
DIU DE REEDUCATION PELVI-PERINEALE. Responsables de l enseignement :
 DIU de rééducation pelvi-périnéale DIU DE REEDUCATION PELVI-PERINEALE Responsables de l enseignement : Pr. Gérard AMARENCO (UPMC), Pr. Michel COSSON (CHU Lille), Pr. Gilberte ROBAIN (UPMC) 1. Cible La
DIU de rééducation pelvi-périnéale DIU DE REEDUCATION PELVI-PERINEALE Responsables de l enseignement : Pr. Gérard AMARENCO (UPMC), Pr. Michel COSSON (CHU Lille), Pr. Gilberte ROBAIN (UPMC) 1. Cible La
schémas du by-pass gastrique pour obésité morbide
 Femme de 58 ans, opérée d un by-pass gastrique 2 ans auparavant. Depuis 10jours, nausées et vomissements. Quels sont les éléments sémiologiques significatifs à retenir sur ls images scanographiques après
Femme de 58 ans, opérée d un by-pass gastrique 2 ans auparavant. Depuis 10jours, nausées et vomissements. Quels sont les éléments sémiologiques significatifs à retenir sur ls images scanographiques après
va être opéré d un hypospadias
 Votre enfant va être opéré d un hypospadias Introduction Le chirurgien urologue pédiatrique vous a confirmé le diagnostic d hypospadias et expliqué les avantages ainsi que les risques et complications
Votre enfant va être opéré d un hypospadias Introduction Le chirurgien urologue pédiatrique vous a confirmé le diagnostic d hypospadias et expliqué les avantages ainsi que les risques et complications
HERNIE DISCALE LOMBAIRE
 Feuillet d'information complémentaire à l'attention du patient HERNIE DISCALE LOMBAIRE Madame, Monsieur, Suite aux examens, une hernie discale au niveau du rachis lombaire a été diagnostiquée ; il faudrait
Feuillet d'information complémentaire à l'attention du patient HERNIE DISCALE LOMBAIRE Madame, Monsieur, Suite aux examens, une hernie discale au niveau du rachis lombaire a été diagnostiquée ; il faudrait
TUTORAT UE 5 2012-2013 Anatomie Correction Séance n 6 Semaine du 11/03/2013
 TUTORAT UE 5 2012-2013 Anatomie Correction Séance n 6 Semaine du 11/03/2013 Appareil respiratoire-organogénèse de l appareil digestif Cours du Pr. PRUDHOMME Séance préparée par Anissa BARAKAT, Caroline
TUTORAT UE 5 2012-2013 Anatomie Correction Séance n 6 Semaine du 11/03/2013 Appareil respiratoire-organogénèse de l appareil digestif Cours du Pr. PRUDHOMME Séance préparée par Anissa BARAKAT, Caroline
Les soins infirmiers en oncologie : une carrière faite pour vous! Nom de la Présentatrice et section de l'acio
 Les soins infirmiers en oncologie : une carrière faite pour vous! Nom de la Présentatrice et section de l'acio Grandes lignes Pourquoi les soins en cancérologie sont-ils un enjeu de santé important? Les
Les soins infirmiers en oncologie : une carrière faite pour vous! Nom de la Présentatrice et section de l'acio Grandes lignes Pourquoi les soins en cancérologie sont-ils un enjeu de santé important? Les
SOMMAIRE. Organisateurs : F. DUMONT (Villejuif) D. ELIAS (Villejuif) Président : Modérateurs : B. LELONG (Marseille) J.
 SOMMAIRE Organisateurs : F. DUMONT (Villejuif) D. ELIAS (Villejuif) Président : G. PORTIER (Toulouse) Modérateurs : F. DUMONT (Villejuif) B. LELONG (Marseille) J. PAINEAU (Nantes) Historique et principes
SOMMAIRE Organisateurs : F. DUMONT (Villejuif) D. ELIAS (Villejuif) Président : G. PORTIER (Toulouse) Modérateurs : F. DUMONT (Villejuif) B. LELONG (Marseille) J. PAINEAU (Nantes) Historique et principes
Qu est-ce que le cancer de l œsophage?
 Cancer de l œsophage Qu est-ce que le cancer de l œsophage? Laissez-nous vous expliquer. www.fondsanticancer.org www.esmo.org ESMO/FAC Patient Guide Series basés sur les recommandations de pratique clinique
Cancer de l œsophage Qu est-ce que le cancer de l œsophage? Laissez-nous vous expliquer. www.fondsanticancer.org www.esmo.org ESMO/FAC Patient Guide Series basés sur les recommandations de pratique clinique
Cancer bronchique primitif: données épidémiologiques récentes
 Cancer bronchique primitif: données épidémiologiques récentes Pr Jean Trédaniel Service de pneumologie et oncologie thoracique Groupe Hospitalier Paris Saint Joseph Université Paris Descartes Sources Données
Cancer bronchique primitif: données épidémiologiques récentes Pr Jean Trédaniel Service de pneumologie et oncologie thoracique Groupe Hospitalier Paris Saint Joseph Université Paris Descartes Sources Données
TRAUMATISME CRANIEN DE L ENFANT : conduite à tenir?
 TRAUMATISME CRANIEN DE L ENFANT : conduite à tenir? H Le Hors-Albouze Urgences pédiatriques Timone enfants Marseille Traumatismes crâniens (TC) de l enfant Grande fréquence même si incidence réelle mal
TRAUMATISME CRANIEN DE L ENFANT : conduite à tenir? H Le Hors-Albouze Urgences pédiatriques Timone enfants Marseille Traumatismes crâniens (TC) de l enfant Grande fréquence même si incidence réelle mal
Insuffisance cardiaque
 Insuffisance cardiaque Connaître son évolution pour mieux la vivre Guide d accompagnement destiné au patient et ses proches Table des matières L évolution habituelle de l insuffisance cardiaque 5 Quelles
Insuffisance cardiaque Connaître son évolution pour mieux la vivre Guide d accompagnement destiné au patient et ses proches Table des matières L évolution habituelle de l insuffisance cardiaque 5 Quelles
